Успехи современной биологии, 2021, T. 141, № 1, стр. 25-31
Тималин: применение для иммунокоррекции и молекулярные аспекты биологической активности
В. Х. Хавинсон 1, 2, Н. С. Линькова 1, 3, 4, *, Н. И. Чалисова 1, 2, О. М. Ивко 1
1 Санкт-Петербургский институт биорегуляции и геронтологии
Санкт-Петербург, Россия
2 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
3 Академия постдипломного образования ФГБУ ФНКЦ ФМБА России
Москва, Россия
4 Белгородский национальный исследовательский государственный университет
Белгород, Россия
* E-mail: miayy@yandex.ru
Поступила в редакцию 12.06.2020
После доработки 12.06.2020
Принята к публикации 12.06.2020
Аннотация
Лекарственный пептидный препарат тималин применяется при различных заболеваниях, связанных с нарушением функций иммунной системы, при вирусных и бактериальных инфекциях, для нормализации регенерации тканей, при угнетении иммунитета и кроветворения после химио- или лучевой терапии. Работа посвящена анализу молекулярного механизма действия тималина и его компонентов, к которым относятся дипептид EW (лекарственный препарат тимоген), дипептид KE, трипептид EDP. Эти короткие пептиды регулируют экспрессию генов и синтез белков теплового шока, цитокинов, системы фибринолиза, геронтогенов, дифференцировки, пролиферации и апоптоза клеток. Тималин и тимоген практически не имеют побочных эффектов и применяются при различных вирусных инфекциях. Вероятно, эти пептидные препараты могут быть эффективны в комплексной терапии коронавирусной инфекции COVID-19.
Создание эффективных и безопасных лекарственных препаратов, способных повышать защитные функции организма – одно из приоритетных направлений молекулярной медицины и иммунологии. Пептиды, образующиеся путем ограниченного протеолиза, являются эндокринными и аутокринными носителями информации о локальном состоянии функций органа или ткани. Низкомолекулярные короткие пептиды размером до 10 аминокислотных остатков обладают широким спектром активности и координируют биологические функции различных органов и тканей (Рыжак и др., 2015; Khavinson, Popovich, 2017). Известно большое количество пептидов, регулирующих дифференцировку, пролиферацию и апоптоз клеток в норме, при патологии и старении организма (Khavinson et al., 2020).
Разработана технология выделения полипептидных комплексов из различных органов и тканей молодых животных. Первым пептидным лекарственным препаратом, созданным по этой технологии, стал полипептидный комплекс, выделенный из тимуса телят – тималин (Морозов, Хавинсон, 1981; Морозов и др., 1982; Хавинсон, Морозов, 1982). Этот препарат нормализует функции иммунной системы, стимулирует процессы регенерации и кроветворения в случае их угнетения. Иммунопротекторное действие тималина выражается в восстановлении количества и соотношения Т- и В-лимфоцитов, их субпопуляций, повышении их функциональной активности, усилении фагоцитоза (Морозов и др., 2000; Anisimov, Khavinson, 2010). Тималин применяется при лечении различных заболеваний, связанных с нарушением функций иммунной системы у детей и взрослых (острые и хронические вирусные и бактериальные инфекции, инфекционные гнойные и септические процессы, нарушение процессов регенерации, угнетение иммунитета и кроветворения после химио- или лучевой терапии) (Хавинсон и др., 1991, 2013, 2014а; Хавинсон, Морозов, 2002; Кузник и др., 2002; Khlystova et al., 2003). Применение тималина способствовало снижению частоты возникновения острых респираторных заболеваний у людей пожилого и старческого возраста в 2.0–2.4 раза (Хавинсон, Морозов, 2002). Установлено, что тималин накапливается в клетках эпителия дыхательных путей человека во время раннего эмбриогенеза (Khlystova et al., 2003). Применение тималина в терапии пациентов с острым абсцессом легкого приводило к снижению синдрома системного воспалительного ответа, фибринолитической активности плазмы и прекращению гиперкоагуляции (Кузник и др., 2002). Тималин проявлял геропротекторные свойства в экспериментах на животных и в клинических исследованиях. Препарат способствовал восстановлению функций иммунной системы и снижал смертность у пациентов пожилого возраста (Коркушко и др., 2002; Anisimov, Khavinson, 2010). Таким образом, тималин нормализует функции иммунной и дыхательной систем, а кроме того, обладает геропротекторным действием. Применение тималина в эксперименте и у пациентов с пневмониями различной этиологии, вирусными инфекционными заболеваниями сопровождалось нормализацией свертывания и фибринолитической активности крови (Кузник и др., 2011, 2013; Хавинсон и др., 2012б, 2013).
В настоящее время одним из перспективных подходов к комплексному лечению вирусного заболевания COVID-19, тяжелая форма которого сопровождается пневмонией, тромбообразованием и дисбалансом цитокинового статуса, являются иммуномодулирующая терапия и применение препаратов, нормализующих систему гемостаза. Учитывая, что в группе риска при COVID-19 находятся в основном лица пожилого и старческого возраста, можно рассматривать тималин как один из препаратов для комплексной терапии инфекции, вызванной SARS-CoV-2 (Severe acute respiratory syndrome coronavirus 2) (Tang et al., 2020; Wang et al., 2020; Zhang et al., 2020).
В связи с этим важным является изучение молекулярных аспектов механизма действия тималина. Следует отметить, что активными компонентами полипептидного препарата являются короткие пептиды в его составе (Хавинсон и др., 2017). Ранее из тималина методом обращенно-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC) был выделен дипептид EW, который впоследствии был синтезирован и получил наименование “тимоген”. Дальнейшие экспериментальные и клинические исследования показали, что тимоген является высокоэффективным иммуномодулятором (Морозов и др., 2000). Идентификация коротких пептидов в составе тималина осуществлялась методами масс-спектрометрии и высокоэффективной жидкостной хроматографии (Журкович и др., 2020). В результате этого исследования были выявлены дипептид KE (вилон) и трипептид EDP (кристаген), которые обладают высокой биологической активностью.
Области применения лекарственных препаратов тималина и тимогена во многом сходны. Имеются следующие показания к применению тимогена: профилактика и комплексная терапия острых и хронических вирусных и бактериальных заболеваний верхних дыхательных путей, профилактика угнетения иммунитета, кроветворения, процессов регенерации в посттравматическом и послеоперационном периодах. Проведено двойное слепое рандомизированное плацебо-контролируемое исследование эффективности тимогена у пациентов пожилого возраста после удаления солидных опухолей в брюшной полости и забрюшинном пространстве. Дооперационное использование тимогена восстанавливало структурные и функциональные параметры иммунитета и приводило к статистически значимому уменьшению количества и спектра послеоперационных осложнений и сокращению послеоперационного периода (Смирнов и др., 2011). Тимоген так же, как и тималин, проявлял геропротекторные свойства в экспериментах на животных. Аналогично тималину, применение тимогена в эксперименте и у пациентов с пневмониями различной этиологии и вирусными инфекционными заболеваниями сопровождалось нормализацией свертывания и фибринолитической активности белков плазмы крови (Кузник и др., 2011; Хавинсон и др., 2013). Следует отметить, что введение тимогена крысам приводило к повышению выживаемости и снижению числа опухолей в 1.5 раза (Anisimov et al., 2000).
Выявлено, что короткие пептиды – тимоген, вилон, кристаген активируют дифференцировку, повышают жизнеспособность и пролиферацию, снижают апоптоз различных субпопуляций иммунных клеток.
Обнаружено, что применение пептида КЕ стимулирует клеточный иммунитет и неспецифическую резистентность организма, оказывает активирующее действие на макрофаги, лимфоциты крови, тимоциты и нейтрофилы (Щербак и др., 2004; Севостьянова и др., 2012). Вилон индуцирует экспрессию молекул CD4 и CD5 на клетках тимуса, стимулируя их дифференцировку в направлении Т-хелперов (Севостьянова и др., 2012). Пептид KE при введении в организм трансгенных мышей подавляет экспрессию онкогена HER-2/neu в 2 раза (Хавинсон, 2009). Вилон способствует увеличению доли транскрибируемого эухроматина и снижению количества гетерохроматина в лимфоцитах крови лиц старческого возраста (Хавинсон и др., 2004). Пептид KE нормализует длину теломер ФГА-стимулированных лимфоцитов крови людей разного возраста (Хавинсон и др., 2019). Вилон также регулирует экспрессию генов IGF1, FOXO1, TERT, TNKS2, NFκB в эмбриональных мезенхимальных стволовых клетках человека линии FetMSC при их репликативном и стационарном старении (Ashapkin et al., 2020). Пептид KE обнаружен в числе 57 дипептидов, способных к селективному связыванию с двунитевой ДНК. При изучении влияния пептидов на экспрессию 15 247 генов методом микрочиповой технологии установлено, что пептид KE регулирует экспрессию генов EPS15, MCM10 homologue, Culline 5, APG5L, FUSED, ZNF01, FLJ12848 fis, ITPK1, SLC7A6, FLJ22439 fis, KIAA0029, FLJ13697 fis, KIAA0699, FLJ10914, Gdap1, MSTP028, MLLT3, PEPP2 и синтез белков цитоскелета, пролиферацию и метаболизм клетки, что объясняет его высокую биологическую активность (Khavinson, Malinin, 2005). Экспериментально выявлено выраженное селективное связывание пептида KE с последовательностью TCGA ДНК, которая входит в состав этих генов. Предполагается, что пептид KE может регулировать экспрессию генов и синтез белков теплового шока (HSP), цитокинов (IL-3, IL-4, IL-5, IL-6, IL-10, IL-17A, TNF-α), тканевого фактора, белков системы фибринолиза (плазминоген, тканевой и урокиназный активаторы плазминогена, антитромбин III), белков “молодости” и “старости” (GDF11, FNDC5, бетатрофин, FGF19, FGF21, FGF23, HMGB1, MIC1/GDF15, JAM-A) (Хавинсон и др., 2011а, 2014б, 2015а,б, 2018; Кузник и др., 2014, 2017). Установлено, что мотив KE встречается в аминокислотных последовательностях некоторых цитокинов и пептидных гормонов, по своим функциям сходных с пептидом KE. В протеоме человека ядерные белки содержат наибольшее количество мотивов KE, тогда как цитоплазматические и все прочие белки имеют минимум содержания KE. В ходе ограниченного протеолиза молекулы пептида КЕ, высвобождаемые из ядерных белков, могут связываться с ДНК и регулировать экспрессию генов (Терехов и др., 2019). Пептид KE снижает экспрессию матриксной металлопротеиназы-9 (ММР-9) и повышает экспрессию молекул Ki-67, CD98hc, синтез которых нарушается при старении фибробластов кожи (Линькова и др., 2016).
Пептид EDP способствует дегетерохроматинизации хроматина лимфоцитов крови лиц пожилого возраста (Хавинсон и др., 2006). Эффективность перорального применения кристагена оценивали у людей пожилого и старческого возраста с нарушенным иммунитетом. Кристаген в сочетании со стандартным лечением способствовал нормализации иммунограммы у 82% пациентов, тогда как в контрольной группе (только стандартное лечение) нормализация иммунограммы наблюдалась у 56% пациентов. Кристаген в большей степени влиял на Т-клеточное звено иммунитета (повышение количества CD3+-, CD4+-клеток, нормализация соотношения CD4+/СD8+) и оказывал менее выраженное действие на В-лимфоциты. У всех пациентов, применявших кристаген, наблюдалось снижение выраженности астенического синдрома, сопровождающего вторичные иммунодефициты (Хавинсон и др., 2006). Установлено иммуногеропротекторное действие кристагена на клетки тимуса крыс, подвергшихся гамма-облучению (модель ускоренного старения). После введения кристагена животным в тимусе сохранялось разделение на корковое и мозговое вещество (его отсутствие – один из признаков старения), повышалось количество макрофагов, тучных клеток, усиливалась пролиферация тимоцитов, оцениваемая по экспрессии PCNA (prolife-rating cell nuclear antigen, ядерный антиген пролиферирующих клеток) (Хавинсон и др., 2006). Показано стимулирующее влияние пептида EDP на способность перитонеальных макрофагов молодых и старых мышей секретировать цитокины IL-1, IL-6, TNF-α. Кроме того, пептид EDP активирует пролиферацию эпителиальных клеток тимуса человека линии VTEC2.H/S (Хавинсон и др., 2006). Пептид EDP угнетает пролиферацию опухолевых клеток линии К-562 эритромиелоза человека. Угнетение пролиферации под действием кристагена, направленное на иммортализованные клетки, может указывать на его противоопухолевую активность. Пептид EDP усиливает спонтанную пролиферативную активность нормальных лимфоцитов, что показывает его стимулирующее влияние на неопухолевые иммунные клетки человека (Хавинсон и др., 2011б). Пероральное применение кристагена в комплексе с другими короткими пептидами способствует повышению стрессоустойчивости и нормализации иммунитета у спортсменок. Пептиды в 2 раза повышали экспрессию гена белка теплового шока HSPA1A и нормализовывали экспрессию гена IL-6. После приема пептидных биорегуляторов у спортсменок снизилась заболеваемость острыми респираторными вирусными инфекциями (Хавинсон и др., 2012а).
Выполнены исследования, в которых проводилось сравнительное изучение тималина и коротких пептидов EW, KE, EDP на иммуногенез. В органотипических культурах ткани селезенки молодых и старых крыс было изучено влияние пептидов на процессы пролиферации и апоптоза клеток (лимфобласты, лимфоциты, макрофаги). Тималин, пептиды EW, KE, EDP повышали индекс площади зоны роста эксплантатов селезенки животных на 20–50%, стимулировали пролиферацию и снижали апоптоз клеток на 29–42% по сравнению с контролем. Эффект тималина был выражен сильнее, чем у коротких пептидов (Чалисова и др., 2006, 2008, 2011, 2015, 2016; Червякова и др., 2013). Полученные данные можно объяснить тем, что в тималине содержатся все 3 исследуемых коротких пептида, а также большое количество других пептидов, которые могут обладать иммунопротекторными свойствами.
Изучено влияние пептидов EW, KE, EDP на экспрессию маркеров рецепторного (белки p16, p21, p53, Caspase-8, -9) и митохондриального (AIF, прохибитин) апоптоза в культурах лимфоцитов крови человека. Установлено, что эти пептиды снижают уровень рецепторного и митохондриального апоптоза в лимфоцитах крови при их репликативном старении. Пептиды EW и KE оказывают более выраженное антиапоптотическое действие в “молодых” и “старых” культурах лимфоцитов крови, чем пептид EDP (Дудков, 2019). Предполагается, что антиапоптотическое действие пептидов может быть связано не только с их способностью эпигенетически регулировать экспрессию генов, но и с другим механизмом. Антиапоптотическое и геропротекторное действие пептидов может быть реализовано путем активации транскрипции генов апоптоза при изменении конформаций гистонов под воздействием коротких пептидов. Методом молекулярного моделирования установлено, что пептиды предпочтительнее всего связываются с гистонами Н1/1, Н1/3, Н1/6, Н2b, H3, H4 по сайтам, которые взаимодействуют с ДНК. Наиболее энергетически выгодное взаимодействие с гистоном H1/3 образует пептид EW.
Информация, поступающая в живой организм, контролируется регуляторными системами, действие которых направлено на сохранение высокой степени стабильности функционирования генома. Следовательно, основная задача системы биорегуляции заключается в управлении экспрессией генов, процессами синтеза белков и защитными функциями организма. Информация об изменениях внешней и внутренней среды служит фактором, который индуцирует трансформацию в системе биорегуляции, необходимую для сохранения функциональной активности клеток. Поэтому взаимодействие информационных молекул, в частности, регуляторных пептидов, с геномом играет важную роль в поддержании клеточного гомеостаза.
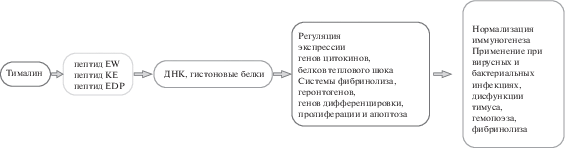
Иммуно- и геропротекторные эффекты тималина, который нормализует дифференцировку, пролиферацию и снижает апоптоз лимфоидных клеток, активирует реакции клеточного иммунитета и процессы регенерации, обусловлены эффектами входящих в его состав коротких пептидов EW, KE, EDP. Пептиды EW, KE, EDP в составе лекарственного препарата тималина способны комплементарно связываться с определенными последовательностями ДНК или гистоновыми белками. В результате этого связывания происходит изменение экспрессии генов и синтеза белков теплового шока, цитокинов, системы фибринолиза, геронтогенов, протеинов, участвующих в дифференцировке, пролиферации и апоптозе иммунных клеток. Нормализация синтеза белков, активирующих функции иммунной и антиоксидантной систем, процессы регенерации, гемостаза проявляется в восстановлении функций регуляторных систем организма и объясняет высокую эффективность тималина в терапии широкого спектра заболеваний (рис. 1). В связи с тем, что тималин и входящий в его состав тимоген применяются при вирусных инфекциях и для бронхопротекции, можно предположить, что эти препараты будут эффективны в комплексной терапии коронавирусной инфекции. Все это указывает на актуальность дальнейших исследований тималина и входящих в его состав коротких пептидов.
Список литературы
Дудков А.В. Пептидная регуляция каспаза-зависимого апоптоза при клеточном старении // Соврем. пробл. науки и образ. 2019. № 2. С. 1–11. http://www.science-education.ru/article/view?id=28701.
Журкович И.К., Ковров Н.Г., Рыжак Г.А. и др. Идентификация коротких пептидов в составе полипептидных комплексов, выделенных из органов животных // Успехи соврем. биол. 2020. Т. 140. № 2. С. 140–148.
Коркушко О.В., Хавинсон В.Х., Бутенко Г.М., Шатило В.Б. Пептидные препараты тимуса и эпифиза в профилактике ускоренного старения. СПб.: Наука, 2002. 202 с.
Кузник Б.И., Будажабон Г.Б., Даренская С.Д., Лиханов И.Д. Влияние тималина на иммунитет и гемостаз у больных с абсцессами легких // Тромбоз, гемостаз, реол. 2002. № 3 (11). С. 55–61.
Кузник Б.И., Линькова Н.С., Тарновская С.И., Хавинсон В.Х. Цитокины и регуляторные пептиды: возрастные особенности изменения, развитие атеросклероза и тромботических заболеваний (обзор собственных данных) // Успехи геронтол. 2013. Т. 26. № 1. С. 38–51.
Кузник Б.И., Линькова Н.С., Хавинсон В.Х. Белки теплового шока: возрастные изменения, развитие тромботических осложнений и пептидная регуляция генома // Успехи геронтол. 2011. Т. 24. №4. С. 539–552.
Кузник Б.И., Хавинсон В.Х., Линькова Н.С. и др. Факторы роста фибробластов FGF19, FGF21, FGF23 как эндокринные регуляторы физиологических функций и геропротекторы. Эпигенетические механизмы регуляции // Успехи соврем. биол. 2017. Т. 137. № 1. С. 84–99.
Кузник Б.И., Хавинсон В.Х., Тарновская С.И. и др. Эпигенетические механизмы действия пептидов Lys-Glu и Ala-Glu-Asp-Gly на систему гемостаза, цитокиновый профиль и продолжительность жизни // Успехи клин. мед. 2014. № 1–2. С. 29–42.
Линькова Н.С., Дробинцева А.О., Орлова О.А. и др. Пептидная регуляция функций фибробластов кожи при их старении in vitro // Клет. технол. биол. мед. 2016. №1. С. 40–44.
Морозов В.Г., Хавинсон В.Х. Выделение, очистка и идентификация иммуномодулирующего полипептида, содержащегося в тимусе телят и человека // Биохимия. 1981. Т. 46. Вып. 9. С. 1652–1659.
Морозов В.Г., Хавинсон В.Х., Кожемякин А.Л., Кожемякин Л.А. Влияние полипептидного фактора тимуса на систему циклических нуклеотидов иммунокомпетентных клеток // Вопр. мед. химии. 1982. Т. 28. Вып. 4. С. 114–118.
Морозов В.Г., Хавинсон В.Х., Малинин В.В. Пептидные тимомиметики. СПб.: Наука, 2000. 158 с.
Рыжак А.П., Чалисова Н.И., Линькова Н.С. и др. Влияние полипептидов на регенерацию клеток в культуре разных тканей молодых и старых крыс // Успехи геронтол. 2015. Т. 28. №1. С. 97–103.
Севостьянова Н.Н., Линькова Н.С., Полякова В.О. и др. Иммуномодулирующее действие вилона и его аналога в культурах клеток тимуса человека и животных // Клет. технол. биол. мед. 2012. № 4. С. 220–223.
Смирнов В.С., Петленко С.В., Ельцин С.С. Применение тимогена для предоперационной подготовки больных пожилого возраста с опухолевыми процессами в брюшной полости // Успехи геронтол. 2011. Т. 24. №2. С. 278–284.
Терехов А.Ю., Кормилец Д.Ю., Линькова Н.С. и др. Пептид КЕ в протеоме человека // Бюл. эксперим. биол. мед. 2019. Т. 168. № 11. С. 569–572.
Хавинсон В.Х. Пептидная регуляция старения. СПб.: Наука, 2009. 50 с.
Хавинсон В.Х., Морозов В.Г. Экспериментальное и клиническое изучение нового иммунорегулирующего препарата – тималина // Военно-мед. журн. 1982. № 5. С. 37–39.
Хавинсон В.Х., Морозов В.Г. Геропротекторная эффективность тималина и эпиталамина // Успехи геронтол. 2002. Вып. 10. С. 74–84.
Хавинсон В.Х., Винер И.А., Трофимова С.В. и др. Методика повышения резервных возможностей организма спортсменок высокой квалификации с помощью пептидных биорегуляторов. Методические рекомендации. СПб.: Институт биорегуляции и геронтологии, 2012а. 22 с.
Хавинсон В.Х., Григорьев Е.И., Малинин В.В., Рыжак Г.А. Пептид, обладающий иммуногеропротекторным действием, фармацевтическая композиция на его основе и способ его применения. Патент РФ 2301074 от 30.05.2006.
Хавинсон В.Х., Копылов А.Т., Васьковский Б.В. и др. Идентификация пептида AEDG в полипептидном комплексе эпифиза // Бюл. эксперим. биол. мед. 2017. Т. 164. №7. С. 52–55.
Хавинсон В.Х., Кузник Б.И., Линькова Н.С. Влияние пептидных биорегуляторов и белков теплового шока на возрастные изменения системы гемостаза // Тромбоз, гемостаз и реол. 2011а. № 4. С. 15–32.
Хавинсон В.Х., Кузник Б.И., Рыжак Г.А. и др. Ирисин, бетатрофин, сахарный диабет, ожирение и метаболический синдром. Эпигенетические механизмы регуляции // Успехи физиол. наук. 2018. Т. 49. № 1. С. 72–86.
Хавинсон В.Х., Кузник Б.И., Рыжак Г.А. Пептидные биорегуляторы – новый класс геропротекторов. Сообщение 1. Результаты экспериментальных исследований // Успехи геронтол. 2012б. Т. 25. № 4. С. 696–708.
Хавинсон В.Х., Кузник Б.И., Рыжак Г.А. Пептидные биорегуляторы – новый класс геропротекторов. Сообщение 2. Результаты клинических исследований // Успехи геронтол. 2013. Т. 26. № 1. С. 20–37.
Хавинсон В.Х., Кузник Б.И., Рыжак Г.А. Пептидные геропротекторы – эпигенетические регуляторы физиологических функций организма. СПб.: РГПУ им. А.И. Герцена, 2014а. 271 с.
Хавинсон В.Х., Кузник Б.И., Тарновская С.И. и др. Пептиды и молекулярные маркеры старения CCL11 и HMGB1: обзор литературы и собственных данных // Успехи геронтол. 2014б. № 3. С. 397–406.
Хавинсон В.Х., Кузник Б.И., Тарновская С.И. и др. Геропротекторные свойства белка GDF11 // Успехи соврем. биол. 2015а. Т. 135. № 4. С. 170–179.
Хавинсон В.Х., Кузник Б.И., Тарновская С.И. и др. Короткие пептиды и регулятор длины теломер гормон ирисин. // Бюл. эксперим. биол. мед. 2015б. Т. 9. С. 332–336
Хавинсон В.Х., Лежава Т.А., Малинин В.В. Влияние коротких пептидов на хроматин в лимфоцитах лиц старческого возраста // Бюл. эксперим. биол. мед. 2004. Т. 137. № 1. С. 89–93.
Хавинсон В.Х., Линькова Н.С., Пендина А.А. и др. Изучение влияния пептида КЕ на длину теломер хромосом ФГА-стимулированных лимфоцитов человека // Мед. академ. журн. 2019. Специальный выпуск. С. 166–168.
Хавинсон В.Х., Никольский И.С., Никольская В.В. и др. Влияние трипептидов на лимфоидные и стволовые клетки // Бюл. эксперим. биол. мед. 2011б. Т. 151. № 6. С. 668–671.
Хавинсон В.Х., Серый С.В., Малинин В.В. Коррекция пептидами тимуса и костного мозга радиационных нарушений иммуно- и гемопоэза // Радиобиология. 1991. Т. 31. Вып. 4. С. 501–505.
Чалисова Н.И., Закуцкий А.Н., Анискина А.И. и др. Тканеспецифическое влияние синтетических биорегуляторных пептидов в органотипической культуре тканей молодых и старых крыс // Успехи геронтол. 2006. Вып. 19. С. 93–96.
Чалисова Н.И., Лесняк В.В., Рыжак Г.А., Оганезова Е.В. Протекторное влияние трипептида в присутствии циклофосфана в культуре лимфоидной ткани крыс // Бюл. эксперим. биол. мед. 2008. Т. 145. № 6. С. 605–608.
Чалисова Н.И., Линькова Н.С., Дудков А.В., Концевая Е.А. Влияние пептидов на пролиферацию и дифференцировку В-лимфоцитов селезенки // Вестн. Белгород. ун-та. 2011. Т. 3. С. 94–97.
Чалисова Н.И., Рыжак А.П., Линькова Н.С. и др. Влияние полипептидов на регенерацию клеток в культуре разных тканей молодых и старых крыс // Успехи геронтол. 2015. Т. 28. № 1. С. 93–107.
Чалисова Н.И., Рыжак А.П., Линькова Н.С. и др. Влияние полипептидов на пролиферацию и апоптоз клеток при старении // Клет. технол. биол. мед. 2016. Т. 4. С. 221–225.
Червякова Н.А., Линькова Н.С., Чалисова Н.И. и др. Молекулярные аспекты иммунопротекторного действия пептидов в селезенке при ее старении // Успехи геронтол. 2013. Т. 26. № 2. С. 224–228.
Щербак В.А., Патеюк А.В. Влияние вилона на иммунный ответ при остром иммобилизационном стрессе у крыс // Сиб. мед. журн. 2004. Т. 44. № 3. С. 26–29.
Anisimov V.N., Khavinson V.Kh. Peptide bioregulation of aging: results and prospects // Biogerontology. 2010. V. 11. P. 139–149. https://doi.org/10.1007/s10522-009-9249-8
Anisimov V.N., Khavinson V.Kh., Morozov V.G. Immunomodulatory synthetic dipeptide L-Glu-L-Trp slows down aging and inhibits spontaneous carcinogenesis in rats // Biogerontology. 2000. V. 1. P. 55–59. https://doi.org/10.1023/a:1010042008969
Ashapkin V., Khavinson V., Shilovsky G. et al. Gene expression in human mesenchymal stem cell aging cultures: modulation by short peptides // Mol. Biol. Rep. 2020. V. 47. P. 4323–4329. https://doi.org/10.1007/s11033-020-05506-3
Khavinson V.Kh., Malinin V.V. Gerontological aspects of genome peptide regulation. Basel (Switzerland): Karger AG, 2005. 104 p.
Khavinson V., Linkova N., Diatlova A., Trofimova S. Peptide regulation of cell differentiation // Stem Cell Rev. Rep. 2020. V. 16. P. 118–125. https://doi.org/10.1007/s12015-019-09938-8
Khavinson V., Popovich I. Short peptides regulate gene expression, protein synthesis and enhance life span RSC drug discovery series № 57 // Anti-aging drugs: from basic research to clinical practice / Ed. A.M. Vaiserman. 2017. Chapter 20. P. 496–513.
Khlystova Z.S., Kalinina I.I., Shmeleva S.P. Thymalin in developing respiratory organs of human fetus // Bull. Exp. Biol. Med. 2003. V. 135. P. 600–602. https://doi.org/10.1023/a:1025449923475
Tang N., Bai H., Chen X. et al. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy // J. Thromb. Haemost. 2020. V. 18. P. 1094–1099. https://doi.org/10.1111/jth.14817
Wang D., Hu B., Hu C. et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus–infected pneumonia in Wuhan, China // JAMA. 2020. V. 323. P. 1061–1069. https://doi.org/10.1001/jama.2020.1585
Zhang C., Wu Z., Li J.-W. et al. The cytokine release syndrome (CRS) of severe COVID-19 and interleukin-6 receptor (IL-6R) antagonist tocilizumab may be the key to reduce the mortality // Int. J. Antimicrob. Agents. 2020. P. 105954. https://doi.org/10.1016/j.ijantimicag.2020.105954
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии