Успехи современной биологии, 2021, T. 141, № 1, стр. 50-65
Эволюционная история цветка Бобовых (Leguminosae)
А. А. Синюшин *
Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: asinjushin@mail.ru
Поступила в редакцию 11.06.2020
После доработки 11.06.2020
Принята к публикации 11.06.2020
Аннотация
Современная эволюционная биология развития включает в свой инструментарий молекулярную филогению, изучение морфологии и морфогенеза, генетику и геномику. Эволюцию цветка удобно изучать на примере высокополиморфной группы, охарактеризованной с позиций современной систематики и молекулярной биологии развития. Такой группой является семейство Бобовых (Leguminosae), демонстрирующее исключительное разнообразие в строении цветка. Исходный план строения цветка в семействе – зигоморфный, пятикруговой, с пятичленными околоцветником и андроцеем, с одночленным гинецеем. Однако в разных эволюционных линиях независимо возникают актиноморфный околоцветник, различные варианты редукции или полимеризации андроцея, многочленный гинецей. Отмечается чрезвычайно высокий уровень гомоплазии. Помимо эволюционной тенденции к стабилизации структуры цветка, неоднократно формируется своеобразный синдром нестабильности, связанный с актиноморфной симметрией и характеризующийся вариабельными числом и положением органов цветка.
ВВЕДЕНИЕ
Эволюционный успех покрытосеменных растений в значительной степени связан с разнообразием уникальной для этого отдела структуры – цветка, адаптированного к различным способам опыления. Начиная со второй половины XX в. формируется плодотворный синтез систематики, вооруженной новыми подходами, классической морфологии и генетики развития. Возникшее направление исследований получило название эволюционной биологии развития – evo-devo. Результатом стало понимание механизмов, лежащих в основе эволюционных событий. Абстрактные формулировки вида “произошла редукция” сменило точное знание того, какие гены ответственны за те или иные морфологические изменения и как давно эти изменения произошли. Точнее было бы сказать, что появились методические возможности для достижения подобных заключений.
В изучении эволюции цветка первый шаг был сделан при исследовании модельных объектов – в основном, Arabidopsis thaliana (Brassicaceae) и Antirrhinum majus (Plantaginaceae). Полученные сведения дали возможность идентифицировать гены, связанные с регуляцией морфогенеза цветка, у представителей других семейств. В их числе было и чрезвычайно интересное с точки зрения разнообразия и эволюции цветка, третье по величине среди покрытосеменных семейство Бобовых (Leguminosae).
Бобовые являются рекордсменом по числу окультуренных представителей (Harlan, 1992). Именно к Бобовым относится старейший модельный объект генетики – горох посевной Pisum sativum L., и именно Бобовые в настоящее время удерживают рекорд по числу полученных полногеномных последовательностей (Bauchet et al., 2019). Эти особенности открывают возможность детального изучения генетической регуляции флорального морфогенеза у представителей данного семейства.
Обширна литература, посвященная развитию цветка у Бобовых. Среди пионеров в этой области уместно упомянуть имя Ширли Такер, которая посвятила флоральному морфогенезу Leguminosae цикл публикаций с середины 1980-х (Tucker, 1984, 1989a,b) до начала 2000-х гг. Эти работы вошли в резонанс с пересмотром системы семейства. Остается только удивляться, как много принципиально важных аспектов, касающихся морфологии цветков Бобовых, было затронуто в этих статьях.
Кроме того, последние десятилетия систематика Бобовых была предметом активного изучения с привлечением современных молекулярно-генетических подходов. Одним из наиболее значительных итогов стала обновленная система семейства, включающая не три, а шесть подсемейств (LPWG, 2017). Именно этой системе мы и будем следовать в дальнейшем, а потому перечислим подсемейства: Caesalpinioideae (148 родов), Cercidoideae (12 родов), Detarioideae (84 рода), Dialioideae (17 родов), Duparquetioideae (1 род) и Papilionoideae (503 рода). По сравнению с традиционной классификацией (Яковлев, 1991), Caesalpinioideae разделились на несколько подсемейств меньшего объема, но Caesalpinioideae s.s. включили бывшее подсемейство Mimosoideae.
Современные методы анализа генома и транс-криптома позволяют отойти от концепции модельного объекта. Так, активные исследования в области филогеномики подсемейства Detarioideae – экзотических растений, мало известных европейским морфологам, – за короткое время подвели к возможности использования этой группы в качестве модельной клады в эволюционной морфологии Бобовых (Ojeda et al., 2019).
При попытке обзора доступной литературы, посвященной цветкам Бобовых, обнаруживается, что различные аспекты освещены в неравной степени. Морфология цветка большинства представителей описана достаточно детально для сопоставления (по крайней мере, в формате видовых и родовых диагнозов). Напротив, ход морфогенеза документирован для существенно меньшего числа родов – включающих, впрочем, большинство узловых таксонов, важных для понимания разнообразия в основных кладах. Генетическая и физиологическая регуляция морфогенеза охарактеризована лишь в некоторых аспектах и изучена в основном на узком круге модельных объектов.
В дальнейшем из соображений конспективности мы, как правило, не станем приводить ссылки на работы, описывающие морфологию цветков, и ограничимся лишь публикациями, посвященными морфогенезу и его регуляции.
Говоря об эволюции цветка, мы отдаем себе отчет в том, что невозможно рассмотреть все возможные апоморфии таксонов невысокого ранга (например триб или родов), хотя их появление, безусловно, подпадает под понятие эволюционной истории. Так, возникновение различных типов строения столбика или опушения чашечки останется за пределами настоящего обзора. Напротив, предметом рассмотрения станут случаи, когда нарушаются симплезиоморфные признаки, присущие интуитивно понимаемому типичному цветку Бобовых. Перечислим их: цветок зигоморфный, круговое расположение органов, пятичленный околоцветник, пятичленный андроцей в двух кругах, одночленный гинецей. Иными словами, основное внимание работы уделено не процессу дифференцировки, а событиям заложения структур цветка Leguminosae.
ЧАШЕЧКА
У всех Бобовых круг чашелистиков закладывается первым и, вероятно, определяет геометрию всего цветка, поскольку органы всех кругов правильно (за исключением случаев, интерпретируемых как редукция одного или нескольких кругов, например Ceratonia, Caesalpinioideae) чередуются друг с другом. Речь, разумеется, идет о цветках с круговым расположением органов, а гинецей составляет исключение почти всегда.
Одним из наиболее важных событий в морфогенезе цветка Бобовых можно считать разметку медианного (лежащего на абаксиально-адаксиальной оси симметрии) чашелистика. В подавляющем большинстве случаев медианный чашелистик имеет абаксиальное положение, что определяет адаксиальное положение медианного лепестка. Этот лепесток имеет особые свойства – в зигоморфном цветке отличается от остальных лепестков и чаще всего сохраняется при частичной редукции венчика.
Однако есть несколько исключений. Хорошо известно, что в адаксиальном положении зачастую, но не всегда, закладывается медианный чашелистик у представителей бывшего подсемейства Mimosoideae. Уверенно подобное можно утверждать только о mimosoids с пятичленной чашечкой, однако и в таких цветках медианный чашелистик может закладываться по-разному, например у Inga этот показатель изменчив на меж- и внутривидовом уровне (Paulino et al., 2017). Более верно, что в этой группе возможно адаксиальное положение медианного чашелистика. Сходный и столь же пластичный морфогенез чашечки описан у Gleditsia (Tucker, 1991), Ceratonia, Erythrophleum (Tucker, 1992). Сопоставление морфологических и филогенетических данных показывает, что такое положение медианного чашелистика присуще целой кладе цезальпиниевых с актиноморфными цветками, в которую входит в качестве субклады бывшее подсемейство Мимозовых (De Barros et al., 2017). Обращает на себя внимание высокая вариабельность в развитии цветка, касающаяся не только положения медианного чашелистика, но и мерности, размера органов, пола зрелого цветка и даже ориентации шва плодолистика (Tucker, 1992).
С учетом особого значения именно адаксиального лепестка в зигоморфном венчике становится понятным, что адаксиальное положение медианного чашелистика несовместимо с зигоморфией у Бобовых. По крайней мере, такое сочетание (обычное, например, для Violaceae или Geraniaceae) у Leguminosae неизвестно. Не очевидно, какое событие было первичным – необычное заложение чашелистика или формирование актиноморфного околоцветника. Однако в обсуждаемом семействе эти черты составляют синдром, включающий также иные черты нестабильности: вариабельную мерность и неустойчивое положение шва плодолистика (Tucker, 1991, 1992).
Сопоставление данных о морфологии околоцветника с филогенией покрытосеменных показывает, что эволюционно исходным в пятичленном цветке было адаксиальное положение медианного чашелистика. Смена геометрии происходила в эволюции независимо около 30 раз (Bukhari et al., 2017). Абаксиальное положение медианного чашелистика в порядке Fabales является синапоморфией для Leguminosae и нехарактерно для остальных семейств (Bello et al., 2012). Вероятно, в подсемействе Caesalpinioideae произошла реверсия к анцестральному положению медианного чашелистика. Возможно, имели место даже два события реверсии: группа родов, в которую входят Ceratonia и Gleditsia, относится к самым рано отделившимся от общего ствола Caesalpinioideae линиям, а бывшие Mimosoideae – к продвинутым цезальпиниевым.
У некоторых базальных Papilionoideae (Swartzia, Bocoa, Candolleodendron, Cordyla) чашечка зрелого цветка представляет собой полностью замкнутый покров, в котором невозможно различить отдельные чашелистики. При зацветании такая чашечка разрывается. Заложение такой чашечки происходит в виде трех (или большего числа) лопастей, которые иногда интерпретируют как отдельные чашелистики (Tucker, 2003a). У некоторых Swartzia, впрочем, описано привычное заложение пяти примордиев, предположительно соответствующих чашелистикам (Tucker, 2003a). Иногда рост чашечки происходит кольцеобразно, без формирования различимых лопастей, причем разные варианты могут сочетаться у одного и того же вида или даже в одном соцветии (Sinjushin, 2018). Эти наблюдения подводят к заключению о том, что три лопасти, с которых начинается развитие чашечки у этих растений, представляют собой не примордии чашелистиков, а, скорее, складки единой кольцеобразной меристемы. Такая интерпретация избавляет от неизбежного затруднения относительно природы трехчленной чашечки в кладе, в которой у многих родов цветок пятичленный.
У многих Detarioideae два адаксиальных чашелистика закладываются в виде отдельных примордиев, но срастаются на ранних стадиях, что производит в зрелом цветке впечатление четырехчленной чашечки. Прочие части цветка остаются пятичленными. В этом подсемействе известны роды и с пятью чашелистиками (Tucker, 2002a, 2003b). У нескольких родов трибы Loteae (Papilionoideae) эти же чашелистики закладываются в виде единственного примордия, который затем распадается на две части (Sokoloff et al., 2007). Наконец, два адаксиальных чашелистика, появляясь независимо, срастаются при образовании двугубой чашечки (например Aeschynomene, Papilionoideae).
ВЕНЧИК
Самая заметная часть цветка, венчик, более всего вносит вклад в субъективную оценку того, насколько типичен цветок у того или иного представителя Бобовых.
Известны многочисленные примеры Бобовых, имеющих радиально симметричный (актиноморфный) венчик. Исторически актиноморфному венчику у Бобовых зачастую придавали большое значение при филогенетических построениях. С применением молекулярной систематики многие таксоны, выделяемые по признакам симметрии цветка, получили новый статус. Так, были переформированы трибы Swartzieae и Sophoreae. Неоправданным оказался родовой статус некоторых морфологически отличающихся таксонов: например, Etaballia является одним из видов Pterocarpus (Klitgård et al., 2013). Вообще, было обнаружено множество случаев, когда выделяемая по молекулярным данным группа весьма разнородна по морфологическим признакам (Повыдыш и др., 2014; Cardoso et al., 2012a,b). Подобные сопоставления в системе Бобовых, группы с чрезвычайно разнообразными цветками, указывают, с одной стороны, на ценность молекулярных методов в филогении, а с другой – на возможность неожиданно высокого уровня гомоплазии (Pennington et al., 2000; Fougère-Danezan et al., 2010).
Генетическая регуляция формирования зигоморфного венчика достаточно детально изучена на модельных объектах – Antirrhinum (Plantaginaceae), Lotus, Pisum (Papilionoideae). Основную роль в определении симметрии играют гены семейства TCP. Их продукты – белки с мотивом спираль–петля–спираль (bHLH), ответственным за взаимодействие с ДНК и между белками (Martín-Trillo, Cubas, 2010). Морфогенетическую роль этих белков видят в подавлении пролиферации клеток за счет ускорения их перехода к дифференцировке. К этому семейству относятся гены CYC (CYCLOIDEA) и DICH (DICHOTOMA) львиного зева (Luo et al., 1999). Оба гена экспрессируются в адаксиальной части флорального примордия; у мутантов cyc происходит расширение программы развития абаксиальных лепестков на латеральные лепестки – вентрализация. У двойных мутантов cyc dich львиного зева вентрализация достигает предела: все лепестки выглядят как абаксиальные, их число обычно увеличено до шести, вместо стаминодия формируется полноценная тычинка (Luo et al., 1999).
С момента идентификации генов CYC и DICH было установлено, что сходные гены определяют зигоморфную симметрию у множества других покрытосеменных и обычно экспрессируются в адаксиальной части цветка (Preston, Hileman, 2009). Геномы Бобовых содержат по несколько ортологов гена CYC, представляющих результат как минимум одной древней дупликации (Citerne et al., 2003). Роль этих генов в морфогенезе цветка детально изучена у Pisum и Lotus (Wang et al., 2008; Xu et al., 2013; He et al., 2020). У гороха известны рецессивные мутации, влияющие на симметрию венчика. У мутантов keeled wings (ген K соответствует PsCYC3) лепестки-весла дифференцируются как элементы лодочки. Флаг мутантов lobed standard 1 (ген LST1 соответствует PsCYC2) развивается с симметричными вырезками на краях. У мутантов symmetric petals 1 (ген SYP1 кодирует транскрипционный фактор, не сходный с продуктом CYC) все лепестки становятся симметричными относительно срединной жилки. Таким образом, и у Бобовых CYC-подобные гены участвуют в определении симметрии цветка. Их роль в эволюции была продемонстрирована на примере Cadia (Papilionoideae). Таксономическое положение этого рода давно вызывало затруднения: черты, традиционно интерпретируемые как продвинутые, сочетаются у него с актиноморфным цветком, но по молекулярным данным Cadia входит в достаточно продвинутую кладу core genistoids (Cardoso et al., 2012b). Ближайшим родственником Cadia оказался род Calpurnia с типично мотыльковым венчиком. Было установлено, что радиальная симметрия венчика у Cadia связана с эктопической экспрессией одного из ортологов CYC в примордиях всех лепестков, а не только адаксиального лепестка (Citerne et al., 2006). Иными словами, недавняя гомеозисная мутация приводит к тому, что все лепестки дифференцируются как флаги и цветок становится актиноморфным. Аномальные формы с дорсализацией всех лепестков известны и у других видов Бобовых (Sinjushin et al., 2015).
Совершенно иной случай описан у Etaballia – монотипного рода (или вида в составе Pterocarpus) (Klitgård et al., 2013) с актиноморфным цветком в филогенетическом окружении таксонов с мотыльковым венчиком. Узкие, симметричные, не разделенные на ноготок и отгиб лепестки Etaballia не сходны с ноготковыми лепестками прочих Pterocarpus и, следовательно, не могут быть результатом гомеозиса. Эпидерма лепестков Etaballia состоит из мелких клеток, расположенных длинными проксимо-дистальными цепочками (Sinjushin, 2019). Вероятнее всего, у этого растения возникла мутация, препятствующая делению клеток лепестков в латеральном направлении и приводящая к развитию узких одинаковых лепестков во всех положениях. Сходные мутации описаны, например, у Rhododendron, Ericaceae (Tasaki et al., 2012). Гомеозис, впрочем, может быть причиной актиноморфии у других родов Pterocarpus clade (Sinjushin, 2019).
Приведенные примеры и анализ филогении Бобовых (LPWG, 2017) убеждают в том, что зигоморфная симметрия цветка является симплезиоморфией семейства. Вероятнее всего, она установилась единожды, но возможны различные пути ее нарушения, которые в разных подсемействах реализовывались неоднократно, порождая таксономические курьезы. В перспективе, по мере изучения морфогенеза цветка и его регуляции, будут открыты новые механизмы перехода от зигоморфной к актиноморфной симметрии. Можно предположить множество подобных механизмов. Например, у Vicia sativa было установлено существование 462 генов, специфически экспрессирующихся в адаксиальном лепестке и предположительно находящихся под контролем двух ортологов CYC (Liu et al., 2013).
Типично мотыльковый венчик многих Papilionoideae состоит из трех типов лепестков. Общей для порядка Fabales особенностью являются свободные лепестки (Bello et al., 2012), но у многих Papilionoideae абаксиальные лепестки постгенитально срастаются в лодочку и тем или иным образом соединены с латеральными. В ряде случаев латеральные и абаксиальные лепестки имеют практически одинаковое строение (неясно мотыльковый венчик). Велик соблазн считать, что у Papilionoideae эволюция венчика шла по пути усложнения от неясно мотылькового к истинно мотыльковому. Однако описанный выше пример мутантов keeled wings гороха показывает, что уподобление латеральных лепестков абаксиальным может происходить очень легко. У представителей трибы Amorpheae постулировано вторичное упрощение венчика, завершающееся полной редукцией латеральных и абаксиальных лепестков у некоторых родов (McMahon, Hufford, 2005). У некоторых видов Lotus программа дифференцировки латеральных лепестков распространяется на адаксиальные и абаксиальные лепестки, что приводит к развитию венчика, приспособленного к орнитофилии (Ojeda et al., 2017). Флаг-капюшон, характерный для многих садовых форм Lathyrus odoratus (Papilionoideae), является результатом переноса программы развития латеральных лепестков на флаг, вызванного мутацией в CYC-подобном гене (Woollacott, Cronk, 2018).
Эти и другие примеры убеждают в том, что симметрия венчика и дифференцировка различных типов лепестков весьма пластичны. Даже в пределах одного подсемейства переходы от венчика с двумя видами лепестков к венчику с тремя видами лепестков или полностью актиноморфному происходили неоднократно (Ojeda et al., 2019). Система семейства (LPWG, 2017) указывает, скорее, на то, что исходным состоянием является зигоморфия, утраченная вторично у некоторых родов в каждом подсемействе. Для большинства Caesalpinioideae в их современном объеме свойственны актиноморфные цветки. Мотыльковый или сходный с ним венчик нехарактерен только для Detarioideae и Duparquetioideae (LPWG, 2017). Уже в работе (Tucker, 2002b) указано, что у Cercis (Cercidoideae) и Papilionoideae сходная морфология венчика есть результат конвергенции.
Различные части венчика могут редуцироваться. Во многих случаях сохраняется только адаксиальный лепесток: Amburana, Bocoa, Swartzia p.p. (базальные Papilionoideae), Amorpha (продвинутые Papilionoideae), Aphanocalyx, Monopetalanthus (Detarioideae). Изредка два абаксиальных лепестка сильно недоразвиты по сравнению с остальными: Hymenaea, Neochevalierodendron (Detarioideae). Значительно уменьшены латеральные лепестки у Onobrychis p.p. (Papilionoideae). Встречаются безлепестные цветки: Swartzia p.p., Cordyla (базальные Papilionoideae), Ceratonia (Caesalpinioideae), Colophospermum, Crudia, Saraca (Detarioideae), Dialium (Dialioideae).
Обращение к онтогенетическим данным показывает, что сходное конечное состояние, например отсутствие лепестков, обусловлено неодинаковой степенью редукции. Если у Cordyla, безлепестных Swartzia и Dialium нет никаких признаков заложения недостающих лепестков (Tucker, 2003a; Zimmerman et al., 2013; Sinjushin, 2018), то у Crudia и Amburana примордии четырех или пяти лепестков формируются, но не развиваются (Tucker, 2001; Leite et al., 2015). Иногда сохраняются (Copaifera, Detarioideae) или изредка развиваются (Ceratonia) рудименты лепестков (Tucker, 1992; Pedersoli et al., 2010).
Традиционно для описания разных степеней редукции используют понятия аборта и абласта (Чуб, 2010; Schmitz, 1872). В первом случае развитие начинается, но орган не достигает типичных размеров и строения; под типичными мы понимаем сопоставимые с другими органами того же типа (например прочими лепестками) или с такими же органами у родственных таксонов. Абласт предполагает, что нет никаких признаков заложения и развития, но в сходном положении у родственных таксонов орган есть. Гипотеза о наличии абластированного органа может потребоваться, чтобы объяснить особенности строения всей системы – например противолежание органов цветка в случае, когда в цветках родственных таксонов обычно чередование. Абортированный орган может достигать значительных размеров. В случае тычинок, например, к аборту мы относим формирование стаминодиев. Таким образом, в венчике также возможны явления аборта и абласта, которые зачастую приводят к сходному строению сформированного цветка, но, вероятно, достигаются за счет разных механизмов.
АНДРОЦЕЙ
Андроцей представляет собой наиболее изменчивую часть цветка Бобовых как в эволюционном, так и в онтогенетическом смысле (Prenner, 2013; Sinjushin, Karasyova, 2017). Симплезиоморфией Бобовых являются десять тычинок в двух кругах (Bello et al., 2012), но зачастую этот план претерпевает изменения.
Нередки случаи редукции части тычинок. Хотя степень этой редукции неодинакова в разных группах Бобовых, можно выделить два основных паттерна, связанных с положениями редуцированных органов (рис. 1).
Рис. 1.
Примеры преобразований андроцея в семействе Бобовых. Околоцветник и срастание тычинок не отображены. (а) – исходный план строения андроцея в семействе; (б) – Amherstia, Bauhinia petiolata, Brownea, Castanospermum; (в) – Arachis, Senna p.p.; (г) – Gilbertiodendron, Phanera; (д) – Bauhinia monandra; (е) – Afzelia; (ж) – Tamarindus; (з) – Petalostylis; (и) – Sindora; (к) – Neptunia (мужской цветок); (л) – Duparquetia; (м) – Dialium p.p., Distemonanthus; (н) – Astragalus p.p., Bauhinia variegata, Staminodianthus; (о) – Ceratonia; (п) – Dimorphandra; (р) – Swartzia p.p.; (с) – Cordyla. Окружностями показаны тычинки, серыми фигурами – стаминодии, звездочками – абластированные органы. Фигура большего размера соответствует наружному кругу.
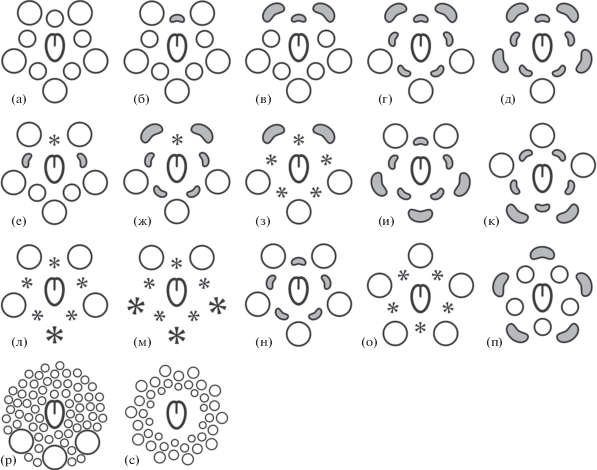
1. Редукция тычинок одного или обоих кругов в адаксиальной части цветка. У Abrus (Papilionoideae) отсутствуют какие-либо признаки закладки тычинки внутреннего круга, противолежащей адаксиальному лепестку, – вексиллярная тычинка (Prenner, 2013). У Castanospermum (базальные Papilionoideae), Amherstia, Brownea (Detarioideae) эта же тычинка остается недоразвитой. У Arachis (Papilionoideae) вексиллярная тычинка и смежные с ней одна–две тычинки наружного круга стерильны, превращены в стаминодии. Вероятно, к этой категории можно отнести превращение тех же трех адаксиальных тычинок в лепестковидные стаминодии у большинства видов Senna (Caesalpinioideae). Эти стаминодии (Marazzi et al., 2007) считают синапоморфией Senna, причем в одной из клад рода предполагается вторичная фертилизация адаксиальных тычинок. Изучение транскриптома различных по положению тычинок у S. bicapsularis показывает, что в тычинках каждого морфологического типа, включая стаминодии, активны несколько сот уникальных генов (Luo et al., 2016). Формирование стаминодиев преимущественно связывают с пониженным уровнем экспрессии генов, предположительно кодирующих белки с мотивом bHLH, и особенностями гормональной регуляции (Luo et al., 2016).
Чрезвычайно разнообразны редукционные явления в андроцее Bauhinia s.l., Cercidoideae (Taubert, 1894); у B. petiolata вексиллярная тычинка недоразвита. Преобразования абаксиальных тычинок встречаются реже – например, абласт медианной абаксиальной тычинки у Duparquetia, Duparquetioideae (Prenner, Klitgaard, 2008) или превращение в стаминодии абаксиальных тычинок обоих кругов у Neptunia, mimosoid Caesalpinioideae (Tucker, 1988). У некоторых Senna превращены в стаминодии по три тычинки с адаксиальной и абаксиальной сторон (Marazzi et al., 2007).
Обращаясь к разнообразию покрытосеменных в целом, можно заметить, что редукция адаксиальной тычинки (или нескольких) достаточно часто сопутствует зигоморфии. Таковы цветки у представителей порядков Lamiales (многие Acanthaceae, Gesneriaceae, Lamiaceae, Plantaginaceae, Scrophulariaceae и др.); Sapindales (Aesculus, Sapindaceae; Galipea, Rutaceae); Myrtales (Cuphea, Lythraceae); Zingiberales (Musaceae, Strelitziaceae, Lowiaceae и Heliconiacae).
Редукция адаксиальных тычинок напрямую связана с экспрессией CYC-подобных генов. У мутантов cyc dich львиного зева все тычинки развиваются полноценно (Luo et al., 1999). У Saintpaulia (Gesneriaceae) известны садовые формы с дорсализацией (все лепестки выглядят как адаксиальные) и вентрализацией (все лепестки выглядят как абаксиальные) венчика. Оба нарушения связаны с изменением уровня и/или паттерна экспрессии двух ортологов CYC (Hsu et al., 2018). В норме три адаксиальные тычинки недоразвиты, превращены в стаминодии. В вентрализованных цветках все тычинки развиваются полностью (медианная адаксиальная несколько меньше прочих), а в дорсализованных – все тычинки заменены на стаминодии. Таким образом, адаксиальная программа развития околоцветника (обычно CYC-опосредованная) определяет и степень развития, и иные особые свойства (например срастание) адаксиальных тычинок11.
2. Полная или частичная редукция одного круга тычинок. Симплезиоморфией порядка Fabales является андроцей из двух пятичленных кругов. В различных группах описано недоразвитие одного круга или его полное отсутствие. Обычно изменению подвергается внутренний круг – например, преобразуется в стаминодии у настолько далеких родов, как Astragalus (A. epiglottis и A. pelecinus), Tetrapterocarpon, Staminodianthus (Papilionoideae), Pentaclethra (mimosoid Caesalpinoideae). У цезальпиниевого Dimorphandra стаминодии формируются из тычинок наружного круга – это менее типичный случай (De Barros et al., 2017). Внутренний круг тычинок преобразован в стаминодии и у некоторых Surianaceae (Cadellia, Suriana), также принадлежащих к порядку Fabales.
В разных подсемействах возможен абласт внутреннего круга – если судить по тому, что сохраняются тычинки, противолежащие чашелистикам. У некоторых Bauhinia (B. variegata, Cercidoideae) единственный (наружный) круг тычинок сочетается с двойным околоцветником. Существует предположение (Tucker, 2000), что у Saraca (Detarioideae) происходит превращение лепестков в тычинки, а ярко окрашенные чашелистики приобретают свойства лепестков. Тычинки с адаксиальной стороны не развиваются, а у S. declinata, в соответствии с этой гипотезой, в принципе нет тычинок в тех же положениях, что и у других Бобовых.
Само по себе лепестковидное строение чашелистиков у Бобовых встречается нечасто, возникает в разных эволюционных линиях и необязательно связано с редукцией других частей. Ярко окрашена внутренняя поверхность чашечки у Delonix, Caesalpinioideae, имеющего нормальное число органов цветка. Лепестковидные чашелис-тики сочетаются с некрупными, слаборазвитыми лепестками у Duparquetia, Duparquetioideae.
Исчезновение одновременно лепестков и части тычинок встречается в разных семействах покрытосеменных. Среди Бобовых таковы роды Ceratonia, Saraca и, возможно, некоторые другие, но приведенные выше примеры убеждают, что редукция тычинок может происходить независимо от лепестков. Отсутствуют лепестки и тычинки наружного круга у Seetzenia, Zygophyllaceae, хотя и в этом семействе тычинки могут редуцироваться при наличии венчика (Tribulopsis, Kallstroemia). Хорошо известен пример Lepidium, Brassicaceae, демонстрирующий гомопластическое разнообразие редукционных процессов в венчике и/или андроцее (Bowman et al., 1999). Развитие тычинок и лепестков на генетическом уровне контролируется во многом сходно, и в экспериментальных условиях показана возможность одновременного подавления их развития (Yun et al., 2002).
У ряда Бобовых (в первую очередь подсем. Caesalpinoideae и Cercidoideae) сочетаются два вышеперечисленных паттерна редукции тычинок – по крайней мере, это объясняет число и расположение тычинок в цветках этих экзотических растений. Лишь три абаксиальных тычинки наружного круга сохраняются у многих видов Cheniella (=Phanera s.l., Cercidoideae), а остальные семь – преобразованы в стаминодии; пять из них с адаксиальной стороны образуют мясистый ярко окрашенный диск, предположительно привлекающий опылителей (Clark et al., 2017). У Bauhinia monandra, Cercidoideae, полноценно развивается лишь медианная абаксиальная тычинка наружного круга, остальные образуют стаминодии; вообще Bauhinia s.l. демонстрируют практически все возможные варианты редукции андроцея.
В необычных цветках подсемейства Dialioideae абласт внутреннего круга андроцея (присущ не всем родам) сочетается с недоразвитием (абортом) членов внешнего круга – как правило, с адаксиальной (Petalostylis), реже с абаксиальной (Dialium) стороны. Сходным образом абластированы все тычинки внутреннего круга и медианная абаксиальная тычинка наружного круга у Duparquetia, Duparquetioideae (Prenner, Klitgaard, 2008). Лишь две адаксиальные тычинки полноценно развиты у Sindora, Detarioideae.
Полный абласт тычинок среди Бобовых, по-видимому, не встречается. В функционально женских цветках Бобовых (например Ceratonia) тычинки всегда закладываются, но их развитие останавливается. Полностью превращены в лепестковидные стаминодии тычинки в стерильных цветках Neptunia (Tucker, 1988).
Таким образом, более обычно неразвитие или недоразвитие тычинок в адаксиальной части цветка, которое мы связываем с активностью CYC-подобных генов. Исключения, когда преобразуются абаксиальные тычинки, редки. В целом такая изменчивость объяснима терминологической неоднозначностью – тем, насколько широко можно трактовать понятия недоразвития или преобразования и, следовательно, тем, насколько разнообразными могут быть причины таких явлений. Редукционные явления в андроцее Бобовых также демонстрируют высокий уровень гомоплазии.
У части Бобовых отмечена полиандрия. В этом отношении наиболее известны некоторые роды Caesalpinioideae – бывшего подсемейства Mimosoideae (Acacia, Inga), Detarioideae (Colophospermum, Maniltoa, Polystemonanthus) и Papilionoideae (Swartzia, Bocoa, Cordyla). Не для всех этих растений изучен ход морфогенеза, но уже имеющиеся данные позволяют сделать вывод о разнообразных механизмах формирования полимерного андроцея. У Acacia имеет место так называемая комплексная акропетальная полиандрия (Ремизова, 2019). Весь андроцей формируется из кольцевой меристемы, и первые примордии отдельных тычинок противолежат чашелистикам (Gómez-Acevedo et al., 2007; Prenner, 2011). По мере акропетального формирования примордиев отдельных тычинок упорядоченность в их расположении утрачивается. Вероятно, правильное чередование венчика и первых тычинок связано с формой кольцевой меристемы, которой давление со стороны примордиев лепестков физически придает форму четырех-пятиугольника.
Кольцевая меристема андроцея описана и у Swartzia (Tucker, 2003a). В зигоморфных цветках этого рода, однако, тычинки обычно диморфные; редко мономорфные (S. auriculata) или триморфные (S. trimorphica). В абаксиальной части кольцевой меристемы практически сразу после ее формирования обособляются примордии нескольких крупных тычинок. Оставшаяся кольцевая меристема дает начало примордиям мелких тычинок, причем этот процесс начинается с абаксиальной части и происходит базипетально (Tucker, 2003a).
У Cordyla, ранее сближаемой с Swartzia (Cardoso et al., 2015), характер развития полимерного андроцея иной. Примордии тычинок закладываются в акропетальном порядке, то есть морфологически сверху вниз, на развивающемся гипантии (отсутствует у Swartzia), имеют разный размер и по крайней мере на ранних стадиях выглядят правильно чередующимися (Sinjushin, 2018). Если у Swartzia все мелкие тычинки одинаковы уже на стадии примордиев, у Cordyla внутренние тычинки часто оказываются без пыльников. Именно из-за этого было предложено выделить мадагаскарские виды Cordyla в отдельный род Dupuya (Kirkbride, 2005), хотя наличие стаминодиев и не уникально для форм с Мадагаскара.
Развитие полимерного андроцея описано и у Colophospermum из подсемейства Detarioideae (Krüger et al., 1999). Тычинки, вероятно, закладываются на кольцевой меристеме в акропетальной последовательности. Все примордии одинакового размера и не имеют явно упорядоченного расположения.
Наблюдения убеждают в том, что полиандрия возникла в разных группах Бобовых независимо и разными путями. Ни у одного изученного представителя Бобовых полимерный андроцей не формируется из нескольких первичных общих примордиев, которые правильно чередовались бы с элементами околоцветника, как это происходит у многих других семейств (Ronse Decraene, Smets, 1993).
В различных подсемействах Бобовых отмечается срастание тычинок. Обзор доступной литературы показывает, что во многих случаях под срастанием понимают разные явления и описывают в разных терминах. Зачастую наличие и тип срастания тычинок оказываются предметом дискуссии (Соколов, 1995). Особенности срастания андроцея весьма пластичны даже в пределах достаточно небольших групп. Для представителей высокоспециализированной клады Papilionoideae, лишенной обращенного повтора хлоропластной ДНК (inverted repeat-lacking clade), в целом характерен двубратственный андроцей со свободной вексиллярной тычинкой. Однако полностью срастаются тычинки у Ononis, триба Trifolieae, нескольких видов Astragalus из разных секций (A. donianus, A. himalayanus, A. oxyodon), Galega, триба Galegeae s.l. Кроме того, в нескольких родах клады формируется так называемый ложнооднобратственный андроцей, в котором вексиллярная тычинка постгенитально прирастает или плотно прилегает к остальным (Tucker, 1989a). Обычно в основании этой тычинки остаются отверстия, через которые есть доступ к нектарникам. Подобный андроцей описан в разных группах и, вероятно, возник независимо из двубратственного.
На регуляторном уровне особые свойства вексиллярной тычинки связаны с экспрессией CYC-подобных генов в адаксиальной области цветка. Такая экспрессия отмечена в примордиях адаксиального лепестка и вексиллярной тычинки у Lotus (Feng et al., 2006). Если в результате мутации или эктопической экспрессии CYC-подобных генов (Feng et al., 2006) все лепестки приобретают свойства флага, срастания тычинок не происходит – как, например, у Cadia или садовой формы Clitoria (Sinjushin et al., 2015). Отмечено, что мотыльковый венчик может сочетаться с любыми формами срастания тычинок, но актиноморфный околоцветник – по крайней мере, у Papilionoideae – крайне редко ассоциирован со сросшимися тем или иным образом тычинками (Sinjushin et al., 2015). Исключение, возможно, единственное, составляет Etaballia, триба Dalbergieae, с актиноморфным венчиком и сросшимися в замкнутую трубку тычинками; о возможной природе актиноморфии у этого необычного рода см. выше. За пределами Papilionoideae такое сочетание встречается, хотя и редко: Brownea и другие роды из Brownea clade (Detarioideae), Inga (mimosoid Caesalpinioideae).
Особенности срастания тычинок связаны со стратегией опыления и, в частности, с наличием и структурой флоральных нектарников. Наиболее детально в этом отношении описаны представители Papilionoideae. Обычно нектарники есть в цветках с несросшимися тычинками, двубратственным или ложнооднобратственным (при наличии отверстий в основании вексиллярной тычинки) андроцеем. Напротив, цветки с однобратственным андроцеем обычно привлекают опылителей пыльцой и редко (например Galega orientalis) секретируют нектар (Bernardello, 2007). В обоих случаях описаны исключения. При сходстве общего плана строения нектарники в семействе достаточно разнообразны. Их структура и расположение иногда отражают симметрию цветка – например, они могут быть локализованы только в абаксиальной части цветоложа (Pisum, Vicia).
Если основным аттрактантом является пыльца, возможна специализация тычинок: часть производит пыльцу для привлечения опылителей, другая – непосредственно для опыления. Различия касаются не только размеров тычинок, но и ультраструктуры и физиологических особенностей производимых пыльцевых зерен (Paulino et al., 2016). У Lupinus, Papilionoideae, преимущественно функцию привлечения выполняют тычинки внутреннего круга, у Cytisus, Papilionoideae, – адаксиальные тычинки обоих кругов. С особым типом опыления (buzz-pollination) связывают дифференцировку тычинок у Senna (Marazzi et al., 2007).
Тычинки могут срастаться с элементами венчика; это происходит в разных трибах и, вероятно, за счет разных механизмов. Хорошо известны примеры Gymnocladus (Caesalpinioideae), Trifolium, Psoralea, Inocarpus (Papilionoideae). Детально изучен онтогенез цветков с подобным срастанием в трибе Amorpheae (McMahon, Hufford, 2002). Зональный рост оснований тычинок приводит к формированию так называемой стемозоны, объединяющей нижние части тычинок и лепестков (вероятно, происходит конгенитальное срастание). В цветках Dalea эта стемозона в сочетании с абластом тычинок внутреннего круга производит впечатление тычиночной трубки, в которой пять тычинок срастаются и чередуются с лепестками. Эта картина настолько поразила некоторых морфологов, что возникла дискуссия о гомологиях между различными частями цветка Dalea и других Papilionoideae, породившая в итоге гипотезу о том, что зигоморфные цветки некоторых Amorpheae возникли в эволюции независимо от прочих представителей подсемейства (McMahon, Hufford, 2002). Онтогенетические исследования лишили эту проблему прежней остроты.
ГИНЕЦЕЙ
Одночленный гинецей считается синапоморфией Leguminosae в рамках порядка Fabales (Bello et al., 2012). У Polygalaceae (Monnina, Pteromonnina) возможен псевдомономерный гинецей, а у Surianaceae (Guilfoylia, Stylobasium), вероятно, истинно одночленный, хотя его можно считать (Endress, 2012) также результатом редукции.
В нескольких эволюционных линиях Бобовых описан полимерный гинецей. Случаи срастания двух и более цветков, приводящего к образованию цветка с несколькими плодолистиками, не несут таксономической информации и, вероятно, возможны во всех группах. В норме несколько плодолистиков образуются в большинстве цветков Inga p.p., Archidendron, Acacia celastrifolia (mimosoid Caesalpinioideae), Swartzia p.p., Aldina diplogyne (базальные Papilionoideae), Thermopsis turcica (продвинутые Papilionoideae). Периодически образуются цветки с полимерным гинецеем у Ceratonia (Caesalpinioideae), Cordyla pinnata (базальные Papilionoideae) и некоторых других Бобовых.
Филогенетическая интерпретация подобного явления длительное время была предметом дискуссии. Так, Г.П. Яковлев считал, что полимерные гинецеи Бобовых представляют собой “морфологические реликты, сохранившиеся в силу гетеробатмии у групп разного систематического положения и различной эволюционной продвинутости” (Яковлев, 1991, с. 35). Более поздние работы сходятся во мнении о плезиоморфном характере мономерного гинецея в семействе и независимом возникновении полимерного в нескольких эволюционных линиях. Насчитывают (Paulino et al., 2014) семь подобных событий полимеризации. Изучение мутантов модельных Бобовых показывает, что лишние плодолистики могут возникать в результате гомеозисного превращения части тычинок, срастания нескольких флоральных меристем или увеличения размеров (фасциации) единственной флоральной меристемы (Sinjushin, 2014; Sinjushin et al., 2019). Именно последний вариант, судя по всему, чаще всего приводит к полимеризации гинецея у Бобовых. Обращает на себя внимание тот факт, что в большинстве случаев несколько плодолистиков развиваются в актиноморфном цветке с полимерным андроцеем и непостоянной мерностью.
У Thermopsis turcica тримерный гинецей сочетается с типично мотыльковым венчиком. Показано, что в таких необычных цветках плодолистики закладываются не одновременно. Происходит не столько увеличение размеров флоральной меристемы (которое привело бы к дестабилизации цветка), сколько ее более длительная пролиферация, допускающая заложение большего числа органов “по вертикали” (Sinjushin et al., 2018). Сочетание зигоморфии с полимерным гинецеем характерно также для некоторых Swartzia. В цветках S. dipetala обычно развиваются два плодолистика, обращенных швами к адаксиальной части цветка, в которой присутствуют два адаксиальных лепестка. Подобная морфология может быть результатом фасциации – срастания или неполного разделения двух флоральных меристем на ранних стадиях. Более вероятно формирование единой плоской меристемы (Paulino et al., 2013), размеры которой делают возможным заложение парных, а не одиночных органов в каждом узле цветка.
Справедливо мнение, что полимерный гинецей плохо сочетается с типично мотыльковым венчиком (flag blossom) именно из-за того, что нестабильность в числе и расположении органов препятствует скоординированному взаимодействию частей такого цветка (Paulino et al., 2014) – в первую очередь это касается лепестков. Именно поэтому полимерный гинецей у Бобовых зачастую является частью синдрома нестабильности, иными словами – сравнительно безвредным следствием, а не адаптивным преимуществом. Обладающий тримерным гинецеем T. turcica образует не больше семян, чем другие виды того же рода с единственным плодолистиком (Sinjushin et al., 2018). Лишь небольшая часть (около 10%) цветков образуют димерный плод у S. dipetala (Paulino et al., 2013). Димерные плоды никогда не были описаны у Cordyla, хотя димерный гинецей встречается регулярно (Sinjushin, 2018).
Наиболее вероятно, что все случаи полимеризации гинецея у Leguminosae представляют собой результат недавних – в эволюционных масштабах – мутаций, дестабилизирующих размер меристемы цветка и/или продлевающих время ее пролиферации. У Arabidopsis описано множество подобных мутаций (Чуб, Синюшин, 2012). Характерно, что нет, пожалуй, ни одного (не монотипного) рода Бобовых, в котором все представители имели бы полимерный гинецей.
Дискуссия о том, терминальное или латеральное положение занимает единственный плодолистик у Бобовых, имеет давнюю историю (Derstine, Tucker, 1991). Преобладает точка зрения, что плодолистик является истинно терминальным производным флоральной меристемы. Возникновение полимерного гинецея интерпретируют как переход от закрытой к открытой системе, то есть очень существенное преобразование меристемы цветка (Paulino et al., 2014).
По нашему мнению, плодолистик представляет собой латеральное производное. В терминальном положении не может находиться структура, имеющая абаксиальную и адаксиальную поверхности, но существуют Бобовые с истинно терминальными обоеполыми цветками в рацемозных (Gleditsia, Gymnocladus) и, вероятно, цимозных (Apuleia, Dialioideae22) соцветиях. Изменения мерности гинецея хорошо объяснимы с точки зрения органотаксиса цветка, то есть антотаксиса (Sinju-shin, 2015). Существуют два отчасти независимых параметра – размеры флоральной меристемы и время ее пролиферации. Увеличение меристемы позволяет заложить дополнительные плодолистики в том же узле, что и первый (вероятно, случай Swartzia), или сформировать целый круг (Inga). Более длительная пролиферация приводит к заложению новых плодолистиков в разных узлах по спирали (Thermopsis turcica). Сочетание обоих преобразований делает возможным, например, появление более чем одного круга плодолистиков (Inga, Acacia celastrifolia). У фасциированных мутантов Бобовых (см. выше) и Arabidopsis (Clark et al., 1995) можно наблюдать все перечисленные варианты. Следовательно, переходы между мономерным и полимерным гинецеем представляют собой количественные изменения и с регуляторной точки зрения должны происходить достаточно легко, как и любые события, касающиеся мерности.
Единственный (или первый в полимерном гинецее с неодновременным заложением элементов) плодолистик в подавляющем большинстве случаев обращен швом к адаксиальной стороне. Все известные исключения относятся к актиноморфным цветкам (Ceratonia, Gleditsia, Acacia). Вероятно, абаксиально-адаксиальная полярность меристемы цветка определяет ориентацию плодолистика – и даже добавочных плодолистиков, которые в цветках Thermopsis turcica отчасти повернуты швами к флагу (Sinjushin et al., 2018). Однако плодолистик в большинстве актиноморфных цветков Gleditsia ориентирован правильно (Tucker, 1991). Вопрос о механизмах, определяющих ориентацию плодолистика в мономерном гинецее, интересен в масштабах всего отдела покрытосеменных и, по-видимому, не имеет единого решения. По крайней мере, в актиноморфных “хаотических” цветках Achlys, Berberidaceae, плодолистик ориентирован единообразно (Endress, 1989), а в зигоморфных цветках Consolida, Ranunculaceae, – нестабильно (собственные данные). У Posidonia, Posidoniaceae, единственный плодолистик стабильно ориентирован швом в абаксиальную сторону (Remizowa et al., 2012).
ПРОЧИЕ ОСОБЕННОСТИ ЦВЕТКОВ БОБОВЫХ
Для описания разнообразия цветков с круговым расположением органов было предложено пользоваться двумя параметрами: мерностью – числом органов в круге – и полнотой – числом кругов (Чуб, 2010). Эта концепция применима к цветкам Бобовых с некоторыми ограничениями, в первую очередь связанными с зигоморфией.
Хотя исходным для Бобовых представляется пятичленный цветок, в некоторых группах мерность меняется. Такие изменения характерны для групп с актиноморфными цветками независимо от их таксономического положения. Трехчленные цветки описаны у некоторых mimosoid Caesalpinioideae (Mimosa ceratonia и другие виды Mimosa, Sanjappa) и Dialioideae (Apuleia). Четырехчленные цветки обычны у M. pudica (mimosoid Caesalpinioideae) и у Tetrapterocarpon (Caesalpinioideae). Мерность цветка имеет определенное таксономическое значение для мимоз (Simon et al., 2011). Цветки некоторых Mimosa можно назвать минимальными для семейства: низкая мерность сочетается с редукцией одного круга тычинок. Возможна и необычно высокая мерность. Так, венчик у Aldina diplogyne (базальные Papilionoideae) и оба круга околоцветника у Englerodendron usambarense (Detarioideae) – шестичленные.
Актиноморфные цветки у Бобовых демонстрируют не только более широкий диапазон мерности, чем зигоморфные, но и отличаются меньшей стабильностью. Вариабельна мерность цветка у Inga, mimosoid Caesalpinioideae (Paulino et al., 2017), Gleditsia (Tucker, 1991), Ceratonia (Tucker, 1992). Проведенное сравнение стабильности цветка у Бобовых с разным строением показало, что актиноморфные цветки имеют бо́льшую изменчивость, чем зигоморфные (Sinjushin, Karasyova, 2017). Внутривидовые и внутриорганизменные колебания в числе органов цветка отражают не генотипические различия между разными цветками в одном соцветии, а общую стабильность морфогенеза.
Наименее склонны к спонтанным колебаниям числа органы адаксиальной части цветка (Sinjushin, Karasyova, 2017; Sinjushin et al., 2019). Это хорошо объясняется тем, что определяющие симметрию CYC-подобные гены активируют переход к дифференцировке, тем самым угнетая клеточные деления. Эти гены подавляют экспрессию ряда факторов, ответственных за осуществление клеточного цикла, например циклинов (Martín-Trillo, Cubas, 2010). Характерно, что у мутантов по CYC-подобным генам увеличивается мерность цветка (Luo et al., 1999; Hsu et al., 2015). В цветке CYC-подобных мутантов гороха также отмечено развитие избыточных органов (Wang et al., 2008).
При изучении Arabidopsis была описана сложная система негативной регуляции размеров апикальной и флоральной меристем (Чуб, Синюшин, 2012). Целый ряд генов, среди которых наиболее известны группы CLAVATA и FASCIATA, ингибируют пролиферацию клеток меристемы. У мутантов по этим и некоторым другим генам эта негативная регуляция утрачивается, что приводит к фасциации – аномальному увеличению меристемы. В цветке это приводит к закладке дополнительных органов и неизбежной дестабилизации. Однако у большинства известных Бобовых регуляция размеров апикальной и флоральной меристем осуществляется отчасти независимо: цветки фасциированных мутантов Бобовых обычно имеют нормальную структуру (Sinjushin, 2016). Одно из исключений – Lupinus angustifolius. В цветках фасциированных мутантов люпина увеличивается число органов во всех кругах, но адаксиальная часть венчика – предполагаемая область экспрессии CYC-подобных генов – оказывается стабильнее прочих (Sinjushin et al., 2019). Таким образом, у Бобовых (как, вероятно, у многих таксонов с зигоморфным цветком) есть две независимые системы негативной регуляции размеров флоральной меристемы, и зигоморфия предполагает более устойчивое к флуктуациям развитие цветка.
Многие онтогенетические события в цветке Бобовых можно объяснить в свете представлений о бластозонах. Первоначально этот термин был введен для обозначения областей побега, компетентных к органогенезу (Hagemann, Gleissberg, 1996). Одно из дополнительных значений – область меристемы, которая при разметке возникает как единое целое, а затем способна к вторичному органогенезу (Чуб, Синюшин, 2012). В этом смысле общие примордии лепестков и тычинок у Pisum (см. ниже) можно интерпретировать как бластозоны (Tucker, 1989b).
При увеличении размеров флоральной меристемы зигоморфных цветков Бобовых зачастую происходит именно расширение бластозоны, позволяющее заложить больше органов в ее пределах. Следствием становится нарушение регулярного чередования органов в кругах. Так, при фасциации цветка у Lupinus вместо одиночных тычинок могут развиваться пары, и именно пары тычинок одного круга чередуются с одиночными или парными тычинками другого (Sinjushin et al., 2019). Сходная, хотя и совершенно не типичная для Бобовых картина наблюдается в очень нестабильных по числу органов цветках Mendoravia, Dialioideae (Zimmerman et al., 2013). Вероятно, производными единой бластозоны являются два адаксиальных лепестка и единой же – два плодолистика у Swartzia dipetala.
Представления об изменениях полноты цветка сформированы преимущественно на материале актиноморфных цветков (Чуб, 2010) и в принципе могут быть аппроксимированы на такие цветки Бобовых. Наиболее выраженное обеднение цветка достигается при редукции лепестков и одного круга тычинок (Ceratonia). Речь идет именно об абласте недостающих органов, а не о делеции кругов (Чуб, 2010). В противном случае тычинки единственного круга в цветке Ceratonia правильно чередовались бы с чашелистиками, чего не наблюдается в реальности. При стохастических колебаниях в структуре актиноморфных цветков Бобовых мерность у противолежащих кругов (например чашечки и наружных тычинок) часто коррелирует сильнее, чем у чередующихся (Sinjushin, Karasyova, 2017). У некоторых специализированных Papilionoideae (например Astragalus) лепесток и противолежащая ему тычинка образуются из единого примордия (Movafeghi et al., 2011).
Большое значение придают последовательности заложения органов у Бобовых. В целом для цветков Бобовых характерно акропетальное развитие. Как правило, органы в абаксиальной части цветка появляются первыми и развиваются с некоторым опережением; случаи обратного порядка редки (Tucker, 2003b). Чашелистики и реже лепестки могут закладываться в спиральном порядке, что считается примитивной особенностью (Tucker, 1984). Круговое заложение органов (с поправкой на более интенсивные темпы развития в абаксиальной части) интерпретируют как более продвинутую черту. Отмечают общую тенденцию к ускорению развития, когда органы разных кругов закладываются одновременно – например, плодолистик появляется одновременно с тычинками наружного круга или даже лепестками (Tucker, 1984; Prenner, Klitgaard, 2008). Некоторого логического завершения это направление достигает у Pisum (и некоторых других членов клады IRLC) в виде так называемых общих примордиев (Tucker, 1989b). После заложения чашелистиков одновременно с плодолистиком образуются четыре примордия, которые затем дают начало венчику и тычинкам.
Хотя в последовательности заложения органов цветка у Бобовых можно выделить архаичные и продвинутые паттерны, отбору в первую очередь подвергается дефинитивное состояние цветка. На этом уровне можно констатировать эквифинальность: одинаковый план строения достигается независимо от последовательности, в которой на флоральной меристеме появляются примордии. Современные представления об эволюции порядка заложения органов цветка также сходятся в том, что переход между различными паттернами происходил легко и в итоге породил высокий уровень гомоплазии (Ремизова, 2019). Имеются наблюдения высокой вариабельности порядка заложения в пределах одного организма. Это касается не только таксонов с хаотичным морфогенезом цветка, например Gleditsia и Ceratonia (Tucker, 1991, 1992), но и вполне традиционных цветков Astragalus (Naghiloo et al., 2012). Изменчивость в порядке заложения чашелистиков у A. compactus связывают с механическим давлением, которое оказывает кроющий лист соцветия. Таким образом, пространственно-временной паттерн заложения примордиев не является определяющим для структуры и функции зрелого цветка.
ЗАКЛЮЧЕНИЕ
Изучение развития цветков в семействе Бобовых представляет собой, пожалуй, один из самых впечатляющих успехов evo-devo в биологии растений. Прогресс в систематике семейства сочетается с детальным изучением морфологии и морфогенеза в ключевых группах, с одной стороны, и с генетикой развития модельных объектов – с другой. Такой подход позволяет однозначно установить, какие состояния признаков были исходными, а какие – производными. Во многих случаях можно уверенно постулировать молекулярный механизм того или иного преобразования.
По сути, на примере Бобовых можно видеть своего рода инверсию методологии эволюционной биологии. Веками морфология лежала в основе систематики, однако хорошо известной проблемой оставалась невозможность ранжировать морфологические признаки по их значимости. Помехой оставалась гомоплазия – лишь в последние десятилетия стал понятным ее истинный, весьма высокий уровень. Филогенетика и филогеномика позволяют однозначно реконструировать ход эволюции таксона и дифференцировать морфологические признаки на архаичные и производные. Яркий пример такой инверсии – тот путь, по которому идет изучение подсемейства Dialioideae. Значительный, достигнутый современными методами анализа генома – и умещающийся по сути в одну публикацию – прорыв в систематике этой необычной группы позволил реконструировать ход эволюции цветка в ней и предложить ее в качестве модели в биологии развития Бобовых (Ojeda et al., 2019).
За последние десятилетия стала общепризнанным фактом высокая степень эквифинальности флорального морфогенеза Бобовых при вариабельности промежуточных стадий. Типично мотыльковый венчик, который по сути и является предметом и итогом естественного отбора, может быть сформирован на основе разной последовательности закладки органов.
Исследование цветков Leguminosae вскрыло колоссальный уровень гомоплазии, длительное время мешавший построению непротиворечивой системы семейства. Нынешний уровень развития легуминистики уже не позволяет считать, например, актиноморфный цветок единообразным для всех Бобовых явлением и интерпретировать его как однозначно древнее (или, напротив, однозначно производное) состояние. Конвергентно возникают актиноморфия, не делимая на отдельные элементы чашечка, полимерный или тем или иным образом редуцированный андроцей, полимерный гинецей.
Зигоморфный пятичленный пятикруговой цветок является несомненной симплезиоморфией Бобовых. Вероятно, зигоморфная симметрия цветка во всем семействе поддерживается одним и тем же регуляторным механизмом и сочетается с дополнительной стабилизацией строения. Однако в разных группах симметрия цветка разными путями меняется на актиноморфную, и зачастую возникает сходный набор апоморфий: пластичный порядок заложения органов в развитии, вариабельное положение медианного чашелистика и шва плодолистика, нестабильная мерность в разных кругах, полимерные андроцей и гинецей. Эти особенности в семействе Бобовых составляют своеобразный синдром нестабильности, который во многих случаях оказывается в адаптивном смысле не менее ценным, чем исходно зигоморфное и стабильное строение цветка.
Список литературы
Повыдыш М.Н., Гончаров М.Ю., Яковлев Г.П. Морфологические особенности цветка “базальных мотыльковых” и их таксономическое значение // Ботан. журн. 2014. Т. 99. С. 377–383.
Ремизова М.В. Шаг вверх, два шага вниз: порядок заложения органов цветка // Онтогенез. 2019. Т. 50. С. 407–423.
Соколов Д.Д. О строении андроцея у Anthyllis vulneraria L. (Papilionaceae, Loteae) // Вестн. Моск. ун-та. Сер. 16. Биология. 1995. № 4. С. 51–54.
Чуб В.В. Роль позиционной информации в регуляции развития органов цветка и листовых серий побегов. М.: Бином. Лаборатория знаний, 2010. 263 с.
Чуб В.В., Синюшин А.А. Фасциация цветка и побега: от феноменологии к построению моделей преобразования апикальной меристемы // Физиол. раст. 2012. Т. 59. С. 574–590.
Яковлев Г.П. Бобовые земного шара. Л.: Наука, 1991. 144 с.
Bauchet G.J., Bett K.E., Cameron C.T. et al. The future of legume genetic data resources: challenges, opportunities, and priorities // Legume Sci. 2019. V. 1. P. e16.
Bello M.A., Rudall P.J., Hawkins J.A. Combined phylogenetic analyses reveal interfamiliar relationships and patterns of floral evolution in the eudicot order Fabales // Cladistics. 2012. V. 28. P. 393–421.
Bernardello G. A systematic survey of floral nectaries // Nectaries and nectar / Eds S.W. Nicolson, M. Nepi, E. Pacini. Dodrecht: Springer, 2007. P. 19–128.
Bowman J.L., Brüggemann H., Lee J.Y., Mummenhoff K. Evolutionary changes in floral structure within Lepidium L. (Brassicaceae) // Int. J. Plant Sci. 1999. V. 160. P. 917–929.
Bukhari G., Zhang J., Stevens P.F., Zhang W. Evolution of the process underlying floral zygomorphy development in pentapetalous angiosperms // Am. J. Bot. 2017. V. 104. P. 1846–1856.
Cardoso D., De Lima H.C., Rodrigues R.S. et al. The realignment of Acosmium sensu stricto with the Dalbergioid clade (Leguminosae: Papilionoideae) reveals a proneness for independent evolution of radial floral symmetry among early-branching papilionoid legumes // Taxon. 2012a. V. 61. P. 1057–1073.
Cardoso D., De Queiroz L.P., Pennington R.T. et al. Revisiting the phylogeny of papilionoid legumes: new insights from comprehensively sampled early-branching lineages // Am. J. Bot. 2012b. V. 99. P. 1991–2013.
Cardoso D., São-Mateus M.B., Cruz D.T. et al. Filling in the gaps of the papilionoid legume phylogeny. The enigmatic Amazonian genus Petaladenium is a new branch of the early-diverging Amburaneae clade // Mol. Phylogenet. Evol. 2015. V. 84. P. 112–124.
Citerne H.L., Luo D., Pennington R.T. et al. A phylogenomic investigation of CYCLOIDEA-like TCP genes in the Leguminosae // Plant Physiol. 2003. V. 131. P. 1042–1053.
Citerne H.L., Pennington R.T., Cronk Q.C.B. An apparent reversal in floral symmetry in the legume Cadia is a homeotic transformation // PNAS USA. 2006. V. 103. P. 12017–12020.
Clark S.E., Running M.P., Meyerowitz E.M. CLAVATA3 is a specific regulator of shoot and floral meristem development affecting the same processes as CLAVATA1 // Development. 1995. V. 121. P. 2057–2067.
Clark R.P., Mackinder B.A., Banks H. Cheniella gen. nov. (Leguminosae: Cercidoideae) from Southern China, Indochina and Malesia // Eur. J. Taxon. 2017. V. 360. P. 1–37.
De Barros T.C., Pedersoli G.D., Paulino J.V., Teixeira S.P. In the interface of caesalpinioids and mimosoids: comparative floral development elucidates shared characters in Dimorphandra mollis and Pentaclethra macroloba (Leguminosae) // Am. J. Bot. 2017. V. 104. P. 218–232.
Derstine K.S., Tucker S.C. Organ initiation and development of inflorescences and flower of Acacia baileyana // Am. J. Bot. 1991. V. 78. P. 816–832.
Endress P.K. Chaotic floral phyllotaxis and reduced perianth in Achlys (Berberidaceae) // Botanica Acta. 1989. V. 102. P. 159–163.
Endress P.K. The immense diversity of floral monosymmetry and asymmetry across angiosperms // Bot. Rev. 2012. V. 78. P. 345–397.
Falcão M.J.A., Paulino J.V., Kochanovski F.J. et al. Development of inflorescences and flowers in Fabaceae subfamily Dialioideae: an evolutionary overview and complete ontogenetic series for Apuleia and Martiodendron // Bot. J. Linn. Soc. 2020. V. 193. P. 19–46.
Feng X., Zhao Z., Tian Z. et al. Control of petal shape and floral zygomorphy in Lotus japonicus // PNAS USA. 2006. V. 103. P. 4970–4975.
Fougère-Danezan M., Herendeen P.S., Maumont S., Bruneau A. Morphological evolution in the variable resin-producing Detarieae (Fabaceae): do morphological characters retain a phylogenetic signal? // Ann. Bot. 2010. V. 105. P. 311–325.
Gómez-Acevedo S.L., Magallón S., Rico-Arce L. Floral development in three species of Acacia (Leguminosae, Mimosoideae) // Aust. J. Bot. 2007. V. 55. P. 30–41.
Hagemann W., Gleissberg S. Organogenetic capacity of leaves: the significance of marginal blastozones in angiosperms // Plant Syst. Evol. 1996. V. 199. P. 121–152.
Harlan J.R. Crops and man. Madison: Amer. Soc. Agronomy, 1992. 284 p.
He L., Lei Y., Li X. et al. SYMMETRIC PETALS 1 encodes an ALOG domain protein that controls floral organ internal asymmetry in pea (Pisum sativum L.) // Int. J. Mol. Sci. 2020. V. 21. P. 4060.
Hsu H.C., Chen C.Y., Lee T.K. et al. Quantitative analysis of floral symmetry and tube dilation in an F2 cross of Sinningia speciosa // Sci. Hortic. 2015. V. 188. P. 71–77.
Hsu H.J., He C.W., Kuo W.S. et al. Genetic analysis of floral symmetry transitions in African violet suggests the involvement of trans-acting factor for CYCLOIDEA expression shifts // Front. Plant Sci. 2018. V. 9. P. 1008.
Kirkbride J.H. Dupuya, a new genus of Malagasy legumes // Novon J. Bot. Nomenclat. 2005. V. 15. P. 305–314.
Klitgård B., Forest F., Booth T.J., Saslis-Lagoudakis C.H. A detailed investigation of the Pterocarpus clade (Leguminosae: Dalbergieae): Etaballia with radially symmetrical flowers is nested within the papilionoid-flowered Pterocarpus // S. Afr. J. Bot. 2013. V. 89. P. 128–142.
Krüger H., Tiedt L.R., Wessels D.C.J. Floral development in the legume tree Colophospermum mopane, Caesalpinioideae: Detarieae // Bot. J. Linn. Soc. 1999. V. 131. P. 223–233.
Leite V.G., Teixeira S.P., Mansano V.F., Prenner G. Floral development of the early-branching papilionoid legume Amburana cearensis (Leguminosae) reveals rare and novel characters // Int. J. Plant Sci. 2015. V. 176. P. 94–106.
Liu Z., Ma L., Nan Z., Wang Y. Comparative transcriptional profiling provides insights into the evolution and develop-ment of the zygomorphic flower of Vicia sativa (Papilionoideae) // PLoS One. 2013. V. 8. P. e57338.
LPWG. The Legume Phylogeny Working Group. A new subfamily classification of the Leguminosae based on a taxonomically comprehensive phylogeny // Taxon. 2017. V. 66. P. 44–77.
Luo D., Carpenter R., Copsey L. et al. Control of organ asymmetry in flowers of Antirrhinum // Cell. 1999. V. 99. P. 367–376.
Luo Z., Hu J., Zhao Z., Zhang D. Transcriptomic analysis of heteromorphic stamens in Cassia biscapsularis L. // Sci. Rep. 2016. V. 6. P. 31600.
McMahon M., Hufford L. Developmental morphology and structural homology of corolla-androecium synorganization in the tribe Amorpheae (Fabaceae: Papilionoideae) // Am. J. Bot. 2002. V. 89. P. 1884–1898.
McMahon M., Hufford L. Evolution and development in the amorphoid clade (Amorpheae: Papilionoideae: Leguminosae): petal loss and dedifferentiation // Int. J. Plant Sci. 2005. V. 166. P. 383–396.
Marazzi B., Conti E., Endress P.K. Diversity in anthers and stigmas in the buzz-pollinated genus Senna (Leguminosae, Cassiinae) // Int. J. Plant Sci. 2007. V. 168. P. 371–391.
Martín-Trillo M., Cubas P. TCP genes: a family snapshot ten year later // Tr. Plant Sci. 2010. V. 15. P. 31–39.
Movafeghi A., Naghiloo S., Dadpour M.R. Inflorescence and floral development in Astragalus lagopoides Lam. (Leguminosae: Papilionoideae: Galegeae) // Flora. 2011. V. 206. P. 219–226.
Naghiloo S., Dadpour M.R., Movafeghi A. Floral ontogeny in Astragalus compactus (Leguminosae: Papilionoideae: Galegeae): variable occurrence of bracteoles and variable patterns of sepal initiation // Planta. 2012. V. 235. P. 793–805.
Ojeda D.I., Jaén-Molina R., Santos-Guerra A. et al. Temporal, but not spatial, changes in expression patterns of petal identity genes are associated with loss of papillate conical cells and the shift to bird pollination in Macaronesian Lotus (Leguminosae) // Plant Biology. 2017. V. 19. P. 420–427.
Ojeda D.I., Koenen E., Cervantes S. et al. Phylogenomic analyses reveal an exceptionally high number of evolutionary shifts in a florally diverse clade of African legumes // Mol. Phylogenet. Evol. 2019. V. 137. P. 156–167.
Paulino J.V., Mansano V.F., Teixeira S.P. Elucidating the unusual floral features of Swartzia dipetala (Fabaceae) // Bot. J. Linn. Soc. 2013. V. 173. P. 303–320.
Paulino J.V., Prenner G., Mansano V.F., Teixeira S.P. Comparative development of rare cases of a polycarpellate gynoecium in an otherwise monocarpellate family, Leguminosae // Am. J. Bot. 2014. V. 101. P. 572–586.
Paulino J.V., Mansano V.F., Prenner G. Evidence for division of labor and division of function related to the pollen release in Papilionoideae (Leguminosae) with a hetero-morphic androecium // Int. J. Plant Sci. 2016. V. 177. P. 590–607.
Paulino J.V., Mansano V.F., Prenner G., Teixeira S.P. High developmental lability in the perianth of Inga (Fabales, Fabaceae): a neotropical woody rosid with gamopetalous corolla // Bot. J. Linn. Soc. 2017. V. 183. P. 146–161.
Pedersoli G.D., Paulino J.V., Leite V.G., Teixeira S.P. Elucidating enigmatic floral tissues in Copaifera langsdorffi Desf. (Leguminosae, Caesalpinioideae) // Int. J. Plant Sci. 2010. V. 171. P. 834–846.
Pennington R.T., Klitgaard B.B., Ireland H., Lavin M. New insights into floral evolution of basal Papilionoideae from molecular phylogenies // Advances in Legume Systematics. Pt 9 / Eds P.S. Herendeen, A. Bruneae, P.S. Pollard. L., Kew: Royal Botanic Gardens, 2000. P. 233–248.
Prenner G. Floral ontogeny of Acacia celastrifolia: an enigmatic mimosoid legume with pronounced polyandry and multiple carpels // Flowers on the Tree of Life / Eds L. Wanntorp, L.P. Ronse De Craene. Cambridge: Cambridge Univ. Press, 2011. P. 256–278.
Prenner G. Flower development in Abrus precatorius (Leguminosae: Papilionoideae: Abreae) and a review of androecial characters in Papilionoideae // S. Afr. J. Bot. 2013. V. 89. P. 210–218.
Prenner G., Klitgaard B.B. Towards unlocking the deep nodes of Leguminosae: floral development and morphology of the enigmatic Duparquetia orchidacea (Leguminosae, Caesalpinioideae) // Am. J. Bot. 2008. V. 95. P. 1349–1365.
Preston J.C., Hileman L.C. Developmental genetics of floral symmetry evolution // Tr. Plant Sci. 2009. V. 14. P. 147–154.
Remizowa M.V., Sokoloff D.D., Calvo S. et al. Flowers and inflorescences of the seagrass Posidonia (Posidoniaceae, Alismatales) // Am. J. Bot. 2012. V. 99. P. 1592–1608.
Ronse Decraene L.P., Smets E.F. Dédoublement revisited: towards a renewed interpretation of the androecium of the Magnoliophytina // Bot. J. Linn. Soc. 1993. V. 113. P. 103–124.
Schmitz F. Die Blüthen-Entwicklung der Piperaceen // Botanische Abhandlungen as dem Gebiet der Morphologie und Physiologie. B. 2 / Ed. J. Hanstein. Bonn: bei Adolph Marcus, 1872. S. 86.
Simon M.F., Grether R., De Queiroz L.P. et al. The evolutionary history of Mimosa (Leguminosae): toward a phylogeny of the sensitive plants // Am. J. Bot. 2011. V. 98. P. 1201–1221.
Sinjushin A.A. Origin and variation of polymerous gynoecia in Fabaceae: evidence from floral mutants of pea (Pisum sativum L.) // Plant Syst. Evol. 2014. V. 300. P. 717–727.
Sinjushin A.A. Is the leguminous flower closed? // Wulfenia. 2015. V. 22. P. 281–287.
Sinjushin A.A. Effects of stem fasciation on inflorescence and flower morphology in legumes // Wulfenia. 2016. V. 23. P. 127–134.
Sinjushin A.A. Floral ontogeny in Cordyla pinnata (A. Rich.) Milne-Redh. (Leguminosae, Papilionoideae): away from stability // Flora. 2018. V. 241. P. 8–15.
Sinjushin A.A. Notes on floral symmetry in the Pterocarpus clade (Leguminosae: Papilionoideae: Dalbergieae) // Wulfenia. 2019. V. 26. P. 175–188.
Sinjushin A.A., Karasyova T.A. Stability of the floral structure in Leguminosae with flag versus non-flag blossom // Wulfenia. 2017. V. 24. P. 1–10.
Sinjushin A.A., Bagheri A., Maassoumi A.A., Rahiminejad M.R. Terata of two legume species with radialized corolla: come correlations in floral symmetry // Plant Syst. Evol. 2015. V. 301. P. 2387–2397.
Sinjushin A.A., Tekdal D., Ciftci C., Cetiner S. Floral develop-ment in Thermopsis turcica, an unusual multicarpellate papilionoid legume // Plant Syst. Evol. 2018. V. 304. P. 461–471.
Sinjushin A.A., Bykova E.A., Choob V.V. Interaction between floral merism and symmetry: evidence from fasciated mutant of Lupinus angustifolius L. (Leguminosae) // Symmetry. 2019. V. 11. P. 321.
Sokoloff D.D., Degtjareva G.V., Endress P.K. et al. Inflorescence and early flower development in Loteae (Leguminosae) in a phylogenetic and taxonomic context // Int. J. Plant Sci. 2007. V. 168. P. 801–833.
Tasaki K., Nakatsuka A., Cheon K.-S. et al. Morphological and expression analyses of MADS genes in Japanese traditional narrow- and/or staminoid-petaled cultivars of Rhododendron kaempferi Planch // Sci. Hort. 2012. V. 134. P. 191–199.
Taubert P. Leguminosae // Die Natürlichen Pflanzenfamilien / Ed. A. Engler. Leipzig: Verlag von Wilhelm Engelmann, 1894. S. 147–153.
Tucker S.C. Unidirectional organ initiation in leguminous flower // Am. J. Bot. 1984. V. 71. P. 1139–1148.
Tucker S.C. Heteromorphic flower development in Neptunia pubescens, a mimosoid legume // Am. J. Bot. 1988. V. 75. P. 205–224.
Tucker S.C. Evolutionary implications of floral ontogeny in legumes // Advances in legume biology / Eds C.H. Stirton, J.L. Zarucchi. St. Louis: Missouri Botanical Garden, 1989a. P. 59–75.
Tucker S.C. Overlapping organ initiation and common primordia in flowers of Pisum sativum (Leguminosae: Papilionoideae) // Am. J. Bot. 1989b. V. 76. P. 714–729.
Tucker S.C. Helical floral organogenesis in Gleditsia, a primitive caesalpinioid legume // Am. J. Bot. 1991. V. 78. P. 1130–1149.
Tucker S.C. The developmental basis for sexual expression in Ceratonia siliqua (Leguminosae: Caesalpinioideae: Cassieae) // Am. J. Bot. 1992. V. 79. P. 318–327.
Tucker S.C. Floral development and homeosis in Saraca (Leguminosae: Caesalpinioideae: Detarieae) // Int. J. Plant Sci. 2000. V. 161. P. 537–549.
Tucker S.C. The ontogenetic basis for missing petals in Crudia (Leguminosae: Caesalpinioideae: Detarieae) // Int. J. Plant Sci. 2001. V. 162. P. 83–89.
Tucker S.C. Comparative floral ontogeny in Detarieae (Leguminosae: Caesalpinioideae). 1. Radially symmetrical taxa lacking organ suppression // Am. J. Bot. 2002a. V. 89. P. 875–887.
Tucker S.C. Floral ontogeny of Cercis (Leguminosae: Caesalpinioideae: Cercideae): does it show convergence with papilionoids? // Int. J. Plant Sci. 2002b. V. 163. P. 75–87.
Tucker S.C. Floral ontogeny in Swartzia (Leguminosae: Papilionoideae: Swartzieae): distribution and role of the ring meristem // Am. J. Bot. 2003a. V. 90. P. 1271–1292.
Tucker S.C. Comparative floral ontogeny in Detarieae (Leguminosae: Caesalpinioideae). III. Adaxially initiated whorls in Julbernardia and Sindora // Int. J. Plant Sci. 2003b. V. 164. P. 275–286.
Wang Z., Luo Y., Li X. et al. Genetic control of floral zygomorphy in pea (Pisum sativum L.) // PNAS USA. 2008. V. 105. P. 10414–10419.
Woollacott C., Cronk Q.C.B. The hooded mutant of Lathy-rus odoratus (Fabaceae) is associated with a cycloidea gene mutation // Botany. 2018. V. 96. P. 47–55.
Yun J.Y., Weigel D., Lee I. Ectopic expression of SUPERMAN suppresses development of petals and stamens // Plant Cell Physiol. 2002. V. 43. P. 52–57.
Xu S., Luo Y., Cai Z. et al. Functional diversity of CYCLOIDEA-like TCP genes in the control of zygomorphic flower development in Lotus japonicus // J. Integr. Plant Biol. 2013. V. 55. P. 221–231.
Zimmerman E., Prenner G., Bruneau A. Floral ontogeny in Dialiinae (Caesalpinioideae: Cassieae), a study in organ loss and instability // S. Afr. J. Bot. 2013. V. 89. P. 188–209.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


