Успехи современной биологии, 2021, T. 141, № 1, стр. 40-49
Роль факторов врожденного и адаптивного иммунитета в формировании дифтерийного бактерионосительства
Г. Г. Харсеева 1, *, А. А. Алиева 1, Л. П. Алексеева 2, О. С. Чемисова 2, А. Л. Трухачев 2, С. Ю. Тюкавкина 1, А. В. Чепусова 1, О. И. Сылка 1
1 Ростовский государственный медицинский университет
Ростов-на-Дону, Россия
2 Ростовский-на-Дону научно-исследовательский противочумный институт
Ростов-на-Дону, Россия
* E-mail: galinagh@bk.ru
Поступила в редакцию 14.07.2020
После доработки 15.07.2020
Принята к публикации 15.07.2020
Аннотация
Цель работы – определение роли факторов врожденного и адаптивного иммунитета в формировании бактерионосительства токсигенных штаммов C. diphtheriae. Установлено, что под влиянием сыворотки крови бактерионосителей происходит увеличение (р ≤ 0.05) адгезивной активности планктонных культур токсигенных штаммов C. diphtheriae gravis tox+ в 1.5–2 раза. Воздействие сыворотки крови пациентов с манифестированными формами дифтерии способствует резкому (в 82 раза) снижению их адгезивности (р ≤ 0.05). У бактерионосителей на фоне низкого содержания антибактериальных антител, высокого уровня антитоксических антител и лактоферрина, а также более широкого спектра сывороточных белков, обладающих способностью ингибировать апоптоз (Humanin-like protein) и связывать тяжелые металлы (Metallothionein), в том числе и железо, адгезивность токсигенных штаммов C. diphtheriae повышается. Образцы сыворотки крови больных манифестированными формами дифтерии и привитых противодифтерийными препаратами обладают наибольшим сродством по масс-спектру белков, тогда как образцы бактерионосителей и непривитых АКДС- и АДС-М-препаратами существенно отличаются от них. Указанные особенности воздействия факторов врожденного и адаптивного иммунитета бактерионосителей предрасполагают к формированию биопленки, понижению выделения токсина за ее пределы и, как следствие, длительной персистенции возбудителя в организме.
ВВЕДЕНИЕ
Проблема бактерионосительства является актуальной при многих инфекциях (стафилококковой, стрептококковой, менингококковой, сальмонеллезной и др.) (Михайлова и др., 2015). Однако несмотря на многочисленные исследования, посвященные этой проблеме, ответа на вопрос, почему у одной части инфицированных возбудителями бактериальных инфекций развиваются клинически выраженные формы заболевания, а у других – бактерионосительство, до сих пор нет. Дифтерийная инфекция в этом отношении не является исключением, несмотря на плановую вакцинацию в рамках Национального календаря прививок препаратами дифтерийного анатоксина, которая привела к резкому сокращению ареала распространения и снижению заболеваемости этой инфекцией, но не полной ее эрадикации (Костюкова, Бехало, 2018).
В настоящее время в Индии, Индонезии, странах Латинской Америки и, особенно, Венесуэле зафиксирован подъем заболеваемости дифтерией (https://www.who.int/ru/news-room/detail/06-12-2017-diphtheria-is-spreading-fast-in-cox-s-bazar-bangladesh).
Случаи заболевания регистрируются в странах Европейского Союза (https://www.rospotrebnadzor.ru/about/info/news/news_details.php?ELEMENT_ID=12046&sphrase_id=1731051).
Резервуар возбудителя дифтерии сохраняется и в России (https://www.rospotrebnadzor.ru/upload/iblock/d9d/gd_2017_seb.pdf?fbclid=IwAR0Ctf6FskpwnIdtvC4x4qcNS5e-GzpM4Stk7x1zawiuiFCMg8mtru9czOk).
Особую важность в сложившейся ситуации представляет проведение вакцинопрофилактики, направленной на создание напряженного специфического иммунитета. Однако высокий уровень антитоксина в организме привитых не препятствует циркуляции штаммов возбудителя дифтерии в популяции. Связано это, прежде всего, с тем, что формирующийся при вакцинации противодифтерийный иммунитет не способен предотвратить адгезию и колонизацию возбудителем слизистой оболочки респираторного тракта человека (Костюкова, Бехало, 2018). У лиц с защитным уровнем антитоксических антител могут сформироваться различные по степени выраженности клинические формы дифтерии: от бессимптомных (бактерионосительство) до тяжелых клинически выраженных (Покровский, Фокина, 2016). Почему так происходит, однозначного ответа пока нет. Известно, что бактерионосительство, в отличие от манифестированных форм инфекции, формируется у лиц с изначально высоким уровнем антитоксических и низким содержанием антибактериальных антител (Костюкова, Гукасян, 1977). Имеет значение и состояние местного иммунитета: уровень секреторного IgA в слюне при кратковременном и транзиторном бактерионосительстве ниже, чем при длительном (Кветная и др., 2000). С другой стороны, важную роль играют и свойства изолированных штаммов коринебактерий. Так, при длительном носительстве выделяются только высокоадгезивные штаммы, независимо от их токсигенности (Костюкова, Карась, 1991). Помимо этого, известно, что возбудитель дифтерии обладает способностью формировать биопленку (Sharma et al., 2019). В целом, приведенные факты не могут дать более или менее полного ответа на поставленный вопрос.
В соответствии с этим, целью исследования явилось определение роли факторов врожденного и адаптивного иммунитета в формировании бактерионосительства токсигенных штаммов C. diphtheriae.
МАТЕРИАЛЫ И МЕТОДЫ
Исследованы штаммы: C. diphtheriae gravis tox+ № 665, полученный из ГИСК им. Л.А. Тарасевича; C. diphtheriae gravis tox+, выделенный от больного с диагнозом локализованная форма дифтерии бактериологической лабораторией ФГКУ “1002 ЦГСЭН” Минобороны России г. Ростова-на-Дону; C. diphtheriae gravis с “молчащим” tox-геном (отрицательный в тесте Элека и положительный при определении гена дифтерийного токсина в ПЦР), предоставленный МБУЗ “Городская больница № 1 им. Н.А. Семашко Ростова-на-Дону”.
Использовали образцы сыворотки крови больных с дифтерией ротоглотки локализованной (30 чел.) и токсической (30 чел.), отобранные на 1–7 сутки заболевания до проведения специфического лечения; бактерионосителей токсигенных штаммов C. diphtheriae (30 чел.); здоровых не привитых (30 чел.) и привитых АКДС- и АДС-М-препаратами (30 чел.) в соответствии с Национальным календарем прививок. Образцы сыворотки крови больных дифтерией были взяты в период эпидемии дифтерии в г. Ростове-на-Дону за период с 1997 г. по 1999 г. и хранились при ‒20°С.
Биопленочные (120- и 720-часовые) культуры штаммов возбудителя дифтерии получали по методу (Watnick, Kolter, 2000).
Адгезивные и инвазивные свойства штаммов коринебактерий определяли на культуре клеток карциномы фарингеального эпителия Нер-2 (Ott et al., 2010). При постановке опытов по прерыванию адгезии и инвазии использовали и коммерческие препараты комплемента (цельного) (НПО “Микроген” МЗ РФ, г. Пермь), лактоферрина (“Hycult Biotechnology (HTB) BV”, Нидерланды) в дозе 270 мкг/мл, антитоксина диагностического дифтерийного (НПО “Микроген” МЗ РФ, г. Пермь) в дозе 5 МЕ/мл, а также образцы сыворотки крови (цельные), которые предварительно отфильтровывали с помощью мембранных фильтров фирмы “Millipore” с размером пор 0.45 мкм и проверяли на стерильность путем высева на 20%-ный сывороточный агар. Непосредственно перед опытом в пробирки вносили по 1.0 мл взвеси коринебактерий густотой 106 колониеобразующих единиц в 1 мл (КОЕ/мл) и 1.0 мл стерильной сыворотки (или указанных препаратов). Полученную смесь выдерживали в термостате 60 мин при 37°С. Далее пробирки центрифугировали при 10 000 об./мин в течение 5 мин, удаляли надосадочную жидкость, осадок ресуспендировали в среде RPMI-1640 до густоты микробной взвеси 106 КОЕ/мл. После этого производили заражение культуры клеток Нер-2. Количество коринебактерий, адгезированных на клетках Нер-2, определяли путем высева смыва на 20%-ный сывороточный агар с последующим подсчетом среднего количества КОЕ в 1 мл. Адгезивные свойства штаммов коринебактерий выражали в (КОЕ ± m) × 102. Для определения числа инвазировавшихся коринебактерий в лунки планшета добавляли гентамицин (ОАО “Дальхимфарм”, Россия) в концентрации 1.2 ± 0.4 мг/мл с целью уничтожения коринебактерий, адгезированных на поверхности клеток Hep-2. Затем клетки Hep-2 подвергались воздействию в течение 5 мин 0.025%-ного раствора Твин-20, после чего содержимое лунок высевали на мясо-пептонный агар с добавлением 20%-ной сыворотки лошадиной нормальной для культивирования микроорганизмов и подсчитывали количество КОЕ в 1 мл. Инвазивные свойства штаммов коринебактерий выражали в (КОЕ ± m) × 102.
Образцы сыворотки крови исследовали с помощью электрофореза в полиакриламидном геле в денатурирующих условиях по методу (Laemmli et al., 1970) и масс-спектрометрическим методом с использованием масс-спектрометра Autoflex (“Bruker Daltonics”, Германия), в качестве матрицы использовали HCCA (α-циано-4-гидроксикоричную кислоту). Идентификацию белков проводили по наборам значений масс пептидов с использованием программы Mascot Search Results (www.matrixscience.com, “Matrix Science”, США), базы данных SwissProt 2014_04. Были заданы следующие параметры поиска: точность определения массы стомиллионных долей, таксон Homo sapiens. Погрешность определения масс ионов пептидных фрагментов составляла примерно 0.03%.
В исследованных образцах сыворотки крови определяли иммунохимическим методом наличие С3-/С4-компонентов системы комплемента (“Beckman Coulter”, США); иммуноферментным методом – уровень лактоферрина (“Hycult Biotechnology (HTB) BV”, Нидерланды), антител к лактоферрину (“Orgentec Diagnostika GmbH”, Германия), противодифтерийных антибактериальных и антитоксических антител (Лабушкина, 2010).
Статистический анализ результатов исследования проводили с применением программы Statistica 12.0 (StatSoft, США). Уровень значимости р при множественном сравнении рассчитывали по критерию Крускалла–Уолиса. При попарном сравнении средних величин между группами использовался критерий Манна–Уитни с учетом поправки Бонферрони на множественные сравнения (Омельченко, Демидова, 2017).
РЕЗУЛЬТАТЫ
При исследовании воздействия образцов сыворотки крови различных контингентов обследованных на адгезивные свойства циркулирующего в популяции штамма C. diphtheriae gravis tox+ (рис. 1) обнаружили увеличение (р ≤ 0.05) адгезивной активности планктонной культуры под влиянием сыворотки крови бактерионосителей почти в 2 раза по сравнению с показателями контроля. При этом наблюдали резкое (в 82 раза) снижение адгезивности (р ≤ 0.05) под воздействием сыворотки крови пациентов с манифестированными формами дифтерии (дифтерией ротоглотки токсической и локализованной) и значительно менее выраженное (в 1.3 раза), но достоверное (р ≤ 0.05) – сыворотки крови привитых АКДС- и АДС-М-препаратами. Под влиянием образцов сыворотки крови непривитых адгезивные свойства коринебактерий не изменялись. При исследовании биопленочных культур этого штамма показатели адгезивности понижались (р ≤ 0.05) под воздействием образцов сыворотки крови как больных с клинически выраженными формами дифтерии, так и бактерионосителей. Но тенденция к более выраженной адгезивной активности культур, обработанных сывороткой крови бактерионосителей, сохранялась (р ≤ 0.05). Под воздействием образцов сыворотки привитых и непривитых АКДС- и АДС-М-препаратами адгезивные свойства биопленочных культур штамма C. diphtheriae gravis tox+ (циркулирующий) также снижались (р ≤ 0.05). При рассмотрении адгезивных свойств планктонной культуры музейного штамма C. diphtheriae gravis tox+ № 665 под воздействием образцов сыворотки бактерионосителей наблюдали увеличение (р ≤ 0.05) показателей адгезии в 1.5 раза, а под воздействием сыворотки крови больных манифестированными формами дифтерии – достоверное (р ≤ 0.05) их снижение. При исследовании биопленочных культур этого штамма коринебактерий обнаружили, что их адгезивность понижалась (р ≤ 0.05) под воздействием образцов сыворотки крови как больных дифтерией, так и бактерионосителей. Воздействие образцов сыворотки привитых и непривитых АКДС- и АДС-М-препаратами не влияло на адгезивные свойства 120-часовых биопленочных культур, но снижало адгезивность 720-часовых биопленочных культур этого штамма коринебактерий. При исследовании штамма C. diphtheriae gravis с “молчащим” tox-геном результаты были иными: адгезивность как планктонной, так и биопленочных культур этого штамма снижалась (р ≤ 0.05) под воздействием всех исследованных образцов сыворотки крови.
Рис. 1.
Показатели адгезии планктонных и биопленочных культур штаммов C. diphtheriae при воздействии образцов сыворотки крови различных контингентов обследованных. (а) – C. diphtheriae gravis tox+ (циркулирующий); (б) – C. diphtheriae gravis tox+ № 665; (в) – C. diphtheriae с “молчащим” tox-геном; по оси ординат – уровень адгезивной активности (КОЕ/мл); по оси абсцисс – контингент обследованных (БН – бактерионосители; ДТ – дифтерия ротоглотки токсическая; ДЛ – дифтерия ротоглотки локализованная; П – привитые; НП – непривитые). Условные обозначения: — – показатели адгезии исследованных культур, не подвергшихся воздействию образцов сыворотки крови обследованных (контроль); * – статистическая значимость отличий (p ≤ 0.05) по сравнению с контролем.

При исследовании воздействия образцов сыворотки крови различных контингентов обследованных на инвазивные свойства циркулирующего в популяции штамма C. diphtheriae gravis tox+ (рис. 2) обнаружили снижение (р ≤ 0.05) инвазивной активности планктонной культуры этого штамма при обработке сывороткой крови больных дифтерией и привитых противодифтерийными препаратами. При этом инвазивные свойства коринебактерий никак не изменялись под влиянием сыворотки крови бактерионосителей и непривитых. Инвазивная активность биопленочных культур этого штамма при исследовании воздействия на нее всех исследованных образцов сыворотки крови резко снижалась (р ≤ 0.05). При рассмотрении инвазивных свойств планктонной и биопленочных культур музейного штамма C. diphtheriae gravis tox+ № 665 под воздействием всех исследованных образцов сыворотки наблюдали ее статистически значимое (р ≤ 0.05) снижение. При исследовании штамма C. diphtheriae gravis с “молчащим” tox-геном установили, что инвазивность планктонной культуры снижалась (р ≤ 0.05) под воздействием сыворотки крови больных дифтерией, бактерионосителей и непривитых и никак не изменялась под влиянием сыворотки крови привитых АКДС- и АДС-М-препаратами. Инвазивная активность биопленочных культур этого штамма снижалась (р ≤ 0.05) под влиянием всех взятых в исследовании образцов сыворотки.
Рис. 2.
Показатели инвазии планктонных и биопленочных культур штаммов C. diphtheriae при воздействии образцов сыворотки крови различных контингентов обследованных. (а) – C. diphtheriae gravis tox+ (циркулирующий); (б) – C. diphtheriae gravis tox+ № 665; (в) – C. diphtheriae с “молчащим” tox-геном; по оси ординат – уровень адгезивной активности (КОЕ/мл); по оси абсцисс – контингент обследованных (БН – бактерионосители; ДТ – дифтерия ротоглотки токсическая; ДЛ – дифтерия ротоглотки локализованная; П – привитые; НП – непривитые). Условные обозначения: — – показатели адгезии исследованных культур, не подвергшихся воздействию образцов сыворотки крови обследованных (контроль); * – статистическая значимость отличий (p ≤ 0.05) по сравнению с контролем.

Различный характер воздействия образцов сыворотки крови больных дифтерией, бактерионосителей и привитых противодифтерийными препаратами на адгезивные и инвазивные свойства планктонных и биопленочных культур штаммов C. diphtheriae предполагает определение отличий использованных образцов сыворотки крови по содержанию в них факторов врожденного и адаптивного иммунитета. При определении факторов врожденного иммунитета (табл. 1) обнаружили, что содержание С3-/С4-компонентов комплемента во всех исследованных образцах сыворотки крови находилось в пределах нормы и не имело никаких отличий вне зависимости от контингента обследованных. При определении уровня лактоферрина установили, что максимальное его количество (р ≤ 0.05) обнаружено в образцах сыворотки бактерионосителей (1000 ± 0.2 нг/мл). Антитела к лактоферрину не обнаружены ни в одном из исследованных образцов сыворотки крови. При определении факторов адаптивного иммунитета установлено, что содержание противодифтерийных антибактериальных антител минимально (р ≤ 0.05) в образцах сыворотки крови бактерионосителей и непривитых противодифтерийными препаратами. Содержание противодифтерийных антитоксических антител в образцах сыворотки крови бактерионосителей (средняя геометрическая величина титров антител СГТ – 1:316.2) макси-мально (р ≤ 0.05), по сравнению с другими контингентами обследованных, в том числе и с привитыми АКДС- и АДС-М-препаратами. При этом в образцах сыворотки крови больных дифтерией ротоглотки токсической уровень антитоксина (СГТ – 1:20.8) был ниже (р ≤ 0.05), чем у больных дифтерией ротоглотки локализованной (СГТ – 1:47.9).
Таблица 1.
Содержание факторов врожденного и адаптивного иммунитета в образцах сыворотки крови различных контингентов обследованных
| Контингент обследованных | Параметры сравнения | ||||
|---|---|---|---|---|---|
| С3-/С4-компоненты системы комплемента, г/л | Лактоферрин, нг/мл | Антитела
к лактоферрину, МЕ/мл |
Противодифтерийные антибактериальные антитела, МЕ/мл | Противодифтерийные антитоксические антитела (СГТ) |
|
| Бактерионосители | 0.95/0.31 | 1000.0 ± 0.2 | <10 | 0.0023 ± 0.0001 | 1:316.2 (234.4–426.5) |
| Дифтерия ротоглотки токсическая | 1.53/0.38 | 760.3 ± 0.1 | <10 | 0.031 ± 0.002 | 1:20.8 (19.9–21.87) |
| Дифтерия ротоглотки локализованная | 1.26/0.35 | 754.2 ± 0.1 | <10 | 0.013 ±0.001 | 1:47.9 (42.67–53.70) |
| Привитые | 1.03/0.23 | 800.4 ± 0.1 | <10 | 0.011 ± 0.002 | 1:181.9 (154.54–229.08) |
| Непривитые | 1.32/0.30 | 750.7 ± 0.1 | <10 | 0.006 ± 0.001 | <1:10 |
Следующим этапом работы стало изучение влияния указанных факторов врожденного и адаптивного иммунитета на адгезивные свойства штаммов C. diphtheriae. Для этого использовали коммерческие препараты комплемента, лактоферрина и антитоксина диагностического дифтерийного.
При определении влияния препарата комплемента (цельного) на планктонные культуры исследованных штаммов C. diphtheriae обнаружили, что их адгезивные свойства во всех случаях достоверно (р ≤ 0.05) понижались. При оценке воздействия на адгезивные свойства исследованных штаммов C. diphtheriae препарата лактоферрина в дозе 270 мкг/мл, соответствующей его нормальному содержанию в сыворотке крови людей, была обнаружена полная блокада адгезивности как планктонных, так и биопленочных культур всех исследованных штаммов коринебактерий. При определении влияния препарата антитоксина диагностического дифтерийного в концентрации 5 МЕ/мл на адгезивные свойства токсигенных штаммов C. diphtheriae никакого изменения адгезивности не обнаружено ни у одного из исследованных штаммов коринебактерий.
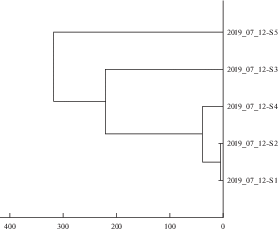
При проведении электрофореза в полиакрил-амидном геле в денатурирующих условиях (рис. 3) исследованные образцы сыворотки крови сравнивали с молекулярными массами стандартных белков в диапазоне от 10 до 170 кДа. Обнаружено, что в зоне 26–43 и 72–170 кДа интенсивность белковых пятен наиболее выражена в образцах сыворотки крови бактерионосителей по сравнению с другими контингентами обследованных. В диапазоне 20–10 000 Да определяли сывороточные белки с помощью масс-спектрометрического метода (MALDI-TOF MS). Последовательность белков на 97–100% соответствовала референсной. Кластерный анализ исследованных образцов сыворотки крови показал следующее (рис. 4). Первую агломерацию образовал кластер, состоящий из показателей S1 – сыворотка крови больных дифтерией ротоглотки токсической и S2 – сыворотка крови больных дифтерией ротоглотки локализованной. К данному кластеру на втором шаге кластеризации присоединился показатель S4 – сыворотка крови привитых АКДС- и АДС-М-препаратами, на третьем – показатель S3 – сыворотка крови бактерионосителей. На последнем шаге кластеризации присоединился показатель S5 – сыворотка крови здоровых, не привитых АКДС- и АДС-М-препаратами. При идентификации белков сыворотки крови обследованных контингентов обнаружено, что в образцах сыворотки крови бактерионосителей более широко представлен спектр сывороточных белков, обладающих способностью ингибировать апоптоз (Humanin-like protein) и связывать тяжелые металлы (Metallothionein), в том числе и железо.
Рис. 3.
Электрофоретическое исследование в полиакриламидном геле в денатурирующих условиях образцов сыворотки крови (разведение 1 : 3) различных контингентов обследованных (1 – дифтерия ротоглотки токсическая; 2 – дифтерия ротоглотки локализованная; 3 – бактерионосители; 4 – привитые АКДС- и АДС-М-препаратами; 5 – непривитые АКДС- и АДС-М-препаратами; 6 – стандартные белки).
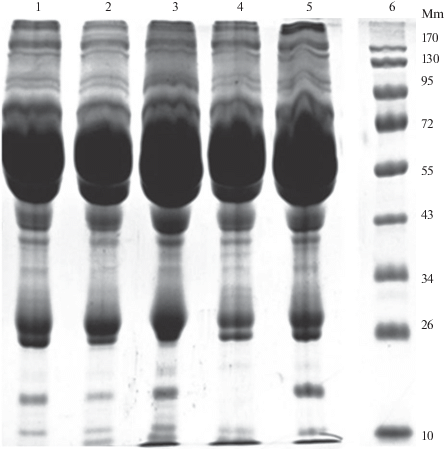
Рис. 4.
Дендрограмма масс-спектрометрического анализа образцов сыворотки крови различных контингентов обследованных (S1 – дифтерия ротоглотки токсическая; S2 – дифтерия ротоглотки локализованная; S3 – бактерионосители; S4 – привитые АКДС- и АДС-М-препаратами; S5 – непривитые АКДС- и АДС-М-препаратами).
ОБСУЖДЕНИЕ
Попадая в организм, возбудитель дифтерии сталкивается с воздействием факторов врожденного и адаптивного иммунитета, которые оказывают определенное влияние на способность коринебактерий прикрепляться к эпителиальным клеткам. В связи с этим представляло интерес исследовать воздействие образцов сыворотки крови различных контингентов обследованных, содержащих эти факторы, на адгезивные и инвазивные свойства штаммов C. diphtheriae. При воздействии образцов сыворотки крови бактерионосителей на продуцирующие токсин штаммы C. diphtheriae адгезивная активность их планктонных культур увеличивалась (р ≥ 0.05) в 1.3–2 раза, а биопленочных – понижалась (р ≥ 0.05). В то же время под действием образцов сыворотки крови бактерионосителей на штамм C. diphtheriae, не продуцирующий токсин, но несущий ген токсигенности, наблюдали снижение адгезивности (р ≥ 0.05) как его планктонной, так и биопленочных культур. Это свидетельствует о том, что определенную роль в повышении адгезивной активности коринебактерий играет выделяемый ими токсин. В организме бактерионосителей, имеющих повышенный уровень антитоксических антител в сыворотке крови, выделяемый C. diphtheriae токсин эффективно нейтрализуется антитоксическими антителами на клеточной поверхности в месте входных ворот инфекции, в результате чего повреждения эпителия не происходит (Кветная и др., 2000). Образующийся иммунный комплекс токсин–антитоксин модифицирует клеточную поверхность и создает благоприятные условия для адгезии и колонизации дифтерийной палочки. Противодифтерийные антитоксические антитела блокировать адгезины коринебактерий не могут, что и обнаружено при исследовании in vitro воздействия антитоксина на адгезивные свойства планктонных и биопленочных культур коринебактерий. Уровень антибактериальных антител, направленных против поверхностных структур коринебактерий, у бактерионосителей низок, поэтому адгезины у C. diphtheriae свободны и формируют биопленку. Это подтверждает тот факт, что межмикробный матрикс дифтерийной биопленки имеет преимущественно белковую природу (Харсеева и др., 2013) и, по всей видимости, сформирован адгезинами. За пределы биопленки выделяется меньшее количество токсина, эффективно блокирующегося антитоксическими антителами, а также лактоферрином, содержание которого у носителей выше (р ≥ 0.05), по сравнению с больными манифестированной формой дифтерии. В свою очередь известно, что антимикробные пептиды могут выступать в роли адъювантов, стимулируя адаптивный иммунный ответ (Чеботарь и др., 2020), в том числе и выработку антитоксических антител. Изолированно in vitro лактоферрин полностью блокировал адгезию планктонных и биопленочных культур C. diphtheriae. Однако известно, что повышенный уровень лактоферрина может стимулировать комплемент-зависимое формирование биопленки, а образовавшийся вследствие этого межмикробный матрикс устойчив к прямому воздействию лактоферрина (Kanwar et al., 2015).
Изменения показателей инвазивной активности исследованных штаммов C. diphtheriae под воздействием образцов сыворотки крови бактерионосителей имели в целом такие же закономерности. Это указывает на существующую взаимосвязь адгезивности и инвазивности возбудителя дифтерии, что объясняется общностью поверхностных структур (DIP0733, DIP1281), отвечающих за эти процессы.
Под воздействием образцов сыворотки крови больных манифестированными формами дифтерии наблюдали наиболее выраженное (р ≤ 0.05) снижение адгезивной и инвазивной активности как планктонных, так и биопленочных культур исследованных штаммов C. diphtheriae, по сравнению с образцами сыворотки других контингентов обследованных. Это можно объяснить наличием антибактериальных антител, блокирующих поверхностные структуры коринебактерий, обусловливающих адгезию и инвазию. Однако в образцах сыворотки крови привитых противодифтерийными препаратами уровень антибактериальных антител не отличался от такового у больных локализованной и токсической формами дифтерии ротоглотки, но снижения адгезивных свойств планктонных и 120-часовых биопленочных культур продуцирующих токсин штаммов C. diphtheriae не наблюдали. В то же время аналогичные результаты обнаружены и при исследовании воздействия на адгезивность и инвазивность штаммов C. diphtheriae образцов сыворотки крови непривитых, содержащих относительно низкий уровень антибактериальных антител. Отличия в воздействии образцов сыворотки различных контингентов обследованных на адгезивность и инвазивность штаммов C. diphtheriae могут быть связаны с наличием в них не только антибактериальных антител и лактоферрина, но и иных белков. Об этом свидетельствовали данные дендрограммы, где видно, что наибольшим сродством по масс-спектру белков обладали образцы сыворотки крови больных манифестированными формами дифтерии и привитых противодифтерийными препаратами. Образцы сыворотки крови бактерионосителей и непривитых АКДС- и АДС-М-препаратами существенно отличались от них. Можно предположить, что различный масс-спектр белковых субстанций, содержащихся в образцах сыворотки крови указанных контингентов обследованных, связан с различным характером их воздействия на адгезивные свойства штаммов C. diphtheriae. Так, в образцах сыворотки крови бактерионосителей более широко, по сравнению с другими контингентами обследованных, представлен спектр белков Humanin-like protein, являющихся мощным ингибитором апоптоза и способных при воздействии на митохондрии увеличивать выработку АТФ, что и обусловливает выживание клеток в стрессовых условиях. Помимо этого, у бактерионосителей, как и у здоровых привитых и непривитых противодифтерийными препаратами, шире спектр и Меtallothionein, по сравнению с больными манифестированными формами дифтерии. Эти белки связывают тяжелые металлы, в том числе, железо и цинк, утилизируя их в организме. Известно, что удержание железа в человеческих клетках – один из важнейших механизмов защиты хозяина, используемый для предотвращения роста бактерий (Rosa et al., 2017; Peng et al., 2018; Ibraim et al., 2019; Sharma et al., 2019). В свою очередь возбудитель дифтерии в условиях низкого содержания железа в свободном состоянии в организме размножается менее интенсивно, происходит активация адгезивного аппарата коринебактерий и усиливается биопленкообразование. C. diphtheriae начинают выделять токсин, который задерживается матриксом биопленки, а выйдя за ее пределы, блокируется антитоксическими антителами и лактоферрином. Перечисленные особенности белкового спектра сыворотки крови бактерионосителей способствуют, по-видимому, активации адгезивного аппарата коринебактерий, биопленкообразованию и длительной персистенции в организме.
ЗАКЛЮЧЕНИЕ
Под воздействием факторов врожденного и адаптивного иммунитета у бактерионосителей на фоне низкого содержания антибактериальных антител, высокого уровня антитоксических антител и лактоферрина, а также более широкого спектра сывороточных белков, обладающих способностью ингибировать апоптоз и связывать тяжелые металлы, в том числе и железо, адгезивность C. diphtheriae повышается, что предрасполагает к формированию биопленки, понижению выделения токсина за ее пределы и, как следствие, длительной персистенции в организме.
Список литературы
Кветная А.С., Иванова В.В., Корженевская Г.Б. и др. Адаптационные механизмы формирования бактерионосительства Corynebacterium diphtheriae // Журн. микробиол. 2000. № 4. Прил. С. 31–36.
Костюкова Н.Н., Бехало В.А. Дифтерийное бактерионосительство // Эпидемиол. вакцинопрофил. 2018. Т. 5. № 18. С. 60–70.
Костюкова Н.Н., Гукасян Л.А. Патогенез дифтерийного носительства в иммунологическом аспекте // Журн. гиг. эпидемиол. микробиол. иммунол. 1977. Т. 21. № 4. С. 394–398.
Костюкова Н.Н., Карась С.Р. Адгезивная активность дифтерийных штаммов в зависимости от особенностей вызываемого ими инфекционного процесса // Журн. микробиол. 1991. № 11. С. 24–27.
Лабушкина А.В. Дифтерийный диализатный антиген и некоторые аспекты противодифтерийного иммунитета у детей с аллергическими заболеваниями: Дис. … канд. мед. наук. М.: ММА им. И.М. Сеченова, 2010. 146 с.
Михайлова Е.А., Киргизова С.Б., Миронов А.Ю. и др. Санация стафилококкового бактерионосительства – новые возможности и перспективы // Клин. лаб. диагн. 2015. Т. 60. № 7. С. 56–57.
Омельченко В.П., Демидова А.А. Медицинская информатика. Руководство к практическим занятиям: учебное пособие. Глава 10. Статистическая обработка результатов медико-биологического исследования с помощью Microsoft Office Excel. М.: ГЭОТАР-Медиа, 2017. С. 324–356.
Покровский В.И., Фокина Г.Г. Дифтерия: болезнь забытая, но не исчезнувшая // Эпидемиол. инфекц. болезни. Актуал. вопр. 2016. № 5. С. 4–12.
Харсеева Г.Г., Миронов А.Ю., Фролова Я.Н., Чепусова А.В. Способность к формированию биопленки возбудителем дифтерии // Клин. лаб. диагн. 2013. № 2. С. 36–38.
Чеботарь И.В., Бочарова Ю.А., Гурьев А.С., Маянский Н.А. Стратегии выживания бактерий в условиях контакта с антибиотиками // Клин. лаб. диагн. 2020. Т. 65. № 2. С. 116–121.
Ibraim I.C., Parise M.T.D., Parise D. et al. Transcriptome profile of Corynebacterium pseudotuberculosis in response to iron limitation // BMC Genomics. 2019. V. 20. Art. 663.
Kanwar J.R., Roy K., Patel Y., Zhou S. Multifunctional iron bound lactoferrin and nanomedicinal approaches to enhance its bioactive functions // Molecules. 2015. V. 20. P. 9703–9731.
Laemmli U.K., Beguin F., Gujer-Kellenberger G. A factor preventing the major head protein of bacteriophage T4 from random aggregation // J. Mol. Biol. 1970. V. 47. № 1. P. 69–74.
Ott L., Höller M., Gerlach R.G. et al. Corynebacterium diphtheriae invasion-associated protein (DIP1281) is involved in cell surface organization, adhesion and internalization in epithelial cells // BMC Microbiol. 2010. № 10. Art. 2.
Peng E.D., Oram D.M., Battistel M.D. et al. Iron and zinc regulate expression of a putative ABC metal transporter in Corynebacterium diphtheriae // J. Bacteriol. 2018. V. 200. № 10. P. e00051-18.
Rosa L., Cutone A., Lepanto M.S. et al. Lactoferrin: a natural glycoprotein involved in iron and inflammatory homeostasis // Int. J. Mol. Sci. 2017. V. 18. № 9. P. e1985.
Sharma N.C., Efstratiou A., Mokrousov I. et al. Diphtheria // Nat. Rev. Dis. Prim. 2019. V. 5. № 1. P. 81.
Watnick P., Kolter R. Biofilm, city of microbes // J. Bacteriol. 2000. V. 182. P. 2675–2679.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


