Успехи современной биологии, 2021, T. 141, № 3, стр. 227-247
Молочная кислота: динамика представлений о биологии лактата
С. В. Чепур 1, *, Н. Н. Плужников 1, О. В. Чубарь 1, И. В. Фатеев 1, Л. С. Бакулина 2, И. В. Литвиненко 3, А. И. Ширяева 1
1 Государственный научно-исследовательский испытательный институт военной медицины МО РФ
Санкт-Петербург, Россия
2 Воронежская государственная медицинская академия им. Н.Н. Бурденко
Воронеж, Россия
3 Военно-медицинская академия им. С.М. Кирова
Санкт-Петербург, Россия
* E-mail: gniiivm_2@mil.ru
Поступила в редакцию 25.11.2020
После доработки 07.12.2020
Принята к публикации 07.12.2020
Аннотация
Повышение уровня лактата в биосредах организма часто интерпретируют как неблагоприятный метаболический фактор, свидетельствующий о гипоксии тканей, нарушении их перфузии. Вместе с тем, увеличение продукции лактата прослежено и в нормоксических условиях, что дало основание к переоценке его роли как ключевого фактора метаболического перепрограммирования организма в условиях стресса/интенсивной физической нагрузки. Молочная кислота вырабатывается в организме как в анаэробных, так и в аэробных условиях и не может рассматриваться как однозначный маркер гипоксии. Лактат рассматривают как важный энергетический метаболит и интермедиат обмена углеводов, а также как сигнальную субстанцию, регулирующую липолиз и β-окисление жирных кислот, обеспечивающую увеличение устойчивости к стресс-индуцирующим воздействиям и ускорение репарации повреждений. β2-адреномиметики, амфетамины и кофакторы пируватдегидрогеназного комплекса оптимизируют энергопродукцию, влияя на метаболизм лактата при стрессовых физических нагрузках, и повышают устойчивость к ним.
ВВЕДЕНИЕ
В ургентных случаях уровень и динамику уровня лактата в крови часто используют как высокозначимый диагностический критерий при оценке тяжести травмы (Cerović et al., 2003; Parsikia et al., 2014; Fukuma et al., 2019) и независимый предиктор неблагоприятного исхода при угрожающих жизни состояниях (Nichol et al., 2010; Bou Chebl et al., 2017). Исходный посыл такого подхода: низкий уровень рО2 в тканях (гипоксия тканей) – причина высокой концентрации лактата в крови – сформирован в сознании специалистов клинического профиля в течение столетия под влиянием множества научных публикаций. Эти экспериментально обоснованные представления, озаренные отблеском авторитета лауреатов Нобелевской премии (A.V. Hill, O.F. Meyerhof – 1922, C. Eijkman, F.G. Hopkins – 1929) (Fletcher, 1907; Hill et al., 1924a,b,c; Meyerhof, 1930, 1942), были незаметно трансформированы в лактат-кислородную догму: высокий уровень лактата в крови – следствие гипоксии тканей (низкого уровня рО2 в тканях). Данный тезис был усилен концепцией анаэробного порога (Wasserman, McIlroy, 1964). Такой сознательный либо подсознательный перенос эмпирического принципа релятивистской симметрии в область биологии в данном случае оказался неправомерным.
И сегодня, несмотря на то, что множеством экспериментальных работ конкретизирована роль лактата в качестве субстрата окисления и регуляторной субстанции, когда доказано существование факторов и механизмов, обеспечивающих продукцию/накопление лактата и в условиях оптимальной оксигенации тканей, лактат-кислородная догма продолжает успешно доминировать в сознании специалистов (Ferguson, 2018). В силу этого цель данной работы – систематизированное изложение современных представлений о физиологической роли лактата при дисгомеостатирующих воздействиях/высокоинтенсивных физических нагрузках в свете последних достижений биологических наук.
ИСТОРИЯ ОТКРЫТИЯ МОЛОЧНОЙ КИСЛОТЫ И ИЗУЧЕНИЯ ЕЕ БИОЛОГИЧЕСКОЙ РОЛИ
Молочная кислота (α-оксипропионовая кислота) впервые выделена из кислого молока шведским химиком К. Шееле в 1780 г. (Benninga, 1990). И вот уже почти четверть тысячелетия, пребывая если не в фокусе внимания, то в поле зрения исследователей, это химическое соединение продолжает оставаться загадочным интермедиатом, биологическая роль которого все еще в значительной степени непонятна.
В течение периода начального накопления экспериментальных фактов (1780–1907 гг.) о роли молочной кислоты в организме животных и человека был сформирован научно-методический базис будущих исследований в данной области. Однако даже контуры проблемы биологии лактата были не обрисованы. В этот период установлена химическая структура молочной кислоты; определена ее продукция в организме животных и в микроорганизмах; выявлено, что образование кислоты возрастает в условиях гипоксии за счет распада гликогена; доказано, что молочная кислота всегда присутствует в тканях умерших пациентов (von Liebig, 1847; Du Bois-Reymond, 1859; Wislicenus, 1873a,b; Araki, 1891a,b, 1892; von Muralt, 1950; Kompanje et al., 2007; Ghaffar et al., 2014; Ferguson, 2018; Brooks, 2018).
Второй, относительно короткий, период (1907–1926 гг.) дальнейшего становления представлений о биологической роли молочной кислоты – этап, который ассоциирован с вопросами биохимии мышечного сокращения. Ключевыми событиями на данном отрезке можно считать:
– обнаружение феномена продукции молочной кислоты в сокращающейся мышце (Fletcher, 1907);
– выявление анаэробного превращения гликогена (глюкозы) в процессе мышечного сокращения в молочную кислоту с последующим ее окислением до СО2 и Н2О или восстановлением до глюкозы, формулирование “модели кислородного долга” (Hill, 1924a,b,c);
– открытие тесной взаимосвязи между поглощением кислорода и метаболизмом молочной кислоты в мышце (Meyerhof, 1920a,b,c, 1921; Hill, Meyerhof, 1923);
– установление факта, что молочная кислота – причина метаболического ацидоза (Barr et al., 1923; Barr, Himwich, 1923a,b; Clausen, 1925).
Следующие шестьдесят лет (1925–1985 гг.) – период господства представлений о том, что молочная кислота – тупиковый, даже токсичный продукт анаэробного метаболизма глюкозы. Важнейшие достижения данного этапа изучения обмена углеводов, биологии молочной кислоты:
– открытие цикла молочной кислоты – цикла Кори (G.T. Cori, C.F. Cori – лауреаты Нобелевской премии 1947 г.) – метаболического пути, по которому лактат, вырабатываемый при анаэробном гликолизе в мышцах, транспортируется в печень, где превращается в глюкозу, которая затем возвращается в мышцы и циклически метаболизируется обратно в лактат (Cori C.F., Cori G.T., 1929; Cori G.T., Cori C.F., 1933; Houssay, 1956; Simoni et al., 2002);
– дальнейшее подтверждение концепции кислородного долга (Hill, 1932), которая стала общепринятой теорией, призванной объяснить такие феномены физиологии мышечных сокращений как лактатемия при длительных интенсивных мышечных нагрузках и утомление мышц (Margaria, 1933);
– получение экспериментальных доказательств того, что АТФ – источник энергии для мышечных сокращений, что мышечные сокращения связаны с гидролизом АТФ под влиянием миозина (Engelhardt, Ljubimova, 1939; Szent-Györgyi, 1949, 1963; Huxley, 1957, 1969; Huxley, Simmons, 1971);
– выявление тесной корреляционной связи между содержанием гликогена в мышцах и выносливостью при физической нагрузке (Bergström et al., 1967; Hermansen et al., 1967);
– обоснование (Wasserman, McIlroy, 1964) концепции анаэробного порога, под которым предложено понимать уровень потребления кислорода, выше которого аэробный синтез АТФ дополняется анаэробной продукцией макроэргов. Согласно предложенной концепции, повышение уровня молочной кислоты, снижение физической выносливости при интенсивной мышечной нагрузке – следствие кислород-зависимого ограничения окислительного фосфорилирования в митохондриях (Wasserman et al., 1973; Wasserman, 1984).
Последние тридцать пять лет – период формирования представлений о роли лактата в реализации стресс-реакции. В течение нескольких десятилетий после опубликования работ супругов Кори усилия исследователей были направлены на поиск доказательств того, что лактат представляет собой причину мышечной усталости (Philp et al., 2005). И только в 1980-е гг. стали появляться сомнения относительно того, что лактат — это конечный продукт метаболизма, то есть метаболический отход (Brooks, 1985; Connett et al., 1986). Выяснилось, что стимулирование процесса гликолиза может происходить совершенно независимо от значений рО2 в клетках (Kemper et al., 2001). Стало очевидным, что лактат – неотъемлемая часть энергопродукции, а не тупиковый метаболический продукт.
Важным событием в изучении биологии молочной кислоты было установление того факта, что клиренс лактата во время и после субмаксимальной мышечной нагрузки зависит, главным образом, от окисления (метаболический клиренс) и его переноса из мышечной ткани в кровь (Donovan, Brooks, 1983; Mazzeo et al., 1986; MacRae et al., 1992). До относительно недавнего времени считали, что лактат выходит из клеток посредством простой диффузии. Вместе с тем, высказано предположение и о существовании лактатного челнока (Brooks, 1986a). Было установлено, что перенос лактата из клеток и в клетки сопряжен с белками монокарбоксилатного транспорта – MCTs-переносчиками (monocarboxylate transporters) лактата, пирувата, кетоновых тел (McCullagh et al., 1996; Wilson et al., 1998; Halestrap, Price, 1999; Halestrap, Meredith, 2004).
Лактатные челноки обеспечивают транспорт монокарбоксилатов не только через плазматическую мембрану клеток, но и через мембраны внутриклеточных органелл:
– пируват активно проникает в пероксисомы, где под влиянием пероксисомальной лактатдегидрогеназы трансформируется в лактат, что сопровождается окислением NADH до NAD+, необходимого для пероксисомального β-окисления длинноцепочечных жирных кислот (Baumgart et al., 1996; McClelland et al., 2003);
– митохондриальный переносчик лактата (Hashimoto, Brooks, 2008) и митохондриальная лактатдегидрогеназа обеспечивают рН- и редокс-гомеостатирование внутриклеточной среды и перенос восстановительных эквивалентов в виде NADH из цитозоля на комплекс I дыхательной цепи митохондрий (рис. 1) (Valenti et al., 2002; Hashimoto et al., 2006; Lemire et al., 2008; Young et al., 2020).
Рис. 1.
Лактатдегидрогеназа обеспечивает трансфер восстановительных эквивалентов в виде NADH на комплекс I митохондрий (адаптировано по: Young et al., 2020). АТФ – аденозинтрифосфат; АДФ – аденозиндифосфат; V – АТФ-синтаза; Pi – фосфат неорганический; Н+ – протон; е– – электрон; NADH – никотинамидадениндинуклеотид восстановленный; NAD+ – никотинамидадениндинуклеотид окисленный; MCT1 – монокарбоксилатный переносчик 1; MCT2 – монокарбоксилатный переносчик 2; MPC1 – митохондриальный переносчик пирувата 1; MPC2 – митохондриальный переносчик пирувата 2; ЛДГ – лактатдегидрогеназа; ПДГ – пируватдегидрогеназа. Здесь и на рис. 2 и 3.

Систематизация существующих к середине 1980-х гг. знаний о быстром накоплении молочной кислоты в клетках и быстром транспорте лактата через плазматическую мембрану во внеклеточное пространство и далее через сосудистую сеть из области с высокой гликолитической активностью в области с высоким уровнем энергопотребления (миокард, ткань ЦНС, скелетная мускулатура) позволила сформировать концепцию лактатного челнока (Brooks, 1985, 1986a,b). Эта цепь обменных процессов, по-видимому, представляет собой важную адаптивную реакцию при стресс-индуцирующих воздействиях. Положения концепции лактатного челнока привлекли внимание специалистов к системным эффектам лактата. Постулировано (Brooks, 2002) представление о роли лактата в качестве метаболического сигнала на уровне всего организма. Предположительно, лактат может действовать как псевдогормон (лактормон) (Brooks, 2002, 2009).
Многие клетки млекопитающих экспрессируют G-белок-сопряженный рецептор GPR81 (G protein-coupled receptor 81 = HCA1 – hydroxycarboxylic acid receptor 1) (Liu et al., 2009; Rooney, Trayhurn, 2011; Lauritzen et al., 2014). Лиганд рецептора GPR81 был неизвестен до 2008 г., когда выяснили, что в качестве высокоспецифичного агониста данного сенсора в диапазоне концентраций 1–20 мМ выступает L-лактат (Cai et al., 2008; Ahmed, 2011; Davenport et al., 2013). Кроме того, лактат проявил свойства положительного модулятора функционального состояния NMDA-рецепторов клеток ЦНС, обеспечивая нейропротекцию и консолидацию памяти (Jourdain et al., 2018).
Лактат как метаболит, участвующий в реализации стресс-реакции, рецептор-опосредованными и рецептор-независимыми путями синхронизирует функционально-метаболический статус клеток с транскрипцией генов:
– ингибируя активность гистондеацетилаз (Latham et al., 2012), лактилируя гистоны (Zhang et al., 2019; Liberti, Locasale, 2020), стимулируя активность некоторых факторов транскрипции (HIF1α, E2F1, Nrf2, TGF-β2) (Takahashi et al., 2019; Tauffenberger et al., 2019; San-Millán et al., 2020), лактат только в ЦНС влияет на экспрессию около 400 генов, обеспечивая синаптическую пластичность и нейропротекцию (Morland et al., 2015; Margineanu et al., 2018; De Castro Abrantes et al., 2019);
– стимулируя эпителиально-мезенхимальную трансдифференциацию (Liu et al., 2016; Miranda-Gonçalves et al., 2020), митохондриальный биогенез, ангиогенез и синтез коллагена, лактат обеспечивает эффективное заживление раневых повреждений (Ghani et al., 2004; Hashimoto et al., 2007; Hunt et al., 2007; Porporato et al., 2012; Tsukamoto et al., 2018; Ohno et al., 2019);
– стимулирует репарацию ДНК (Wagner et al., 2015, 2017) и, по-видимому, защищает ее от повреждений (De Carvalho Cunha et al., 2018);
– модулирует иммунный статус организма (Jiang, 2017; Wong et al., 2019), проявляет противовоспалительные эффекты (Hoque et al., 2014; Ratter et al., 2018; Santos et al., 2019), эффективно нейтрализует супероксидные и гидроксильные радикалы (Groussard et al., 2000), способствует купированию стресса эндоплазматического ретикулума (Tauffenberger et al., 2019), подавляет процесс аутофагии (Matsuo et al., 2019), что обеспечивает цитопротективный эффект.
АЭРОБНЫЙ ГЛИКОЛИЗ
На протяжении многих лет в качестве лидирующего патогенетического механизма формирования лактат-ацидоза рассматривали именно гипоксию, что нашло отражение во множестве публикаций (Cohen, Woods, 1976; Cahill, 1977). Но общепринятая концепция патогенеза гиперлактатемии при критических состояниях не позволяла получить ответы на целый ряд вопросов (Halmagyi et al., 1967, 1971; Liddell et al., 1979; McCarter et al., 2001; Levy et al., 2007; Wutrich et al., 2010):
– почему адреналин стимулирует продукцию лактата?
– почему уровень лактата в биосредах прямо коррелирует с концентрацией катехоламинов в плазме крови?
– почему блокада адренергических рецепторов в значительной степени предотвращает накопление лактата в биосредах организма при шоковых состояниях?
– почему лактат улучшает сократительную функцию миокарда при шоковых состояниях?
На моделях угрожающих жизни состояний убедительно показано, что тканевая гипоперфузия и гипоксия не представляют собой основную патофизиологическую причину гиперлактатемии (Regueira et al., 2012). Поэтому в 2013 г. было предложено (Marik, Bellomo, 2013a) рассматривать стимулирование аэробного гликолиза при стресс-индуцирующих/критических состояниях как часть стресс-индуцированной адаптивной реакции, когда возрастание продукции лактата об-условлено стимуляцией активности Na+/K+-АТФаз за счет выброса катехоламинов, а не дефицитом кислорода в тканях.
Новая парадигма понимания физиологической сущности аэробного гликолиза при стресс-индуцирующих воздействиях (рис. 2) основана на многочисленных убедительных данных о том, что:
Рис. 2.
Стресс-индуцированная продукция пирувата (лактата). β2-АР – β2-адренорецептор; КА – катехоламин; АЦ – аденилатциклаза; цАМФ – циклический аденозинмонофосфат.
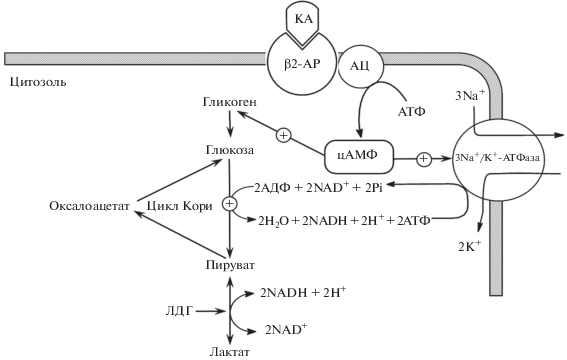
– катехоламины посредством активирования β2-адренорецепторов (β2-АР) увеличивают уровень цАМФ в цитозоле клеток, что обусловливает стимулирование гликогенолиза, гликолиза и активности Na+/K+-АТФаз (James et al., 1999b; McCarter et al., 2002; Levy et al., 2008; Bers, Despa, 2009);
– образующийся в процессе функционирования Na+/K+-АТФазы АДФ посредством стимулирования активности фосфофруктокиназы (скорость-лимитирующий энзим гликолиза) увеличивает интенсивность гликолиза, то есть стимулирует образование пирувата (лактата) (Goldhammer, Paradies, 1979; Evans et al., 1981; Jenkins et al., 2011);
– активно функционирующая Na+/K+-АТФаза стимулирует продукцию лактата и в условиях оптимальной оксигенации тканей (James et al., 1996, 1999a; Levy et al., 2005, 2008).
Таким образом, многие ткани, включая скелетную мускулатуру, могут продуцировать большие объемы лактата и в условиях оптимальной оксигенации, если активность Na+/K+-АТФаз стимулирована воздействием катехоламинов (адреналин, норадреналин) (McCarter et al., 2001, 2002; Levy et al., 2008; Qvisth et al., 2008). Эффект катехоламинов относительно стимуляции аэробного гликолиза обусловлен их взаимодействием с β2‑АР (Levy et al., 2008; Qvisth et al., 2008).
Роль β2‑агонистов (в особенности короткодействующих: сальбутамола, тербуталина, левалбутеринола, пирбутерола и др.) не только в купировании бронхообструкции, но и в воспроизведении гликолитических эффектов катехоламинов с последующей глюкоземией (Beta-2 adrenergic agonists, 2017; Hsu, Bajaj, 2021), многократно доказана в спортивной медицине (Davis, 1985; Allen et al., 2019).
Стрессовая гипергликемия и резистентность к инсулину – эволюционно древняя адаптивная реакция, направленная на обеспечение энергопотребностей и функциональной активности инсулиннезависимых тканей (нервная ткань, эпителий кишечника и др.) (Shepherd, Kahn, 1999; Barreto, Volpato, 2006; Soeters, Soeters, 2012; Marik, Bellomo, 2013b). О биологической значимости метаболического перепрограммирования свидетельствует то, что эффекты катехоламинов дублируются (воспроизводятся) остеокальцином. Остеокальцин – гормон, продуцируемый остеобластами в процессе остеосинтеза, который регулирует связывание ионов кальция и образование гидроксиапатита (Zoch et al., 2016). Кроме того, остеокальцин участвует в регулировании метаболизма глюкозы (Tangseefa et al., 2018) и действует как стресс-гормон:
– опосредует немедленную реакцию на стресс даже в условиях надпочечниковой недостаточности (Berger et al., 2019);
– рецептор-зависимым путем (рецептор GPRC6A) супрессирует β-окисление жирных кислот, модулирует процессы гликогенеза и гликогенолиза, то есть переключает энергопродукцию на преимущественное окисление углеводов (Pi et al., 2020);
– способствует адаптации к физической нагрузке – увеличивает физическую работоспособность (Mera et al., 2016).
ЛАКТАТ: ПРИЧИНА, СЛЕДСТВИЕ ИЛИ МЕТАБОЛИТ-ПРОТЕКТОР МЫШЕЧНОЙ УСТАЛОСТИ?
Классическая теория мышечной усталости, вызванной физическими упражнениями, предполагает ее ассоциированность с метаболическими изменениями – снижением показателя рН, накоплением неорганического фосфата (Pi) при неадекватном снабжении мышц кислородом (Mitchell, Blomqvist, 1971; Bassett, Howley, 2000). Известно, что мышечная активность поддерживается за счет расходования макроэргов. Три основные АТФазы обеспечивают выполнение мышечной работы: 1) Na+/K+‑АТФаза восстанавливает ионные градиенты на плазматической мембране мышечных клеток, 2) миозиновая АТФаза обеспечивает сокращение актин-миозиновых комплексов, 3) Са2+-АТФаза осуществляет транспорт Са2+ из цитоплазмы мышечных клеток в цистерны саркоплазматического ретикулума, что обеспечивает расслабление мышц. Для обеспечения активности этих ферментов в процессе мышечного сокращения из общего бюджета используемых макроэргов потребляется 10, 60 и 30% соответственно (Homsher, 1987).
При мышечных сокращениях активируются АТФазы и гликолиз, что сопровождается накоплением внутриклеточных метаболитов: Н+, пирувата, Pi. Если объем гликолитической продукции пирувата превышает объем утилизации (окисления) метаболита в митохондриях, его избыток трансформируется в молочную кислоту. При физиологических значениях рН молочная кислота в биологических жидкостях почти полностью (99%) диссоциирует на лактат-анион (La–) и протон (Н+) (Gladden, 2004). Накопление Н+ приводит к уменьшению величины внутриклеточного рН с 7.3 до 6.9–6.4 единиц, несмотря на действие буферных систем. Считалось, что при достижении внутриклеточным рН величины 6.4 транспорт глюкозы и интенсивность гликолитических реакций замедляются, выделение Са2+ из цистерн саркоплазматического ретикулума и чувствительность тропонина С к ионам кальция снижаются (Delcher, Shipp, 1966; Ui, 1966; Kaminskas, 1978; Metzger, Moss, 1990), что потенциально может привести к нарушению мышечных сокращений. Однако роль снижения величины рН в суммарном формировании мышечной усталости не нашла экспериментального подтверждения и в настоящее время аргументированно оспорена – ацидификация цитоплазмы мышечных волокон оказывает лишь минимальное влияние на сократительную способность скелетных мышц млекопитающих (Pate et al., 1995; Stackhouse et al., 2001). В частности, установлено, что основным источником протонов при сокращении мышечных волокон выступает реакция гидролиза АТФ (Zilva, 1978; Madias, 1986; Robergs et al., 2004):
Мышечная активность в условиях энергодефицита сопряжена с накоплением Pi (фосфат-анион), выделяющегося во внутриклеточную среду при гидролизе креатинфосфата и АТФ. При формировании мышечной усталости уровень Pi в цитоплазме мышечных волокон может быстро возрастать от 5 до 30 мМ (Allen, Trajanovska, 2012). Pi ингибирует высвобождение Са2+ из цистерн саркоплазматического ретикулума, нарушая тем самым сократительную функцию мышц (Sundberg, Fitts, 2019), что синергично усиливается повышенными концентрациями Н+ (Nelson et al., 2014). Обращает внимание и то, что Pi в биологических средах при физиологических значениях величины рН существует в форме ${\text{HPO}}_{4}^{{2 - }}$ и при закислении среды (накоплении Н+) может функционировать в качестве буфера, поскольку величина логарифма константы протонирования в этом случае составляет 6.82 (Robergs et al., 2004):
Концентрация лактата в плазме крови при истощающих физических нагрузках коррелирует с развитием мышечной усталости. Однако продукцию лактата при дефиците макроэргических фосфатов (АТФ) считают следствием, а не причиной состояний, которые вызывают ацидоз (Robergs, 2001). Более того, лактат-анион обеспечивает защиту от мышечной усталости, противодействуя угнетающему влиянию повышенных уровней внеклеточного К+ на возбудимость мышечных волокон и силу мышечных сокращений (Nielsen et al., 2001; Pedersen et al., 2003; De Paoli et al., 2007). Поэтому введение бикарбоната натрия пациентам при выраженной лактатемии сопряжено с более высокой смертностью (Kim et al., 2013). Международным руководством при сепсисе бикарбонатная терапия при лечении пациентов не рекомендована, если рН крови ≥7.15, при этом оставлены без рекомендаций случаи более выраженного лактат-ацидоза (Rhodes et al., 2017).
При длительной мышечной активности снижение уровня К+ в саркоплазме мышечных волокон (в 1.3–7 раз) и возрастание концентрации К+ в интерстициальной жидкости (до 2 раз) при 1.5–2-кратном возрастании уровня Na+ в цитоплазме мышечных клеток приводит к подавлению возбудимости и сократимости мышечных волокон, то есть к мышечной усталости. Повышение активности Na+/K+-АТФазы плазматической мембраны миоцитов во время интенсивной мышечной нагрузки стабилизирует трансмембранные градиенты концентрации ионов и увеличивает возбудимость сарколеммы мышечных волокон, тем самым защищая от наступления мышечной слабости (McKenna et al., 2008).
Ингибирующий эффект повышенных концентраций внеклеточного К+ на активность Na+/K+-АТФазы преодолевается аддитивным действием лактата и катехоламинов (Nielsen et al., 2001; Pedersen et al., 2003; De Paoli et al., 2007). Стимуляция β2‑АР приводит к активированию протеинкиназ А и С (Han et al., 2006; Bibert et al., 2008; Despa et al., 2008) с последующим фосфорилированием фосфолеммана (малый саркоплазматический протеин, ассоциированный с Na+/K+-АТФазой, модулирующий активность данного ионного обменника), что проявляется стимулированием активности Na+/K+-АТФазы, но ингибированием Na+/Ca2+‑обмена (Bers, Despa, 2009; Cheung et al., 2010, 2013).
Гиперлактатемия при критических состояниях обусловлена не только избыточной продукцией лактата, а, главным образом, подавлением утилизации молочной кислоты (Levraut et al., 1998). Угрожающие жизни состояния, длительная мышечная активность высокой интенсивности – стресс-индуцирующие воздействия, сопровождающиеся резким и значительным (многократным) увеличением уровня адреналина и более мощным – норадреналина в крови (Galbo et al., 1975; Horton et al., 1985; Zouhal et al., 2008; Soria et al., 2014). Катехоламины при интенсивной мышечной активности обеспечивают перераспределение кровотока в интересах работающих мышц, гомеостатирование давления крови (Thomas, Segal, 2004; Holwerda et al., 2015) и выступают в качестве основного регулятора метаболизма глюкозы (Marliss, Vranic, 2002). Биогенные амины (адреналин и норадреналин) стимулируют активность Na+/K+-АТФаз плазматической мембраны мышечных волокон, что индуцирует аэробный гликолиз и, следовательно, увеличивает продукцию лактата в мышцах (James et al., 1999а; McCarter et al., 2002; Levy et al., 2008; Sepp et al., 2014). Лактат в качестве приоритетного энергетического субстрата далее утилизируется в митохондриях при участии пируватдегидрогеназного комплекса (табл. 1, рис. 3).
Таблица 1.
Состав пируватдегидрогеназного ферментного комплекса
| Фермент | Символ | Число мономеров (олигомеров) |
Кофермент | Прекурсор |
|---|---|---|---|---|
| Пируватдекарбоксилаза (КФ 1.2.4.1) |
Е1 | 120 (30 тетрамеров) |
Тиамин-пирофосфат (ТПФ) | Витамин В1 |
| Дигидролипоилтрансацетилаза (КФ 2.3.1.12) |
Е2 | 180 (60 тримеров) |
Липоамид | Липоевая кислота (ЛК) |
| СоА | Пантотеновая кислота | |||
| Дигидролипоилдегидрогеназа (КФ 1.8.1.4) |
Е3 | 12 (6 димеров) |
FAD, NAD+ | Витамины В2, PP |
Рис. 3.
Пируватдегидрогеназный комплекс (адаптировано по: Milne et al., 2002; Vijayakrishnan et al., 2011; Patel et al., 2014). ТПФ – тиаминпирофосфат; ЛК – липоевая кислота; FADH2 – флавинадениндинуклеотид восстановленный, FAD – флавинадениндинуклеотид окисленный; СоА – коэнзим А. I – Е1 катализирует декарбоксилирование пирувата и перенос 2(С)-фрагмента на ТПФ; II – Е2 катализирует окисление гидроксиэтильной группы и перенос 2(С)-фрагмента на ЛК; III – ацетилированная дигидролипоилтрансфераза взаимодействует с СоА с образованием восстановленной формы ЛК и ацетид-СоА; IV – восстановленная форма трансацетилазы окисляется при участии Е3; V – восстановленная форма Е3 окисляется при взаимодействии с NAD+.

Пируватдегидрогеназный комплекс (ПДК), представляющий собой структурно-функциональное объединение энзимов массой более ×106 Да, катализирует окислительное декарбоксилирование пирувата с образованием ацетил-СоА, NADH и СО2, таким образом соединяя анаэробную и аэробную продукцию макроэргов. В условиях хронического стресса и при длительных интенсивных мышечных нагрузках активность ПДК может подавляться под влиянием прооксидантов (гидроксильный радикал, пероксинитрит) (Churchill et al., 2005; Martin et al., 2005), что сопровождается нарушением утилизации пирувата, то есть нарушением энергопродукции (Vary et al., 1986; Nirupama et al., 2012; Gudiksen et al., 2016).
Активность ПДК контролируется посредством фосфорилирования/дефосфорилирования пируватдекарбоксилазы (Е1) ПДГ‑киназами/ПДГ-фосфатазами (Sheeran et al., 2019). Ионы магния как кофакторы и регуляторы активности ферментов играют важную роль в физиологии клеток организма человека, в том числе в процессах митохондриального окислительного фосфорилирования, и способствуют поддержанию функциональной активности мышц (Bohl, Volpe, 2002; Pilchova et al., 2017; Zhang et al., 2017). Эффекты стресс-гормонов (катехоламинов), уровень которых коррелирует с интенсивностью мышечной активности, ассоциированы с гипермагнезиурией и, следовательно, с падением уровня ионов магния в биосредах организма (Тарасов и др., 2015; Joborn et al., 1985; Whyte et al., 1987; Cordova et al., 1992). Катионы магния активируют ПДК посредством стимулирования активности фосфатазы пируватдекарбоксилазы, в качестве кофактора (MgАТФ2–) стимулируют ферменты гликолиза (гексокиназа, фосфофруктокиназа, фосфоглицераткиназа, пируваткиназа) и нормализуют активность Na+/K+-АТФаз, что приводит к ускорению утилизации лактата, увеличению энергопродукции, восстановлению возбудимости и сократимости мышечных волокон (Caddell, 2001; Huang, Kuo, 2007; Pilchova et al., 2017). Если потребление Mg2+ менее 260 мг/день у физически активных мужчин и менее 220 мг/день у женщин, то может сформироваться магний-дефицитный статус. В условиях интенсивных физических нагрузок суточная потребность в магнии увеличивается на 10–20% (Nielsen, Lukaski, 2006). Поэтому назначение препаратов магния при истощающей мышечной активности повышает работоспособность и выносливость (Chen et al., 2014; Veronese et al., 2014; Kass, Poeira, 2015; Zhang et al., 2017).
Активность ПДК в значительной степени зависит и от обеспеченности кофакторами: тиаминдифосфатом и липоевой кислотой. При интенсивных физических и нервно-эмоциональных нагрузках в организме человека быстро возникает недостаток тиамина – витамина В1 (Рахманов и др., 2016; Andersen et al., 2015). Выраженная склонность организма человека к формированию тиамин-дефицита, по-видимому, связана с низкой концентрацией тиамина в циркулирующей крови, с отсутствием депо тиаминдифосфата в тканях (Gangolf et al., 2010) и с возрастанием скорости инактивации данного витамина при стимулировании митохондриальной энергопродукции (Nijakowski, 1966; Manore, 2000).
При угрожающих жизни состояниях уровень тиамина в плазме крови отрицательно коррелирует с возрастанием концентрации лактата и положительно – с активностью пируватдегидрогеназы (Donnino et al., 2010; Costa et al., 2013; Attaluri et al., 2018). Вместе с тем, при дефиците тиамина снижается не только пируватдегидрогеназная активность, но и уменьшается количество энзимов, входящих в состав ферментного комплекса (Andersen et al., 2015), по-видимому, вследствие ускоренной протеолитической деградации его лишенных кофактора компонентов (Li et al., 2004) и подавления их экспрессии (Pekovich et al., 1998). Назначение витамина В1 при тиамин-дефицитных состояниях стимулирует аэробный метаболизм, предупреждает избыточное накопление лактата (Manzanares, Hardy, 2011; Giacalone et al., 2015; Lerner et al., 2017; Attaluri et al., 2018), а высокие дозы тиамина (100 мг/день) замедляют наступление усталости при интенсивных физических нагрузках, ускоряют восстановление после наступления усталости (Suzuki, Itokawa, 1996; Choi et al., 2013; Masuda et al., 2015). Следует заметить, что тиамин-дефицит может проявляться не только слабостью скелетной мускулатуры, но и симптомами систолической дисфункции (Ahmed et al., 2015).
Кроме тиамина, важным регулятором активности пируватдекарбоксилазы ПДК считают экзогенную R‑липоевую кислоту, оказывающую ингибирующее влияние на активность киназы пируватдегидрогеназы (Korotchkina et al., 2004).
В качестве дополнительного ростового фактора бактерий липоевая кислота описана еще в 1937 г. (Snell et al., 1937) и уже в 1951 г. выделена в чистом виде как кофактор ПДК (Reed et al., 1951). В структуре липоевой (тиоктовой, 6,8-дитиоктовой) кислоты содержится две SH-группы (тио-группы), которые могут быть либо в окисленном, либо в восстановленном состоянии:
Ее восстановленная форма известна как дигидролипоевая кислота, а окисленная – как α-липоевая кислота (Kramer, Packer, 2001). В структуре тиоктовой кислоты локализован один хиральный (асимметричный) атом углерода С(6) и поэтому она может существовать в виде пары энантиомеров (оптических изомеров), то есть в форме R- и L-изомеров. Биологически активна только R-липоевая кислота (Reed, 1998; Uchida et al., 2015). Восстановленная тиоктовая кислота обладает весьма высоким восстановительным потенциалом, равным –0.32 В (Smith et al., 2004), существенно превосходящим величины редокс-потенциала восстановленного глутатиона и восстановленной аскорбиновой кислоты (–0.24 и –0.28 В соответственно) (Packer et al., 1995; Padmalayam, 2012).
Из желудочно-кишечного тракта человека поступает не более 30–40% от общего количества липоевой кислоты (Teichert et al., 2003; Hermann et al., 2014). Не отличаясь тропностью к митохондриям, она распределяется в цитозоле клеток, и лишь малая часть экзогенной тиоктовой кислоты проникает в митохондрии (Brown et al., 2007; Ripcke et al., 2009). Обладая высоким восстановительным потенциалом, дигидролипоевая кислота способна напрямую без участия каких-либо ферментов гасить активные радикалы/метаболиты кислорода и азота, восстанавливать окисленные формы глутатиона, α-токоферола, витамина С и коэнзима Q10 (Kozlov et al., 1999; Jones et al., 2002; Smith et al., 2004). Антиоксидантное действие липоевой кислоты ассоциировано и с ее способностью хелатировать ионы металлов переменной валентности, предотвращая таким образом их участие в генерировании активных радикалов кислорода (Suh et al., 2005; Ali et al., 2015; Camiolo et al., 2019). Но значимость экзогенной липоевой кислоты как антиоксиданта, по-видимому, ограничена тем, что в тканях уровень свободной тиоктовой кислоты на порядок ниже, чем других антиоксидантов, и она быстро утилизируется в реакциях липоилирования свободных радикалов.
Тем не менее, липоевая кислота весьма благоприятно влияет на клинико-биохимические проявления угрожающих жизни состояний (Li et al., 2014; Ali et al., 2016; Petronilho et al., 2016). Тиоктовая кислота, практически не проникая внутрь митохондрий (Reed, 1957; Lodge, Packer, 1999), способствует купированию митохондриальной дисфункции (Barbiroli et al., 1995; Liu, 2008; Nicolson, 2014).
Изначально предполагали, что тиоктовая кислота синтезируется только микроорганизмами и для млекопитающих служит витамин-подобной субстанцией (Goraca et al., 2011). Однако оказалось, что липоевую кислоту синтезируют не только прокариоты, но и митохондрии эукариот из октановой кислоты и S‑аденозилметионина SAM (S-adenosylmethionine) при участии октаноилтрансферазы и синтазы липоевой кислоты LASY (lipoic acid synthase), которая катализирует замену двух атомов водорода в положении С(6) и С(8) на две тио-группы (SH-группы) из состава двух молекул SAM (Jordan, Cronan, 1997; Cronan et al., 2005; Padmalayam et al., 2009; Cronan, 2016).
Синтаза липоевой кислоты млекопитающих экспрессируется в виде проэнзима, на N-концевой части полипептидной цепи которого локализована адресная последовательность из 37 аминокислотных остатков, селективно направляющих профермент в матрикс митохондрий, где адресный локус удаляется и протеин приобретает ферментативную активность (Morikawa, 2001; Cronan, 2016). Липоевая кислота в свободном виде может выделяться в бактериях из состава активного центра энзимов под влиянием липоамидазы (Jiang, Cronan, 2005). Роль липоамидазы в митохондриях эукариот, как выяснилось в последнее время, выполняет NAD-зависимая гистондеацетилаза/АДФ-рибозилтрансфераза SIRT4, инактивирующая ПДК путем удаления кофактора (липоевой кислоты) из активного центра дигидролипоилтрансацетилазы (Mathias et al., 2014, 2016).
Под влиянием стресс-реализующих гормонов и провоспалительных медиаторов возрастает активность α-кетоглутаратдегидрогеназы, сукцинатдегидрогеназы (Zakharchenko et al., 2013), но подавляется активность пируватдегидрогеназы (Vary et al., 1998; Andersen et al., 2015; Nuzzo et al., 2015). И при этом SIRT4, ингибирующий ПДК, оказывает парадоксальное противовоспалительное действие (Tao et al., 2015, 2019).
Почему при максимальной интенсивности митохондриальной энергопродукции SIRT4, выступая в качестве регулятора митохондриального биогенеза, подавляя разобщение окисления и фосфорилирования, снижая β-окисление жирных кислот в митохондриях (Laurent et al., 2013; Ho et al., 2013; Betsinger, Cristea, 2019; Han et al., 2019), ингибирует активность ПДК? Следует обратить внимание на то, что при подавлении активности комплекса IV (цитохром с-оксидаза) митохондриальной электрон-транспортной цепи (низкие значения рО2, воздействие NO•, CN–) (Chandel et al., 1995; Sarti et al., 2003, 2012; Leavesley et al., 2008) и при возрастании соотношения NADH/NAD+ комплекс I дыхательной цепи становится одним из основных источников супероксидного анион-радикала (${\text{O}}_{2}^{{ - \centerdot }}$) в митохондриях (Murphy, 2009). Поэтому биологическая целесообразность ингибирования ПДК и стимулирования активности α‑кетоглутаратдегидрогеназы состоит в ограничении поступления субстрата (NADH) на митохондриальный дыхательный комплекс I (подавление его супероксид-генерирующего эффекта) и в стимулировании сукцинат-зависимой (дыхательный комплекс II, сукцинатдегидрогеназа) энергопродукции. Однако такая адаптивная реакция, по-видимому, может быть благоприятной лишь кратковременно, поскольку в условиях стресс-реакции экспрессия LASY подавлена (Padmalayam et al., 2009), а активность α-кетоглутаратдегидрогеназы быстро ингибируется прооксидантами (Tretter, Adam-Vizi, 2005; McLain et al., 2011).
При угрожающих жизни состояниях, при истощающих физических нагрузках, то есть в условиях длительного метаболического стресса, SIRT4-зависимое ингибирование пируватдегидрогеназной активности митохондрий становится, по сути дела, необратимым вследствие отсутствия возможности синтеза de novo липоевой кислоты как кофактора дигидролипоилтрансацетилазы (Е2) ПДК. В этой ситуации при угрожающих жизни состояниях назначение липоевой кислоты эффективно предотвращает/купирует митохондриальную дисфункцию (Vanasco et al., 2008; Nicolson, 2014; Petronilho et al., 2016). Таким образом, значимым элементом фармакологической стратегии профилактики/купирования митохондриальной дисфункции при длительных стресс-индуцирующих воздействиях (истощающих мышечных нагрузках) может быть использование фармакологических средств (липоевая кислота), стимулирующих экспрессию LASY (Padmalayam, 2012; Padmalayam et al., 2012).
Биологическая целесообразность стресс-индуцированных реакций организма зависит от их направленности на сохранение и оптимизацию энергопродукции в жизненно важных органах и тканях (Nesse et al., 2016). Наиболее выражены эти реакции при тяжелых формах гипоксии, кровопотере и сепсисе (Hart et al., 1989), когда уровни адреналина и норадреналина в плазме крови пациентов могут увеличиваться в 50 и 10 раз соответственно (Chernow et al., 1982). Такая динамика уровней катехоламинов сопровождается метаболическим перепрограммированием организма, проявляющимся:
– гипергликемией (McCowen et al., 2001; Dungan et al., 2009; Bar-Or et al., 2019);
– гиперлактатемией (Garcia-Alvarez et al., 2014; Kaukonen et al., 2014; Brooks, 2020);
– лактат-зависимым, рецептор-опосредованным (GPR81) ингибированием липолиза в жировых клетках и соответствующим снижением уровня свободных жирных кислот в плазме крови (Cai et al., 2008; Ge et al., 2008; Liu, 2008; Ahmed et al., 2010; Bergersen, 2015);
– пируват-зависимым увеличением в матриксе митохондрий уровней малонил-СоА и ацетил-СоА, ингибирующих соответственно транспорт в митохондрии жирных кислот (в виде ацил-СоА) (McGarry et al., 1977; Saddik et al., 1993) и активность β-кетотиолазы – скорость-лимитирующего энзима β-окисления жирных кислот (Brooks, 2020).
Представленные данные со всей очевидностью свидетельствуют о том, что в условиях острого стресса метаболические процессы в организме перепрограммируются на преимущественное окисление глюкозы. Об этом, в частности, свидетельствует динамика величины дыхательного коэффициента, который под влиянием стресс-индуцирующих факторов может возрастать до предельных величин (McGregor et al., 1994; Patkova et al., 2018; Griffiths et al., 2019). И именно углеводы обеспечивают выносливость во время длительной мышечной активности (Hawley, Leckey, 2015).
Дыхательный коэффициент – это отношение объема диоксида углерода, выделившегося при дыхании, к объему кислорода, потребленного в процессе дыхания. Величина дыхательного коэффициента при окислении жиров и углеводов составляет 0.7 и 1.0 соответственно (Prentice et al., 2013). Но каким преимуществом, с точки зрения оптимизации энергопродукции, отличается утилизация углеводов от β‑окисления жирных кислот? Почему организму в условиях стресса, когда лимитирующим фактором чаще всего становится кислород, выгоднее переключаться на окисление углеводов?
Для получения ответа на эти вопросы следует обратить внимание на стехиометрию митохондриального окислительного фосфорилирования (Leverve et al., 2007). Стехиометрия синтеза АТФ в отношении потребления О2 выше при окислении углеводов и ниже при β-окислении жирных кислот. На моль АТФ, синтезируемого при окислении липидов, расходуется на 10–13% больше молей кислорода (Hinkle et al., 1991; Brand, 2005; Mookerjee et al., 2017).
Помимо митохондрий, в качестве значимых потребителей кислорода в клетках млекопитающих выступают монооксигеназы эндоплазматического ретикулума и энзимы пероксисом, обеспечивающие гидроксилирование липофильных ксенобиотиков и окисление длинноцепочечных разветвленных жирных кислот соответственно (Gordeziani et al., 2016; Islinger et al., 2018). О масштабе внемитохондриального потребления кислорода можно судить, исходя из того, что при физиологических условиях до 20–30% кислорода, потребляемого печенью, утилизируется в пер-оксисомах и монооксигеназной системой микросом, а выделяемая энергия рассеивается в виде тепла (De Duve, Baudhuin, 1966; Reddy, Mannaerts, 1994; Legakis et al., 2002).
Цитохром с-оксидаза митохондрий обладает высокой степенью сродства к кислороду – Km (константа Михаэлиса) энзима к молекулярному кислороду менее 1 мкМ/л (Krab et al., 2011), тогда как аффинность различных изоформ цитохрома Р450 к молекулярному кислороду значительно ниже – Km = 4–5 мкМ/л (Estabrook et al., 1968; Ullrich et al., 1968). Поэтому в условиях даже умеренной гипоксии монооксигеназная система микросом не может эффективно конкурировать с цитохром с-оксидазой митохондрий за кислород – метаболическая активность многих (большинства) изоформ цитохрома Р450 снижается, то есть в условиях гипоксии потребление кислорода монооксигеназами подавлено (Fradette, Du Souich, 2004; Gong et al., 2017; Zhou et al., 2018).
В отличие от монооксигеназ эндоплазматического ретикулума пероксисомальные оксидазы, по-видимому, способны эффективно конкурировать с цитохром с-оксидазой митохондрий за кислород. Здесь следует обратить внимание на амфетамин. Амфетамин – синтетический психостимулятор и антидепрессант фенэтиламинового ряда – в низких и умеренных дозах увеличивает физическую выносливость людей и животных (Weiss, Laties, 1962; Wyndham et al., 1971; Gerald, 1978). Механизмы реализации эффектов амфетамина (увеличение физической выносливости) остаются неизвестными (Wan et al., 2017). Вместе с тем, описано, что амфетамин замедляет наступление утомления крыс, нивелируя вызванное мышечной активностью повышение температуры тела вследствие увеличения тепловыделения (Morozova et al., 2016). Но эти экспериментальные данные можно интерпретировать и как следствие ингибирования пероксисомального β-окисления длинноцепочечных и разветвленных жирных кислот, когда прекращается потребление кислорода в пероксисомах и рассеивание энергии в виде тепла. Кроме того, амфетамин увеличивает активность Na+/K+-АТФаз (Angel et al., 1985; Zugno et al., 2009). Эти фармакологические эффекты амфетамина вполне удовлетворительно объясняют его способность увеличивать физическую выносливость человека и животных.
ЗАКЛЮЧЕНИЕ
Исторически повышение уровня лактата в биосредах организма, к сожалению, интерпретировали неудачно – как неблагоприятный метаболический фактор. Но пришло время нового понимания биологии лактата – как ключевого фактора метаболического перепрограммирования организма в условиях стресса/интенсивной физической нагрузки. Аэробно/анаэробно продуцируемый лактат выполняет как минимум три функции, представляя собой:
– метаболит, минимизирующий в условиях острого стресса потребление кислорода и оптимизирующий энергопродукцию в процессе митохондриального окислительного фосфорилирования;
– главный глюконеогенный предшественник и интермедиат, обеспечивающий энергопродукцию в клетках ЦНС, миокарда, печени, почек;
– сигнальную субстанцию, обеспечивающую посредством редокс-регуляции, лактилирования и рецептор-опосредованного ингибирования липолиза в жировой ткани β-окисление жирных кислот в митохондриях и пероксисомах, увеличение устойчивости к стресс-индуцирующим воздействиям и ускорение репарации повреждений.
Список литературы
Рахманов Р.С., Пискарев Ю.Г., Блинова Т.В. и др. Оценка витаминно-минеральной обеспеченности организма при физических и нервно-эмоциональных нагрузках // ЗНиСО. 2016. № 4 (277). С. 11–15.
Тарасов Е.А., Блинов Д.В., Зимовина У.В., Сандакова Е.А. Дефицит магния и стресс: вопросы взаимосвязи, тесты для диагностики и подходы к терапии // Терапевт. архив. 2015. Т. 87. № 9. С. 114–122.
Ahmed K. Biological roles and therapeutic potential of hydroxyl-carboxylic acid receptors // Front. Endocrinol. 2011. V. 2. Art. 51.
Ahmed K., Tunaru S., Tang C. et al. An autocrine lactate loop mediates insulin-dependent inhibition of lipolysis through GPR81 // Cell Metab. 2010. V. 11. Iss. 4. P. 311–319.
Ahmed M., Azizi-Namini P., Yan A.T., Keith M. Thiamin deficiency and heart failure: the current knowledge and gaps in literature // Heart Gail. Rev. 2015. V. 20. Iss. 1. P. 1–11.
Ali Y.F., Desouki O.S., Selim N.S., Ereiba K.M. Assessment of the role of α-lipoic acid against the oxidative stress of induced iron overload // J. Radiat. Res. Appl. Sci. 2015. V. 8. Iss. 1. P. 26–35.
Ali R.M., Khairy M.A., Mansour D.Y. Effect of alpha-lipoic acid on acute lung injury and acute kidney injury in major postpartum hemorrhage // Ains Shams J. Anaesthesiol. 2016. V. 9. Iss. 2. P. 219–224.
Allen D.G., Trajanovska S. The multiple roles of phosphate in muscle fatigue // Front. Physiol. 2012. V. 3. Art. 463.
Allen H., Backhouse S.H., Hull J.H., Price O.J. Anti-doping policy, therapeutic use exemption and medication use in athletes with asthma: a narrative review and critical appraisal of current regulations // Sports Med. 2019. V. 49. Iss. 5. P. 659–668.
Andersen L.W., Liu X., Peng T.J. et al. Pyruvate dehydrogenase activity and quantity decreases after coronary artery bypass grafting: a prospective observational study // Shock. 2015. V. 43. Iss. 3. P. 250–254.
Angel I., Hauger R.L., Luu M.D. et al. Glucostatic regulation of (+)-[3H]amphetamine binding in the hypothalamus: correlation with Na+,K+-ATPase activity // PNAS USA. 1985. V. 82. № 18. P. 6320–6324.
Araki T. Ueber die Bildung von Milchsäure und Glycose im Organismus bei Sauerstoffmangel // Z. Physiol. Chem. 1891a. B. 15. S. 335–370.
Araki T. Ueber die Bildung von Milchsäure und Glycose im Organismus bei Sauerstoffmangel. Zweite Mittheilung: Ueber die Wirkung von Morphium, Amylnitrite, Cocain // Z. Physiol. Chem. 1891b. B. 15. S. 546–561.
Araki T. Ueber die Bildung von Milchsäure und Glycose im Organismus bei Sauerstoffmangel. Dritte Mittheilung // Z. Physiol. Chem. 1892. B. 16. S. 453–459.
Attaluri P., Castillo A., Edriss H., Nugent K. Thiamine deficienct: an important consideration in critically ill patients // Am. J. Med. Sci. 2018. V. 356. Iss. 4. P. 382–390.
Barbiroli B., Medori R., Tritschler H.J. et al. Lipoic (thioctic) acid increases brain energy availability and skeletal muscle performance as shown by in vivo 31P-MRS in a patient with mitochondrial cytopathy // J. Neurol. 1995. V. 242. Iss. 7. P. 472–477.
Bar-Or D., Rael L.T., Madayag R.M. et al. Stress hyperglycemia in critically ill patients: insight into possible molecular pathways // Front. Med. 2019. V. 6. Art. 54.
Barr D.P., Himwich H.E., Green R.P. Studies in the physiology of muscular exercise. I. Changes in acid-base equilibrium following short periods of vigorous muscular exercise // J. Biol. Chem. 1923. V. 55. P. 495–523.
Barr D.P., Himwich H.E. Studies in the physiology of muscular exercise. II. Comparison of arterial and venous blood following vigorous exercise // J. Biol. Chem. 1923a. V. 55. P. 525–537.
Barr D.P., Himwich H.E. Studies in the physiology of muscular exercise. III. Development and duration of changes in acid-base equilibrium // J. Biol. Chem. 1923b. V. 55. P. 539–555.
Barreto R.E., Volpato G.L. Stress responses of the fish Nile tilapia subjected to electroshock and social stressors // Braz. J. Med. Biol. Res. 2006. V. 39. № 12. P. 1605–1612.
Bassett D.R., Howley E.T. Limiting factors for maximum oxygen uptake and determinants of endurance performance // Med. Sci. Sports Exerc. 2000. V. 32. Iss. 1. P. 70–84.
Baumgart E., Fahimi H.D., Stich A., Völkl A. L-lactate dehydrogenase A4- and A3B isoforms are bona fide peroxisomal enzymes in rat liver. Evidence for involvement in intraperoxisomal NADH reoxidation // J. Biol. Chem. 1996. V. 271. № 7. P. 3846–3855.
Benninga H. Scheele discovers lactic acid // A history of lactic acid making: a chapter in the history of biotechnology. Dordrecht, Boston, London: Kluwer Academic Publishers, 1990. P. 7–9.
Berger J.M., Singh P., Khrimian L. et al. Mediation of the acute stress response by the skeleton // Cell. Metab. 2019. V. 30. Iss. 5. P. 890–902.
Bergersen L.H. Lactate transport and signaling in the brain: potential therapeutic targets and roles in body–brain interaction // J. Cereb. Blood Flow Metab. 2015. V. 35. Iss. 2. P. 176–185.
Bergström J., Hermansen L., Hultman E., Saltin B. Diet, muscle glycogen and physical performance // Acta Physiol. Scand. 1967. V. 71. Iss. 2–3. P. 140–150.
Bers D.M., Despa S. Na/K-ATPase – an integral player in the adrenergic fight-or-flight response // Tr. Cardiovasc. Med. 2009. V. 19. Iss. 4. P. 111–118.
Beta-2 adrenergic agonists / LiverTox: Clinical and research information on drug‑induced liver injury. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases, 2017. PMID 31643996.
Betsinger C.N., Cristea I.M. Mitochondrial function, metabolic regulation, and human disease viewed through the prism of Sirtuin 4 (SIRT4) functions // J. Proteom. Res. 2019. V. 18. № 5. P. 1929–1938.
Bibert S., Roy S., Schaer D. et al. Phosphorylation of phospholemman (FXYD1) by protein kinase A and C modulates distinct Na,K-ATPase isozymes // J. Biol. Chem. 2008. V. 283. № 1. P. 476–486.
Bohl C.H., Volpe S.L. Magnesium and exercise // Crit. Rev. Food Sci. Nutr. 2002. V. 42. Iss. 6. P. 533–563.
Bou Chebl R., El Khuri C., Shami A. et al. Serum lactate is an independent predictor of hospital mortality in critically ill patients in the emergency department: a retrospective study // Scand. J. Trauma Resusc. Emerg. Med. 2017. V. 25. № 1. Art. 69.
Brand M.D. The efficiency and plasticity of mitochondrial energy transduction // Biochem. Soc. Trans. 2005. V. 33. Pt. 5. P. 897–904.
Brooks G.A. Anaerobic threshold: review of the concept and directions for future research // Med. Sci. Sports Exerc. 1985. V. 17. Iss. 1. P. 22–31.
Brooks G.A. The lactate shuttle during exercise and recovery // Med. Sci. Sports Exerc. 1986a. V. 18. Iss. 3. P. 360–368.
Brooks G.A. Lactate production under fully aerobic conditions: the lactate shuttle during rest and exercise // Fed. Proc. 1986b. V. 45. № 13. P. 2924–2929.
Brooks G.A. Lactate shuttles in nature // Biochem. Soc. Trans. 2002. V. 30. Iss. 2. P. 258–264.
Brooks G.A. Cell–cell and intracellular lactate shuttles // J. Physiol. 2009. V. 587. Iss. 23. P. 5591–5600.
Brooks G.A. The science and translation of lactate shuttle theory // Cell Metab. 2018. V. 27. Iss. 4. P. 757–785.
Brooks G.A. Lactate as a fulcrum of metabolism // Redox Biol. 2020. V. 35. Art. 101454.
Brown S.E., Ross M.F., Sanjuan-Pla A. et al. Targeting lipoic acid to mitochondria: synthesis and characterization of a triphenylphosphonium-conjugated alpha-lipoic derivative // Free Radic. Biol. Med. 2007. V. 42. Iss. 12. P. 1766–1780.
Caddell J.L. Magnesium deficiency promotes muscle weakness, contributing to the risk of sudden death (SIDS) in infants sleeping prone // Magnes. Res. 2001. V. 14. № 1–2. P. 39–50.
Cahill G.F.Jr. Clinical and biochemical aspects of lactic acidosis // JAMA. 1977. V. 237. № 10. P. 1010.
Cai T.Q., Ren N., Jin L. et al. Role of GPR81 in lactate-mediated reduction of adipose lipolysis // Biochem. Biophys. Res. Commun. 2008. V. 377. Iss. 3. P. 987–991.
Camiolo G., Tibulla D., Giallongo C. et al. α-Lipoic acid reduces iron-induced toxicity and oxidative stress in a model of iron overload // Int. J. Mol. Sci. 2019. V. 20. № 3. Art. 609.
Cerović O., Golubović V., Špec-Marn A. et al. Relationship between injury severity and lactate levels in severely injured patients // Intens. Care Med. 2003. V. 29. Iss. 8. P. 1300–1305.
Chandel N., Budinger G.R., Kemp R.A., Schumacker P.T. Inhibition of cytochrome-c oxidase activity during prolonged hypoxia // Am. J. Physiol. 1995. V. 268. Iss. 1. P. L918–L925.
Chen H.Y., Cheng F.C., Pan H.C. et al. Magnesium enhances exercise performance via increasing glucose availability in the blood, muscle, and brain during exercise // PLoS One. 2014. V. 9. № 1. Art. e85486.
Chernow B., Rainey T.G., Lake C.R. Endogenous and exogenous catecholamines in critical care medicine // Crit. Care. Med. 1982. V. 10. Iss. 6. P. 409–416.
Cheung J.Y., Zhang X.Q., Song J. et al. Phospholemman: a novel cardiac stress protein // Clin. Transl. Sci. 2010. V. 3. Iss. 4. P. 189–196.
Cheung J.Y., Zhang X.Q., Song J. et al. Coordinated regulation of cardiac Na+/Ca2+ exchanger and Na+-K+-ATPase by phospholemman (FXYD1) // Sodium calcium exchange: a growing spectrum of pathophysiological implication / Ed. L. Annunziato. Luxembourg: Springer, 2013. P. 175–190.
Choi S.K., Baek S.H., Choi S.W. The effects of endurance training and thiamine supplementation on antifatigue during exercise // J. Exerc. Nutr. Biochem. 2013. V. 17. № 4. P. 189–198.
Churchill E.N., Murriel C.I., Chen C.H. et al. Reperfusion-induced translocation of deltaPKC to cardiac mitochondria prevents pyruvate dehydrogenase reactivation // Circ. Res. 2005. V. 97. № 1. P. 78–85.
Clausen S.W. Anhydremic acidosis due to lactic acid // Am. J. Dis. Child. 1925. V. 29. № 6. P. 761–766.
Cohen R.D., Woods H.F. Clinical and biochemical aspects of lactic acidosis. L.: Blackwell Sci. Publ., 1976. 276 p.
Connett R.J., Gayeski T.E., Honig C.R. Lactate efflux is unrelated to intracellular pO2 in a working red muscle in situ // J. Appl. Physiol. 1986. V. 61. Iss. 2. P. 402–408.
Cordova A., Escanero J.F., Gimenez M. Magnesium distribution in rat after maximal exercise in air and under hypoxic conditions // Magnes. Res. 1992. V. 5. № 1. P. 23–27.
Cori C.F., Cori G.T. Glycogen formation in the liver from d- and l-lactic acid // J. Biol. Chem. 1929. V. 81. № 2. P. 389–403.
Cori G.T., Cori C.F. Changes in hexose phosphate, glycogen, and lactic acid during contraction and recovery of mammalian muscle // J. Biol. Chem. 1933. V. 99. № 2. P. 493–505.
Costa N.A., Dorna M.S., Gut A.L. et al. Serum thiamin concentration is negatively correlated with lactate levels in survivors of septic shock // Crit. Care. 2013. V. 17. Suppl. 3. Abstr. P55.
Cronan J.E. Assembly of lipoic acid on its cognate enzymes: an extraordinary and essential biosynthetic pathway // Microbiol. Mol. Biol. Rev. 2016. V. 80. № 2. P. 429–450.
Cronan J.E., Fearnley I.M., Walker J.E. Mammalian mitochondria contain a soluble acyl carrier protein // FEBS Lett. 2005. V. 579. № 21. P. 4892–4896.
Davenport A.P., Alexander S.P., Sharman J.L. et al. International Union of Basic and Clinical Pharmacology. LXXXVIII. G protein-coupled receptor list: recommendations for new pairing with cognate ligands // Pharmacol. Rev. 2013. V. 65. № 3. P. 967–986.
Davis J.A. Anaerobic threshold: review of the concept and directions for future research // Med. Sci. Sports Exerc. 1985. V. 17. № 1. P. 6–21.
De Carvalho Cunha V.N., Dos Santos Rosa T., Sales M.M. et al. Training performed above lactate threshold decreases p53 and shelterin expression in mice // Int. J. Sport. Med. 2018. V. 39. Iss. 9. P. 704–711.
De Castro Abrantes H., Briquet M., Schmuziger C. et al. The lactate receptor HCAR1 modulates neuronal network activity through the activation of Gα and Gβγ subunits // J. Neurosci. 2019. V. 39. № 23. P. 4422–4433.
De Duve C., Baudhuin P. Peroxisomes (microbodies and related particles) // Physiol. Rev. 1966. V. 46. Iss. 2. P. 323–357.
De Paoli F.V., Overgaard K., Pedersen T.H., Nielsen O.B. Additive protective effects of the addition of lactic acid and adrenaline on excitability and force in isolated rat skeletal muscle depressed by elevated extracellular K+ // J. Physiol. 2007. V. 581. Pt. 2. P. 829–839.
Delcher H.K., Shipp J.C. Effect of pH, pCO2 and bicarbonate on metabolism of glucose by perfused rat heart // Biochim. Biophys. Acta. 1966. V. 121. Iss. 2. P. 250–260.
Despa S., Tucker A.L., Bers D.M. Phospholemman-mediated activation of Na/K-ATPase limits [Na]i and inotropic state during β-adrenergic stimulation in mouse ventricular myocytes // Circulation. 2008. V. 117. № 145. P. 1849–1855.
Donnino M.W., Carney E., Cocchi M.N. et al. Thiamine deficiency in critically ill patients with sepsis // J. Crit. Care. 2010. V. 25. Iss. 4. P. 576–581.
Donovan C.M., Brooks G.A. Endurance training affects lactate clearance, not lactate production // Am. J. Physiol. 1983. V. 244. № 1. P. E83–E92.
Du Bois-Reymond E.H. Über die Angeblich Saure Reaction des Muskelfleisches // J. Prakt. Chem. 1859. B. 77. S. 206–244.
Dungan K.M., Braithwaite S.S., Preiser J.C. Stress hyperglycaemia // Lancet. 2009. V. 373. № 9677. P. 1798–1807.
Engelhardt W.A., Ljubimowa M.N. Myosine and adenosinetriphosphatase // Nature. 1939. V. 144. Iss. 3650. P. 668–669.
Estabrook R.W., Hildebrandt A., Remmer H. et al. The role of cytochrome P-450 in microsomal mixed function oxidation reactions // Biochemie des Sauerstoffs / Eds B. Hess, H. Staudinger. Berlin: Springer-Verlag, 1968. S. 142–177.
Evans P.R., Farrants G.W., Hudson P.J. Phosphofructokinase: structure and control // Phil. Trans. R. Soc. Lond. B. Biol. Sci. 1981. V. 293. Iss. 1063. P. 53–62.
Ferguson B.S., Rogatzki M.J., Goodwin M.L. et al. Lactate metabolism: historical context, prior misinterpretations, and current understanding // Eur. J. Appl. Physiol. 2018. V. 118. Iss. 4. P. 691–728.
Fletcher W.M. Lactic acid in amphibian muscle // J. Physiol. 1907. V. 35. Iss. 4. P. 247–309.
Fradette C., Du Souich P. Effect of hypoxia on cytochrome P450 activity and expression // Curr. Drug Metab. 2004. V. 5. Iss. 3. P. 257–271.
Fukuma H., Nakada T., Shimada T. et al. Prehospital lactate improves prediction of the need immediate interventions for hemorrhage after trauma // Sci. Rep. 2019. V. 9. Art. 13755.
Galbo H., Holst J.J., Christensen N.J. Glucagon and plasma catecholamine responses to graded and prolonged exercise in man // J. Appl. Physiol. 1975. V. 38. Iss. 1. P. 70–76.
Gangolf M., Czerniecki J., Radermecker M. et al. Thiamine status in humans and content of phosphorylated thiamine derivatives in biopsies and cultured cells // PLoS One. 2010. V. 5. Iss. 10. Art. e13616.
Garcia-Alvarez M., Marik P., Bellomo R. Stress hyperlactataemia: present understanding and controversy // Lancet Diab. Endocrinol. 2014. V. 2. Iss. 4. P. 339–347.
Ge H., Weiszmann J., Reagan J.D. et al. Elucidation of signaling and functional activities of an orphan GPCR, GPR81 // J. Lipid Res. 2008. V. 49. № 4. P. 797–803.
Gerald M.C. Effects of (+)-amphetamine on the treadmill endurance performance of rats // Neuropharmacology. 1978. V. 17. Iss. 9. P. 703–704.
Ghaffar T., Irshad M., Anwar Z. et al. Recent trends in lactic acid biotechnology: a brief revive on production to purification // J. Radiat. Res. Appl. Sci. 2014. V. 7. № 2. P. 222–229.
Ghani Q.P., Wagner S., Becker H.D. et al. Regulatory role of lactate in wound repair // Meth. Enzymol. 2004. V. 381. P. 565–575.
Giacalone M., Martinelli R., Abramo A. et al. Rapid reversal of severe lactic acidosis after thiamine administration in critically ill adults: a report of 3 cases // Nutr. Clin. Pract. 2015. V. 30. Iss. 1. P. 104–110.
Gladden L.B. Lactate metabolism: a new paradigm for the third millennium // J. Physiol. 2004. V. 558. Iss. 1. P. 5–30.
Goldhammer A.R., Paradies H.H. Phosphofructokinase: structure and function // Curr. Top. Cell Regul. 1979. V. 15. P. 109–141.
Gong W., Xu P., Guo S. et al. Effect of hypoxia on the pharmacokinetics and metabolism of zaleplon as a probe of CYP3A1/2 activity // RSC Adv. 2017. V. 7. № 41. P. 25414–25421.
Goraca A., Huk-Kolega H., Piechota A. et al. Lipoic acid – biological activity and therapeutic potential // Pharmacol. Rep. 2011. V. 63. № 4. P. 849–858.
Gordeziani M.S., Varazi T.G., Pruidze M.V. Structural-functional organization of cytochrome P450 containing monooxygenase and some aspects of modeling // Ann. Agrar. Sci. 2016. V. 14. № 2. P. 82–94.
Griffiths A., Shannon O., Matu J. et al. Response: commentary on the effects of hypoxia on energy substrate use during exercise // J. Int. Soc. Sport. Nutr. 2019. V. 16. Art. 61.
Groussard C., Morel I., Chevanne M. et al. Free radical scavenging and antioxidant effects of lactate ion: an in vitro study // J. App. Physiol. 2000. V. 89. Iss. 1. P. 169–175.
Gudiksen A., Schwartz C.L., Bertholdt L. et al. Lack of skeletal muscle IL-6 affects pyruvate dehydrogenase activity at rest and during prolonged exercise // PLoS One. 2016. V. 11. Iss. 6. P. e0156460.
Halestrap A.P., Price N.T. The proton-linked monocarboxylate transporter (MCT) family: structure, function and regulation // Biochem. J. 1999. V. 343. Pt. 2. P. 281–299.
Halestrap A.P., Meredith D. The SLC16 gene family – from monocarboxylate transporters (MCTs) to aromatic amino acid transporters and beyond // Pflügers Arch. 2004. V. 447. № 5. P. 619–628.
Halmagyi D.F., Irving M.H., Gillett D.J., Varga D. Effect of adrenergic blockade on consequences of sustained epinephrine infusion // J. Appl. Physiol. 1967. V. 23. Iss. 2. P. 171–177.
Halmagyi D.F., Kennedy M., Varga D. Combined adrenergic receptor blockade and circulating catecholamines in hemorrhagic shock // Eur. Surg. Res. 1971. V. 3. № 6. P. 378–388.
Han F., Bossuyt J., Despa S. et al. Phospholemman phosphorylation mediates the protein kinase C-dependent effects on Na+/K+ pump function in cardiac myocytes // Circ. Res. 2006. V. 99. № 12. P. 1376–1383.
Han Y., Zhou S., Coetzee S., Chen A. SIRT4 and its roles in energy and redox metabolism in health, disease and during exercise // Front. Physiol. 2019. V. 10. Art. 1006.
Hart B.B., Stanford G.G., Ziegler M.G. et al. Catecholamines: study of interspecies variation // Crit. Care Med. 1989. V. 17. № 11. P. 1203–1222.
Hashimoto T., Brooks G.A. Mitochondrial lactate oxidation complex and an adaptive role for lactate production // Med. Sci. Sport. Exerc. 2008. V. 40. Iss. 3. P. 486–494.
Hashimoto T., Hussien R., Brooks G.A. Colocalization of MCT1, CD147, and LDH in mitochondrial inner membrane of L6 muscle cells: evidence of a mitochondrial lactate oxidation complex // Am. J. Physiol. Endocrinol. Metab. 2006. V. 290. Iss. 6. P. E1237–E1244.
Hashimoto T., Hussien R., Oommen S. et al. Lactate sensitive transcription factor network in L6 cells: activation of MCT1 and mitochondrial biogenesis // FASEB J. 2007. V. 21. Iss. 10. P. 2602–2612.
Hawley J.A., Leckey J.J. Carbohydrate dependence during prolonged, intense endurance exercise // Sports Med. 2015. V. 45 (Suppl. 1). P. S5–S12.
Hermann R., Mungo J., Cnota P.J., Ziegler D. Enantiomer-selective pharmacokinetics, oral bioavailability, and sex effects of various alpha-lipoic acid dosage forms // Clin. Pharmacol. 2014. V. 6. P. 195–204.
Hermansen L., Hultman E., Saltin B. Muscle glycogen during prolonged severe exercise // Acta Physiol. Scand. 1967. V. 71. № 2–3. P. 129–139.
Hill A.V. The revolution in muscle physiology // Physiol. Rev. 1932. V. 12. Iss. 1. P. 56–67.
Hill A.V., Meyerhof O. Über die Vorgänge bei der Muskelkontraktion // Ergeb. der Physiol. 1923. B. 22. S. 299–327.
Hill A.V., Long C.N.H., Lupton H. Muscular exercise, lactic acid and the supply and utilization of oxygen. Parts I–III // Proc. R. Soc. Lond. B. Biol. Sci. 1924a. V. 96. Iss. 679. P. 438–475.
Hill A.V., Long C.N.H., Lupton H. Muscular exercise, lactic acid, and the supply and utilization of oxygen. Parts IV–VI // Proc. R. Soc. Lond. B. Biol. Sci. 1924b. V. 97. Iss. 681. P. 84–138.
Hill A.V., Long C.N.H., Lupton H. Muscular exercise, lactic acid and the supply and utilization of oxygen. Parts VII–VIII // Proc. R. Soc. Lond. B. Biol. Sci. 1924c. V. 97. Iss. 682. P. 155–176.
Hinkle P.C., Kumar M.A., Resetar A., Harris D.L. Mechanistic stoichiometry of mitochondrial oxidative phosphorylation // Biochemistry. 1991. V. 30. Iss. 14. P. 3576–3582.
Ho L., Titus A.S., Banerjee K.K. et al. SIRT4 regulates ATP homeostasis and mediates a retrograde signaling via AMPK // Aging. 2013. V. 5. № 11. P. 835–849.
Holwerda S.W., Restaino R.M., Fadel P.J. Adrenergic and non-adrenergic control of active skeletal muscle blood flow: implications for blood pressure regulation during exercise // Auton. Neurosci. 2015. V. 188. P. 24–31.
Homsher E. Muscle enthalpy production and its relationship to actomyosin ATPase // Ann. Rev. Physiol. 1987. V. 49. P. 673–690.
Hoque R., Farooq A., Ghani A. et al. Lactate reduces liver and pancreatic injury in Toll-like receptor- and inflammasome-mediated inflammation via GPR81-mediated suppression of innate immunity // Gastroenterology. 2014. V. 146. Iss. 7. P. 1763–1774.
Horton T.J., Pagliassotti M.J., Hobbs K., Hill J.O. Fuel metabolism in men and women during and after long-duration exercise // J. Appl. Physiol. 1985. V. 85. Iss. 5. P. 1823–1832.
Houssay B.A. Carl F. and Gerty T. Cori // Biochim. Biophys. Acta. 1956. V. 20. P. 11–16. https://doi.org/10.1016/0006-3002(56)90255-4
Hsu E., Bajaj T. Beta 2 agonists // StatPearls. Treasure Island (FL): StatPearls Publishing, 2021. PMID 31194406.
Huang C.L., Kuo E. Mechanism of hypokalemia in magnesium deficiency // J. Am. Soc. Nephrol. 2007. V. 18. Iss. 10. P. 2649–2652.
Hunt T.K., Aslam R.S., Beckert S. et al. Aerobically derived lactate stimulates revascularization and tissue repair via redox mechanisms // Antioxid. Redox Signal. 2007. V. 9. Iss. 8. P. 1115–1124.
Huxley A.F. Muscle structure and theories of contraction // Prog. Biophys. Biophys. Chem. 1957. V. 7. P. 255–318.
Huxley H.E. The mechanism of muscular contraction // Science. 1969. V. 164. Iss. 3886. P. 1356–1365.
Huxley A.F., Simmons R.M. Proposed mechanism of force generation in striated muscle // Nature. 1971. V. 233. № 5321. P. 533–538.
Islinger M., Voelkl A., Fahimi H.D., Schrader M. The peroxisome: an update on mysteries 2.0 // Histochem. Cell. Biol. 2018. V. 150. Iss. 5. P. 443–471.
James J.H., Fang C.H., Schrantz S.J. et al. Linkage of aerobic glycolysis to sodium-potassium transport in rat skeletal muscle. Implications for increased muscle lactate production in sepsis // J. Clin. Invest. 1996. V. 98. Iss. 10. P. 2388–2397.
James J.H., Luchette F.A., McCarter F.D., Fischer J.E. Lactate is an unreliable indicator of tissue hypoxia in injury or sepsis // Lancet. 1999a. V. 354. Iss. 9177. P. 505–508.
James J.H., Wagner K.R., King J.K. et al. Stimulation of both aerobic glycolysis and Na+-K+-ATPase activity in skeletal muscle by epinephrine or amylin // Am. J. Physiol. 1999b. V. 277. Iss. 1. P. E176–E186.
Jenkins C.M., Yang J., Sims H.F., Gross R.W. Reversible high affinity inhibition of phosphofructokinase-1 by acyl-CoA: a mechanism integrating glycolytic flux with lipid metabolism // J. Biol. Chem. 2011. V. 286. № 14. P. 11937–11950.
Jiang B. Aerobic glycolysis and high level of lactate in cancer metabolism and microenvironment // Gen. Dis. 2017. V. 4. Iss. 1. P. 25–27.
Jiang Y., Cronan J.E. Expression cloning and demonstration of Enterococcus faecalis lipoamidase (pyruvate dehydrogenase inactivase) as a Ser-Ser-Lys triad amidohydrolase // J. Biol. Chem. 2005. V. 280. № 3. P. 2244–2256.
Joborn H., Akerström G., Ljunghall S. Effects of exogenous catecholamines and exercise on plasma magnesium concentrations // Clin. Endocrinol. 1985. V. 23. Iss. 3. P. 219–226.
Jones W., Li X., Qu Z.C. et al. Uptake, recycling, and antioxidant actions of alpha-lipoic acid in endothelial cells // Free Radic. Biol. Med. 2002. V. 33. Iss. 1. P. 83–93.
Jordan S.W., Cronan J.E. A new metabolic link. The acyl carrier protein of lipid synthesis donates lipoic acid to the pyruvate dehydrogenase complex in Escherichia coli and mitochondria // J. Biol. Chem. 1997. V. 272. № 29. P. 17903–17906.
Jourdain P., Rothenfusser K., Ben-Adiba C. et al. Dual action of L-lactate on the activity of NR2B-containing NMDA receptors: from potentiation to neuroprotection // Sci. Rep. 2018. V. 8. № 1. Art. 13472.
Kaminskas E. The pH-dependence of sugar-transport and glycolysis in cultured Ehrlich ascites-tumour cells // Biochem. J. 1978. V. 174. Iss. 2. P. 453–459.
Kass L.S., Poeira F. The effect of acute vs chronic magnesium supplementation on exercise and recovery on resistance exercise, blood pressure and total peripheral resistance on normotensive adults // J. Int. Soc. Sport. Nutr. 2015. V. 12. Art. 19.
Kaukonen K.M., Bailey M., Egi M. et al. Stress hyperlactatemia modifies the relationship between stress hyperglycemia and outcome: a retrospective observational study // Crit. Care Med. 2014. V. 42. Iss. 6. P. 1379–1385.
Kemper W.F., Lindstedt S.L., Hartzler L.K. et al. Shaking up glycolysis: sustained, high lactate flux during aerobic rattling // PNAS USA. 2001. V. 98. № 2. P. 723–728.
Kim H.J., Son Y.K., An W.S. Effect of sodium bicarbonate administration on mortality in patients with lactic acidosis: a retrospective analysis // PLoS One. 2013. V. 8. Iss. 6. P. e65283.
Kompanje E.J.O., Jansen T.C., van der Hoven B., Bakker J. The first demonstration of lactic acid in human blood in shock by Johann Joseph Scherer (1814–1869) in January 1843 // Intens. Care Med. 2007. V. 33. Iss. 11. P. 1967–1971.
Korotchkina L., Sidhu S., Patel M.S. R-lipoic acid inhibits mammalian pyruvate dehydrogenase kinase // Free Radic. Res. 2004. V. 38. Iss. 10. P. 1083–1092.
Kozlov A.V., Gille L., Staniek K., Nohl H. Dihydrolipoic acid maintains ubiquinone in the antioxidant active form by two-electron reduction of ubiquinone and one-electron reduction of ubisemiquinone // Arch. Biochem. Biophys. 1999. V. 363. Iss. 1. P. 148–154.
Krab K., Kempe H., Wikström M. Explaining the enigmatic KM for oxygen in cytochrome c oxidase: a kinetic model // Biochim. Biophys. Acta. 2011. V. 1807. Iss. 3. P. 348–358.
Kramer K., Packer L. R-alpha lipoic acid // Nutraceuticals in health and disease prevention / Eds K. Kramer, P.P. Hoppe, L. Packer. N.Y.: Marcel Dekker Inc., 2001. P. 129–164.
Latham T., Mackay L., Sproul D. et al. Lactate, a product of glycolytic metabolism, inhibits histone deacetylase activity and promotes changes in gene expression // Nucl. Acids Res. 2012. V. 40. № 11. P. 4794–4803.
Laurent G., German N.J., Saha A.K. et al. SIRT4 coordinates the balance between lipid synthesis and catabolism by repressing malonyl CoA decarboxylase // Mol. Cell. 2013. V. 50. Iss. 5. P. 686–698.
Lauritzen K.H., Morland C., Puchades M. et al. Lactate receptor sites link neurotransmission, neurovascular coupling, and brain energy metabolism // Cereb. Cortex. 2014. V. 24. № 10. P. 2784–2795.
Leavesley H.B., Li L., Prabhakaran K. et al. Interaction of cyanide and nitric oxide with cytochrome c oxidase: implications for acute cyanide toxicity // Toxicol. Sci. 2008. V. 101. Iss. 1. P. 101–111.
Legakis J.E., Koepke J.I., Jedeszko C. et al. Peroxisome senescence in human fibroblasts // Mol. Biol. Cell. 2002. V. 13. № 12. P. 4243–4255.
Lemire J., Mailloux R.J., Appanna V.D. Mitochondrial lactate dehydrogenase is involved in oxidative-energy metabolism in human astrocytoma cells (CCF-STTG1) // PLoS One. 2008. V. 3. Iss. 2. P. e1550.
Lerner R.K., Pessach I., Rubinstein M., Paret G. Lactic acidosis as presenting symptom of thiamine deficiency in children with hematologic malignancy // J. Pediatr. Intens. Care. 2017. V. 6. № 2. P. 132–135.
Leverve X., Batandier C., Fontaine E. Choosing the right substrate // Novartis Found Symp. 2007. V. 280. P. 108–121.
Levraut J., Ciebiera J.P., Chave S. et al. Mild hyperlactatemia in stable septic patients is due to impaired lactate clearance rather than overproduction // Am. J. Respir. Crit. Care Med. 1998. V. 157. Iss. 4. P. 1021–1026.
Levy B., Gibot S., Franck P. et al. Relation between muscle Na+K+ATPase activity and raised lactate concentration in septic shock: a prospective study // Lancet. 2005. V. 365. Iss. 9462. P. 871–875.
Levy B., Mansart A., Montemont C. et al. Myocardial lactate deprivation is associated with decreased cardiovascular performance, decreased myocardial energetics, and early death in endotoxic shock // Intens. Care Med. 2007. V. 33. Iss. 3. P. 495–502.
Levy B., Desebble O., Montemont C., Gibot S. Increased aerobic glycolysis through beta2 stimulation is a common mechanism involved in lactate formation during shock states // Shock. 2008. V. 30. Iss. 4. P. 417–421.
Li G., Gao L., Jia J. et al. α-Lipoic acid prolongs survival and attenuates acute kidney injury in a rat model of sepsis // Exp. Pharmacol. Physiol. 2014. V. 41. Iss. 7. P. 459–468.
Li J., Wynn R.M., Machius M. et al. Cross-talk between thiamin diphosphate binding and phosphorylation loop conformation in human branched-chain alpha-keto acid decarboxylase/dehydrogenase // J. Biol. Chem. 2004. V. 279. № 31. P. 32968–32978.
Liberti M.V., Locasale J.W. Histone lactylation: a new role for glucose metabolism // Tr. Biochem. Sci. 2020. V. 45. Iss. 3. P. 179–182.
Liddell M.J., Daniel A.M., MacLean L.D., Shizgal H.M. The role of stress hormones in the catabolic metabolism of shock // Surg. Gynecol. Obstet. 1979. V. 149. № 6. P. 822–830.
Liu J. The effects and mechanisms of mitochondrial nutrient alpha-lipoic acid on improving age-associated mitochondrial and cognitive dysfunction: an overview // Neurochem. Res. 2008. V. 33. Iss. 1. P. 194–203.
Liu C., Wu J., Zhu J. et al. Lactate inhibits lipolysis in fat cells through activation of an orphan G-protein-coupled receptor, GPR81 // J. Biol. Chem. 2009. V. 284. № 5. P. 2811–2822.
Liu M., Quek L.E., Sultani G., Turner N. Epithelial-mesenchymal transition induction is associated with augmented glucose uptake and lactate production in pancreatic ductal adenocarcinoma // Canc. Metab. 2016. V. 4. Art. 19.
Lodge J.K., Packer L. Natural sources of lipoic acid in plant and animal tissues // Antioxidant food supplements in human health / Eds L. Packer, M. Hiramatsu, T. Yoshikawa. San Diego: Academic Press, 1999. P. 121–134.
MacRae H.S., Dennis S.C., Bosch A.N., Noakes T.D. Effects of training on lactate production and removal during progressive exercise in humans // J. Appl. Physiol. 1992. V. 72. Iss. 5. P. 1649–1656.
Madias N.E. Lactic acidosis // Kidney Int. 1986. V. 29. Iss. 3. P. 752–774.
Manore M.M. Effect of physical activity on thiamine, riboflavin, and vitamin B-6 requirements // Am. J. Clin. Nutr. 2000. V. 72. Iss. 2. P. 598S–606S.
Manzanares W., Hardy G. Thiamine supplementation in the critically ill // Curr. Opin. Clin. Nutr. Metab. Care. 2011. V. 14. Iss. 6. P. 610–617.
Margaria R., Edwards H.T., Dill D.B. The possible mechanism of contracting and paying the oxygen debt and the role of lactic acid in muscular contraction // Am. J. Physiol. 1933. V. 106. № 3. P. 689–715.
Margineanu M.B., Mahmood H., Fiumelli H., Magistretti P.J. L-lactate regulates the expression of synaptic plasticity and neuroprotection genes in cortical neurons: a trans-criptome analysis // Front. Mol. Neurosci. 2018. V. 11. Art. 375.
Marik P.E., Bellomo R. Lactate clearance as a target of therapy in sepsis: a flawed paradigm // Crit. Care. 2013a. V. 1. № 1. Art. 3.
Marik P.E., Bellomo R. Stress hyperglycemia: an essential survival response! // Crit. Care. 2013b. V. 17. № 2. Art. 305.
Marliss E.B., Vranic M. Intense exercise has unique effects on both insulin release and its roles in glucoregulation: implications for diabetes // Diabetes. 2002. V. 51. Suppl. 1. P. S271–S283.
Martin E., Rosenthal R.E., Fiskum G. Pyruvate dehydrogenase complex: metabolic link to ischemic brain injury and target of oxidative stress // J. Neurosci. Res. 2005. V. 79. Iss. 1–2. P. 240–247.
Masuda H., Masuda T., Hatta H. Effect of thiamin (vitamin B1) on carbohydrate metabolism at rest and during exercise // J. Phys. Fitness Sports. 2015. V. 4. Iss. 4. P. 337–341.
Mathias R.A., Greco T.M., Oberstein A. et al. Sirtuin 4 is a lipoamidase regulating pyruvate dehydrogenase complex activity // Cell. 2014. V. 159. Iss. 7. P. 1615–1625.
Mathias R.A., Greco T.M., Cristea I.M. Identification of Sirtuin4 (SIRT4) protein interactions: uncovering candidate acyl-modified mitochondrial substrates and enzymatic regulators // Meth. Mol. Biol. 2016. V. 1436. P. 213–239.
Matsuo T., Daishaku S., Sadzuka Y. Lactic acid promotes cell survival by blocking autophagy of B16F10 mouse melanoma cells under glucose deprivation and hypoxic conditions // Biol. Pharm. Bull. 2019. V. 42. Iss. 5. P. 837–839.
Mazzeo R.S., Brooks G.A., Schoeller D.A., Budinger T.F. Disposal of [1–13C]lactate in humans during rest and exercise // J. Appl. Physiol. 1986. V. 60. Iss. 1. P. 232–241.
McCarter F.D., James J.H., Luchette F.A. et al. Adrenergic blockade reduces skeletal muscle glycolysis and Na(+), K(+)-ATPase activity during hemorrhage // J. Surg. Res. 2001. V. 99. Iss. 2. P. 235–244.
McCarter F.D., Nierman S.R., James J.H. et al. Role of skeletal muscle Na+-K+ ATPase activity in increased lactate production in subacute sepsis // Life Sci. 2002. V. 70. Iss. 16. P. 1875–1888.
McClelland G.B., Khanna S., Gonzalez G.F. et al. Peroxisomal membrane monocarboxylate transporters: evidence for a redox shuttle system? // Biochem. Biophys. Res. Commun. 2003. V. 304. Iss. 1. P. 130–135.
McCowen K.C., Malhotra A., Bistrian B.R. Stress-induced hyperglycemia // Crit. Care Clin. 2001. V. 17. Iss. 1. P. 107–124.
McCullagh K.J., Juel C., O’Brien M., Bonen A. Chronic muscle stimulation increases lactate transport in rat skeletal muscle // Mol. Cell. Biochem. 1996. V. 156. Iss. 1. P. 51–57.
McGarry J.D., Mannaerts G.P., Foster D.W. A possible role for malonyl-CoA in the regulation of hepatic fatty acid oxidation and ketogenesis // J. Clin. Invest. 1977. V. 60. № 1. P. 265–270.
McGregor I.S., Lee A.M., Westbrook R.F. Stress-induced changes in respiratory quotient, energy expenditure and locomotor activity in rats: effects of midazolam // Psychopharmacology. 1994. V. 116. Iss. 4. P. 475–482.
McKenna M.J., Bangbo J., Renaud J.M. Muscle K+, Na+, and Cl– disturbances and Na+‑K+ pump inactivation: implications for fatigue // J. Appl. Physiol. 2008. V. 104. Iss. 1. P. 288–295.
McLain A.L., Szweda P.A., Szweda L.I. α-Ketoglutarate dehydrogenase: a mitochondrial redox sensor // Free Radic. Res. 2011. V. 45. Iss. 1. P. 29–36.
Mera P., Laue K., Ferron M. et al. Osteocalcin signaling in myofibers is necessary and sufficient for optimum adaptation to exercise // Cell. Metab. 2016. V. 23. № 6. P. 1078–1092.
Metzger J.M., Moss R.L. Effects of tension and stiffness due to reduced pH in mammalian fast- and slow-twitch skinned skeletal muscle fibres // J. Physiol. 1990. V. 428. Iss. 1. P. 737–750.
Meyerhof O. Die Energieumwandlungen im Muskel. I. Über die Beziehungen der Milchsäure zur Wärmebildung und Arbeitsleistung des Muskels in der Anaerobiose // Pflügers Arch. Physiol. Mensch. Tiere. 1920a. B. 182. S. 232–283.
Meyerhof O. Über die Energieumwandlungen im Muskel. II. Das Schicksal der Milchsäure in der Erholungsperiode des Muskels // Pflügers Arch. Physiol. Mensch. Tiere. 1920b. B. 182. S. 284–317.
Meyerhof O. Die Energieumwandlungen im Muskel. III. Kohlehydrat- und Milchsäureumsatz im Froschmuskel // Pflügers Arch. Physiol. Mensch. Tiere. 1920c. B. 185. S. 11–32.
Meyerhof O. Die Energieumwandlungen im Muskel. IV. Mitteilung. Über die Milchsäurebildung in der Zerschnittenen Muskulatur // Pflügers Arch. Physiol. Mensch. Tiere. 1921. B. 188. S. 114–160.
Meyerhof O. The chemistry of muscular contraction // Lancet. 1930. V. 216. № 5600. P. 1415–1422.
Meyerhof O. Intermediate carbohydrate metabolism // A symposium on respiratory enzymes. Madison: Univ. Wisconsin Press, 1942. P. 3–15.
Milne J.L., Shi D., Rosenthal P.B. et al. Molecular architecture and mechanism of an icosahedral pyruvate dehydrogenase complex: a multifunctional catalytic machine // EMBO J. 2002. V. 21. № 21. P. 5587–5598.
Miranda-Gonçalves V., Lameirinhas A., Macedo-Silva C. et al. Lactate increases renal cell carcinoma aggressiveness through Sirtuin 1-dependent epithelial-mesenchymal transition axis regulation // Cells. 2020. V. 9. Iss. 4. Art. 1053.
Mitchell J.H., Blomqvist G. Maximal oxygen uptake // N. Engl. J. Med. 1971. V. 284. № 18. P. 1018–1022.
Mookerjee S.A., Gerencser A.A., Nicholls D.G., Brand M.D. Quantifying intracellular rates of glycolytic and oxidative ATP production and consumption using extracellular flux measurements // J. Biol. Chem. 2017. V. 292. № 17 P. 7189–7207.
Morikawa T., Yasuno R., Wada H. Do mammalian cells synthesize lipoic acid? Identification of a mouse cDNA encoding a lipoic acid synthase located in mitochondria // FEBS Lett. 2001. V. 498. Iss. 1. P. 16–21.
Morland C., Lauritzen K.H., Puchades M. et al. The lactate receptor, G-protein-coupled receptor 81/hydroxycarboxylic acid receptor 1: expression and action in brain // J. Neurosci. Res. 2015. V. 93. Iss. 7. P. 1045–1055.
Morozova E., Yoo Y., Behrouzvaziri A. et al. Amphetamine enhances endurance by increasing heat dissipation // Physiol. Rep. 2016. V. 4. Iss. 17. P. e12955.
Murphy M.P. How mitochondria produce reactive oxygen species // Biochem. J. 2009. V. 417. Iss. 1. P. 1–13.
Nelson C.R., Debold E.P., Fitts R.H. Phosphate and acidosis act synergistically to depress peal power in rat muscle fibers // Am. J. Physiol. Cell Physiol. 2014. V. 307. Iss. 10. P. 939–950.
Nesse R.M., Bhatnagar S., Ellis B. Evolutionary origins and functions of the stress response system // Stress: concepts, cognition, emotion, and behavior. Ch. 11 / Ed. G. Fink. L.: Academic Press, 2016. P. 95–101.
Nichol A.D., Egi M., Pettila V. et al. Relative hyperlactatemia and hospital mortality in critically ill patients: a retrospective multi-centre study // Crit. Care. 2010. V. 14. № 1. Art. R25.
Nicolson G.L. Mitochondrial dysfunction and chronic diseases: treatment with natural supplements // Integr. Med. (Encinitas). 2014. V. 14. № 4. P. 35–43.
Nielsen F.H., Lukaski H.C. Update on the relationship between magnesium and exercise // Magnes. Res. 2006. V. 19. № 3. P. 180–189.
Nielsen O.B., de Paoli F., Overgaard K. Protective effects of lactic acid on force production in rat skeletal muscle // J. Physiol. 2001. V. 536. Iss. 1. P. 161–166.
Nijakowski F. Assays of some vitamins of the B complex group in human blood in relation to muscular effort // Acta Physiol. Pol. 1966. V. 17. P. 397–404.
Nirupama R., Devaki M., Yajurvedi H.N. Chronic stress and carbohydrate metabolism: persistent changes and slow return to normalcy in male albino rats // Stress. 2012. V. 15. Iss. 3. P. 262–271.
Nuzzo E., Berg K.M., Andersen L.W. et al. Pyruvate dehydrogenase activity is decreased in the peripheral blood mononuclear cells of patients with sepsis. A prospective observational trial // Ann. Am. Thorac. Soc. 2015. V. 12. Iss. 11. P. 1662–1666.
Ohno Y., Ando K., Ito T. et al. Lactate stimulates a potential for hypertrophy and regeneration of mouse skeletal muscle // Nutrients. 2019. V. 11. Iss. 4. Art. 869.
Packer L., Witt E.H., Tritschler H.J. Alpha-lipoic acid as a biological antioxidant // Free Radic. Biol. Med. 1995. V. 19. Iss. 2. P. 227–250.
Padmalayam I. Targeting mitochondrial oxidative stress through lipoic acid synthase: a novel strategy to manage diabetic cardiovascular disease // Cardiovasc. Hematol. Agents Med. Chem. 2012. V. 10. Iss. 3. P. 223–233.
Padmalayam I., Hasham S., Saxena U., Pillarisetti S. Lipoic acid synthase (LASY): a novel role in inflammation, mitochondrial function, and insulin resistance // Diabetes. 2009. V. 58. Iss. 3. P. 600–608.
Padmalayam I., Hamm R., Reddy D.S. et al. Identification of a pharmacological inducer of lipoic acid synthase that impacts mitochondrial function: metabolic benefits and body weight loss without changes in caloric intake // J. Diab. Metab. 2012. Art. S11:002.
Parsikia A., Bones K., Kaplan M. et al. The predictive value of initial serum lactate in trauma patients // Shock. 2014. V. 42. № 3. P. 199–204.
Pate E., Bhimani M., Franks-Skiba K., Cooke R. Reduced effect of pH on skinned rabbit psoas muscle mechanics at high temperatures: implications for fatigue // J. Physiol. 1995. V. 486. Iss. 3. P. 689–694.
Patel M.S., Nemeria N.S., Furey W., Jordan F. The pyruvate dehydrogenase complexes: structure-based function and regulation // J. Biol. Chem. 2014. V. 289. № 24. P. 16615–16623.
Patkova A., Joskova V., Havel E. et al. Prognostic value of respiratory quotient in severe polytrauma patients with nutritional support // Nutrition. 2018. V. 49. P. 90–95.
Pedersen T.H., Clausen T., Nielsen O.B. Loss of force induced by high extracellular [K+] in rat muscle: effect of temperature, lactic acid and β2-agonist // J. Physiol. 2003. V. 551. Iss. 1. P. 227–286.
Pekovich S.R., Martin P.R., Singleton C.K. Thiamine deficiency decreases steady-state transketolase and pyruvate dehydrogenase but not α-ketoglutarate dehydrogenase mRNA levels in three human cell types // J. Nutr. 1998. V. 128. Iss. 4. P. 683–687.
Petronilho F., Florentino D., Danielski L.G. et al. Alpha-lipoic acid attenuates oxidative damage in organs after sepsis // Inflammation. 2016. V. 39. Iss. 1. P. 357–365.
Philp A., Macdonald A.L., Watt P.W. Lactate – a signal coordinating cell and systemic function // J. Exp. Biol. 2005. V. 208. Iss. 24. P. 4561–4575.
Pi M., Xu F., Ye R. et al. Role of GPRC6A in regulating hepatic energy metabolism in mice // Sci. Rep. 2020. V. 10. Art. 7216.
Pilchova I., Klacanova K., Tatarkova Z. et al. The involvement of Mg2+ in regulation of cellular and mitochondrial functions // Oxid. Med. Cell. Longev. 2017. V. 2017. Art. ID 6797460.
Porporato P.E., Payen V.L., De Saedeleer C.J. et al. Lactate stimulates angiogenesis and accelerates the healing of superficial and ischemic wounds in mice // Angiogenesis. 2012. V. 15. Iss. 4. P. 581–592.
Prentice R.L., Neuhouser M.L., Tinker L.F. et al. An exploratory study of respiratory quotient calibration and association with postmenopausal breast cancer // Canc. Epidemiol. Biomark. Prev. 2013. V. 22. Iss. 12. P. 2374–2383.
Qvisth V., Hagström-Toft E., Enoksson S., Bolinder J. Catecholamine regulation of local lactate production in vivo in skeletal muscle and adipose tissue: role of β-adrenoreceptor subtypes // J. Clin. Endocrinol. Metab. 2008. V. 93. Iss. 1. P. 240–246.
Ratter J.M., Rooijackers H.M.M., Hooiveld G.J. et al. In vitro and in vivo effects of lactate on metabolism and cytokine production of human primary PBMCs and monocytes // Front. Immunol. 2018. V. 9. Art. 2564.
Reddy J.K., Mannaerts G.P. Peroxisomal lipid metabolism // Ann. Rev. Nutr. 1994. V. 14. P. 343–370.
Reed L.J. The chemistry and function of lipoic acid // Adv. Enzymol. Relat. Subj. Biochem. 1957. V. 18. P. 319–347.
Reed L.J. From lipoic acid to multi-enzyme complex // Protein Sci. 1998. V. 7. Iss. 1. P. 220–224.
Reed L.J., DeBusk B.G., Gunsalus I.C., Hornberger C.S.Jr. Crystalline alpha-lipoic acid; a catalytic agent associated with pyruvate dehydrogenase // Science. 1951. V. 114. Iss. 2952. P. 93–94.
Regueira T., Djafarzadeh S., Brandt S. et al. Oxygen transport and mitochondrial function in porcine septic shock, cardiogenic shock, and hypoxaemia // Acta Anaesthesiol. Scand. 2012. V. 56. Iss. 7. P. 846–859.
Rhodes A., Evans L.E., Alhazzani W. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016 // Intens. Care Med. 2017. V. 43. Iss. 3. P. 304–377.
Ripcke J., Zarse K., Ristow M., Birringer M. Small-molecule targeting of the mitochondrial compartment with an endogenously cleaved reversible tag // ChemBioChem. 2009. V. 10. Iss. 10. P. 1689–1696.
Robergs R.A. Exercise-induced metabolic acidosis: where do the protons come from? // Sportscience. 2001. V. 5. № 2. P. 1–20.
Robergs R.A., Ghiasvand F., Parker D. Biochemistry of exercise-induced metabolic acidosis // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2004. V. 287. Iss. 3. P. R502–R516.
Rooney K., Trayhurn P. Lactate and the GPR81 receptor in metabolic regulation: implications for adipose tissue function and fatty acid utilization by muscle during exercise // Br. J. Nutr. 2011. V. 106. Iss. 9. P. 1310–1316.
Saddik M., Gamble J., Witters L.A., Lopaschuk G.D. Acetyl-CoA carboxylase regulation of fatty acid oxidation in the heart // J. Biol. Chem. 1993. V. 268. № 34. P. 25836–25845.
San-Millán I., Julian C.G., Matarazzo C. et al. Is lactate an oncometabolite? Evidence supporting a role for lactate in the regulation of transcriptional activity of cancer-related genes in MCF7 breast cancer cells // Front. Oncol. 2019. V. 9. Art. 1536.
Santos N., Pereira-Nunes A., Baltazar F., Granja S. Lactate as regulator of cancer inflammation and immunity // Immunometabolism. 2019. V. 1. P. e190015.
Sarti P., Arese M., Bacchi A. et al. Nitric oxide and mitochondrial complex IV // IUBMB Life. 2003. V. 55. Iss. 10–11. P. 605–611.
Sarti P., Forte E., Giuffre A. et al. The chemical interplay between nitric oxide and mitochondrial cytochrome c oxidase: reactions, effectors and pathophysiology // Int. J. Cell. Biol. 2012. V. 2012. Art. ID 571067.
Sepp M., Sokolova N., Jugai S. et al. Tight coupling of Na+/K+-ATPase with glycolysis demonstrated in permeabilized rat cardiomyocytes // PLoS One. 2014. V. 9. Iss. 6. P. e99413.
Sheeran F.L., Angerosa J., Liaw N.Y. et al. Adaptations in protein expression and regulated activity of pyruvate dehydrogenase multienzyme complex in human systolic heart failure // Oxid. Med. Cell Longev. 2019. V. 2019. Art. 4532592.
Shepherd P.R., Kahn B.B. Glucose transporters and insulin action – implications for insulin resistance and diabetes mellitus // N. Engl. J. Med. 1999. V. 341. № 4. P. 248–257.
Simoni R.D., Hill R.L., Vaughan M. Carbohydrate metabolism: glycogen phosphorylase and the work of Carl F. and Gerty T. Cori. 1928–1943 // J. Biol. Chem. 2002. V. 277. № 29. Art. 18e.
Smith A.R., Shenvi S.V., Widlansky M. et al. Lipoic acid as a potential therapy for chronic diseases associated with oxidative stress // Curr. Med. Chem. 2004. V. 11. Iss. 9. P. 1135–1146.
Snell E.E., Strong F.M., Peterson W.H. Growth factor for bacteria: fractionation and properties of an accessory factor for lactic acid bacteria // Biochem. J. 1937. V. XXXI. Iss. 10. P. 1789–1799.
Soeters M.R., Soeters P.B. The evolutionary benefit of insulin resistance // Clin. Nutr. 2012. V. 31. Iss. 6. P. 1002–1007.
Soria M., Gonzalez-Haro C., Anson M.A. et al. Variations in serum magnesium and hormonal levels during incremental exercise // Magnes. Res. 2014. V. 27. № 4. P. 155–164.
Stackhouse S.K., Reisman D.S., Binder-Macleod S.A. Challenging the role of pH in skeletal muscle fatigue // Phys. Ther. 2001. V. 81. № 12. P. 1897–1903.
Suh J.H., Moreau R., Heath S.H., Hagen T.M. Dietary supplementation with (R)-α-lipoic acid reverses the age-related accumulation of iron and depletion of antioxidants in the rat cerebral cortex // Redox Rep. 2005. V. 10. № 1. P. 52–60.
Sundberg C.W., Fitts R.H. Bioenergetic basis of skeletal muscle fatigue // Curr. Opin. Physiol. 2019. V. 10. P. 118–127.
Suzuki M., Itokawa Y. Effects of thiamine supplementation on exercise-induced fatigue // Metab. Brain Dis. 1996. V. 11. Iss. 1. P. 95–106.
Szent-Györgyi A. Free-energy relations and contraction of actomyosin // Biol. Bull. 1949. V. 96. № 2. P. 140–161.
Szent-Györgyi A. Lost in the twentieth century // Ann. Rev. Biochem. 1963. V. 32. P. 1–15.
Takahashi H., Alves C.R.R., Stanford K.I. et al. TGF-β2 is an exercise-induced adipokine that regulates glucose and fatty acid metabolism // Nat. Metab. 2019. V. 1. № 2. P. 291–303.
Tangseefa P., Martin S.K., Fitter S. et al. Osteocalcin-dependent regulation of glucose metabolism and fertility: skeletal implications for the development of insulin resistance // J. Cell. Physiol. 2018. V. 233. Iss. 5. P. 3769–3783.
Tao Y., Huang C., Huang Y. et al. SIRT4 suppresses inflammatory responses in human umbilical vein endothelial cells // Cardiovasc. Toxicol. 2015. V. 15. Iss. 3. P. 217–223.
Tao Y., Yu S., Chao M. et al. SIRT4 suppresses the PI3K/Akt/NF-kB signaling pathway and attenuates HUVEC injury induced by oxLDL // Mol. Med. Rep. 2019. V. 19. № 6. P. 4973–4979.
Tauffenberger A., Fiumelli H., Almustafa S., Magistretti P.J. Lactate and pyruvate promote oxidative stress resistance through hermetic ROS signaling // Cell Death Dis. 2019. V. 10. № 9. Art. 653.
Teichert J., Hermann R., Ruus P., Preiss R. Plasma kinetics, metabolism, and urinary excretion of alpha-lipoic acid following oral administration in healthy volunteers // J. Clin. Pharmacol. 2003. V. 43. Iss. 11. P. 1257–1267.
Thomas G.D., Segal S.S. Neural control of muscle blood flow during exercise // J. Appl. Physiol. 2004. V. 97. Iss. 2. P. 731–738.
Tretter L., Adam-Vizi V. Alpha-ketoglutarate dehydrogenase: a target and generator of oxidative stress // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2005. V. 360. Iss. 1464. P. 2335–2345.
Tsukamoto S., Shibasaki A., Naka A. et al. Lactate promotes myotube hypertrophy via a pathway involving MyoD in vitro and enhances muscle regeneration in vivo // Int. J. Mol. Sci. 2018. V. 19. Iss. 11. Art. 3649.
Uchida R., Okamoto H., Ikuta N. et al. Enantioselective pharmacokinetics of α‑lipoic acid in rats // Int. J. Mol. Sci. 2015. V. 16. Iss. 9. P. 22781–22794.
Ui M. A role of phosphofructokinase in pH-dependent regulation of glycolysis // Biochim. Biophys. Acta. 1966. V. 124. Iss. 2. P. 310–322.
Ullrich V., Cohen B., Cooper D.Y., Estabrook R.W. Reactions of hemoprotein P-450 // Structure and function of cytochromes / Eds K. Okunuki, M.D. Kamen, I. Sekuzu. Tokyo: Univ. Tokyo Press, 1968. P. 649–655.
Valenti D., de Bari L., Atlante A., Passarella S. L-lactate transport into rat heart mitochondria and reconstruction of the L-lactate/pyruvate shuttle // Biochem. J. 2002. V. 364. Iss. 1. P. 101–104.
Vanasco V., Cimolai M.C., Evelson P., Alvarez S. The oxidative stress and the mitochondrial dysfunction caused by endotoxemia are prevented by α-lipoic acid // Free Radic. Res. 2008. V. 42. Iss. 9. P. 815–823.
Vary T.C., Siegel J.H., Nakatani T. et al. Effect of sepsis on activity of pyruvate dehydrogenase complex in skeletal muscle and liver // Am. J. Physiol. 1986. V. 250. Iss. 6. Pt. 1. P. E634–E640.
Vary T.C., Hazen S.A., Maish G., Cooney R.N. TNF binding protein prevents hyperlactatemia and inactivation of PGH complex in skeletal muscle during sepsis // J. Surg. Res. 1998. V. 80. Iss. 1. P. 44–51.
Veronese N., Berton L., Carraro S. et al. Effect of oral magnesium supplementation on physical performance in healthy elderly women involved in a weekly exercise program: a randomized controlled trial // Am. J. Clin. Nutr. 2014. V. 100. Iss. 3. P. 974–981.
Vijayakrishnan S., Callow P., Nutley M.A. et al. Variation in the organization and subunit composition of the mammalian pyruvate dehydrogenase complex E2/E3BP core assembly // Biochem. J. 2011. V. 437. Iss. 3. P. 565–574.
von Liebig J. Recherches de chimie animale // CR Hebdom. Séances Acad. Sci. 1847. V. 24. P. 69–73.
von Muralt A. The development of muscle-chemistry, a lesson in neurophysiology // Biochim. Biophys. Acta. 1950. V. 4. Iss. 1–3. P. 126–129.
Wagner W., Ciszewski W.M., Kania K.D. L- and D-lactate enhance DNA repair and modulate the resistance of cervical carcinoma cells to anticancer drugs via histone deacetylase inhibition and hydroxycarboxylic acid receptor 1 activation // Cell. Commun. Signal. 2015. V. 13. Art. 36.
Wagner W., Kania K.D., Ciszewski W.M. Stimulation of lactate receptor (HCAR1) affects cellular DNA repair capacity // DNA Repair. 2017. V. 52. P. 49–58.
Wan J.J., Qin Z., Wang P.Y. et al. Muscle fatigue: general understanding and treatment // Exp. Mol. Med. 2017. V. 49. № 10. P. e384.
Wasserman K. The anaerobic threshold measurement in exercise testing // Clin. Chest. Med. 1984. V. 5. Iss. 1. P. 77–88.
Wasserman K., McIlroy M.B. Detecting the threshold of anaerobic metabolism in cardiac patients during exercise // Am. J. Cardiol. 1964. V. 14. Iss. 6. P. 844–852.
Wasserman K., Whipp B.J., Koyl S.N., Beaver W.L. Anaerobic threshold and respiratory gas exchange during exercise // J. Appl. Physiol. 1973. V. 35. № 2. P. 236–243.
Weiss B., Laties V.G. Enhancement of human performance by caffeine and the amphetamines // Pharmacol. Rev. 1962. V. 14. Iss. 1. P. 1–36.
Whyte K.F., Addis G.J., Whitesmith R., Reid J.L. Adrenergic control of plasma magnesium in man // Clin. Sci. 1987. V. 72. Iss. 1. P. 135–138.
Wilson M.C., Jackson V.N., Heddle C. et al. Lactic acid efflux from white skeletal muscle is catalyzed by the monocarboxylate transporter isoform MCT3 // J. Biol. Chem. 1998. V. 273. № 26. P. 15920–15926.
Wislicenus J. Über die Isomeren Milchsäuren // Annalen der Chemie und Pharmacie. 1873a. B. CLXVI. S. 1–64.
Wislicenus J. Über die Optisch-Aktive Milchsäure der Fleischflüssigkeit, die Paramilchsäure (Zweite Abhandlung) // Annalen der Chemie und Pharmacie. 1873b. B. CLXVI. S. 302–346.
Wong J., Choi S.Y.C., Liu R. et al. Potential therapies for infectious diseases based on targeting immune evasion mechanisms that pathogens have in common with cancer cells // Front. Cell Infect. Microbiol. 2019. V. 9. Art. 25.
Wutrich Y., Barraud D., Conrad M. et al. Early increase in arterial lactate concentration under epinephrine infusion is associated with a better prognosis during shock // Shock. 2010. V. 34. Iss. 1. P. 4–9.
Wyndham C.H., Rogers G.G., Benade A.J., Strydom N.B. Physiological effects of the amphetamines during exercise // S. Afr. Med. J. 1971. V. XLV. № 10. P. 247–252.
Young A., Oldford C., Mailloux R.J. Lactate dehydrogenase supports oxidation in mitochondria isolated from different mouse tissues // Redox Biol. 2020. V. 28. Art. 101339.
Zakharchenko M.V., Zakharchenko A.V., Khunderyakova N.V. et al. Burst of succinate dehydrogenase and α-ketoglutarate dehydrogenase activity in concert with the expression of genes coding for respiratory chain proteins underlies short-term beneficial physiological stress in mitochondria // Int. J. Biochem. Cell. Biol. 2013. V. 45. Iss. 1. P. 190–200.
Zhang Y., Xun P., Wang R. et al. Can magnesium enhance exercise performance? // Nutrients. 2017. V. 9. № 9. Art. 946.
Zhang D., Tang Z., Huang H. et al. Metabolic regulation of gene expression by histone lactylation // Nature. 2019. V. 574. № 7779. P. 575–580.
Zhou X., Nian Y., Qiao Y. et al. Hypoxia plays a key role in the pharmacokinetic changes of drugs at high altitude // Curr. Drug Metab. 2018. V. 19. № 11. P. 960–969.
Zilva J.F. The origin of the acidosis in hyperlactataemia // Ann. Clin. Biochem. 1978. V. 15. Iss. 1. P. 40–43.
Zoch M.L., Clemens T.L., Riddle R.C. New insights into the biology of osteocalcin // Bone. 2016. V. 82. P. 42–49.
Zouhal H., Jacob C., Delamarche P., Gratas-Delamarche A. Catecholamines and the effects of exercise, training and gender // Sport. Med. 2008. V. 38. Iss. 5. P. 401–423.
Zugno A.I., Valvassori S.S., Scherer E.B. et al. Na+,K+-ATPase activity in an animal model of mania // J. Neural Transm. 2009. V. 116. Iss. 4. P. 431–436.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии



