Успехи современной биологии, 2021, T. 141, № 4, стр. 382-389
Удаленные синцитии анастомозов смежных нейронов
О. С. Сотников 1, *, Л. А. Давыдова 2
1 Институт физиологии им. И.П. Павлова РАН
Санкт–Петербург, Россия
2 Белорусский государственный медицинский университет
Минск, Беларусь
* E-mail: ossotnikov@mail.ru
Поступила в редакцию 05.10.2020
После доработки 28.01.2021
Принята к публикации 27.02.2021
Аннотация
Описанные ранее межнейронные волоконные несинаптические связи обычно рассматривались как комиссуральные, а их появление гипотетически связывалось не с обычным, а часто с повторным делением ядер нейронов и ростом связывающих их нейритов. Цель нашей работы состояла в пересмотре этой нейробиологической гипотезы, основанной на фиксированных препаратах, с позиций кинетики живых нейронов. С помощью видеосъемки было показано, что двуядерные нейроны образуются не путем деления клеток, а с помощью слияния двух их нервных отростков и тел. Показано, что ток аксоплазмы – не жидкость, а сократимый гель, который, сокращаясь, сближает клетки, вплоть до их слияния. Стало ясно, что фрагменты соединяющих волокон являются не просто комиссуральными отростками, а представляют собой трубчатую, электрически и тинкториально проницаемую, ретрагирующую систему – анастомоз. Как всякий анастомоз, эта структура имеет две концевые перфорации, то есть является дистантным синцитием. Эти данные теперь позволяют считать нейриты не как исключение общебиологического закона об общих основных свойствах клеток Ранвье. Такой синцитий описан впервые только у отростчатых клеток. Поэтому нами проанализированы монографии классика нейрогистологии Сантьяго Рамон-и-Кахаля. В работах автора были обнаружены повсеместные множественные, неопознанные им ранее, дистантные анастомозы, которые, по нашему мнению, должны существенно влиять на электрические свойства нейронов и нуждаются в дополнении общебиологической теории нервной системы многоклеточных животных.
ВВЕДЕНИЕ
Трудно себе представить, что при современной световой микроскопии можно было увидеть, открыть какую-то новую неизведанную морфологическую структуру и ее функцию. Действительно, нейроны с одиночными короткими и утолщенными ветвями, соединяющими два тела клетки, были известны еще Рудольфу Вагнеру (Wagner, 1854). Но это была уникальная единичная редкость, как считалось, “уродливый артефакт”, не представляющий интереса для науки и практики. Однако число описаний так называемых комиссур увеличивалось и обратило на себя внимание многих морфологов (рис. 1). Но факты оказались непризнанными. Знаменитый испанский нейрогистолог Сантьяго Рамон-и-Кахаль – основоположник “Нейронной теории” не придавал значения этим, якобы случайным, находкам. Но теперь этот феномен обнаружен у всех видов многоклеточных: у млекопитающих и человека, у моллюсков, раков, у насекомых и у кишечнополостных. Причем, такие нервные отростки, связывающие тела нейронов, встречаются в ядрах мозга, в сетчатке, в ганглиях кишечника и других органах нервной системы.
Рис. 1.
Многочисленные комиссуральные свяи нейронов у животных разного вида. а – нейрональные связи пирамидных клеток амонова рога (Дойников, 1955); б – связь отростков нейронов симпатического узла тритона разного диаметра (Лавдовский, Овсянников, 1887); в – соединенные комиссурами нейроны мозжечка (van Gehuchten, 1891); г – множественные синцитиальные связи в сети нервной системы речного рака (Tonner, 1933); д – слившиеся отростки сенсорных нейронов стрекозы (Заварзин, 1941); е – три комиссурально связанных нейрона ретины человека (по: Келликер, 1865).

ОБЩЕБИОЛОГИЧЕСКАЯ ГИПОТЕЗА О РЕГЕНЕРАЦИИ МНОГОЯДЕРНЫХ НЕЙРОНОВ
В 1972 г. появились обширные исследования венесуэльских нейрогистологов (Sosa J.M., Sosa H.M.S., 1972). Они продемонстрировали короткую комиссуральную волоконную связь многих двух- и трехнейронных нервных клеток. Их препараты, по нашему мнению, опровергают прежние представления о том, что такие связи отсутствуют в ЦНС. Они формулируют гипотезу о том, что межнейронные комиссуры являются результатом “простого”, многократного расщепления ядер (амитоза), без стадий митоза, с постепенным расхождением клеток и одновременным вытягиванием связующего цитоплазматического мостика, образовавшегося между нейронами. Сходного распространенного мнения современных исследователей о формировании комиссур придерживались ранее Гензен, Бете и Дорн. Однако на отличных препаратах (Sosa J.M, Sosa H.M.S, 1972), как, в принципе, на любых фиксированных препаратах в статике, описанный авторами гипотетический процесс наблюдать невозможно. Кроме того, классический амитоз предполагает наличие митоза без цитокинеза, а авторы дважды подчеркивают, что митоза “ни разу не встречали”. Сходные представления о возможном “расщеплении” и расхождении ядер одной клетки высказывались многими авторами и неоднократно в качестве новой, повторной функции зрелого нейрона. Такие гипотетические представления широко известны и сейчас (Blümcke, Wiestler, 2002; Hirohata, 2008; Zhu et al., 2008; Kawataki et al., 2010; Joyon et al., 2016 и др.). Нам известны 76 статей сторонников амитоза. Многие из них даже не обсуждают возможность слияния отростков и тел нейронов.
Цель наших видеоисследований состояла в том, чтобы продемонстрировать, что описанные короткие межнейронные внесинаптические связи являются не просто комиссурами, а представляют собой полые цилиндрические образования, заполненные сократимым гелем, электрически и тинкториально проницаемой субстанцией – анастомозами, то есть своеобразными дистантными цитоплазматическими синцитиями с двумя перфорациями, по одной на каждой клетке. Ставилась задача выявить у нейронов их прижизненные общебиологические свойства: подвижность, цитоплазматическую адгезивность и нейрональное мембранное слияние. Чтобы опровергнуть случайность находок таких синцитиальных анастомозов, следовало проанализировать результаты многочисленных монографий знаменитых исследователей мозга – Рамон-и-Кахаля и его сторонников, отрицавших возможность межнейронных цитоплазматических связей. В результате, мы стремились обосновать возможность существования и в нервной системе не только уникальных химических синапсов, но и распространенной у всех других клеток общебиологической синцитиальной цитоплазматической связи.
МАТЕРИАЛЫ И МЕТОДЫ
Импрегнация фиксированных препаратов
Объект исследования: каудальный брыжеечный узел взрослых животных (38 собак).
При исследовании применена методика импрегнации 2%-ным раствором азотнокислого серебра по Рассказовой. Для гистологических исследований узлы брали у животных, находящихся под эфирным наркозом, чтобы предотвратить аутолиз и уменьшить время нарушения кровоснабжения ганглия. Материал, предназначенный для импрегнации, фиксировали в 12%-ном растворе нейтрального формалина. Срезы изготавливали толщиной 20–30 мкм на замораживающем микротоме. Часть срезов дополнительно обрабатывали 0.2%-ным раствором золотохлористоводородной кислоты. Названными методами выявляли гистологическую структуру ганглия: нервные клетки, их отростки, нервные волокна и межнейрональные связи.
Структурная динамика живых нейронов
Для культивирования клеток взрослых моллюсков (80 животных) использовали специальные микрокамеры. Среду для культивирования готовили на основе маточной однократной среды RPMI-1640 путем разведения ее стерильным физиологическим раствором (ммоль): 75 NaCl, 5 KCl, 2.5 CaCl2, 2.5 MgCl2. Для стерилизации среду фильтровали, пропуская ее через миллипоровые мембраны с диаметром пор 0.22 мкм с помощью Peristaltic Miniflon Pump 304 (Польша). При фильтрации среды она достигала оптимального для культивирования значения pH – 7.8. Трансмиссионная микроскопия осуществлялась с помощью инвертированного фазово–контрастного видеомикроскопа МБИ-13 (ЛОМО). Использована видеокамера DCM310 (USB2.0).
РЕЗУЛЬТАТЫ
Статическая морфология парных нейронов, соединенных комиссурами
Современная классическая нейроморфология, вслед за блестящими работами Рамон-и-Кахаля, основанными на импрегнационных методиках серебрения, исследовала многие детали строения ЦНС и ПНС (рис. 2). Эта методика открыла сущность обширной интеграционной взаимосвязи клеток нервной системы. Но ее естественным недостатком было то, что она допускала анализ только посмертных гистологических препаратов. Морфологическая функция, кинетика живых нейронов в значительной мере, поэтому, оставалась неизученной. Оказалось, что использование прижизненной фазово-контрастной микроскопии и видеосъемки открывает новые структурные и физиологические свойства препаратов. На рис. 2а, 2б, 2г четко видны толстые, одиночные, комиссурально связанные нейроны. Эти препараты никак не соответствуют предположению амитоза нейронов. Как отмечалось выше, это неподвижные фиксированные статические структуры. У них нет фигур митоза и деления клеток, реально нет движения, нет кинетики. Поэтому мы решили к прежним гистологическим препаратам присовокупить динамику поведения живых нейронов, выявленную с помощью видеосъемки, то есть, фактически, показать картину морфологической физиологии нейрона.
Рис. 2.
Комиссурально связанные нейроны фиксированного каудального брыжеечного узла нейронов собаки и живые связанные нейроны моллюска. а, г – утолщенные, одиночные комиссуры спаренных нейронов, как гипотеза незавершенного деления нейронов (амитоз); б – протоплазматические мостики спаренных нервных отростков; в – живые спаренные нейроны в культуре ткани; 1 – цитоплазматические мостики разного размера, связывающие нервные отростки; 2 – межклеточные утолщенные комиссуры; Н – тело нейрона; а, б, г – импрегнация азотнокислым серебром по Рассказовой; в – прижизненная фазово-контрастная видеомикроскопия. Oб. 40Ph, ок. 10.

Движение аксоплазмы – доказательство анастомоза
Прежде всего, оказалось, что аксоплазма – это не жидкость, а водный гель, который способен сокращаться в обе противоположные стороны одновременно (рис. 3). Следовательно, такие межклеточные отростки необходимо именовать не как комиссуры, а как интернейрональные цитоплазматические анастомозы, особые короткие, утолщенные, одиночные структуры, позволяющие току аксоплазмы смещаться вдоль нейритов и осуществлять электрофизиологическую и тинкториальную взаимосвязь клеток.
Рис. 3.
Перемещение массы аксоплазмы в двух противоположных направлениях (к соме и к концу волокна). Движение концов препарата – противоположное. a–г – стадии процесса; 1 – область адгезии волокна, образованная дополнительными клетками; 2 – медленная скорость сокращения аксоплазмы на периферическом конце препарата; 3 – варикозная деформация аксона; 4 – истончение массы аксоплазмы посередине препарата в результате движения аксоплазмы в оба конца от центральной точки адгезии. Прижизненная микроскопия. Фазовый контраст. Серийная фазовоконтрастная видеосъемка. Об. 40Ph, ок. 10.

Общебиологическое свойство адгезии и слияния живых нервных клеток
Важно продемонстрировать, что анастомозы образуются не путем амитоза, а в результате слияния волокон “конец-в-конец” (рис. 4а). Слияние “конец-в-бок” (рис. 4б) как бы блокирует видимую внешнюю регенерацию, но движение аксоплазмы продолжает перемещаться, причем в обе стороны от контакта слияния двух волокон. Как у всякой трубчатой структуры, у наших анастомозов существуют два отверстия, которые и являются дистантными синцитиальными межклеточными перфорациями.
Рис. 4.
Синцитиальное слияние нервных отростков с образованием кольцевидных анастомозов. а – слияние нервных отростков “конец-в-конец”; б – слияние нервных отростков “конец-в-бок”; 1 – отросток нейрона А; 2 – ламеллярный отросток нейрона Б; 3 – соединенные филоподии конусов роста клеток А и Б перед слиянием их ламеллярных отростков; 4 – формирующаяся единая цитоскелетная аксиальная структура, проникающая в ламеллоподии обеих клеток; 5 – поврежденный нейрон; 6 – синцитиальное образование сливающихся отростков; 7 – регенерирующие нейриты. Культура нейронов. Прижизненная видеомикроскопия. Фазовый контраст. Об. 20Ph, ок. 10.

Именно цитоплазматические слияния смежных волокон соединяют два нейрона, а анастомоз между ними, сокращаясь и впячиваясь в сомы клеток, превращается в дистантные синцитии (рис. 5).
Рис. 5.
Сближение и синцитиальное слияние нейронов в результате ретрактильной подвижности аксоплазмы их анастомозов. а – синцитиальный анастомоз сближает тела нейронов, регенерирующих отростки и общее передвижение дикариона; б – кинетика формирования дистантного синцития в результате ретракции аксоплазмы и слияния двух тел нейронов; в – слияние отростка с другим телом клетки, ретракция отростка и контакт тел двух нейронов перед слиянием; 1 – синцитиальный анастомоз двух нейронов; 2 – синцитиальная связь двух нейронов; 3 – дикарион; 4 – слияние тела в бок отростка. Культура ткани. Прижизненная видеомикроскопия. Фазовый контраст. Об. 20Ph, ок. 10.

Известно, что синцитий как самостоятельная структура существует у всех типов клеток. Но по предположению общебиологической НЕЙРОНАЛЬНОЙ ТЕОРИИ, нейроны не содержат синцитиев, что отличает их от ненервных клеток. Особенность представленного нами нервного синцития состоит в том, что он образуется у клеток с разветвленной арборизацией, поэтому мембранная адгезия чаще реализуется между нервными волокнами, а не между телами клеток. В этом уникальность описанной структуры и причина того, что она долгое время оставалась незамеченной в густых нервных сплетениях. Возможно поэтому, она не отмечена ни в монографиях нейронистов, включая Рамон-и-Кахаля, ни в трудах ретикуляристов – сторонников Камилло Гольджи.
ОБСУЖДЕНИЕ
Обоснование свойств дистантных синцитиев
Таким образом, малозаметная и безымянная, предполагаемая многими как элемент амитоза, волоконная комиссура предстает как неопознанная ранее органелла: толстый, одиночный, короткий, неветвистый сегмент нервного волокна, являющийся анастомозом, заполненным подвижной аксоплазмой, который сокращается, сближая тела нейронов вплоть до их контактов и слияния. Главным отличием этой структуры, видимо, является ее образование путем адгезии, ретракции и слияния смежных нервных отростков между собой или с телом клетки и формирование анастомоза двух дистантных мембранных фибросоматических синцитиев, связывающих электрически и тинкториально оба тела нейрона. Особенностью этой структуры является то, что она подобна электрическому синапсу, обладает крайне низким электрическим сопротивлением, проводит нервный импульс от обоих синцитиальных концов и пропускает ток в двух противоположных направлениях.
Сравнение электрических синапсов и синцитиев
Еще в 1959 г. Фёршпан и Поттер (Furshpan, Potter, 1959) физиологически доказали возможность электрической взаимосвязи между нейронами, минуя медиаторные синапсы. С тех пор, исследование электрических синапсов приобрело большую популярность (Сотников, 2019; Сергеева и др., 2020; Nagy et al., 2019; Peng et al., 2019). Было установлено увеличение численности одиночных электрических синапсов при патологии (Belousov, 2012; Belousov, Fontes, 2013). Удалось продемонстрировать также механизм превращения электрических синапсов в одиночные синцитии (Сотников, 2019). Наконец, в этой статье мы впервые попытались продемонстрировать новый биологический феномен сдвоенных дистантных синцитиальных анастомозов.
Утверждая новую структуру и ее значение для нейрона, необходимо продемонстрировать полноценное, четкое, статическое, морфологическое описание, доказать на живых нейронах механизм возможного функционирования структуры. Мы впервые попытались продемонстрировать все эти свойства предполагаемой новой структуры – дистантного анастомоза. Отсутствие всех этих условий в прошлом возможно и не позволяло реализовать и осмыслить указанную структуру необычного синцития. Основным недостатком обоснования дистантных синцитиальных межнейронных анастомозов могло считаться отсутствие доказательств значительного числа этих структур, полученных одним исследователем однотипным методом.
Неожиданные доказательства дистантных синцитиев в книгах Рамон-и-Кахаля
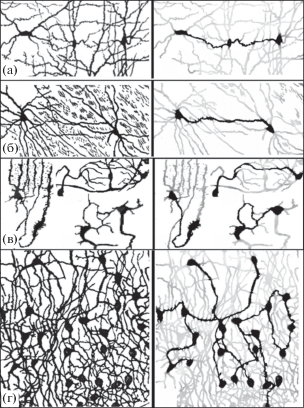
Мы считали возможным найти доказательства синцитиев при анализе многочисленных прекрасных трудов самого великого Рамон-и-Кахаля, который требовал от ретикуляристов массовости доказательства наличия цитоплазматической связи нейронов (Ramon y Cajal, 1954). Для этого, мы проанализировали иллюстрации давно опубликованных и уже неоднократно цитированных монографий Кахаля. Чтобы уменьшить естественную маскировку запутанных нервных сплетений в мозге, был использован метод демаскирования, позволяющий снизить оптическую плотность тонких второстепенных нервных ветвей, оставляя четкими только истинные, утолщенные межклеточные связи (рис. 6). Анализ каждой из 10 иллюстраций книги выявил массу, ранее скрытых в нервных сплетениях мозга, дистантных синцитиальных анастомозов, соединяющих чаще два, но иногда до пяти и более нейронов. Авторы считают, что этим методом, с помощью препаратов Кахаля, выполнено требование об убедительном количестве дистантных синцитиев в нервной системе.
Рис. 6.
Синцитиальные межнейронные анастомозы нервных препаратов из книги “Гистология нервной системы человека и позвоночных” (Ramon y Cajal, 1911), и те же демаскированные препараты с уменьшенной интенсивностью неконтактирующих арборизаций. а, б – мозг кошки; в – обонятельные нейроны и кольцевые синцитиальные анастомозы затылочного отдела мозга мыши; г – промежуточный мозг крысы. Импрегнация на основе “черной реакции” Гольджи.
ЗАКЛЮЧЕНИЕ
Наши исследования вносят существенное и важное дополнение к великой НЕЙРОННОЙ ТЕОРИИ. Впервые обнаруживаются, помимо химических и электрических синапсов, новые общебиологические структуры – дистантные двойные межклеточные синцитии аксоплазмы. Выявлено, что аксоплазма – это не жидкость, а сократимый гель, который ретрагирует в обе противоположные стороны одновременно и обязательно. Нервные сети формируются только путем синцитиального слияния отростков и тел нейронов. Нервная система – это не только рефлекторные дуги, но и ретикулярные синцитиальные сплетения. Ретикулярная концепция расширяет и углубляет нейронную теорию. Они должны рассматриваться вместе, как единая теория нервной системы.
Список литературы
Дойников Б.С. Избранные труды по нейроморфологии и нейропатологии. М.: Медгиз, 1955. 467 с.
Заварзин А.А. Очерки по эволюционной гистологии нервной системы. М.-Л.: Медгиз, 1941. 379 с.
Келликер А. Гистология или учебник о тканях человека. СПб: Типография А. Голицина, 1865. 759 с.
Лавдовский М.Д., Овсянников Ф.В. Основания к изучению микроскопической анатомии человека и животных. Т. 1. СПб: Изд-во К. Риккера, 1887. 247 с.
Сергеева С.С., Сотников О.С., Парамонова Н.М. Способ создания нейрофизиологической модели простой нервной системы, обладающей реверберацией // Рос. физиол. журн. им. И.М. Сеченова. 2020. Т. 106. № 8. С. 1–7.
Сотников О.С. Объединенная нейронно-ретикулярная теория. СПб.: Наука, 2019. 239 с.
Belousov A.B. The regulation and role of neuronal gap junctions during neuronal injury // Channels (Austin). 2012. V. 6. №5. P. 390–392.
Belousov A.B., Fontes J.D. Neuronal gap junctions: making and breaking connections during development and injury // Trends Neurosci. 2013. V. 36. № 4. P. 227–236.
Blümcke I., Wiestler O.D. Gangliogliomas: an intriguing tumor entity associated with focal epilepsies // J. Neuropathol. Exp. Neurol. 2002. V. 61. № 7. P. 575–584. https://doi.org/10.1093/jnen/61.7.575
Furshpan E.J., Potter D.D. Transmission at the giant motor synapse of the crayfish // J. Physiol. (Lond.). 1959. V. 145. P. 289—325.
Hirohata S. Histopathology of central nervous system lesions in Behçet’s disease // J. Neurol. Sci. 2008. V. 267. № 1–2. P. 41–47.https://doi.org/10.1016/j.jns.2007.09.041
Joyon N., Tauziède-Espariat A., Alentorn A. et al. K27M mutation in H3F3A in ganglioglioma grade I with spontaneous malignant transformation extends the histopathological spectrum of the histone H3 oncogenic pathway // Neuropathol. Appl. Neurobiol. 2017. V. 43. № 3. P. 271–276. https://doi.org/10.1111/nan.12329
Kawataki T., Sato E., Sato T. et al. Anaplastic ganglioglioma with malignant features in both neuronal and glial components-case report // Neurol. Med. Chir. (Tokyo). 2010. V. 50. № 3. P. 228–231.https://doi.org/10.2176/nmc.50.228
Nagy J.I., Pereda A.E., Rash J.E. On the occurrence and enigmatic functions of mixed (chemical plus electrical) synapses in the mammalian CNS // Neurosci. Lett. 2019. V. 695. P. 53–64. https://doi.org/10.1016/j.neulet.2017.09.021
Peng Y., Wang X., Guo Y. et al. Pattern of cell-to-cell transfer of microRNA by gap junction and its effect on the proliferation of glioma cells // Cancer Sci. 2019. V. 110. № 6. P. 1947–1958.https://doi.org/10.1111/cas.14029
Ramon y Cajal S. Neuron theory or reticular theory? Objective evidence of the anatomical unity of nerve cells. Madrid: Inst. Ramon y Cajal, 1954. 144 p.
Sosa J.M., Sosa H.M.S. The multiplication of nerve cells by amitotic division during extrauterine life in mammals // Acta Anat. (Basel). 1972. V. 82. № 4. P. 579–605.
Tonner F. Ein Beitrag zur Anatomie und Physiologie des Peripheren Nervensystem von Astacus Fluviatilis // Zool. Jb. (Abt. Anat.). 1933. B. 53. S. 101–152.
van Gehuchten A. La structure des centres nerveux: la moelle épinière et le cervelet // La Cellule. 1891. V. 7. P. 79–122.
Wagner R. Neurologische Untersuchungen. Göttingen: G.H. Wigand, 1854. 244 S.
Zhu S.Q., Qi L., Rui Y.F. et al. Astragaloside IV inhibits spontaneous synaptic transmission and synchronized Ca2+ oscillations on hippocampal neurons // Acta Pharmacol. Sin. 2008. V. 29. № 1. P. 57–64. https://doi.org/10.1111/j.1745-7254.2008.00712.x
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


