Успехи современной биологии, 2021, T. 141, № 5, стр. 467-482
Протеолитические ферменты мицелиальных грибов с плазминоподобной и активаторной к плазминогену активностью
А. А. Осмоловский 1, *, В. Г. Крейер 1, Н. А. Баранова 1, Н. С. Егоров 2
1 Биологический факультет Московского государственного университета им. М.В. Ломоносова
Москва, Россия
2 Международный биотехнологический центр Московского государственного университета им. М.В. Ломоносова
Москва, Россия
* E-mail: aosmol@mail.ru
Поступила в редакцию 30.01.2021
После доработки 02.02.2021
Принята к публикации 02.02.2021
Аннотация
Рассмотрен потенциал микроскопических грибов к секреции протеолитических ферментов медицинского назначения, а именно протеиназ с тромболитической, фибринолитической и активаторной к плазминогену активностью. Проанализированы и обобщены сведения о наиболее известных препаратах подобных протеиназ со времени получения первого (1959 г.) до настоящего времени. Описаны ключевые свойства подобных ферментов и препаратов, указывающие на возможность их применения в медицине.
ВВЕДЕНИЕ
В естественных условиях обитания микромицетам необходимо секретировать внеклеточные ферменты, способные разрушать сложные природные органические соединения для обеспечения себя пищевыми субстратами. Экспрессия этих ферментов регулируется в ответ на изменения окружающей среды (Шамрайчук и др., 2020; Semenova et al., 2020). Большинство внеклеточных ферментов мицелиальных грибов являются гидролазами, действующими на полисахариды, белки, липиды и нуклеиновые кислоты. Наиболее широко среди ферментов, секретируемых микромицетами, распространены протеолитические ферменты (протеиназы). Именно они играют важную роль в физиологии и росте как сапротрофных, так и патогенных видов мицелиальных грибов, обеспечивая белковое (аминный азот) питание и выступая в качестве факторов вирулентности и патогенности (Yike, 2011).
Комплекс секретируемых микромицетами протеиназ состоит из 5–12 различных ферментов, обладающих широкой субстратной специфичностью. Это свойство выгодно отличает грибы от бактерий, для которых характерен синтез небольшого числа (1–3) индивидуальных протеиназ (Ландау и др., 1998). Поэтому микромицеты способны широко использовать для питания разнообразные белковые субстраты, встречающиеся повсеместно (Павлюкова и др., 1998; Шамрайчук и др., 2020; Srilakshmi, 2014; Semenova et al., 2017, 2020). Разнообразие функций, условий секреции и действия протеиназ определяет многообразие и специфичность этих ферментов, продуцируемых микромицетами (Srilakshmi, 2014).
Протеиназы микроорганизмов составляют 60% от мирового объема продаж всех ферментов, поскольку находят практическое применение в пищевой и химической промышленности, медицине, производстве сельскохозяйственной продукции, научных исследованиях. Они более доступны по сравнению с протеиназами животного и растительного происхождения (Rao et al., 1998; Mótyán et al., 2013; De Souza et al., 2015; Dos Santos Aguilar, 2018). Ряд протеиназ применяется в медицине в качестве терапевтических средств для лечения различных заболеваний (Craik et al., 2011). Очень широко распространены исследования по поиску, получению и изучению внеклеточных протеиназ мицелиальных грибов, способных воздействовать на систему гемостаза (свертывания крови и фибринолиза) млекопитающих и человека (Peng et al., 2005; Ventakatanagaraju, Divakar, 2014; Ventakatanagaraju et al., 2014).
Одной из дисфункций системы гемостаза является накопление фибрина в кровеносных сосудах. В норме излишки фибрина устраняют компоненты фибринолитической системы. Нарушение ее регуляции тесно связано с множественными патологическими состояниями, такими как тромбоз, воспаление, прогрессирование рака и невропатии (Lin et al., 2020). Тромбоэмболические осложнения, возникающие в сердечно-сосудистой системе, являются частой причиной летальных исходов и инвалидности людей во многих странах (Ali et al., 2014; Chapin, Hajjar, 2015; Sharma et al., 2020). Поэтому актуальным остается поиск биологически активных веществ, обладающих высокой фибринолитической и антикоагулянтной активностью, и получение на их основе тромболитиков с высоким терапевтическим эффектом при лечении осложнений такого рода (Lal, 2017; Sharma et al., 2020). В связи с этим активно ведется интенсивное изучение плазминоподобных ферментов микроорганизмов, то есть протеиназ, способных, аналогично плазмину крови человека, путем прямого гидролиза фибрина растворять тромбы крови человека (Шаркова и др., 2015; Осмоловский и др., 2018; Корниенко и др., 2020; Лукьянова и др., 2020; Kotb et al., 2015). Перспективны также микробные протеиназы активаторного действия, которые посредством ограниченного протеолиза белка крови плазминогена приводят к опосредованному лизису тромба и, как следствие, восстановлению кровотока (Батомункуева, Егоров, 2001; Осмоловский и др., 2014).
Многочисленными исследованиями показано, что микромицеты могут секретировать ферменты, оказывающие воздействие на белки системы гемостаза, проявляя при этом несколько типов протеолитической активности, что делает их более доступными и дешевыми продуцентами таких ферментов, по сравнению с аналогами (Осмоловский и др., 2014, 2018; Звонарева и др., 2015; Лукьянова и др., 2020; Rashmi, Liny, 2013; Palanivel et al., 2013). Успехи в исследованиях такого рода ферментов открывают большие возможности не только в решении проблемы лизиса предобразованных сгустков крови, но и проблемы ранней и адекватной диагностики нарушений системы гемостаза человека, а, следовательно, и проблемы предотвращения тромбообразования (Kotb, 2014). Поэтому важным этапом в подобных исследованиях является направленный поиск новых продуцентов, имеющих определенные преимущества перед уже известными.
Протеиназы микромицетов фибринолитического действия, выделенные в чистом виде и охарактеризованные, отличаются по спектру протеиназной активности, по оптимальным параметрам работы и скорости расщепления тромбов. Некоторые из них показали свою перспективность в опытах in vitro (Корниенко и др., 2021; Wu et al., 2009b; Kotb et al., 2015; Afini et al., 2016; Shilpa et al., 2019), другие – доказали эффективность в in vivo-исследованиях (Подорольская и др., 2006, 2014; Wu, Xu, 2012; Da Silva et al., 2019).
МИКРОМИЦЕТЫ – ПРОДУЦЕНТЫ ПРОТЕИНАЗ ТРОМБОЛИТИЧЕСКОГО И ФИБРИНОЛИТИЧЕСКОГО ДЕЙСТВИЯ
Действие протеиназ, обладающих фибринолитической активностью, можно разделить на прямое, или плазминоподобное (непосредственный гидролиз фибрина наподобие физиологической протеиназы – плазмина), и непрямое (за счет активации профермента – плазминогена – предшественника плазмина). Эндогенные протеиназы человека и животных прямого тромболитического действия расщепляют аргинил-глициновые связи в молекуле фибрина, а ферменты, активирующие плазминоген – аргинил-валиновые связи в его молекуле (Cesarman-Maus, Hajjar, 2005).
Активация проферментов системы гемостаза происходит за счет реакции их ограниченного протеолиза. Это свойство присуще некоторым протеиназам микромицетов, что выгодно отличает их от протеиназ других микроорганизмов, в частности, бактерий.
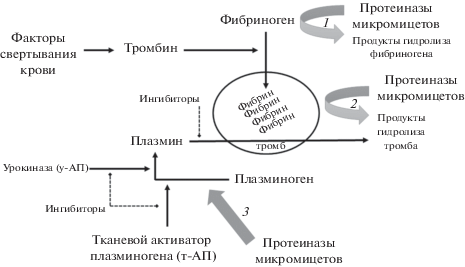
Мишени действия протеиназ мицелиальных грибов в контексте физиологических фибринолитических реакций представлены на рис. 1. Фибринолитическое звено системы гемостаза представлено проферментом плазминогеном, превращающимся в активный протеолитический фермент – плазмин, специфично расщепляющий волокна белка фибрина, составляющего основу тромба. Конверсия плазминогена в плазмин происходит под действием эндогенных протеиназ-активаторов – тканевого активатора плазминогена (т-АП) и урокиназного активатора плазминогена (у-АП, урокиназа) (Cesarman-Maus, Hajjar, 2005). Активность экзогенных протеиназ-фибринолитиков по отношению к расщепляемым ими белкам принято называть, соответственно, плазминоподобной (фибринолитической) и активаторной к плазминогену. Последняя активность в случаях, когда она уточнена, может быть подобной тканевому активатору плазминогена (т-АП-подобной) и урокиназной. Кроме того, протеиназы мицелиальных грибов способны активно расщеплять и предшественник фибрина – фибриноген, коагулируемый ключевой протеиназой системы гемостаза – тромбином. В этом случае говорят о фибриногенолитической активности. Фибриноген млекопитающих состоит из трех полипептидных цепей – Aα, Bβ и γ. Свертывание фибриногена происходит за счет специфического расщепления тромбином первых двух цепей с высвобождением фибринопептидов (A и B соответственно), а расщепление – за счет гидролиза всех цепей плазмином без образования фибринопептидов (Mosesson, 2005). Способность протеиназ гидролизовать сформированные тромбы (как молодые, свежесформированные, так и старые) называют тромболитической активностью. Регуляция функционирования фибринолитического звена системы гемостаза определяется другими белками плазмы, включая ряд ингибиторов, которые могут снижать тромболитическую активность протеиназ микромицетов непосредственно в кровотоке.
Рис. 1.
Упрощенная схема свертывания крови и фибринолиза и действие протеиназ микромицетов на ее компоненты: 1 – фибриногенолитическая активность, 2 – тромболитическая и фибринолитическая (плазминоподобная) активности, 3 – активаторная к плазминогену активность.
Микромицеты, у которых обнаружена способность синтезировать ферменты фибринолитического действия, в эколого-трофическом отношении можно разделить на несколько групп. Так, известны продуценты – сапротрофы (Шаркова и др., 2015; Abdel-Fattah, Ismail, 1983), эндофиты и фитопатогены (Егоров и др., 1971; Ahmad et al., 2014), энтомопатогены (Шаркова и др., 2015, 2016а) и нематопатогены (Шаркова и др., 2016б). По современной систематике, большинство из них относится к анаморфам аскомицетного аффинитета, хотя известны продуценты и среди зигомицетов.
Толчком, послужившим стимулом для широкого изучения микроорганизмов, образующих протеиназы фибринолитического действия, явилось сообщение британскими учеными Марио Стефанини и Гектором Марином в 1958 г. об обнаружении фибринолитической активности протеиназы, выделенной из культуры Aspergillus oryzae В-1273 (Stefanini, Marin, 1958). А через год ими с соавторами был получен первый в мире фибринолитический препарат грибного происхождения, названный Аспергиллином О (Stefanini et al., 1959). Внутривенное введение этого препарата человеку и животным вызывало лизис тромбов крови. Препарат также гидролизовал казеин, альбумин, но не действовал на гемоглобин и не обладал антигенностью. Несколько десятилетий Аспергиллин О являлся промышленным препаратом, применяемым в системе здравоохранения США и Канады (Демина, Лысенко, 1991). Спустя несколько лет подобные исследования протеолитических ферментов микромицетов стали проводить во многих странах мира: в Европе (прежде всего – в России, Великобритании, Швеции, Германии, Франции, Болгарии, Белоруссии, Чехии, Польше), Юго-Восточной Азии (прежде всего – в Японии, Китае, Индии), Северной Африке (прежде всего – в Египте), Южной Америке (прежде всего – в Бразилии).
В России первые исследования протеиназ фибринолитического действия, образуемых культурами микроскопических грибов, были начаты еще во времена СССР на кафедре микробиологии МГУ под руководством Н.С. Егорова в 1962 г. Из культуральной жидкости A. oryzae штамм МГУ был выделен и изучен фермент тромболитического действия (Кудряшов и др., 1963; Ландау, Егоров, 1965), названный Аспергиллином М (московским). Этот фермент оказался термолабильным и отличался от известной к тому времени аспергиллопептидазы В A. oryzae по оптимальному значению рН, типу действия и аминокислотному составу. Было доказано, что препарат обладал способностью лизировать искусственно вызванные у животных тромбы, причем наилучший эффект получался при совместном введении Аспергиллина М с гепарином (Струкова, Андреенко, 1965). Под влиянием Аспергиллина М происходило изменение структуры фибрина, его лизис, после чего полностью восстанавливался ток крови.
За несколько десятилетий было открыто большое число микромицетов, протеолитические ферменты которых обладают тромболитической и фибринолитической активностью (табл. 1). Они характеризуются широкой субстратной специфичностью, способностью гидролизовать не только нерастворимый фибрин, но и ряд других белковых субстратов. Определяющими перспективность применения в биомедицине протеиназ микромицетов являются оптимальные параметры их работы – температура и рН. Как видно из табл. 1, некоторые из выделенных протеиназ оказались способными проявлять фибринолитическое действие в физиологических условиях организма человека: для их активности оптимум рН составлял 7.0–8.0, а температуры – 37°C. Однако современная медицина требует еще более эффективных средств для лечения тромбозов, поэтому поиск новых продуцентов протеолитических ферментов по-прежнему актуален.
Таблица 1.
Протеолитические ферменты микромицетов и препараты на их основе с выраженной тромболитической и фибринолитической активностью
| Продуцент протеиназы | Оптимум фибринолитической активности | Расщепляемые белковые субстраты (изученные) | Коммерческое или рабочее название протеиназы | Место получения и изучения | Источник | |
|---|---|---|---|---|---|---|
| T, °C | рН | |||||
| Aspergillus oryzae B-1275 | 37 | 6.0–7.5 | Казеин, желатин, фибрин, фибриноген | Аспергиллин О | Лондон, Великобритания | Stefanini et al., 1959 |
| A. oryzae МГУ | 37 | 7.0 | Фибрин, фибриноген | Аспергиллин М | Москва, СССР | Егоров и др., 1965 |
| A. oryzae | 35–40 | 7.0–7.5 | Фибрин | СА-7 | Торонто, Канада | Ives, Tosoni, 1967 |
| A. oryzae | 37 | 7.0 | Казеин, желатин, фибрин, фибриноген | Бриназа (Бринолаза) | Сёдертелье, Швеция | Svärd, 1972 |
| A. oryzae KSK-3 | 50 | 6.0 | Фибрин, казеин | – | Нара, Япония | Shirasaka et al., 2012 |
| A. ochraceus | 37 | 7.8–8.0 | Казеин, фибрин, фибриноген | Окраза | Эрфурт, Германия | Töpfer et al., 1971 |
| A. ochraceus НР-19 | 45 | 8.5 | Казеин, фибрин, фибриноген | – | Москва, СССР | Клечковская и др., 1979 |
| A. ochraceus 513 | 50 | 8.0 | Казеин, фибрин | – | Москва, Россия | Батомункуева, Егоров, 2002 |
| A. ochraceus ВКМ F-4104D |
45 | 9.0–10.0 | Казеин, фибрин | АО-3 | Москва, Россия | Осмоловский и др., 2017 |
| A. terricola | 53 | 7.5–8.0 | Казеин, гемоглобин, фибриноген, фибрин | Террилитин | Ленинград, СССР | Селезнева, Большаков, 1986 |
| A. fumigatus CBS 113.26 | 37–42 | 9.0 | Фибриноген | – | Анжер, Франция | Larcher et al., 1992 |
| A. brasiliensis AUMC 9735 | 30 | 6.0–11.0 | Фибрин | – | Загазиг, Египет | Kotb et al., 2015 |
| A. brasiliensis BCW2 | 40 | 5.0 | БСА, овальбумин, желатин, казеин, кровяные сгустки | – | Йола, Нигерия | Chimbekujwo et al., 2020 |
| A. carbonarius S-CSR-0007 | 45 | 7.0 | Казеин, фибрин, кровяные сгустки | – | Раманаттукара, Индия | Afini et al., 2016 |
| A. kanagawaensis | 37 | 7.0 | Казеин, фибрин | Протеаза II | Москва, СССР | Ушакова и др., 1974 |
| A. ustus 1 | 41 | 6.0 | Казеин, коллаген, фибрин, эластин | – | Москва, Россия | Попова и др., 2021 |
| Fusarium semitectum | 50–60 | 7.0 | Казеин, желатин, гемоглобин, фибрин, БСА, ЧСА | – | Каир, Египет | Fayek et al., 1976 |
| Fusarium oxysporum N.R.C.1 | 37 | 7.0 | Фибрин, казеин | – | Каир, Египет | Abdel-Fattah et al., 1993 |
| Fusarium pallidoroseum | 40 | 7.0 | Фибрин, казеин | – | Александрия, Египет | El-Aassar, 1995 |
| Fusarium sp. BLB | 50 | 9.5 | Фибрин, казеин | FP | Осака, Япония | Ueda et al., 2007 |
| Fusarium sp. CPCC480097 | 45 | 8.5 | Фибриноген, фибрин | Fu-P | Шанхай, Китай | Wu et al., 2009b |
| Trichothecium roseum | 37 | 7.0 | Фибрин, фибриноген, казеин | Трихолизин (Триаза) | Москва, СССР | Степанова и др., 1976 |
| Oidiodendron flafum | 45–55 | 8.0 | Фибрин | – | Гиза, Египет | Tharwat et al., 2006 |
| Arthrobotrys longa | 37 | 6.0–9.0 | Фибрин, фибриноген, казеин | Лонголитин | Москва, Россия | Цыманович и др., 1992 |
| Sarocladium strictum 203 | 37 | 8.0 | Фибрин, фибриноген, казеин | Протеиназа III | Москва, Россия | Корниенко и др., 2021 |
| Rhizopus chinensis 12 | 45 | 10.5 | Фибрин, фибриноген, казеин | – | Тяньцзинь, Китай | Xiao-Ian et al., 2005 |
| Rhizopus microsporus var. tuberosus | 37 | 7.0 | Фибрин | – | Тяньцзинь, Китай | Zhang et al., 2015 |
| Mucor subtilissimus UCP 1262 |
40 | 9.0 | Коллаген, фибрин, кератин | – | Бразилиа, Бразилия | Nascimento et al., 2020 |
| Neurospora sitophila | 50 | 7.4 | Фибрин, фибриноген | – | Цицикар, Китай | Deng et al., 2018 |
| Cochliobolus lunatus | 40 | 6.8 | Фибрин | – | Каир, Египет | Abdel-Fattah, Ismail, 1984 |
| Scedosporium apiospermum | 37 | 9.0 | Фибриноген | – | Анже, Франция | Larcher et al., 1996 |
| Paecilomyces tenuipes | 35 | 5.0 | Фибрин, фибриноген | PTEFP | Кванджу, Корея | Kim et al., 2011 |
Активными продуцентами протеиназ тромболитического действия являются многие виды и штаммы сапротрофных и фитопатогенных плесневых грибов-аскомицетов таких родов, как Aspergillus, Fusarium, Paecilomyces. По физико-химическим свойствам внеклеточные протеиназы этих продуцентов (в большинстве описанных случаев) являются щелочными сериновыми протеиназами с молекулярными массами в пределах 14–45 кДа.
Наибольшая доля продуцентов протеиназ с фибрино- и тромболитической активностью приходится на представителей рода Aspergillus (Егоров и др., 1973; Grigorov et al., 1969). У аспергиллов в большинстве случаев выявлена корреляция между фибринолитической и тромболитической активностями (Егоров и др., 1973). Так, у культур аспергиллов, не обладающих фибринолитической активностью или имеющих незначительную фибринолитическую активность, не обнаружено и тромболитической активности. Культуры с высокой фибринолитической активностью имеют также высокую тромболитическую активность. Однако для ряда штаммов Aspergillus, не обладающих тромболитической активностью, показана высокая фибринолитическая активность. Последнее можно объяснить действием плазменных ингибиторов протеиназ, присутствующих в том числе и в тромбах. Наиболее часто штаммы аспергиллов, обладающие высокой фибринолитической активностью, встречаются среди представителей видов A. candidus, A. fumigatus, A. nidulans, A. ochraceus, A. oryzae, A. terreus (Демина, Лысенко, 1991; Ventakatanagaraju, Divakar, 2014). Из фильтрата культуральной жидкости многих из них были выделены и охарактеризованы протеолитические ферменты.
Особый интерес представляют фитопатогенные грибы родов Fusarium, Cladosporium и Alternaria (Егоров и др., 1971). Среди этих микромицетов более 80% изученных культур являются активными в отношении фибринолиза. У представителей рода Cladosporium данная активность значительно ниже, чем у других грибов. Высокая фибринолитическая активность была обнаружена у представителей рода Alternaria. Среди других продуцентов перспективных в медицинском отношении протеиназ следует считать представителей рода Fusarium. Протеиназы известных продуцентов микромицетов этого рода также демонстрируют высокую фибринолитическою активность, но отличаются от протеиназ аспергиллов по субстратной специфичности и рН-стабильности (Ueda et al., 2007; Wu et al., 2009a). Сравнительные исследования по фибринолитической активности фузариумов, аналогичные для аспергиллов, к настоящему времени не проводились, поэтому нельзя однозначно сказать о превалировании у них какого-либо одного типа активности по отношению к белкам фибринолитической системы человека.
Необходимо отметить, что величина протеолитической активности и свойства протеиназ различаются между штаммами, в том числе и среди представителей одного вида. Поэтому исследования, направленные на поиск новых протеиназ медицинского назначения имеют перспективы продолжения.
Хорошо изученными препаратами внеклеточных протеиназ микромицетов с выраженной тромболитической и фибринолитической активностью являются СА-7, террилитин, окраза, лонголитин. В последнее время были получены данные о новых протеиназах A. oryzae, A. ochraceus, A. brasiliensis, Fusarium sp., Sarocladium strictum, Mucor subtilissimus.
Первые протеолитические препараты, такие как СА-7 и Аспергиллин О, выделенный при культивировании A. oryzae, известны как стабильные, неантигенные, обладающие протеолитическими свойствами, сходными со свойствами плазмина (Ives, Tosoni, 1967; Roschlau, 1968). CA-7 эффективно лизирует венозные и артериальные тромбы. В опытах на животных было показано их ингибирование белками плазмы, однако удалось подобрать концентрации, позволяющие достигать значимого фибринолитического эффекта (Bergkvist, Svärd, 1964). На фоне введения гепарина препарат использовался в некоторых клиниках Канады и Европы в качестве тромболитического агента. Установлено, что тромболитическая активность данного препарата обратно пропорциональна концентрации СА-7-ингибитора, присутствующего в крови. Поэтому, для каждого пациента необходимо индивидуально определять ежедневную дозу СА-7 (Roschlau, 1968). Из протеолитического комплекса A. oryzae выделена еще одна протеиназа – бриназа, характеризующаяся высокой фибринолитической активностью и способностью гидролизовать казеин, желатин и частично денатурировать гемоглобин (Svärd, 1972). На фоне применения бриназы фиксировался высокий тромболизис без существенных кровотечений в качестве побочной реакции (Frisch, 1989). В 2011 г. была выделена перспетивная фибринолитическая протеиназа из другого штамма A. oryzae – KSK-3, отличающаяся от других известных фибринолитических ферментов. Молекулярная масса протеиназы составила приблизительно 30 кДа, максимальная фибринолитическая активность наблюдалась при pH 6.0 и 50°C. Протеаза была стабильна при pH от 4.0 до 9.0 при температуре до 50°C. Выделенный фермент относится к классу сериновых протеиназ. Предложено его применение в пероральной фибринолитической терапии и в качестве нутрицевтика для предупреждения развития сердечно-сосудистых заболеваний (Shirasaka et al., 2012).
Из A. terricola выделен комплекс протеолитических ферментов – Террилитин (Имшенецкий, Броцкая, 1969; Касаткина и др., 1969; Селезнева, Большакова, 1986; Zaikina et al., 1975), состоящий из трех протеиназ, отличающихся по молекулярной массе, изоэлектрическим точкам (pI), а также по некоторым энзиматическим свойствам. Два фермента (с pI 4.7 и 4.5 и молекулярными массами 26 и 22 кДа соответственно) представляют собой протеиназы серинового типа, одна (с pI 4.35 и молекулярной массой 46 кДа) относится к металлопротеиназам. Термостабильность всех трех протеиназ наблюдалась в интервалах температур до 50°C, рН-стабильность – от 5.0 до 8.0. Тромболитическую активность комплекса изучали на моделях экспериментальных венозного и артериального тромбозов. Максимальный эффект наблюдался при введении Террилитина в участок вены или артерии в непосредственной близости от тромба. Было показано, что Террилитин повышал фибринолитическую активность плазмы крови. Несмотря на высокую активность данного препарата, отсутствие специфичности и токсические свойства не позволяют применять его для лизирования тромбов in vivo при внутривенном введении. В настоящее время препарат применяется в медицине как наружное средство – для лечения ожоговых и гнойных ран.
Эффективный тромболизис демонстрируют протеолитические ферменты A. ochraceus. Сначала была выделена и детально изучена протеиназа, получившая название Окраза. Она обладала высокой тромболитической, фибринолитической и фибриногенолитической активностями in vitro и in vivo, сопоставимыми с плазмином (Klöcking, Makwardt, 1971; Teisseyre et al., 1974). Однако протеолитическая активность окразы быстро нейтрализовывалась плазматическими ингибиторами. Были подобраны концентрации окразы, которые не превышали ингибирующую способность плазмы, и условия, в которых она проявляла определенную специфичность к фибрину, вызывая тромболизис (Klöcking et al., 1981). Наибольшую активность окраза проявляла в комплексе с гепарином (Kudrjashov et al., 1976). Позднее с использованием других штаммов A. ochraceus было показано присутствие в секретоме микромицета протеолитического комплекса с несколькими протеиназами с разной специфичностью к белкам системы гемостаза человека. Так, наряду с плазминоподобной активностью, протеиназы проявляли коагулазное действие (Клечковская и др., 1979). Протеиназы A. ochraceus ВКМ F-4104D АО-1 и АО-3 c pI 5.05 и 6.83 были отнесены к классу сериновых негликозилированных протеиназ, которые проявляли сходную субстратную специфичность. Они имели близкие значения молекулярной массы (около 32 и 35 кДа) и одинаковый оптимум активности при 45°C. По своим свойствам они оказались сходными с протеиназой, активирующей антикоагулянтный профермент гемостаза – протеина С (АО-2) – основного протеолитического фермента A. ochraceus ВКМ F-4104D, однако по значению pI, величине удельной амидолитической активности, оптимуму рН и температуры, интервалу рН и температурной стабильности, по кинетическим параметрам отличались как от нее, так и друг от друга (Осмоловский и др., 2015, 2017).
Комплекс протеиназ фибринолитического действия был выявлен у A. kanagawaensis. Показано, что данный комплекс состоит из двух протеолитических ферментов: I (с незначительной фибринолитической и казеинолитической активностями) и II (с высокой фибринолитической активностью). Высокая фибринолитическая активность протеиназы II сочетается с высокой казеинолитической и тромболитической активностями (Ушакова и др., 1974).
Новая протеиназа с фибринолитическим действием была выделена из ранее не изучавшегося в этом отношении микромицета A. brasiliensis AUMC 9735. Протеиназа имела молекулярную массу 40 кДа и была стабильна в интервале pH 6–11. Очищенный фермент показал более высокую термостабильность, чем большинство фибринолитических ферментов мицелиальных грибов, со средним значением температуры (Tm) при 60.4°C и временем полужизни (t1/2) при 50–80°C, равным 672.1–6.5 мин. Активность фермента полностью нивелировалась в присутствии этилендиаминтетрауксусной кислоты (EДTA) и восстанавливалась после добавления катионов Mg2+, что свидетельствует о том, что фермент является металлопротеазой, а Mg2+ действует как кофактор (Kotb et al., 2015). Частично очищенная протеаза другого штамма – A. brasiliensis BCW2 – была стабильна при pH 4–6 и температуре 30–40°C, проявляла повышенную активность с Ca2+ (Chimbekujwo et al., 2020).
Весьма перспективными представляются и другие изучаемые в отношении тромболизиса внеклеточные протеиназы аспергиилов – A. flavus AUMC 9736 (Kotb et al., 2015), A. japonicum KGSS 05 (Yadav, Siddalingeshwara, 2016), A. ustus 1 (Попова и др., 2021).
Микромицет Fusarium oxyporum N.R.C.J. известен как один из первых продуцентов из рода Fusarium, из культуральной жидкости которого были выделены две протеиназы с фибринолитической активностью. Обе протеиназы были более активны в отношении фибрина человека, чем фибрина быка, при этом активность мажорной протеиназы была в 72 раза выше, чем активность минорной. Оба фермента имели одинаковый оптимум температуры (37°C) и pH (6.98). Минорный фермент оказался более термо- и рН-стабильным. Оба фермента значительно активировались Ca2+ и ингибировались EДTA (Abdel-Fattah et al., 1993).
Высокоактивный по отношению к человеческому фибрину препарат был получен из F. pallidoroseum. Он состоит из трех компонентов, не расщепляет желатин и слабо гидролизует казеин. Высокий температурный оптимум активности (40°C) не позволяет эффективно применять данный препарат (El-Aassar et al., 1995).
Фибринолитический фермент, образуемый Fusarium sp. CPCC 480097 и названный Fu-P, с молекулярной массой 28 кДа и pI 8.1 характеризуется способностью расщеплять Аα-цепь фибриногена с высокой эффективностью. Fu-P был идентифицирован как химотрипсин-подобная серин-металлопротеиназа. Первые 15 аминокислот N-концевой последовательности Fu-P не показали гомологии с таковыми других известных фибринолитических ферментов. Фибринолитическая и фибриногенолитическая активность протеиназы была выше, чем активность урокиназы. Эта протеиназа может иметь потенциальное применение в тромболитической терапии и в профилактике тромбозов (Wu et al., 2009a). Исследования in vivo показали, что Fu-P значительно увеличивал время свертывания фибриногена, активировал частичное тромбинопластиновое время и тромбиновое время и не ингибировал действие тромбина и фактора Ха (Wu, Xu, 2012).
Еще одна фибринолитическая сериновая щелочная протеиназа была выделена из культуральной жидкости Fusarium sp. BLB. Она имела молекулярную массу 27 кДа и проявляла максимальную активность при pH 9.5 и 50°C. Стабильность наблюдалась в интервале pH 2.5–11.5 и при температурах до 50°С (Ueda et al., 2007).
Среди новых изолятов фузариумов, проявляющих фибринолитическую активность, определенные перспективы связаны со штаммом Fusarium sp. CSN-6 (Chandrashekhar, Hariharan, 2019).
Протеиназа тромболитического действия также была получена при культивировании одного из микромицетов Cladosporium sp. Очищенная протеиназа имела молекулярную массу около 35 кДа и проявляла максимальную активность при pH 10 при 50°C (Hariharan et al., 2018).
Фибринолитическая активность была также обнаружена у протеиназ некоторых микромицетов рода Penicillium и близких родов – Verticillium и Paecilomyces. Так, известны фибринолитические ферменты иммобилизованной культуры P. chrysogenium H9 (El-Aassar et al., 1990) и P. chrysogenium SGAD12 (Gopinath et al., 2011). Штамм Penicillium sp. BF20 рассматривается как перспективный продуцент фибрино- и фибриногенолитических протеиназ. Протеолитические ферменты этого штамма демонстрировали способность полностью расщеплять фибриноген и фибрин за 15 и 120 мин соответственно (Baggio et al., 2019). Протеиназы, выделенные из культуральной жидкости разных штаммов рода Verticillum, имели очень низкие величины фибринолитической активности, уступающие протеиназам аспергиллов (Чердынцева, Егоров, 1988).
Ряд работ по изучению синтеза протеолитических ферментов, обладающих фибринолитической активностью, проводился на Purpureocillium lilacinum (бывш. Paecilomyces lilacinus, Penicillium lilacinum) (Егоров и др., 1972; Андреева и др., 1972). Было показано, что по величине тромболитической активности протеолитические ферменты данного микромицета значительно превосходят трипсин и плазмин (Егоров и др., 1972). Протеолитические ферменты фибринолитического действия, выделенные из P. lilacium, представляют собой термолабильные металлопротеиназы с различной молекулярной массой, способные гидролизовать казеин и гемоглобин в широком диапазоне рН (от 4.0 до 11.0). Однако фибринолитическая активность ферментов полностью ингибировалась ингибиторами плазмы крови, что существенно ограничило возможность их применения.
Фибринолитический фермент энтомопатогенного гриба Paecilomyces tenuipes (PTEFP) – новая сериновая протеиназа, найденная у представителей этой группы. Она способна быстро гидролизовать Aα-цепь фибриногена человека, но не гидролизовывала Bβ- или γ-цепи, что указывало на то, что это α-фибриногеназа. PTEFP имел молекулярную массу 14 кДа и проявлял максимальную активность при 35°C и pH 5.0. Протеиназа была стабильна при pH 5.0–8.0 и ниже 40°C. Ионы Ca2+ усиливали активность фермента, а ионы Zn2+ – ингибировали ее (Kim et al., 2011).
У некоторых видов рода Acremonium (бывш. Cephalosporium), в частности у штаммов A. sclerotigenum, были обнаружены протеолитические ферменты с высокой фибринолитической активностью (Pisano et al., 1963). Однако, стоит заметить, что данные о фибринолитических ферментах микромицетов этого рода немногочисленны, в частности, при изучении способности штаммов трех видов акремониумов при росте на восьми средах секретировать протеиназы, фибринолитическая активность не была обнаружена (Чердынцева, Егоров, 1988).
Протеиназы тромболитического и фибринолитического действия найдены и у зигомицетов. Перспективные продуценты плазминоподобных протеиназ встречаются среди представителей родов Mucor и Rhizopus.
Мицелиальный гриб Mucor subtilissimus UCP 1262 секретирует протеиназу с молекулярной массой 20 кДа и pI 4.94. Фермент представляет собой химотрипсиноподобную сериновую протеиназу, активность которой усиливается добавлением ионов Cu2+, Mg2+ и Fe2+. Максимальная фибринолитическая активность наблюдалась при 40°C. Протеиназа представляет собой новый фибринолитический фермент, который может быть использован для лечения тромбоэмболических заболеваний, таких как инсульты, легочная эмболия и тромбоз глубоких вен (Nascimento et al., 2015, 2017, 2020). Дальнейшие исследования показали, что протеиназа не разрушает цепи Aα и Bβ фибриногена человека и крупного рогатого скота, что указывает на то, что фермент действует как фибринолитический агент. В опытах на мышах на основании цитотоксического анализа, биохимических и гистоморфометрических параметров органов мышей, обработанных ферментом, сделан вывод, что этот фермент безопасен с токсикологической точки зрения и не вызывает генотоксических или мутагенных эффектов. Гемостатическая безопасность и фибриногенолитическая активность указывают на то, что эта протеаза является фибринолитическим агентом прямого действия (Da Silva et al., 2019).
Новый фибринолитический фермент, секретируемый Rhizopus chinensis 12 с молекулярной массой около 18.0 кДа и pI 8.5 способен гидролизовать фибрин и расщеплять α-, β- и γ-цепи фибриногена. Максимальная активность протеиназы была при температуре 45°C и pH 10.5. Протеиназа ингибировалась ингибиторами сериновых и металлопротеиназ. Первые 12 аминокислот N-концевой последовательности фермента не имели гомологии с фибринолитическими ферментами других микроорганизмов (Xiao-Lan et al., 2004).
Внеклеточные тромбо- и фибринолитические ферменты микромицетов разнообразны и по ряду физико-химических свойств отличаются как друг от друга, так и от других ферментов подобного рода и демонстрируют перспективность их практического применения, подтверждающуюся исследованиями на животных.
МИКРОМИЦЕТЫ – ПРОДУЦЕНТЫ ПРОТЕИНАЗ, АКТИВИРУЮЩИХ ПЛАЗМИНОГЕН
Изучение фибринолитической активности протеиназ микромицетов и их воздействия на другие компоненты системы гемостаза позволило обнаружить у некоторых штаммов способность их протеиназ к активации плазминогена (табл. 2). При этом культур, образующих только тканевые активаторы плазминогена, обнаружено не было. Данная активность сопровождалась фибринолитической активностью, что указывает на одновременное образование микромицетами нескольких протеолитических ферментов (Ландау и др., 1998). Поэтому существенным критерием, определяющим перспективность таких протеиназ можно считать долю активаторной к плазминогену активности от фибринолитической активности.
Таблица 2.
Микромицеты – продуценты протеиназ – активаторов плазминогена
| Продуцент | Доля активаторной активности от фибринолитической активности, % | Стадия разработки | Источник |
|---|---|---|---|
| Trichothecium roseum | ~25 | Пройдены клинические испытания, есть рекомендация в качестве инъекционного препарата для лечения тромбозов глубоких вен и артерий | Пленина и др., 2006 |
| Arthrobotrys longa | 50 | Пройдены доклинические испытания, препарат может быть использован в качестве перорального тромболитического средства | Подорольская и др., 2014 |
| Tolypocladium inflatum | 50 | In vitro-исследования | Шаркова и др., 2015 |
| Rhizopus microsporus var. tuberosus | ~20 | In vitro-исследования | Zhang et al., 2015 |
| Neurospora sitophila | ~20 | In vitro-исследования | Deng et al., 2018 |
| Sarocladium strictum | ~30 | In vitro-исследования | Корниенко и др., 2020 |
В конце XX в. из культуральной жидкости несовершенных грибов Trichothecium roseum и Arthrobotrys longa получены два тромболитических препарата с активаторной к плазминогену активностью – трихолизин (триаза) и лонголитин соответственно.
Трихолизин представляет собой протеиназный комплекс, состоящий из пяти компонентов. Он гидролизует фибрин, фибриноген, оказывая при этом большее сродство к фибрину, удлиняет время свертывания крови (то есть действует как антикоагулянт), активирует плазминоген, превращая его в активный фермент плазмин (Серебрякова и др., 1977). Протеиназы комплекса не отличались между собой по удельной фибринолитической активности (Степанова и др., 1976). Один из компонентов (IV) представляет собой протеиназу с молекулярной массой 26.5 кДа с оптимумом активности при температуре 37°C и оптимальным значением рН активности в пределах между 8.5 и 9.0, почти лишенную казеинолитической активности, но с высоким фибринолитическим эффектом. Остальные протеиназы имеют примерно одинаковое оптимальное значение рН активности (8.0–9.0).
Влияние трихолизина на систему свертывания крови и фибринолиз изучали в условиях in vitro. Добавление препарата к донорской или кроличьей плазме крови вызывало быстрый лизис кровяного сгустка (менее 2 ч). В экспериментах на животных было показано значительное повышение фибринолитической активности крови с отсутствием побочных токсических реакций. Уже через час после введения препарата животным отмечался выраженный фибринолиз и лизис тромбов. Препарат успешно прошел доклинические и клинические испытания. Предложено его применение в качестве лекарства для внутривенного введения при лечении тромбозов различного рода – инфаркта миокарда, ишемического инсульта, тромбофлебита (Пленина и др., 2006).
Препарат внеклеточных протеолитических ферментов, полученный из культуральной жидкости штамма А. longa Mecht. №1 получил название “Лонголитин”. Препарат обладает фибринолитической, тромболитической, эстеразной, невысокой протеолитической и активаторной по отношению к плазминогену активностями (Андреенко и др., 1983). При разделении лонголитина было выявлено 6 белковых фракций, среди которых фибринолитически активной оказалась одна. Фермент обладал pI 3.7 и молекулярной массой 28.6 кДа. Оптимальная активность была при рН 6.0–9.0 и температуре 37°С. По действию ингибиторов фермент был предварительно отнесен к протеиназам серинового типа, содержащим тиоловые группы (Цыманович и др., 1992).
Эффективность лонголитина была доказана в опытах in vitro и in vivo. Было показано выраженное сродство препарата к фибрину, а его внутривенное введение животным повышало фибринолитические и активаторные свойства плазмы и доказало его локальное действие на структуру тромбов. Увеличение количества плазмина в крови животных, получивших высокие дозы препарата, показывало способность препарата активировать плазминоген (Андреенко и др., 1984). Лонголитин был впервые предложен как тромболитический препарат для лечения тромбофлебитов и флеботромбозов, благодаря его способности проникать через эпидермис и подлежащие мягкие ткани в систему микроциркуляции и системный кровоток и вызывать адекватные физиологические и биохимические реакции (Подорольская и др., 2002).
При наружном применении лонголитин (как индивидуально, так и в смеси с гепарином) вызывает значительное ускорение тромболизиса, действуя локально на структуры тромба, и не влияет на гемостаз. Гепарин значительно ускорял процесс растворения тромбов только при совместном применении его с лонголитином. Так, лонголитин в 2 раза уменьшал время растворения тромба и в 4.5 раза увеличивал скорость тромболизиса. Совместное применение лонголитина и гепарина увеличивало в 30 раз тромболизис яремной вены по сравнению с контрольной группой. Биохимические показатели гемостаза (содержание фибриногена, фибринолитическая активность, время рекальцификации) практически не изменялись в процессе тромболизиса как в опыте, так и в контроле, что указывает на специфичность и селективность лонголитина (Подорольская и др., 2006).
Введение лонголитина в полость желудка и в полость рта крысам также продемонстрировало эффект достоверного увеличения фибринолитической и антикоагулянтной активности крови животных. Полученный эффект оказался пролонгированным, сохраняясь еще неделю после отмены препарата и создавая в организме животных благоприятный противотромботический фон, в отличие от свойственного внутривенному введению торможения фибринолиза по окончании курса применения. Таким образом, лонголитин может быть использован перорально как в лечебных, так и в профилактических целях (Подорольская и др., 2014).
Активность по типу активаторов плазминогена также была обнаружена у протеиназ микроскопичесих грибов Aspergillus foetidus, A. niger, A. repens (Чердынцева, Егоров, 1988), Purpureocillium lilacinum (бывш. Penicillium lilacium, Андреева и др., 1972), Fusarium sp. (Ландау и др., 1998; Abdel-Fattah et al., 1993) и Tolypocladium inflatum (Шаркова и др., 2016а).
Один из штаммов Rhizopus microsporus var. tuberosus секретировал протеиназу с молекулярной массой 24.5 кДа и оптимальной активностью при pH 7.0 и температуре 37°C. Фибринолитическая активность фермента усиливалась за счет Na+, Ca2+, Mg2+ и Mn2+. Напротив, ионы Zn2+ и Cu2+ частично подавляли ферментативную активность. Было показано, что фермент не только непосредственно разрушает фибрин, но также активирует плазминоген в плазмин для разложения фибрина. Результаты показывают, что чистый фермент может растворять сгусток крови и может применяться при лечении тромбоза (Zhang et al., 2015).
Среди изученных в последнее время, весьма перспективными представляются протеиназы микромицета Sarocladium strictum 203. Было обнаружено, что штамм способен секретировать протеолитические ферменты с незначительной неспецифической протеолитической активностью и выраженной фибринолитической и активаторной к плазминогену активностями (Корниенко и др., 2020). Препарат внеклеточных протеиназ S. strictum 203 состоит из трех щелочных трипсиноподобных тиолзависимых протеиназ серинового типа с различными изоэлектрическими точками 4.5, 7.2 и 11.8 и близкими значениями молекулярной массы (~35 кДа). Одна из протеиназ (протеиназа III) была негликозилированной, остальные представляли собой гликопротеины. Протеиназы различались по спектру протеолитической активности по отношению к белкам – компонентам тромбов. Предполагается, что активирующее плазминоген действие протеиназ микромицета обусловлено урокиназной активностью (Корниенко и др., 2021).
РАСПРОСТРАНЕННОСТЬ ПЛАЗМИНОПОДОБНОЙ И АКТИВАТОРНОЙ К ПЛАЗМИНОГЕНУ АКТИВНОСТЕЙ У МИКРОМИЦЕТОВ
Способность к синтезу фибринолитических ферментов как прямого направленного, так и непрямого действия распространена среди микроскопических грибов не повсеместно. Так, пример некоторых скрининговых исследований показывает, что около 2/3 исследованных культур – изолятов различных экотопов – обладают способностью к их секреции (Ландау и др., 1998; Шаркова и др., 2015).
Так, Н.С. Ландау с соавт. (Ландау и др., 1998) было установлено, что наиболее широко у мицелиальных грибов распространена общая протеолитическая (казеинолитическая) активность (выявлена у 66% исследованных культур). Фибринолитическая активность была обнаружена у 56% микромицетов при определении активности с фибрином крови человека и у 65% штаммов при определении активности с фибрином крови быка. Активаторная к плазминогену активность была выявлена у 20 и 30% исследованных штаммов, при определении активности с фибрином крови человека и быка соответственно. Таким образом, специфичность протеиназ к белкам крови животных (быка) встречается у микромицетов чаще, чем к белкам крови человека. Среди изученных микромицетов, синтезирующих протеиназы с общей протеолитической (казеинолитической) активностью, фибрин крови человека и быка могли расщеплять 70 и 71% штаммов соответственно. Подавляющее большинство микромицетов (90%), проявивших фибринолитическую активность по отношению к фибрину человека, оказалось активно и по отношению к фибрину крови быка. Было установлено, что среди штаммов микромицетов, секретирующих протеиназы с фибринолитической активностью по отношению к фибрину крови быка, число культур, протеиназы которых обладали активностью по отношению к фибрину крови человека, было меньше (78%). Активность к плазминогену крови человека и быка проявляли протеиназы с казеинолитической активностью у 25 и 36% штаммов изученных микромицетов соответственно. Среди фибринолитически активных штаммов выявлено значительное количество культур, образующих активаторные по отношению к плазминогену ферменты (34–45%). Однако среди исследованных 116 штаммов мицелиальных грибов не обнаружено ни одного, который образовывал бы только ферменты, аналогичные по действию тканевым активаторам плазминогена крови человека или быка (Ландау и др., 1998).
Т.С. Шарковой с соавт. (Шаркова и др., 2015) было показано, что лишь 26% из числа исследованных культур микромицетов из разных таксонов могут секретировать внеклеточные протеиназы, активные по отношению к фибрину. Среди изученных 83 штаммов также не было выявлено ни одного, образующего протеиназы только с активаторной к плазминогену активностью. Отмечается, что по сравнению с зигомицетами, аскомицеты оказались более активными продуцентами протеиназ фибринолитического действия. Проведенный скрининг показал, что наиболее перспективной эколого-трофической группой для поиска продуцентов фибринолитических ферментов можно считать энтомопатогенные микромицеты (Шаркова и др., 2015).
Введение в практику исследований протеолитических ферментов микромицетов фибринолитического действия хромогенных пептидных субстратов (паранитроанилидов) белков системы гемостаза для определения протеолитической активности позволило выявить различия в спектре их действия (амидолитическая активность). Так, к примеру, протеиназа Fusarium sp. BLB показала наибольшую активность по отношению к субстрату сериновых протеиназ широкого спектра и только в 5 раз меньшую – к субстрату плазмина (Sugimoto et al., 2007), а протеиназа S. strictum 203 обладала наибольшей амидолитической активностью по отношению к субстрату урокиназы и в 1.8–2.0 раза меньшей активностью к субстратам плазмина, тромбина и тканевого активатора плазминогена (Корниенко и др., 2021). Некоторые различия в амидолитической активности выявлены и у протеиназ аспергиллов. Например, протеиназа A. oryzae KSK-3 в 2 раза активнее гидролизовала субстрат тромбина, нежели субстрат плазмина или субстрат широкого спектра сериновых протеиназ (Shirasaka et al., 2012). Протеиназы A. ochraceus ВКМ F-4104D были наиболее активны по отношению к субстрату плазмина и чуть менее, – к субстрату тромбина (Осмоловский и др., 2017).
Определение субстратной специфичности внеклеточных протеиназ микромицетов по отношению к хромогенным пептидным субстратам представляется важной характеристикой, определяющей возможность направленного использования таких ферментов в медицине. В связи с этим был предложен подход к скринингу продуцентов протеиназ направленного действия, в том числе с плазминоподобной и активаторной к плазминогену активностями, базирующийся на определении в культуральной жидкости микромицетов, наряду с активностью с белковыми субстратами амидолитической активности, со специфическими хромогенными пептидными субстратами белков системы гемостаза (Osmolovskiy et al., 2018).
ЗАКЛЮЧЕНИЕ
Несмотря на существование проблемы изучения протеиназ микромицетов, активных по отношению к фибрину человека, на протяжении чуть более 60 лет она не теряет своей актуальности. Фибрин как субстрат протеолиза имеет множество способов расщепления, и места его расщепления, скорость его расщепления и величина получаемых продуктов расширяют представления не только о действии протеолитических ферментов мицелиальных грибов, но и открывают новые возможности их применения. Сведения о распространенности протеиназ, обладающих конкретными свойствами и выраженными как плазминоподобной, так и активаторной к плазминогену активностью, представляют важность для понимания эволюции протеолитических ферментов и их участия во внеклеточном пищеварении у микромицетов – изолятов различных экотопов. С медицинской точки зрения, требования, предъявляемые к ферментным препаратам микробного происхождения, очень высоки: тромболитические препараты должны обладать высокой специфичностью, эффективностью и не являться аллергенами. Действуя на белки системы гемостаза, подобные ферментные препараты не должны в осуществляемых ими реакциях образовывать токсичные для организма человека продукты и быть слишком чувствительными к плазменным ингибиторам.
Исследования последних лет, проводимые на более современном научном уровне, дают возможность получения новых препаратов протеиназ микромицетов для коррекции нарушений системы гемостаза. Изучение разных видов микромицетов позволяет найти высокоактивные штаммы, протеиназы которых способны селективно воздействовать на фибрин и плазминоген человека и других млекопитающих.
Список литературы
Андреева Н.А., Ушакова В.И., Егоров Н.С. Изучение протеолитических ферментов разных штаммов Penicillium lilacium Thom в связи с их фибринолитической активностью // Микробиология. 1972. Т. 41. № 3. С. 417–421.
Андреенко Г.В., Серебрякова Т.Н., Максимова Р.А. и др. Свойства препарата фибринолитических ферментов, полученного из культуральной жидкости несовершенного гриба Arthrobotrys longa // Вестн. Моск. ун-та. Сер. 16. Биол. 1983. № 1. С. 24–28.
Андреенко Г.В., Серебрякова Т.Н., Цыманович С.Г. и др. Влияние лонголитина на фибринолиз у животных // Вестн. Моск. ун-та. Сер. 16. Биол. 1984. № 3. С. 43–47.
Батомункуева Б.П., Егоров Н.С. Выделение, очистка и разделение комплексного препарата внеклеточных протеиназ Aspergillus ochraceus 513 с фибринолитическими и антикоагулянтными свойствами // Микробиология. 2001. Т. 70. № 5. С. 602–606.
Батомункуева Б.П., Егоров Н.С. Изучение препаратов внеклеточных протеиназ грибов Aspergillus ochraceus 513 и Aspergillus alliaceus 7 dN1 // Микробиология. 2002. Т. 71. № 1. С. 56–58.
Демина Н.С., Лысенко С.В. Микроорганизмы, синтезирующие ферменты тромболитического действия // Биол. науки. 1991. № 9. С. 136–153.
Егоров Н.С., Ушакова В.И., Андреева Н.А. Выделение и изучение некоторых свойств протеолитических ферментов, образуемых Penicillium lilacinum Thom // Прикл. биохим. микробиол. 1972. Т. 8. № 6. С. 854–860.
Егоров Н.С., Ушакова В.И., Мирчинк Т.Г., Клечковская В.В. О фибринолитической и тромболитической активности плесневых грибов рода Aspergillus // Научн. докл. высш. школы. 1973. № 9. С. 103–105.
Егоров Н.С., Ушакова В.И., Никольский Л.М. О способности некоторых микроорганизмов образовывать фибринолитические вещества // ДАН СССР. 1965. Т. 165. № 1. С. 217–220.
Егоров Н.С., Ушакова В.И., Прудлов Б. Изучение образования протеолитических ферментов несовершенными грибами родов Cladosporium, Fusarium и Alternaria в связи с их фибринолитической активностью // Микробиология. 1971. Т. 40. № 4. С. 604–609.
Звонарева Е.С., Осмоловский А.А., Крейер В.Г. и др. Выявление мишеней действия внеклеточных протеаз – активаторов белков системы гемостаза, образуемых микромицетами Aspergillus ochraceus и Aspergillus terreus // Биоорг. химия. 2015. Т. 41. № 5. С. 559–564.
Имшенецкий А.А., Броцкая С.З. Селекция микроорганизмов, обладающих тромболитической активностью // Микробиология. 1969. Т. 38. № 6. С. 1043–1049.
Касаткина И.Д., Имшенецкий А.А., Броцкая С.З., Желтова Е.Д. Мутанты Aspergillus terricola, образующие протеазы с фибринолитическим действием // Микробиология. 1969. Т. 38. № 5. С. 766–774.
Клечковская В.В., Отрошко Т.А., Егоров Н.С. Протеолитические ферменты, образуемые Aspergillus ochraceus в связи с их плазмокоагулирующей и фибринолитической активностями // Микробиология. 1979. Т. 47. № 5. С. 820–826.
Корниенко Е.И., Кокаева Л.Ю., Биланенко Е.Н. и др. Sarocladium strictum – перспективный продуцент протеолитических ферментов с выраженной фибринолитической активностью // Микол. и фитопатол. 2020. Т. 54. № 3. С. 206–213.
Корниенко Е.И., Осмоловский А.А., Крейер В.Г. и др. Характеристика и свойства комплекса протеолитических ферментов тромболитического действия микромицета Sarocladium strictum // Прикл. биохим. микробиол. 2021. Т. 57. № 1. С. 46–53.
Кудряшов Б.А., Андреенко Г.В., Егоров Н.С. и др. Фибринолитические агенты, выделенные из культур некоторых сапрофитных грибов // ДАН СССР. 1963. Т. 153. № 4. С. 939–942.
Ландау Н.С., Егоров Н.С. Образование фибринолитического агента Aspergillus oryzae штамм МГУ при развитии в глубинных условиях на синтетической среде // Науч. докл. высш. школы. 1965. № 3. С. 168–172.
Ландау Н.С., Кураков А.В., Гуликова О.М. и др. Экстрацеллюлярные протеиназы микромицетов с фибринолитическими и антикоагулятными свойствами // Микробиология. 1998. Т. 67. № 2. С. 215–220.
Лукьянова А.А., Корниенко Е.И., Виган П.А. и др. Секреция микромицетами протеиназ с активностью, подобной активности белков системы гемостаза // Вестн. Моск. ун-та. Сер. 16. Биол. 2020. Т. 75. № 1. С. 37–42.
Осмоловский А.А., Звонарева Е.С., Крейер В.Г. и др. Воздействие внеклеточных протеаз микромицетов рода Aspergillus на белки системы гемостаза // Биоорг. химия. 2014. Т. 40. № 6. С. 688–694.
Осмоловский А.А., Звонарева Е.С., Крейер В.Г. и др. Секреция протеиназ с фибринолитической активностью микромицетами рода Aspergillus // Вестн. Моск. ун-та. Сер. 16. Биол. 2018. Т. 73. № 1. С. 47–51.
Осмоловский А.А., Крейер В.Г., Баранова Н.А., Егоров Н.С. Свойства внеклеточных плазминоподобных протеиназ микромицета Aspergillus ochraceus // Прикл. биохим. микробиол. 2017. Т. 53. № 4. С. 373–379.
Осмоловский А.А., Крейер В.Г., Баранова Н.А. и др. Свойства внеклеточной протеиназы – активатора протеина С плазмы крови, образуемой микромицетом Aspergillus ochraceus // Прикл. биохим. микробиол. 2015. Т. 51. № 1. С. 86–92.
Павлюкова Е.Б., Белозерский М.А., Дунаевский Я.Е. Внеклеточные протеолитические ферменты мицелиальных грибов // Биохимия. 1998. Т. 63. № 8. С. 1059–1089.
Пленина Л.В., Гаврилов О.К., Кручинский Н.Г. и др. Клинические испытания тромболитического препарата грибного происхождения – триаза // Усп. мед. микол. 2006. № 7. С. 20–21.
Подорольская Л.В., Серебрякова Т.Н., Шаркова Т.С. Действие лонголитина – тромболитического препарата из низшего сапротрофного гриба Arthtrobotris longa на фибринолиз и гемостаз у крыс при пероральном применении // Тромбоз, гемостаз и реология. 2014. Т. 4. № 60. С. 67–73.
Подорольская Л.В., Серебрякова Т.Н., Шаркова Т.С. и др. Тромболитический эффект лонголитина на модели экспериментального тромбоза у крыс и кроликов при наружном применении (потенцирующее влияние гепарина) // Вестн. Моск. ун-та. Сер. 16. Биол. 2006. № 3. С. 11–16.
Подорольская Л.В., Шаркова Т.С., Андреенко Г.В., Серебрякова Т.Н. Гемостаз и фибринолиз при наружном применении тромболитического препарата лонголитина // Вестн. Моск. ун-та. Сер. 16. Биол. 2002. № 2. С. 11–15.
Попова Е.А., Крейер В.Г., Комаревцев С.К. и др. Свойства высокоактивной в отношении фибриллярных белков внеклеточной протеиназы, образуемой микромицетом Aspergillus ustus 1 // Прикл. биохим. микробиол. 2021. Т. 57. № 2. С. 138–144.
Селезнева А.А., Большакова М.Д. Протеолитический комплекс Aspergillus terricola // Прикл. биохим. микробиол. 1986. Т. 22. № 1. С. 3–11.
Серебрякова Т.Н., Андреенко Г.В., Максимова Р.А., Степанова Ц.Н. Активаторные свойства протеиназы, образуемой культурой сапрофитного гриба Trichothecium roseum Lk. ex Fr. // Прикл. биохим. микробиол. 1977. Т. 12. № 3. С. 398–404.
Степанова Ц.Н., Максимова Р.А., Юликова Е.П. и др. Фракционирование препарата фибринолитических ферментов “Трихолизина”, образуемого Trichotecium roseum Lk. Ex Fr. на карбоксиметил-сефадексе С-50 // Прикл. биохим. микробиол. 1976. Т. 12. № 3. С. 407–410.
Струкова С.М., Андреенко Г.В. Исследования тромболитической активности аспергиллина М при экспериментальном тромбозе // Арх. патол. 1965. № 4. С. 23–29.
Ушакова В.И., Далько Л.Д., Егоров Н.С. Изучение протеазного комплекса, синтезируемого Aspergillus kanagawaensis, в связи с его фибринолитической активностью // Науч. докл. высш. школы. 1974. Т. 8. С. 93–97.
Цыманович С.А., Никандров В.Н., Максимова Р.А. и др. Физико-химические свойства тромболитического препарата лонголитина // Вопр. мед. химии. 1992. Т. 38. С. 44–45.
Чердынцева Т.А., Егоров Н.С. Образование грибами родов Aspergillus, Acremonium, Verticillum внеклеточных протеаз, свертывающих плазму крови и лизирующих кровяные сгустки // Микробиология. 1988. Т. 57. № 4. С. 574–578.
Шамрайчук И.Л., Белякова Г.А., Еремина И.М. и др. Протеолитические ферменты грибов и их ингибиторы как перспективные биоцидные средства антифунгального действия // Вестн. Моск. ун-та. Сер. 16. Биол. 2020. Т. 75. № 3. С. 123–130.
Шаркова Т.С., Матвеева Э.О., Крейер В.Г. и др. Образование протеиназ – активаторов плазминогена микроскопическим грибом Tolypocladium inflatum // Прикл. биохим. микробиол. 2016а. Т. 52. № 1. С. 38–43.
Шаркова Т.С., Корниенко Е.И., Осмоловский А.А. и др. Морфофизиологические особенности микромицета Arthrobotrys longa – продуцента протеолитического комплекса тромболитического действия лонголитин // Микробиология. 2016б. Т. 85. № 2. С. 171–176.
Шаркова Т.С., Кураков А.В., Осмоловский А.А., Матвеева Э.О. и др. Скрининг продуцентов протеиназ с фибринолитической и коллагенолитической активностями среди микромицетов // Микробиология. 2015. Т. 84. № 3. С. 316‒322.
Abdel-Fattah A.F., Ismail A.S. Production of proteolytic enzymes with special reference to fibrinolytic enzymes by fungi // Microbiol. Esp. 1983. V. 36. № 3–4. P. 59–64.
Abdel-Fattah A., Ismail A.M.S., Salch S.A. Purification and properties of two fibrinolytic enzymes from Fusarium oxysporum N.R.C.J. // Zbl. Microbiol. 1993. V. 148. № 2. P. 123–128.
Abdel-Fattah A.F., Ismail A.S. Preparation and properties of fibrinolytic enzymes produced by Cochliobolus lunnatus // Biotechnol. Bioeng. 1984. V. 26. P. 37–40.
Afini A.V.M., Sooraj S.N., Smitha K.V., Kunhi A.A.M. Production and partial characterization of fibrinolytic enzyme from a soil isolate Aspergillus carbonarius S-CSR-0007 // Int. J. Pharm. Pharm. Sci. 2016. V. 8. № 12. P. 142–148.
Ahmad M.S., Noor Z.M., Ariffin Z.Z. Isolation and identification fibrinolytic protease endophytic fungi from Hibiscus leaves in Shah Alam // Int. J. Biol. Biomol. Agric. Food. Biotech. Eng. 2014. V. 8. № 10. P. 1109–1112.
Ali M.R., Hossain M.S., Islam M.A. et al. Aspect of thrombolytic therapy: a review // Sci. World J. 2014. V. 2014. A. 586510.
Baggio L.M., Panagio L.A., Gasparin F.G.M. et al. Production of fibrinogenolytic and fibrinolytic enzymes by a strain of Penicillium sp. isolated from contaminated soil with industrial effluent // Acta Sci. Health Sci. 2019. V. 41. P. e40606.
Bergkvist R., Svärd P.O. Studies on the thrombolytic activity of a arotease from Aspergillus oryzae // Acta Physiol. Scand. 1964. V. 60. P. 363–371.
Cesarman-Maus G., Hajjar K.A. Molecular mechanisms of fibrinolysis // Brit. J. Haematol. 2005. V. 129. P. 307–321.
Chandrashekhar N., Hariharan P. Production, purification and characterization of fibrinolytic protease from Fusarium spp. CSN-6 through solid-state fermentation // Int. J. Eng. Res. Technol. 2019. V. 8. № 10. P. 192–198.
Chapin J.C., Hajjar K.A. Fibrinolysis and the control of blood coagulation // Blood Rev. 2015. V. 29. № 1. P. 17–24.
Chimbekujwo K.I., Ja’afaru M.I., Adeyemo O.M. Purification, characterization and optimization conditions of protease produced by Aspergillus brasiliensis strain BCW2 // Sci. Afr. 2020. V. 8. P. e00398.
Craik C.S., Page M.J., Madison E.L. Proteases as therapeutics // Biochem. J. 2011. V. 435. P. 1–16.
Da Silva M.M., Rocha T.A., Moura D.F. et al. Effect of acute exposure in swiss mice (Mus musculus) to a fibrinolytic protease produced by Mucor subtilissimus UCP 1262: an histomorphometric, genotoxic and cytological approach // Reg. Toxicol. Pharmacol. 2019. V. 103. P. 282–291.
De Souza P.M., De Assis Bittencourt M.L., Caprara C.C., De Freitas M. A biotechnology perspective of fungal proteases // Braz. J. Microbiol. 2015. V. 46. № 2. P. 337–346.
Deng Y., Liu X., Katrolia P., Kopparapu N.K. et al. A dual-function chymotrypsin-like serine protease with plasminogen activation and fibrinolytic activities from the GRAS fungus, Neurospora sitophila // Int. J. Biol. Macromol. 2018. V. 109. P. 1338–1343.
Dos Santos Aguilar J.G., Sato H.H. Microbial proteases: production and application in obtaining protein hydrolysates // Food Res. Int. 2018. V. 103. P. 253–262.
El-Aassar S.A. Production and properties of fibrinolytic enzyme in solid state cultures of Fusarium pallidoroseum // Biotech. Lett. 1995. V. 17. № 5. P. 943–948.
El-Aassar S.A., El-Badry H.M., Abdel-Fattah A.F. The biosynthesis of proteases with fibrinolytic activity in immobilited cultures of Penicillium chrysogenium H9 // Appl. Microbiol. Biotechnol. 1990. V. 33. P. 26–30.
Fayek K.I., Foda M.S., El Naggar M.R. Production physiology and properties of a novel fungal fibrinolytic enzyme // Zeitschr. Allgem. Mikrobiol. 1976. V. 16. № 6. P. 416–423.
Frisch E.P. Clinical pharmacology of the thrombolytic enzyme preparation brinase // Semin. Thromb. Hemost. 1989. V. 15. № 3. P. 341–346.
Gopinath S.M., Suneetha T.B., Ashwini patil G.M. Exploration of newer substrate for fibrinolytic enzyme production by solid-state fermentation using Penicillium chrysogenum SGAD12 // J. Res. Biol. 2011. V. 1. № 4. P. 242–245.
Grigorov I., Petrunova S., Velianov D. et al. Fibrinolytic and proteolytic activity of fungi of the group Aspergilleae // Izv. Mikrobiol. Inst. (Sofiia). 1969. V. 20. P. 301–310.
Hariharan P., Chandrashekhar N., Viresh Sharma A. et al. Isolation, production and purification of new thrombolytic enzyme from Cladosporium spp. // Eur. J. Biotechnol. Biosci. 2018. V. 6. № 2. P. 01–04.
Ives D.A.J., Tosony A.L. Purification of CA-7, a thrombolytic fungal protease // Can. J. Bioch. 1967. V. 45. P. 1055–1065.
Kim H.C., Choi B.-S., Sapkota K. et al. Purification and characterization of a novel, highly potent fibrinolytic enzyme from Paecilomyces tenuipes // Proc. Biochem. 2011. V. 46. № 8. P. 1545–1553.
Klöcking H.P., Markwardt F. Thrombolytic effect of a protease from Aspergillus ochraceus // Folia Haematol. Int. Mag. Klin. Morphol. Blutforsch. 1971. V. 95. № 2. P. 179–186.
Klöcking H.P., Markwardt F., Hentschel H. Studies on the fibrinolytic effect of ocrase // Acta Biol. Med. Ger. 1981. V. 40. № 9. P. 1161–1166.
Kotb E. The biotechnological potential of fibrinolytic enzymes in the dissolution of endogenous blood thrombi // Biotechnol. Prog. 2014. V. 30. № 3. P. 656–672.
Kotb E., Helal G.E.-D.A., Edries F.M. Screening for fibrinolytic filamentous fungi and enzymatic properties of the most potent producer, Aspergillus brasiliensis AUMC 9735 // Biologia. 2015. V. 70. № 12. P. 1565–1574.
Kudrjashov B.A., Liapina L.A., Klöcking H.P. Fibrinolytic properties of a heparin-ocrase complex // Folia Haematol. Int. Mag. Klin. Morphol. Blutforsch. 1976. V. 103. № 4. P. 573–582.
Lal V. Fibrinolytic drug therapy in the management of intravascular thrombosis, especially acute myocardial infarction. A review // Asian J. Pharm. Clin. Res. 2017. V. 2. A. 555593.
Larcher G., Bouchara J.-P., Annaix V., Symoens F. et al. Purification and characterization of a fibrinogenolytic serine proteinase from Aspergillus fumigatus culture filtrate // FEBS Lett. 1992. V. 308. № 1. P. 65–69.
Larcher G., Cimon B., Symoens F., Tronchin G. et al. A 33 kDa serine proteinase from Scedosporium apiospermum // Biochem. J. 1996. V. 315. P. 119–126.
Lin H., Xu L., Yu S. et al. Therapeutics targeting the fibrinolytic system // Exp. Mol. Med. 2020. V. 52. P. 367–379.
Mosesson M.W. Fibrinogen and fibrin structure and functions // J. Thromb. Haemost. 2005. V. 3. № 8. P. 1894–1904.
Mótyán J.A., Tóth F., Tőzsér J. Research applications of proteolytic enzymes in molecular biology // Biomolecules. 2013. V. 3. № 4. P. 923–942.
Nascimento T.P., Conniff A.E.S., Moura J.A.S. et al. Protease from Mucor subtilissimus UCP 1262: evaluation of several specific protease activities and purification of a fibrinolytic enzyme // An. Acad. Bras. Cienc. 2020. V. 92. № 4. P. e20200882.
Nascimento T.P., Sales A.E., Porto T.S. et al. Purification, biochemical, and structural characterization of a novel fibrinolytic enzyme from Mucor subtilissimus UCP 1262 // Bioproc. Biosyst. Eng. 2017. V. 40. № 8. P. 1209–1219.
Nascimento T.P., Sales A.E., Porto T.S. et al. Production and characterization of new fibrinolytic protease from Mucor subtillissimus UCP 1262 in solid-state fermentation // Adv. Enz. Res. 2015. V. 3. P. 81–91.
Osmolovskiy A.A., Lukianova A.A., Zvonareva E.S. et al. Combined microbiological approach to screening of producers of proteases with hemostasis system proteins activity among micromycetes // Biotechnol. Rep. 2018. V. 19. P. e00265.
Palanivel P., Ashokkumar L., Balagurunathan R. Production, purification and fibrinolytic characterization of alkaline protease from extremophilic soil fungi // Int. J. Pharm. Bio. Sci. 2013. V. 4. № 2. P. 101–110.
Peng Y., Yang X., Zhang Y. Microbial fibrinolytic enzymes: an overview of source, production, properties, and thrombolytic activity in vivo // Appl. Microbiol. Biotechnol. 2005. V. 69. P. 126–132.
Pisano M.A., Oleniacz W.S., Mason R.T. et al. Enzyme production by species of Cephalosporium // Appl. Micro-biol. 1963. V. 11. P. 111–115.
Rao M.B., Tanksale A.M., Ghate M.S., Deshpande V.V. Molecular and biotechnological aspects of microbial proteases // Microbiol. Mol. Biol. Rev. 1998. V. 62. № 3. P. 597–635.
Rashmi B.S., Liny P. Production and characterization of novel fibrinolytic enzyme from different soil fungal sp. // Int. J. Pharm. Bio. Sci. 2013. V. 4. № 3. P. 454–463.
Roschlau W. Thrombolytic therapy with CA-7, a fibrinolytic enzyme from Aspergillus oryzae // Can. Med. J. 1968. V. 98. № 16. P. 757–761.
Semenova T.A., Dunaevsky Y.E., Beljakova G.A., Belozersky M.A. Extracellular peptidases of insect-associated fungi and their possible use in biological control programs and as pathogenicity markers // Fung. Biol. 2020. V. 124. № 1. P. 65–72.
Semenova T.A., Dunaevsky Y.E., Beljakova G.A. et al. Extracellular peptidases as possible markers of fungal ecology // Appl. Soil Ecol. 2017. V. 113. P. 1–10.
Sharma C., Salem G.E.M., Sharma N. et al. Thrombolytic potential of novel thiol-dependent fibrinolytic protease from Bacillus cereus RSA1 // Biomolecules. 2020. V. 10. № 3. P. 1–23.
Shilpa H.K., Ambekar J.G., Dongre N.N., Siddalingeshwara K.G. Application of fibrinolytic enzyme from Aspergillus tamarii – in vitro studies // Eur. J. Pharm. Med. Res. 2019. V. 6. № 12. P. 560–562.
Shirakara N., Naitou M., Okamura K. et al. Purification and characterization of a fibrinolytic protease from Aspergillus oryzae KSK-3 // Mycoscience. 2012. V. 53. № 5. P. 354–364.
Srilakshmi J., Madhavi J., Lavanya S., Ammani K. Commercial potential of fungal protease: past, present and future prospects // J. Pharm. Chem. Biol. Sci. 2014. V. 2. № 4. P. 218–234.
Stefanini M., Marin H. Fibrinolysis. I. Fibrinolytic activity of extracts from non-pathogenic fungi // Proc. Soc. Exp. Biol. Med. 1958. V. 99. № 2. P. 504–507.
Stefanini M., Adamis D.M., Soardi F. et al. Purification of Aspergillin O // Lancet. 1959. V. 274. № 7100. P. 443–444.
Sugimoto S., Fujii T., Morimiya T. et al. The fibrinolytic activity of a novel protease derived from a tempeh producing fungus, Fusarium sp. BLB // Biosci. Biotechnol. Biochem. 2007. V. 71. № 9. P. 2184–2189.
Svärd P.-O. Basic biochemical and pharmacological properties of brinase // J. Clin. Pathol. 1972. V. 25. № 7. P. 633–634.
Teisseyre E., Latallo Z.S., Kopeć M. Studies on the proteolysis of fibrinogen and fibrin by Aspergillus ochraceus enzyme as compared to the action of plasmin // Folia Haematol. 1974. V. 101. № 1. P. 99–110.
Tharwat N.A. Purification and biochemical characterization of fibrinolytic enzyme produced by thermophilic fungus Oidiodendron flavum // Biotechnology. 2006. V. 5. № 2. P. 160–165.
Töpfer H., Piesche K., Schäfer G. Isolation of a fibrinolytically active protease from Aspergillus ochraceus // Folia Haematol. 1971. V. 95. № 2. P. 174–178.
Ueda M., Kubo T., Miyatake K., Nakamura T. Purification and characterization of fibrinolytic alkaline protease from Fusarium sp. BLB // Appl. Microbiol. Biotechnol. 2007. V. 74. P. 331–338.
Ventakatanagaraju E., Divakar G. An overview on microbial fibrinolytic proteases // Int. J. Pharm. Sci. Res. 2014. V. 5. № 3. P. 643–656.
Ventakatanagaraju E., Divakar G., Swetha S. Overview on fibrinolytic proteases purification strategies // Int. J. Pharm. Res. Sci. 2014. V. 2. № 3. P. 232–246.
Wu B., Xu J. Antithrombotic effect of a novel protein from Fusarium sp. CPCC 480097 in a rat model of artery-vein bypass thrombosis // Pharm. Biol. 2012. V. 50. № 7. P. 866–870.
Wu B., Wu L., Chen D., Yang Z., Luo M. Purification and characterization of a novel fibrinolytic protease from Fusarium sp. CPCC 480097 // J. Ind. Microbiol. Biotechnol. 2009a. V. 36. P. 451–459.
Wu B., Wu L., Ruan L., Ge M. et al. Screening of endophytic fungi with antithrombotic activity and identification of a bioactive metabolite from the endophytic fungal strain CPCC 480097 // Curr. Microbiol. 2009b. V. 58. P. 522–527.
Xiao-Ian L., Lian-xiang D., Fu-ping L. et al. Purification and characterization of a novel fibrinolytic enzyme from Rhizopus chinensis 12 // Appl. Microbiol. Biotechnol. 2005. V. 67. P. 209–214.
Yadav S., Siddalingeshwara K.G. Biosynthesis of clot busting fibrinolytic enzyme from Aspergillus japonicum by supplementing carbon sources // Int. J. Curr. Microbiol. App. Sci. 2016. V. 5. № 3. P. 860–864.
Yike I. Fungal proteases and their pathophysiological effects // Mycopathologia. 2011. V. 171. P. 299–323.
Zaikina N.A., Shataeva L.K., Elinov N.P., Samsonov G.V. Some properties of the protease from Aspergillus terricola // Mycopathologia. 1975. V. 56. № 3. P. 153–157.
Zhang S., Wang Y., Zhang N. et al. Purification and characterisation of a fibrinolytic enzyme from Rhizopus microsporus var. tuberosus // Food. Technol. Biotechnol. 2015. V. 53. № 2. P. 243–248.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


