Успехи современной биологии, 2021, T. 141, № 5, стр. 457-466
КОВИД-19. Клеточные и молекулярные механизмы поражения мозга
О. А. Гомазков *
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
Москва, Россия
* E-mail: oleg-gomazkov@yandex.ru
Поступила в редакцию 06.04.2021
После доработки 31.05.2021
Принята к публикации 31.05.2021
Аннотация
Наиболее распространенным клиническим проявлением COVID-19 служит двусторонняя пневмония – диффузное альвеолярное повреждение с выраженной микроангиопатией. Системная инфекция сопровождается увеличением циркулирующих в крови хемокинов и интерлейкинов, которые, проникая через гематоэнцефалический барьер, попадают в мозг. Клинические материалы свидетельствуют о поражениях головного мозга и периферической нервной системы, о нейродегенеративных и психических расстройствах. Вследствие нарушений системы церебрального эндотелия и изменений равновесия АПФ2 (ACE2) – сопряженных цитохимических процессов – развивается коагулопатия, ведущая к микротромбозам и закупорке сосудов. Обсуждается концепция “нейротропизма” SARS-CoV-2 как обоснование проникновения вируса в мозг. Инфекция может развиваться как аксональный транспорт через бульбарную зону в ольфакторную область коры мозга. Еще более распространен “гематогенный путь” вирусной трансфекции, который включает повреждения сосудистого эндотелия и нарушение защитной роли ГЭБ. Основная концепция, объясняющая механизм поражения мозга, относится к феномену нейровоспаления. Астроциты и микроглия рассматриваются как потенциальные мишени коронавируса SARS-CoV-2. Диссонанс биохимических процессов оси АПФ2/АПФ и изменения функций ангиотензиновых пептидов ведут к активации астроглии с развитием нейродеструктвных процессов при COVID-19.
ВВЕДЕНИЕ
Развитие событий, связанных с пандемией COVID-19, привело к масштабному анализу патогенеза заболевания – сложного комплекса негативных процессов. Вспышка инфекции вызвана вариантом коронавирусов группы SARS-CoV. Международный комитет по таксономии присвоил новому возбудителю официальное название SARS-CoV-2. Всемирная организация здравоохранения определила заболевание как пандемию COVID-19 (Coronavirus disease 2019).
Клинические исследования установили, что в качестве характерного проявления патогенеза COVID-19 диагностируется острое повреждение легких с инвертированной реакцией иммунных систем. Вызываемый исходно вирусной атакой цитокиновый шторм демонстрирует симптоматику провоспалительной этиологии с явлениями гемодинамической нестабильности, дисфункции многих органов тела, неврологического диссонанса.
ИСХОДНЫЕ ПРЕДСТАВЛЕНИЯ О ПАТОГЕНЕЗЕ КОВИД-19. ОБЩИЕ КЛИНИЧЕСКИЕ ПРИЗНАКИ
Принципиальным положением, которое определяет специфичность и масштабность инфекции COVID-19, оказывается совпадение химических структур, благодаря которому коронавирусы SARS-CoV-2 обладают исключительной способностью связываться с особым белком, обозначенным как “angiotensin-converting enzyme” (ACE2), или ангиотензин-превращающий фермент второго типа (АПФ2). Уровень связывания SARS-CoV-2 с АПФ2 в 10–20 раз выше, его аффинность предыдущего вирусного штамма – SARS-CoV. Новый вирус, благодаря особой структуре шипов, использует АПФ2 в качестве троянского коня для внедрения в клетку-хозяина (Tai et al., 2020). Это обстоятельство, с одной стороны, выделяет начальные этапы сложного заболевания, а с другой – определяет целевую направленность в разработке специфических вакцин в качестве блокаторов вирусов и ограничения последствий.
Связывание с АПФ2 и перенос процесса в эндосому запускают репликацию вируса в клетках легочного альвеолярного эпителия и васкулярного эндотелия. За счет очень высокого патогенного аффинитета SARS-CoV-2 нарушает естественные реакции цитоиммунного и гемоваскулярного контроля. Поскольку АПФ2 экспрессируется во многих органах человека, альвеолярные эпителиальные клетки легких оказываются первичной мишенью коронавируса. Патохимический анализ установил также локализацию фермента АПФ2 у человека в эндотелии артериальных и венозных сосудов и в артериях гладких мышц практически всех органов. Молекулы АПФ2 были обнаружены в слизистой оболочке носа, рта, желудка, кишечника и др. как первая ступень вирусной инвазии (Hamming et al., 2004). Эта информация о распространении АПФ2 свидетельствует о высокой патогенности инфекции и разнообразных манифестациях заболевания COVID-19, включая тяжелую пневмонию, полиорганные и неврологические расстройства.
Характерной чертой патогенеза COVID-19 является цитокиновый шторм с повышенными уровнями интерлейкинов IL-6 и IL-1β, фактора некроза опухоли альфа (TNF-α), хемокинового лиганда 2 (CCL2), гранулоцитарно-макрофагальнного колониестимулирующего фактора (GM-CSF). Иммунологический дистресс, приводящий к синдрому цитокинового шторма и острому респираторному синдрому, является типичным для пациентов с COVID-19. Провоцирующие клеточное воспаление цитокины, включая TNF-α, IFNγ, IL-1, IL-6, IL-18 и др., секретируются в большом количестве, образуя поле стохастического диссонанса (Kempuraj et al., 2020).
Типичными клиническими проявлениями COVID-19 служит двусторонняя пневмония – с выраженной микроангиопатией. Гиперкоагуляционный синдром, который развивается у части больных, может поражать, помимо легких, сердце, мозг, почки и другие органы. Развитие васкулярной эндотелиальной дисфункции сопровождается внутриклеточной диффузией, коагулопатией и тромбозами (Tang et al., 2020).
ЭНДОТЕЛИАЛЬНАЯ ДИСФУНКЦИЯ КАК МИШЕНЬ СИСТЕМНОГО ПОРАЖЕНИЯ ПРИ КОВИДЕ-19. КОНЦЕПЦИЯ ШТОРМ-2
Многообразие проявлений коронавирусной болезни позволяет говорить о комплексе диссонансов патохимических процессов в организме. Основной клеточной мишенью SARS-CoV-2 служит АПФ2, естественный фактор гемососудистой регуляции. Коронавирус блокирует активность фермента, нарушая баланс цитоиммунного и гемоваскулярного контроля. В нормальных физиологических условиях эту регуляторную миссию осуществляет комплекс родственных белков – АПФ и АПФ2, контролирующих синтез и активность физиологически активных пептидов – ангиотензинов и брадикинина. Специфическая акцепция коронавирусом фермента АПФ2 ведет к диссонансу гемоваскулярного контроля и множественными нарушениями в системе гемостаза. В первых публикациях по АПФ2 этот белок уже рассматривается как первичное звено патологий, вызываемых вирусными штаммами SARS (Hamming et al., 2004; Kuba et al., 2005).
Второй аспект проблемы относится к роли эндотелия – клеток, выстилающих эндоваскулярную поверхность. Поскольку основным местом локализации ферментов АПФ и АПФ2, регулирующих систему гемоваскулярного гомеостаза, служит сосудистый эндотелий, его нарушение оказывается основным местом диссонанса. Нарушение ренин-ангиотензиновой ферментной оси за счет блокирования АПФ2 и усиления негативной активности АПФ ведет к реализации прооксидативных и провоспалительных процессов на плацдарме сосудистого эндотелия.
На этом основании, с учетом клинических материалов COVID-19, сформулирована концепция ШТОРМ-2. Сущность ее относится к манифестации множественных расстройств, когда вызываемое коронавирусом SARS-CoV-2 клеточное воспаление перерастает в полиорганную дисфункцию (Гомазков, 2021). При остром течении заболевания зафиксированы проблемы в работе сердца, мозга, почек, эндокринной системы и др., выраженные как расстройства микрогемодинамики, коагулопатии, диссеминированных микротромбозов.
КОВИД-19 И ПОРАЖЕНИЯ НЕРВНОЙ СИСТЕМЫ
Сведения о неврологических осложнениях при COVID-19 свидетельствуют о поражениях головного мозга и периферической нервной системы, их локализации и сопутствующих психических расстройствах. Первые клинические публикации описывали неврологические эксцессы, выявляемые у одной трети больных, инфицированных вирусом SARS-CoV-2 (Mao et al., 2020). В течение 2020–2021 гг. число статей, посвященных неврологическим осложнениям при COVID-19, в журналах базы данных PubMed превысило две с половиной тысячи. Накапливается все больше доказательств, что SARS-CoV-2 является причиной нейроинвазии, распространяемой от периферии к мозгу (Li et al., 2020a,b).
В целом, показатели таких расстройств включали:
• поражения центральной нервной системы (ЦНС) – вестибулопатия, головная боль, изменение сознания, атаксия, судороги, нарушения мозгового кровообращения;
• поражения периферической нервной системы – обоняния, вкуса, зрения, болевые реакции;
• поражения скелетно-мышечной системы – болевые симптомы, дискомфорт двигательной активности;
• глубокие цереброваскулярные расстройства – ишемический инсульт, тромбозы венозного синуса мозга, кровоизлияния.
Структурные изменения в головном мозге подтверждены методами визуализации, которые демонстрировали морфофизиологические нарушения. По данным МРТ, через 2–4 недели после появления первичных симптомов у 60% больных выявлялись признаки острого ишемического инфаркта, тромбоза глубоких вен, множественных микрокровоизлияний и нарушений перфузии (Chougar et al., 2020). Были установлены подкорковые микрокровоизлияния, отечные неспецифические глубокие изменения белого вещества мозга (Coolen et al., 2020). Геморрагические поражения выявлялись в таламусе, медиальных височных долях и зрительных буграх (Poyiadji et al., 2020). Цитохимический анализ свидетельствовал о реактивном астроглиозе, появлении глиального фибриллярного кислого белка и наличии маркеров деструкции – белков легкой цепи нейрофиламентов и внутриаксональных повреждений (Kanberg et al., 2020).
Констатируется, что при поражении эндотелия и нарушении контроля тромбогенеза формируется патология мелких сосудов по типу воспалительной ангиопатии (васкулита). Развитие ишемии затрагивает в первую очередь мелкие перфорирующие сосуды, обеспечивающие кровоснабжение лимбических зон головного мозга (Соколова, Федин, 2020). Нейрогенное повреждение может быть вызвано мультифокальной церебральной ишемией или тромбогенезом при нарушении гематоэнцефалического барьера (ГЭБ). Изменения защитной роли ГЭБ включали отек, воспалительное повреждение эндотелия, системный васкулит и некроз клеток мозга.
Отмечается зависимость между тяжестью COVID-19 и частотой неврологических проявлений, которые включают нарушения мозгового кровообращения, острую некротизирующую энцефалопатию и синдром Гийена–Барре. Факторы, потенциально осложняющие при COVID-19 развитие неврологических патологий, включают артериальную гипертензию, сахарный диабет, хронические заболевания сердца и дыхательной системы. Особому вниманию подлежит контроль прогрессирующих неврологических заболеваний на фоне нарушений церебрального кровообращения (Гусев и др., 2020). В отдаленном периоде отмечаются нейропсихиатрические расстройства – депрессии, психоз, галлюцинации и др. (Troyer et al., 2020; Szcześniak et al., 2021). Патологоанатомическое обследование пациентов с изменениями психического статуса выявило фрагменты вируса SARS-CoV-2 в нейронах лобных долей мозга (Paniz-Mondolfi et al., 2020).
На рис. 1 (Aghagoli et al., 2020) суммированы основные мишени поражения мозга при COVID-19.
Рис. 1.
Коронавирус SARS-CoV-2 – основные мишени и этапные механизмы поражения мозга (адаптировано по: Aghagoli et al., 2020).
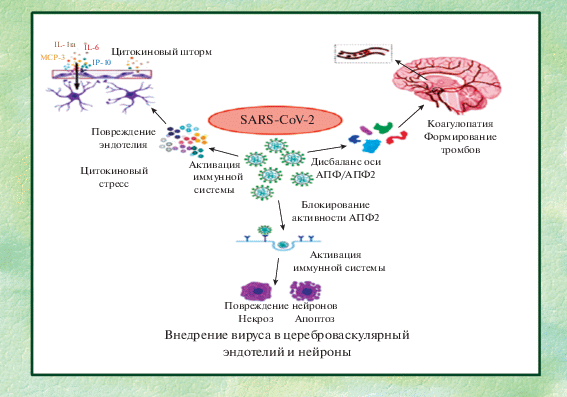
● Цитокиновый шторм, вызванный первичным действием вируса SARS-CoV-2, нарушает защитную функцию ГЭБ, приводя к проникновению агентов в мозг.
● Вследствие нарушений в эндотелии и изменений равновесия биохимической оси ангиотензиновых пептидов (АПФ2/АПФ) развивается коагулопатия, ведущая к микротромбозам и закупорке сосудов.
● Комплекс этих процессов способствует поражению нейронов как следствие астроглиального клеточного нейровоспаления.
ПРОНИКНОВЕНИЕ ВИРУСА SARS-COV-2 В МОЗГ
Нейротропизм, как биологическое понятие, рассматривается в качестве общей черты вирусной патологии, о чем свидетельствует сравнительный анализ семейства коронавирусов SARS-CoV. Нейроинвазивные агенты напрямую повреждают структуры головного мозга и периферической нервной системы в результате измененных иммунных ответов хозяина (Desforges et al., 2014). Исследования предыдущего периода, выполненные в модельных экспериментах с различными штаммами SARS-CoV, показали возможность поражения нейронов, расположенных в центрах продолговатого мозга (Netland et al., 2008). Перенося эту информацию на нынешнюю ситуацию с COVID-19, Ли с соавт. полагают, что фатальные случаи заболевания, по-видимому, связаны с нейроинвазивной дисфункцией кардиореспираторного центра головного мозга (Li et al., 2020a,b).
Однако значительный объем клинической информации свидетельствует, что поражающий потенциал CОVID-19 не обязательно ограничивается нейрореспираторными нарушениями. Важным элементом нейротропизма служит трансфекция патогенных агентов в мозг (Cardona et al., 2020). Дополнительным аргументом служит информация о широком распространении белка АПФ2 в клетках головного мозга – в стволе мозга, субфорникальной зоне, паравентрикулярном ядре, солитарном тракте, ростральной вентролатеральной области и др. По данным секвенирования РНК, белок АПФ2 экспрессируется также в коре мозга и в гиппокампе (Zeisel et al., 2015). По функциональным типам клеток, экспрессия АПФ2 (то есть мишень для связывания коронавируса) обнаружена как в возбуждающих, так и тормозных нейронах, а также в ненейронных клетках – астроцитах, олигодендроцитах (Chen et al., 2021).
Анализируя ситуацию с COVID-19, можно рассматривать различные варианты нейроинвазии структур головного мозга.
1. Инфекция через ольфакторную бульбарную зону (Mahalaxmi et al., 2021). Исследования МРТ выявили наличие вируса в эпителии носовых полостей и реснитчатых клетках пациентов на ранней фазе заболевания (Galougahi et al., 2020). Инфекция головного мозга может происходить как аксональный транспорт через обонятельный нерв, достигая ольфакторной области коры мозга и структуры височной доли (Bougakov et al., 2021). Из обонятельной луковицы SARS-CoV-2 за счет транссинаптического трафика проникает в таламус и ствол мозга. В дыхательном центре вирус вызывает респираторные нарушения в форме коллапса (Gandhi et al., 2020). Неврологические последствия инфекции SARS-CoV-2 можно объяснить выраженной центральной гипоксической дисфункцией в условиях острого респираторного дистресс-синдрома.
2. Еще более распространен так называемый гематогенный путь, который включает вызываемые коронавирусом повреждения сосудистого эндотелия и нарушение защитной целостности ГЭБ. За счет распространения белка АПФ2 в эндотелии коронавирус SARS-CoV-2 получает возможность полиорганного поражения большого сосудистого полотна (Baig et al., 2020). Взаимодействие вируса с белком АПФ2 в эндотелии капилляров может привести к поражению в форме эндотелиита (Varga et al., 2020) и таким образом облегчить проникновение вируса в мозг. Моригучи с соавт. продемонстрировали наличие осколков SARS-CoV-2 в цереброспинальной жидкости на фоне менингоэнцефалитных проявлений патогенеза COVID-19 (Moriguchi et al., 2020).
Предыдущие модельные исследования показали, что репликация вирусов в эндотелиальных клетках вызывает деградацию контактных белков, которая приводит к нарушению защитной системы ГЭБ (Verma et al., 2009; Lega et al., 2019). SARS-CoV вызывал клеточный стресс, связанный с усилением цитотоксических эффектов, и дегенерацию через механизмы апоптоза (Desforges et al., 2014). Эти предклинические данные ассоциируются с COVID-19, поскольку при патологоанатомическом исследовании было установлено наличие частиц вируса SARS-CoV-2 в эндотелии микрососудов лобной доли головного мозга (Paniz-Mondolfi et al., 2020). Поражение эндотелиальных клеток связано с экспрессией молекул адгезии (VCAM и ICAM): внедрение вируса индуцирует матричные металлопротеиназы, способствующие разрушению субклеточных контактов. Гибель эндотелиальных клеток нарушает микросреду паренхимы головного мозга, обеспечивая доступность коронавируса к другим участкам (Alquisiras-Burgos et al., 2021).
Таким образом, в качестве механизма повреждения ГЭБ при инвазии SARS-CoV-2 рассматривается следующая последовательность событий: 1) связывание вируса с белком АПФ2 на мембране эндотелиальных клеток, которое влечет массовое инфицирование клеток; 2) закрепление вируса влияет на контактность межклеточных молекул адгезии, индуцируя матричные металлопротеиназы, которые способствуют разрушению эндотелиальных структур; 3) гибель клеток эндотелия определяет доступность для вируса SARS-CoV-2 других участков головного мозга.
НЕЙРОВОСПАЛЕНИЕ КАК ВЕДУЩИЙ КЛЕТОЧНО-МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ ПОРАЖЕНИЙ ПРИ КОВИД-19
В предыдущих исследованиях вирусов группы SARS-CoV было установлено, что нарушение целостности ГЭБ при респираторной атаке может быть обусловлено цитотоксическим механизмом с индукцией апоптоза (Desforges et al., 2014). ГЭБ играет роль регуляторного посредника между ЦНС и иммунной системой мозга. В качестве обобщающей причины поражения рассматривается процесс нейровоспаления, когда развивается диссонанс защитных механизмов (Erickson et al., 2012). При исследовании острого респираторного синдрома, вызванного предыдущими штаммами коронавируса SARS, выявлено, что монокины, индуцированные IFNγ, экспрессируются в мезенхиме мозга в глиоцитах с инфильтрацией моноцитов/макрофагов и Т-лимфоцитов (Xu et al., 2005).
Нейровоспаление. Дуальный принцип регуляции мозга
Изначально следует акцентировать внимание на роли астроглиальных клеток в большом арсенале регуляторных процессов “нормального” мозга. Современные сведения позволяют рассматривать микроглию как гетерогенные популяции клеток с многообразными функциями, включая контроль паренхимы, ликвидацию апоптотических клеток и осколков фагоцитоза, а также влияние на процессы синаптической пластичности и нейрогенеза (Tremblay et al., 2011). Взаимодействие астроглии и эндотелия определяет структуру и функции ГЭБ (Da Silva et al., 2019).
Микроглиальные клетки способствуют ремоделированию (по сути, упорядочению) среды нейронов, участвуя в ликвидации “изношенных” структур (обломков клеток, синапсов, органелл и др.), способствуя развитию и выживанию нейронов. Астроциты отвечают за формирование синапсов как ключевых компонентов нейротрансмиттерной функции. Отмечается сигнальная роль трансформирующего ростового фактора TGF-β в индуцированном астроцитами синаптогенезе клеток коры (Diniz et al., 2012). Суммированы сведения о регуляции астроцитами высших психических функций, включая память и социальное поведение (Гомазков, 2019).
В то же время большая часть литературы ассоциирует астроглиальные клетки с понятием “нейровоспаления”, которое традиционно понимается как участие в негативных (патогенетических) процессах (Bentivoglio et al., 2011). Реактивные глиальные клетки обладают двойственным фенотипом нейротоксического или нейропротективного характера, в зависимости от инфекционных стимулов, патофизиологического состояния, возраста пациента (Pekny et al., 2016). Острое нейровоспаление развивается как системный процесс гиперэкспрессии молекул иммунной защиты, дисфункции эндотелиальных клеток, повреждения структур мозга (Matias et al., 2019).
По данным лабораторных исследований, первичные неврологические нарушения при COVID-19 описываются как “синдром высвобождения цитокинов” (Moore, June, 2020). Нейровоспалительные реакции развиваются как следствие инвертированного иммунного ответа при участии цитокинов IL-1β, IL-6, TNF-α, хемокинов CCL2, CCL5, CXCL1, вторичных сигнальных посредников (NO), реактивных форм кислорода. Многие из упомянутых медиаторов воспаления вырабатываются реактивными клетками астроглии (Norden et al., 2016).
Констатируя дуальный принцип нейровоспаления, Ди Сабато с соавт. (Di Sabato et al., 2016) разделяют проадаптивные (защитные, физиологические) и маладаптивные (негативные) процессы нейровоспаления, образно определяемые как “Дьявол – в деталях”. Проапоптотические пути, ведущие к образованию реактивных форм кислорода и ликвидации клеточных структур, опосредуются включением сигнальных молекул, синтезируемых астроглией. Один из них – ядерный фактор транскрипции NF-κB регулирует активность молекул воспаления, которые ассоциируются с нейродегенеративными заболеваниями (Shabab et al., 2017).
Результаты предшествующих экспериментальных исследований свидетельствуют, что нейровирулентность SARS-CoV коррелирует со способностью индуцировать провоспалительные сигналы цитокинов. Вирусы с различной нейровирулентностью провоцируют активацию цитокинов IL-12, p40, TNF-α и др., как в астроцитах, так и в микроглии головного и спинного мозга (Li et al., 2004). При регулируемой активации микроглии и Toll-подобных рецепторов распознавания патогенов происходит трансформация астроцитов в провоспалительные и пронейродегенеративные клетки мозга (Rosciszewski et al., 2018).
Астроциты и механизмы нейродегенерации при COVID-19
Астроциты и микроглия рассматриваются как потенциальные мишени инвазии SARS-CoV-2 (Vargas, Geraldo, 2020). Комплекс клинических материалов позволяет считать, что активированная микроглия во время периферического цитокинового шторма может быть вовлечена в неврологические проявления заболевания. При анализе тяжелых случаев COVID-19 установлено, что системная инфекция сопровождается увеличением циркулирующих в крови хемокинов и интерлейкинов, которые, проникая через ГЭБ, попадают в мозг. Функция иммунных и глиальных клеток имеет решающее значение для определения неврологического повреждения и исхода заболевания (Tremblay et al., 2020). Острый нейровоспалительный ответ включает активацию резидентных тканевых макрофагов в ЦНС и последующее высвобождение цитокинов и хемокинов, связанных с активацией окислительного стресса и отсроченным повреждением нейронов. Заслуживает внимания избирательное применение терапевтических средств, обладающих опосредованным противовоспалительным и противовирусным эффектами (Путилина, Гришин, 2020).
Биохимический анализ плазмы крови пациентов COVID-19 тяжелых и умеренных случаев демонстрировал увеличение уровня биомаркеров повреждения, таких как GFAP (глиальный фибриллярный кислый белок) и NfL (белок легкой цепи нейрофиламента), что свидетельствует об активации астроцитов и повреждении нейронов (Kanberg et al., 2020). При экстремальной активации глиальных клеток нейрональные повреждения могут относиться как к локальным синаптическим элиминациям, так и к апоптотической деструкции самих нейронов. Эти явления ведут к дисбалансу синаптических процессов в мозге (Garber et al., 2019).
Эта линия рассуждений позволила сделать вывод, что реактивный фенотип микроглии может быть ведущей причиной нейродегенеративных расстройств при патологии COVID-19. Провоспалительное праймирование (предварение) микроглии при инфекции SARS-CoV-2 усиливает симптоматику предыдущих заболеваний пациента.
Диссонанс ангиотензиновой системы и нейровоспаление
Представление ренин-ангиотензиновой системы является отдельной темой в анализе патогенеза COVID-19. Комплекс биохимических процессов, начинающихся с каталитической функции фермента АПФ2 и взаимодействия фрагментов ангиотензинов с рецепторами, определяет контроль микрогемодинамики, гемотрансфузии, нейровоспаления, оксидативного стресса, апоптоза (Kangussu et al., 2020). Роль ренин-ангиотензиновой системы как звена сигнальной регуляции – гемодинамических расстройств, реакции на стрессорные и нейротоксические воздействия и особые формы социального поведения, была представлена в нашей книге (Гомазков, 1993).
Основной клеточной мишенью агрессии вируса SARS-CoV-2 служит АПФ2, естественный биохимический фактор сосудистой регуляции. Нарушение сопряженных отношений ферментных систем АПФ2/АПФ под влиянием агрессии коронавируса играет значительную роль в патогенезе COVID-19. Биохимическая роль АПФ2 и АПФ состоит в гидролизе фрагментов “большого” ангиотензина I (АНГ1–10): комбинация AПФ2 → → АНГ(1–7) → рецeптор MasR функционально противостоит оси AПФ → АНГ(1–8) → рецептор AT1R. Пептид АНГ(1–7), связываясь с MasR, потенцирует комплекс защитных реакций (рис. 2). Рецепторы MasR локализованы во многих структурах головного мозга, включая гиппокамп, миндалину, таламическое ядро, кору (Regenhardt et al., 2014).
Рис. 2.
Ренин-ангиотензиновая ось АПФ2/АПФ и баланс протективных (антиоксидантных) и провоспалительных процессов в сосудистом эндотелии. Агрессивное взаимодействие коронавируса с ферментом АПФ2 нивелирует защитную миссию, стимулирует гиперпродукцию АНГ(1–8), вызывая нарушения васкулярного гомеостаза.

Можно констатировать, что подавление коронавирусом белка АПФ2 ведет к нивелированию защитных функций конкурирующей системы и развитию нейровоспалительных ответов (Gheblawi et al., 2020). Астроциты, реагирующие на провоспалительные медиаторы, становятся факторами снижения антиоксидантной активности, также связанной с AНГ(1–7) и рецепторами MasR (Gallagher et al., 2006). С позиций фармакотерапии, поддержание активности оси АПФ2 → АНГ(1–7) → → MasR или блокирование оси AПФ → → АНГ(1–8) → AT1R может сыграть защитную роль при поражении мозга. Перспективным может быть использование непептидного агониста рецепторов и усиление сигнала MasR как протективного механизма (Santos, Ferreira, 2006).
Суммируя эти результаты, можно выстроить последовательность процессов патогенеза и поражения мозга при COVID-19. 1) Повреждение эндотелиальных клеток и нарушение защитных функций ГЭБ ведет к трансдукции провоспалительных сигналов с периферии в паренхиму мозга с активированием воспалительного ответа микроглии и астроцитов. 2) Астроциты оказываются основными исполнителями в системе нейровоспаления, поскольку при блокировании (акцепции) вирусом фермента АПФ2 микроглия стимулирует рилизинг провоспалительных цитокинов. 3) Диссонанс биохимических процессов комплекса АПФ2/АПФ и изменение соотношения ангиотензиновых пептидов провоцируют активность компонентов астроглии и нейровоспаление, ведущие к нейродеструктивным осложнениям при COVID-19.
ЗАКЛЮЧЕНИЕ
Данные предыдущих экспериментальных работ с различными штаммами коронавирусов SARS, а также клинические материалы пандемии COVID-19 предоставляют информацию о механизмах влияния на ЦНС. Можно выделить следующие положения, которые характеризуют специфику нейродеструктивных процессов.
1. Новой позицией представляется информация о нейротропности SARS-CoV-2 как обоснование трансфекции вируса и провоцирование неврологических расстройств различного генеза. “Врастание” вируса в клетки капилляров облегчает его проникновение в структуры мозга (Cardona et al., 2020).
2. “Гематогенный путь” заражения, связанный с массированным воздействием цитокинового шторма на эндотелий, может влиять на клетки микрососудов головного мозга, которые формируют ГЭБ. Присутствие вируса SARS-CoV-2 в микроциркуляторном русле предполагает контакт с АПФ2 в эндотелии различных систем, включая церебральную микрогемодинамику.
3. Активация нейровоспалительного ответа и включение реактивных клеток астроглии рассматривается как комплекс цитобиохимических процессов, балансирующих на грани “защита–повреждение”. Острое нейровоспаление развивается как процесс гиперэкспрессии молекул иммунной защиты, активации эндотелиальных клеток, повреждения структур мозга. Синдром экспрессии астроцитов служит прологом для включения механизма прооксидативного и проапоптотического влияния, поражающего структуры мозга.
4. Вследствие нарушения церебрального эндотелия и изменений равновесия АПФ2-сопряженных систем развиваются коагулопатия и тромбозы сосудов мозга. Комплекс этих процессов ведет к поражению нейронов, что в результате приводит к активированному нейровоспалению и патогенетическому влиянию астроглиальных механизмов включения апоптоза и некроза.
5. На основании анализа этой информации выявляется ступенчатый механизм поражения нейроцитохимических, иммунологических и органных систем, сплетенный в картину неврологических и психических осложнений.
Эти материалы служат обоснованием для системного применения терапевтических подходов.
● Необходимость генерализованного предупреждения инвазии коронавируса с использованием сцецифических вакцин и химических лигандов, ингибирующих коронавирус SARS-CoV-2.
● Ограничения иммунного диссонанса, цитокинового шторма, как фактора генерализации и прогрессирования заболевания.
● Восстановление нарушенного влиянием коронавируса равновесия биохимических систем АПФ2/АПФ, с реабилитацией антивоспалительных, антитромботических и антигипертензивных механизмов.
● Использование специализированной терапии поражаемых органов (сердца, мозга, эндокринной системы и др.) для поддержания функций.
● Контроль “отставленных” проявлений нейродеструктивных и психических заболеваний с учетом персонализированных особенностей пациента.
Список литературы
Гомазков О.А. Функциональная биохимия регуляторных пептидов. М.: Наука, 1993. 160 с.
Гомазков О.А. Астроциты как компоненты регуляции высших функций мозга // Нейрохимия. 2019. Т. 36 (4). С. 267–274.
Гомазков О.А. Поражение сосудистого эндотелия как ведущий механизм системной патологии COVID-19 // Успехи соврем. биол. 2021. Т. 141 (2). С. 118–127.
Гусев Е.И., Мартынов М.Ю., Бойко А.Н. и др. Новая коронавирусная инфекция (COVID-19) и поражение нервной системы: механизмы неврологических расстройств, клинические проявления, организация неврологической помощи // Журн. неврол. психиатр. 2020. Т. 120 (6). С. 7–16.
Путилина М.В., Гришин Д.В. SARS-CoV-2 (COVID-19) как предиктор нейровоспаления и нейродегенерации: потенциальные стратегии терапии // Журн. неврол. психиатр. 2020. Т. 120 (8–2). С. 58–64.
Соколова Л.П., Федин А.И. Когнитивные и вегетативные нарушения при новой коронавирусной болезни // Новости неврологии. 2020. Bып. 11 (73). www.neuronews.ru.
Aghagoli G., Gallo Marin B., Katchur N. et al. Neurological involvement in COVID-19 and potential mechanisms: a review // Neurocrit. Care. 2020. P. 1–10. https://doi.org/10.1007/s12028-020-01049-4
Alquisiras-Burgos I., Peralta-Arrieta I., Alonso-Palomares L.A. et al. Neurological complications associated with the blood-brain barrier damage induced by the inflammatory response during SARS-CoV-2 infection // Mol. Neurobiol. 2021. V. 58 (2). P. 520–535.
Baig A.M., Khaleeq A., Ali U., Syeda H. Evidence of the COVID-19 virus targeting the CNS: tissue distribution, host-virus interaction, and proposed neurotropic mechanisms // ACS Chem. Neurosci. 2020. V. 11. P. 995–998. https://doi.org/10.1021/ acschemneuro. 0c00122
Bentivoglio M., Mariotti R., Bertini G. Neuroinflammation and brain infections: historical context and current perspectives // Brain Res. Rev. 2011. V. 66 (1–2). P. 152–173.
Bougakov D., Podell K., Goldberg E. Multiple neuroinvasive pathways in COVID-19 // Mol. Neurobiol. 2021. V. 58 (2). P. 564–575. https://doi.org/10.1007/s12035-020-02152-5
Cardona C.G., Pájaro Q.L.D., Marzola Q.I.D. et al. Neuro-tropism of SARS-CoV-2: mechanisms and manifestations // J. Neurol. Sci. 2020. V. 412. P. 116824. https://doi.org/10.1016/j.jns.2020.116824
Chen R., Wang K., Yu J., Howard D. et al. The spatial and cell-type distribution of SARS-CoV-2 receptor ACE2 in human and mouse brain // Front. Neurol. 2021. V. 11. P. 573095. https://doi.org/10.3389/fneur.2020.573095
Chougar L., Shor N., Weiss N. et al. Retrospective observational study of brain magnetic resonance imaging findings in patients with acute SARS-CoV-2 infection and neurological manifestations // Radiology. 2020. V. 297 (3). P. E313–E323.
Coolen T., Lolli V., Sadeghi N. et al. Early postmortem brain MRI findings in COVID-19 non-survivors // Neurology. 2020. V. 95 (14). P. 2016–2027. https://doi.org/10.1212/wnl.0000000000010116
Da Silva S.M., Campos G.D., Gomes F.C.A., Stipursky J. Radial glia-endothelial cells’ bidirectional interactions control vascular maturation and astrocyte differentiation: impact for blood-brain barrier formation // Curr. Neurovasc. Res. 2019. V. 16 (4). P. 291–300.
Desforges M., Le Coupanec A., Stodola J.K. et al. Human coronaviruses: viral and cellular factors involved in neuroinvasiveness and neuropathogenesis // Virus Res. 2014. V. 194. P. 145–158.
Di Sabato D.J., Quan N., Godbout J.P. Neuroinflammation: the devil is in the details // J. Neurochem. 2016. V. 139. Suppl. 2. P. 136–153.
Diniz L.P., Almeida J.C., Tortelli V. et al. Astrocyte-induced synaptogenesis is mediated by transforming growth factor beta signaling through modulation of D-serine levels in cerebral cortex neurons // J. Biol. Chem. 2012. V. 287 (49). P. 41432–41445.
Erickson M.A., Dohi K., Banks W.A. Neuroinflammation: a common pathway in CNS diseases as mediated at the blood-brain barrier // Neuroimmunomodulation. 2012. V. 19 (2). P. 121–130.
Gallagher P.E., Chappell M.C., Ferrario C.M., Tallant E.A. Distinct roles for ANG II and ANG-(1–7) in the regulation of angiotensin-converting enzyme 2 in rat astrocytes // Am. J. Physiol. Cell Physiol. 2006. V. 290. P. C420–C426.
Galougahi M., Ghorbani J., Bakhshayeshkaram M. et al. Olfactory bulb magnetic resonance imaging in SARS-CoV-2-induced anosmia: the first report // Acad. Radiol. 2020. V. 27 (6). P. 892–893. https://doi.org/10.1016/j.acra.2020. 04.002
Gandhi S., Srivastava A.K., Ray U., Tripathi P.P. Is the collapse of the respiratory center in the brain responsible for respiratory breakdown in COVID-19 patients? // ACS Chem. Neurosci. 2020. V. 11 (10). P. 1379–1381.
Garber C., Soung A., Vollmer L.L. et al. T cells promote microglia-mediated synaptic elimination and cognitive dysfunction during recovery from neuropathogenic flaviviruses // Nat. Neurosci. 2019. V. 22 (8). P. 1276–1288.
Gheblawi M., Wang K., Viveiros A. et al. Angiotensin converting enzyme 2: SARS-CoV-2 receptor and regulator of the renin-angiotensin system // Circ. Res. 2020. V. 126 (10). P. 1456–1474.
Hamming I., Timens W., Bulthuis M. et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis // J. Pathol. 2004. V. 203. P. 631–637.
Kanberg N., Ashton N.J., Andersson L.M. et al. Neurochemical evidence of astrocytic and neuronal injury commonly found in COVID-19 // Neurology. 2020. P. e1754–e1759. https://doi.org/10.1212/WNL.0000000000010111
Kangussu L.M., Marzano L.A.S., Souza C.F. et al. COVID-19, mast cells, cytokine storm, psychological stress, and neuroinflammation // Neuroscientist. 2020. V. 26 (5–6). P. 402–414.
Kuba K., Imai Y., Rao S. et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury // Nat. Med. 2005. V. 11. P. 875–879.
Leda A.R., Bertrand L., Andras I.E. et al. Selective disruption of the blood-brain barrier by Zika virus // Front. Microbiol. 2019. V. 10. P. 2158. https://doi.org/10.3389/fmicb.2019.02158
Li Y., Fu L., Gonzales D.M., Lavi E. Coronavirus neurovirulence correlates with the ability of the virus to induce proinflammatory cytokine signals from astrocytes and microglia // J. Virol. 2004. V. 78 (7). P. 3398–3406.
Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients // J. Med. Virol. 2020a. V. 92 (6). P. 552—555.https://doi.org/10.1002/jmv
Li Z., Liu T., Yang N., et al. Neurological manifestations of patients with COVID-19: Potential routes of SARS-CoV-2 neuroinvasion from the periphery to the brain // Front. Med. 2020b. V. 14 (5). P. 533–541. https://doi.org/10.1007/s11684-020-0786-5
Mahalaxmi I., Kaavya J., Mohana Devi S., Balachandar V. COVID-19 and olfactory dysfunction: a possible associative approach towards neurodegenerative diseases // J. Cell Physiol. 2021. V. 236 (2). P. 763–770. https://doi.org/10.1002/jcp.29937
Mao L., Jin H., Wang M. et al. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan // JAMA Neurol. 2020. V. 77 (6). P. 683–690. https://doi.org/10.1001/jamaneurol. 2020.1127
Matias I., Morgado J., Gomes F.C.A. Astrocyte heterogeneity: impact to brain aging and disease // Front. Aging Neurosci. 2019. V. 11. P. 59. https://doi.org/10.3389/fnagi.2019.00059
Moore J.B., June C.H. Cytokine release syndrome in severe COVID-19 // Science. 2020. V. 368 (6490). P. 473–474.
Moriguchi T., Harii N., Goto J. et al. A first case of associated with SARS-Coronavirus-2 // Int. J. Infect. Dis. 2020. V. 94. P. 55–58. https://doi.org/10.1016/j.ijid.2020.03.062
Netland J., Meyerholz D.K., Moore S. et al. Severe acute respiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2 // J. Virol. 2008. V. 82 (15). P. 7264–7275.
Norden D.M., Trojanowski P.J., Villanueva E. et al. Sequential activation of microglia and astrocyte cytokine expression precedes increased Iba-1 or GFAP immunoreactivity following systemic immune challenge // Glia. 2016. V. 64 (2). P. 300–316.
Paniz-Mondolfi A., Paniz-Mondolfi A., Bryce C. et al. Central nervous system involvement by severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) // J. Med. Virol. 2020. V. 92 (7). P. 699–702.
Pekny M., Pekna M., Messing A. et al. Astrocytes: a central element in neurological diseases // Acta Neuropathol. 2016. V. 131. P. 323–345.
Poyiadji N., Shahin G., Noujaim D. et al. COVID-19-associated acute hemorrhagic necrotizing encephalopathy: CT and MRI features // Radiology. 2020. V. 296 (2). P. 201187.https://doi.org/10.1148/radiol.2020201187
Regenhardt R.W., Mecca A.P., Desland F. et al. Centrally administered angiotensin-(1–7) increases the survival of stroke-prone spontaneously hypertensive rats // Exp. Physiol. 2014. V. 99. P. 442–453.
Rosciszewski G., Cadena V., Murta V. et al. Toll-like receptor 4 (TLR4) and triggering receptor expressed on myeloid cells-2 (TREM-2) activation balance astrocyte polarization into a proinflammatory phenotype // Mol. Neurobiol. 2018. V. 55. P. 3875–3888.
Santos R.A., Ferreira A.J. Pharmacological effects of AVE 0991, a nonpeptide angiotensin-(1–7) receptor agonist // Cardiovasc. Drug Rev. 2006. V. 24 (3–4). P. 239–246.
Shabab T., Khanabdali R., Moghadamtousi S.Z. et al. Neuroinflammation pathways: a general review // Int. J. Neurosci. 2017. V. 127 (7). P. 624–633.
Szcześniak D., Gładka A., Misiak B. et al. The SARS-CoV-2 and mental health: from biological mechanisms to social consequences // Prog. Neuropsychopharm. Biol. Psych. 2021. V. 104. P. 110046. https://doi.org/10.1016/j.pnpbp.2020.110046
Tai W., He L., Zhang X. et al. Characterization of the receptor-binding domain (RBD) of 2019 novel coronavirus: implication for development of RBD protein as a viral attachment inhibitor and vaccine // Cell Mol. Immunol. 2020. V. 7. P. 613. https://doi.org/10.1038/s41423-020-0400-4
Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia // J. Thromb. Haemost. 2020. V. 18. P. 844–847.
Tremblay M.E., Madore C., Bordeleau M. et al. Neuropathobiology of COVID-19: the role for glia // Front. Cell Neurosci. 2020. V. 14. P. 592214.
Tremblay M.E., Stevens B., Sierra A. et al. The role of microglia in the healthy brain // J. Neurosci. 2011. V. 31 (45). P. 16064–16069.
Troyer E.A., Kohn J.N., Hong S. Are we facing a crashing wave of neuropsychiatric sequelae of COVID-19? Neuropsychiatric symptoms and potential immunologic mechanisms // Brain Behav. Immun. 2020. V. 87. P. 34–39. https://doi.org/10.1016/j.bbi.2020.04.027
Varga Z., Flammer A.J., Steiger P. et al. Endothelial cell infection and endotheliitis in COVID-19 // Lancet. 2020. V. 395 (10234). P. 1417–1418.
Vargas G., Geraldo L.H.M. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and glial cells: insights and perspectives // Brain Behav. Immun. Health. 2020. V. 7. P. 100127. https://doi.org/10.1016/j.bbih.2020.100127
Verma S., Lo Y., Chapagain M. et al. West Nile virus infection modulates human brain microvascular endothelial cells tight junction proteins and cell adhesion molecules: transmigration across the in vitro blood-brain barrier // Virology. 2009. V. 385 (2). P. 425–433.
Xu J., Zhong S., Liu J. et al. Detection of severe acute respiratory syndrome coronavirus in the brain: potential role of the chemokine mig in pathogenesis // Clin. Infect. Dis. 2005. V. 41 (8). P. 1089–1096.
Zeisel A., Munoz-Manchado A. B., Codeluppi S. et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq // Science. 2015. V. 347. P. 1138–1142.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


