Успехи современной биологии, 2021, T. 141, № 5, стр. 428-442
Современное понимание молекулярных механизмов адипогенеза и пластичности жировой ткани
О. П. Шатова 1, *, А. А. Заболотнева 1, А. В. Шестопалов 1, 2
1 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
2 НМИЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева
Москва, Россия
* E-mail: shatova.op@gmail.com
Поступила в редакцию 25.03.2021
После доработки 03.04.2021
Принята к публикации 03.04.2021
Аннотация
Обсуждается современное понимание гетерогенности жировой ткани и ее клеточного состава. Описываются пять основных типов адипоцитов, при этом для каждого типа идентифицированы свои подтипы и их фунциональные и морфологические особенности. Дискутируется роль метаболического и клеточного микроокружения преадипоцитов в адипогенезе, описываются его этапы и ключевые механизмы регуляции. Ведущая роль в терминальной дифференцировке преадипоцитов выделяется рецепторам, активируемым пероксисомными пролифераторами-γ, и морфогенетическим белкам костной ткани. Проводится анализ высокой пластичности адипоцитов и их способности к трансдифференцировке и дедифференцировке в другой тип клеток. Обсуждаются вопросы сенесценции и апоптоза адипоцитов, а также хронического воспаления как фактора, влияющего на нарушение адипогенеза. Высказывается мысль, что изменение скорости адипогенеза, ранняя сенесценция и апоптоз жировых клеток приводят к развитию инсулинорезистентности и метаболически нездорового ожирения.
ВВЕДЕНИЕ
В настоящее время происходит существенный пересмотр позиций в понимании биологической роли жировой ткани в организме человека. За последние десятилетия были идентифицированы и охарактеризованы различные типы адипоцитов – белые, бурые, бежевые, желтые, розовые. Стало понятным, что жировая ткань обладает высокой степенью гетерогенности даже в пределах одного жирового депо. Важной особенностью жировой ткани является ее высокая пластичность и способность жировых клеток к трансдифференцировке и дедифференцировке в другой тип клеток. При этом путь трансформации зависит не столько от характеристик самих преадипоцитов, сколько от их клеточного и метаболического микроокружения. Было обнаружено, что преадипоциты образуются из разных клеток-предшественников: так, термогенные адипоциты могут иметь миогенное (бурый тип клеток) или адипогенное (бежевый тип) происхождение. Остаются не до конца изученными механизмы адипогенеза и способы его регуляции. Ведущую роль в терминальной дифференцировке преадипоцитов отводят рецепторам, активируемым пероксисомными пролифераторами γ (PPARγ, peroxisome proliferator-activated receptors γ), морфогенетическим белкам костной ткани (ВМР, bone morphogenetic proteins), инсулину и кортизолу. Следует отметить, что фактор некроза опухоли α (ФНОα) также стимулирует адипогенез, однако при хроническом воспалении происходит подавление адипогенеза, старение адипоцитов и повышенная продукция провоспалительных цитокинов, что однозначно приводит к гибели воспаленных и гипертрофии соседних адипоцитов. Нарушение адипогенеза, преждевременное старение белых адипоцитов, изменение метаболического и клеточного микроокружения преадипоцитов и ранний апоптоз жировых клеток служат причиной развития инсулинорезистентности и метаболически нездорового ожирения.
ТИПЫ ЖИРОВОЙ ТКАНИ
В настоящее время жировая ткань классифицируется по анатомическому расположению и типу жировых клеток на четыре основных вида (Bahmad et al., 2020). Так, все жировые клетки, или адипоциты, подразделяются на: белые (95%), бурые (1–2%), бежевые (Kahn et al., 2019), розовые (Cinti et al., 2018) и желтые. Последние были не так давно идентифицированы в красном костном мозге (Suchacki et al., 2020).
Белая жировая ткань (white adipose tissues, WAT) в значительной степени гетерогенна по локализации и клеточному составу (Kahn et al., 2019). Выделяют несколько типов белой жировой ткани: висцеральную и невисцеральную, которая, в свою очередь, может быть подкожной (подкожно-жировая клетчатка) и внутрикожной (интердермальная) (Driskell et al., 2014). Внутрикожная жировая ткань участвует в заживлении ран и развитии волос (Kahn et al., 2019), тогда как подкожная жировая ткань является главной в выполнении резервно-энергетической и эндокринной функций организма (Driskell et al., 2014). К клеткам, из которых состоит белая жировая ткань, относятся: белые адипоциты, белые преадипоциты, мезенхимальные стволовые клетки (МСК), перициты, моноциты и макрофаги (Kahn et al., 2019). Висцеральная белая жировая ткань отличается от подкожной жировой ткани не только по клеточному составу, но также повышенной продукцией резистина, низкой секрецией лептина (Debette et al., 2010) и низкой чувствительностью к инсулину (Fox et al., 2007). Поэтому накопление висцерального жира согласуется с развитием метаболического синдрома (Fox et al., 2007), сахарного диабета 2-го типа (CД 2-го типа), сердечно-сосудистых заболеваний и жировой инфильтрацией печени (Speliotes et al., 2010). Также существуют и метаболические отличия: в висцеральной жировой ткани повышена скорость липолиза и образование большого количества свободных жирных кислот (СЖК) (Debette et al., 2010). Интересно отметить, что депонирование жира именно на бедрах и туловище значительно снижает риск возникновения метаболического синдрома (Fox et al., 2007), а высокая секреция лептина подкожными адипоцитами предотвращает развитие нейродегенеративных заболеваний (Debette et al., 2010). В случаях липодистрофических заболеваний у человека (например, при семейной частичной липодистрофии или при липодистрофии, вызванной антиретровирусной терапией у ВИЧ-инфицированных) наблюдается потеря белых адипоцитов подкожных жировых депо на конечностях и при этом накопление висцерального жира, в том числе в областях локализации бурой жировой ткани (Ortega-Molina et al., 2012; Enzi et al., 2015). Одновременно с этим наблюдается гипертрофия бежевой (индуцированной бурой) жировой ткани и ее замещение белой жировой тканью в дорсо-цервикальной области у ВИЧ-инфицированных пациентов (Cereijo et al., 2015). Вследствие этих явлений у больных наблюдается метаболический парадокс: липодистрофия сочетается с симптомами-спутниками ожирения – инсулинорезистентностью, гипергликемией, гепатостеатозом, гипертензией и дислипидемией (Huang-Doran et al., 2010; Grundy, 2015). Это говорит о том, что не только патологический избыток, но и недостаток жировой ткани вызывает серьезные метаболические нарушения.
Бурая жировая ткань (brown adipose tissues, BAT) локализована в шейной, подмышечной, паравертебральной и надключичной областях. Ключевая функция бурых адипоцитов заключается в их участии в адаптивном (не дрожательном) термогенезе (Rui, 2017), а также в эндокринной регуляции липогенеза и адипогенеза (Pinckard et al., 2021). Большое количество бурых адипоцитов наблюдается в детском возрасте, а при взрослении их количество уменьшается, что филогенетически объясняется поведенческой адаптацией (ношение одежды) (Rui, 2017). Кроме того, в экспериментах на животных (Sbarbati et al., 1991), а также при исследовании биопсийных проб перикаротидных шейных жировых депо у людей (Vijgen et al., 2011; Rossato, 2016) были обнаружены значительное уменьшение количества бурых адипоцитов и увеличение числа белых адипоцитов (в том числе за счет увеличения транс-дифференцировки бурой жировой ткани в белую жировую ткань), связанные со старением организмов. Следует отметить, что полное отсутствие бурой жировой ткани в организме лабораторных мышей приводит к фатальной гипотермии и является несовместимым с жизнью (Chen et al., 2019).
В настоящее время у человека описаны два вида термогенных адипоцитов: бурые и бежевые адипоциты (Rui, 2017). Так как бурые адипоциты экспрессируют существенно более высокие уровни разобщающего белка 1 (uncoupling proteins 1, UCP-1), чем бежевые адипоциты, ранее считалось, что бежевый жир играет незначительную роль в термогенезе. Однако недавние исследования продемонстрировали решающую роль бежевого жира в регуляции энергетического гомеостаза всего организма через UCP-1-независимые термогенные механизмы (Chen et al., 2019).
Важно отметить, что жировая ткань костного мозга (BМАТ, bone marrow adipose tissues) также является отдельным депо жировой ткани в организме человека (Suchacki et al., 2020) и включает в себя: конститутивную жировую ткань, локализованную в дистальных отделах костей конечностей, а также регулируемую жировую ткань, которая диффузно распределена в позвоночнике и костях проксимальных сегментов конечностей и реагирует на факторы окружающей среды (Craft et al., 2019). Жировая ткань костного мозга играет важную роль в метаболизме костной ткани и регуляции активности остеобластов (Cawthorn et al., 2017). В отличие от бурых и бежевых адипоцитов, жировая ткань костного мозга не экспрессирует UCP-1 (Craft et al., 2019). Реакции на адренергические стимулы в адипоцитах костного мозга выражены в меньшей степени, чем в белых адипоцитах (Scheller et al., 2019). Такая резистентность желтых адипоцитов в большей степени проявляется в дистальных отделах костей конечностей, где адипоциты крупнее и где они являются конститутивными. Считается, что на адренергическую чувствительность адипоцитов влияет клеточное микроокружение. Также следует отметить, что у женщин резистентность к липидно-капельному ремоделированию желтых адипоцитов ниже, чем у мужчин (Scheller et al., 2019). При голодании жировая ткань костного мозга не расходуется и при этом становится основным источником циркулирующего гормона адипонектина (Cawthorn et al., 2014).
ГЕТЕРОГЕННОСТЬ АДИПОЦИТОВ
Адипоциты даже в пределах одного вида жировой ткани являются достаточно гетерогенными клетками. Было показано, что преадипоциты белой жировой ткани с низким уровнем CD9 (мембранный белок, гликопротеин из надсемейства тетраспанинов) являются более адипогенными, тогда как преадипоциты с высоким уровнем CD9 являются более профибротическими и провоспалительными (Marcelin et al., 2017). В настоящее время с помощью метода одноклеточного транскриптомного профилирования преадипоцитов человека и мезенхимальных клеток-предшественников идентифицировано четыре подтипа жировых клеток из белой жировой ткани, включая бежевый термогенный подтип и подтип, специализированный на секреции лептина (Rojas-Rodriguez et al., 2019).
Бурая жировая ткань является гетерогенной, как и белая жировая ткань. В бурой жировой ткани выделяют бурые адипоциты с высоким и низким термогенным эффектом. Низкотермогенные адипоциты экспрессируют низкий уровень UCP-1 и адипонектина, содержат жировые капли большего размера и меньшее количество митохондрий (Song et al., 2020).
Бежевые адипоциты представлены двумя типами клеток. Это обычные бежевые адипоциты и гликолитические бежевые адипоциты (g-beige adipocytes) (Chen et al., 2019). Так, показано, что гликолитические бежевые адипоциты контролируют термогенез и гомеостаз глюкозы в отсутствие β-адренергической стимуляции, а тепловой стресс индуцирует образование данных адипоцитов из предшествующих им белых адипоцитов (Chen et al., 2019).
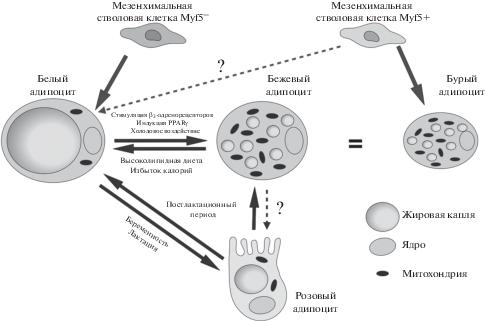
Следует отметить, что в различных жировых депо в зависимости от условий (стресс, холодовая стимуляция, избыток или недостаток калорий в пище, период лактации и т.д.) изменяется соотношение белых, бежевых и бурых адипоцитов (Ibrahim, 2010; Esteve Ràfols, 2014). За счет пластичности жировой ткани и способности адипоцитов к дифференцировке и дедиффференцировке количество и фенотип клеток непостоянны (Pellegrinelli et al., 2016) (рис. 1).
Рис. 1.
Пластичность адипоцитов. Адипоциты белой и бурой жировой тканей дифференцируются из различных мезенхимальных предшественников (Cawthorn et al., 2017; Leiva et al., 2020). В некоторых исследованиях показана возможность образования белых адипоцитов из Myf+-стволовых клеточных линий, дающих начало бурой жировой ткани (Sanchez-Gurmaches et al., 2012). Бежевые адипоциты образуются из белых адипоцитов при действии холода или адренергической стимуляции (Bozec et al., 2016). При этом фенотипически бежевые адипоциты напоминают бурые и экспрессируют одни и те же маркерные молекулы. Белые адипоциты могут трансдиффиренцироваться в альвеолярные клетки (розовые адипоциты) молочной железы во время лактации, которые, в свою очередь, могут возвращаться в исходное состояние белых жировых клеток или превращаться в бежевые адипоциты после окончания лактации (Cinti et al., 2018). Не показана, но теоретически возможна дифференцировка бежевых адипоцитов в розовые.
ПРОИСХОЖДЕНИЕ АДИПОЦИТОВ
Бурая жировая ткань развивается в процессе эмбриогенеза из мезодермы, в то время как бежевые адипоциты образуются из белых адипоцитов в постнатальном периоде. Белые преадипоциты развиваются из Myf5-негативных (Myf5, myogenic factor) клеток-предшественников, и дифференцировка белых преадипоцитов в зрелые белые адипоциты происходит, скорее всего, постнатально (Leiva et al., 2020). Так, дифференцировка белых адипоцитов в бежевые адипоциты называется ремоделированием белой жировой ткани или браунингом (Rui, 2017). Бурые и бежевые адипоциты имеют различные источники происхождения, но при этом морфологически и метаболически они очень похожи. Классические бурые адипоциты (эволюционно запрограммированные) являются производными клеток-предшественников, которые имеют происхождение из мышечной линии клеток Myf5 (Cawthorn et al., 2017). Бурые адипоциты могут быть локализованы вместе с белыми адипоцитами, например, в межлопаточной области и паранефрально. Кроме того, в результате браунинга при длительном воздействии холода или при активации β-адренергических рецепторов во многих депо белой жировой ткани появляются UCP-1-позитивные клетки, и данные бурые жировые клетки, которые не являются производными от Myf5-положительной линии, называются индуцибельными бежевыми или коричнево-белыми клетками (иначе brite-адипоцитами) (Bozec, Hannemann, 2016). При этом холодовая стимуляция или воздействие агонистами β3-адренорецепторов не одинаково увеличивают уровень UCP-1-позитивных клеток в различных депо белого жира – возникает так называемый “феномен Арлекина” (при иммунногистохимическом анализе на UCP-1 жировая ткань выглядит неоднородно окрашенной из-за разной степени экспрессии термогенина) (Cinti et al., 2002; Rui, 2017). Однако хроническое холодовое воздействие ослабляет этот эффект (клетки окрашиваются более равномерно), что связывают с повышением экспрессии белков теплового шока, предохраняющих адипоциты от повреждений, связанных с избыточной выработкой тепла (Morroni et al., 1995). Одновременно с этим происходит стимуляция браунинга большего количества белых адипоцитов, что позволяет более равномерно распределять продукцию тепла между клетками (Lee et al., 2015).
Следует отметить, что в некоторых исследованиях было показано происхождение белых жировых клеток из Myf5+-клеточной линии. Это указывает на высокую пластичность мезенхимальных клеток при определенных условиях (Sanchez-Gurmaches et al., 2012). Более того, путь дифференцировки в белую или бурую жировую ткань определяют не только клетки-предшественники, но и нишевые локальные факторы, образующие микроокружение преадипоцитов. Например, было показано, что донорские преадипоциты, изолированные из подкожного и висцерального депо, проходят последующую дифференцировку в соответствии с местом инъекции, а не с местом происхождения при высоколипидной диете (преадипоциты дифференцируются только в висцеральном, но не подкожном жировом депо) (Jeffery et al., 2016). Этот факт подтверждается данными недавних исследований, показывающих, что экспрессия PPARγ, стимулирующая адипогенез в культурах фибробластов, не способна инициировать адипогенез in vivo, если сама физиологическая способность к адипогенезу лимитирована (как в подкожном жировом депо или при соблюдении низколипидной диеты) (Lee et al., 2012). Все эти данные неизбежно подводят нас к вопросам о том, какие же факторы являются направляющими при дифференцировке предшественников жировых клеток, каковы источники этих факторов и как осуществляется их дифференциальная регуляция в различных жировых депо? Эти вопросы остаются нерешенными в настоящее время, а поиск ответа на них усложняется еще и тем, что не так давно с помощью метода транскриптомного профилирования отдельных клеток были обнаружены различные популяции стромальных клеток в разных жировых депо, каждая из которых состоит из субпопуляций, причем некоторые из них имеют антиадипогенное действие (Burl et al., 2018; Schwalie et al., 2018). Все это указывает на высокую гетерогенность, пластичность и зависимость от эндо- и экзогенных факторов адипоцитарных клеток. В качестве иллюстрации вышесказанного в табл. 1 и 2 приведены, соответственно, некоторые характеристики различных жировых депо человека и факторы, влияющие на адипогенез в этих депо, а также гены, дифференциально экспрессирующиеся в клетках-предшественниках различных адипоцитов (Craft et al., 2018).
Таблица 1.
Стимуляция адипогенеза в разных нишах преадипоцитов (Ghaben, Scherer, 2019)
| Параметры | Жировые депо | ||||
|---|---|---|---|---|---|
| костный мозг | висцеральное депо | подкожное депо | мышечное депо | интердермальное депо | |
| Стимуляторы адипогенеза | Анорексия, облучение, старение | Избыточное питание | Холодовое воздействие | Избыточное питание, травма | Заживление ран, смена фаз развития волосяных фолликулов |
| Маркеры преадипоцитов | LepR+ | PDGFRα+ PDGFRβ+ |
PDGFRα+ | PDGFRα+ | PDGFRα+ и/или Zfp423+ Дедифферен- цировка миофибро-бластов |
| Сигналы, регулирующие адипогенез |
Лептин Сигнальный путь Hedgehog (ингибирование) |
Инсулин, глюкокортикоиды | Неизвестно | Сигнальный путь Hedgehog (ингибиро- вание) |
Wnt (ингибирование) NOTCH (дедифференцировка) |
Примечание: PDGF (platelet derived growth factor) – тромбоцитарный фактор роста; LepR – рецептор лептина; Zfp423 (zinc finger protein 423) – белок цинковый палец 423; Wnt (Wg (wingless) и Int) – сигнальный путь регулирующий эмбриогенез и дифференцировку клеток; NOTCH – семейство трансмембранных белков, которые принимают участие в юкстакринном сигналинге.
Таблица 2.
Гены, дифференциально экспрессируемые в клетках-предшественниках различных адипоцитов (Craft et al., 2018)
| Гены | Гены, специфичные для мезодермы MEOX1, PAX3/7, Myf5 | WNT1 SOX10 |
PRX-1 | HOXB6 |
|---|---|---|---|---|
| Локализация жировой ткани | Забрюшинные и межлопаточные адипоциты |
Адипоциты лица и шеи |
Подкожные адипоциты | Паховые брыжеечные и парагонадные адипоциты |
ЭТАПЫ АДИПОГЕНЕЗА
Адипогенез ‒ это процесс дифференцировки мультипотентных МСК в адипоциты (Schwalie et al., 2018).
Белые адипоциты возникают из МСК, которые находятся в строме жировой ткани. Когда МСК становятся преадипоцитами, они теряют способность дифференцироваться в другие мезенхимальные клоны. Первая фаза дифференцировки адипоцитов известна как детерминация. Вторая фаза адипогенеза ‒ терминальная дифференцировка, при которой преадипоциты приобретают характеристики зрелых адипоцитов, накапливая липидные капли и получая способность реагировать на гормоны, в частности на инсулин (Sarjeant, Stephens, 2012). Таким образом, МСК дифференцируются в липобласты, затем в преадипоциты и, в конечном счете, в зрелые адипоциты (Bahmad et al., 2020).
Общепринятой на настоящий момент является теория происхождения предшественников адипоцитов (как белой, так и бурой жировых тканей) и в период онтогенеза, и во взрослом организме из клеток, локализованных в стенках кровеносных капилляров жировой ткани – эндотелиоцитов и перицитов (Berry et al., 2013). Капиллярная сеть, равно как и суспензия из отдельных клеток микрососудов эксплантов жировой ткани человека, обладают способностью образовывать предшественников адипоцитов, автономно дифференцирующихся в зрелые адипоциты (Min et al., 2016). Более того, в экспериментах показано, что изолированные человеческие адипоциты дедифференцируются в эндотелиоподобные клетки (Planat-Benard et al., 2004), а эндотелиальные клетки могут быть дедифференцированы в мезенхимальные клетки, дифференцирующиеся в адипоциты, хондроциты и остеобласты (Medici et al., 2010). Мезенхимально-эндотелиальный переход связан с активацией сигнального пути BMP/TGFβ (см. ниже) (Maddaluno et al., 2013). Последние исследования, проведенные среди групп пациентов, а также на мышах, показывают, что, по крайней мере, некоторые субпопуляции адипоцитов имеют происхождение из гемопоэтических клеток красного костного мозга (Horowitz et al., 2017). Кроме того, в некоторых исследованиях показано мезотелиальное происхождение висцеральных адипоцитов (Chau et al., 2014). Следует отметить, что вопрос биогенеза адипоцитов остается все еще открытым и активно исследуется в настоящее время.
Известно, что для адипогенеза белых и бурых адипоцитов требуется активация одних и тех же ключевых транскрипционных факторов. К ним относятся: рецептор, активируемый PPARγ, белки, связывающие CCAAT/энхансер (CEBP, CCAAT-enhancer-binding proteins), Krüppel-подобный фактор (KLF, Krüppel-like factor), а также белки – сигнальные преобразователи и активаторы транскрипции (STAT, signal transducer and activator of transcription) (Bahmad et al., 2020). Также дифференцировка адипоцитов регулируется BMP, данные белки относятся к суперсемейству трансформирующих факторов роста β (TGF-β, transforming growth factor β). При этом дифференцировка белых адипоцитов регулируется BMP-2 и BMP-4, тогда как BMP-7 является главным фактором в дифференцировке преадипоцитов в зрелые бурые адипоциты. Кроме того, важным регулятором дифференцировки бурых и белых адипоцитов является активация пути р38 (Leiva et al., 2020).
Наиболее универсальные маркеры преадипоцитов белой жировой ткани – PDGFRα и PPARγ, экспрессирующиеся в клетках-предшественниках, но не в зрелых адипоцитах (Berry, Rodeheffer, 2013). В адипоцитарных депо клетки PDGFRα+ и PPARγ+ локализуются в области стенок кровеносных капилляров (Lee et al., 2012). PPARγ+-клетки напоминают гладкомышечные клетки стенок кровеносных сосудов, иначе называемые перицитами, и экспрессируют общие маркеры гладкомышечных клеток – гладкомышечный актин α (αSMA, α-smooth muscle actin) и PDGFRβ (Tang et al., 2008). Исследования на мышах in vivo показали, что клетки αSMА+ и PDGFRβ+ превращаются в белые адипоциты при высоколипидной диете (Vishvanath et al., 2016). Однако последние исследования, проведенные с помощью метода профилирования транскриптомов одиночных клеток, указывают на гетерогенность предшественников адипоцитов из разных депо и, вероятно, на разные стимулы, активирующие программу адипогенеза в них (Hepler et al., 2018).
Ранние исследования на культурах фибробластов показали, что для инициации их дифференцировки in vitro (стадии детерминации) достаточно связывания BMP-2 и BMP-4 со своими рецепторами для активации транскрипционного фактора SMAD4 (Huang et al., 2009). Активированный SMAD4, в свою очередь, стимулирует транскрипцию PPARγ – главного регулятора адипогенеза. С другой стороны, в адипогенных фибробластах была обнаружена повышенная экспрессия еще одного транскрипционного фактора – Zfp423, который увеличивал чувствительность фибробластов к проадипогенным стимулам BMP (Gupta et al., 2010). При этом экспрессия Zfp423 требуется для образования подкожного жира у плода, но не является необходимой для образования висцерального жира при высоколипидной диете (Shao et al., 2016; Hepler et al., 2017). Были выявлены и многие другие факторы, направляющие дифференцировку фибробластов на путь адипогенеза, однако все еще остаются невыясненными способы активации и регуляции экспрессии этих факторов.
Несмотря на множество белых пятен в этом вопросе, главным регулятором адипогенеза считается PPARγ, поскольку его экспрессия является абсолютно необходимой для терминальной дифференцировки преадипоцитов как в культурах клеток, так и in vivo (Barak et al., 1999; Rosen et al., 1999). В качестве эндогенных лигандов-активаторов PPARγ были предложены многие липидные метаболиты – полиненасыщенные жирные кислоты, эйкозаноиды, простагландины. Однако аффинность или представленность таких потенциальных активаторов в жировой ткани низкая, поэтому в настоящее время остается неизвестным истинный физиологический лиганд PPARγ (Schupp, Lazar, 2010).
Одним из важнейших эффектов PPARγ является активация транскрипционного фактора C/EBPα (Wu et al., 1999). В культурах фибробластов для дифференцировки в зрелые адипоциты достаточно индукции экспрессии C/EBPα и PPARγ (Freytag et al., 1994). Транскрипционные факторы C/EBPα и PPARγ находятся в функциональном синергизме. Более 90% сайтов связывания PPARγ с ДНК также связывают и C/EBPα; для того, чтобы полностью активировать транс-крипцию генов, экспрессируемых в зрелых адипоцитах (например, гены, кодирующие инсулиновые рецепторы, глюкозные транспортеры, адипонектин, белок, связывающий жирные кислоты AP2 – adipocyte fatty acid-binding protein, перилипины, лептин и другие), PPARγ должен активировать транскрипцию белков семейства C/EBP (Lefterova et al., 2008). Интересно, что для адипогенеза в эмбриональном периоде не требуется активации C/EBPα, возможно, из-за активности другого родственного транскрипционного фактора – C/EBPβ. Однако экспрессия C/EBPα является абсолютно необходимым условием для всех форм адипогенеза во взрослом организме (Wang et al., 2015) (рис. 2).
Рис. 2.
Ключевые этапы адипогенеза. Мультипотентные фибробластоподобные мезенхимальные клетки-предшественники (экспрессирующие αSMA и PDGFRβ) являются предшественниками адипоцитов, но также могут давать начало миобластам, хондробластам и остеобластам (Tang et al., 2008). Для этапа детерминации требуется сигнальная активность белков BMP, после чего предшественники адипоцитов начинают экспрессировать транскрипционный фактор Zfp423 (Huang et al., 2009; Gupta et al., 2010). На стадии терминальной дифференцировки происходит активация главных регуляторов адипогенеза – транскрипционных факторов PPARγ и C/EBPα/C/EBPβ (Barak et al., 1999; Rosen et al., 1999; Wang et al., 2015). В зрелом адипоците экспрессируются как маркеры ранних этапов дифференцировки, так и гормоны и ферменты, характерные для зрелых адипоцитов (адипонектин, лептин, адипоцитарная триглицеридлипаза – АТГЛ, липопротеинлипаза – ЛПЛ, перилипин 1) (Lefterova et al., 2008). В настоящее время известно, что адипоциты подвергаются дедифференцировке обратно в фибробластоподобные преадипоциты (Bi et al., 2016; Plikus et al., 2017; Wang et al., 2018).

Белая жировая ткань по праву считается самой динамичной и изменчивой тканью в организме человека (Lowe et al., 2011). Известно, что дифференцировка преадипоцитов не является однонаправленным процессом и при влиянии определенных стимулов адипоциты могут дедифференцироваться в фибробластоподобные клетки (рис. 2). Этот процесс наблюдается при заживлении ран, росте опухолей и лактации (Bi et al., 2016; Plikus et al., 2017; Wang et al., 2018). Причем альвеолярные клетки молочной железы, образовавшиеся из адипоцитов (называемых также “розовыми адипоцитами” из-за их характерного окрашивания во время беременности), могут неоднократно проходить процесс трансдифференцировки (возвращаться в исходный фенотип белых жировых клеток при окончании лактации и дифференцироваться в ацинарные клетки при новой беременности) (рис. 1). Более того, в экспериментах на мышах была показана возможность трансдифференцировки альвеолярных клеток в бежевые адипоциты в раннем постлактационном периоде (Cinti et al., 2018).
РЕГУЛЯЦИЯ АДИПОГЕНЕЗА
Увеличение объема жировой ткани может происходить благодаря увеличению размеров адипоцитов – гипертрофии и/или увеличению количества адипоцитов – гиперплазии (за счет образования новых адипоцитов путем дифференцировки преадипоцитов) (Kahn et al., 2019). Факторы, определяющие жировую массу у взрослых людей, до конца не изучены, но считается, что наиболее важным является повышенное накопление липидов в уже развитых жировых клетках (адипоцитах), а количество адипоцитов детерминировано генетически (Spalding et al., 2008). Так, количество белых адипоцитов остается постоянным в зрелом возрасте, как у худых, так и у тучных людей, даже после заметной потери веса, что указывает на то, что количество адипоцитов устанавливается в детском и подростковом возрасте. Однако следует отметить, что недавние исследования на грызунах с использованием стабильных изотопов в качестве меток показали, что преадипоциты подкожного жирового депо проходят дифференцировку в эмбриональном периоде, а в постнатальном периоде увеличиваются за счет гипертрофии в ответ на переедание (Wang et al., 2013). В то же время развитие висцеральной жировой ткани происходит, главным образом, постнатально, в равной степени, как путем гиперплазии, так и гипертрофии (Jeffery et al., 2015). Более того, известно, что около 10% адипоцитов ежегодно обновляется во всех возрастных группах, и это не зависит от индекса массы тела (ИМТ) (Spalding et al., 2008).
Ранний рекрутинг новых жировых клеток зависит от перекрестного взаимодействия между сигналами Wnt и BMP-4. Так, Wnt усиливает пролиферацию преадипоцитов, тогда как BMP-4 отвечает за их терминальную дифференцировку в зрелые адипоциты. Wnt-белки ингибируют адипогенез, подавляя экспрессию CEBP-α и PPAR-γ (Lowe et al., 2011). Wnt-белки представляют собой семейство секретируемых гликопротеинов, которые регулируют ремоделирование тканей взрослого человека и, в том числе, это относится и к белой жировой ткани. Считается, что сигнальная сеть Wnt необходима для обеспечения кросс-коммуникации жировых клеток. Ключевой регуляторной молекулой сигнального каскада Wnt является белок β-катенин, участвующий, в том числе, в координации транскрипции генов. В отсутствие Wnt цитоплазматический β-катенин фосфорилируется казеинкиназой I и киназой гликогенсинтазы 3-β, что приводит к его убиквитинированию и последующей протеасомной деградации. В том случае, если Wnt связывается с рецепторами Frizzled (FZD, семейство белков G-белковых рецепторов) и корецепторами белков -5 или -6 рецепторов ЛПНП (липопротеины низкой плотности, LRP5/6, low-density lipoprotein receptor-related protein 5/6), комплекс деградации инактивируется. Это приводит к гипофосфорилированию β-катенина и его транслокации в ядро, где он связывается с белками семейства транскрипционных факторов TCF ‒ факторами связывания лимфоидного энхансера/Т-клеточного фактора транскрипции (LEF/T-cell transcription factor, lymphoid enhancer binding factor), для активации генов-мишеней Wnt (рис. 3). Нарушение регуляции этих сигнальных путей связано с неправильным течением адипогенеза и изменением способности реагировать на потребность организма в накоплении избыточных липидов в подкожной жировой ткани. В свою очередь, это приводит к гипертрофии, дисфункции и инсулинорезистентности белых адипоцитов, что сопровождается снижением синтеза и активации ГЛЮТ-4 (глюкозный транспортер тип 4 — инсулинзависимый белок-переносчик глюкозы) и нарушением транспорта глюкозы в адипоциты (Smith, Kahn, 2016).
Рис. 3.
Регуляция адипогенеза. Множество внеклеточных сигналов направляет процесс дифференцировки преадипоцитов. Некоторые сигнальные молекулы, такие как инсулин, глюкокортикоиды, костные морфогенетические белки (BMP), напрямую активируют PPARγ и/или C/EBPα для активации дифференцировки преадипоцитов (Barak et al., 1999; Rosen et al., 1999; Wang et al., 2015). Другие стимулы (например, белки семейств Wnt или Hedgehog (SHH)) ингибируют адипогенез через прямую репрессию комплекса PPARγ–C/EBPα или путем супрессии других проадипогенных сигнальных каскадов (например, ингибирование инсулинового сигнального каскада белками Hedgehog) (Fontaine et al., 2008; Lowe et al., 2011). Помимо этого, другие стимулы, такие как окислительный стресс и продукция РФК (Mahadev et al., 2004; Furukawa et al., 2004), воспаление (Alessi et al., 2000; Weisberg et al., 2003), циркадные ритмы (Sun et al., 2018), холодовая стимуляция, также принимают участие в регуляции адипогенеза (Wang et al., 2016). ИЛ – интерлейкин, TGFβ – трансформирующий фактор β (transforming growth factor β), TNF – фактор некроза опухолей (tumour necrosis factor), MCP1 – хемоаттрактантный белок моноцитов (monocyte chemoattractant protein 1).

Очень важным звеном в активации адипогенеза на этапе детерминации являются реактивные формы кислорода (РФК), образование которых влияет на стабильность фактора, индуцируемого гипоксией 1α (HIF-1α, hypoxia-inducible factor), ингибирующего PPARγ (Lowe et al., 2011). Кроме того, показана способность физиологических концентраций РФК усиливать инсулиновый сигналинг, что стимулирует адипогенез (Mahadev et al., 2004). Однако высокие уровни РФК, образуемые НАДФН-оксидазами при ожирении, связаны с развитием инсулиновой резистентности и подавлением адипогенеза (Furukawa et al., 2004).
МикроРНК обеспечивают дополнительный механизм контроля адипогенеза (Lowe et al., 2011). В недавних исследованиях было показано, что некоторые микроРНК ингибируют экспрессию лейкозного ингибиторного фактора (LIF, leukemia inhibitory factor), а данное событие способствует адипогенезу. Например, микроРНК-130, -378 и -27 регулируют экспрессию адипогенных и липогенных генов (Lowe et al., 2011).
Безусловно, важнейшими проадипогенными факторами являются глюкокортикоидные гормоны и инсулин, напрямую влияющие на экспрессию транскрипционных факторов PPARγ и C/EBPα, направляющих дифференцировку преадипоцитов (Chapman et al., 1985; Bäck, Arnqvist, 2009). Сигнальный путь Hedgehog, напротив, ингибирует адипогенез путем супрессии проадипогенных сигнальных каскадов (Fontaine et al., 2008).
Другими регуляторными факторами адипогенеза являются: холодовое воздействие, которое, как и стимуляция β3-адренорецепторов, индуцирует адипогенез бурой жировой ткани (Wang, Seale, 2016); провоспалительные молекулы: фактор некроза опухолей, трансформирующий фактор β, ΝΟ и др. – являются важными стимуляторами адипогенеза, однако хроническое воспаление подавляет адипогенез и стимулирует адипоциты к большей секреции воспалительных факторов, что ускоряет старение клеток и усиливает метаболический дисбаланс (Alessi et al., 2000; Weisberg et al., 2003); циркадианные ритмы: экспрессия главного регулятора адипогенеза – PPARγ – является цикличной и зависит от суточных ритмов, поэтому развитие ожирения и нарушение адипогенеза ассоциированы с нарушением этих ритмов (Sun et al., 2018) (рис. 3).
СТАРЕНИЕ И ГИБЕЛЬ АДИПОЦИТОВ
Адипоциты человека живут приблизительно 10 лет, и за время своей жизни триацилглицеролы (ТАГ) внутри адипоцитов обновляются около 6 раз. Также показано, что адипоцитарные ТАГ постоянно метаболизируются, и нет конститутивных ТАГ, которые не подвергаются липолизу (Spalding et al., 2017).
Считается, что редукция бурой жировой ткани с возрастом происходит по причинам уменьшения репродуктивной способности стволовых клеток, снижения продукции трийодтиронина и конверсии тироксина в трийодтиронин, нарушения функционирования митохондрий и сниженной активности симпатической нервной системы (Graja, Schulz, 2015). Общепринятой является теория развития хронического воспалительного процесса как ключевого фактора старения или сенесценции тканей (Franceschi, 2017). С возрастом в жировой ткани увеличивается число клеток (наиболее вероятно, макрофагов и Т-лимфоцитов), секретирующих определенные факторы (известные как SASP, senescence-associated secretory phenotype), повреждающие окружающие клетки, приводящие к их дегенерации и развитию хронического воспалительного процесса (так называемый inflammaging) (Franceschi et al., 2017).
Так, сенесценцию адипоцитов определяли с помощью генного и секреторного профилирования по активности β-галактозидазы в парных биоптатах подкожной и сальниковой жировой ткани у пациентов с выраженным ожирением. Установили, что активность β-галактозидазы в семь раз выше в подкожной жировой клетчатке, чем в жировой ткани сальника. При этом было показано что более высокая активность β-галактозидазы сопряжена с высокой концентрацией сывороточного лептина и, соответственно, с развитием инсулинорезистентности и выраженной дислипидемии. Несколько факторов, включая белок, связывающий инсулиноподобный фактор роста-3 (IGFBP-3, insulin-like growth factor-binding protein), ингибитор активатора плазминогена-1 (PAI-1, plasminogen activator inhibitor 1), хемокиновый лиганд C-C мотива 2 (CCL2) и ИЛ-6, были повышены в подкожной жировой ткани. В то же время сенолитическое лечение уменьшало активность β-галактозидазы и приводило к нормализации описанных факторов (Rouault et al., 2021).
Люди с ожирением имеют целый ряд метаболических сдвигов. При увеличении размеров адипоциты испытывают механический стресс, поскольку увеличивается их контактирование с соседними клетками и компонентами экстрацеллюлярного матрикса (Halberg et al., 2009). Кроме того, возникает состояние гипоксии из-за ограниченной диффузии кислорода к адипоцитам. Механический и гипоксический стресс приводят к развитию воспаления, что сопровождается усилением липолиза, секрецией воспалительных цитокинов и снижением секреции противовоспалительных адипокинов, например, лептина и адипонектина (Meyer et al., 2013). Кроме того, размер адипоцитов положительно коррелирует не только с различными воспалительными факторами, но также и с количеством CD206+-макрофагов, участвующих в фагоцитозе погибших клеток (Murano et al., 2008). Таким образом, не само ожирение, а именно размер адипоцитов является ключевым фактором, определяющим их гибель. Но следует отметить, что висцеральные адипоциты имеют меньший критический размер смерти (размер адипоцита, при котором происходит индукция его гибели), по сравнению с подкожными адипоцитами (Cinti et al., 2018).
В гипертрофированных адипоцитах наблюдается ряд важных патологических изменений: меняется число и размер митохондрий, происходит гипертрофия эндоплазматической сети и аппарата Гольджи (что связано, в том числе, с гиперпродукцией провоспалительных факторов, например, MCP-1, CXCL14, MIP-1α, MCP-2, MCP-3, RANTES), накопление гранул холестерола и гиперпродукция коллагена и амилоида во внеклеточном матриксе (Xu et al., 2003; Kanda et al., 2006; Sun et al., 2011). Присутствие холестерола и модификация клеточных органелл являются потенциальными молекулярными паттернами, ассоциированными с повреждением клетки (DAMPS, damage-associated-molecular patterns), выступающими в качестве активаторов рецепторов NLR (NOD-like receptors; nucleotide oligomerization domain receptors), которые вместе с белками – прокаспазой-1 и PYCARD (apoptosis-associated speck-like protein containing a CARD, апоптоз-ассоциированный speck-подобный белок, содержащий CARD) формируют единый белковый комплекс (Duewell et al., 2010). Активация NLRs приводит к образованию активной каспазы-1, которая инициирует особый вид клеточный смерти, связанной с гипервоспалением, – пироптозом (Martinon, Tschopp, 2007). С учетом того, что с возрастом увеличивается число клеток, продуцирующих воспалительные факторы, все большее число адипоцитов подвергается пироптозу, что в свою очередь способствует большей гипертрофии оставшихся клеток и развитию метаболических нарушений, ассоциированных с их гипертрофией.
Однако около 20–30% от общего числа больных с ожирением являются метаболически здоровыми людьми. Более того, корреляционные клинические исследования показывают, что стимуляция адипогенеза у людей с низким ИМТ может положительно сказываться на метаболическом здоровье. Например, люди, предрасположенные к гипертрофическому ожирению, имеют сниженную чувствительность к инсулину, поэтому даже при нормальной массе тела (без ожирения) у таких пациентов развивается инсулинорезистентность. Так, в исследованиях in vivo было показано, что ингибирование адипогенеза во взрослом возрасте с помощью делеции PPARγ приводит к патологической гипертрофической экспансии белой жировой ткани в условиях избыточного питания. Напротив, стимуляция висцерального адипогенеза за счет гиперэкспрессии PPARγ имела благоприятный эффект – наблюдалось снижение уровня локального воспаления, сохранение нормальной секреции адипонектина без повышения массы тела. Также было высказано предположение, что нарушение адипогенеза может привести к неспособности секвестрировать липотоксичные жирные кислоты (Petrus et al., 2018).
СИГНАЛЬНЫЕ МОЛЕКУЛЫ АДИПОЦИТОВ
Эндокринная функция жировой ткани общеизвестна. Жировая ткань секретирует гормоны, цитокины, ростовые факторы белково-пептидной природы: лептин, адипонектин, резистин, висфатин, апелин, аспросин, фактор роста фибробластов (FGF21, fibroblast growth factor 21) и др. (рис. 4). Эти факторы имеют множество мишеней действия (печень, скелетная мускулатура, нервная ткань, сердце, кишечник, поджелудочная железа и др.) и играют важнейшую роль в поддержании их функционирования и метаболизма в целом (Galic et al., 2010).
Однако в настоящее время описаны совершенно новые сигнальные молекулы, образуемые жировой тканью. К ним относятся разветвленные эфиры жирных кислот и гидроксильных жирных кислот (FAHFA) и 12,13-дигидроксиоктадек-9Z-еновая кислота (12,13-diHOMЕ) (Kahn et al., 2019). Наиболее изученным FAHFA является соединение пальмитиновой кислоты с гидроксистеаратом. Также было установлено, что уровень FAHFA увеличен у мышей с повышенной экспрессией ГЛЮТ-4 в жировой ткани и у животных с метаболически здоровым фенотипом. Также FAHFA проявляют противовоспалительные свойства, снижая индуцированную липополисахаридами активацию макрофагов (Kuda, 2017; Kahn et al., 2019). Липокин diHOME является продуктом метаболизма линолевой кислоты. При этом высокий уровень 12,13-diHOME обнаруживается в белой жировой ткани, ее функция заключается в увеличении утилизации СЖК. Физические нагрузки и воздействие холода положительно коррелируют с высоким уровнем 12,13-diHOME в сыворотке крови, что обусловлено ее регуляторной ролью в процессе окисления СЖК в миоцитах (Ortega-Molina et al., 2012; Vidal, Stanford, 2020).
ЗАКЛЮЧЕНИЕ
Несмотря на исключительную сложность вопросов происхождения адипоцитов, молекулярных механизмов их генеза и метаболической роли жировой ткани, в настоящее время начинает складываться концепция адипогенеза как многоступенчатого процесса дифференцировки мезенхимальных стволовых клеток. При этом преадипоциты обладают выраженной гетерогенностью, пластичностью и имеют периваскулярное происхождение. Предшественники адипоцитов находятся также вне основных жировых депо и играют важную роль в процессах регенерации и регуляции метаболизма кожи, костной и мышечной тканей. Важной особенностью адипоцитов является их способность к дедифференцировке – возможности возвращаться в исходное состояние фибробластоподобных клеток, а также к трансдифференцировке – трансформации в другой тип жировых или нежировых клеток. Адипогенез и путь трансформации зрелых адипоцитов зависят от многих факторов, имеющих как системный (действие гормонов, циркадных ритмов, холодовая стимуляция), так и локальный характер (влияние микроокружения, пара- и аутокринные факторы). Скорость адипогенеза и метаболическая функция жировой ткани имеют исключительное влияние на здоровье организма в целом и продолжительность жизни, поскольку адипогенез позволяет секвестировать липиды и предотвращать их липотоксическое действие на другие ткани, а также выполняет регуляторную роль в обмене веществ. С этим связан поиск новых терапевтических агентов – регуляторов адипогенеза, потенциально применимых для лечения ожирения, метаболического синдрома, СД 2-го типа и других дисметаболических расстройств, а также для регенеративной терапии.
Список литературы
Alessi M.C., Bastelica D., Morange P. et al. Plasminogen activator inhibitor 1, transforming growth factor-beta1, and BMI are closely associated in human adipose tissue during morbid obesity // Diabetes. 2000. V. 49. № 8. P. 1374–1380.
Bäck K., Arnqvist H.J. Changes in insulin and IGF-I receptor expression during differentiation of human preadipocytes // Growth Horm. IGF Res. 2009. V. 19. № 2. P. 101–111.
Bahmad H.F., Daouk R., Azar J. et al. Modeling adipogenesis: current and future perspective // Cells. 2020. V. 9. № 10. P. 2326.
Barak Y., Nelson M.C., Ong E.S. et al. PPAR gamma is required for placental, cardiac, and adipose tissue development // Mol. Cell. 1999. V. 4. № 4. P. 585–595.
Berry R., Rodeheffer M.S. Characterization of the adipocyte cellular lineage in vivo // Nat. Cell Biol. 2013. V. 15. № 3. P. 302–308.
Bi P., Yue F., Karki A. et al. Notch activation drives adipocyte dedifferentiation and tumorigenic transformation in mice // J. Exp. Med. 2016. V. 213. № 10. P. 2019–2037.
Bozec A., Hannemann N. Mechanism of regulation of adipocyte numbers in adult organisms through differentiation and apoptosis homeostasis // J. Vis. Exp. 2016. V. 3. № 112. P. 53822.
Burl R.B., Ramseyer V.D., Rondini E.A. et al. Deconstructing adipogenesis induced by β3-adrenergic receptor activation with single-cell expression profiling // Cell Metab. 2018. V. 28. № 2. P. 300–309.
Cawthorn W.P., Scheller E.L., Learman B.S. et al. Bone marrow adipose tissue is an endocrine organ that contributes to increased circulating adiponectin during caloric restriction // Cell Metab. 2014. V. 20. P. 368–375.
Cawthorn W.P., Scheller E.L. Editorial: bone marrow adipose tissue: formation, function, and impact on health and disease // Front. Endocrinol. (Lausanne). 2017. V. 8. P. 112.
Cereijo R., Gallego-Escuredo J.M., Moure R. The molecular signature of HIV-1-associated lipomatosis reveals differential involvement of brown and beige/brite adipocyte cell lineages // PLoS One. 2015. V. 10. № 8. P. e0136571.
Chapman A.B., Knight D.M., Ringold G.M. Glucocorticoid regulation of adipocyte differentiation: hormonal triggering of the developmental program and induction of a differentiation-dependent gene // J. Cell Biol. 1985. V. 101. № 4. P. 1227–1235.
Chau Y.Y., Bandiera R., Serrels A. et al. Visceral and subcutaneous fat have different origins and evidence supports a mesothelial source // Nat. Cell Biol. 2014. V. 16. № 4. P. 367–375.
Chen Y., Ikeda K., Yoneshiro T. Thermal stress induces glycolytic beige fat formation via a myogenic state // Nature. 2019. V. 565. P. 180–185.
Cinti S. Adipose organ development and remodeling // Comp. Physiol. 2018. V. 8. № 4. P. 1357–1431.
Cinti S., Cancello R., Zingaretti M.C. et al. CL316,243 and cold stress induce heterogeneous expression of UCP1 mRNA and protein in rodent brown adipocytes // J. Histochem. Cytochem. 2002. V. 50. № 1. P. 21–31.
Craft C.S., Li Z., MacDougald O.A. et al. Molecular differences between subtypes of bone marrow adipocytes // Curr. Mol. Biol. Rep. 2018. V. 4. P. 16–23.
Craft C.S., Robles H., Lorenz M.R. et al. Bone marrow adipose tissue does not express UCP1 during development or adrenergic-induced remodeling // Sci. Rep. 2019. V. 9. P. 17427.
Debette S., Beiser A., Hoffmann U. et al. Visceral fat is associated with lower brain volume in healthy middle-aged adults // Ann. Neurol. 2010. V. 68. P. 136–144.
Driskell R.R., Jahoda C.A., Chuong C.M. et al. Defining dermal adipose tissue // Exp. Dermatol. 2014. V. 23. P. 629–631.
Duewell P., Kono H., Rayner K.J. et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals // Nature. 2010. V. 464. № 7293. P. 1357–1361.
Esteve Ràfols M. Adipose tissue: cell heterogeneity and functional diversity // Endocrinol. Nutr. 2014. V. 61. № 2. P. 100–112.
Enzi G., Busetto L., Sergi G. et al. Multiple symmetric lipomatosis: a rare disease and its possible links to brown adipose tissue // Nutr. Metab. Cardiovasc. Dis. 2015. V. 25. № 4. P. 347–353.
Fontaine C., Cousin W., Plaisant M. et al. Hedgehog signaling alters adipocyte maturation of human mesenchymal stem cells // Stem Cells. 2008. V. 26. № 4. P. 1037–1046.
Fox C.S., Massaro J.M., Hoffmann U. et al. Abdominal visceral and subcutaneous adipose tissue compartments: association with metabolic risk factors in the Framingham Heart Study // Circulation. 2007. V. 116. P. 39–48.
Franceschi C. Healthy ageing in 2016: obesity in geroscience – is cellular senescence the culprit? // Nat. Rev. Endocrinol. 2017. V. 13. № 2. P. 76–78.
Franceschi C., Garagnani P., Vitale G. et al. Inflammaging and “Garb-aging” // Tr. Endocrinol. Metab. 2017. V. 28. № 3. P. 199–212.
Freytag S.O., Paielli D.L., Gilbert J.D. Ectopic expression of the CCAAT/enhancer-binding protein alpha promotes the adipogenic program in a variety of mouse fibroblastic cells // Gen. Dev. 1994. V. 8. № 14. P. 1654–1663.
Furukawa S., Fujita T., Shimabukuro M. Shimomura I. Increased oxidative stress in obesity and its impact on metabolic syndrome // J. Clin. Invest. 2004. V. 114. № 12. P. 1752–1761.
Galic S., Oakhill J.S., Steinberg G.R. Adipose tissue as an endocrine organ // Mol. Cell Endocrinol. 2010. V. 316. № 2. P. 129–139.
Ghaben A.L., Scherer P.E. Adipogenesis and metabolic health // Nat. Rev. Mol. Cell. Biol. 2019. V. 20. № 4. P. 242–258.
Graja A., Schulz T.J. Mechanisms of aging-related impairment of brown adipocyte development and function // Gerontology. 2015. V. 61. № 3. P. 211–217.
Grundy S.M. Adipose tissue and metabolic syndrome: too much, too little or neither // Eur. J. Clin. Invest. 2015. V. 45. № 11. P. 1209–1217.
Gupta R.K., Arany Z., Seale P. et al. Transcriptional control of preadipocyte determination by Zfp423 // Nature. 2010. V. 464. № 7288. P. 619–623.
Halberg N., Khan T., Trujillo M.E. Hypoxia-inducible factor 1alpha induces fibrosis and insulin resistance in white adipose tissue // Mol. Cell Biol. 2009.V. 29. № 16. P. 4467–4483.
Hepler C., Shao M., Xia J.Y. et al. Directing visceral white adipocyte precursors to a thermogenic adipocyte fate improves insulin sensitivity in obese mice // Elife. 2017. V. 6. P. e27669.
Hepler C., Shan B., Zhang Q. et al. Identification of functionally distinct fibro-inflammatory and adipogenic stromal subpopulations in visceral adipose tissue of adult mice // Elife. 2018. V. 7. P. e39636.
Horowitz M.C., Berry R., Holtrup B. Bone marrow adipocytes // Adipocyte. 2017. V. 6. № 3. P. 193–204.
Huang H., Song T.J., Li X. et al. BMP signaling pathway is required for commitment of C3H10T1/2 pluripotent stem cells to the adipocyte lineage // PNAS USA. 2009. V. 106. № 31. P. 12670–12675.
Huang-Doran I., Sleigh A., Rochford J.J. et al. Lipodystrophy: metabolic insights from a rare disorder // J. Endocrinol. 2010. V. 207. № 3. P. 245–255.
Ibrahim M.M. Subcutaneous and visceral adipose tissue: structural and functional differences // Obes. Rev. 2010. V. 11. № 1. P. 11–18.
Jeffery E., Church C.D., Holtrup B. Rapid depot-specific activation of adipocyte precursor cells at the onset of obesity // Nat. Cell Biol. 2015. V. 17. № 4. P. 376–385.
Jeffery E., Wing A., Holtrup B. The adipose tissue microenvironment regulates depot-specific adipogenesis in obesity // Cell Metab. 2016. V. 24. № 1. P. 142–150.
Kahn C.R., Wang G., Lee K.Y. Altered adipose tissue and adipocyte function in the pathogenesis of metabolic syndrome // J. Clin. Invest. 2019. V. 129. P. 3990–4000.
Kanda H., Tateya S., Tamori Y. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity // J. Clin. Invest. 2006. V. 116. № 6. P. 1494–505.
Kuda O. Bioactive metabolites of docosahexaenoic acid // Biochimie. 2017. V. 136. P. 12–20.
Lee Y.H., Petkova A.P., Mottillo E.P. et al. In vivo identification of bipotential adipocyte progenitors recruited by β3-adrenoceptor activation and high-fat feeding // Cell Metab. 2012. V. 15. № 4. P. 480–491.
Lee Y.H., Petkova A.P., Konkar A.A. et al. Cellular origins of cold-induced brown adipocytes in adult mice // FASEB J. 2015. V. 29. № 1. P. 286–299.
Lefterova M.I., Zhang Y., Steger D.J. et al. PPAR gamma and C/EBP factors orchestrate adipocyte biology via adjacent binding on a genome-wide scale // Gen. Dev. 2008. V. 22. № 21. P. 2941–2952.
Leiva M., Matesanz N., Pulgarin-Alfaro M. et al. Uncovering the role of p38 family members in adipose tissue physiology // Front. Endocrinol. (Lausanne). 2020. V. 11. P. 572089.
Lowe C.E., O’Rahilly S., Rochford J.J. et al. Adipogenesis at a glance // J. Cell. Sci. 2011. V. 124. P. 2681–2686.
Maddaluno L., Rudini N., Cuttano R. et al. EndMT contributes to the onset and progression of cerebral cavernous malformations // Nature. 2013. V. 498. № 7455. P. 492–496.
Mahadev K., Motoshima H., Wu X. et al. The NAD(P)H oxidase homolog Nox4 modulates insulin-stimulated generation of H2O2 and plays an integral role in insulin signal transduction // Mol. Cell Biol. 2004. V. 24. № 5. P. 1844–1854.
Marcelin G., Ferreira A., Liu Y. et al. A PDGFRalpha-mediated switch toward CD9(high) adipocyte progenitors controls obesity-induced adipose tissue fibrosis // Cell Metab. 2017. V. 25. P. 673–685.
Martinon F., Tschopp J. Inflammatory caspases and inflammasomes: master switches of inflammation // Cell Death Diff. 2007. V. 14. № 1. P. 10–22.
Medici D., Shore E.M., Lounev V.Y. et al. Conversion of vascular endothelial cells into multipotent stem-like cells // Nat. Med. 2010. V. 16. № 12. P. 1400–1406.
Meyer L.K., Ciaraldi T.P., Henry R.R. et al. Adipose tissue depot and cell size dependency of adiponectin synthesis and secretion in human obesity // Adipocyte. 2013. V. 2. № 4. P. 217–226.
Min S.Y., Kady J., Nam M. et al. Human “brite/beige” adipocytes develop from capillary networks, and their implantation improves metabolic homeostasis in mice // Nat. Med. 2016. V. 22. № 3. P. 312–318.
Morroni M., Barbatelli G., Zingaretti M.C. et al. Immunohistochemical, ultrastructural and morphometric evidence for brown adipose tissue recruitment due to cold acclimation in old rats // Int. J. Obes. Relat. Metab. Disord. 1995. V. 19. № 2. P. 126–131.
Murano I., Barbatelli G., Parisani V. et al. Dead adipocytes, detected as crown-like structures, are prevalent in visceral fat depots of genetically obese mice // J. Lipid. Res. 2008. V. 49. № 7. P. 1562–1568.
Ortega-Molina A., Efeyan A., Lopez-Guadamillas E. et al. Pten positively regulates brown adipose function, energy expenditure, and longevity // Cell Metab. 2012. V. 15. № 3. P. 382–394.
Pellegrinelli V., Carobbio S., Vidal-Puig A. et al. Adipose tissue plasticity: how fat depots respond differently to pathophysiological cues // Diabetologia. 2016. V. 59. № 6. P. 1075–1088.
Petrus P., Mejhert N., Corrales P. et al. Transforming growth factor-beta3 regulates adipocyte number in subcutaneous white adipose tissue // Cell Rep. 2018. V. 25. P. 551–560.
Pinckard K.M., Shettigar V.K., Wright K.R. et al. A novel endocrine role for the BAT-released lipokine 12,13-diHOME to mediate cardiac function // Circulation. 2021. V. 143. P. 145–159.
Planat-Benard V., Silvestre J.S., Cousin B. et al. Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives // Circulation. 2004. V. 109. № 5. P. 656–663.
Plikus M.V., Guerrero-Juarez C.F., Ito M. et al. Regeneration of fat cells from myofibroblasts during wound healing // Science. 2017. V. 355. № 6326. P. 748–752.
Rojas-Rodriguez R., Lujan-Hernandez J., Min S.Y. Generation of functional human adipose tissue in mice from primed progenitor cells // Tiss. Eng. Part A. 2019. V. 25. P. 842–854.
Rossato M. Aging and brown adipose tissue activity decline in human: does the brain extinguish the fire? // Aging Clin. Exp. Res. 2016. V. 28. № 3. P. 579–581.
Rouault C., Marcelin G., Adriouch S. et al. Senescence-associated beta-galactosidase in subcutaneous adipose tissue associates with altered glycaemic status and truncal fat in severe obesity // Diabetologia. 2021. V. 64. P. 240–254.
Rui L. Brown and beige adipose tissues in health and disease // Compr. Physiol. 2017. V. 7. P. 1281–1306.
Rosen E.D., Sarraf P., Troy A.E. et al. PPAR gamma is required for the differentiation of adipose tissue in vivo and in vitro // Mol. Cell. 1999. V. 4. № 4. P. 611–617.
Sarjeant K., Stephens J.M. Adipogenesis // Cold Spring Harb. Perspect. Biol. 2012. V. 4. P. a008417.
Sanchez-Gurmaches J., Hung C.M., Sparks C.A. et al. PTEN loss in the Myf5 lineage redistributes body fat and reveals subsets of white adipocytes that arise from Myf5 precursors // Cell Metab. 2012. V. 16. № 3. P. 348–362.
Sbarbati A., Morroni M., Zancanaro C., Cinti S. Rat interscapular brown adipose tissue at different ages: a morphometric study // Int. J. Obes. 1991. V. 15. № 9. P. 581–587.
Scheller E.L., Khandaker S., Learman B.S. Bone marrow adipocytes resist lipolysis and remodeling in response to beta-adrenergic stimulation // Bone. 2019. V. 118. P. 32–41.
Schupp M., Lazar M.A. Fingered for a fat fate // Cell Metab. 2010. V. 11. P. 244–245.
Schwalie P.C., Dong H., Zachara M. et al. A stromal cell population that inhibits adipogenesis in mammalian fat depots // Nature. 2018. V. 559. № 7712. P. 103–108.
Shao M., Hepler C., Vishvanath L. et al. Fetal development of subcutaneous white adipose tissue is dependent on Zfp423 // Mol. Metab. 2016. V. 6. № 1. P. 111–124.
Smith U., Kahn B.B. Adipose tissue regulates insulin sensitivity: role of adipogenesis, de novo lipogenesis and novel lipids // J. Int. Med. 2016. V. 280. P. 465–475.
Song A., Dai W., Jang M.J. et al. Low- and high-thermogenic brown adipocyte subpopulations coexist in murine adipose tissue // J. Clin. Invest. 2020. V. 130. P. 247–257.
Spalding K.L., Arner E., Westermark P.O. et al. Dynamics of fat cell turnover in humans // Nature. 2008. V. 453. P. 783–787.
Spalding K.L., Bernard S., Naslund E. et al. Impact of fat mass and distribution on lipid turnover in human adipose tissue // Nat. Commun. 2017. V. 8. P. 15253.
Speliotes E.K., Massaro J.M., Hoffmann U. Fatty liver is associated with dyslipidemia and dysglycemia independent of visceral fat: the Framingham Heart Study // Hepatology. 2010. V. 51. P. 1979–1987.
Suchacki K.J., Tavares A.S., Mattiucci D. et al. Bone marrow adipose tissue is a unique adipose subtype with distinct roles in glucose homeostasis // Nat. Commun. 2020. V. 11. P. 3097.
Sun K., Kusminski C.M., Scherer P.E. Adipose tissue remodeling and obesity // J. Clin. Invest. 2011. V. 121. № 6. P. 2094–2101.
Sun M., Feng W., Wang F. Meta-analysis on shift work and risks of specific obesity types // Obes. Rev. 2018. V. 19. № 1. P. 28–40.
Tang W., Zeve D., Suh J.M. White fat progenitor cells reside in the adipose vasculature // Science. 2008. V. 322. № 5901. P. 583–686.
Vidal P., Stanford K.I. Exercise-induced adaptations to adipose tissue thermogenesis // Front. Endocrinol. (Lausanne). 2020. V. 11. P. 270.
Vijgen G.H., Bouvy N.D., Teule G.J. Brown adipose tissue in morbidly obese subjects // PLoS One. 2011. V. 6. № 2. P. e17247.
Vishvanath L., MacPherson K.A., Hepler C. et al. Pdgfrβ+ mural preadipocytes contribute to adipocyte hyperplasia induced by high-fat-diet feeding and prolonged cold exposure in adult mice // Cell Metab. 2016. V. 23. №2. P. 350–359.
Wang Q.A., Tao C., Gupta R.K. et al. Tracking adipogenesis during white adipose tissue development, expansion and regeneration // Nat. Med. 2013. V. 19. № 10. P. 1338–1344.
Wang Q.A., Tao C., Jiang L. et al. Distinct regulatory mechanisms governing embryonic versus adult adipocyte maturation // Nat. Cell. Biol. 2015. V. 17. № 9. P. 1099–1111.
Wang Q.A., Song A., Chen W. et al. Reversible de-differentiation of mature white adipocytes into preadipocyte-like precursors during lactation // Cell Metab. 2018. V. 28. № 2. P. 282–288.
Wang W., Seale P. Control of brown and beige fat development // Nat. Rev. Mol. Cell Biol. 2016. V. 17. № 11. P. 691–702.
Weisberg S.P., McCann D., Desai M. et al. Obesity is associated with macrophage accumulation in adipose tissue // J. Clin. Invest. 2003. V. 112. № 12. P. 1796–1808.
Wu Z., Rosen E.D., Brun R. et al. Cross-regulation of C/EBP alpha and PPAR gamma controls the transcriptional pathway of adipogenesis and insulin sensitivity // Mol. Cell. 1999. V. 3. № 2. P. 151–158.
Xu H., Barnes G.T., Yang Q. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance // J. Clin. Invest. 2003. V. 112. № 12. P. 1821–1830.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии



