Успехи современной биологии, 2022, T. 142, № 3, стр. 253-267
Контуры теории функционирования водных экосистем: биогенное лимитирование
А. Л. Рижинашвили *
Санкт-Петербургский филиал Института истории естествознания и техники им. С.И. Вавилова РАН
Санкт-Петербург, Россия
* E-mail: railway-ecology@yandex.ru
Поступила в редакцию 17.11.2021
После доработки 25.02.2022
Принята к публикации 05.03.2022
- EDN: KMBGNA
- DOI: 10.31857/S0042132422030061
Аннотация
Процесс эвтрофирования водоемов, то есть повышения биологической продуктивности их экосистем, за последние десятилетия приобрел настолько глобальный масштаб, что сегодня речь идет об озерах как “горячих точках” углеродного бюджета биосферы. Для прогноза эмиссии с поверхности водных объектов углекислого газа, а также оценки их продукционного и самоочистительного потенциала, необходимы теоретические представления о механизмах функционирования водных экосистем. Однако до сих пор основные положения теории этих вопросов до конца не разработаны. В частности, не решена проблема биогенного лимитирования. Господствовавшая с 1960-х гг. фосфорная парадигма в начале ХХI в. подверглась существенному пересмотру, так как неоднократно была показана ведущая роль азота в контроле первичного продукционного процесса. Но единого мнения о том, когда экосистема лимитирована по азоту, а когда – по фосфору, либо когда наблюдается ко-лимитирование, не выработано. В статье решение поставленного вопроса проводится на основе ретроспективного анализа состояния продукционной гидробиологии с начала ХХ в., а также анализируются выполненные в последние два десятилетия работы, посвященные биогенному лимитированию водных экосистем. Обсуждается также широкий экологический контекст принципа лимитирующего фактора Ю. Либиха, его биологический смысл. Вероятнее всего, в каждом водоеме действует локальная совокупность условий, обеспечивающая смену периодов азотного или фосфорного ограничения фотосинтеза фитопланктона. Дальнейшие исследования проблемы биогенного лимитирования должны быть направлены на выяснение особенностей взаимодействия водорослей и бактерий, в особенности, на участие бактерий в цикле азота и деструкции органических соединений.
ВВЕДЕНИЕ
Процесс эвтрофирования водоемов, то есть повышения биологической продуктивности их экосистем, за последние десятилетия приобрел настолько глобальный масштаб, что сегодня речь идет об озерах как “горячих точках” углеродного бюджета биосферы (см., например, Holgerson et al., 2022). В связи с современными климатическими процессами внимание привлекает проблема эмиссии водоемами углекислого газа (Doyle et al., 2021). По-прежнему актуальным остается вопрос о прогнозе “цветения” воды цианобактериями, выделяющими крайне токсичные вещества (Hennemann, Petrucio, 2016). Для оценки продукционного и самоочистительного потенциала гидроэкосистем необходимы теоретические представления о механизмах их функционирования. Существует определенное мнение, что теория эвтрофирования водоемов уже в значительной мере разработана (Алимов и др., 2009). Парадоксально, но ее основные положения в четко сформулированном виде пока не известны ни в российской, ни в общемировой литературе.
Понятно, что первичным звеном продукционного процесса в водных экосистемах является фитопланктон (включая водоросли и цианобактерии). Условия жизни данной группы организмов определяются, в частности, доступностью элементов минерального питания, из которых азоту и фосфору традиционно придается первостепенное значение. Соответственно, взаимосвязь между показателями обилия планктонных водорослей (их биомасса, содержание основного фотосинтетического пигмента – хлорофилла а) и содержания указанных главных биогенных элементов на протяжении десятилетий становилось предметом исследовательского внимания гидробиологов и лимнологов. Разрешение вопроса о том, каким образом и в какой степени фитопланктон откликается на скорость поступления (биогенную нагрузку) и концентрацию форм азота и фосфора в воде является принципиальным для разработки представлений о путях и механизмах эвтрофирования водоемов.
Во второй половине ХХ в. постепенно стало складываться убеждение о преимущественно фосфорном лимитировании фитопланктона в пресных водах, возникла так называемая фосфорная парадигма (Бульон, 2016; Lewis, Wurtsbaugh, 2008). Корни этой парадигмы заслуживают отдельного анализа, который будет проведен ниже в этой статье. С другой стороны, данные работ последних двух–трех десятилетий заставляют пересмотреть сложившиеся взгляды. Роль фосфора как лимитирующего элемента питания уже не представляется столь бесспорной и определяющей. Происходит вполне четкое осознание того, что азот также может выступать в качестве лимитирующего фактора, как наряду с фосфором (ко-лимитирование), так и отдельно. Интересно, что библиометрический анализ гидробиологических публикаций в мире за 1900–2013 гг. показал, что внимание к азоту в анализе явлений эвтрофирования все более возрастает в последние два десятилетия (Gao et al., 2015). Как следует из результатов многочисленных исследований, рассмотрение которых будет проведено ниже, переход в лимитировании от фосфора к азоту и наоборот зависит и от географического положения водоема, особенностей его водосбора, морфометрии, и от тесноты связи биотических компонентов экосистемы (по крайней мере, в планктонном сообществе). Вместе с тем, представления о характере лимитирования носили и носят разрозненный и нередко противоречивый характер.
В основу настоящей работы положен обзор и анализ современных взглядов на проблему лимитирования экосистем пресноводных водоемов биогенными элементами с целью приведения их в систему. Данный анализ будет проведен с обращением к ретроспективе развития продукционной гидробиологии и одному из основных принципов экологии – правилу лимитирующего фактора Ю. Либиха. Внимание будет сосредоточено на дилемме азот–фосфор. Необходимо отметить, что интерес только к биогенным элементам и только к азоту и фосфору сужает проблему, так как в целом ряде случаев лимитирующим фактором для фитопланктона может выступать свет, а среди биогенных элементов – углерод. Однако сведение проблемы лимитирования к конкуренции двух основных элементов служит на настоящем этапе исследований попытке выделить общие черты функционирования фитопланктона пресных вод в зависимости от биогенной нагрузки.
ПРАВИЛО ЛИБИХА В ОТНОШЕНИИ ПРОБЛЕМЫ ЛИМИТИРОВАНИЯ ТРОФНОСТИ ВОДОЕМОВ
Традиционно принято считать, что Ю. Либих в 1840 г. предложил принцип (правило, закон) лимитирующего фактора (Никольский, 2014). Согласно этому принципу, широко кочующему из учебника в учебник, жизнедеятельность организма определяется фактором, находящимся в минимуме (Одум, 1986). Иными словами, во всей совокупности факторов подразумевается наличие некоего “слабого звена”, которое регулирует максимально возможную урожайность растений. Однако стоит отметить, что никакого правила сам Либих в своем труде “Химия в приложении к земледелию и физиологии” (Либих, 1936) не предлагал. Вероятно, речь может идти о краткой формулировке основной идеи, проходящей через весь труд ученого, – необходим возврат в почву всех вынесенных с урожаем элементов питания. Более того, Либих не акцентирует внимание на веществе, находящемся в наименьшем количестве, но говорит о необходимости соблюдения определенной пропорции между разными компонентами удобрений, ибо в случае относительной нехватки какого-либо одного не проявится действие других. Однако без достаточных оснований именно отдельные высказывания Либиха впоследствии оказались возведенными в ранг вполне конкретного принципа или правила в общей экологии, причем даже с такой формулировкой, в которой акценты явно смещены.
При трактовке приложений принципа Либиха нужно обязательно учитывать, что исходно он был предложен для сельскохозяйственных растений. Действительно, именно в случае искусственного выращивания культур актуальность приобретает необходимость возврата вынесенных с урожаем из почвы химических элементов. Стоит отметить, что в водоеме это не имеет принципиального значения, так как в целом распад организмов после их гибели приводит к возврату усвоенных ими веществ в среду. В этом состоит принципиальное затруднение для приложения идей Либиха в гидробиологии. Следовательно, в водоемах должны действовать иные причинно-следственные механизмы, регулирующие жизнедеятельность и продуктивность организмов, их отклик на имеющиеся элементы питания.
Во второй половине XIX в.–начале ХХ в. стала распространяться популярная и довольно широкая аналогия продуктивности водоемов и плодородия почв, что связывалось с практическими потребностями рыбного хозяйства. Агрохимические принципы Либиха были перенесены на жизнедеятельность организмов в морях и внутренних водоемах (Джонстон, 1919; Shelford, 1913). В 1901 г. появился так называемый метод химических стаканов К. Кнауте (K. Knaute) (Сомов, 1920), позволяющий определить потребность фитопланктона в водоеме в том или ином элементе. Сущность его была довольно проста и состояла в добавлении минеральных солей к пробам воды; по развитию основных видов водорослей можно было судить о нехватке какого-либо вещества или элемента питания. “Метод стаканов”, по мнению специалистов рыбного хозяйства, является практическим применением правила Либиха (Сомов, 1920). Авторы указывали также на необходимость учета стехиометрического соотношения между основными элементами питания. Впоследствии в СССР А.В. Францев и К.А. Гусева разработали методику прогноза гидробиологической производительности водоемов, сходную с “методом стаканов” (см., например, Гусева, 1938).
Однако полноценная теоретическая основа представлений о лимитировании водоемов биогенными элементами появилась только в связи с разработкой основ региональной лимнологии Э. Науманном (см., например, Науманн, 1927). Нужно сказать, что Науманн не выделял какой-либо один элемент питания в качестве основополагающего для развития фитопланктона. Его концепция связывала продуктивность фитопланктона с геологическими условиями местности, в том числе, с химическим составом пород и почв региона. При этом подразумевался весь набор основных химических элементов (азот, фосфор, кальций, железо, и др.) без выделения какого-либо одного. Очевидно, что в разных регионах у фитопланктона будет различная обеспеченность ими.
Единичные наблюдения лимитирования развития планктона тем или иным элементом в естественных водоемах стали появляться в первой четверти ХХ в. (Киселев, 1941). Иногда именно азот стал выступать в качестве основного жизненно необходимого элемента. Так, известна попытка определить количество рыбы в озере, исходя из данных по концентрации азотсодержащих соединений в воде и донных отложениях (Озеров, 1924). В этой работе автор ссылается на аналогию с агрикультурой, где азот, по его мнению, имеет первенствующее значение.
Когда появилась система градации водоемов по уровню трофии? Дж.Э. Хатчинсон (Hutchinson, 1973) полагает, что благодаря Э. Науманну в 1919 г., который перенял соответствующую терминологию из Г. Вебера (G.A. Weber). Согласно Хатчинсону, Вебер в 1907 г. описывал условия питания флоры торфяных болот Германии, выделив эвтрофную, мезотрофную и олиготрофную стадии развития, которые связаны с поступлением соответствующих количеств минеральных веществ. Однако, видимо, соответствующие термины пришли примерно в это же время из микробиологии. Об этом очень ярко свидетельствует работа российского альголога А.П. Артари (1913). Проводя эксперименты с питанием одноклеточных водорослей, он задумался над классификацией организмов по отношению к концентрации солей и глюкозы (“крепости растворов”). Обсуждая терминологию, он ссылается на микробиолога М. Бейеринка и физиолога А. Пюттера. Первый предложил подразделять микроорганизмы по отношению к азотистым веществам на олигонитрофильные, мезонитрофильные, и полинитрофильные. Пюттер же классифицировал организмы по отношению к концентрации общего питательного раствора на олиготрофофильные, мезотрофофильные и политрофофильные. Артари присоединился к этой классификации и для краткости предложил различать олиготрофные, мезотрофные и политрофные организмы. Согласно Артари, в подразделении организмов по отношению к питательным веществам важнее осмотическое давление среды, а не собственно ее питательный состав. Поскольку ученый установил возможность потребления водорослями органических веществ, то и предложил пользоваться концентрациями глюкозы для маркировки границ олиго-, мезо- и политрофии. На терминологические построения Артари повлияла также разработка Р. Кольквитцем и М. Марссоном в 1902 г. системы сапробности организмов. Так, он считает, что полисапробы (по Кольквитцу и Марссону) часто бывают и политрофами. Хотя Артари говорит об организмах, а не о водоемах, сходство терминологии представляется поразительным. Не исключено, что обсуждаемые термины (“олиготрофный”, “мезотрофный”, “эвтрофный”) появились независимо у нескольких авторов в начале ХХ в. Основывались они, как пишет и сам Науманн, на вполне очевидной мысли о градации значений факторов на область олиготипа, мезотипа и политипа. Он же упоминает о том, что это принято в микробиологии. Кстати, в своей наиболее известной работе Науманн (1927) употребляет термин “политрофия” для факторов и “эвтрофный” для водоемов.
Советский гидробиолог В.М. Рылов и венгерский гидрохимик Р. Мауха особенно высоко оценивали ведущий принцип региональной лимнологии – зависимость интенсивности развития и продуцирования фитопланктона от геологических особенностей того или иного района. По В.М. Рылову региональная лимнология “по своей природе является чисто экологической доктриной, основанной на физиологии питания продуцентов” (Rylov, 1929, p. 538). Согласно его мнению, спектры среды “нужно понимать в смысле закона минимума” (там же). Рылов отмечает, что “количество фосфора и азота в естественных условиях часто не соответствует требованиям закона минимума, и, таким образом, эти элементы играют роль ограничения продукции или “минимальных факторов” (там же). По Мауха (Maucha, 1924) фотосинтез фитопланктона служит ключом к решению вопросов взаимодействия “неорганической среды” и “гидробиоса” (терминология Мауха). Интересно, что сам Мауха считал именно углекислый газ наиболее важным компонентом среды, ограничивающим развитие водорослей.
Получается, что ранние исследователи вопросов трофности водоемов не выделяли какой-либо отдельный фактор в развитии фитопланктона как лимитирующий – все зависит от условий местности. Однако на данном этапе это были достаточно общие соображения.
АЗОТ vs ФОСФОР
Как уже отмечалось, первоначальные идеи о зависимости продукции фитопланктона от геологических условий местности в рамках региональной лимнологии не предполагали выделения какого-либо одного фактора продуктивности. Азот и фосфор многие гидробиологи первой половины ХХ в. часто рассматривали наравне и наряду с другими элементами (Киселев, 1941). Интересно, что в СССР вопросам лимитирования продуктивности водоемов практически до 1970-х гг. почти не уделяли специального внимания (см. обзор у Михеевой, 1983). В этой связи показательно, что в классической монографии Г.Г. Винберга (1960) “Первичная продукция водоемов”, обобщающей материалы по продукции и деструкции прудов, озер и морей, условия биогенного лимитирования почти не затрагиваются. В литературе того времени можно найти лишь отдельные упоминания по обсуждаемым вопросам. В частности, особенно много дискутировалась данная проблема в 1950-е гг. в связи с удобрением прудов. Г.Г. Винберг обратил внимание на ведущую роль азота в продукционных процессах в прудах (Винберг, Ляхнович, 1965). Интересна попытка выделения гидрохимических зон продуктивности озер и водохранилищ, предпринятая И.В. Барановым (1982). Автор учитывал всю совокупность физико-химических факторов в зависимости от географических условий. И.В. Баранов (1948) высказал мнение, что существуют зоны биогенных минимумов, взаимно связанные с характером водосбора. Он же показал, что водоемы силурийского плато – водоемы минимума по фосфору, а северные водоемы – по азоту. В мировой литературе с самого начала ХХ в. проводилось довольно много исследований, направленных на выяснение химического состава воды в водоемах. Здесь стоит отметить, прежде всего, работы школы Э. Берджа–Ч. Джудея, а затем Дж.Э. Хатчинсона. Ученик Хатчинсона Э. Диви в 1940 г. опубликовал работу с примечательным названием “Вклад в региональную лимнологию” (Deevey, 1940). В ней, пожалуй, впервые четко ставится вопрос о первостепенном значении фосфора для развития фитопланктона в пресных водах. Однако указывается, что азот также объясняет заметную долю дисперсии в содержании хлорофилла. Автор заключает, что “азот и фосфор действуют совместно в обеспечении большей части наблюдаемой изменчивости хлорофилла” (Deevey, 1940, p. 731). В сущности, Диви положил начало так называемому регрессионному пути решения проблемы лимитирования фитопланктона, когда по концентрации элемента можно предсказывать содержание хлорофилла.
Известно, что зарождение так называемой фосфорной парадигмы отсчитывают с классической работы Р. Волленвейдера (R. Vollenweider) 1968 г. (Lewis, Wurtsbaugh, 2008). Существует несколько причин, по которым фосфор оказался первенствующим в вопросе лимитирования пресноводных экосистем. Во-первых, в отличие от фосфора азот в ряде химических форм более лабилен и поэтому труднее поддается количественному учету (например, выделяются газообразные формы – молекулярный азот, окислы азота, и аммиак). Ряд соединений фосфора, напротив, нерастворим и легко выпадает в осадок. Собственно, расчеты Волленвейдера основываются, в том числе, на коэффициенте водообмена, с помощью которого можно оценить степень удержания фосфора. В этой связи стоит упомянуть и работу Хатчинсона, в которой цикл фосфора и цикл железа, который также дает нерастворимые соединения, рассматриваются как взаимосвязанные (Hutchinson, 1941). Во-вторых, традиционно считается, что потери азота в естественных водоемах могут быть компенсированы за счет азотфиксации. Наконец, в-третьих, повышенное внимание к фосфору связано с возрастающим по интенсивности применением во второй половине ХХ в. удобрений и моющих средств, содержащих этот элемент, который вносится с поверхностным стоком в водоемы (Даценко, 2007; Бульон, 2016).
В какой мере азотфиксация может привести к такому обеспечению фитопланктона азотом, при котором его лимитирование этим элементом будет исключено? Многократно повторяется мнение, что азотфиксация является энергозатратным процессом, а имеющиеся количественные данные указывают на крайнюю недостаточность поступления азота в водоемы за счет азотфиксации. Так, по наблюдениям в озерах Саскачевана (Канада) темпы азотфиксации в среднем только на 11.3% (медиана – 3.5%) удовлетворяют потребности фитопланктона в азоте, и масса фиксированного цианобактериями азота составляет 7.5% от общего поступления этого элемента в водоем (Hayes et al., 2019). Авторы делают вывод, что, несмотря на то, что фиксированный азот помогает поддерживать первичную продукцию, это не исключает лимитирование по азоту в богатых фосфором озерах. В небольшом мелководном озере в штате Вермонт (США) за счет азотфиксации фитопланктон получал только 9% азота, невзирая на то, что цианобактерии составляли 81–98% общей биомассы (Ferber et al., 2004). Таким образом, темпы азотфиксации в водоемах, видимо, далеко не всегда соответствуют тем, что необходимы для обеспечения их экосистем азотом. С другой стороны, по данным для одного из канадских озер (северо-запад Онтарио), азотфиксация составляет заметную часть общей азотной нагрузки на эпилимнион в период быстрого развития “цветения” (Higgins et al., 2018). По материалам, полученным для других озер Канады, атмосферный азот, фиксируемый цианобактериями, обеспечивает как минимум 12–38% потребностей водорослей в эвтрофных озерах (Patoine, Leavitt, 2008). Однако эти оценки варьируют в зависимости от географических особенностей озер, года наблюдений и условий в конкретном водоеме. Имеет значение конкуренция между азотфиксирующими (диазотрофными) и неазотфиксирующими видами; последние могут быть лимитированы по азоту даже в присутствии азотфиксаторов (Gerven et al., 2019). Интересно, что цианобактерии (как диазотрофные, так и неазотфиксирующие) способны запасать азот в составе пигментов фикобилипротеинов, что, очевидно, помогает им преодолевать дефицит азота (Wang et al., 2021).
Обычно наблюдающаяся тесная связь между содержанием хлорофилла и концентрацией фосфора принимается за доказательство лимитирования экосистемы фосфором (Даценко, 2007). Действительно, судя по графикам, рассеяние точек наблюдений демонстрирует почти функциональную связь в случае с фосфором, нежели с азотом (рис. 1; см. также Phillips et al., 2008). Это дает возможность получать регрессионные зависимости, имеющие, как считалось, прогностическое значение в практических вопросах (см., например, классическую статью Dillon, Rigler, 1974). Однако было показано, что в лимитированных по азоту озерах содержание последнего не всегда лучше (по сравнению с концентрацией фосфора) коррелирует с хлорофиллом (Prairie et al., 1989). Кроме того, согласно принципу оптимума, отклик организма на градиенте фактора среды должен носить нелинейный характер. Отсюда можно предполагать наличие областей усиления, оптимума и угнетения жизнедеятельности.
Рис. 1.
Зависимость годовой первичной продукции (ПП) фитопланктона озер Латгалии (юго-восточная Латвия) от: (а) – среднегодовой концентрации неорганического азота (аммония и нитрата), Ni; (б) – среднегодовой концентрации общего фосфора, Рt. Приведены оценки коэффициента корреляции (r) и доверительная вероятность (р). Данные для построения графиков заимствованы из: Трансформация органического..., 1989.
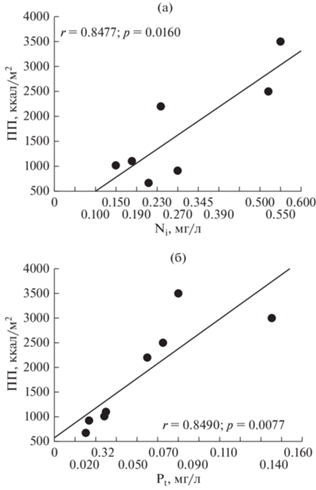
К сожалению, попытки решить вопрос о биогенном лимитировании экосистем водоемов на сегодня зачастую сводятся к метаанализу большого массива данных. Между тем, применение все более изощренных статистических методов анализа, пришедших на смену регрессионным уравнениям и линиям, само по себе не вскрывает биологического механизма лимитирования и не дает однозначного ответа на вопрос о его характере.
Недавно на большом массиве данных по озерам всего мира был показан сигмоидальный характер связи хлорофилла и фосфора (Quinlan et al., 2021). Линейный участок в концентрации общего фосфора находится в области 0.004–0.23 мг/л (4–230 мкг/л). При превышении верхнего порога данного диапазона фитопланктон не реагирует на дальнейший рост содержания фосфора в воде. За пределами линейного участка в областях низкой и высокой концентрации фосфора находились озера регионов с очень холодным и жарким климатом соответственно. Коллектив канадских исследователей (McCauley et al., 1989) пришел к выводу, что при высоких концентрациях фосфора азот может выступать в качестве лимитирующего фактора. Правда, приводимый ими диапазон концентрации общего фосфора, на котором связь с хлорофиллом прямолинейна, очень широк, составляя 50–1000 мкг/л. По данным Хольгерсона с соавт. (Holgerson et al., 2022), валовая продукция фитопланктона положительно связана с концентрацией общего фосфора в озерах, для которых его содержание укладывается в пределы 11–75 мкг/л. Фильструп и Даунинг (Filstrup, Downing, 2017) указывают границу в 100 мкг/л – выше этой концентрации фосфора содержание хлорофилла возрастает в зависимости от общего азота. Граничную концентрацию растворимых форм фосфора в 50 мкг/л приводят Дональд c соавт. (Donald et al., 2011).
Намечается тенденция к усилению эвтрофирования в озерах с высокой концентрацией фосфора при поступлении в них азота (Donald et al., 2011). Хлорофилл слабо реагирует на общий азот, когда мало фосфора. При достижении же определенной концентрации общего азота содержание хлорофилла снижается, а нитрат представляет доминирующую форму азота (Filstrup, Downing, 2017). Указано также, что граница между олиготрофным и мезотрофным состоянииями озера является одновременно границей между дефицитом и избытком азота (Scott et al., 2019).
Денитрификация способствует удалению азота, накопленного в результате азотфиксации, во многих эвтрофных озерах (Scott et al., 2019), в результате чего озера становятся лимитированными по азоту. Авторы показали, что, возможно, по этой причине испытывают дефицит азота 51% олиготрофных озер, 60% – мезотрофных, 72% – эвтрофных, 89% – гипертрофных. Здесь интересно, что с возрастанием трофности дефицит азота нарастает. По данным, полученным на 831 озере всего мира, было установлено, что в ряду от олиготрофных к гипертрофным озерам вероятность ко-лимитирования азотом и фосфором возрастает с 15 до 67%, при этом вероятность лимитирования только по фосфору снижается с 77 до 22.3% (Zhou et al., 2022).
Избыток азота может оказывать и угнетающее действие на фитопланктон. Так, на примере некоторых озер сельскохозяйственных регионов США показано, что азот в нитратной форме приводит к так называемому subsidy-stress-эффекту для функционирования хлорофилла (Filstrup et al., 2018).
ГЕОГРАФИЧЕСКИЕ ОСОБЕННОСТИ ЛИМИТИРОВАНИЯ ТРОФНОСТИ
Поскольку исходно концепция региональной лимнологии опиралась на зональные закономерности состава почв и горных пород, то логично обратиться к очевидному вопросу: связан ли характер лимитирования (по азоту и по фосфору) с географическим положением водоема и характером угодий его водосбора?
Некоторые авторы обращают внимание на широтную изменчивость лимитирования водоемов по биогенным элементам (Гашкина, Моисеенко, 2010; Гашкина, 2011). А именно, в европейской части России при продвижении с севера на юг (по направлению от тундры к степи) происходит смена лимитирования от азота к фосфору. Иными словами, северные водоемы лимитированы по азоту, тогда как южные – по фосфору. Так, в тундре 81% озер лимитированы по азоту, в лесах таких озер уже 39%, в степях же – 0%. Авторы исследования связывают это с составом почв, которые отличаются степенью подвижности разных элементов. Впрочем, здесь имеет значение и трофический статус водоема (чем выше трофический уровень, тем больше накапливается фосфора по сравнению с азотом), и соотношение концентраций азота, фосфора и углерода. Поэтому ученые делают вывод о неоднозначном характере лимитирования трофности, указывая на частое ко-лимитирование азотом и фосфором.
По данным Абель с соавт. (Abell et al., 2012), изучавшими широтную изменчивость содержания хлорофилла в водоемах мира в связи с концентрацией биогенов, фосфор все же важнее как лимитирующий фактор, тогда как азот статистически более значим только для мелководных озер. Однако при разработке практических рекомендаций по восстановлению водоемов и профилактике эвтрофирования важно учитывать и азот.
В литературе накопилось достаточно много свидетельств того, что северные озера лимитированы по азоту. При объяснении причин такого положения указывается на явление браунификации (гумификации), при котором в водоемы поступает избыточное количество терригенного гумуса (Isles et al., 2020). Полагают, что именно озера с темной водой, гумифицированные, оказываются лимитированными по азоту (Phillips et al., 2008). Возрастание содержания органического углерода в воде может играть двоякую роль в отношении азота: с одной стороны, поступающие органические вещества сами служат источником минерального азота, а с другой – стимулируют денитрификацию за счет усиления активности бактерий. Денитрификация способствует удалению азота из водной экосистемы в воздушную среду, обусловливая таким образом азотное лимитирование. Действительно, как выяснилось, в Швеции 79% озер лимитированы по азоту (Isles et al., 2020). Однако, возможно, что лимитирование по азоту не связано напрямую с браунификацией, так как интенсивность самой браунификации ковариирует с количеством атмосферных выпадений азота. Есть данные (Isles et al., 2018), свидетельствующие, что лимитирование зависит от атмосферных выпадений неорганического азота. В последние годы наблюдается уменьшение выпадений азота, особенно на северных территориях. Поэтому азотное лимитирование становится более распространенным в субарктических и бореальных территориях Европы: сейчас здесь 63% озер лимитированы по азоту и 20% ко-лимитированы азотом и фосфором, тогда как раньше их было 32 и 45% соответственно. Сдвиг к азотному лимитированию может способствовать развитию цианобактерий, особенно если при этом возрастает температура (Isles et al., 2018). Существует также мнение, что озера в естественном состоянии лимитированы по азоту, тогда как по фосфору они становятся лимитированными при интенсификации атмосферных выпадений (Bergstrom et al., 2008). Действительно, показано, что многие олиготрофные озера являются азот-лимитированными.
Браунификация сама по себе несет еще одно важное следствие для функционирования фитопланктона – уменьшение прозрачности воды. Показана унимодальная зависимость первичной продукции и биомассы фитопланктона от концентрации растворенного органического углерода (РОУ) (Bergstrom, Karlsson, 2019; Stetler et al., 2021; Holgerson et al., 2022). Пик продукции или биомассы наблюдается в районе промежуточных значений последней. В качестве таких значений указываются различные, но близкие, числа: 11 мг/л (озера Швеции, изучалась среднегодовая биомасса фитопланктона; Bergstrom, Karlsson, 2019); от 4.5 до 10 мг/л, в среднем 7 мг/л (158 озер мира, валовая первичная продукция; Holgerson et al., 2022). Интересно, что приводимые числа попадают в интервал (5–10 мг/л углерода), отделяющий так называемые автотрофные озера от гетеротрофных (Prairie et al., 2002; Hanson et al., 2003). Действительно, при превышении пороговой концентрации РОУ свет выступает лимитирующим фактором, и преобладающим процессом становится не продукция, а деструкция аллохтонных органических веществ.
Противоречивы данные о влиянии характера угодий водосбора на лимитирование озерных экосистем.
Так, по Ванни с соавт. (Vanni et al., 2011) фитопланктон в озерах с лесным водосбором лимитирован по азоту, тогда как с сельскохозяйственным – по фосфору. В озерах со смешанным характером угодий водосбора происходит сезонный сдвиг лимитирования от фосфора к азоту. Авторский коллектив также показал, что главным источником потерь азота в водоемах с хозяйственно освоенным водосбором может служить денитрификация. Был сделан вывод, что вопрос о лимитировании следует решать с учетом специфики водосбора и конкретных видов угодий. Авторы полагают, что взаимоотношения между азотом, фосфором, и уровнем продуктивности фитопланктона в значительной степени регулируются характером угодий водосбора. Данные Хэйс с соавт. (Hayes et al., 2015) свидетельствуют о том, что погодные условия вносят дополнительный вклад: фитопланктон в сельскохозяйственных ландшафтах лимитирован по фосфору, но при засухе лимитирование сдвигается на азот. Засуха стимулирует развитие азотфиксирующих бактерий. По данным того же исследования лесные озера всегда лимитированы по азоту, независимо от наступления засушливого периода.
Глубина озер оказалась одним из факторов, определяющих характер лимитирования. Считается, что мелководные (с глубиной менее 6 м) озера лимитированы по азоту, а глубоководные – по фосфору. Так, общий азот оказался значимым предиктором биомассы фитопланктона в мелководных озерах (Donis et al., 2021). К близким результатам пришли Абель с соавт. (Abell et al., 2012), однако здесь речь идет об озерах низких широт (Новая Зеландия). То, что для мелководных озер роль общего азота выше, чем фосфора, указывали также Мосс с соавт. (Moss et al., 2013). Интересно, что наши стехиометрические расчеты обеспеченности первичной продукции неорганическим азотом указывают на возможную взаимосвязь обеспеченности с глубиной прозрачности водоема (Рижинашвили, Максимова, 2017). Иными словами, чем больше прозрачность водоема, тем в меньшей степени водоем лимитирован по неорганическому азоту. Как правило, водоемы с большей глубиной обладают и наибольшей прозрачностью. Почему планктонные продуценты именно в мелководных озерах могут испытывать дефицит азота? Здесь в качестве одной из причин можно указать на конкуренцию за него с бактериопланктоном (Рижинашвили, Максимова, 2017). Кроме того, экосистемы мелководных озер отличаются повышенной биологической активностью в силу хорошей освещаемости и прогреваемости водной массы (Moss et al., 2013). В этих условиях (при повышении температуры) может усиливаться денитрификация, что и приводит к потерям азота (Moss et al., 2013).
В последние несколько лет довольно много работ посвящено влиянию климата на условия биогенного лимитирования водных экосистем. Такой интерес связан с усиливающимися глобальными климатическими изменениями на земном шаре. На примере 230 озер Европы, расположенных в средиземноморской, континентальной и бореальной зонах, показано, что световые условия и интенсивность стратификации объясняют большую часть дисперсии хлорофилла а, нежели содержание биогенных элементов (Donis et al., 2021). По данным этих авторов, особенно такое заключение оказалось верным для общего фосфора, который никогда (! – А.Р.) не выступал в качестве объясняющей переменной, в отличие от общего азота, оказавшегося значимым для мелководных и континентальных озер. Шуво с соавт. (Shuvo et al., 2021) на материале 2561 озера всего мира утверждают, что содержание фосфора и климатические параметры (температура воздуха, осадки, облачность, инсоляция) в равной степени (42 и 38% соответственно) хорошо объясняют содержание хлорофилла. Однако интересно, что указанные авторы взяли в расчет только данные по фосфору, не учитывая ни азот, ни другие биогенные элементы. Ученые сделали вывод, что климатические особенности действуют синергично с фосфором.
Из всех климатических переменных наибольшее внимание гидробиологов всегда привлекала температура, поскольку от ее величины напрямую зависит скорость химических реакций. Накопленные материалы свидетельствуют, что, как правило, температура действует на фитопланктон не непосредственно, а в совокупности с биогенными элементами. В этом отношении весьма показательно симуляционное моделирование, предпринятое Вард с соавт. (Ward et al., 2020) для данных по олитрофному озеру (оз. Санапи, Нью-Гемпшир, США). По результатам этих авторов, медианная летняя концентрация хлорофилла а положительно связана с летней температурой воздуха, в то время как годовой максимум хлорофилла положительно коррелирует с внешней фосфорной нагрузкой за три предшествующих года. Таким образом, типичное летнее содержание хлорофилла (медиана) зависит от климатических особенностей, тогда как пик (“цветение”) обусловливается фосфорной нагрузкой. То есть, речь идет о двух временных шкалах – долговременной (многолетней) и кратковременной (дни и сезоны). В результате эффект, который оказывает на фитопланктон биогенная нагрузка или кратковременные экстремальные явления (например, засуха) может быть запаздывающим. Следует сказать также и о том, что необходимо использование разных показателей состояния фитопланктона, о чем наглядно свидетельствуют приведенные результаты.
Эксперименты с мезокосмами показали, что сообщество организмов фитопланктона более чутко реагирует на изменения концентрации биогенных элементов, нежели на воздействие температурного фактора (Filiz et al., 2020). Более того, чувствительность структуры сообщества к высоким температурам зависит от доступности биогенов. Для датских озер было установлено, что химизм воды (и отчасти морфология озера) оказывает более существенное влияние на таксономическое богатство (на уровне рода) фитопланктона, нежели климат и характер угодий водосбора (Ozkan et al., 2013). При этом общий азот значимее фосфора.
Таксономическая специфичность реакции фитопланктона на температуру также хорошо известна. Часто указывается, что синезеленые водоросли более чувствительны к повышению температуры и лучше растут при ее повышении, чем другие группы (см., например, краткое обсуждение этого вопроса у Hennemann, Petrucio, 2016). На примере трех озер Китая разного трофического статуса показано, что взаимодействие температурного фактора и содержания биогенов определяется таксономическим составом альгофлоры (Dong et al., 2018): в олиготрофном озере, где доминирует зеленая водоросль Mougeotia, биогенный элемент (фосфор) превалирует по значимости над температурой, тогда как в эвтрофном и гипертрофном водоемах, отличающихся доминированием цианобактерий, азот и температура оказывают совместное воздействие.
БИОЛОГИЧЕСКАЯ СПЕЦИФИКА БИОГЕННОГО ЛИМИТИРОВАНИЯ
Необходимо учитывать, что продукционный процесс в экосистемах осуществляют живые организмы. Поэтому, помимо общих условий водоема, его географического положения, имеет значение также и таксономическая специфичность продуцентов, и взаимоотношения между разными группами гидробионтов. Отдельные примеры реакции групп фитопланктона на факторы среды и способность цианобактерий к азотфиксации уже упоминались выше.
Обсуждая таксономический состав водорослей, следует обратить внимание, прежде всего, на размерные отличия. Мелкоклеточные и крупноклеточные формы различаются интенсивностью продуцирования органического вещества (скорость фотосинтеза на единицу массы) (Гутельмахер, 1986). К тому же, например, цианобактерии, как правило, имеют крупные размеры, и поэтому слабее выедаются зоопланктоном. В.В. Бульон (2016) акцентирует внимание на различный характер взаимосвязи биомассы разных по размерам групп фитопланктона с общим фосфором. Так, мелкие (менее 35–50 мкм) водоросли практически не реагируют на изменение концентрации фосфора, тогда как крупноклеточные организмы демонстрируют выраженный нелинейный эффект – сигмоидальную зависимость.
Однако наибольшее значение имеют взаимоотношения гидробионтов в планктонном сообществе. Прежде всего, должно привлечь внимание взаимодействие между водорослями и бактериями. Гидробиологи начала ХХ в. (например, Мауха (Maucha, Unger, 1924)) писали о своеобразном симбиозе этих групп организмов. Г.Г. Винберг (1956) говорил о том, что большая часть первичных органических веществ, образовавшихся в ходе жизнедеятельности фитопланктона, утилизируется бактериями, а не зоопланктоном. Высвобождаемые бактериями углекислый газ и биогенные элементы снова используются фитопланктоном в продукционном процессе. Так, показано, что чистая первичная продукция фитопланктона почти на четверть (на 19%) может опираться на аллохтонный углерод за счет углекислого газа, выделяемого при дыхании бактерий, использующих терригенный гумус (Demars et al., 2020). Авторы считают, что такое положение доказывает возможность углеродного лимитирования водорослей. Углеродное лимитирование (в том числе, по неорганическому углероду) может регулироваться также температурой. Например, указывается, что, в отличие от фотосинтеза, скорость дыхания более чувствительна к изменению температуры. Соответственно при повышении температуры образование углекислого газа будет более интенсивным (Zagarese et al., 2021).
Между водорослями и бактериями имеет место конкуренция. Одним из основных условий конкуренции является доступ лабильных органических соединений. Многие авторы указывают на то, что при высоком содержании этих веществ (измеряемому, например, по БПК5) бактерии выступают конкурентом фитопланктона в биогенных элементах. Так, добавление глюкозы в опытах способствует лимитированию фитопланктона за счет развития бактериопланктона на богатом субстрате (Joint et al., 2002). Наиболее часто встречается лимитирование по азоту. Например, для роста бактерий на углеводах необходимо снять ограничение их в азоте, и углеводы при этом начинают активно использоваться. Нами (Рижинашвили, Максимова, 2017) было показано, что в условиях повышенного БПК5 наблюдается высокая эффективность роста бактериопланктона; в таких водоемах предположительно можно ожидать азотного лимитирования водорослей.
Интересно, что наибольшая эффективность роста бактерий наблюдается как раз на автохтонных органических соединениях, продуцируемых водорослями, поэтому добавление фосфора может содействовать увеличению бактериальной биомассы (за счет интенсификации развития фитопланктона) (Kritzberg et al., 2005). Бактерии интенсивно конкурируют с водорослями при низкой фосфорной нагрузке (Mindl et al., 2005). В результате фосфорного дефицита водоросли выделяют экстрацеллюлярные органические вещества, которые еще более интенсифицируют рост бактерий. Однако при высокой фосфорной нагрузке водоросли наращивают свою биомассу быстрее, чем бактерии. В то же самое время эффективность роста бактерий часто бывает отрицательно взаимосвязана с отношением C : N в субстрате, что лишний раз демонстрирует их высокую потребность в азоте (Kritzberg et al., 2005). Эта потребность, очевидно, может варьировать по сезонам. Так, для бактерий из озера Констанц в Германии было показано, что аминокислоты потребляются ими преимущественно весной, тогда как глюкоза – летом (Weiss, Simon, 1999).
Выедание фитопланктона планктонными ракообразными также указывается в качестве одного из факторов лимитирования трофности (Бульон, 2016). При умеренном прессе со стороны зоопланктона (если судить по соотношению биомасс зоопланктона и фитопланктона) взаимосвязь хлорофилла и фосфора становится более выраженной, тогда как при усиленном выедании выход хлорофилла на единицу массы общего фосфора был меньше. Стоит отметить, что речь идет в большей степени о статистической взаимосвязи, нежели о биологическом механизме: зоопланктон, потребляя водоросли, уменьшает содержание хлорофилла относительно фосфора.
Интересно отметить, что фитопланктон и зоопланктон занимают дифференцированные позиции относительно накопления биогенных элементов. По наблюдениям на польских озерах разного трофического статуса было установлено, что фитопланктон является весьма эффективным потребителем азота, что вызывает нехватку минерального азота в верхнем слое воды и опускание клеток на глубину (Karpowicz et al., 2020). Фитопланктон в целом обладает повышенной потребностью в азоте, которая не покрывается за счет реминерализации его зоопланктоном. Напротив, зоопланктон накапливает много фосфора.
Имеет значение также таксономическая специфичность водорослей в отношении потребления разных форм неорганического азота. Обсуждение этого вопроса принципиально при выявлении конкретного механизма азотного лимитирования и решения дилеммы азот–фосфор в определенных случаях. Из двух превалирующих по содержанию форм ионного азота (аммоний, нитрат) аммоний представляется наиболее предпочтительным для усвоения водорослями (по крайней мере, цианобактериями), так как на его утилизацию требуется меньше энергии (Erratt et al., 2018). Однако многие диатомовые водоросли предпочитают нитрат (Berg et al., 2003; Glibert et al., 2016).
В целом, сведения о предпочитаемых разными таксонами формах азота разноречивы. По данным экспериментов (Donald et al., 2011), разные формы азота (включая мочевину) на фоне высокого содержания фосфора стимулировали развитие примерно одинаковых групп водорослей; азотфиксирующие цианобактерии на добавление соединений азота не реагировали. Относительно видов центрической диатомовой Cyclotella экспериментально показано, что нитрат стимулирует ее рост (Donald et al., 2013). Кроме того, указывается, что эта водоросль обильна в богатых нитратом эвтрофных водах. Добавка аммония к богатой фосфором воде благоприятствует доминированию недиазотрофной водоросли Planktothrix agardhii, способной продуцировать токсичный микроцистин. Добавление мочевины стимулирует рост многих таксонов фитопланктона. Более того, отмечается предпочтение этой формы азота как наименее энергозатратной при потреблении. В целом, по данным цитируемых авторов энергетические траты для ассимиляции восстановленных форм азота (аммоний, мочевина) составляют менее половины от трат, необходимых для усвоения нитрата. В результате в экспериментах увеличение биомассы фитопланктона было 1.5-кратным в случае добавления аммония или мочевины по сравнению с нитратом. Вместе с тем, авторы специально указывают, что на потребление и предпочтение тех или иных форм азота конкретными таксонами водорослей влияет совокупность факторов.
Эксперименты с цианобактериями, вызывающими “цветение” воды (Microcystis, Dolichospermum, Synechococcus) (Erratt et al., 2018), показали, что рост цианобактерий в большей степени стимулируется нитратом и мочевиной, нежели аммонием. Несмотря на это, добавление мочевины способствовало образованию большего количества пигментов, чем в том случае, когда водоросли получали нитрат. Наличие таких клеток “высокого качества” дает цианобактериям преимущество в условиях недостатка света. Не исключено также, что запасание азота в виде пигментов позволяет этой группе фитопланктона избежать азотного лимитирования (Wang et al., 2021).
Установлено, что температура влияет на скорость потребления разных форм неорганического азота водорослями и бактериями (Reay et al., 1999). В отношении нитрата скорость его потребления снижается при наступлении субоптимальной для организма температуры, тогда как для аммония температурной зависимости не отмечено. Сказанное означает, что при низких температурах зависимость от аммония становится определяющей для фитопланктонных организмов. К тому же аммоний даже в небольшой концентрации может ингибировать поглощение водорослями нитрата (Dortch, 1990). Это может объяснить, почему и при высокой концентрации нитрата нередко наблюдается невысокая биомасса фитопланктона.
Наконец, следует обратить внимание на конкуренцию между разными группами водорослей, например, цианобактериями и зелеными водорослями, в результате чего может возникнуть одновременное лимитирование фитопланктонного сообщества по азоту и по фосфору (Chorus, Spij-kerman, 2021). Однако сведений об этом пока немного.
ОТ Р-ПАРАДИГМЫ К N-P-ТЕОРИИ ФУНКЦИОНИРОВАНИЯ ГИДРОЭКОСИСТЕМ
В 2008 г. в одном из центральных гидробиологических журналов “International Review of Hydrobiology” вышла статья с весьма показательным названием “Control of lacustrine phytoplankton by nutrients: erosion of the phosphorus paradigm” (Lewis, Wurtsbaugh, 2008). В ней авторы обобщили взгляды на проблему биогенного лимитирования пресноводных экосистем и предложили основные положения N–P-парадигмы контроля развития фитопланктона в озерах. Эти основные положения следующие: азот и фосфор в равной степени ответственны за лимитирование фитопланктона элементами питания в незагрязненных озерах; часто наблюдаются временные сдвиги в N- или Р-лимитировании, особенно в олиготрофных озерах; низкое соотношение азота к фосфору в сочетании с высокой концентрацией фосфора способствует доминированию азотфиксирующих цианобактерий; азотфиксаторы далеко не полностью покрывают дефицит азота. Сформулированные идеи можно считать достаточно общими взглядами на N–P-контроль.
Тем не менее, нельзя сказать, что вопрос о характере лимитирования пресноводных экосистем решен окончательно или что положение с этой проблемой близко к завершающей стадии разработки. Приведенные в настоящей статье материалы позволяют заключить лишь, что азот, так же как и фосфор, в очень многих случаях необходимо рассматривать как лимитирующий элемент для фитопланктона. Было показано и то, что сдвиги в лимитировании могут происходить в одном и том же озере в течение сезона (при наступлении засухи). Вероятно, в такой ситуации правильнее не искать однозначных формулировок, а предусмотреть возможные варианты роли азота и фосфора в обеспечении ими фитопланктона в разных фазах развития экосистем. Необходимо также отказаться от попыток наметить граничные концентрации азота и фосфора для водоемов разных регионов как от бесперспективных, о чем свидетельствует весь накопленный опыт. Приводимые ниже соображения могут быть применимы, в основном, к водоемам умеренной и отчасти бореальной зоны Европы.
Скорее всего, одним из существенных посредников действия азота и фосфора на планктонные водоросли выступает соотношение автохтонных и аллохтонных органических соединений. Органические вещества одновременно являются и источниками биогенных элементов, и модуляторами абиотических условий в водоеме (которые также могут выступать как лимитирующие факторы). Их химическая природа и количество определяются характером ландшафтов водосбора в сочетании с климатическими особенностями и гидрологическими условиями. Эта сложная комбинация обусловливает наличие двух временных шкал в экосистеме – внутрисезонной (внутригодовой) и многолетней (межгодовой). Данное обстоятельство делает практически бессмысленным оперирование регрессионными линиями связи концентрации азота и фосфора и хлорофилла а или биомассы фитопланктона и первичной продукции, полученным на разных водоемах даже в один и тот же сезон.
При преимущественно автохтонном характере органических соединений и их обильной концентрации бактерии могут выступать серьезным конкурентом фитопланктона за биогенные элементы и особенно за азот. Это объясняет, почему, как показано выше, по мере роста трофии водоема продуценты становятся все в большей степени лимитированными по азоту. Особенно это справедливо для мелководных озер, в которых все биологические процессы протекают с высокой интенсивностью. Это азотное лимитирование, по всей видимости, может быть вторичным, а исходное увеличение первичной продукции контролируется фосфором. Однако такое положение дел наблюдается не всегда, поскольку азотное голодание само по себе может стимулировать экстрацеллюлярную продукцию водорослей (Corzo et al., 2000). Кроме того, нужно иметь в виду интенсивность внешнего водообмена озера – проточные озера получают большую биогенную нагрузку, особенно по азоту, что может снимать лимитирование.
При повышенной нагрузке водоема аллохтонными органическими веществами (терригенным гумусом), то есть в водоемах с лесистым и заболоченным водосбором, ситуация с лимитированием не столь ясная. Гумусовые вещества, как известно, весьма разнообразны по составу и содержат не только азот и фосфор, но даже моносахариды (Попов, 2004), которые могут быть питательным субстратом для бактерий. По этой причине водоемы с сильно гумифицированной водой нельзя считать обедненными биогенными элементами. Деструкция аллохтонных органических соединений бактериями способствует высвобождению минеральных форм азота и фосфора. Однако использование питательных веществ водорослями здесь может быть затруднено рядом условий: лимитирование светом из-за повышенной цветности, дефицит неорганического углерода в водах с малой минерализацией и кислой реакцией среды. К тому же гумусовые вещества разного состава могут быть в различной степени устойчивы к непосредственной бактериальной атаке. Именно непостоянством состава гумусовых веществ, скорее всего, объясняются противоречивые данные о характере связи фитопланктона c азотом и фосфором.
ЗАКЛЮЧЕНИЕ
Вероятно, нет каких-либо зональных факторов биогенного лимитирования продуктивности, но в каждом водоеме действует локальная совокупность условий, обеспечивающая смену периодов азотного или фосфорного ограничения фотосинтеза фитопланктона.
Азотный цикл в водоемах заслуживает самого пристального внимания, так как повышенная химическая и биологическая лабильность нитрата, аммония, мочевины, аминокислот, делают именно азот, а не фосфор, своеобразным “слабым звеном” в круговороте веществ. В этой связи интересно, что рассчитанная по стехиометрии Рэдфилда условная первичная продукция (в предположении, что весь имеющийся минеральный азот переходит в органическое вещество) весьма близка по величине к реально измеренной в водоеме продукции фитопланктона (Рижинашвили, Максимова, 2017). Такой же расчет условной продукции, проведенный по фосфору, показал, что содержание общего фосфора многократно превышает необходимое для поддержания наблюдаемой продукции количество. Получается, что азот стехиометрически гораздо ближе к потребностям фитопланктона, нежели фосфор. Можно предположить, что азотное лимитирование – весьма частое явление. К сожалению, опыт расчета условной продукции по концентрации биогенных элементов крайне ограничен (см., например, Covino et al., 2018; Rizhinashvili, Maksimova, 2018).
Дальнейшие исследования проблемы биогенного лимитирования должны быть направлены на выяснение особенностей взаимодействия водорослей и бактерий, в особенности, на участие бактерий в цикле азота и деструкции органических соединений. Необходимы количественные оценки масштабов азотфиксации, денитрификации, аммонификации, и нитрификации в водоемах. Сопоставление их с азотной нагрузкой с водосбора и первичной продукцией позволит подойти к формулировке конкретных суждений о недостатке или избытке азота в экосистемах.
Список литературы
Алимов А.Ф., Бульон В.В., Голубков С.М. Ресурсный потенциал видов, сообществ и экосистем континентальных водоемов // Успехи соврем. биол. 2009. Т. 129. № 6. С. 516–527.
Артари А.П. К физиологии и биологии хламидомонад. М.: Типография Русского товарищества, 1913. 78 с.
Баранов И.В. Исследование фотосинтеза в водоемах Силурийского плато Ленинградской области // Вестн. ЛГУ. 1948. № 7. С. 58–68.
Баранов И.В. Основы биопродукционной гидрохимии. М.: Легкая и пищевая промышленность, 1982. 112 с.
Бульон В.В. Новый взгляд на парадигму фосфорного контроля в лимнологии // Успехи соврем. биол. 2016. Т. 136. № 3. С. 311–318.
Винберг Г.Г. Первичная продукция планктона // Журн. общ. биол. 1956. Т. 17. № 5. С. 364–376.
Винберг Г.Г. Первичная продукция водоемов. Минск: Изд-во Академии наук БССР, 1960. 329 с.
Винберг Г.Г., Ляхнович В.П. Удобрение прудов. М.: Пищевая промышленность, 1965. 271 с.
Гашкина Н.А. Зональные особенности распределения биогенных элементов и органического вещества в малых озерах // Водные ресурсы. 2011. Т. 38. № 3. С. 325–344.
Гашкина Н.А., Моисеенко Т.И. Лимитирование трофности малых озер по основным биогенным элементам // ДАН. 2010. Т. 435. № 3. С. 394-398.
Гусева К.А. Гидробиологическая производительность и прогнозы цветения водоемов // Микробиология. 1938. Т. 7. Вып. 3. С. 303–315.
Гутельмахер Б.Л. Метаболизм планктона как единого целого: трофометаболические взаимодействия зоо- и фитопланктона. Л.: Наука, 1986. 155 с.
Даценко Ю.С. Эвтрофирование водохранилищ. Гидролого-гидрохимические аспекты. М.: ГЕОС, 2007. 252 с.
Джонстон Дж. Условия жизни в море. Петроград: Девятая Государственная Типография, 1919. 372 с.
Киселев И.А. Новейшие достижения в изучении продуктивности водоемов. I. Факторы, определяющие продуктивность планктона // Природа. 1941. № 1. С. 56–61.
Либих Ю. Химия в приложении к земледелию и физиологии. М.–Л.: ОГИЗ–Сельхозгиз, 1936. 408 с.
Михеева Т.М. Сукцессия видов в фитопланктоне: определяющие факторы. Минск: Изд-во БГУ им. В.И. Ленина, 1983. 72 с.
Науманн Э. Цель и основные проблемы региональной лимнологии // Тр. Косинской биологической станции Московского общества испытателей природы. 1927. Вып. 6. С. 3–11.
Никольский А.А. Великие идеи великих экологов: история ключевых концепций в экологии. М.: ГЕОС, 2014. 189 с.
Одум Ю. Экология. В 2 тт. Т. 1. М.: Мир, 1986. 328 с.
Озеров С.А. К вопросу о химическом определении продуктивности озер // Тр. Научного института рыбного хозяйства. 1924. Т. 1. С. 365–396.
Попов А.И. Гуминовые вещества: свойства, строение, образование / Ред. Е.И. Ермаков. СПб.: СПбГУ, 2004. 248 с.
Рижинашвили А.Л., Максимова О.Б. Оценка обеспеченности первичной продукции в малом озере и его трофический статус // Гидробиол. журн. 2017. Т. 53. № 6. С. 31–42.
Сомов М.П. Основы рыбоводной таксации озерных угодий // Изв. отдела прикладной ихтиологии и научно-промысловых исследований. 1920. Т. 1. Вып. 2. С. 131–336.
Трансформация органического и биогенных веществ при антропогенном эвтрофировании озер / Ред. В.Г. Драбкова, Е.А. Стравинская. Л.: Наука, 1989. 268 с.
Abell J.M., Ozkundakci D., Hamilton D.P., Jones J.R. Latitudinal variation in nutrient stoichiometry and chlorophyll–nutrient relationships in lakes: a global study // Fund. Appl. Limnol. 2012. V. 181/1. P. 1–14.
Berg G.M., Balode M., Purina I. et al. Plankton community composition in relation to availability and uptake of oxidized and reduced nitrogen // Aqua. Microb. Ecol. 2003. V. 30. P. 263–274.
Bergstrom A.-K., Karlsson J. Light and nutrient control phytoplankton biomass responses to global change in northern lakes // Global Change Biol. 2019. V. 25. № 6. P. 2021–2029.
Bergstrom A.-K., Jonsson A., Jansson M. Phytoplankton responses to nitrogen and phosphorus enrichment in unproductive Swedish lakes along a gradient of atmospheric nitrogen deposition // Aqua. Biol. 2008. V. 4. P. 55–64.
Chorus I., Spijkerman E. What Colin Reynolds could tell us about nutrient limitation, N:P ratios and eutrophication control // Hydrobiologia. 2021. V. 848. P. 95–111.
Corzo A., Morillo J.A., Rodriguez S. Production of transparent exopolymer particles (TEP) in cultures of Chaetaceros calcitrans under nitrogen limitation // Aqua. Microb. Ecol. 2000. V. 23. P. 63–72.
Covino T.P., Bernhardt E.S., Heffernan J.B. Measuring and interpreting relationships between nutrient supply, demand, and limitation // Freshwater Sci. 2018. V. 37. № 3. P. 448–455.
Deevey E.S. Limnological studies in Connecticut. Part V. A contribution to regional limnology // Am. J. Sci. 1940. V. 238. № 10. P. 717–741.
Demars B.O.L., Friberg N., Thornton B. Pulse of dissolved organic matter alters reciprocal carbon subsidies between autotrophs and bacteria in stream food webs // Ecol. Monographs. 2020. V. 90. № 1. Art. e01399.
Dillon P.J., Rigler F.H. The phosphorus–chlorophyll relationship in lakes // Limnol. Oceanogr. 1974. V. 19. № 5. P. 767–773.
Donald D.B., Bogard M.J., Finlay K., Leavitt P.R. Comparative effects of urea, ammonium, and nitrate on phytoplankton abundance, community composition, and toxicity in hypereutrophic freshwaters // Limnol. Oceanogr. 2011. V. 56. № 6. P. 2161–2175.
Donald D.B., Bogard M.J., Finlay K. et al. Phytoplankton-specific response to enrichment of phosphorus-rich surface waters with ammonium, nitrate, and urea // PLoS One. 2013. V. 8. № 1. Art. e53277.
Dong J., Zhou Q., Gao Y. et al. Long-term effects of temperature and nutrient concentrations on the phytoplankton biomass in three lakes with differing trophic statuses on the Yungui Plateau, China // Annal. de Limnologie – Int. J. Limnol. 2018. V. 54. Art. 9.
Donis D., Mantzouki E., McGinnis D.F. et al. Stratification strength and light climate explain variation in chlorophyll a at the continental scale in a European multilake survey in a heatwave summer // Limnol. Oceanogr. 2021. V. 66. № 12. P. 4314–4333.
Dortch Q. The interaction between ammonium and nitrate uptake in phytoplankton // Marine Ecol. Progr. Series. 1990. V. 61. P. 183–201.
Doyle B.C., de Eyto E., McCarthy V. et al. Late summer peak in pCO2 corresponds with catchment export of DOC in a temperate, humic lake // Inland Waters. 2021. V. 11. № 2. P. 234–249.
Erratt K.J., Creed I.F., Trick C.G. Comparative effects of ammonium, nitrate and urea on growth and photosynthetic efficiency of three bloom-forming cyanobacteria // Freshwater Biol. 2018. V. 63. P. 626–638.
Ferber L.R., Levine S.N., Lini A., Livingston G.P. Do cyanobacteria dominate in eutrophic lakes because they fix atmospheric nitrogen? // Freshwater Biol. 2004. V. 49. P. 690–708.
Filiz N., Iskin U., Beklioglu M. et al. Phytoplankton community response to nutrients, temperatures, and a heat wave in shallow lakes: an experimental approach // Water. 2020. V. 12. № 12. Art. 3394.
Filstrup C.T., Downing J.A. Relationship of chlorophyll to phosphorus and nitrogen in nutrient-rich lakes // Inland Waters. 2017. V. 7. № 4. P. 385–400.
Filstrup C.T., Wagner T., Oliver S.K. et al. Evidence for regional nitrogen stress on chlorophyll a in lakes across large landscape and climate gradients // Limnol. Oceanogr. 2018. V. 63. № S1. P. S324–S339.
Gao W., Chen Y., Liu Y., Guo H.-Ch. Scientometric analysis of phosphorus research in eutrophic lakes // Scientometrics. 2015. V. 102. P. 1951–1964.
Gerven van L.P.A., Kuiper J.J., Mooij W.M. et al. Nitrogen fixation does not axiomatically lead to phosphorus limitation in aquatic ecosystems // Oikos. 2019. V. 128. P. 563–570.
Glibert P.M., Wilkerson F.P., Dugdale R.C. et al. Pluses and minuses of ammonium and nitrate uptake and assimilation by phytoplankton and implications for productivity and community composition, with emphasis on nitrogen-enriched conditions // Limnol. Oceanogr. 2016. V. 61. № 1. P. 165–197.
Hanson P.C., Bade D.L., Carpenter S.R., Kratz T.K. Lake metabolism: relationships with dissolved organic carbon and phosphorus // Limnol. Oceanogr. 2003. V. 48. № 3. P. 1112–1119.
Hayes N.M., Vanni M.J., Horgan M.J., Renwick W.H. Climate and land use interactively affect lake phytoplankton nutrient limitation status // Ecology. 2015. V. 96. № 2. P. 392–402.
Hayes N.M., Patoine A., Haig H.A. et al. Spatial and temporal variation in nitrogen fixation and its importance to phytoplankton in phosphorus-rich lakes // Freshwater Biol. 2019. V. 64. P. 269–283.
Hennemann M.C., Petrucio M.M. High chlorophyll a concentration in a low nutrient context: discussion in a subtropical lake dominated by Cyanobacteria // J. Limnol. 2016. V. 75. № 3. P. 520–530.
Higgins S.N., Paterson M.J., Hecky R.E. et al. Biological nitrogen fixation prevents the response of a eutrophic lake to reduced loading of nitrogen: evidence from a 46-year whole-lake experiment // Ecosystems. 2018. V. 21. P. 1088–1100.
Holgerson M.A., Hovel R.A., Kelly P.T. et al. Integrating ecosystem metabolism and consumer allochthony reveals nonlinear drivers in lake organic matter processing // Limnol. Oceanogr. 2022. V. 67. № S1. P. S71–S85.
Hutchinson G.E. Limnological studies in Connecticut. IV. The mechanisms of intermediary metabolism in stratified lakes // Ecol. Monographs. 1941. V. 11. № 1. P. 22–60.
Hutchinson G.E. Eutrophication // Am. Scientist. 1973. V. 61. P. 269–279.
Isles P.D.F., Creed I.F., Bergstrom A.-K. Recent synchronous declines in DIN:TP in Swedish lakes // Glob. Biogeochem. Cycl. 2018. V. 32. P. 208–225.
Isles P.D.F., Jonsson A., Creed I.F., Bergstrom A.-K. Does browning affect the identity of limiting nutrients in lakes? // Aqua. Sci. 2020. V. 82. № 2. Art. 45.
Joint I., Henriksen P., Fonnes G.A. et al. Competition for inorganic nutrients between phytoplankton and bacterioplankton in nutrient manipulated mesocosms // Aqua. Microb. Ecol. 2002. V. 29. P. 145–159.
Karpowicz M., Zielinski P., Grabowska M. et al. Effect of eutrophication and humification on nutrient cycles and transfer efficiency of matter in freshwater food webs // Hydrobiologia. 2020. V. 847. P. 2521–2540.
Kritzberg E.S., Cole J.J., Pace M.M., Graneli W. Does autochthonous primary production drive variability in bacterial metabolism and growth efficiency in lakes dominated by terrestrial C inputs? // Aqua. Microb. Ecol. 2005. V. 38. P. 103–111.
Lewis W.M., Wurtsbaugh W.A. Control of lacustrine phytoplankton by nutrients: erosion of the phosphorus paradigm // Int. Rev. Hydrobiol. 2008. V. 93. № 4–5. P. 446–465.
Maucha R. Upon the influence of temperature and intensity of light on the photosynthetic production of nannoplankton // Verhandlungen der Int. Vereinigung für Theoretische und Angewandte Limnol. 1924. V. 2. P. 381–401.
Maucha R., Unger E. Theoretical considerations on the mutual connections between the hydrobios and E. Naumann’ milieu-spectra // Verhandlungen der Int. Vereinigung für Theoretische und Angewandte Limnol. 1924. V. 2. P. 402–414.
McCauley E., Downing J.A., Watson S. Sigmoid relationships between nutrients and chlorophyll among lakes // Canadian J. Fish. Aqua. Sci. 1989. V. 46. P. 1171–1175.
Mindl B., Sonntag B., Pernthaler J. et al. Effect of phosphorus loading on interactions of algae and bacteria: reinvestigation of the “phytoplankton–bacteria paradox” in a continuous cultivation system // Aqua. Microb. Ecol. 2005. V. 38. P. 203–213.
Moss B., Jeppesen E., Sondergaard M. et al. Nitrogen, macrophytes, shallow lakes and nutrient limitation: resolution of a current controversy? // Hydrobiologia. 2013. V. 710. P. 3–21.
Ozkan K., Jeppesen E., Sondergaard M. et al. Contrasting roles of water chemistry, lake morphology, land-use, climate and spatial processes in driving phytoplankton richness in the Danish landscape // Hydrobiologia. 2013. V. 710. P. 173–187.
Patoine A., Leavitt P.R. Landscape analysis of the role of N2 fixation in satisfying algal demand for nitrogen in eutrophic lakes // Verhandlungen der Int. Vereinigung für Theoretische und Angewandte Limnol. 2008. V. 30. Pt 3. P. 366–370.
Phillips G., Pietilainen O.-P., Carvalho L. et al. Chlorophyll– nutrient relationships of different lake types using a large European dataset // Aqua. Ecol. 2008. V. 42. P. 213–226.
Prairie Y.T., Duarte C.M., Kalff J. Unifying nutrient–chlorophyll relationships in lakes // Canadian J. Fish. Aqua. Sci. 1989. V. 46. P. 1176–1182.
Prairie Y.T., Bird D.F., Cole J.J. The summer metabolic balance in the epilimnion of southeastern Quebec lakes // Limnol. Oceanogr. 2002. V. 47. № 1. P. 316–321.
Quinlan R., Filazzola A., Mahdiyan O. et al. Relatioships of total phosphorus and chlorophyll in lakes worldwide // Limnol. Oceanogr. 2021. V. 66. № 2. P. 392–404.
Reay D.S., Nedwell D.B., Priddle J., Ellis-Evans J.C. Temperature dependence of inorganic nitrogen uptake: reduced affinity for nitrate at suboptimal temperatures in both algae and bacteria // Appl. Environ. Microbiol. 1999. V. 65. № 6. P. 2577–2584.
Rizhinashvili A.L., Maksimova O.B. Is nitrate a driver for pigments of phytoplankton (a case study from a small shallow European lake)? // Annal. de Limnologie – Int. J. Limnol. 2018. V. 54. Art. 38.
Rylov W. Einige Bemerkungen betreffs des regionallimnologischen Studiums // Verhandlungen der Int. Vereinigung für Theoretische und Angewandte Limnol. 1929. V. 4. P. 538–548.
Scott J.T., McCarthy M.J., Paerl H.W. Nitrogen transformations differentially affect nutrient-limited primary production in lakes of varying trophic state // Limnol. Oceanogr. Lett. 2019. V. 4. № 4. P. 96–104.
Shelford V.E. Animal communities in temperate America // The Geographic Society of Chicago. Bulletin. № 5 (Pt 1). Chicago: The Univ. Chicago Press, 1913. 362 p.
Shuvo A., O’Reilly C.M., Blagrave K. et al. Total phosphorus and climate are equally important predictors of water quality in lakes // Aqua. Sci. 2021. V. 83. № 1. Art. 16.
Stetler J.T., Knoll L.B., Driscoll Ch.T., Rose K.C. Lake browning generates a spatiotemporal mismatch between dissolved organic carbon and limiting nutrients // Limnol. Oceanogr. Lett. 2021. V. 6. № 4. P. 182–191.
Vanni M.J., Renwick W.H., Bowling A.M. et al. Nutrient stoichiometry of linked catchment-lake systems along a gradient of land use // Freshwater Biol. 2011. V. 56. P. 791–811.
Wang J., Wagner N.D., Fulton J.M., Scott J.T. Diazotrophs modulate phycobiliproteins and nitrogen stoichiometry differently than other cyanobacteria in response to light and nitrogen availability // Limnol. Oceanogr. 2021. V. 66. № 6. P. 2333–2345.
Ward N.K., Steele B.G., Weathers K.C. et al. Differential responses of maximum versus median chlorophyll-a to air temperature and nutrient loads in an oligotrophic lake over 31 years // Water Res. Research. 2020. V. 56. Art. e2020WR027296.
Weiss M., Simon M. Consumption of labile dissolved organic matter by limnetic bacterioplankton: the relative significance of amino acids and carbohydrates // Aqua. Microb. Ecol. 1999. V. 17. P. 1–12.
Zagarese H.E., de Los Angeles Gonzalez Sagrario M., Wolf-Gladrow D. et al. Patterns of CO2 concentration and inorganic carbon limitation of phytoplankton biomass in agriculturally eutrophic lakes // Water Res. 2021. V. 190. Art. 116715.
Zhou J., Han X., Brookes J.D., Qin B. High probability of nitrogen and phosphorus co-limitation occurring in eutrophic lakes // Environ. Poll. 2022. V. 292. Pt A. Art. 118276.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


