Успехи физиологических наук, 2019, T. 50, № 2, стр. 82-92
Синдром внезапной детской смерти: патогенез и молекулярные аспекты
Е. С. Поправка 1, 3, *, Н. С. Линькова 1, 3, В. О. Полякова 2, 4, Д. С. Медведев 3, 5
1 Кафедра “Медицинская физика” Института физики, нанотехнологий и телекоммуникаций Санкт-Петербургского политехнического университета Петра Великого
190000 Санкт-Петербург, Россия
2 Отдел патоморфологии ФГБНУ “Научно-исследовательский институт акушерства, гинекологии
и репродуктологии имени Д.О. Отта”
199034 Санкт-Петербург, Россия
3 Отдел биогеронтологии, отдел клеточной биологии и патологии АНО НИЦ
“Санкт-Петербургский институт биорегуляции и геронтологии”
199034 Санкт-Петербург, Россия
4 Биолого-почвенный факультет, кафедра общей физиологии Санкт-Петербургского государственного университета
199034 Санкт-Петербург, Россия
5 Кафедра ЛФК и спортивной медицины ВГБОУ ВО “Северо-Западный государственный
медицинский университет им. И.И. Мечникова”
195271 Санкт-Петербург, Россия
* E-mail: miayy@yandex.ru
Поступила в редакцию 21.07.2018
Аннотация
Синдром внезапной детской смерти (СВДС) – одна из основных причин смерти детей в первый год жизни. СВДС считается полиэтиологичным заболеванием, его причина не установлена. В обзоре рассматриваются роль сердечно-сосудистой патологии, патологии дыхательного центра в развитии СВДС. Описаны другие факторы, обуславливающие развитие СВДС: дефицит серотониновых рецепторов, гипотезы незрелости водителя ритма дыхания новорожденных, удлиненного интервала Q–T, апноэ, незавершенной терморегуляции и иммунная теория. Рассматриваются молекулярные аспекты развития СВДС в соответствии с указанными теориями. Приведенные данные позволяют предположить, что анализ экспрессии сигнальных молекул IL-1β, NOS1AP, RyR2, Cav3, Atoh1, GABA и серотонина в периферических тканях матери и плода может применяться для предиктивной диагностики СВДС.
СВДС (синдром внезапной детской смерти) – необъяснимая смерть внешне здоровых детей в возрасте до 1 года, при которой вскрытие не позволяет установить причину летального исхода. Синонимы этого термина – “спонтанная смерть при отсутствии болезни” или “безболезненная смерть” [19]. СВДС в настоящее время занимает одно из первых мест среди причин постнеонатальной младенческой смертности. Несмотря на то, что исследования данной проблемы интенсивно ведутся со второй половины 80-х годов XX в., до сих пор не установлены причины развития СВДС, а известны лишь некоторые факторы риска [14].
По данным Всемирной организации здравоохранения за 2013 г. доля СВДС в структуре младенческой смертности в мире составляет до 33%. Всего в год в странах Европейского содружества регистрируют около 6 тысяч, а в США – около 5 тысяч случаев СВДС [36].
В настоящее время проводятся исследования, направленные на выявление факторов риска, изучение патогенеза данного заболевания, усовершенствование диагностических методик и разработку программ для предотвращения смерти детей группы риска [11].
Часто при СВДС у новорожденных выявляются незначительные повреждения клеток и внутриклеточных структур ритмогенной зоны сердца и дыхательного центра продолговатого мозга, которые не доступны для верификации при гистологических методах исследования [46]. В связи с этим, исследования, направленные на изучение молекулярных аспектов развития СВДС, имеют большое фундаментальное и практическое значение.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ СИНДРОМА ВНЕЗАПНОЙ ДЕТСКОЙ СМЕРТИ
По определению консенсусной группы Национального института детского здоровья и развития человека (National Institute of Child Health and Human Development; NICHD), принятому в 1989 г., СВДС – это внезапная смерть ребенка в возрасте до одного года, которая остается необъяснимой после проведения полного посмертного исследования, включающего вскрытие, изучение места смерти и анализ медицинской документации [4]. В Международной классификации болезней 10-го пересмотра (МКБ-10) диагноз формулируется как “внезапная смерть грудного ребенка”. В зарубежной литературе с 1969 г. используется термин “Sudden Infant Death Syndrome” (SIDS) [21]. Диагноз СВДС ставят в том случае, когда после полного изучения всех обстоятельств смерти ребенка, ее причина остается невыясненной [13].
Регистрация случаев СВДС у детей грудного возраста в течение последних 2-х десятилетий проводится во всех промышленно развитых странах мира, где этот синдром занимает одно из первых мест среди причин постнеонатальной младенческой смерти [6]. Риск внезапной смерти во сне максимален у новорожденных в возрасте от 2 до 4 мес., снижается к 6 месяцам и почти не встречается после 9 мес. жизни. Приблизительно 60% погибших – мальчики. Чаще всего СВДС верифицируется в зимний период [13].
На сегодняшний день СВДС детей грудного возраста считается полиэтиологичным заболеванием. Несмотря на то, что исследования случаев неожиданной смерти младенцев не привели к объяснению причин этого явления, было обнаружено немало общих признаков, свойственных данной патологии [9]. Факторы, сопутствующие развитию СВДС, были выявлены в ходе крупных эпидемиологических исследований [43]. Чаще всего один этиологический фактор объясняется несколькими вариантами патогенеза, а один и тот же патогенетический механизм имеет место в интерпретации летального исхода у младенца с несколькими факторами риска [36].
Таким образом, все факторы риска, связанные с СВДС, можно разделить на 4 группы: 1 – зависящие от родителей, 2 – определяющиеся социально-экономическим статусом семьи ребенка и влиянием окружающей среды, 3 – факторы, связанные непосредственно с ребенком и 4 – ранее выявленные или скрыто протекающие сердечно-сосудистые заболевания, тяжесть течения которых у новорожденного не предполагает внезапного летального исхода [6] (рис. 1).
Рис. 1.
Классификация этиологических факторов синдрома внезапной смерти новорожденных [по [6] в модификации].

Далее более подробно представлены основные гипотезы возникновения СВДС, а также соответствующие им патогенетические механизмы развития летального исхода.
РОЛЬ СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ В РАЗВИТИИ СИНДРОМА ВНЕЗАПНОЙ ДЕТСКОЙ СМЕРТИ
Наиболее обоснованной на сегодняшний день является сердечно-сосудистая теория развития СВДС. Согласно этой гипотезе для объяснения механизма СВДС клинические и морфологические исследования были направлены на изучение проводящей системы и автономной нервной регуляции функции сердца [3]. Важной чертой структурно-функционального состояния сердца новорожденных и грудных детей является выполнение сложной программы кардиогенеза, включающей синхронное развитие структурных элементов сердца, особенности которого при СВДС пока остаются не раскрытыми. Одна из основных версий патогенеза СВДС – нарушение сердечной деятельности младенца: аритмии, вплоть да кратковременной остановки сердца, которые могут встречаться даже у здоровых детей [5].
У половины детей, спасенных после остановки дыхания, выявлены различные патологии артерий, кровоснабжающих головной мозг. Таким образом, одной из возможных причин СВДС может являться нарушение кровообращения. При определенном расположении головы младенца артерии могут пережиматься, вызывая кислородное голодание мозга. Ребенок до 4 месяцев обычно не имеет достаточно развитых мышц шеи, чтобы повернуть голову в более безопасное положение, избежав пережатия. В пользу этой теории свидетельствует то, что после четырехмесячного возраста, когда дети учатся поворачивать голову, случаи возникновения СВДС выявляются реже [20, 34].
Положение сердца новорожденного выше, и его форма более круглая, чем у взрослого. Пульс у ребенка более частый, чем у взрослого, что связано с интенсивным энергетическим обменом вследствие быстрого роста организма [5, 18]. Некоторые врачи относят остановку дыхания к вторичным факторам, считая причиной развития СВДС брадикардию (частота сокращений сердца ребенка медленнее 70 ударов в минуту), переменчивая частота сокращений сердца. В пользу этой версии свидетельствует то, что в части случаев у погибших была обнаружена мутация в гене SCN5A (LQT3), который кодирует структуру натриевых каналов сердца. В последствии это вызывает нестабильность сердечных сокращений. Однако стоит отметить, что у здоровых детей в норме также могут наблюдаться изменения в биении сердца, вплоть до краткосрочных остановок [5].
РОЛЬ ПАТОЛОГИИ ДЫХАТЕЛЬНОГО ЦЕНТРА В РАЗВИТИИ СИНДРОМА ВНЕЗАПНОЙ ДЕТСКОЙ СМЕРТИ
Продолговатый мозг регулирует дыхательный и сердечный рефлексы в организме человека. Предполагают, что нарушение его функции способно вызвать СВДС [46].
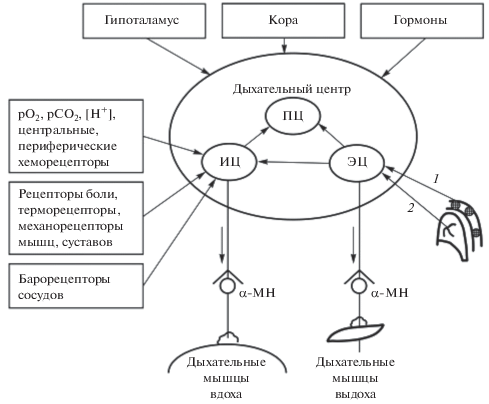
Дыхательным центром (ДЦ) называют совокупность нейронов, расположенных в различных отделах центральной нервной системы, регулирующих ритмические координированные сокращения дыхательных мышц и приспосабливающих дыхание к изменяющимся условиям среды и потребностям организма. Среди этих структур особую роль в регуляции дыхания играет ДЦ, представленный отделами, локализованными в стволе головного мозга, без функционирования которых дыхание прекращается. Часть нейронов ДЦ расположена в правой и левой половинах продолговатого мозга в области дна IV желудочка. Выделяют дорзальную группу нейронов, активирующих мышцы вдоха, – инспираторный центр (ИЦ) и вентральную группу нейронов, контролирующих выдох, – экспираторный центр (ЭЦ). В смене вдоха на выдох существенное значение имеет пневмотаксический центр (ПЦ), который осуществляет свое влияние через нейроны ЭЦ [16].
Важная роль в определении характера ритмической активности нейронов ДЦ и дыхания принадлежит сигналам от рецепторов коры головного мозга, лимбической системы и гипоталамуса. Нейроны ИЦ получают информацию о содержании газов в артериальной крови, рН крови от хеморецепторов сосудов и ликвора, расположенных на вентральной поверхности продолговатого мозга. К ДЦ поступают нервные импульсы от рецепторов, контролирующих растяжение легких и состояние дыхательных и других мышц, от терморецепторов, болевых и сенсорных рецепторов [34].
Моторные нейроны, активированные потоком нервных импульсов инспираторных нейронов ДЦ, посылают эфферентные импульсы к нервно-мышечным синапсам мышц вдоха, обеспечивающих увеличение объема грудной клетки. Вслед за грудной клеткой увеличивается объем легких и происходит вдох. Во время вдоха активируются рецепторы растяжения дыхательных путей и легких. Поток нервных импульсов от этих рецепторов по афферентным волокнам блуждающего нерва поступает в продолговатый мозг и активирует экспираторные нейроны, запускающие выдох. Так замыкается один контур механизма регуляции дыхания.
Описанная схема нервных связей отражает общий принцип регуляции дыхательного цикла (рис. 2). В действительности же афферентные потоки сигналов от многочисленных рецепторов дыхательных путей, сосудов, мышц, кожи поступают ко всем структурам ДЦ. На одни группы нейронов они оказывают возбуждающее действие, на другие – тормозное. Переработка и анализ этой информации в ДЦ ствола мозга находится под контролем и корригируется высшими отделами головного мозга. Так, гипоталамус играет ведущую роль в изменениях дыхания, связанных с реакциями на болевые раздражения, физическую нагрузку, а также обеспечивает вовлечение дыхательной системы в терморегуляторные реакции [16].
Рис. 2.
Схема функционального строения дыхательного центра. Обозначения ИЦ – инспираторный центр; ПЦ – пневмотаксический центр; ЭЦ – экспираторный центр; 1, 2 – импульсы от рецепторов растяжения дыхательных путей, легких и грудной клетки [по [7]].
При быстром развитии гиперкапнии увеличение вентиляции легких на 25% вызвано стимуляцией периферических хеморецепторов углекислого газа и рН. В большей степени это связано с активацией центральных хеморецепторов продолговатого мозга протонами водорода и углекислым газом. Это обусловлено высокой проницаемостью гематоэнцефалического барьера для углекислого газа [43]. При длительной гиперкапнии рН ликвора возвращается к норме вследствие постепенного увеличения проницаемости гематоэнцефалического барьера для анионов и их накопления в ликворе. Это приводит к снижению вентиляции, развившейся в ответ на гиперкапнию [34].
При аутопсийном исследовании у детей с СВДС были обнаружены недоразвитые части дугообразного ядра головного мозга, которые отвечают за синхронность сердечно-сосудистой и дыхательной деятельности человека [21]. В крови новорожденных с СВДС было выявлено повышение концентрации углекислого газа [32]. У части погибших детей в продолговатом мозге обнаружены отклонения синтеза холинацетилтрансфераз. Особенно часто эти нарушения встречались у детей, подвергавшихся влиянию сигаретного дыма. У других пациентов имелись структурные повреждения продолговатого мозга и морфологические изменения нейронов. Эта патология могла возникнуть во время внутриутробного развития вследствие гипоксии [2]. Многие новорожденные дети первых месяцев жизни при задержке поступления в дыхательные пути воздуха не пытаются адаптироваться – у них происходит остановка дыхания, так как ДЦ развит недостаточно [16].
ДРУГИЕ ФАКТОРЫ, ОБУСЛАВЛИВАЮЩИЕ РАЗВИТИЕ СИНДРОМА ВНЕЗАПНОЙ ДЕТСКОЙ СМЕРТИ
Помимо гипотез об участии сердечно-сосудистой патологии и дисфункции ДЦ в развитие СВДС могут быть вовлечены и другие механизмы.
Дефицит серотониновых рецепторов. Предполагают, что СВДС может быть вызван недостатком рецепторов к серотонину в продолговатом мозге, отвечающем за связь дыхания и частоты сердечных сокращений [27].
Серотонин, синтезируемый нейронами ствола головного мозга, регулирует дыхание, сердцебиение и кровяное давление во время сна. Вследствие нехватки рецепторов к серотонину, нарушаются функции нейронов ствола головного мозга: от скопления углекислого газа в повышенной концентрации у спящего на животе ребенка увеличивается риск возникновения СВДС [39].
У новорожденных, умерших в результате СВДС, обнаружена опосредованная серотонином дисрегуляция вегетативной нервной системы. Выявлен полиморфизм в гене HTTLPR – транспортере серотонина, влияющем на широкий спектр автономных функций, таких как дыхание, кардиоваскулярная и циркадная регуляция. Некоторые полиморфизмы были идентифицированы в зоне промотера гена транспортера серотонина. L-аллель гена HTTLPR повышает эффективность промотера, уменьшая концентрацию серотонина в нервных окончаниях. Доказана ассоциация L/L генотипа с СВДС [30, 42]. Впоследствии повышается уязвимость ребенка к внешним факторам (пронированная поза во сне, перегревание) [10].
Гипотеза незрелости водителя ритма дыхания новорожденных. Часть случаев СВДС связана с тем, что недостаточно развитый водитель ритма дыхания, затухая под воздействием случайного сингулярного стимула, не в состоянии возобновить движение. Точные механизмы этого феномена остаются до конца не выясненными. Ими может являться незрелость ДЦ в сочетании с другими неблагоприятными факторами (простуда, переохлаждение, сигаретный дым). У взрослых людей система множественных водителей ритма дыхания, кровообращения устроена более надежно [32].
Гипотеза удлиненного интервала Q–T. Время от начала сокращения желудочков сердца до их расслабления обозначается на кардиограмме интервалом Q–T. По разным оценкам удлинение этого периода от 440 до 450 миллисекунд коррелирует с внезапной коронарной смертью взрослых [15]. У 30–35% детей, погибших от СВДС, были зарегистрированы удлиненные Q–T интервалы, при которых возникает электрическая нестабильность сердечной мышцы. Однако эта особенность может являться одним из вариантов нормы, достигая максимальной выраженности к 2 мес. и исчезая к 6 мес., что совпадает с возрастными рисками развития СВДС [41].
Гипотеза апноэ. У детей существует феномен периодического дыхания, когда глубокие вдохи перемежаются интервалами от 3 до 20 с. У недоношенных детей эти паузы между дыхательными движениями значительно превышают 20 секунд. Апноэ длительностью более 20 с исчезает после достижения новорожденными возраста, соответствующего 37 нед. Но в редких случаях длительные паузы могут сохраняться даже у доношенных детей. Выявлена корреляция между апноэ и СВДС [35].
Наряду с пробуждением “хватательное” дыхание является одним из основных механизмов самовыживания. В норме в ответ на острую гипоксию и гиперкапнию во сне возникает защитная реакция пробуждения, которая предусматривает форсированное дыхание (возникновение “гипоксической” одышки), активное расширение верхних дыхательных путей и пробуждение. Такая реакция формируется в результате последовательной специфической активации корково-подкорковых структур головного мозга и включает активирующие и тормозящие компоненты, которые осуществляют тесное взаимодействие между собой. Корковая реакция реализуется через активацию норадренергических, серотонинергических, допаминергических, холинергических и гистаминергических нейронов головного мозга и гипоталамуса [24, 35]. Подкорковая реакция пробуждения контролируется центрами ствола мозга, ответственными за сердечный ритм, артериальное давление и респираторную активность [39]. “Хватательное” дыхание характерно для пациентов с СВДС [45]. Вероятно, при СВДС рано развивается гипотония, что объясняет неспособность форсированного дыхания приводить к восстановлению жизненных функций организма. До сих пор гипотеза остается спорной, так как не были произведены измерения артериального давления новорожденных во время наступления внезапной смерти [31, 54]. Показано, что у детей групп риска СВДС отсутствуют компенсаторные реакции на возникающую гипоксию. При этом повышение в крови уровня углекислого газа и снижение концентрации кислорода не только не стимулирует, но и угнетает ДЦ [49].
Гипотеза незавершенной терморегуляции. Жизненно важные центры в продолговатом мозге формируются у детей до 3 мес. жизни. При неполной детерминации нейронов переднего и заднего отделов гипоталамуса, отвечающих за терморегуляцию, средняя температура тела у новорожденных ниже нормы. До завершения дифференцировки нейронов отмечаются колебания показателей температуры детей и неадекватный температурный ответ. При изменении микроклимата спальни младенец может перегреться, что скажется на дыхательной и сердечной деятельности и может привести к внезапной смерти [4, 37].
Иммунная теория. Аутоиммунные заболевания матери могут увеличивать риск развития внезапной смерти ребенка, позитивного в отношении волчаночных антител – (волчаночного антикоагулянта). Почти у половины таких новорожденных на электрокардиограмме (ЭКГ) выявляется удлинение интервала QТ даже при отсутствии нарушений атриовентрикулярного проведения, являющегося важным признаком волчаночного синдрома. Новорожденные, родившиеся от матерей с системной красной волчанкой или синдромом Шегрена, предрасположены к развитию полной атриовентрикулярной блокады. Нарушения вентрикулярной проводимости в виде удлинения интервала QТ преходящи и обычно исчезают к шестому месяцу жизни вместе с сопутствующими волчаночными антителами, но их наличие в анамнезе указывает на предрасположенность новорожденного к развитию угрожающих жизни аритмий СВДС [33].
У многих детей, погибших от СВДС, в течение недели или в последний день жизни имели место проявления какой-либо инфекции. Сторонники этой теории полагают, что микроорганизмы выделяют токсины, которые впоследствии вызывают нарушение пробуждения ото сна. Токсины микроорганизмов (у большинства погибших новорожденных был обнаружен золотистый стафилококк) провоцируют и усиливают воспалительную реакцию [32]. Другие исследователи установили, что у детей с СВДС имелись антитела к иммоноглобулину А (IgA) к токсинам энтеробактерий и клостридий. Здоровые дети тоже имеют антитела к этим микроорганизмам, но других классов (IgM и IgG). Полученные данные позволили сделать вывод о том, что такие токсины действуют на всех детей, но факторы риска (перегревание, воздействие компонентов табачного дыма и другие) приводят к нарушению механизмов защиты новорожденного. В результате сочетание инфекции и факторов риска приводит к смертельному исходу [4].
Ряд исследований указывает, что причиной СВДС может стать возбудитель язвенной болезни желудка – Helicobacter pylori. Этот микроорганизм часто выделяются в тканях желудка и дыхательных путей у младенцев, впоследствии умерших от СВДС. Helicobacter pylori способен вызвать синтез аммония, который становится причиной нарушения дыхания и, как следствие, СВДС [4, 6, 43].
Все эти гипотезы являются различными формулировками близких предположений, но ни одна из них полностью не объясняет все случаи возникновения СВДС.
МОЛЕКУЛЫ, ВОВЛЕЧЕННЫЕ В ПАТОГЕНЕЗ СИНДРОМА ВНЕЗАПНОЙ ДЕТСКОЙ СМЕРТИ
Наибольшее число исследований СВДС посвящено изучению механизмов нарушения регуляции дыхания, роли гипоксии и гиперкапнии, отдельных биохимических маркеров и нейротрансмиттеров в развитии внезапной остановки дыхания и кровообращения во сне [2]. В прошлые два десятилетия поиск генов-факторов риска СВДС основывался на гипотезе, что СВДС – нарушение гомеостаза [42]. В настоящее время с СВДС связывают гены полиморфизмов, ответственные за становление вегетативных функций, энергетический метаболизм, реакцию на инфекционный процесс, а также гены-нейротрансмиттеры [33].
Наиболее важные изменения нейрохимической активности выявлены в 5-гидрокситриптаминовой системе мозга. Показано, что от 50 до 75% случаев СВДС имеют дефект в данной системе. 5-гидрокситриптаминовая система мозга во взаимодействии с нейромедиаторами отвечает за поддержание гомеостаза, функцию вентиляции и дыхания, терморегуляцию, автономный контроль и реакцию на гипоксию. В исследованиях на пациентах с СВДС были показаны аномалии в количестве и/или дифференциации 5-гидрокситриптаминовых нейронов и их рецепторов [33].
СЕРОТОНИН
Важным фактором в опосредовании реакции пробуждения является серотонин, который играет центральную роль в регуляции сна, процессе дыхания, хеморецепции и температурного гомеостаза. В исследованиях, основанных на связывании различных рецепторов с нейротрансмиттером у детей, умерших от СВДС, выявлено снижение числа рецепторов серотонина в головном мозге [26, 53]. Так как этот нейромедиатор задействован в регуляции практически всех механизмов, связанных с СВДС (контроль за верхними дыхательными путями, механика дыхания, пробуждение, “хватательное дыхание”) [29], то, возможно, этой молекуле принадлежит ключевая роль в патогенезе СВДС.
Серотонин участвует в процессах возникновения аллергии и воспаления. Этот нейромедиатор увеличивает проницаемость сосудов, усиливает хемотаксис и миграцию лейкоцитов в очаг воспаления, повышает содержание эозинофилов в крови, усиливает дегрануляцию тучных клеток и высвобождение других медиаторов аллергии и воспаления, что может иметь непосредственное отношение к иммунной гипотезе и инфекционному механизму возникновения СВДС [50].
МЕЛАТОНИН
Серотонин является предшественником мелатонина, образующегося в эпифизе под действием фермента арилалкиламин-N-ацетилтрансферазы (ААNАТ) и транскрипционного фактора CREB [17]. Мелатонин (МТ) – основной регулятор биологических ритмов. Пинеальный и экстрапинеальный МТ участвует в различных физиологических процессах: пигментном обмене, метаболизме свободных радикалов, иммунном ответе, регуляции функций эндокринной, нервной и сердечно-сосудистой систем [40, 44, 51]. Широкое спектр регуляторных эффектов МТ может характеризовать его роль в патогенезе СВДС, как межклеточного нейроэндокринного регулятора и координатора биологических процессов [25, 48].
АДАПТЕРНЫЙ БЕЛОК НЕЙРОНАЛЬНОЙ СИНТАЗЫ ОКСИДА АЗОТА-1
Адаптерный белок нейрональной синтазы оксида азота-1 (NOS1AP) – цитозольный протеин, связывающий нейрональную синтазу оксида азота (nNOS). Наибольшая концентрация NOS1AP выявлена в коре и продолговатом мозге, наименьшая – в гиппокампе [41]. Связываясь с NOS1AP, nNOS образует меньше комплексов с NMDA-рецепторами, и это снижает NMDA-опосредованный приток кальция и деактивирует каталитическую деятельность NOS. Была отмечена ассоциация полиморфизмов гена NOS1AP с удлинением QT-интервала при СВДС [38, 47].
КАВЕОЛИН-3
У младенцев, погибших в результате СВДС, были обнаружены мутации генов кавеолина-3 (Cav3) и рианодинового рецептора-2 (RyR2). Указанные гены отвечают за структуру протеинов, играющих ключевую роль в регуляции электрической активности кардиомиоцитов [28]. Cav3 – рецептор независимого эндоцитоза, белок плазматической мембраны, имеющий структурную функцию. В клетке кавеолин собирается в олигомеры, связывает холестерин и сфинголипиды в определенных участках клеточной мембраны, что приводит к формированию кавеолы. Cav3 сосредоточен в кавеоле кардиомиоцитов и модулирует синтез оксида азота, метаболизм холестерина и механизм сокращения кардиомиоцитов. В кардиомиоцитах Cav3 отрицательно регулирует АТФ-зависимые калиевые каналы, локализованные в кавеолах [14].
Cav3 ассоциируется с сердечным натрий-кальциевым обменником (NCX) в кавеолах кардиомиоцитов. Эта ассоциация встречается преимущественно в областях, близких к периферической мембране кардиомиоцитов. Взаимодействия между Cav3 и сердечным NCX влияют на NCX-регуляцию клеточных сигнальных факторов и возбуждение кардиомиоцитов [28].
Кроме того, Cav3 влияет на открытие кальциевых каналов L-типа (LTCC), которые участвуют в сокращении кардиомиоцитов. Нарушение функций Cav3 уменьшает вероятность открытия LTCC [8]. При увеличении интервала QT зарегистрирована повышенная экспрессия Cav3. Установлено, что мутации гена Cav3 ассоциированы с персистирующим поздним натриевым током и коррелируют с возникновением СВДС [1].
РИАНОДИНОВЫЙ РЕЦЕПТОР-2
RyR2 – белок, функционирующий как основной компонент кальциевого канала, находящегося в саркоплазматическом ретикулуме клеток. В кардиомиоцитах RyR2 выполняет функцию сопряжения потенциала действия с сокращением [5]. Рецепторы RyR2 опосредуют высвобождение ионов кальция из саркоплазматического ретикулума и эндоплазматической сети, основным механизмом их активации является кальций-индуцированное высвобождение кальция [28].
Мутации гена RyR2 изменяют восприимчивость кальциевых каналов к симпатической стимуляции нервной системы. Во время стресса повышается восприимчивость кальциевых каналов, что способно вызвать аритмию. Рецептор RyR2 уменьшает вероятность высвобождения возбуждающих нейротрансмиттеров и значительно снижает порог для распространения деполяризации в нейронах продолговатого мозга, что приводит к кардиореспираторному коллапсу [22].
АТОНАЛЬНЫЙ ГОМОЛОГ-1
Установлено, что в организме погибших от СВДС младенцев может не экспрессироваться ген атонального гомолога-1 (Atoh1), вовлеченный в функции ДЦ. Ген Atoh1 кодирует синтез одноименного белка, являющегося транскрипционным фактором, необходимым для дифференцировки нейронов [30]. Недостаток белка Atoh1 или мутации в нем негативно влияют на развитие нейронов, контролирующих содержание углекислого газа в крови [34]. Отсутствие координированной связи между нейронами не позволяет подавать сигналы, регулирующие дыхание, в организме накапливается углекислый газ, что приводит к смерти [30, 34]. Мышата с нокаутом гена Atoh1 гибнут в первые дни после рождения [27, 33].
ИНТЕРЛЕЙКИН-1Β
Интерлейкин-1β (IL-1β) – провоспалительный цитокин, член семейства интерлейкина-1. В исследовании мозга детей, погибших от СВДС, отмечалась повышенная иммуннореактивность к IL-1β в дугообразном ядре и дорсальном ядре вагуса [12]. Имеется точка зрения, согласно которой инфекция может играть критическую роль в апноэ младенцев и СВДС, а IL-1β выступает в качестве ключевого медиатора между этими событиями [52]. Увеличение содержания IL-1β в организме новорожденных при инфекционных заражениях может явиться причиной внезапной остановки дыхания вследствие снижения вентиляторной чувствительности к основному стимулу дыхания – углекислому газу. Возможно, что патофизиологическим механизмом СВДС является незрелость центральных хеморецепторных нейронов и ослабление вследствие этого реакции на гиперкапнический стимул. Повышение уровня IL-1β в стволе головного мозга будет усиливать действие такого фактора [55].
GABA-РЕЦЕПТОР
Существует предположение, что СВДС может быть обусловлен нейрохимическими аномалиями, связанными с недостатком рецептов γ-аминомасляной кислоты (GABA). GABA выполняет в организме функцию нейромедиатора, участвующего в процессах центрального торможения. При выбросе GABA в синаптическую щель происходит активация ионных каналов GABA-рецепторов, приводящая к ингибированию нервного импульса [23].
Под влиянием GABA активируются энергетические процессы мозга, повышается оксигенация тканей, улучшается утилизация мозгом глюкозы и кровоснабжение [43]. В продолговатом мозге GABA помогает регулировать гомеостаз при участии медуллярной серотонинергической (5-НТ) системы. Ранее были выявлены аномалии экспрессии 5-НТ в медуллярной 5-HT-системе младенцев, погибших от СВДС [21]. Установлено, что экспрессия GABA рецепторов снижается в мозговой 5-HT-системе мозга при СВДС по сравнению с нормой [23].
ЗАКЛЮЧЕНИЕ
Большинство исследований СВДС характеризуют механизмы нарушения регуляции дыхания, роль гипоксии и гиперкапнии, нейромедиаторов в развитии внезапной остановки дыхания и нарушения функций сердечно-сосудистой системы во сне [2]. В последние десятилетия поиск генов-маркеров СВДС основывался на гипотезе о том, что эта патология возникает вследствие нарушения гомеостаза [42]. В настоящее время с СВДС связывают гены полиморфизмов, ответственные за становление вегетативных функций, энергетический метаболизм, реакцию на инфекционный процесс, а также гены, вовлеченные в реализацию функций нейромедиаторов [33].
Так, у детей, погибших от СВДС, выявлено снижение числа рецепторов к серотонину в головном мозге [26, 53]. Была отмечена ассоциация полиморфизмов гена адаптерного белка нейрональной синтазы оксида азота-1 (NOS1AP) с удлинением QT-интервала при СВДС [38, 46].
У младенцев, погибших в результате СВДС, были обнаружены мутации генов кавеолина-3 (Cav3) и рианодинового рецептора RyR2. Указанные гены отвечают за структуру протеинов, играющих ключевую роль в регуляции электрической активности кардиомиоцитов [28]. Установлено, что в организме погибших от СВДС младенцев может отсутствовать ген атонального гомолога-1 (Atoh1), вовлеченного в функции ДЦ. Этот ген способствует синтезу одноименного белка, являющегося транскрипционным фактором, необходимым для образования нервных типов клеток. У детей, погибших от СВДС, отмечалась повышенная иммуннореактивность к IL-1β в дугообразном ядре и дорсальном ядре вагуса [12], что коррелирует с иммунологической теорией патогенеза СВДС. Кроме того, существует предположение, что СВДС может быть обусловлен нейрохимическими аномалиями, связанными с недостатком рецептов GABA.
Таким образом, верификация сигнальных молекул IL-1β, NOS1AP, RyR2, Cav3, Atoh1, GABA и серотонина в периферических тканях матери и плода открывает новые перспективы для диагностики вероятности развития СВДС и снижения смертности новорожденных.
СПИСОК СОКРАЩЕНИЙ
5-HT 5-hydroxytryptamine receptors
ААNАТ aralkylamine N-acetyltransferase
ATOH1 protein atonal homolog 1
CAV3 Caveolin 3
GABA gamma-Aminobutyric acid
Ig Immunoglobulin
IL-1β Interleukin 1 beta
LTCC L-type calcium channel
NICHD National Institute of Child Health and Human Development
NMDA N-methyl-D-aspartate
nNOS neuronal nitric oxide synthase
NOS1AP nitric oxide synthase 1 (neuronal) adaptor protein
RyR2 ryanodine receptor 2
SIDS sudden infant death syndrome
ДЦ дыхательный центр
ИЦ инспираторный центр
МКБ-10 международная классификация болезней 10-го пересмотра
МТ мелатонин
ПЦ пневмотаксический центр
ЭЦ экспираторный центр
СВДС синдром внезапной детской смерти
Список литературы
Бокерия О.Л., Санакоев М.К. Синдром удлиненного QT-интервала // Анналы аритмологии. 2015. Т. 12. № 2. С. 114–128.
Волянюк Е.В., Сафина А.И. Респираторная патология у недоношенных детей в раннем возрасте // Вестник современной клинической медицины. 2013. Т. 6. № 1. С. 45–52.
Воробьев Л.В. Индекс PQs, как показатель риска внезапного нарушения ритма сердца при тахикардии // Успехи современного естествознания. 2013. № 11. С. 17.
Каюков Р.А. Причинно-следственный анализ младенческой смертности на современном этапе // Современные проблемы науки и образования. 2012. № 1. С. 17–19.
Кожевникова О.В., Намазова-Баранова Л.С., Абашидзе Э.А. и др. О развитии сердечно-сосудистых заболеваний при нарушениях сна у детей // Вопросы современной педиатрии. 2016. № 6. С. 15.
Медведева В.В., Кучеренко Н.П., Герасименко А.И. и др. Современные медико-биологические факторы риска синдрома внезапной смерти грудных детей // Медико-социальные проблемы семьи 2013. Т. 18. № 1. С. 89–93
Михайлова Н.Л., Чемпалова Л.С. Физиология центральной нервной системы: учебное пособие. Ульяновск: УлГУ, 2010. 164 с.
Нагорная Н.В., Пшеничная Е.В., Конопко Н.Н. Внезапная сердечная смерть у детей: причины и возможные пути профилактики // Здоровье ребенка. 2009. № 1. С. 16.
Пекарев О.Г., Оноприенко Н.В., Штуккина П.Ю. и др. Проблема XXI века: преждевременные роды // Медицина и образование в Сибири. 2013. № 4. С. 12.
Попов М.М., Оленич В.Б., Савво О.М. Состояние гуморального иммунитета у детей с синдромом вегетативной дисфункции, что родились недоношеными с перинатальным поражением центральной нервной системы (ЦНС) // Иммунология и алергология: наука и практика. 2013. № 4. С. 80–84.
Розумный Д.В. Морфогенез синдрома внезапной детской смерти в перинатальной патологии // Известия Самарского научного центра Российской академии наук. 2013. Т. 15. № 3 С. 6.
Рыжкова А.И., Серебрякова Е.Н., Сокол Е.В. и др. Вторичный гемофагоцитарный синдром у детей первых месяцев жизни // Педиатрический вестник Южного Урала. 2015. № 1. С. 72–76.
Сирс У., Сирс М. Ваш малыш от рождения до двух лет. М.: Изд-во Эксмо, 2006. 912 с.
Сторожук П.Г., Сторожук А.П., Быков И.М. Биохимические предпосылки, лежащие в основе синдрома внезапной детской смерти, и меры по ее профилактике // Вестник интенсивной терапии. 2010. № 1. С. 12–17.
Тайжанова Д.Ж., Романюк Ю.Л. Синдром удлиненного интервала QT: вопросы диагностики и лечения // Международный журн. прикладных и фундаментальных исследований. 2015. № 3. С. 2.
Украинцев С.Е., McJarrow P. Питание и развитие мозга: современные представления и взгляд в будущее // Педиатрия. 2012. Т. 91. № 1. С. 102–107.
Хавинсон В.Х., Линькова Н.С., Кветной И.М. и др. Молекулярно-клеточные механизмы пептидной регуляции синтеза мелатонина в культуре пинелоцитов // Бюлл. эксп. биол. мед. 2012. Т. 153. № 2. С. 223–226.
Юнусова Ю.Р. Морфологические особенности сердца детей первого года жизни при скоропостижной смерти на дому // Известия Самарского научного центра Российской академии наук. 2010. Т. 12. № 1. С. 6.
Юнусова Ю.Р., Разумный Д.В. Количественный анализ и особенности кардиоморфогенеза у детей первого года жизни при скоропостижной смерти на дому // Вестник Российского университета дружбы народов. Серия: Медицина. 2009. № 4. С. 12–15.
Юнусова Ю.Р., Разумный Д.В., Федорина Т.А. и др. Изменения сердца при синдроме внезапной детской смерти // Архив патологии. 2014. Т. 76. № 3. С. 47–52.
Adams S.M., Ward Ch.E., Garcia K.L. Sudden Infant Death Syndrome // American Family Physician. 2015. V. 91. № 11. P. 778–783.
Aiba I., Wehrens X.H.T., Noebels J.L. Leaky RyR2 channels unleash a brainstem spreading depolarization mechanism of sudden cardiac death // Proceedings of the National Academy of Sciences. 2016. V. 113. № 33. P. 4895–4903.
Broadbelt K.G., Paterson D.S., Belliveau R.A. et al. Decreased GABAA Receptor Binding in the Medullary Serotonergic System In the Sudden Infant Death Syndrome // J. Neuropathology and Experimental Neurology. 2011. V. 70. № 9. P. 799–810.
Buchanan G.F., Murray N.M., Hajek M.A. et al. Serotonin neurones have anti-convulsant effects and reduce seizure-induced mortality // The J. physiology. 2014. V. 592. № 19. P. 4395–4410.
Calvo J.R., Gonzalez-Yanes C., Maldonado M.D. The role of melatonin in the cells of the innate immunity: a review // J. Pineal Research. 2013. V. 55. № 2. P. 103–120.
Cummings K.J. Aspiring to inspire–serotonin, the laryngeal chemoreflex and the sudden infant death syndrome // Experimental Physiology. 2016. V. 101. № 7. P. 790–790.
Cummings K.J., Commons K.G., Trachtenberg F.L. et al. Caffeine improves the ability of serotonin-deficient (pet-1-/-) mice to survive episodic asphyxia // Pediatric research. 2012. V. 73. № 1. P. 38–45.
Curran J., Mohler P.J. Alternative paradigms for ion channelopathies: disorders of ion channel membrane trafficking and posttranslational modification // Annual Review of Physiology. 2015. V. 77. P. 505–524.
Duncan Jh.R., Paterson D.S., Hoffman J.M. et al. Brainstem Serotonergic Deficiency in Sudden Infant Death Syndrome // Preliminary Communication. 2010. V. 303. № 5. P. 430–437.
Garvey S.M., Aggarwal V., Lai Ch.-S. et al. Exploratory Brain Metabolomics: Sudden Infant Death Syndrome // The FASEB J. 2016. V. 30. № 1. P. 233.
Garcia A.J., Koschnitzkya J.E., Ramireza J.M. Clinical Challenges to Ventilatory Control The physiological determinants of Sudden Infant Death Syndrome // Respiratory Physiology & Neurobiology. 2013. V. 189. № 2. P. 288–300.
Gazit A.Z., Kemp J.S. Cerebral Tissue Oxygenation Index and SIDS // Pediatrics. 2014. V. 134. № 3. P. 598–599.
Graham S.F., Chevallier O.P., Kumar P. et al. Metabolomic profiling of brain from infants who died from Sudden Infant Death Syndrome reveals novel predictive biomarkers // J. Perinatology. 2016. № 10. P. 139.
Guyenet P.G., Bayliss D.A. Neural control of breathing and CO2 homeostasis // Neuron. 2015. V. 87. № 5. P. 946–961.
Haynes R.L., Folkerth R.D., Paterson D.S. et al. Serotonin Receptors in the Medulla Oblongata of the Human Fetus and Infant: The Analytic Approach of the International Safe Passage Study // J. Neuropathology & Experimental Neurology. 2016. V. 75. № 11. P. 1048–1057.
Hefti M.M., Kinney H.C., Cryan J.B. et al. Sudden unexpected death in early childhood: general observations in a series of 151 cases // Forensic Science, Medicine, and Pathology. 2016. V. 12. № 1. P. 4–13.
Horne R.S., Hauck F.R., Moon R.Y. Sudden infant death syndrome and advice for safe sleeping // British Medical J. 2015. V. 350. P. 1989.
Huang L., Yu Y., Chen Y. et al. Association of common variants in NOS1AP gene with sudden unexplained nocturnal death syndrome in the southern Chinese Han population // International J. Legal medicine. 2014. V. 128. № 6. P. 933–938.
Iceman K.E., Richerson G.B., Harris M.B. Medullary serotonin neurons are CO2 sensitive in situ // J. Neurophysiology. 2013. V. 110. № 11. P. 2536–2544.
Ferracioli-Oda E., Qawasmi A., Bloch M.H. Meta-analysis: melatonin for the treatment of primary sleep disorders // PloS one. 2013. V. 8. № 5. P. 63–73.
Kapoor A., Sekar R.B., Hansen N.F. et al. An enhancer polymorphism at the cardiomyocyte intercalated disc protein NOS1AP locus is a major regulator of the QT interval // The American J. Human Genetics. 2014. V. 94. № 6. P. 854–869.
Kinney H.C., Cryan J.B., Haynes R.L. et al. Dentate gyrus abnormalities in sudden unexplained death in infants: morphological marker of underlying brain vulnerability // Acta Neuropathologica. 2015. V. 129. № 1. P. 65–80.
Machaalani R., Waters K.A. Neurochemical abnormalities in the brainstem of the Sudden Infant Death Syndrome (SIDS) // Pediatric Respiratory Reviews. 2014. V. 15. № 4. P. 293–300.
Manchester L.C., Coto-Montes A., Boga J.A. et al. Melatonin: an ancient molecule that makes oxygen metabolically tolerable // J. Pineal Research. 2015. V. 59. № 4. P. 403–419.
Migliarini S., Pacini G., Pelosi B. et al. Lack of brain serotonin affects postnatal development and serotonergic neuronal circuitry formation // Molecular Psychiatry. 2013. V. 18. № 10. P. 1106–1118.
Moon R.Y., Darnall R.A., Goodstein M.H. et al. SIDS and other sleep-related infant deaths: expansion of recommendations for a safe infant sleeping environment // Pediatrics. 2011. V. 128. № 5. P. 1341–1367.
Osawa M., Kimura R., Hasegawa I. et al. SNP association and sequence analysis of the NOS1AP gene in SIDS // Legal Medicine. 2009. V. 11. № 1. P. 307–308.
Pandi-Perumal S.R., BaHammam A.S., Brown G.M. et al. Melatonin antioxidative defense: therapeutical implications for aging and neurodegenerative processes // Neurotoxicity Research. 2013. V. 23. № 3. P. 267–300.
Pusiol T., Lavezzi A., Matturri L. et al. Impact assessment of endocrine disruptors on sudden intrauterine and infant death syndromes // European J. Forensic Sciences. 2016. V. 3. № 2. P. 8–15.
Shajib M.S., Khan W.I. The role of serotonin and its receptors in activation of immune responses and inflammation // Acta Physiologica. 2015. V. 213. № 3. P. 561–574.
Slominski R.M., Reiter R.J., Schlabritz-Loutsevitch N. et al. Melatonin membrane receptors in peripheral tissues: distribution and functions // Molecular and Cellular Endocrinology. 2012. V. 351. № 2. P. 152–166.
Vennemann M.T., Mechtild M.T., Loddenkötter B. et al. Cytokines and sudden infant death // International J. Legal Medicine. 2012. V. 126. № 2. P. 279–284.
Wacker D., Wang C., Katritch V. et al. Structural features for functional selectivity at serotonin receptors // Science. 2013. V. 340. № 6132. P. 615–619.
Watts S.W., Morrison S.F., Davis R.P. et al. Serotonin and blood pressure regulation // Pharmacological reviews. 2012. V. 64. № 2. P. 359–388.
Xia L., Bartlett D., Leiter J.C. Systemic administration of Interleukin-1beta enhances thermal prolongation of the laryngeal chemoreflex in decerebrate piglets implications for Sudden Infant Death Syndrome // The FASEB J. 2012. V. 26. № 1. P. 1082–1089.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


