Успехи физиологических наук, 2019, T. 50, № 4, стр. 81-86
Матриксные металлопротеиназы как одно из звеньев патогенеза наружного генитального эндометриоза
А. Р. Ильина a, b, Е. С. Миронова a, Н. С. Линькова a, c, *, В. О. Полякова a, d, e, f, И. М. Кветной a, d, e, Н. Н. Белушкина g
a Отдел биогеронтологии АНО НИЦ “Санкт-Петербургский институт биорегуляции и геронтологии”
197110 Санкт-Петербург, Россия
b Кафедра “Медицинская физика”, Институт биомедицинских систем и технологий,
Санкт-Петербургский политехнический университет Петра Великого
194223 Санкт-Петербург, Россия
c Кафедра терапии, гериатрии и антивозрастной медицины академии постдипломного образования ФГБУ “Федеральный научно-клинический центр специализированных видов медицинской помощи
и медицинских технологий ФМБА”
115687 Москва, Россия
d Отдел патоморфологии ФГБНУ “Научно-исследовательский институт акушерства,
гинекологии и репродуктологии им. Д.О. Отта”
199034 Санкт-Петербург, Россия
e Кафедра нормальной физиологии и патологии Санкт-Петербургского государственного университета
199034 Санкт-Петербург, Россия
f ЧОУ ВО “Санкт-Петербургский медико-социальный институт”
195271 Санкт-Петербург, Россия
g Центр иммунологии и молекулярной биомедицины Биологического факультета
Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: miayy@yandex.ru
Поступила в редакцию 03.02.2019
После доработки 15.03.2019
Принята к публикации 06.04.2019
Аннотация
В России эндометриоз встречается у 50% женщин репродуктивного возраста и часто становится причиной бесплодия. Патогенез этого заболевания в настоящее время до конца не изучен, что затрудняет его лечение. По одной из гипотез молекулами, вовлеченными в развитие эндометриоза, являются матриксные металлопротеиназы (ММР). Цель исследования – оценить роль ММР-2 и ММР-9 в патогенезе наружного генитального эндометриоза (НГЭ1). Методом иммуногистохимии в железах эндометрия женщин с НГЭ выявлено увеличение экспрессии ММР-2 на 34–72% и ММР9 – более, чем в 100 раз, по сравнению с нормальным эндометрием. В строме эндометрия у пациенток с НГЭ экспрессия ММР-9 повышалась более, чем в 100 раз. В эндометриальных гетеротопиях женщин с НГЭ экспрессия ММР-2 возрастала на 26–50%, а экспрессия ММР-9 – в 2.5–3.9 раза по сравнению с контролем. При прогрессировании НГЭ экспрессия ММР-2 в железистом компоненте эндометрия повышается. Таким образом, расщепление межклеточного матрикса и базальных мембран эндотелиоцитов с участием ММР-2 и ММР-9 лежит в основе имплантации эндометриальных гетеротопий и неоангиогенеза, которые являются ключевыми звеньями НГЭ.
Согласно данным РОССТАТ женское население России составляет 54% от общего числа жителей страны. В репродуктивном возрасте находятся 45% женщин и у 50% из них диагностируется эндометриоз [9]. Известно, что эндометриоз-ассоциированное бесплодие возникает на 20–50% чаще, чем у женщин без патологии эндометрия. Причиной возникновения бесплодия при эндометриозе являются гормональные и иммунные нарушения, негативно влияющие на формирование ооцитов, оплодотворение и эмбриогенез [1, 9]. Таким образом, эндометриоз является социально значимым заболеванием, а его этиология и молекулярные механизмы возникновения в настоящее время до конца не изучены.
Основными звеньями патогенеза наружного генитального эндометриоза (НГЭ) считают ретроградный заброс эндометрия в брюшную полость, имплантацию эндометриальных очагов и их пролиферативный рост под действием гормональных и иммунных факторов, а также неоангиогенез, способствующий автономному существованию эндометриальных гетеротопий [5, 9]. В перечисленных процессах важную роль играют цитокины (IL-1, IL-4, IL-6, IL-8, IL-10, TNF-α, PG-E2) и факторы роста (VEGF, TGF-β), регулирующие ремоделирование межклеточного матрикса [2, 3, 5, 9]. Так, в эндотелиоцитах IL-1 стимулирует выработку ММР-9, а индуктором синтеза ММР-9 в них является VEGF [3], экспрессия которого индуцируется IL-6 [5]. Кроме того, IL-4 и IL-10 через супрессию синтеза IL-1 в макрофагах индуцируют синтез ММР-9. Кроме того, выявлена способность ММР-9 осуществлять активацию IL-8 и трансформирующего фактора роста типа бета (TGF-β), который способен угнетать пролиферацию эндотелиоцитов [3, 4]. ММР-2 менее подвержена регуляции со стороны факторов роста и цитокинов в связи с малым количеством регуляторных элементов в промоторной зоне гена ММР-2 [10], однако в кератиноцитах, глиальных клетках, меланоме, аденокарциноме, фибросаркоме индуктором синтеза ММР-2 является TGF-β, в фибробластах и лейомиоцитах – IL-1, TNF-α [1, 2].
Учитывая данные о взаимной регуляции синтеза ММР, цитокинов и факторов роста в норме и при патологии можно предположить, что ММР-2 и ММР-9 играют важную роль в развитии НГЭ [4, 6, 10]. Однако ввиду неоднозначности имеющихся данных, важно провести расширенное исследование роли ММР-2 и ММР-9 в патогенезе различных стадий НГЭ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Образцы эндометрия и эндометриальных гетеротопий были взяты путем пайпель-биопсии у женщин репродуктивного возраста (22–35 лет, средний возраст 29.7 ± 4.0 лет) с НГЭ. Весь материал был разделен на 4 группы по стадиям заболевания согласно клинической классификации НГЭ [11]: Ι группа – 1-ая стадия НГЭ, ΙΙ группа – 2-ая стадия НГЭ, III группа – 3-я стадия НГЭ, IV группа – 4-ая стадия НГЭ. В каждой группе выделяли по 2 подгруппы, одна из которых содержала материал эндометрия (n = 10), другая – материал эндометриальных гетеротопий (n = 10). Контролем служили биоптаты нормального эндометрия (n = 5), полученного при обследовании по планированию беременности, и аутопсийный материал брюшины (n = 5) женщин без НГЭ. Весь материал был получен в архиве отдела патоморфологии НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта.
Материал заключали в парафиновые блоки, фиксировали в 10% формалине в течение 2–5 ч в проводочной станции Microm STP120 (ThermoScientific, США) в течение 17 ч, после чего в термостате при 60°С заливали в парафин. Затем на микротоме (Sakura, Япония) изготавливали срезы толщиной 3–5 мкм, помещали на предметные стекла, покрытые поли-L-лизином (ThermoScientific, США) и в течение 1–2 дней просушивали срезы в термостате при 40°С. Детекцию ММР-2 и ММР-9 в материале эндометрия, эндометриальных гетеротопий и брюшины осуществляли иммуногистохимическим методом с применением первичных кроличьих поликлональных антител ab37150 (1 : 500, Abcam) к ММР-2, первичных мышиных моноклональных антител ab58803 (1 : 100, Abcam) к ММР-9 и вторичных антител Biotinylated Goat Anti-Polyvalent Plus + Streptavidin Peroxidase Plus (Abcam). Инкубирование с первичными антителами к ММР-2 осуществляли в течение 1 ч при комнатной температуре, к ММР-9 – 12 ч при 4°С, со вторичными антителами – 10 мин при комнатной температуре согласно требованиям производителя. Результаты, полученные методом стрептавидин-биотиновой гистохимии сравнивали с данными, полученными методом иммунофлуоресцентной гистохимии. Для выявления ММР-2 и ММР-9 иммунофлуоресцентным методом образцы эндометрия, эндометриальных гетеротопий и брюшины после обработки первичными антителами инкубировали 30 мин в темноте при комнатной температуре со вторичными козьими анти-кроличьими антителами Alexa Fluor 488 ab150077 (1 : 1000, Abcam) и козьими анти-мышиными Alexa Fluor 647 ab150115 (1 : 1000, Abcam), соответственно.
Визуализацию результатов экспрессии ММР-2 и ММР-9 в материале эндометрия, эндометриальных гетеротопий и брюшины, полученных методом стрептавидин-биотиновой гистохимии, осуществляли с использованием светового микроскопа Olympus BX46 (Olympus, Япония). Визуализацию результатов, полученных иммунофлуоресцентным методом, проводили на конфокальном микроскопе FlueView 1000 (Olympus, Япония).
Количественную оценку экспрессии ММР-2 и ММР-9 в исследуемом материале осуществляли по результатам стрептавидин-биотиновой гистохимии. При помощи программного обеспечения “СellSens Entry” и цифровой камеры Olympys-UC30 были получены микрофотографии 5 полей зрения с каждого препарата при ×400. В программе “Видеотест Морфология 5.2” определяли относительную площадь экспрессии, которую рассчитывали, как отношение площади, занимаемой иммунопозитивными клетками, к площади всех клеток в поле зрения, и выражали в процентах. Для статистического анализа данных использовали непараметрический U-критерий Манна–Уитни. Для выявления взаимосвязи между экспрессией маркеров и степенью тяжести НГЭ применяли S-критерий Джонкира.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Экспрессия ММР-2 в железистом компоненте эндометрия у женщин с НГЭ 2–4 стадий была выше, чем в контроле, соответственно на 34, 39 и 72% (табл. 1). В стромальном компоненте эндометрия пациенток с НГЭ 1 стадии экспрессия ММР-2 была на 62% выше, чем в контроле. В эндометриальных гетеротопиях при 1–4 стадиях заболевания экспрессия ММР-2 была соответственно на 49, 50, 26 и 45% выше, чем в контрольном материале брюшины. При переходе от 2 к 4 стадии НГЭ было выявлено достоверное увеличение экспрессии ММР-2 в железистом компоненте эндометрия.
Таблица 1.
Относительная площадь экспрессии ММР-2 (%) в эндометрии и эндометриальных гетеротопиях пациенток с НГЭ
| Компонент эндометрия | Эндометрий | ||||
|---|---|---|---|---|---|
| Контроль | I группа | II группа | III группа | IV группа | |
| ЖК | 16.84 ± 0.70 | 18.67 ± 1.35 | 22.56 ± 1.50* | 23.44 ± 2.07* | 28.92 ± 0.61* |
| СК | 6.34 ± 0.58 | 10.25 ± 0.86** | 8.40 ± 0.44 | 6.19 ± 0.67 | 7.62 ± 0.69 |
| Контроль (брюшина) | Эндометриальные гетеротопии | ||||
| I группа | II группа | III группа | IV группа | ||
| 8.43 ± 0.41 | 12.56 ± 0.94# | 12.65 ± 0.84# | 10.59 ± 0.84# | 12.24 ± 0.92# | |
ЖК – железистый компонент эндометрия, СК – стромальный компонент эндометрия. * р < 0.05 по сравнению с соответствующим показателем в ЖК эндометрия женщин без НГЭ, ** р < 0.05 по сравнению с соответствующим показателем в СК эндометрия женщин без НГЭ, # – по сравнению с соответствующим показателем в брюшине женщин без НГЭ.
Увеличение экспрессии ММР-2 в эндометрии при НГЭ по сравнению с контролем и в зависимости от стадии эндометриоза может свидетельствовать о повышении протеолитической активности ММР-2 при развитии патологии, и, как следствие, об увеличении вероятности ретроградного заброса материала эндометрия. В данном случае, увеличение экспрессии ММР-2 может быть проявлением молекулярных каскадов позитивной индукции, развивающихся при прогрессировании патологии. Увеличение экспрессии ММР-2 в эндометриальных гетеротопиях при НГЭ по сравнению с контролем может быть проявлением предполагаемой супрессорной активности ММР-2 в отношении ангиогенеза – одного из звеньев патогенеза НГЭ. Данное предположение высказано на основе исследований, свидетельствующих об активности ММР-2 в подавлении адгезии эндотелиальных клеток [8].
Экспрессия ММР-9 (рис. 1, 2, табл. 2) в железистом компоненте эндометрия у женщин с НГЭ 1–4 стадий была выше, чем в контроле, соответственно в 110, 93, 63 и 152 раза. В стромальном компоненте эндометрия у пациенток с НГЭ 1–4 стадии экспрессия ММР-9 была соответственно в 80, 69, 99 и 273 раза выше, чем в контроле. В эндометриальных гетеротопиях при 1–4 стадиях заболевания экспрессия ММР-9 была соответственно в 3.9, 3.0, 2.7 и 2.5 раза выше, чем в контрольном материале брюшины.
Рис. 1.
Иммуногистохимическое окрашивание на ММР9, ×400. Линия масштаба соответствует 50 мкм. А – эндометрий женщин без патологии (контроль), Б – эндометрий женщин с наружным генитальным эндометриозом второй степени тяжести, В – брюшина женщин без патологии (контроль), Г – эндометриальная гетеротопия, полученная от пациенток с наружным генитальным эндометриозом первой степени тяжести.

Рис. 2.
Иммунофлуоресцентное окрашивание на ММР9, ×400. Синяя флуоресценция – ядра клеток (краситель – DAPI), красная – экспрессия ММР-9 (вторичные антитела – Alexa Fluor 647). Линия масштаба соответствует 50 мкм. А – эндометрий женщин без патологии (контроль), Б – эндометрий женщин с наружным генитальным эндометриозом четвертой степени тяжести, В – брюшина женщин без патологии (контроль), Г – эндометриальная гетеротопия, полученная от пациентки с наружным генитальным эндометриозом четвертой степени тяжести.
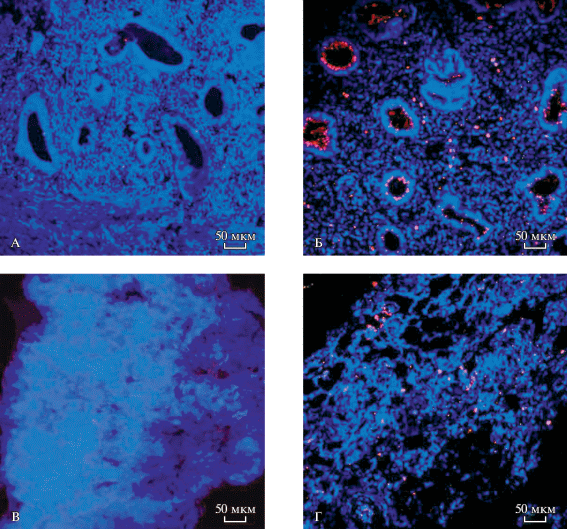
Таблица 2.
Относительная площадь экспрессии ММР-9 в эндометрии и эндометриальных гетеротопиях при НГЭ
| Компонент эндометрия | Эндометрий | ||||
|---|---|---|---|---|---|
| Контроль | I группа | II группа | III группа | IV группа | |
| ЖК | 0.05 ± 0.01 | 3.75 ± 0.31** | 3.22 ± 0.40** | 4.63 ± 0.43** | 12.68 ± 1.22** |
| СК | 0.40 ± 0.04 | 44.05 ± 1.77* | 37.19 ± 2.06* | 25.33 ± 1.09* | 60.69 ± 2.97* |
| Контроль (брюшина) | Эндометриальные гетеротопии | ||||
| I группа | II группа | III группа | IV группа | ||
| 2.79 ± 0.13 | 10.96 ± 0.43# | 8.35 ± 0.69# | 7.59 ± 0.77# | 6.93 ± 0.58# | |
Обозначения и достоверности как в табл. 1.
Как известно, основной функцией MMP является расщепление компонентов межклеточного матрикса [4, 10, 11]. В первичной структуре ММР-2 в составе каталитического центра имеется фибронектиновый домен, ответственный за связывание с ламинином и фибронектином. Ламинин – компонент мембран эндотелиоцитов, а фибронектин входит в состав межклеточного вещества. В структуре ММР-9 имеется домен, обеспечивающий высокое сродство ММР-9 к коллагену IV типа, который, так же, как и ламинин, является компонентом клеточных мембран. Разрушение межклеточного матрикса и базальных мембран эндотелиоцитов лежит в основе имплантации эндометриальных гетеротопий и неоангиогенеза, которые являются ключевыми звеньями НГЭ [4, 11].
Предположение о том, что ММР-2 и ММР-9 играют важную роль и в развитии НГЭ, было высказано и другими авторами [4, 6, 10]. В исследовании Szymanowski и соавторов (2016) не было выявлено достоверных различий в экспрессии мРНК ММР-2 и ММР-9 в эндометрии женщин первой и второй степени тяжести НГЭ по сравнению с лицами без патологии репродуктивной системы. Авторы этого исследования полагают, что полученные результаты указывают на необходимость дальнейшего изучения роли ММР в патогенезе эндометриоза. В другой работе показано отсутствие различий в экспрессии мРНК ММР-9 в эндометрии женщин с НГЭ и без патологии [6]. Однако в этом исследовании отсутствовало разделение пациенток по степени тяжести эндометриоза и не проводилось изучение уровня ММР-9 в эктопическом эндометрии, как и в исследовании Szymanowski К. и соавторов (2016) [9].
В обзоре Ярмолинской и соавт. (2012) обобщены данные о роли матриксных металлопротеиназ в патогенезе эндометриоза [5]. Авторы подчеркивают связь ММР-1,-3,-9 с системой цитокинов и отмечают увеличение экспрессии ММР-2 и ММР-9 в эктопическом эндометрии при внутреннем генитальном эндометриозе. Кроме того, показано повышение экспрессии мРНК ММР-2 и ММР-9 в эндометриальных гетеротопиях женщин с НГЭ по сравнению с экспрессией мРНК этих металлопротеиназ в нормальном эндометрии. Два последних результата недостаточно обоснованы ввиду неоднородности выборки по степеням эндометриоза и использования авторами в качестве эндометриальных гетеротопий материал очагов овариального эндометриоза, который часто может быть идентифицирован вместо кистозных новообразований.
Нами показано увеличение экспрессии ММР-2 и ММР-9 в эндометрии и в эндометриальных гетеротопиях пациенток с НГЭ всех степеней тяжести по сравнению с контролем, что свидетельствует о непосредственном участии ММР-2 и ММР-9 в патогенезе НГЭ, экспериментально подтверждая предположение, ранее высказанное другими авторами. Учитывая приведенную выше информацию и полученные нами данные, можно заключить, что экспрессия ММР-2 и ММР-9 активируется цитокинами и VEGF и играет ключевую роль в патогенезе НГЭ.
Список литературы
Маркелова Е.В., Здор В.В., Романчук А.Л., Бирко О.Н. Матриксные металлопротеиназы и их взаимосвязь с системой цитокинов, диагностический и прогностический потенциал // Иммунопатология, аллергология, инфектология. 2016. № 2. С. 11–22.
Тарламазян А.В., Столярова У.В. Вопросы этиологии, патогенеза, классификации, диагностики и лечения ретроцервикального эндометриоза (обзор) // Саратовский научно-медицинский журнал. 2016. Т. 12. № 2. С. 138–144.
Цицкарава Д.З., Ярмолинская М.И., Селютин А.В., Сельков С.А. Оценка содержания и патогенетической роли цитокинов перитонеальной жидкости у пациенток с глубоким инфильтративным эндометриозом // Журнал акушерства и женских болезней. 2017. Т. 66. № 1. С. 38–45.
Ярмолинская М.И., Молотков А.С., Денисова В.М. Роль матриксных металлопротеиназ в патогенезе генитального эндометриоза // Журн. акушерства и женских болезней. 2012. Т. LXI. № 2. С. 92–100.
Ярмолинская М.И., Русина Е.И., Хачатурян А.Р., Флорова М.С. Клиника и диагностика генитального эндометриоза // Журн. акушерства и женских болезней. 2016. Т. 65. № 5. С. 4–21.
Ahn S.H., Monsanto S.P., Miller C. et al. Pathophysiology and Immune Dysfunction in Endometriosis // BioMed. Research International. 2015. P. 1–12.
Collette T., Maheux R., Mailloux J., Akoum A. Increased expression of matrix metalloproteinase-9 in the eutopic endometrial tissue of women with endometriosis // Human Reproduction. 2006. V. 21. № 12. P. 3059–3067.
Kianpour M., Nematbakhsh M., Ahmadi S.M. et al. Serum and Peritoneal Fluid Levels of Vascular Endothelial Growth Factor in Women with Endometriosis // J. Fertility and Sterility. 2013. V. 7. № 2. P. 96–99.
Lee H., Chang K.W., Yang H.Y. et al. MT1-MMP regulates MMP-2 expression and angiogenesis-related functions in human umbilical vein endothelial cells // Biochem Biophys Res Commun. 2013. V. 437(2). P. 232–238.
Philippe E., Van den Steen, Dubois B. et al. Biochemistry and Molecular Biology of Gelatinase B or Matrix Met-alloproteinase-9 (MMP-9) // Critical Reviews in Biochemistry and Molecular Biology. 2002. № 37. P. 375–536.
Szymanowski K., Dera-Szymanowska A., Mikołajczyk M., Wirstlein P. Matrix metalloproteinase-2 (MMP-2), MMP-9, tissue inhibitor of matrix metalloproteinases (TIMP-1) and transforming growth factor-β2 (TGF-β2) expression in eutopic endometrium of women with peritoneal endometriosis // Ann. Agric. Environ. Med. 2016. V. 23. № 4. P. 649–653.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


