Успехи физиологических наук, 2019, T. 50, № 4, стр. 50-63
Возможные механизмы влияния ацетилхолина на обработку информации в лемнисковом слуховом пути
И. Г. Силькис *
Институт высшей нервной деятельности и нейрофизиологии РАН
517485 Москва, Россия
* E-mail: isa-silkis@mail.ru
Поступила в редакцию 19.05.2019
После доработки 10.06.2019
Принята к публикации 21.07.2019
Аннотация
Проведен анализ возможных механизмов влияния ацетилхолина на восприятие чистых тонов в лемнисковом слуховом пути и на вызванные обучением перестройки рецептивных полей тонотопически связанных нейронов первичного слухового поля А1 и внутреннего коленчатого тела. Оценен вклад холинергических входов из базального переднего мозга и педункулопонтийного ядра в модуляцию активности нейронов каждой из структур, участвующих в обработке тонов и включающих поле А1, префронтальную кору, гиппокампальную формацию, таламические ядра, нижнее двухолмие и базальные ганглии. Отмечен многокомпонентный характер влияния различных концентраций ацетилхолина на формирование рецептивных полей, вызванный разнообразием типов холинорецепторов на основных клетках и тормозных интернейронах в каждой из указанных структур, а также разной связываемостью этих рецепторов с ацетилхолином. С учетом такого влияния ацетилхолина дано объяснение причин разнонаправленного характера его влияния на пластические перестройки рецептивных полей нейронов поля А1 при обучении, в котором условным стимулом является тон, а безусловным – стимуляция холинергической структуры. Проведен сравнительный анализ функционирования лемнискового пути в норме и в условиях дефицита ацетилхолина, характерного для болезни Альцгеймера. Поскольку дисфункция слуховой системы возникает уже на ранней стадии болезни, понимание механизмов влияния ацетилхолина на функционирование этой системы представляет интерес, так как может быть полезным для поиска возможностей улучшения обработки звуков.
Многочисленные публикации указывают на то, что потеря слуха с высокой вероятностью коррелирует с возникновением деменции у пожилых людей [87]. При болезни Альцгеймера (БА) ухудшается порог для восприятия звуков, причем дисфункция центральной и периферической слуховой системы возникает уже на ранней стадии БА и поэтому может являться индикатором ее последующего развития [79, 88]. Одной из причин ухудшения слуха при БА может являться характерный для этой болезни дефицит холинергической иннервации разных структур мозга. Дегенерация начинается в медиальной перегородке/диагональной полоске Брока (МП/ДПБ) иннервирующих гиппокамп, затем захватываются энторинальная и височная области новой коры, а позднее и другие части лимбической системы, теменно-затылочная и лобная области коры, базальные ганглии (БГ), базальное ядро Мейнерта (БЯМ) – основной источник холинергической иннервации коры. Кроме того, при БА и у старых животных уменьшается количество мускариновых М1 рецепторов в полях СА3 и СА1 гиппокампа и в энторинальной коре (ЭК), также уменьшается плотность никотиновых α4β2 рецепторов и связывание М1 рецепторов с ацетилхолином (АХ), тогда как количество М2 рецепторов не меняется, а их связывание увеличивается [39, 54].
Имеются экспериментальные свидетельства того, что АХ, который выделяется из терминалей нейронов базального переднего мозга (БПМ), включающего БЯМ и МП/ДПБ, играет важную роль в связанных с обучением пластических перестройках рецептивных полей (РП) нейронов первичного слухового поля А1 [86]. Исследования показали, что изменения РП в поле А1 происходят только при ассоциативном обучении, являются высокоспецифичными, быстро приобретаются и могут поддерживаться неопределенно долго, т.е. они обладают всеми характеристиками ассоциативной памяти [93]. Была выдвинута гипотеза о конвергенции звукового условного стимула (УС) и безусловного стимула на нейронах проекционного таламического ядра – внутреннего коленчатого тела (ВКТ), за которым следует активация холинергических ядер БПМ и выделение АХ, активирующего мускариновые рецепторы на нейронах слуховой коры, что способствует модификации синаптической передачи в коре [32]. Действительно, после сочетания звукового стимула с электрической стимуляцией БПМ в поле А1 были обнаружены изменения эффективности синаптической передачи – длительная потенциация (ДП) и длительная депрессия (ДД) [32]. Пластические перестройки синаптической передачи коррелировали с уменьшением вариабельности ответов нейронов на тоны предпочтительной частоты настройки (ПЧН), что способствовало улучшению детектирования и распознавания стимулов, близких к пороговым, а также ранее не воспринимаемых стимулов [32]. Поле А1 является звеном лемнисковой слуховой системы, которая также включает вентральную часть ВКТ (ВКТв) и центральную часть нижнего двухолмия (НДц) [84] (рис. 1). От нейронов ВКТв, имеющих хорошую частотную настройку, информация переносится в поле А1 тонотопически [84]. Обратные проекции из поля А1 в ВКТв тоже организованы топически [41].
Рис. 1.
Схема организации нейронных цепей, участвующих в обработке тонов в лемнисковом слуховом пути. Области коры: А1 – первичная слуховая; ПФК – префронтальная; ОфК – орбитофронтальная; ПгК – парагиппокампальная; ЭК – энторинальная. Гипп – гиппокамп; Суб – субикулюм. Холинергические структуры: БЯМ – базальное ядро Мейнерта, МП – медиальная перегородка, ДПБ – диагональная полоска Брока; ППЯ – педункулопонтийное ядро. Ядра таламуса: ВКТв – вентральная часть внутреннего коленчатого тела, МДЯ – медиодорзальное, РЕ – реуниенс; НДц – центральная часть нижнего двухолмия; ВД – верхнее двухолмие. Базальные ганглии: ПЯ – прилежащее ядро (вентральный стриатум); С-Н и С-П – стрионигральные и стриопаллидарные шипиковые нейроны, соответственно; ВП – вентральный паллидум; ЧВр и ЧВк – ретикулярная и компактная части черного вещества соответственно; ВПП – вентральное поле покрышки; СТЯ – субталамическое ядро; Д1 и Д2 – рецепторы, чувствительные к дофамину. Большие светлые и темные кружки – возбудительные и тормозные проекционные нейроны, соответственно; маленькие светлые, темные и заштрихованные кружки – возбудительные, тормозные и холинергические входы, соответственно; маленькие треугольники и квадраты – потенциированные и депрессированные возбудительные входы, соответственно; утолщенные и тонкие линии – сильные и слабые входы, соответственно; стрелки – дофаминергический вход.
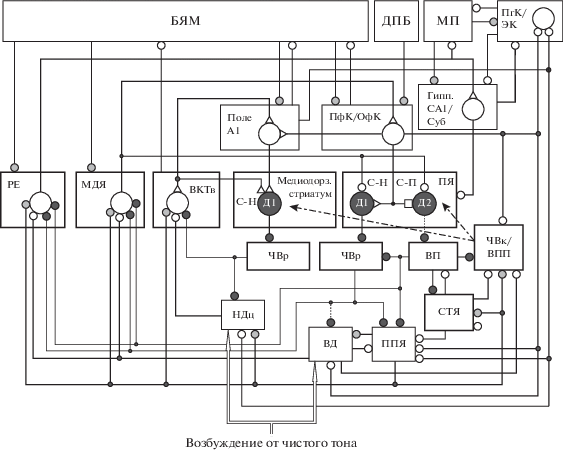
Возможные механизмы формирования РП нейронов поля А1 и моносинаптически связанных с ними нейронов ВКТв анализировались нами ранее [3]. Было указано на существенную роль БГ и префронтальной коры (ПфК) в восприятии тонов [3]. Нами не учитывалась роль гиппокампа в запоминании звуковой информации и не анализировались особенности влияния АХ на функционирование лимбического слухового пути в норме и патологии. Однако известно, что холинергический вход в гиппокамп из МП/ДПБ влияет на обработку звуков, а повреждение этого входа приводит к нарушению памяти о звуковом стимуле [83].
Задачей настоящей работы являлся анализ возможных механизмов влияния АХ на функционирование лемнискового слухового пути, восприятие чистых тонов и пластические перестройках РП нейронов поля А1 и ВКТв. Такой анализ представляет интерес, в частности, потому, что потеря слуха сама по себе ведет к дефициту коммуникаций, социальной изоляции и ухудшению качества жизни [85], а понимание механизмом обработки звуков может способствовать поиску возможностей для облегчения этого симптома БА.
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ РЕЦЕПТИВНЫХ ПОЛЕЙ НЕЙРОНОВ ПОЛЯ А1
Роль базальных ганглиев в формировании рецептивных полей нейронов поля А1
При разработке механизма формирования РП нейронов поля А1 и ВКТв нами были учтены известные данные о функциональной организации нейронных цепей, участвующих в обработке информации о чистых тонах [3]. Схема организации связей в этих цепях представлена на рис. 1. На формирование РП оказывают влияние ДП и ДД эффективности межнейронных связей в слуховых и лимбических цепях кора–БГ–таламус–кора (К–БГ–Т–К). Согласно предложенному механизму, дофамин, выделяющийся во входном ядре БГ – стриатуме в ответ на УС – тон с частотой F, воздействуя на Д1 рецепторы на С-Н нейронах, способствует индукции ДП эффективности сильных входов из поля А1 к этим нейронам и ДД слабых входов. Сильными являются входы от нейронов, ПЧН которых совпадала с частотой F. Последующая реорганизация активности нейронов в цепи поле А1–БГ–ВКТв – поле А1 приводит к растормаживанию через выходное ядро БГ – ретикулярную часть черного вещества (ЧВр) активности нейронов ВКТв и тонотопически связанных с ними нейронов поля А1 с первоначальной ПЧН F или близкой к F. Таким образом, в основе пластических перестроек РП нейронов этих областей лежит модификация эффективности синаптической передачи между всеми элементами цепи К–БГ– Т–К. Поскольку ГАМКергические нейроны латеральной части ЧВр проецируются в НДц, нейроны которого иннервируют ВКТв, можно полагать, что в формировании РП при обработке чистых тонов участвует растормаживающее действие со стороны БГ не только на ВКТв, но и на НДц.
Роль префронтальной коры и внимания в формировании рецептивных полей нейронов поля А1
С помощью функционального магнитного резонанса показано, что при сохранении памяти о тоне активность слуховой коры увеличивается [57]. Важно, что нейронное отображение сохраняемого в памяти тона является специфичным для слуховой коры и высших областей коры, включая фронтальную область, и что для запоминания необходимо направлять внимание на определенный стимул [51]. Мы полагаем, что внимание является частью сенсорной обработки [4]. Произвольное внимание к стимулу с частотой F запускается усилением активности нейронов ПфК, которое приводит к увеличению активности нейронов поля А1 с ПЧН, совпадающей с частотой F. Влияние ПфК осуществляется как непосредственно, за счет корково-корковых влияний сверху–вниз, так и опосредованно, за счет выделения дофамина в ответ на тон и растормаживания таламуса со стороны лимбической части БГ, включающей вентральный стриатум – прилежащее ядро (ПЯ) [4] (рис. 1). Благодаря этому, при наличии произвольного внимания обработка тона с частотой F должна облегчаться. В пользу влияний со стороны ПфК на формирование РП могут свидетельствовать данные о том, что оптогенетическая стимуляция орбитофронтальной коры (ОфК), которая является частью ПфК, приводила к коротколатентному возбуждению нейронов поля А1, а сочетание стимуляции ОфК со звуком модифицировало РП нейронов поля А1 [95].
Роль гиппокампа в поддержании памяти о звуках
В настоящее время гиппокамп с прилегающей парагиппокампальной областью рассматривают не как обособленный модуль, обеспечивающий связь внешних стимулов с их долговременными отображениями в памяти, а как часть континуума областей мозга, участвующих в сенсорном восприятии [52]. Парагиппокампальная область, получающая топически организованные проекции из ОфК, состоит из ЭК, а также периринальной и постринальной областей коры [49]. Периринальную кору, сигналы от которой поступают в гиппокамп через латеральную часть ЭК рассматривают как одно из звеньев поступления сенсорной информации, а в постринальной коре, сигналы от которой поступают в гиппокамп через медиальную часть ЭК, обрабатывается информация о расположении в пространстве. Слуховая кора проецируется непосредственно в парагиппокампальную область [69], а через нее информация поступает в заднюю часть гиппокампа [6]. С помощью функционального магнитного резонанса показано на человеке, что поддержание в памяти информации об отдельных тонах ассоциируется с активацией слуховой коры, нижней лобной извилины и задней части гиппокампа, причем паттерны нейронной активности для разных тонов различаются [51]. После удаления нижней височной извилины, включая ринальную кору, наблюдались нарушения слуховой памяти [30]. У пациентов с поражением парагиппокампальной области нарушалось восприятие звуков [12]. Сохранение в памяти информации об отдельных тонах связано с увеличением взаимодействия между гиппокампом и нижней лобной извилиной [51]. Авторы указанной работы полагают, что гиппокамп вовлечен во все фазы слуховой рабочей памяти (кодирование, поддержание, извлечение из памяти); что активность в слуховой коре и нижней лобной извилине специфична по отношению к тону, поддерживаемому в рабочей памяти; а также что длинно-аксонные связи между слуховой корой, гиппокампом и фронтальной корой могут лежать в основе поддержания отображений тона в рабочей памяти в активном состоянии. Активность нейронов в гиппокампе зависит как от параметров звука, так и от расположения его источника. Показано, например, что при длительном (30-минутном) предъявлении тона с частотой 4 кГц большой громкости изменялась активность клеток места в гиппокампе [36]. С пространственной локализацией коррелирует также срабатывание нейронов субикулюма и нейронов ПЯ, в которое проецируется субикулюм [61]. Гиппокамп играет важную роль в функционировании лимбической части БГ, поскольку сигналы из ПфК в ПЯ являются слабыми и не позволяют довести шипиковую клетку до разряда. Однако одновременное поступление в ПЯ сигналов из ПфК и гиппокампа позволяет шипиковой клетке разрядиться. Таким образом, афферентный вход из гиппокампа может играть роль “ворот” при пропускании сигналов из ПфК через ПЯ [29].
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ВЛИЯНИЯ АЦЕТИЛХОЛИНА НА ФОРМИРОВАНИЕ РЕЦЕПТИВНЫХ ПОЛЕЙ НЕЙРОНОВ ПОЛЯ А1 И ФУНКЦИОНИРОВАНИЕ ГИППОКАМПА
Особенности организация холинергических проекций в структуры, участвующие в обработке тонов, и пути активации холинергических клеток сенсорными стимулами
Организация холинергических проекций БПМ у человека является кортико-топической. Нейроны передне-медиальной части БПМ (МП/ДПБ) проецируются в гиппокамп, а задне-латеральная часть БПМ – БЯМ иннервирует инсулярную и цингулярную кору [31], а также дорзальную и каудальную части мПфК [15]. Холинергические нейроны, проецирующиеся в поле А1 и другие слуховые поля, расположены в ограниченной области в каудальной части БПМ, причем в первичные и вторичные слуховые области коры проецируются разные группы клеток [20]. В свою очередь, холинергические нейроны, проецирующемся в поле А1, получают иннервацию из ВКТв и задних интраламинарных ядер таламуса, тогда как иннервация к холинергическим нейронам, проецирующимся в высшие слуховые поля, поступает из этих же слуховых полей [20]. Важно отметить, что холинергические афференты иннервируют не только пирамидные клетки, но и тормозные интернейроны коры, участвующие в растормаживании [53]. По-видимому, это растормаживание вносит важный вклад в обучение, поскольку показано, что его прерывание нарушает обучение [53]. Отмечено, что перекрываемость групп холинергических клеток БПМ, проецирующихся в различные части коры, коррелирует с наличием связей между этими областями коры [98]. Одновременная холинергическая иннервация связанных областей может способствовать пластическим перестройкам в коре [40, 98]. Следует иметь в виду, что из БПМ в кору поступают не только холинергические, но также ГАМКергические и глутаматергические волокна [56] (на рисунке не показаны, с целью его упрощения). Кроме того, БПМ проецируется в связанное с ПфК медиодорзальное ядро (МДЯ) таламуса, в интраламинарные ядра (к которым относится связанное с гиппокампом ядро реуниенс, РЕ) и ретикулярное таламическое ядро (на рисунке не показано с целью упрощения). Благодаря этому БПМ оказывает холинергическое воздействие на кору не только непосредственно, но и через таламо-кортикальные входы [48]. В срединные ядра таламуса, связанные с высшими корковыми областями, холинергическая иннервация поступает также из педункулопонтийного ядра (ППЯ) и латеродорзального тегментального ядра, причем ГАМКергические проекции из этих ядер в таламусе представлены слабо [90]. Проекционные ядра таламуса, к которым относится ВКТ, получают холинергическую иннервацию только из ППЯ.
Пери- и постринальная области коры, а также ЭК получают холинергическую иннервацию из каудальной части БПМ, а также горизонтальной части ДПБ, тогда как ЭК получает иннервацию из ростральной части БПМ, включающей МП, а также из горизонтальной и вертикальной частей ДПБ [50]. Нейроны, проецирующиеся в латеральную часть ЭК, расположены более каудально, чем нейроны, проецирующиеся в медиальную ЭК.
Кроме входа в гиппокамп из МП/ДПБ на активность нейронов гиппокампа может влиять холинергический вход из ППЯ. Это влияние осуществляется через таламическое РЕ, которое иннервирует поле СА1 гиппокампа и МП [62]. Холинергический вход из ППЯ влияет также на активность нейронов БГ, поскольку иннервирует нейроны субталамического ядра (СТЯ), внутреннюю и наружную части бледного шара (БШв и БШн), а также дофаминергические клетки компактной части черного вещества и вентрального поля покрышки (ЧВк/ВПП) [26]. Для этих проекций тоже характерна топическая организация. Компактная зона ППЯ и латеральная часть диффузной зоны ППЯ проецируются в БШ и энтопедункулярное ядро (у грызунов это аналоги БШн и БШв, соответственно), а также в вентральный паллидум (ВП) [1]. Медиальная часть диффузной зоны ППЯ проецируется только в БШ. В БШ поступают как холинергические, так и не холинергические волокна [1]. Холинергический вход имеется и в ЧВр [68].
Новая кора является одним из источников нисходящих проекций к холинергическим нейронам БПМ, причем проекции из ПфК к холинергическим нейронам БПМ организованы топически [34]. Слуховая кора также является одним из источников нисходящих проекций к холинергическим нейронам БПМ [99]. Нейроны поля А1 могут влиять сверху–вниз на выделение АХ, через проекции пирамидных клеток слоя 5 на холинергические клетки ППЯ и латеродорзального тегментального ядра (на рисунке не представлено с целью упрощения), а последние иннервируют нейроны НД и ВКТ [78]. Кроме того, активность нейронов ППЯ зависит от активности нейронов поля А1 и субикулюма, поскольку они возбуждают шипиковые клетки дорзального стриатума и ПЯ, соответственно, а изменение активности последних через выходные ядра БГ влияют на степень ингибирования ППЯ (рис. 1). Лимбическая часть БГ может влиять и на активность холинергических клеток в БЯМ, поскольку нейроны ПЯ проецируются посредственно в БЯМ [10]. Показано, что эффективность ГАМК торможения со стороны нейронов раковины ПЯ на холинергические клетки модулируется воздействием на глутаматные рецепторы на шипиковых клетках ПЯ [105]. Эти рецепторы иннервируются афферентами из ПфК и гиппокампа. Таким образом, ПфК и гиппокамп могут оказывать влияние на БЯМ через ПЯ.
Несмотря на то, что в БПМ поступает мало волокон из первичных сенсорных областей коры, разномодальные сенсорные стимулы увеличивают высвобождение АХ в коре [21]. Почти все холинергические нейроны БПМ отвечают на подкрепление с малым ЛП (18+/–2 мс), причем это может быть как положительное подкрепление, так и отрицательное [40, 56]. Примечательно, что респонсивные свойства были одинаковы у нейронов БПМ, проецирующихся в слуховую кору и в ПфК [98]. Электрическая стимуляция сенсорного пути, так же как и внешние стимулы, приводила к увеличению выделения АХ в соответствующей области коры. Так, стимуляция ВКТ приводила к увеличению на 72% концентрации АХ в слуховой коре [75]. Звуковые стимулы статистически значимо увеличивали выделение АХ и в гиппокампе, причем выделение АХ в гиппокампе и коре регулируется различным образом [43]. Нейроны ППЯ отвечают на звуковые стимулы, имеющие поведенческую значимость, с ЛП менее 80 мс. Также отмечено, что имеется сходство в ответах нейронов ППЯ и стриатума. Влияние сверху–вниз на выделение АХ достаточно эффективно. Так, временное ингибирование ПфК препятствовало увеличению выделения АХ в слуховой коре при электрической стимуляции ВКТ [75]. Кроме того, после ингибирования ПфК уменьшалось на 15–59% спонтанное выделение АХ в разных сенсорных областях. Благодаря корковым влияниям на БПМ, холинергический вход в кору, в конечном счете, отражает комбинированное действие, управляемое сигналом и когнитивным детектированием. Результаты исследований реакций нейронов ППЯ на сенсорные стимулы приведены в обзоре [91].
Вклад холинорецепторов в модулирующее влияние АХ на активность нейронов слуховой коры и их РП
Ацетилхолин, выделяющийся при поступлении звукового УС, модулирует эффективность синаптических входов к нейронам коры и влияет на изменение РП пирамидных нейронов в поле А1 через мускариновые и никотиновые рецепторы, которые как в поле А1, так и в ПфК, располагаются на основных клетках и тормозных интернейронах. За счет активации никотиновых рецепторов разных типов может осуществляться быстрое влияние АХ, а мускариновые рецепторы участвуют в медленных и более диффузных воздействиях, способствуя усилению активности [24]. Ранее нами были сформулированы правила модулирующего действия АХ на эффективность возбудительной и тормозной синаптической передачи [2]. Согласно этим правилам, воздействие на постсинаптические никотиновые и мускариновые М1/М5 рецепторы способствует индукции ДП возбудительных входов к нейронам, а воздействие на М2-М4 рецепторы – ДД. Знак модификации тормозного входа противоположен по знаку. Поскольку у человека даже на клетке одного типа (например, пирамидной) имеются как М1, так и М2 рецепторы [96], выделение АХ и воздействие на мускариновые рецепторы в коре может приводить к разнонаправленным эффектам. Очевидно, что результирующий эффект должен зависеть от плотности холинорецепторов каждого типа и их сродства с АХ а, следовательно, от концентрации АХ. Мускариновые М1 и М2 рецепторы располагаются и на ГАМКергических интернейронах, причем в различном соотношении в разных сенсорных областях [25]. Поэтому изменение эффективности возбудительного входа должно зависеть от силы торможения. Обзор данных о влиянии АХ на синаптическую пластичность и восприятие звуковой информации за счет активации никотиновых рецепторов приведен в работе [35]. Следует отметить, что на холинергических нейронах БПМ найдены гетеромеры, состоящие из никотиновых α7β2 рецепторов, которые очень чувствительны к бета-амилоидам, подавляющим их функционирование [59]. Поэтому при БА, вследствие уменьшения деполяризации холинергических клеток через никотиновые рецепторы, должно уменьшиться выделение АХ в разных структурах мозга.
В поле А1 никотин действует через α4β2 рецепторы, которые располагаются на нейронах слоев 2–4, где оканчиваются таламические афференты, что приводит к увеличению амплитуды и уменьшению ЛП коротколатентных ответов нейронов коры [44]. На генно-модифицированных мышах с отсутствием М2 и М3 рецепторов показано, что в поле А1 активация М1 рецепторов усиливает активность пирамидных клеток [38]. Если торможение было изначально сильным, активация мускариновых рецепторов способствовала усилению ответа пирамидной клетки, а если первоначально ТПСП отсутствовали, ответ уменьшался [7]. Авторы указанной работы объяснили наблюдавшийся ими эффект растормаживанием, т.е. ослаблением активности интернейрона. На такую возможность указывают и результаты работы [11], в которой АХ оказывал гиперполяризующее действие на пирамидные нейроны в слоях 2/3 слуховой коры через воздействие на тормозные интернейроны.
Холинорецепторы различных типов могут вносить разнонаправленный вклад в обучение. Например, в экспериментах, проведенных авторами работы [58], введение антагониста мускариновых рецепторов скополамина ухудшало обучение, тогда как введение антагониста никотиновых рецепторов мекамиламина его улучшало.
Возможные механизмы влияния ацетилхолина на функционирование стриатума
Ацетилхолин влияет на прохождение сигналов через БГ благодаря тому, что выделяется из терминалей холинергических интернейронов стриатума (на рисунке не представлены с целью упрощения). Согласно предложенному нами ранее механизму функционирования БГ [81], АХ, воздействуя на М4 рецепторы, расположенные на С-Н нейронах, должен способствовать индукции ДД эффективности сильных входов из поля А1 к этим нейронам и ДП слабых входов. Ранее нами было отмечено, что поскольку холинергические интернейроны стриатума отвечают паузой на сенсорные стимулы, ДД на С-Н клетках не индуцируется, что должно способствовать растормаживанию нейронов ВКТв и контрастированию РП нейронов ВКТв и поля А1. В пользу предложенного нами механизма влияния АХ на функционирование БГ через мускариновые рецепторы на нейронах стриатума свидетельствуют результаты работы [16]. Выделение АХ в стриатуме приводит также к активации никотиновых рецепторов на ГАМКергических интернейронах стриатума, увеличению их активности и последующему усилению ингибирования шипиковых клеток [27]. По-видимому, во время паузы в отсутствие воздействия на никотиновые рецепторы на ГАМКергических интернейронах, ингибирование шипиковых клеток должно ослабляться. Вследствие этого должны улучшаться условия для открывания НМДА каналов и индукции ДП на С-Н клетках, что приведет к усилению растормаживания нейронов ВКТв со стороны ЧВр и увеличению активности нейронов поля А1. На нейронах ЧВр, которое реципрокно связано с ППЯ, имеются α7 и другие типы никотиновых рецепторов [73]. Ослабление тормозного действия со стороны ЧВр на активность нейронов ППЯ может привести к увеличению выделения АХ, а последующее усиление воздействия на α7 рецепторы приведет к увеличению активности клеток ЧВр и увеличению торможения нейронов ППЯ. Так что формируется цепь отрицательной обратной связи, ограничивающая чрезмерное возбуждение нейронов этих структур. Показано, что повреждение ППЯ приводит к снижению гиперактивности нейронов ЧВр [17].
Отмечено, что активация никотиновых рецепторов оказывает двунаправленный эффект на активность шипиковых нейронов стриатума, причем эффект зависит от концентрации АХ из-за наличия никотиновых рецепторов с низкой и высокой связываемостью. В результате никотин может как усиливать, так и ослаблять роль подкрепления при обучении [37].
Возможные механизмы участия ацетилхолина в процессах внимания к стимулу
Присутствие АХ способствует поддержанию внимания к стимулу. Так показано, что стимуляция холинергического входа из БЯМ в кору вносит вклад в установление внимания к стимулу и улучшает обучение [58]. Если системное введение антагониста мускариновых рецепторов атропина значительно ухудшало выполнение задач, связанных с переключением внимания между звуковыми и зрительными сигналами, то никотин улучшал выполнение задачи [18] и усиливал ответ на оптимальную частоту звукового стимула, на который направлено внимание [65]. Усиление активности нейронов слуховой коры при произвольном внимании определяется ее возбуждением со стороны ПфК [4]. Поскольку связи между этими областями реципрокны, активность нейронов увеличивается в обеих областях. Действительно, одновременная регистрация активности нейронов в этих областях у бодрствующих мышей показала, что нейроны ПфК реагируют на звуковые стимулы, причем холинергическая иннервация слуховой коры способствовала контрастированию ответов в ПфК за счет модуляции внутрикорковых связей в слуховой коре [45]. Существенный дефицит холинергических клеток в БЯМ при БА коррелирует с дефицитом памяти и внимания [28]. К потере внимания может приводить и уменьшение плотности β2 рецепторов в ВКТ, которое наблюдается у пожилых людей [82]. Этот эффект может быть связан с тем, что в норме холинергическая иннервация ВКТ должна вызывать ВПСП предположительно через никотиновые β2 рецепторы, у которых высокая связываемость с АХ в отличие от β4 рецепторов с низкой связываемостью. Потеря β2 рецепторов может приводить к ослаблению реакций нейронов ВКТ на поступающие сигналы. Полагают, что не только в сенсорных областях, но и в ПфК α4β2 рецепторы играют одну из ключевых ролей, необходимых для детектирования сигнала, который привлекает внимание к УС [72].
Возможные механизмы участиия ацетилхолина в восприятии и запоминании звуковой информации при участии гиппокампа
Прерывание холинергического входа в гиппокамп из МП/ДПБ связывают с различными неврологическими нарушениями, включая БА [63]. При повреждении холинергического входа в вентральную часть гиппокампа, нарушалась память о звуковом стимуле, связанном со страхом [83]. Снижение экспрессии транспортера АХ в синаптических везикулах во всех слоях зубчатой извилины, а также полей СА3 и СА1 гиппокампа, в которых располагается множество синапсов, коррелирует с появлением тиннитуса [102]. Ранее нами был проведен анализ особенностей влияния АХ на функционирование гиппокампа, базирующийся на известных данных о расположении пре- и постсинаптических мускариновых и никотиновых рецепторов на нейронах разных полей гиппокампа, а также на сформулированных нами правилах модуляции эффективности синаптической передачи [5]. Было сделано заключение, что при характерном для БА снижении в гиппокампе концентрации АХ и изменений плотности холинорецепторов могут депрессироваться реакции пирамидных нейронов полей СА3 и СА1 на сигналы из ЭК. Вследствие этого должно затрудняться взаимодействие семантической информации, хранящейся в коре, с информацией об эпизоде, хранящейся в гиппокампе, что может лежать в основе нарушений извлечения информации из памяти. Это заключение может быть применимо и к нарушению воспоминаний о звуковой информации. Следует отметить, что при БА изменения происходят и на входе в гиппокамп из ЭК, поскольку в ЭК накапливается фосфорилированный тау-белок, причем ЭК поражается в первую очередь [70]. При этом в ЭК наблюдается снижение ответов на звуковые стимулы независимо от их связи с обучением [70]. Следствием этого должно являться уменьшение реакций нейронов во всех поля гиппокампа, поскольку они получают возбуждение из ЭК.
При повреждении входа из МП/ДПБ в гиппокамп нарушается синхронизация по фазе между дорзальным гиппокампом и фронтальной корой [77]. Ослабление височно-лобных корково-корковых связей и синхронизации в тета- и альфа ритме является одним из отличительных признаков БА [42]. Поскольку в отсутствие синхронизации не выполняется правило Хебба, должны ухудшаться условия для индукции ДП на возбудительном входе из ПфК в поле А1. Это должно ослабить внимание к стимулу и препятствовать сдвигу РП нейронов в сторону частоты тона, являющегося УС.
Возможные механизмы модулирующего влияния ацетилхолина на активность нейронов таламуса и РП нейронов ВКТв
Поскольку источником выделения АХ в ВКТв являются холинергические клетки ППЯ, их растормаживание со стороны выходных ядер БГ приведет к усилению воздействия на мускариновые М1 и М5 рецепторы на нейронах ВКТ, что будет способствовать ДП их возбуждения. Одновременно должно уменьшиться ингибирование части нейронов ВКТв со стороны ЧВр, так что ответы нейронов на ПЧН должны дополнительно увеличиться, а РП стать более выраженными. При этом увеличатся и ответы тонотопически связанных с ними нейронов поля А1. Такое предположение было сделано и авторами работы, в которой сочетанная электрическая стимуляция ППЯ и тона определенной частоты приводила к значительному сдвигу ПЧН нейронов слуховой коры в сторону частоты сочетанного тона [60]. Этому эффекту препятствовало введение антагониста мускариновых рецепторов атропина в таламус или в кору [60]. Современные данные о влиянии различных нейромодуляторов, включая АХ, на функционирование таламуса представлены в обзоре [90]. Холинергический вход приводит к увеличению деполяризации большинства нейронов таламуса, однако некоторые релейные клетки и интернейроны гиперполяризуются. Примечательно, что в дорзальной и вентральной частях ВКТ количество деполяризующих и гиперполяризующих эффектов не одинаково. В вентральной части, связанной с первичной слуховой областью коры, наблюдались в основном деполяризующие эффекты [90]. Из этих данных следует, что АХ, усиливая активность релейных клеток ВКТв, способствует передаче информации о чистых тонах в поле А1. Кроме того, деполяризуются те клетки парафасцикулярного ядра, которые проецируются в новую кору [13]. В согласии с правилами модуляции показано, что этот эффект был вызван воздействием на никотиновые рецепторы и мускариновые М1/М3 рецепторы [104]. На срезах показано, что АХ влияет на эффективность синаптической передачи и во внутрикорковых, и в таламо-кортикальных синапсах, т.е. модулирует влияния сверху–вниз и снизу–вверх [89]. Поскольку таламо-кортикальная передача усиливается при воздействии на никотиновые рецепторы [47], можно полагать, что на пирамидных нейронах таламуса имеются рецепторы этих типов. Блокада никотиновых рецепторов уменьшала ответ, вызванный звуком, особенно слабым, близким к пороговому для восприятия. Таким образом, за счет активации никотиновых рецепторов эндогенный АХ может понижать порог для восприятия сигнала и усиливать вызванный ответ на звук [47].
РАЗНОНАПРАВЛЕННОЕ ВЛИЯНИЕ АЦЕТИЛХОЛИНА НА ИЗМЕНЕНИЕ РЕАКЦИЙ НЕЙРОНОВ ПЕРВИЧНОЙ СЛУХОВОЙ КОРЫ И ИХ РЕЦЕПТИВНЫХ ПОЛЕЙ ПРИ ОБУЧЕНИИ (ОБЪЯСНЕНИЕ РАЗЛИЧИЙ С ПОМОЩЬЮ ПРЕДЛАГАЕМОГО МЕХАНИЗМА)
С помощью микродиализа показано, что при ассоциативном павловском обучении, в котором УС являлся тон, концентрация АХ в поле А1 последовательно увеличивалась по мере обучения, причем в отсутствие обучения увеличения концентрации АХ не наблюдалось [19]. Искусственное увеличение концентрации АХ с помощью системного введення ингибитора холинестеразы во время обучения улучшало выполнение задачи на восприятие, причем этот эффект был специфичен по отношению к физическим параметрам используемых УС [76]. Таким образом, обучение связано с увеличением концентрации АХ. Отмечено, что сочетанная стимуляции БЯМ и тона приводит к изменениям РП нейронов поля А1, имитирующим изменения, возникающие при классическом обучении [74]. Такие же изменения РП нейронов в поле А1 наблюдались при сочетании УС с пищевым или аверзивным безусловным стимулом [92]. Однако обращает на себя внимание тот факт, что моделирование процесса обучения с помощью сочетания тона со стимуляцией холинергического входа может приводить к разнонаправленным изменениям РП нейронов. Так, в одной группе экспериментов сочетание УС – тона определенной частоты со стимуляцией БЯМ в качестве безусловного стимула приводило к потенциации ответов нейронов в поле А1, причем пик ответов наблюдался для частоты УС [66], ПЧН сдвигалась в сторону этого тона [33] и улучшалось нейронное отображение этого тона в поле А1 [94]. Сочетание тона с микроионофорезом в кору АХ также приводило к значительному снижению порога ответов нейронов коры на тон той частоты, которая использовалась для сочетаний [22, 97]. Этому эффекту препятствовал микроионофорез в кору антагониста мускариновых рецепторов атропина. То, что мускариновые рецепторы участвуют в специфической пластичности РП нейронов слоев 2–4 поля А1, вызванной сочетанной стимуляцией БПМ с тоном определенной частоты, показано и в работ [67]. Авторы работы [22] предположили, что наблюдавшийся ими сдвиг РП нейронов коры был вызван увеличением эффективности входа из ВКТ к пирамидным нейронам коры, обусловленным активацией мускариновых рецепторов. В пользу такого предположения могут служить результаты работы [103], в которой электрическая стимуляция БПМ в сочетании с тоном определенной частоты приводила к сдвигу ПЧН нейронов ВКТв в сторону этой частоты, уменьшению порога ответов на тоны этой частоты и увеличению числа спайков в ответе. Поскольку эти эффекты исчезали при инактивации коры, можно полагать, что кортикофугальные влияния, в свою очередь, вносят существенный вклад в специфические перестройки ответов нейронов в ВКТв [103].
Кроме того, сочетанная стимуляция БЯМ с тоном определенной частоты способствовала сдвигу ПЧН нейронов НДц в сторону сочетанного тона, хотя первоначально их ПЧН была другой [99]. При выработке реакции избегания, когда УС являлся тон, ПЧН нейронов НДц сдвигалась в сторону этого тона [101]. Сдвиг ПЧН нейронов в одном из локусов НДц в результате стимуляции другого локуса НДц зависел от кортикофугальных влияний со стороны слуховой коры, поскольку блокировался при инактивации коры [103]. Сдвиг РП нейронов НД зависел от активации мускариновых рецепторов на этих нейронах, тогда как аппликация их антагониста атропина в НД препятствовала эффекту [100, 101]. Из приведенных данных следует, что под действием АХ меняются РП нейронов в разных структурах лимбического пути, в котором происходит обработка тонов, что изменения происходят уже на ранних стадиях обработки, и что особую роль в этих процессах играют нисходящие влияния. Полагают, что в холинергической модуляции восприятия и памяти участвуют нейроны слоя 5В слуховой коры, которые проецируются в НД, причем деполяризации и стойкому срабатыванию этих кортико-колликулярных нейронов способствует воздействие АХ на мускариновые рецепторы [46].
В экспериментах на крысах, хорошо обученных реакции избегания на подачу УС – тона определенной частоты, показано, что в слое 4 слуховой коры никотин усиливает амплитуду локального потенциала поля и снижает порог ответа на частоту этого УС [55]. Одновременно увеличивался порог и уменьшалась амплитуда ответов на тон другой частоты. У крыс с плохой обучаемостью никотин к таким изменениям не приводил [55]. Таким образом, никотин, способствуя избирательности РП, может играть облегчающую роль в обучении [55]. Системное введение никотина также способствовало усилению ответов нейронов поля А1 с определенной ПЧН F [9, 65]. Одновременно усиливалась таламо-кортикальные входы к нейронам с ПЧН F и ослаблялись ответы на широкополосный шум, причем подавление усиливалось по мере удаления частоты шума от частоты F. Такой же эффект имел место и на уровне таламуса и НД [9]. Так что влияние никотина также может суммироваться по мере восхождения сигналов по слуховому пути.
Однако в другой группе экспериментов активация мускариновых рецепторов способствовала противоположному эффекту – уменьшению ответов на тон, совпадающий с ПЧН, и увеличению ответов на тоны другой частоты. В этих опытах АХ или ацетил-бета метахолин апплицировали близко к локусу регистрации, так что концентрация вещества могла быть большой. При увеличении концентрации эндогенного АХ с помощью блокатора холинестеразы также наблюдали подавление ответа на тон ПЧН и усиление ответов на тоны другой частоты [8]. С учетом предлагаемого механизма такой характер модулирующего влияния АХ на сдвиг РП можно объяснить потенциирующим влиянием АХ на возбуждение тормозных интернейронов через М1 рецепторы и преобладающим действием сильного торможения над потенцирующим действием активации М1 рецепторов на пирамидных клетках поля А1. Мы полагаем, что в этих экспериментах концентрациях АХ была высока и позволила активировать М1 рецепторы, чувствительность которых меньше, чем у М2 рецепторов. На лучшую связываемость с карбахолом М2 рецепторов по сравнению с М1/М5 рецепторами могут косвенно указывать данные о том, что для деполяризации интернейронов поля СА1 через мускариновые М1 рецепторы требовалось сильное возбуждение холинергических клеток [14]. При низкой концентрации АХ гиперполяризация интернейронов поля СА1 наблюдалась чаще, чем деполяризация [64], по-видимому, из-за активации только М2 рецепторов и невозможности вовлечения М1 рецепторов. Вероятно, тормозное действие преобладало и в тех экспериментах, в которых после одного месяца сочетанной стимуляции БЯМ с тонами 2 кГц или 14 кГц уменьшалось возбуждение нейронов поля А1 в ответах на эти тоны [71].
Обнаружено, что у мышей с отсутствием никотиновых β2 рецепторов или в условиях блокады β2 рецепторов нейроны коры чаще находились в деполяризованном состоянии, а их ответы были больше по амплитуде [80]. Поскольку такое действие никотина было связано с изменением передачи через ГАМКб рецепторы [80], с учетом правил модуляции можно полагать, что в норме в активности пирамидной клетки преобладает усиление торможения вследствие индукции ДП на возбудительных входах к тормозному интернейрону за счет вовлечения β2 рецепторов. Обнаружено, что в регулировании состояний нейрона участвуют не только β2 рецепторы, характеризующиеся высокой связываемостью, но и характеризующиеся слабой связываемостью α7 рецепторы. При воздействии АХ на никотиновые α7 рецепторы менялись деполяризованные верхние состояния пирамидных клеток [80]. Аналогичные эффекты наблюдались и в ПфК [72]. Если при большой концентрации АХ имеет место не только увеличение активности пирамидных клеток за счет воздействия на М1 рецепторы, но и усиление афферентного торможения за счет активации никотиновых рецепторов и М1 рецепторов на тормозных интернейронах, то результирующий эффект должен зависеть от эффективности торможения. Это может лежать в основе наблюдавшегося в ряде случаев уменьшения ответов нейрона на ПЧН в присутствии АХ.
По-видимому, при системном использовании агонистов или антагонистов холинорецепторов результирующий эффект в значительной степени определяется их непосредственным влиянием на активность возбудительных и тормозных нейронов коры, но при этом характер влияния зависит от соотношения параметров возбуждения и торможения. Например, из предлагаемого механизма следует, что использование антагонистов мускариновых рецепторов может приводить к ослаблению торможения нейронов таламуса со стороны БГ и последующему увеличению возбуждения нейронов поля А1 в ответ на тон. Однако, в некоторых опытах антагонист мускариновых рецепторов скополамин приводил к уменьшению ответов нейронов слуховой коры на тон [23] и ухудшению обучения [58]. Но в некоторых случаях это полезно, так как уменьшение активности нейронов поля А1 может препятствовать появлению тиннитуса, для которого характерно гипервозбуждение нейронов коры. Из предложенного механизма следует, что хотя дефицит АХ при БА ухудшает слуховое восприятие, системное использование агонистов мускариновых рецепторов для ослабления этого симптома нежелательно, поскольку оно может вызвать тиннитус, а также привести к двигательным нарушениям.
Следует отметить, что предлагаемый механизм функционирования лемнискового слухового пути не учитывает влияния недавно обнаруженного ГАМКергического входа из коры в стриатум; участия ГАМКергических интернейронов в функционировании стриатума; наличие входов из ППЯ в разные ядра БГ, а также ГАМКергических и глутаматергических входов из БПМ в кору и из ППЯ в таламус. Очевидно, что эти факторы должны привести к еще более сложному характеру влияния АХ на обработку тонов и формирование РП нейронов в поле А1 и ВКТ.
ВЫВОДЫ
1. Из проведенного анализа влияния АХ на обработку информации о чистых тонах в лемнисковом слуховом пути следует, что многокомпонентный характер этого влияния определяется следующими факторами:
а) наличием в коре, гиппокампальной формации и подкорковых структурах холинорецепторов разных типов, располагающихся и на пирамидных клетках, и на интернейронах, участвующих в цепях афферентного торможения и растормаживания;
б) зависимостью результирующего эффекта от концентрации АХ, вследствие различной связываемости холинорецепторов с АХ;
в) наличием реципрокных связей между нейронами холинергических структур и структур, участвующих в обработке звуков, так что выделение АХ регулируется не только сенсорным стимулом, но и нисходящими влияниями со стороны коры и таламических ядер;
г) существенным вкладом в формирование РП нейронов поля А1 и ВКТ воздействия АХ на функционирование БГ и гиппокампальной формации.
2. На основании сопоставления известных из литературы данных и следствий предлагаемого механизма влияния АХ на обработку тонов сделано заключение, что при системном использовании агонистов или антагонистов холинорецепторов результирующий эффект в значительной степени зависит от модулирующего влияния АХ непосредственно на активность возбудительных и тормозных нейронов коры и, следовательно, от силы торможения.
3. Предлагаемый механизм позволяет предположить, что многокомпонентный характер влияния АХ на нейроны всех структур, участвующих в обработке тонов, и разная концентрация АХ могут лежать в основе известных данных о разнонаправленном влиянии АХ на изменения реакций нейронов поля А1 и их РП при обучении.
4. Поскольку дисфункция слуховой системы возникает уже на ранней стадии болезни Альцгеймера, характеризующейся дефицитом холинергической передачи, понимание механизмов влияния АХ на функционирование этой системы представляет интерес, так как может способствовать поиску возможностей для улучшения обработки звуков.
Работа выполнена при поддержке Российского научного фонда, грант № 16-15-10403n.
Список литературы
Горбачевская А.И., Чивилёва О.Г. Организация эфферентных проекций ножкомостового ядра покрышки среднего мозга на паллидум собаки // Морфология. 2005. № 2. С. 19–23.
Силькис И.Г. Унифицированный постсинаптический механизм влияния различных нейромодуляторов на модификацию возбудительных и тормозных входов к нейронам гиппокампа (Гипотеза) // Успехи физиол. наук. 2002. Т. 33. № 1. С. 40–56.
Силькис И.Г. О роли базальных ганглиев в формировании рецептивных полей нейронов первичной слуховой коры и механизмы их пластичности // Успехи физиол. наук. 2015. Т. 46. № 3. С. 60–75.
Силькис И.Г. О роли базальных ганглиев в обработке сложных звуковых стимулов и слуховом внимании // Успехи физиол. наук. 2015. Т. 46. № 3. С. 76–92.
Силькис И.Г., Маркевич В.А. Возможные механизмы влияния различных концентраций ацетилхолина на функционирование гиппокампа // Успехи физиол. наук. 2016. Т. 47. № 4. С. 57–76.
Aggleton J.P., Wright N.F., Vann S.D., Saunders R.C. Medial temporal lobe projections to the retrosplenial cortex of the macaque monkey // Hippocampus. 2012. V. 22. № 9. P. 1883–1900.
Aramakis V.B., Bandrowski A.E., Ashe J.H. Muscarinic reduction of GABAergic synaptic potentials results in disinhibition of the AMPA/kainate-mediated EPSP in auditory cortex // Brain Res. 1997. V. 758. № 1–2. P. 107–117.
Ashe J.H., McKenna T.M., Weinberger N.M. Cholinergic modulation of frequency receptive fields in auditory cortex: II. Frequency-specific effects of anticholinesterases provide evidence for a modulatory action of endogenous ACh // Synapse. 1989. V. 4. № 1. P. 44–54.
Askew C., Intskirveli I., Metherate R. Systemic nicotine increases gain and narrows receptive fields in A1 via integrated cortical and subcortical actions // eNeuro. 2017. V. 4. № 3. eCollection
Bálint E., Mezey S., Csillag A. Efferent connections of nucleus accumbens subdivisions of the domestic chicken (Gallus domesticus): an anterograde pathway tracing study // J. Comp. Neurol. 2011. V. 519. № 15. P. 2922–2953.
Bandrowski A.E., Moore S.L., Ashe J.H. Cholinergic synaptic potentials in the supragranular layers of auditory cortex // Synapse. 2001. V. 41. № 2. P. 118–130.
Barense M.D., Henson R.N., Lee A.C., Graham K.S. Medial temporal lobe activity during complex discrimination of faces, objects, and scenes: Effects of viewpoint // Hippocampus. 2010. V. 20. № 3. P. 389–401.
Beatty J.A., Sylwestrak E.L., Cox C.L. Two distinct populations of projection neurons in the rat lateral parafascicular thalamic nucleus and their cholinergic responsiveness // Neuroscience. 2009. V. 162. № 1. P. 155–173.
Bell L.A., Bell K.A., McQuiston A.R. Synaptic muscarinic response types in hippocampal CA1 interneurons depend on different levels of presynaptic activity and different muscarinic receptor subtypes // Neuropharmacol. 2013. V. 73. P. 160–173.
Bloem B., Schoppink L., Rotaru D.C. et al. Topographic mapping between basal forebrain cholinergic neurons and the medial prefrontal cortex in mice // J. Neurosci. 2014. V. 34. № 49. P. 16 234–16 246.
Bordia T., Perez X.A. Cholinergic control of striatal neurons to modulate L-dopa-induced dyskinesias // Eur. J. Neurosci. 2019. V. 49. № 6. P. 859–868.
Breit S., Lessmann L., Unterbrink D. et al. Lesion of the pedunculopontine nucleus reverses hyperactivity of the subthalamic nucleus and substantia nigra pars reticulata in a 6-hydroxydopamine rat model // Eur. J. Neurosci. 2006. V. 24. № 8. P. 2275–2282.
Brown D.C., Nichols J.A., Thomas F. et al. Nicotinic modulation of auditory attentional shift in the rat // Behav Brain Res. 2010. V. 210. № 2. P. 273–279.
Butt A.E., Chavez C.M., Flesher M.M. et al. Association learning-dependent increases in acetylcholine release in the rat auditory cortex during auditory classical conditioning // Neurobiol. Learn. Mem. 2009. V. 92. № 3. P. 400–409.
Chavez C., Zaborszky L. Basal forebrain cholinergic-auditory cortical network: Primary versus nonprimary auditory cortical areas // Cereb. Cortex. 2017. V. 27. № 3. P. 2335–2347.
Chaves-Coira I., Barros-Zulaica N., Rodrigo-Angulo M., Núñez Á. Modulation of specific sensory cortical areas by segregated basal forebrain cholinergic neurons demonstrated by neuronal tracing and optogenetic stimulation in mice // Front. Neural Circuits. 2016. V. 10. Article 28.
Chen G., Yan J. Cholinergic modulation incorporated with a tone presentation induces frequency-specific threshold decreases in the auditory cortex of the mouse // Eur. J. Neurosci. 2007. V. 25. № 6. P. 1793–1803.
Deng A., Liang X., Sun Y. et al. Scopolamine attenuates auditory cortex response // Acta Otolaryngol. 2015. V. 135. № 11. P. 1132–1137.
Dasgupta R., Seibt F., Beierlein M. Synaptic release of acetylcholine rapidly suppresses cortical activity by recruiting muscarinic receptors in layer 4 // J. Neurosci. 2018. V. 25. № 38. № 23. P. 5338–5350.
Disney A.A., Domakonda K.V., Aoki C. Differential expression of muscarinic acetylcholine receptors across excitatory and inhibitory cells in visual cortical areas V1 and V2 of the macaque monkey // J. Comp. Neurol. 2006. V. 499. № 1. P. 49–63.
Eid L., Parent A., Parent M. Asynaptic feature and heterogeneous distribution of the cholinergic innervation of the globus pallidus in primates // Brain Struct. Funct. 2016. V. 221. № 2. P. 1139–1155.
Faust T.W., Assous M., Tepper J.M., Koós T. Neostriatal GABAergic interneurons mediate cholinergic inhibition of spiny projection neurons // J. Neurosci. 2016. V. 36. № 36. P. 9505–9511.
Ferreira-Vieira T.H., Guimaraes I.M., Silva F.R., Ribeiro F.M. Alzheimer’s disease: Targeting the cholinergic system // Curr. Neuropharmacol. 2016. V. 14. № 1. P. 101–115.
French S.J., Totterdell S. Hippocampal and prefrontal cortical inputs monosynaptically converge with individual projection neurons of the nucleus accumbens // J. Comp. Neurol. 2002. V. 446. № 2. P. 151–165.
Fritz J.B., Malloy M., Mishkin M., Saunders R.C. Monkey׳s short-term auditory memory nearly abolished by combined removal of the rostral superior temporal gyrus and rhinal cortices // Brain Res. 2016. V. 1640. Pt. B. P. 289–298.
Fritz H.J., Ray N., Dyrba M. et al. The corticotopic organization of the human basal forebrain as revealed by regionally selective functional connectivity profiles // Hum. Brain Mapp. 2018. V. 40. № 3. P. 868–878.
Froemke R.C., Carcea I., Barker A.J. et al. Long-term modification of cortical synapses improves sensory perception // Nat. Neurosci. 2013. V. 16. № 1. P. 79–88.
Froemke R.C., Merzenich M.M., Schreiner C.E. A synaptic memory trace for cortical receptive field plasticity // Nature. 2007. V. 450. № 7168. P. 425–429.
Gaykema R.P., van Weeghel R., Hersh L.B., Luiten P.G. Prefrontal cortical projections to the cholinergic neurons in the basal forebrain // J. Comp. Neurol. 1991. V. 303. № 4. P. 563–583.
Gil S.M., Metherate R. Enhanced sensory-cognitive processing by activation of nicotinic acetylcholine receptors // Nicotine Tob. Res. 2019. V. 21. № 3. P. 377–382.
Goble T.J., Møller A.R., Thompson L.T. Acute high-intensity sound exposure alters responses of place cells in hippocampus // Hear Res. 2009. V. 253. № 1–2. P. 52–59.
Grasing K. A threshold model for opposing actions of acetylcholine on reward behavior: Molecular mechanisms and implications for treatment of substance abuse disorders // Behav. Brain Res. 2016. V. 312. P. 148–162.
Gulledge A.T., Bucci D.J., Zhang S.S. et al. M1 receptors mediate cholinergic modulation of excitability in neocortical pyramidal neurons // J. Neurosci. 2009. V. 29. № 31. P. 9888–9902.
Haley G.E., Kroenke C., Schwartz D. et al. Hippocampal M1 receptor function associated with spatial learning and memory in aged female rhesus macaques // Age (Dordr.). 2011. V. 33. № 3. P. 309–320.
Hangya B., Ranade S.P., Lorenc M., Kepecs A. Central cholinergic neurons are rapidly recruited by reinforcement feedback // Cell. 2015. V. 162. № 5. P. 1155–1168.
Hazama M., Kimura A., Donishi T. et al. Topography of corticothalamic projections from the auditory cortex of the rat // Neuroscience. 2004. V. 124. № 3. P. 655–667.
Hsiao F.J., Chen W.T., Wang P.N. et al. Temporo-frontal functional connectivity during auditory change detection is altered in Alzheimer’s disease // Hum. Brain Mapp. 2014. V. 35. № 11. P. 5565–5577.
Inglis F.M., Fibiger H.C. Increases in hippocampal and frontal cortical acetylcholine release associated with presentation of sensory stimuli // Neuroscience. 1995. V. 66. № 1. P. 81–86.
Intskirveli I., Metherate R. Nicotinic neuromodulation in auditory cortex requires MAPK activation in thalamocortical and intracortical circuits // J. Neurophysiol. 2012. V. 107. № 10. P. 2782–2793.
James N.M., Gritton H.J., Kopell N. et al. Muscarinic receptors regulate auditory and prefrontal cortical communication during auditory processing // Neuropharmacology. 2019. V. 144. P. 155–171.
Joshi A., Kalappa B.I., Anderson C.T., Tzounopoulos T. Cell-specific cholinergic modulation of excitability of layer 5b principal neurons in mouse auditory cortex // J. Neurosci. 2016. V. 36. № 32. P. 8487–8499.
Kawai H., Lazar R., Metherate R. Nicotinic control of axon excitability regulates thalamocortical transmission // Nat. Neurosci. 2007. V. 10. № 9. P. 1168–1175.
Kolmac C., Mitrofanis J. Organization of the basal forebrain projection to the thalamus in rats // Neurosci. Lett. 1999. V. 272. № 3. P. 151–154.
Kondo H., Witter M.P. Topographic organization of orbitofrontal projections to the parahippocampal region in rats // J. Comp. Neurol. 2014. V. 522. № 4. P. 772–793.
Kondo H., Zaborszky L. Topographic organization of the basal forebrain projections to the perirhinal, postrhinal, and entorhinal cortex in rats // J. Comp. Neurol. 2016. V. 524. № 12. P. 2503–2515.
Kumar S., Joseph S., Gander P.E. et al. A Brain system for auditory working memory // J. Neurosci. 2016. V. 36. № 16. P. 4492–4505.
Kumaran D., Maguire E.A. Novelty signals: a window into hippocampal information processing // Trends Cogn. Sci. 2009. V. 13. № 2. P. 47–54.
Letzkus J.J., Wolff S.B., Meyer E.M. et al. A disinhibitory microcircuit for associative fear learning in the auditory cortex // Nature. 2011. V. 480. № 7377. P. 331–335.
Levin E.D., Hall B.J., Rezvani A.H. Heterogeneity across brain regions and neurotransmitter interactions with nicotinic effects on memory function // Curr. Top Behav. Neurosci. 2015. V. 23. P. 87–101.
Liang K., Poytress B.S., Weinberger N.M., Metherate R. Nicotinic modulation of tone-evoked responses in auditory cortex reflects the strength of prior auditory learning // Neurobiol. Learn. Mem. 2008. V. 90. № 1. P. 138–146.
Lin S.C., Brown R.E., Hussain Shuler M.G. et al. Optogenetic dissection of the basal forebrain neuromodulatory control of cortical activation, plasticity, and cognition // J. Neurosci. 2015. V. 35. № 41. P. 13 896–13 903.
Linke A.C., Cusack R. Flexible information coding in human auditory cortex during perception, imagery, and STM of complex sounds // J. Cogn. Neurosci. 2015. V. 27. № 7. P. 1322–1333.
Liu R., Crawford J., Callahan P.M. et al. Intermittent stimulation in the nucleus basalis of Meynert improves sustained attention in rhesus monkeys // Neuropharmacology. 2018. V. 137. P. 202–210.
Liu Q., Huang Y., Xue F. et al. A novel nicotinic acetylcholine receptor subtype in basal forebrain cholinergic neurons with high sensitivity to amyloid peptides // J. Neurosci. 2009. V. 29. № 4. P. 918–929.
Luo F., Yan J. Sound-specific plasticity in the primary auditory cortex as induced by the cholinergic pedunculopontine tegmental nucleus // Eur. J. Neurosci. 2013. V. 37. № 3. P. 393–399.
Martin P.D., Ono T. Effects of reward anticipation, reward presentation, and spatial parameters on the firing of single neurons recorded in the subiculum and nucleus accumbens of freely moving rats // Behav. Brain Res. 2000. V. 116. № 1. P. 23–38.
McKenna J.T., Vertes R.P. Afferent projections to nucleus reuniens of the thalamus // J. Comp. Neurol. 2004. V. 480. № 2. P. 115–142.
Mergenthal A.R., Bouteiller J.C., Berger T.W. Cholinergic modulation of CA1 pyramidal cells via M1 muscarinic receptor activation: a computational study at physiological and supraphysiological levels // Conf. Proc. IEEE Eng. Med. Biol Soc. 2018. V. 2018. P. 1396–1399.
McQuiston A.R. Acetylcholine release and inhibitory interneuron activity in hippocampal CA1 // Front. Synaptic Neurosci. 2014. V. 6. Article 20.
Metherate R., Intskirveli I., Kawai H.D. Nicotinic filtering of sensory processing in auditory cortex // Front. Behav. Neurosci. 2012. V. 6. Article 44.
Miasnikov A.A., Chen J.C., Weinberger N.M. Rapid induction of specific associative behavioral memory by stimulation of the nucleus basalis in the rat // Neurobiol. Learn. Mem. 2006. V. 86. № 1. P. 47–65.
Miasnikov A.A., McLin D. 3rd, Weinberger N.M. Muscarinic dependence of nucleus basalis induced conditioned receptive field plasticity // Neuroreport. 2001. V. 12. № 7. P. 1537–1542.
Moehle M.S., Pancani T., Byun N. et al. Cholinergic projections to the substantia nigra pars reticulata inhibit dopamine modulation of basal ganglia through the M4 muscarinic receptor // Neuron. 2017. V. 96. № 6. P. 1358–1372.
Munoz-Lopez M.M., Mohedano-Moriano A., Insausti R. Anatomical pathways for auditory memory in primates // Front. Neuroanat. 2010. V. 4. Article 129.
Nouriziabari B., Sarkar S., Tanninen S.E. et al. Aberrant cortical event-related potentials during associative learning in rat models for presymptomatic stages of Alzheimer’s disease // J. Alzheimers Dis. 2018. V. 63. № 2. P. 725–740.
Pandya P.K., Moucha R., Engineer N.D. et al. Asynchronous inputs alter excitability, spike timing, and topography in primary auditory cortex // Hear. Res. 2005. V. 203. № 1–2. P. 10–20.
Parikh V., Ji J., Decker M.W., Sarter M. Prefrontal beta2 subunit-containing and alpha7 nicotinic acetylcholine receptors differentially control glutamatergic and cholinergic signaling // J. Neurosci. 2010. V. 30. № 9. P. 3518–3530.
Poisik O.V., Shen J.X., Jones S., Yakel J.L. Functional alpha7-containing nicotinic acetylcholine receptors localize to cell bodies and proximal dendrites in the rat substantia nigra pars reticulata // J. Physiol. 2008. V. 586. № 5. P. 1365–1378.
Puckett A.C., Pandya P.K., Moucha R. et al. Plasticity in the rat posterior auditory field following nucleus basalis stimulation // J. Neurophysiol. 2007. V. 98. № 1. P. 253–265.
Rasmusson D.D., Smith S.A., Semba K. Inactivation of prefrontal cortex abolishes cortical acetylcholine release evoked by sensory or sensory pathway stimulation in the rat // Neuroscience. 2007. V. 149. № 1. P. 232–241.
Rokem A., Silver M.A. The benefits of cholinergic enhancement during perceptual learning are long-lasting // Front. Comput. Neurosci. 2013. V. 7. Article 66.
Sanchez-Alavez M., Robledo P., Wills D.N. et al. Cholinergic modulation of event-related oscillations (ERO) // Brain Res. 2014. V. 1559. P. 11–25.
Schofield B.R. Projections from auditory cortex to midbrain cholinergic neurons that project to the inferior colliculus // Neuroscience. 2010. V. 166. P. 231–240.
Shahmiri E., Jafari Z., Noroozian M. et al. Effect of mild cognitive impairment and Alzheimer disease on auditory steady-state responses // Basic Clin. Neurosci. 2017. V. 8. № 4. P. 299–306.
Sigalas C., Rigas P., Tsakanikas P., Skaliora I. High-affinity nicotinic receptors modulate spontaneous cortical up states in vitro // J. Neurosci. 2015. V. 35. № 32. P. 11196–11208.
Silkis I. The cortico-basal ganglia-thalamocortical circuit with synaptic plasticity. II. Mechanism of synergistic modulation of thalamic activity via the direct and indirect pathways through the basal ganglia // Biosystems. 2001. V. 59. № 1. P. 7–14.
Sottile S.Y., Ling L., Cox B.C., Caspary D.M. Impact of ageing on postsynaptic neuronal nicotinic neurotransmission in auditory thalamus // J. Physiol. 2017. V. 595. № 15. P. 5375–5385.
Staib J.M., Della Valle R., Knox D.K. Disruption of medial septum and diagonal bands of Broca cholinergic projections to the ventral hippocampus disrupt auditory fear memory // Neurobiol. Learn. Mem. 2018. V. 152. P. 71–79.
Suga N. Tuning shifts of the auditory system by corticocortical and corticofugal projections and conditioning // Neurosci. Biobehav. Rev. 2012. V. 36. № 2. P. 969–988.
Swords G.M., Nguyen L.T., Mudar R.A., Llano D.A. Auditory system dysfunction in Alzheimer disease and its prodromal states: A review // Ageing Res. Rev. 2018. V. 44. P. 49–59.
Thiel C.M. Pharmacological modulation of learning-induced plasticity in human auditory cortex // Restor. Neurol. Neurosci. 2007. V. 25. № 3–4. P. 435–443.
Thomson R.S., Auduong P., Miller A.T., Gurgel R.K. Hearing loss as a risk factor for dementia: A systematic review // Laryngoscope Investig. Otolaryngol. 2017. V. 2. № 2. P. 69–79.
Tuwaig M., Savard M., Jutras B. et al. Deficit in central auditory processing as a biomarker of pre-clinical Alzheimer’s disease // J. Alzheimers Dis. 2017. V. 60. № 4. P. 1589–1600.
Varela C. The gating of neocortical information by modulators // J. Neurophysiol. 2013. V. 109. № 5. P. 1229–1232.
Varela C. Thalamic neuromodulation and its implications for executive networks // Front. Neural Circuits. 2014. V. 8. Article 69.
Vitale F., Capozzo A., Mazzone P., Scarnati E. Neurophysiology of the pedunculopontine tegmental nucleus // Neurobiol. Dis. 2019. V. 128. P. 19–30.
Weinberger N.M. The nucleus basalis and memory codes: Auditory cortical plasticity and the induction of specific, associative behavioral memory // Neurobiol. Learn. Mem. 2003. V. 80. № 3. P. 268–284.
Weinberger N.M. Associative representational plasticity in the auditory cortex: A synthesis of two disciplines // Learn. Mem. 2007. V. 14. № 1–2. P. 1–16.
Weinberger N.M. New perspectives on the auditory cortex: Learning and memory // Handb. Clin. Neurol. 2015. V. 129. P. 117–147.
Winkowski D.E., Nagode D.A., Donaldson K.J. et al. Orbitofrontal cortex neurons respond to sound and activate primary auditory cortex neurons // Cereb. Cortex. 2018. V. 28. № 3. P. 868–879.
Wevers A. Localisation of pre- and postsynaptic cholinergic markers in the human brain // Behav. Brain Res. 2011. V. 221. № 2. P. 341–355.
Yan J., Zhang Y. Sound-guided shaping of the receptive field in the mouse auditory cortex by basal forebrain activation // Eur. J. Neurosci. 2005. V. 21. № 2. P. 563–376.
Zaborszky L., Csordas A., Mosca K. et al. Neurons in the basal forebrain project to the cortex in a complex topographic organization that reflects corticocortical connectivity patterns: an experimental study based on retrograde tracing and 3D reconstruction // Cereb. Cortex. 2015. V. 25. № 1. P. 118–137.
Zhang Y., Hakes J.J., Bonfield S.P., Yan J. Corticofugal feedback for auditory midbrain plasticity elicited by tones and electrical stimulation of basal forebrain in mice // Eur. J. Neurosci. 2005. V. 22. № 4. P. 871–879.
Zhang Y., Suga N. Modulation of responses and frequency tuning of thalamic and collicular neurons by cortical activation in mustached bats // J. Neurophysiol. 2000. V. 84. № 1. P. 325–333.
Zhang Y., Suga N. Corticofugal feedback for collicular plasticity evoked by electric stimulation of the inferior colliculus // J. Neurophysiol. 2005. V. 94. № 4. P. 2676–2682.
Zhang L., Wu C., Martel D.T. et al. Remodeling of cholinergic input to the hippocampus after noise exposure and tinnitus induction in Guinea pigs // Hippocampus. 2019. V. 29. № 8. P. 669–682.
Zhang Y., Yan J. Corticothalamic feedback for sound-specific plasticity of auditory thalamic neurons elicited by tones paired with basal forebrain stimulation // Cereb. Cortex. 2008. V. 18. № 7. P. 1521–1528.
Zhu J., Heggelund P. Muscarinic regulation of dendritic and axonal outputs of rat thalamic interneurons: a new cellular mechanism for uncoupling distal dendrites // J. Neurosci. 2001. V. 21. № 4. P. 1148–59.
Zmarowski A., Sarter M., Bruno J.P. Glutamate receptors in nucleus accumbens mediate regionally selective increases in cortical acetylcholine release // Synapse. 2007. V. 61. № 3. P. 115–23.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


