Успехи физиологических наук, 2020, T. 51, № 1, стр. 87-102
Реактивация и реконсолидация памяти в оборонительном и пищевом инструментальном поведении
М. И. Зайченко a, В. А. Маркевич a, Г. А. Григорьян a, *
a Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии Российской академии наук
Москва, Россия
* E-mail: grigorygrigoryan@hotmail.com
Поступила в редакцию 08.08.2019
После доработки 10.09.2019
Принята к публикации 01.10.2019
Аннотация
Обнаружение феномена лабилизации и реконсолидации памяти открыло широкие возможности для вмешательства в хорошо упроченную память о сильно травмирующих негативных событиях прошлого с целью ее ослабления или даже “стирания”. Для проявления реконсолидации существуют определенные “пограничные условия”, без соблюдения которых она не вызывается. Это интервалы времени, в течение которых осуществляется дестабилизация памяти, сила и давность памяти, условия реактивации и т.д. Дестабилизация и реконсолидация памяти легко вызывается при быстром обучении, с одним сочетанием условного и безусловного раздражителей, основанным, как правило, на аверсивных событиях. В инструментальных двигательных рефлексах, требующих для выработки большого числа сочетаний, реконсолидацию памяти вызвать очень трудно. Это, на наш взгляд, происходит из-за сложности реактивации, проблем “улавливания” сути и момента решения инструментальной задачи и быстрой после этого стабилизации рефлекса. В настоящей работе приводятся литературные и собственные данные о характере дестабилизации и особенностях реконсолидации инструментальных условных рефлексов. Впервые в литературе приводятся данные об особенностях реконсолидации оборонительного инструментального поведения и зависимость реконсолидации памяти в пищевом инструментальном поведении от условий ее реактивации.
Память является уникальным творением природы. Она является фундаментальной основой обучения животных и человека, без нее невозможно адаптироваться в сложном и быстро изменяющемся мире. В наши дни из-за увеличения продолжительности жизни человека обозначился существенный рост нейродегенеративных заболеваний, ведущих к серьезным расстройствам памяти и других когнитивных функций. Это, прежде всего, болезнь Альцгеймера, требующая дорогостоящего лечения, которое, к сожалению, остается пока малоэффективным. Не менее важным является терапия тяжелых эмоциональных потрясений человека, вызванных травмами личной жизни (особенно в раннем детстве), известных еще как синдром посттравматического стресса. Память о сильно пережитом негативном событии продолжает вызывать у субъекта страх и переживания, которые мешают нормально жить и работать. В этом плане существенной задачей для исследователей является изучение механизмов и путей “стирания” негативной памяти для восстановления нормальной личной и социальной жизни человека.
Долгое время считалось, что формирование памяти проходит две стадии. Вначале фазу краткосрочной памяти (до нескольких часов), которая является лабильной и подвержена разным естественным и искусственным воздействиям. Такими воздействиями могут быть охлаждения, гипоксия, мозговая травма, электрошок, новое обучение, блокада белкового синтеза, нарушение экспрессии и функции специфических белков и т.д. Затем наступает фаза долгосрочной памяти (через 24 ч и более), во время которой память стабилизируется и не меняется при воздействиях на нее [24, 51]. Однако подобная точка зрения в последние годы подверглась существенным сомнениям. Начало этим сомнениям положили работы лаборатории Льюиса [46, 47], которые показали, что консолидированная память может снова принимать лабильную форму, если спустя некоторое время после ее формирования и стабилизации применить условный раздражитель. Этот факт впоследствии получил название “реконсолидация” памяти [24, 59, 60]. Изолированное применение условного раздражителя на фоне хорошо консолидированной памяти является, по сути, реактивацией или извлечением следов сохраненной памяти, а сам условный раздражитель напоминанием (reminder). В качестве напоминания могут быть использованы также контекст окружающей среды (обстановка) и безусловный раздражитель. Напоминание с помощью сигнального раздражителя более эффективно при использовании небольших интервалов между обучением и тестированием сохранности навыка, тогда как контекст оказывается более эффективным при больших интервалах до начала тестирования [33]. Важную роль играет также срок давности памяти. Например, в модели пассивного избегания (inhibitory avoidance) память 2-х и 7-и дневной давности с момента формирования легче подвергается дестабилизации и повторной реконсолидации, чем 2-х недельная и одномесячная память [54]. Для проявления феномена реконсолидации важную роль играет лабильная фаза в период реактивации памяти, которую иначе называют еще временным окном реконсолидации. Границы этого окна определяются так называемыми “пограничными условиями” (boundary conditions), вне которых память реконсолидировать не удается. Важное место среди этих условий занимают степень обучения, условия реактивации, срок давности памяти с момента формирования памяти и др. [84]. Чем раньше была сформирована память, тем слабее она подвергается дестабилизации и реконсолидации. В случае реактивации условный раздражитель или контекст могут приводить к двум разным состояниям памяти в зависимости от количества неподкрепляемых применений. Либо к процессу реконсолидации при одном-двух применениях условного раздражителя, либо к угашению обученного навыка при множестве их применений (4 и более раза) [63, 69, 84]. М. Монфил и соавт. [59], показали, что если до начала угашения давать всего одну пробу без подкрепления (дестабилизация памяти), то память о страхе быстро нивелируется, в отличие от процедуры чистого угашения. Помимо угашения существуют и другие способы, влияющие на состояние памяти во время реконсолидации, и не только ослабляющие, но и усиливающие, оригинальную память. Например, Дж. Хобрич и соавт. [34] показали, что если в процессе реактивации аверсивной памяти применять эмоциональные позитивные стимулы, то реконсолидация способствует сохранению памяти страха с меньшим уровнем аверсии благодаря инкорпорации в нее позитивной информации. Аналогичные данные были получены R. Феррер Монти и соавт. [28], которые показали, что потребление раствора сахарозы в стадии реактивации условно-рефлекторной реакции страха, приводит к ослаблению страха в результате реконсолидации памяти. Это ослабление реализуется через GluN2B-содержащие NMDA рецепторы в базолатеральной миндалине, поскольку блокада этих рецепторов снимает облегчающий эффект приема сахарозы. Даже простое применение нейтрального нового раздражителя во время дестабилизации позитивной памяти облегчает процесс ее реконсолидации [86]. То же вызывается инкорпорацией независимого обучения в Т-образном лабиринте на процесс реконсолидации новой пространственной памяти совершенно в другой ситуации [74].
РЕКОНСОЛИДАЦИЯ ПАМЯТИ В ОБОРОНИТЕЛЬНОМ ПОВЕДЕНИИ
В подавляющем большинстве работ реконсолидацию памяти и влияние на нее различных воздействий в фазу реактивации (дестабилизации) исследуют на модели условно-рефлекторной реакции страха (fear conditioning), в которой применяется всего одно сочетание условного (звуковой сигнал) и безусловного (электрокожное раздражение) раздражителей. Через 24 ч вызывают дестабилизацию памяти процедурой напоминания, когда животному предъявляют либо изолированный условный раздражитель, либо помещают в ту же обстановку, где оно ранее получало болевое электрокожное раздражение, либо дают и то и другое одновременно. На следующий день тестируют сохранность навыка (retention test) для оценки влияния на условно-рефлекторную реакцию страха эффектов напоминания и влияния амнестических агентов. Показано, что при достижении пика обучения, при котором стабилизация навыка достигает максимальных значений, реконсолидация памяти оказывается малоэффективной, а амнестические воздействия в этот период не действуют или действуют очень слабо. Известно, что в реализации условно-рефлекторной реакции страха активную роль играет норадренергическая система мозга [50, 62, 81, 82]. Она благоприятствует консолидации памяти, во время которой краткосрочная лабильная память переходит в стабильную долгосрочную. Увеличение норадренергической активности во время травмы усиливает память о травматическом событии (Pitman, 1989), а блокада ее с помощью антагонистов бета-адренорецепторов сразу после травмы уменьшает риск развития посттравматического синдрома [68]. Клинические наблюдения показывают, что симптомы посттравматического стресса, связанные с активностью норадренергической системы, сохраняются длительное время после травмы [48, 83, 61 ]. Ключевой структурой в реализации условно-рефлекторной реакции страха является латеральное ядро миндалины. В нем происходит конвергенция информации от условного и безусловного раздражителей [43, 49, 75]. Норадреналин в латеральной миндалине играет важную роль в ходе выработки, угашения и реконсолидации условно-рефлекторной реакции страха. Показано, что системное или прямое введение в миндалину антагониста бета-адренорецепторов, пропранолола вызывает торможение реконсолидации условной реакции страха на тон [15, 17–20]. Введение в миндалину агониста бета-адренорецепторов, изопротеренола после реактивации хорошо консолидированной памяти, наоборот, усиливает реакцию страха и ослабляет ее угасание спустя 48 ч [20]. В то же время показано, что пропранолол угнетает процесс реконсолидации памяти не во всех случаях. Например, ухудшение реконсолидации не происходило в модели inhibitory avoidance [58], которая основана на избегании животным того отдела камеры, где оно ранее получало болевое воздействие. В большинстве работ, в которых исследовали влияние негативных событий на реконсолидацию памяти, использовали модель обучения с одним единственным сочетанием условного и безусловного раздражителей [3, 5, 7, 59, 60, 71, 90]. Только в одной из известных нам работ на улитках [2] отрицательный безусловный раздражитель использовали многократно (5 электрокожных раздражений в день в течение 5 дней). Через 24 ч после этого улиток помещали в тот же контекст, в котором им предъявлялись электрокожные раздражения, и еще через сутки у них снова тестировали память. Надо отметить, что в отмеченных опытах многократное применение отрицательного безусловного раздражителя использовалось без сочетания его со специальным условным раздражителем, а давалось в условиях того же контекста – пластикового шара, плавающего в воде [2]. В наших опытах для исследования реконсолидации памяти мы использовали две модели – общепринятую условно-рефлекторную реакцию страха (fear conditioning) и рефлекс двустороннего избавления (two-ways escape response) [7, 90]. В первом случае давалось всего одно сочетание условного и безусловного раздражителей, а во втором – сочетания этих раздражителей предъявлялись многократно. В задачу работы входило исследование влияния блокады бета-адренорецепторов на реконсолидацию памяти в обеих моделях обучения.
УСЛОВНО-РЕФЛЕКТОРНАЯ РЕАКЦИЯ СТРАХА
Условно-рефлекторную реакцию страха (fear conditioning) вырабатывали в стандартной темно-светлой камере. Всех крыс подразделяли на 4 группы по 10-12 в каждой группе. В первый день после помещения животных в камеру в течение двух минут их оставляли в условиях свободного поведения (груминг, исследовательская активность и т.д.). После этого включали условный раздражитель (тон) на 30 с, и за 2 с до его окончания давали электрокожное болевое раздражение, которое прекращали вместе со звуком. Через 24 ч группе 1 вводили физиол. раствор без помещения животных в ту же обстановку, где они ранее получали электрокожное раздражение (контрольная группа без напоминания). Группа 2 получала напоминание, т.е. животных помещали в ту же обстановку, где они ранее проходили первичное обучение. Сразу после напоминания им вводили внутрибрюшинно пропранолол (5.0 мг/кг) (экспериментальная группа с напоминанием и пропранололом). Группа 3 получала напоминание, но пропранолол животным не вводили (контрольная группа с напоминанием без пропранолола). И, наконец, группа 4 напоминание не получала, но пропранолол животным вводили (контрольная группа без напоминания с пропранололом). Через 24 ч все 4 группы крыс снова помещали в ту же камеру, где проводили первичное обучение и исследовали у них сохранность навыка по степени замирания. Опыты проводили в условиях контроля над поведением с помощью видео регистрации с последующей статистической обработкой полученных данных.
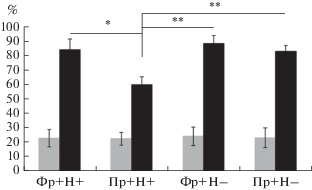
Однократное сочетание тона с болевым электрокожным раздражением существенно усиливало реакцию замирания при повторном тестировании животных спустя 48 ч. Различия между интенсивностью замирания в фоне и после однократного сочетания тона с болевым электрокожным раздражением были выраженными для всех групп животных [F(1,86) = 175.56; p < 0.0001]. До сочетания тона с электрокожным болевым воздействием (фон) разницы между группами по интенсивности замирания не наблюдалось [F(3,43) = 0.14; p = 0.99]. Системное введение пропранолола и физиол. раствора в фазу реактивации выявило у крыс разных групп существенные различия в степени замирания [F(3,43) = 4.69; p < 0.001] при тестировании сохранности навыка (retention) спустя 24 ч (рис. 1). Эти различия были вызваны существенной разницей между группой крыс, получавшей пропранолол и напоминание и другими группами животных. Иными словами, реактивация памяти путем напоминания контекстом приводила к актуализации памяти о болевом электрокожном раздражении и к ее повторной консолидации в форме отчетливого замирания в фазу проверки сохранности навыка. Введение пропранолола (5.0 мг/кг) сразу после напоминания подавляло реконсолидацию, что проявилось в виде существенного ослабления реакции замирания в эту фазу.
Рис. 1.
Влияние норадренергической блокады при системном введении пропранолола на реконсолидацию памяти в модели условно рефлекторной реакции страха. А – схема опытов. В первый день опытов животным давали одно сочетание тона с болевым электрокожным раздражением (1 мА). Через 24 ч вызывали напоминание, помещая крыс в тот же контекст, в котором они получали электрокожное раздражение. Сразу после напоминания животным вводили пропранолол или физиол. раствор. Еще через 24 ч в том же контексте у них тестировали реакцию замирания. Длительность эпизодов замирания (в процентах к общему времени пробы) в фоне (светлые столбики) и спустя 48 ч после обучения (темные столбики). Физ. раствор и пропранолол вводили внутрибрюшинно животным, получавшим напоминание (ФР+Н+; Пр+Н+) и не получавшим его (ФР+Н–; Пр+Н–). * – p < 0.05, ** – p < 0.01.
РЕАКЦИЯ ДВУСТОРОННЕГО ИЗБАВЛЕНИЯ
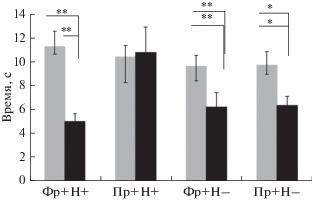
Реакцию двустороннего избавления/избегания (РДИ) исследовали в челночной камере, разделенной на две половины. На пол одной из половин подавалось электрическое раздражение, результатом которого являлась перебежка животного на другую сторону камеры. Отличие процедуры реакции двустороннего избегания от процедуры одностороннего избегания заключается в том, что животные в первом случае могут получать электрокожное раздражение в любой части камеры, в интервалах между пробами они остаются в камере. Во втором случае электрокожное раздражение предъявляется животным всегда только на одной стороне камеры (справа или слева), а во время интервала между пробами их удаляют из экспериментальной камеры. Обычно условный раздражитель (тон) действует в течение 5–6 с изолированно, после чего к нему на несколько секунд присоединяется болевое электрокожное раздражение. Чтобы избавиться от него крыса должна перебежать на другую половину камеры. Если животное перебегает на другую сторону во время изолированного действия звука, то оно не получает электрических импульсов тока вообще, и такая реакция в отличие от реакции избавления (когда оно получает хотя бы один импульс тока) называется реакцией избегания. Реакция двустороннего избегания, после нескольких первых проявлений быстро стабилизируется и достигает высокой прочности. Поскольку при высоко упроченных условных рефлексах реконсолидация памяти сильно затруднена, мы слегка модифицировали процедуру выработки РДИ, уменьшив отставление между условным и безусловным раздражителями со стандартных 5–6 до 3 с. Тем самым, мы создали для животного более напряженные по времени условия для “принятия решения” и выполнение реакции избегания . На наш взгляд, это должно было ослабить динамику выработки и снизить процент осуществления реакции избегания в целом. При таком коротком отставлении раздражителей животные первые 7–8 дней проявляли в основном реакцию избавления, что было достаточным для исследования у них влияния пропранолола на реконсолидацию памяти в модели РДИ в чистом виде, без эффектов избегания. Учитывая предварительные данные, мы провели исследование на новых группах животных (4 группы по 10 в каждой) в течение трех дней. В первый день все животные получали по 10 сочетаний тона с электрокожным болевым раздражением. РДИ оценивали по времени (латентному периоду) от начала включения тока на решетку до момента перебежки животным на другую половину камеры. Во второй день крысам группы 1 после предъявления 10 сочетаний раздражителей (напоминание) вводили внутрибрюшинно физиол. раствор, а крысам группы 2 – пропранолол (5.0 мг/кг). Животных 3 и 4 групп в опыт не брали (без напоминания), но группе 3 вводили в виварии физиол. раствор, а группе 4 – пропранолол. На третий день тестирования у всех животных исследовали латентный период РДИ. Использованный нами подход в известной степени имитирует классическое исследование реконсолидации памяти, проведенное К. Надером и соавт. [59, 60], с той лишь разницей, что в классическом исследовании безусловный (отрицательный) раздражитель применялся всего один раз в период обучения, а в наших опытах – многократно, включая фазу тестирования. В работе К. Надера и соавт. [60] напоминанием было одиночное неподкрепляемое применение условного раздражителя в том же контексте, а в наших опытах – 10 подкрепляемых применений условного раздражителя. Контролем к процедуре напоминания были пропуск одиночного изолированного условного раздражителя в работе К. Надера [60] и пропуск 10 сочетаний условного и безусловного раздражителей в наших опытах. Предварительные опыты показали, что реакция избавления доминирует первые 7–8 дней обучения, после чего появляются реакции избегания. После получения 10 сочетаний тона с электрокожным болевым раздражением в первый опытный день все группы крыс избавлялись от тока с латентным периодом 9–11 с. Существенных различий между группами по скорости осуществления реакции избавления не наблюдалось [F(3,36) = 0.47, p = 0.70]. Однако системное введение пропранолола и физиол. раствора через 24 ч крысам, получавшим и не получавшим в том же контексте напоминания, выявило у них при тестировании еще через 24 ч достоверные различия по латентному периоду реакции избавления [F(3,36) = 3.68; p < 0.05] (рис. 2). Эти различия были вызваны существенной разницей в проявлениях РДИ у крыс, которые получали напоминание и пропранолол, и остальными группами животных.
Рис. 2.
Влияние норадренергической блокады при системном введении пропранолола на реконсолидацию памяти в модели реакции двустороннего избавления. Cреднее время реакции избавления (с) в первый (светлые столбики) и в последний день тестирования (темные столбики). Физ. раствор и пропранолол вводили внутрибрюшинно животным, получавшим напоминание (ФР+Н+; Пр+Н+) и не получавшим его (ФР+Н–; Пр+Н–). * – p < 0.05, ** – p < 0.01.
В большинстве работ для манипуляций с памятью в период ее лабильного состояния используют модели с быстрым обучением – применением одного или двух сочетаний условного и безусловного раздражителей. Чаще всего для этого используют модель условно-рефлекторной реакции страха [59, 60], реже модель inhibitory avoidance [39, 70] и условной вкусовой аверсии [31]. Мы для этой цели помимо fear conditioning использовали еще модель двустороннего избавления, в которой тон и электрокожное болевое раздражение сочетаются не один раз, а многократно. В обоих случаях системное введение пропраналола сразу после реактивации контекстом вызывало у крыс ухудшение памяти об электрокожном болевом раздражении. В первом случае ухудшение памяти проявилось в уменьшении степени замирания животных, во втором – значительным увеличением латентного периода РДИ.
В последние годы получено много данных о роли норадренергической системы мозга в процессах реконсолидации памяти об аверсивных событиях и возможностях использования блокаторов бета-адренорецепторов для стирания памяти об этих событиях [11, 48, 78, 85]. Причем, имеются факты, как о самостоятельном влиянии блокады бета-адренорецепторов на процессы реконсолидации памяти [17, 56, 58], так и об антагонизме влияний на них альфа1- и бета-адренорецепторов [32], однонаправленном влиянии ингибиторов опиоидных (налоксана) и бета-адренорецепторов (пропранолола) и изолированном влиянии антагонистов глюкокортикоидов (RU 38486) и бета-адренорецепторов [67]. Показано, что индуцированное стрессом депрессивно-подобное поведение, ослабляется под влиянием пропранолола или циклогексимида (ингибитор синтеза белка), если их применять в фазу реконсолидации стрессового состояния [38]. Для индивидуумов с высоким индексом тревожности требуются более высокие дозы пропранолола в период реконсолидации памяти об аверсивном событии [80]. Недавно было показано, что блокада бета-адренорецепторов с помощью пропранолола, глюкокортикоидных рецепторов с помощью мифепристона и активация NMDA-рецепторов с помощью агониста d-циклосерина не влияют на процесс реконсолидации и эмоциональное состояние лиц, переживших сильный посттравматический стресс [87]. Введение пропранолола здоровым испытуемым в фазу реактивации эмоциональной памяти ослабляло у них проявление негативных впечатлений при повторном тестировании спустя 24 часа после реактивации [77, 78]. С помощью магнитно-резонансного функционального картирования была выявлена высокая степень активности в миндалине и гиппокампе при повторном тестировании эмоционально-негативных, но не нейтральных событий. Высокая активность вызывалась также в фазу реактивации памяти, но она не модулировалась влиянием пропранолола [77, 78]. Введение испытуемым пропранолола в очень высоких дозах (40 мг/кг), но до реактивации памяти (startle response) не вызывало угнетения рефлекса при последующем тестировании [14]. Пропранолол практически не влиял также на память людей, переживших синдром посттравматического шока, как при изолированном применении, так и в комбинации с антагонистом глюкокортикоидных рецепторов, мифепрестоном [87]. Показано также, что блокада бета-адренорецепторов пропраналолом “стирает” память не во всех моделях, и даже в тех случаях, когда аверсивное событие применяется всего один раз, например, в модели inhibitory avoidance [58]. В работах на животных влияние пропранолола на последующее состояние памяти зависело от того, в какую структуру (например, в миндалину или гиппокамп) [17, 18] или в какой ее отдел (в базалотаральную или латеральную миндалину) вводилось вещество [см. детали в обзоре 72]. Важными были также способ введения вещества (системно или внутрь структуры) и условия перевода памяти в лабильное состояние (контекстом или сигнальным раздражителем) [10, 58, 85], а также модель обучения, дозировка вещества и интенсивность электрокожного раздражения. В частности, как уже упоминалось, эффект пропранолола не проявлялся на модели inhibitory avoidance [58], хотя в ранних исследованиях лаборатории С. Сары [70] при системном введении пропранолола был получен положительный результат. В этой работе интенсивность электрокожного раздражения при выработке рефлекса составляла 0.25 мА, а в работе Е. Муравьевой и К. Алберини [58] 0–0.9 мА. Однако, в специальных опытах с более слабыми интенсивностями электрокожного раздражения (0.25 и 0.6 мА) Е. Муравьева и К. Алберини не получили тормозного эффекта пропранолола на память в модели inhibitory avoidance, хотя введение вещества за 30 мин до реактивации значительно ослабляло рефлекс. Авторы [58] полагают, что отсутствие тормозного эффекта пропранолола на реконсолидацию памяти в модели inhibitory avoidance связано с инструментализацией обучения и более сложным типом структурно-функциональной организации этого рефлекса. В противоположность сказанному в наших опытах при выраженном инструментальном характере обучения и большом числе и продолжительности получаемых болевых раздражений РДИ легко поддавалась влиянию пропранолола. Это проявилось в форме существенного ухудшения памяти, причем даже более выраженного, чем в модели условно-рефлекторной реакции страха. При этом тренд обучения реакции избавления, выражающийся в постепенном уменьшении латентного периода перебежки животного в безопасный отдел камеры под влиянием пропранолола резко обрывался. Время избавления значительно увеличивалось и возвращалось к значениям, имевшим место в начале выработки рефлекса. Интересно, что пропуск опыта сам по себе существенно не влиял на латентный период РДИ у крыс, получавших физиол. раствор и пропранолол без напоминания. Не вдаваясь в характер влияний норадренергической системы на уровне разных структур мозга, можно предположить, по меньшей мере, три возможных ее влияния на функциональном уровне. Во-первых, это может быть связано с разной оценкой восприятия боли, которая, возможно, ослабевает при блокаде норадренергической системы мозга [42] за счет повышения порогов электрокожного раздражения. Во-вторых, блокада бета-адренорецепторов с помощью пропранолола может уменьшать реакцию страха [16] и за счет этого увеличивать время избавления от болевого раздражения. И, наконец, норадренергическая блокада может снижать мотивацию к осуществлению реакции избавления [1, 4]. В этом случае действие пропранолола, хотя внешне по поведенческим проявлениям и имитирует утрату памяти об отрицательных воздействиях, на самом деле еще более усугубляет негативную ситуацию, поскольку лишает субъект (животное) способности сопротивляться и преодолевать трудное состояние [4]. Такое состояние встречается у людей при выраженном хроническом стрессе и депрессии с истощенными норадренергической и серотонинергической системами мозга.
РЕКОНСОЛИДАЦИЯ ПАМЯТИ В ПИЩЕВОМ ИНСТРУМЕНТАЛЬНОМ ПОВЕДЕНИИ
Сегодня мало кто сомневается в том, что память при определенных условиях подвергается дестабилизации и повторной консолидации (реконсолидации). Это было многократно установлено для памяти, основанной на отрицательных событиях [12, 13, 30, 45, 59, 60]. Показана также возможность дестабилизации и реконсолидации памяти, сформированной на основе положительного подкрепления, в частности, в таких моделях, как autoshaping [55], павловский инструментальный трансфер [44], условное подкрепление (conditioned reinforcement) [56], goal tracking [72], условное предпочтение места (conditioned place preference) [88] и в ряде других. В то же время практически нет данных о том, что дестабилизация и реконсолидация памяти проявляется в инструментальных условных рефлексах. Даже, наоборот, существует литература, которая свидетельствует о том, что инструментальное поведение не подвергается дестабилизации и реконсолидации [36, 53]. А в тех случаях, когда такое поведение напоминает реконсолидацию, ингибиторы синтеза белка не блокируют поведенческие эффекты. Возникает вопрос, почему в литературе до сих пор нет убедительных данных в пользу того, что память в инструментальном пищевом поведении способна к дестабилизации и реконсолидации. На наш взгляд, этому могут быть несколько причин. Во-первых, в отмеченных работах [36, 53] инструментальное поведение было сильно упроченным и практически автоматизированным. Получить дестабилизацию такого поведения, по-видимому, очень трудно, если вообще возможно. Наши опыты показали [6], что когда навык сильно упрочен, то реактивация памяти существенно не влияет на последующее проявление этого навыка. Наоборот, когда навык еще не прочный, напоминание положительно влияет на его будущее проявление. Среди других причин, по которым реконсолидация памяти не проявляется в инструментальном поведении, может быть использование неадекватных и неумелых приемов реактивации [65]. Например, непонятно каким должно быть напоминание в инструментальном поведении, сколько раз следует его применять, и каким образом – с подкреплением или без него. Хорошо известно, что при небольшом числе изолированных применений условного раздражителя навык скорее реконсолидируется, чем угасает, и, наоборот, при большом числе применений он легче угашается, чем реконсолидируется. Этот факт относят к пограничным состояниям, который подчеркивает важную роль подкрепления, и в особенности, манипуляций с ним для выявления реконсолидации в инструментальном пищедобывательном поведении [23, 79]. Одним из существенных отличий Павловских классических условных рефлексов, сформированных на базе страха (fear conditioning, inhibitory avoidance, conditioned taste aversion), от инструментальных рефлексов, выработанных на положительном подкреплении, является скорость их образования. Для выработки первых, достаточно всего одного-двух сочетаний, тогда как для выработки последних требуется значительное их число. Быстрота образования классических условных рефлексов является важнейшим условием для их дестабилизации и последующей реконсолидации памяти. В классических рефлексах даже одно единственное напоминание условным раздражителем или контекстом без подкрепления оказывается достаточным, чтобы вызвать лабильное состояние и реконсолидацию. Совсем по-другому обстоит дело с инструментальным поведением. Здесь главное даже не продолжительность обучения и количество используемых проб, а момент “улавливания” сути задачи, после чего поведение быстро стабилизируется и легко воспроизводится. На наш взгляд, реконсолидацию инструментального поведения сложно обнаружить как раз потому, что экспериментатору трудно выявить момент “улавливания” сущности задачи. Пока этот момент еще не наступил, то нечего и консолидировать. А после того как он наступил, навык быстро стабилизируется и автоматизируется, и дестабилизировать его становится очень трудно. Вероятно по этой причине, П. Хернандез и А. Келли [36] не смогли обнаружить дестабилизацию и реконсолидацию инструментального пищевого рефлекса. В их опытах реактивацию проводили на фоне высоко упроченного условного рефлекса - безошибочного совершения 10 последовательных нажатий на одну из педалей, которая сигнализировалась положительным условным раздражителем. Другим важным фактором для проявления реконсолидации являются характер и условия реактивации (дестабилизации) памяти. В классических условных рефлексах она вызывается довольно просто, однократным предъявлением условного раздражителя или контекста без подкрепления. В инструментальном поведении все обстоит гораздо сложнее. Разные исследователи для дестабилизации такой памяти применяют изощренные схемы. Например, в лаборатории Дж. Ли [25, 26, 71, 72] для этого использовали несколько приемов. Вначале крыс обучали нажимать на педаль для получения пищи в режиме подкрепления с переменным интервалом, в среднем продолжительностью 60 с (от 30 до 90 с). Каждое нажатие на педаль открывало доступ к одной пищевой таблетке. Опыт продолжали в течение 30 минут или до получения максимально 60 пищевых таблеток; опыты проводили в течение 10 дней. После 10-го дня осуществляли реактивацию выработанного навыка разными способами: 1) короткими неподкрепляемыми эпизодами по 5 минут, во время которых регистрировали число нажатий, 2) сменой режима подкрепления, при котором каждое 20 нажатие в среднем (от 12 до 28 нажатий) (VR20) приводило к подкреплению, 3) сменой режима подкрепления, при котором только каждое 20-е нажатие на педаль приводило к получению подкрепления (FR20). Авторы обнаружили реконсолидацию инструментального навыка только при реактивации с помощью режима подкрепления VR 20. Введение антагониста NMDA-рецепторов, MK-801 непосредственно до реактивации подавляло реконсолидацию инструментального навыка [25, 26]. Для объяснения механизмов реконсолидации авторы привлекли довольно популярную гипотезу, высказанную много лет назад В. Шульцем [76] об “ошибке прогноза подкрепления” (reward prediction error). Согласно гипотезе для дестабилизации и последующей реконсолидации памяти обязательным условием является наличие ошибки прогноза подкрепления, т.е., расхождение ожидаемого подкрепления с реально получаемым [25, 26]. Чем больше ошибка прогноза подкрепления, тем лучшими являются условия для дестабилизации и последующей реконсолидации памяти. На наш взгляд, предлагаемая авторами гипотеза имеет больше теоретический, чем практический интерес, поскольку мало что дает для выбора конкретных действий, приводящих к дестабилизации памяти. В этом плане, можно упомянуть недавнюю работу Дж. Хобрич и соавт. [34], в которой дестабилизировали память, правда, связанную не с позитивным подкреплением, а со страхом, но в момент дестабилизации на фоне негативного состояния предъявляли также пищевое подкрепление. Вообще считается, что дестабилизация и реконсолидация памяти всегда связаны с какими-то новыми условиями, которые модифицируют и обновляют (updating) старую память. Это могут быть самые разнообразные факторы, но их влияния инкорпорируются и интегрируются с исходной памятью. В частности, на этой основе был применен еще один прием дестабилизации памяти на крысах [40], который имитировал аналогичные опыты на людях [37]. Две группы крыс обучали в одном контексте (А) находить пищу в 3-х строго расположенных кормушках и поедать ее [40]. На следующий день одну группу крыс тестировали в том же контексте (напоминание), но пищу располагали в 3-х других кормушках, а вторую группу обучали находить пищу в аналогично расположенных кормушках, но в другом контексте (без напоминания) (контекст Б). На третий день две группы крыс снова тестировали в контексте А при расположении пищи в тех же кормушках, что и в первый день. Оказалось, что крысы с напоминанием существенно чаще подходили к кормушкам 2-ого дня, чем крысы без напоминания. Эти данные свидетельствует о том, что реактивация способствует инкорпорации и интеграции нового опыта, приобретенного во второй день, в старую память, которая была приобретена в первый день обучения [40].
ВЛИЯНИЕ БЛОКАДЫ БЕТА-АДРЕНОРЕЦЕПТОРОВ НА РЕКОНСОЛИДАЦИЮ ПАМЯТИ В ПИЩЕДОБЫВАТЕЛЬНОМ ПОВЕДЕНИИ
Опыты проводили на крысах-самцах линии Вистар в 8-канальном радиальном лабиринте. Лабиринт состоял из центральной платформы и 8 отходящих от нее в виде лучей рукавов (45 × 10 см) со слегка приподнятыми бортиками (7 см). В дистальных частях лабиринта располагались кормушки, в которых помещали пищевые таблетки (45 мг). Лабиринт был приподнят от пола на 50 см. Перед началом обучения крыс помещали в центральную зону для знакомства с лабиринтом и обследования обстановки в течение 10 минут (pre-training). В первый день предварительного обучения пищевые таблетки разбрасывали по всему лабиринту. Во второй день их помещали в кормушки, расположенные в дистальных частях лабиринта, и вблизи кормушек. Обучение проводили в течение 15 дней, в день предъявляли 2 пробы по 5 мин с интервалом в 30 мин. Пробу начинали с помещения крыс в центральную зону лабиринта. За время пробы крысы заходили в четыре подкрепляемых рукава лабиринта, находили 4 пищевые таблетки и поедали их. Четыре других рукава были всегда неподкрепляемыми. Подкрепляемые рукава сигнализировались специальными вставками – дорожками из шерсти, металлической сетки, полиэтилена и жести. Положение вставок в лабиринте меняли от пробы к пробе. Четыре неподкрепляемых рукава (без вставок) представляли обычный пол лабиринта. Степень обучения крыс в лабиринте оценивали по числу ошибок краткосрочной и долгосрочной памяти. За ошибки долгосрочной памяти принимали заходы в неподкрепляемые рукава лабиринта, а за ошибки краткосрочной (рабочей) памяти - повторные заходы в подкрепляемые рукава лабиринта. Степень прочности пищедобывательного навыка исходно мы оценивали по продолжительности (числу дней) обучения, а эффекты реактивации и реконсолидации памяти измеряли через определенное время (15 и 25 дни) по ходу обучения. Однако оказалось, что число ошибок долгосрочной и рабочей памяти более точно отражают прочность вырабатываемого пищедобывательного навыка, чем общее число примененных проб. Поэтому позже мы несколько модифицировали схему опытов, исследуя реактивацию и реконсолидацию памяти не в условно принятые дни, а на основе совершения животными определенного числа ошибок долгосрочной и рабочей памяти в ходе обучения. Были использованы 4 группы крыс. Первым двум группам предъявляли напоминание, после чего одной из них вводили внутрибрюшинно блокатор бета-адренорецепторов, пропранолол (5.0 мг/кг) (группа 1, n = 13), а другой – физиол. раствор (группа 2, n = 13). Две другие (контрольные) группы напоминания не получали, но в день перерыва им также вводили пропранолол (5.0 мг/кг) (группа 3, n = 12) и физиол. раствор (группа 4, n = 12). Через 24 ч у всех групп крыс тестировали сохранность пищедобывательного навыка (retention test). Напоминание у крыс группы 2, получавших физиол. раствор, приводило к существенному снижению числа ошибок долгосрочной и рабочей памяти при тестировании в retention фазу по сравнению с крысами групп 3 и 4 не получавших напоминания. Так среднее число ошибок долгосрочной памяти у крыс группы 2 составляло 1.5 ± 0.7 за опыт, а у крыс группы 3 и 4 – соответственно 3.0 ± 1.3 и 3.3 ± 0.9 ошибки за опыт. Другими словами, при напоминании пищедобывательного навыка животные совершали в два раза меньше ошибок долгосрочной памяти, чем без напоминания. То же самое наблюдалось у них при оценке рабочей памяти. У крыс, получавших напоминание и физиол. раствор число ошибок рабочей памяти (1.2 ± 0.6) было примерно в два раза меньше, чем у других групп крыс (2.5 ± 1.0). Блокада бета-адренорецепторов) слегка увеличивала число ошибок долгосрочной (1.75 ± 0.8) и рабочей памяти, но эта разница по сравнению с другими группами животных была недостоверной. Таким образом, в отличие от оборонительного поведения с применением однократного и многократных сочетаний условного и безусловного раздражителей, блокада бета-адренорецепторов пропранололом в пищедобывательном поведении не препятствовала проявлению феномена реконсолидации памяти. Учитывая это обстоятельство, а также данные литературы [29], в последующих экспериментах мы для исследования влияния на реконсолидацию памяти в пищедобывательном поведении использовали антагонизм НМДА-рецепторов с помощью вещества МК-801.
РЕКОНСОЛИДАЦИЯ ПАМЯТИ В ЗАВИСИМОСТИ ОТ УСЛОВИЙ РЕАКТИВАЦИИ И БЛОКАДЫ НМДА-РЕЦЕПТОРОВ
Реактивация с помощью одной пробы без подкрепления. В первой серии опытов мы исследовали реконсолидацию памяти, сформированной в процессе выработки пищедобывательного поведения в 8-канальном радиальном лабиринте, использованием одной единственной пробы без подкрепления. После того как все крысы обучались обходить подкрепляемые рукава лабиринта и находить в них пищу, совершая при этом в среднем 1.0–1.5 ошибки долгосрочной памяти за пробу, исследовали возможность проявления у них феномена реконсолидации и влияние на этот процесс антагониста НМДА-рецепторов, вещества МК-801. Каких либо различий в фоне между группами крыс по числу совершенных ошибок долгосрочной памяти [F(3,18) = 0.31; p > 0.05] и по времени обхода подкрепляемых рукавов лабиринта [F(3,18) = 0.06; p > 0.05] обнаружено не было. При тестировании через 24 ч у всех крыс, получавших реактивацию и инъекцию физиол. раствора, резко увеличилось число ошибок долгосрочной памяти, с 1.2 ± 0.5 до 3.5 ± 0.5 за пробу. У других групп крыс серьезного ухудшения памяти по этому показателю по сравнению с фоном не наблюдалось (1.8 ± 0.9 и 1.7 ± 0.5 у реактивированной группы, получавшей инъекцию MK-801; 1.0 ± 0.3 и 1.2 ± 0.5 у не реактивированной группы, получавшей MK-801; и 1.2 ± 0.7 и 1.4 ± 0.7 у не реактивированной группы, получавшей инъекцию физиол. раствора). Другими словами, одна единственная проба без подкрепления в фазу реактивации приводила к существенному росту числа ошибок долгосрочной памяти у крыс реактивированной группы (эффект реконсолидации) по сравнению с животными, не подвергавшимися реактивации, и животными, подвергавшимися реактивации, но получавшими системное введение МК-801 (рис. 3). В последнем случае введение вещества препятствовало реконсолидации памяти, на что указывает отсутствие достоверной разницы в числе ошибок в фоне и в тесте у реактивированной группы, получавшей МК-801. Таким образом, однократный пропуск подкрепления в 4-х рукавах лабиринта приводил к увеличению числа ошибок долгосрочной памяти. Введение препарата МК-801 блокировало этот эффект.
Рис. 3.
Влияние антагониста НМДА-рецепторов, МК-801, на реконсолидацию памяти у крыс, обученных пищедобывательному поведению в 8-канальном радиальном лабиринте в случае ее реактивации с помощью одной пробы без подкрепления. Светлые столбики – фоновые значения (до реактивации), темные столбики – данные, полученные при тестировании. По вертикальной оси – на рис. 1, среднее число ошибок долгосрочной памяти (заходов в неподкрепляемые рукава лабиринта) за одиночную пробу. Цифрами помечены: 1 – группа, подвергавшаяся реактивации и получавшая сразу после нее внутрибрюшинное введение физиологического раствора; 2 – группа, подвергавшася реактивации и получавшая сразу после нее внутрибрюшинное введение МК-801 (0.1 мг/кг); 3 – группа, не подвергавшаяся реактивации и получавшая в домашней клетке введение физиологического раствора; 4 – группа, не подвергавшаяся реактивации и получавшая в домашней клетке введение МК-801. Звездочкой показаны достоверные (p < 0.05) внутригрупповые различия до реактивации (в фоне) и после нее (при тестировании), а решеткой – межгрупповые различия. Черточки отражают ошибки средних значений.

Реактивация с помощью 3 проб без подкрепления. Во второй серии опытов мы провели исследование реконсолидации памяти посредством ее реактивации тремя последовательными неподкрепляемыми пробами. Но при этом мы учли, что при трех пробах без подкрепления может запуститься процесс угашения обученного пищедобывательного навыка, что само по себе является самостоятельным и независимым от реконсолидации процессом. Так как в одной реактивируемой пробе по условиям эксперимента животное не получает четырех подкреплений, а в трех пробах уже 12 подкреплений, то можно было ожидать ухудшения базового пищедобывательного навыка. По сути, так оно и происходило. Уже в третьей пробе в процессе реактивации значительно ослабла мотивация поиска, и увеличилось время, за которое животные обследовали лабиринт. Чтобы как-то противодействовать этому процессу, мы усилили исходно выработанный пищедобывательный навык, посредством дополнительного тренинга, доведя число ошибок для фона в среднем до 0.2–0.6 за пробу. Однако, несмотря на это, при повторной реактивации и последующем тестировании пищедобывательного поведения, нам не удалось получить значимых различий между исследованными группами животных по показателю ошибок долгосрочной памяти [F(3,40) = 2.01; p = 0.12]. При трех последовательных пробах без подкрепления в фазу реактивации с интервалом в 30 с время обхода подкрепляемых рукавов лабиринта у крыс, получавших реактивацию и инъекцию физиол. раствора в тесте увеличилось почти вдвое (99.2 ± 12.5) по сравнению с фоном (47.4 ± 9.2). У крыс других групп время обхода подкрепляемых рукавов в тесте не отличалось от уровня фона, и в среднем находилось в пределах одной минуты. Таким образом, вариант реактивации памяти с помощью трех последовательных проб без подкрепления оказался неэффективным для проявления реконсолидации памяти.
Реактивация с помощью 3 проб с усиленным подкреплением. Прежде чем перейти к дестабилизации пространственной памяти в радиальном лабиринте с помощью трех проб с усиленным подкреплением, надо было ослабить исходный пищедобывательный навык. Это было достигнуто месячным перерывом в опытах. В результате число ошибок долгосрочной памяти у разных групп животных выросло в среднем до 1.5–3.0 за пробу. Три пробы подряд с усиленным подкреплением в фазу реактивации привели к значительному сокращению числа ошибок у группы животных, получавших реактивацию и инъекцию физиол. раствора в фазу тестировании. Однако достоверных различий в числе ошибок долгосрочной памяти для разных групп животных обнаружено не было [F(3,40) = 1.597; p = 0.20]. Таким образом, и этот вариант реактивации оказался не эффективным для проявления реконсолидации памяти.
В результате проведенных опытов было установлено, что память в инструментальном пищевом поведении в 8-канальном радиальном лабиринте подвергается реконсолидации, которая блокируется антагонистом НМДА-рецепторов, МК-801, но это происходит только при реактивации памяти с использованием одной пробы без подкрепления. Когда в качестве реактивации были использованы три последовательные пробы без подкрепления, или три последовательные пробы с усиленным подкреплением, то обнаружить реконсолидацию и влиять на процесс с помощью МК-801 нам не удалось. В литературе имеется всего несколько работ, в которых исследовали возможность проявления реконсолидации памяти в инструментальном пищевом поведении [25, 26, 36, 53, 70]. В двух из них реконсолидацию обнаружить не удалось [36, 53]. В опытах П. Хернандез и А. Келли [36] крысам, обученным получать пищевое подкрепление нажатием на одну из двух педалей, на 10-14-й дни обучения вводили ингибитор синтеза белка, анизомицин. При тестировании через 24 ч у них наблюдалось ухудшение памяти, проявившееся в существенном уменьшении числа нажатий на педаль. На первый взгляд, могло показаться, что ухудшение памяти было вызвано угнетением синтеза белка. Однако, в контрольных экспериментах было показано, что частичная амнезия была связана не с мнемоническими процессами, а с развитием условной вкусовой аверсии на вредные свойства препарата [36]. В другой работе [53] ингибитор синтеза белка, циклогексимид (3.0 мг/кг) не оказывал влияния на частоту нажатий, хотя аверсивными свойствами он не обладал. Важно отметить, что в отмеченных работах, блокада синтеза белка проводилась на стадии высоко упроченного инструментального пищевого поведения, при котором, по мнению ряда авторов [22, 73, 84] реконсолидация памяти либо вообще не вызывается, либо вызывается с большим трудом. Кроме того, в этих работах исходную память специально не реактивировали, а полагались только на эффект ингибирования синтеза белка. Недавно М. Экстон-МасГинесс и Дж. Ли [25] показали, что память в инструментальном пищевом поведении все же может реконсолидироваться, но только при особых условиях ее реактивации. В частности, одним из таких условий было применение в фазу реактивации изменяющегося числа (в среднем 5) нажатий на педаль [25]. Системное введение крысам МК-801 за 30 мин до реактивации блокировало процесс реконсолидации. В другой работе из той же лаборатории [26] реконсолидацию памяти в инструментальном поведении удалось обнаружить даже при сильно упроченном инструментальном навыке, но реактивацию в этом случае осуществляли в режиме (VR) с большей вариацией числа нажатий на педаль (в среднем n = 20) для получения подкрепления. При таком же, но фиксированном числе нажатий на педаль (n = 20) реконсолидацию памяти получить не удалось [26]. И, наконец, в еще одной работе [70] на такой же модели (8-канальный радиальный лабиринт), что использовали мы, авторы смогли обнаружить реконсолидацию памяти. Необходимо указать на ряд методических различий в этой работе [70] и нашем исследовании. Во-первых, Дж. Пшибиславский и соавт. предъявляли подкрепление в трех рукавах лабиринта, а не в четырех, как это делали мы. Во-вторых, авторы обучали крыс, давая им 3 пробы в день, а не одну, как было в наших опытах. В-третьих, дестабилизацию памяти они проводили с помощью только одной пробы, которую подкрепляли, а не с помощью одной или трех проб без подкрепления или трех проб с усиленным подкреплением, как это было в нашем исследовании. И, наконец, для выяснения возможности блокады реконсолидации памяти они использовали антагонизм не НМДА-, а бета-адренергических рецепторов. Дж. Пшибиславский и соавт. [70] обнаружили существенное ухудшение памяти у крыс, которые подвергались реактивации и которым вводился пропранолол, по сравнению с крысами, которые реактивации не подвергались и которым пропранолол вводили в виварии. Трудно оценить, по какой причине происходило ухудшение памяти в опытах Дж. Пшибиславского и соавт. [70], поскольку согласно процедурным особенностям сравниваться между собой в них могли только эффекты пропранолола и физиол. раствора у реактивированных крыс, и/или эффекты пропранолола у реактивированных и не реактивированных животных. Ряд авторов [64, 73] считает, что реконсолидироваться может только обновляемая (updated) память. Поскольку сильно упроченная память обновляется слабо, или не обновляется совсем, то, по их мнению, она не может реконсолидироваться. Р. Фернандесом и соавт. [27] было высказано предположение, что критерием оценки для обновления памяти служит рассогласование между ожидаемым и реальным подкреплениями, или так называемая “ошибка прогноза подкрепления” (prediction error). Чем больше ошибка прогноза подкрепления, тем сильнее обновляется память, и наоборот. В случае инструментальных нажатий на педаль дестабилизировать и обновить оригинальную память оказывается очень сложно, поскольку в ее основе лежит жестко фиксированный стереотип (нажатие–подкрепление), трудно поддающийся переделке. Хотя авторы отмеченных выше работ [25, 26] считают, что полученные ими данные отражают процессы дестабилизации и реконсолидации памяти, они не исключают возможности их объяснения с позиций выработки двух самостоятельных инструментальных пищевых рефлексов и условных эффектов от вида и других свойств педали (условное подкрепление). Использование 8-канального радиального лабиринта в качестве модели для оценки реконсолидации памяти в инструментальном поведении является, с нашей точки зрения, более предпочтительным приемом, поскольку позволяет наблюдать за постепенным развитием обучения, при котором “улавливание” сути задачи не приводит к быстрому упрочению и специализации навыка, как при обучении нажатиям на педаль. При “педальной” форме инструментального поведения оценка памяти осуществляется косвенно, по характеристикам обучения, тогда как в 8-канальном радиальном лабиринте она оценивается прямым путем – на основе числа совершенных ошибок. Кроме того, разные манипуляции (число проб в одном опыте, общее число проб, число подкрепляемых и неподкрепляемых рукавов лабиринта, длительность перерывов между опытами и др.) могут значительно влиять на память, усиливая или ослабляя ее. В наших опытах мы уделили внимание двум факторам, способным повлиять на процесс реконсолидации – на силу памяти, оцениваемую по числу совершенных ошибок, и на особенности ее реактивации – по числу проб в фазу реактивации. Число проб, используемых в фазу реактивации, имеет принципиальное значение, поскольку от этого зависит степень рассогласования между прогнозируемым и реально получаемым подкреплением (прогноз ошибки) а, в итоге, и степень обновления памяти. В зависимости от числа неподкрепляемых проб развиваются два самостоятельных и независимых процесса: или реконсолидация или угашение оригинальной памяти. Реконсолидация обусловлена обновлением оригинальной памяти, а угашение – формированием новой памяти о том, что условный раздражитель и связанное с ним действие, больше не приводят к получению подкрепления [79]. К настоящему времени получено много поведенческих [29, 79, 84], биохимических [52], нейрофизиологических [8], эпигенетических [35] и других свидетельств в пользу разной природы процессов реконсолидации и угашения. Использование одной пробы без подкрепления в наших опытах вызывало дестабилизацию оригинальной памяти и ее повторную консолидацию, что проявилось в существенном увеличении числа ошибок долгосрочной памяти у реактивированных крыс по сравнению с не реактивированными животными. Это, вероятно, происходило в результате рассогласования (mismatch) между ожидаемым пищевым подкреплением и его реальным отсутствием. В опытах Д. Севенстера и соавт. [79] при исследовании условно-рефлекторной реакции страха у людей было показано, что первое применение условного раздражителя без подкрепления приводит к дестабилизации оригинальной памяти, тогда как второе неподкрепляемое его применение не влияет на память. Авторы разработали шкалу субъективной оценки ожидания безусловного раздражителя от –5 до +5. Оказалось, что ожидание безусловного раздражителя при первом его пропуске составляло +3.8, а при втором пропуске уже +0.9, что приближалось к уровню неопределенности (0), при котором рассогласование (mismatch) было недостаточным, чтобы вызвать дестабилизацию, обновление и реконсолидацию оригинальной памяти. Каждое последующее применение условного раздражителя без безусловного раздражителя минимизирует рассогласование между прогнозом и реальностью, в результате вместо реконсолидации формируется новое обучение (угашение), противоположное исходно выработанному навыку. Вероятно, в наших опытах при трех последовательных пробах без подкрепления (в сумме при пропуске 12 подкреплений) в фазу реактивации, вместо дестабилизации и реконсолидации искомого пищедобывательного навыка, начинал формироваться противоположный ему процесс угашения. Об этом свидетельствует то, что число ошибок у животных, получавших эти три пробы подряд, а также время обхода ими подкрепляемых рукавов лабиринта значительно увеличились, а блокада НМДА-рецепторов с помощью МК-801 никак не влияла на этот процесс.
ЗАКЛЮЧЕНИЕ
Открытие феномена реконсолидации памяти в результате ее реактивации открыло широкие возможности для изменения или полного стирания “негативной” памяти о сильных эмоциональных травмах и потрясениях прошлого. Но чтобы реконсолидация проявилась необходимы определенные условия и временные интервалы (окна), вне которых память не реконсолидируется. Немаловажное значение для этого имеют сила (прочность) памяти, давность ее существования и условия реактивации (дестабилизации). Например, легче реактивируется и реконсолидируется “молодая” память, чем “старая”. Также легче подвергается реконсолидации менее прочная, чем высоко упроченная память. Наиболее эффективным приемом стирания памяти в период ее дестабилизации является блокада синтеза белка (анизомицин, циклогексимид). Однако, по этическим причинам, блокаторы синтеза белка не могут быть использованы для влияния на память человека . Для этой цели применяют фармакологические воздействия, в частности, блокаторы бета-адренорецепторов (пропранолол) и глутаматэргических рецепторов (МК-801). Показано, что блокада бета-адренорецепторов “стирает” память не во всех моделях. Существенную роль в эффектах пропранолола играют место введения вещества, способы его введения, типы памяти, условия перевода памяти в лабильное состояние и т.д. Блокада глутаматэргических рецепторов является более эффективной при использовании пищевых условных рефлексов, в том числе при инструментальном поведении, как показали настоящие опыты. Помимо фармакологических подходов с целью влияния на реконсолидацию памяти используют также различные поведенческие приемы. Например, применяют комбинацию приемов реконсолидации памяти и угашения, или процедуру инкорпорации (интеграции) в старую память нового опыта, или эмоционально позитивных стимулов в аверсивную память, или даже просто нейтральных стимулов. Важную роль в проявлениях реконсолидации и влияния на нее различных амнестических агентов играют особенности и условия реактивации памяти и знак подкрепления, на основе которого формируется память. Последний фактор определяет, прежде всего, скорость обучения. Так для формирования аверсивной памяти достаточно всего одного сочетания условного и безусловного раздражителей. К этим типам обучения относятся классический условный рефлекс (fear conditioning), реакция пассивного избегания (inhibitory avoidance) и условная вкусовая аверсия (conditioned taste aversion). Методика реактивации памяти в этих рефлексах проста, удобна и занимает всего одно несочетанное применение условного раздражителя и контекста. Поведение на базе положительного подкрепления (если это не самостимуляция мозга и наркотические вещества), требует для своего формирования большого числа проб, и соответственно, сложных и неадекватных приемов реактивации, которые часто трудно понять и оценить. Не случайно до сих пор в литературе нет единого мнения о способности инструментальных пищевых рефлексов к реактивации и реконсолидации памяти. В настоящей работе нам удалось найти особенности реактивации памяти в пищевом инструментальном поведении, которые приводили или не приводили к реконсолидации обученного навыка. Они оказались связанными с особенностями подкрепления в фазу реактивации. Причем реактивация и последующая реконсолидация памяти были актуальными при использовании одной только пробы без подкрепления, и не актуальными при использовании трех последовательных проб без подкрепления, или наоборот, трех последовательных проб с подкреплениями. Блокада НМДА-рецепторов с помощью МК-801 эффективно подавляла процесс реконсолидации памяти.
Список литературы
Базян А.С., Григорьян Г.А. Молекулярно-химические основы подкрепления и эмоциональных состояний // Успехи физиологических наук. 2006. Т 37. № 1. С. 68–83.
Гайнутдинова Т.Х., Тагирова Р.Р., Исмаилова А.И., Муранова Л.Н., Гайнутдинов Х.Л., Балабан П.М. Зависимая от белкового синтеза реактивация обстановочного условного рефлекса у виноградной улитки // Журн. высш. нерв. деят. 2004. Т. 54. № 6. С. 795–800.
Григорьян Г.А., Маркевич В.А. Консолидация, реактивация и реконсолидация памяти // Журн. высш. нерв. деят. 2014. Т. 64. № 2. С. 123–136.
Григорьян Г.А. Память и депрессии // Журн. высш. нерв. деят. 2006. Т.56. № 4. С. 556–570.
Муравьева Е.В., Анохин К.В. Участие синтеза белка в реконсолидации памяти в разное время после обучения условно-рефлекторному замиранию у мышей // Журн. высш. нерв. деят. 2006. Т. 56. № 2. С. 274–281.
Зайченко М.И., Григорьян Г.А., Маркевич В.А. Влияние МК-801 на пространственную память в 8-канальном радиальном лабиринте у крыс зависит от условий ее реактивации // Журн. высш. нервн. деят. 2018. Т. 68. № 2. С. 216–222.
Зайченко М.И., Маркевич В.А., Григорьян Г.А. Пропранолол ухудшает память при однократно и многократно сочетанных с тоном болевых воздействиях // Журн. высш. нервн. деят. 2016. Т. 66. № 2. С. 220–228.
Зюзина А.Б., Балабан П.М. Угашение и реконсолидация памяти // Журн. высш. нервн. деят. 2015. Т. 65. № 5. С. 564–576.
Муравьева Е.В., Анохин К.В. Участие синтеза белка в реконсолидации памяти в разное время после обучения условнорефлекторному замиранию у мышей // Журн. высш. нервн. деят. 2006 Т. 56. № 2. С. 274–281.
Abrari K., Rashidy-Pour A., Semnanian S., Fathollahi Y. Administration of corticosterone after memory reactivation disrupts subsequent retrieval of a contextual conditioned fear memory: dependence upon training intensity // Neurobiol. Learn. Mem. 2008. V. 89. P. 178–184.
Achterberg E.J., Trezza V., Vanderschuren L.J. Beta-Adrenoreceptor stimulation mediates reconsolidation of social reward-related memories // PLoS One. 2012. V. 7. № 6. :e39639.
Baratti C.M., Boccia M.M., Blake M.G., Acosta G.B. Reactivated memory of an inhibitory avoidance response in mice is sensitive to a nitric oxide synthase inhibitor // Neurobiol. Learn. Mem. 2008. V. 89. P. 426–440.
Boccia M.M., Blake M.G., Acosta G.B., Baratti C.M. Memory consolidation and reconsolidation of an inhibitory avoidance task in mice: effects of a new different learning task // Neuroscience. 2005. V. 135. P. 19–29.
Bos M.G., Beckers T., Kindt M. Noradrenergic blockade of memoryreconsolidation: a failure to reduce conditioned fear responding // Front. Behav. Neurosci. 2014. V. 28. № 8. P. 412–422.
Bush D.E.A., Caparosa E.M., Gekker A., LeDoux J.E. Beta-adrenergic receptors in the lateral nucleus of the amygdala contribute to the acquisition but not the consolidation of auditory fear conditioning // Front. Behav. Neurosci. 2010. V. 4. P. 1–7.
Camp R.M., Johnson J.D. Repeated stressor exposure enhances contextual fear memory in a beta-adrenergic receptor-dependent process and increases impulsivity in a non-beta receptor-dependent fashion // Physiol. Behav. 2015. S0031-9384 (15): 00135-143.
Debiec J., Ledoux J.E. Disruption of reconsolidation but not consolidation of auditory fear conditioning by noradrenergic blockade in the amygdale // Neuroscience. 2004. V.129. № 2. P. 267-272.
Debiec J., LeDoux J.E. Noradrenergic signaling in the amygdala contributes to the reconsolidation of fear memory: treatment implications for PTSD // Ann. N. Y. Acad. Sci. 2006. V. 1071. P. 521–524.
Debiec J., Doyère V., Nader K., Ledoux J.E. Directly reactivated, but not indirectly reactivated, memories undergo reconsolidation in the amygdale // Proc. Natl. Acad. Sci. U S A. 2006. V.103. № 9. P. 3428–3433.
Dbeiec J., Bush D.E., LeDoux J.E. Noradrenergic enhancement of reconsolidation in the amygdala impairs extinction of conditioned fear in rats–a possible mechanism for the persistence of traumatic memories in PTSD // Depress. Anxiety. 2011. V.28. № 3. P. 186–193.
Debiec J., LeDoux J.E., Nader K. Cellular and systems reconsolidation in the hippocampus // Neuron. 2002. V. 36. № 3. P. 527–538.
De Jaeger X., Courtey J., Brus M., Artinian J., Villain H., Bacquié E., Roullet P. Characterization of spatial memory reconsolidation // Learn. Mem. 2014. V. 6. P. 316–324.
Diaz-Mataix L., Ruiz Martinez R.C., Schafe G.E., Ledoux J.E., Doyere V. Detection of a temporal error triggers reconsolidation of amygdala-dependent memories // Curr. Biol. 2013. P. 467–472.
Dudai Y. The neurobiology of consolidations, or, how stable is the engram? // Annu. Rev. Psychol. 2004. V. 55. P. 51–86.
Exton-McGuinness M.T., Lee J.L. Reduction in responding for sucrose and cocaine reinforcement by disruption of memory reconsolidation (1,2,3) // eNeuro. 2015. V. 2. № 2. P. 9–15.
Exton-McGuinness M.T., Patton R.C., Sacco L.B., Lee J.L. Reconsolidation of a well-learned instrumental memory // Learn. Mem. 2014. V. 21. № 9. P. 468–477.
Fernández R.S., Boccia M.M., Pedreira M.E. The fate of memory: Reconsolidation and the case of Prediction Error // Neurosci. Biobehav. Rev. 2016. V. 68. P. 423–441.
Ferrer Monti R.I., Giachero M., Alfei J.M., Bueno A.M., Cuadra G., Molina V.A. An appetitive experience after fear memory destabilization attenuates fear retention: involvement GluN2B-NMDA receptors in the basolateral amygdala complex // Learn Mem. 2016. V. 23. № 9. P. 465–78.
Flavell C.R., Lee J.L. Reconsolidation and extinction of an appetitive pavlovian memory // Neurobiol. Learn. Mem. 2013.V. 104. P. 25–31.
Flint R.W., Noble L.J., Ulmen A.R. NMDA receptor antagonism with MK-801 impairs consolidation and reconsolidation of passive avoidance conditioning in adolescent rats: evidence for a state dependent reconsolidation effect // Neurobiol. Learn. Mem. 2013 V. 101. P. 114–119.
Flint R.W., Jr., Marino C.L. Cycloheximide impairs reconsolidation of a contextually reactivated memory in a conditioned taste aversion paradigm // Behav. Neurosci. 2007.V.12. P. 433–438.
Gazarini L., Stern C.A., Carobrez A.P., Bertoglio L.J. Enhanced noradrenergic activity potentiates fear memory consolidation and reconsolidation by differentially recruiting alfa1- and beta-adrenergic receptors // Learn. Mem. 2013. V. 20. № 4. P. 210–219.
Gisquet-Verrier P., Smith C. Avoidance performance in rat enhanced by postlearning paradoxical sleep deprivation // Behav. Neural. Biol. 1989. V. 52. № 2. P. 152–169.
Haubrich J., Crestani A.P., Cassini L.F., Santana F., Sierra R.O., Alvares Lde O., Quillfeldt J.A. Reconsolidation allows fear memory to be updated to a less aversive level through the incorporation of appetitive information // Neuropsychopharmacology. 2015. P. 40. № 2. P. 315–326.
Hemstedt T.J., Lattal K.M., Wood M.A. Reconsolidation and extinction: Using epigenetic signatures to challenge conventional wisdom. Neurobiol. Learn. Mem. 2017. S1074-7427(17)30006-0.
Hernandez P.J., Kelley A.E. Long_term memory for instrumental responses does not undergo protein synthesis_dependent reconsolidation upon retrieval // Learn. Mem. 2004. V. 11. P. 748–754.
Hupbach A., Gomez R., Hardt O., Nadel L. Reconsolidation of episodic memories: A subtle reminder triggers integration of new information // Learn. Mem. 2007. V. 14. P. 47–53.
Hymel K.A., Eans S.O., L Sitchenko K., Gomes S.M., Lukowsky A.L., Medina J.M., Sypek E.I., Carey A.N., McLaughlin J.P. Stress-induced increases in depression-like and cocaine place-conditioned behaviors are reversed by disruption of memories during reconsolidation // Behav. Pharmacol. 2014. V. 25. № 6. P. 599–608.
Inda M.C., Muravieva E.V., Alberini C.M. Memory retrieval and the passage of time: from reconsolidation and strengthening to extinction // J. Neurosci. 2011. V. 31. P. 1635–1643.
Jones B., Bukoski E., Nadel L., Fellous J.M. Remaking memories: reconsolidation updates positively motivated spatial memory in rats // Learn Mem. 2012. V. 19. № 3. P. 91–98.
Kindt M., Soeter M., Sevenster D. Disrupting reconsolidation of fear memory in humans by a noradrenergic β-blocker // J. Vis. Exp. 2014. V. 94. e52151, https://doi.org/10.3791/52151
Kline R.H., Exposto F.G., O’Buckley S.C., Westlund K.N., Nackley A.G. Catechol-O-methyltransferase inhibition alters pain and anxiety-related volitional behaviors through activation of β-adrenergic receptors in the rat // Neuroscience. 2015. V. 290. P. 561–569.
LeDoux J. The amygdale // Curr. Biol. 2007. V. 17. № 20. P. 868–874.
Lee J.L., Everitt B.J. Reactivation-dependent amnesia in Pavlovian approach and instrumental transfer // Learn. Mem. 2008. V. 15. P. 597–602.
Lee J.L.C., Milton A.L., Everitt B.J. Reconsolidation and extinction of conditioned fear: inhibition and potentiation // J. Neurosci. 2006. V. 26. P. 10051–10056.
Lewis D.J. Psychobiology of active and inactive memory // Psychol. Bull. 1979. V. 86. P. 1054–108
Lewis D.J., Bregman N.J., Mahan J.J. Cue-dependent amnesia in rats // J. Comp. Physiol. Psychol. 1972. V. 81. № 2. P. 243–247.
Lonergan M.H., Olivera-Figueroa L.A., Pitman R.K., Brunet A. Propranolol’s effects on the consolidation and reconsolidation of long-term emotional memory in healthy participants: a meta-analysis // J. Psychiatry Neurosci. 2013. V. 38. № 4. P. 222–231.
Maren S. Synaptic mechanisms of associative memory in the amygdale // Neuron. 2005. V. 47. № 6. P. 783–786.
McGaugh J.L. The amygdala modulates the consolidation of memories of emotionally arousing experiences // Annu. Rev. Neurosci. 2004. V. 27. P. 1–28.
McGaugh J.L. Memory–a century of consolidation // Science. 2000. V. 287. № 5451. P. 248–251.
Merlo E., Milton A.L., Goozée Z.Y., Theobald D.E., Everitt B.J. Reconsolidation and extinction are dissociable and mutually exclusive processes: Behavioral and molecular evidence // The J. Neuroscience. 2014. V. 34. P. 2422–2431.
Mierzejewski P., Korkosz A., Rogowski A., Korkosz I., Kostowski W., Scinska A. Post-session injections of a protein synthesis inhibitor, cycloheximide do not alter saccharin self-administration // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2009. V. 33. P. 286–289.
Milekic M.H., Alberini C.M. Temporally graded requirement for protein synthesis following memory reactivation // Neuron. 2002. V. 36. № 3. P. 521–525.
Milton A.L., Schramm M.J., Wawrzynski J.R., Gore F., Oikonomou-Mpegeti F., Wang N.Q., Samuel D., Economidou D., Everitt B.J. Antagonism at NMDA receptors, but not beta-adrenergic receptors, disrupts the reconsolidation of pavlovian conditioned approach and instrumental transfer for ethanol-associated conditioned stimuli // Psychopharmacol. 2012. V. 219. P. 751–761.
Milton A.L., Lee J.L., Everitt B.J. Reconsolidation of appetitive memories for both natural and drug reinforcement is dependent on {beta}-adrenergic receptors // Learn. Mem. 2008. V. 15. № 2. P. 88–92.
Monfils M.H., Cowansage K.K., Klann E., LeDoux J.E. Extinction-reconsolidation boundaries: key to persistent attenuation of fear memories // Science. 2009. V. 324. № 5929. P. 951–955.
Muravieva E.V., Alberini C.M. Limited efficacy of propranolol on the reconsolidation of fear memories // Learn Mem. 2010. V. 17. № 6. P. 306–313.
Nader K., Schafe G.E., Le Doux J.E. Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval // Nature. 2000. 406: 722–726.
Nader K., Schafe G.E., LeDoux J.E. The labile nature of consolidation theory // Nat. Rev. Neurosci. 2000. V. 1. № 3. P. 216–219.
Nemeroff C.B., Bremner J.D., Foa E.B., Mayberg H.S., North C.S., Stein M.B. Posttraumatic stress disorder: a state-of-the-science review // J. Psychiatr. Res. 2006. V. 40. № 1. P. 1–21.
O’Donnell T., Hegadoren K.M., Coupland N.C. Noradrenergic mechanisms in the pathophysiology of post-traumatic stress disorder // Neuropsychobiology. 2004. 50(4): 273–283.
Pedreira M.E., Maldonado H. Protein synthesis subserves reconsolidation or extinction depending on reminder duration // Neuron. 2003. V. 38. № 6. P. 863–869.
Pedreira M.E., Perez-Cuesta L.M., Maldonado H. Mismatch between what is expected and what actually occurs triggers memory reconsolidation or extinction // Learn. Mem. 2004. V. 11. P. 579–585.
Pineyro M.E., Monti R.I.F., Alfei J.M., Bueno A.M., Urcelay G.P. Memory destabilization is critical for the success of the reactivation–extinction procedure // Learn Mem. 2014 V. 21. P. 46–54.
Pitman R.K. Post-traumatic stress disorder, hormones, and memory // Biol. Psychiatry. 1989. V. 26. № 3. P. 221–223.
Pitman R.K., Milad M.R., Igoe S.A., Vangel M.G., Orr S.P., Tsareva A., Gamache K., Nader K. Systemic mifepristone blocks reconsolidation of cue-conditioned fear; propranolol prevents this effect // Behav. Neurosci. 2011. V. 125. № 4. P. 632–638.
Pitman R.K., Sanders K.M., Zusman R.M., Healy A.R., Cheema F., Lasko N.B., Cahill L., Orr S.P. Pilot study of secondary prevention of posttraumatic stress disorder with propranolol // Biol. Psychiatry. 2002. V. 51. № 2. P. 189–192.
Power A.E., Berlau D.J., McGaugh J.L., Steward O. Anisomycin infused into the hippocampus fails to block “reconsolidation” but impairs extinction: the role of re-exposure duration // Learn Mem. 2006. V.13 № 1. P. 27–34.
Przybyslawski J., Roullet P., Sara S.J. Attenuation of emotional and nonemotional memories after their reactivation: role of beta adrenergic receptors // J. Neurosci. 1999. V. 19. P. 6623–6628.
Reichelt A.C., Lee J.L.C. Memory reconsolidation in aversive and appetitive settings // Front. Behav. Neurosci. 2013. V. 7. P. 118–119.
Reichelt A.C., Lee J.L.C. Appetitive pavlovian goal-tracking memories reconsolidate only under specific conditions // Learn. Mem. 2012. V. 20. P. 51–60.
Rodriguez-Ortiz C.J., De la Cruz V., Gutierrez R., Bermudez-Rattoni F. Protein synthesis underlies post-retrieval memory consolidation to a restricted degree only when updated information is obtained // Learn. Mem. 2005. V. 12. P. 533–537.
Salvetti B., Morris R.G., Wang S.H. The role of rewarding and novel events in facilitating memory persistence in a separate spatial memory task // Learn. Mem. 2014. V. 21. № 2. P. 61–72.
Schafe G.E., Doyere V., LeDoux J.E. Tracking the fear engram: the lateral amygdala is an essential locus of fear memory storage // J. Neurosci. 2005. V. 25. № 43. P. 10010–10014.
Schultz W., Dayan P., Montague R.A. Neural Substrate of Prediction and Reward // Science. 1997. V. 5306. P. 1593–1599.
Schwabe L., Nader K., Wolf O.T., Beaudry T., Pruessner J.C. Neural signature of reconsolidation impairments by propranolol in human // Biol. Psychiatry. 2012. V. 71. № 4. P. 380–386.
Schwabe L., Nader K., Pruessner J.C. Beta-Adrenergic blockade during reactivation reduces the subjective feeling of remembering associated with emotional episodic memories // Biol. Psychol. 2013. V.92. № 2. P. 227–232.
Sevenster D., Beckers T., Kindt M. Prediction error demarcates the transition from retrieval, to reconsolidation, to new learning // Learn. Memory. 2014. 21. P. 580–584.
Soeter M., Kindt M. High trait anxiety: a challenge for disrupting fear memory reconsolidation // PLoS One. 2013. V. 8. № 11. e75239.
Southwick S.M., Davis M., Horner B., Cahill L., Morgan C.A. 3rd, Gold P.E., Bremner J.D., Charney D.C. Relationship of enhanced norepinephrine activity during memory consolidation to enhanced long-term memory in humans // Am. J. Psychiatry. 2002. 159(8): 1420–1422.
Southwick S.M., Bremner J.D., Rasmusson A., Morgan C.A. 3rd, Arnsten A., Charney D.S. Role of norepinephrine in the pathophysiology and treatment of posttraumatic stress disorder // Biol. Psychiatry. 1999. V. 46. № 9. P. 1192–1204.
Strawn J.R., Geracioti T.D. Jr. Noradrenergic dysfunction and the psychopharmacology of posttraumatic stress disorder // Depress. Anxiety. 2008. V. 25. № 3. P. 260–271.
Suzuki A., Josselyn S.A., Frankland P.W., Masushige S., Silva A.J., Kida S. Memory reconsolidation and extinction have distinct temporal and biochemical signatures // J. Neurosci. 2004. V. 20. P. 4787–4795.
Taherian F., Vafaei A.A. Vaezi G.H., Eskandarian S., Kashef A., Rashidy-Pour A. Propranolol–induced impairment of contextual fear memory reconsolidation in rats: a similar effect on weak and strong recent and remote memories // Basic Clin. Neurosci. 2014. V. 5. № 3. P. 231–239.
Wang S.H. Novelty enhances memory persistence and remediates propranolol-induced deficit via reconsolidation // Neuropharmacology. 2018. V. 141. P. 42–54.
Wood N.E., Rosasco M.L., Suris A.M., Spring J.D., Marin M.F., Lasko N.B., Goetz J.M., Fischer A.M., Orr S.P., Pitman R.K. Pharmacological blockade of memory reconsolidation in posttraumatic stress disorder: three negative psychophysiological studies // Psychiatry Res. 2015. 225. № 1–2. P. 31–39.
Wu Y., Li Y., Yang X., Sui N. Differential effect of beta-adrenergic receptor antagonism in basolateral amygdala on reconsolidation of aversive and appetitive memories associated with morphine in rats // Addict Biol. 2014. V. 19. № 1. P. 5–15.
Wu Y., Li Y., Gao J., Sui N. Differential effect of NMDA receptor antagonist in the nucleus accumbens on reconsolidation of morphine -related positive and aversive memory in rats // Eur. J. Pharmacol. 2012. V. 674. № 2–3. P. 321–326.
Zaichenko M.I., Markevich V.A., Grigoryan G.A. Propranolol Degrades Memory Reconsolidation in Conditions of Single and Multiple Combinations of Tones with Pain // Neuroscience and Behavioral Physiology. 2017. V. 47. № 6. P. 722–777.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


