Успехи физиологических наук, 2020, T. 51, № 2, стр. 68-87
Динамика паттернов электрической активности мозга при нарушениях его функционального состояния
О. Е. Дик a, *, А. Д. Ноздрачев a, **
a ФГБУН Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: dickviola@gmail.com
** E-mail: a.d.nozdrachev@mail.ru
Поступила в редакцию 26.02.2019
После доработки 26.02.2019
Принята к публикации 26.02.2019
Аннотация
Обзор посвящен применению методов нелинейной динамики к анализу изменений, происходящих в паттернах электрической активности мозга человека, регистрируемой в виде электроэнцефалограммы при различных нарушениях функционального состояния центральной нервной системы. Показана возможность применения этих методов для определения состояний, непосредственно предшествующих эпилептическим разрядам при парциальной эпилепсии, для выявления степени патологических проявлений в нервной системе при сосудистой патологии мозга разной степени тяжести и при нарушениях сердечного ритма при мерцательной аритмии. Использование совокупности методов вейвлетного и мультифрактального анализа позволяет выявлять механизмы, лежащие в основе изменения структуры паттернов ЭЭГ при возникновении эпилептических разрядов.
ВВЕДЕНИЕ
Физиологические системы представляют собой сложные нелинейные и нестационарные динамические системы, способные генерировать автоколебания (биоритмы) и переключаться из одних режимов колебаний в другие под действием различных внутренних и внешних факторов. Нестационарность означает изменение структуры ритмов во времени, а нелинейность отражает тот факт, что небольшие изменения параметров системы могут вызывать значительные изменения в ее ответах (сигналах). Вариабельность и нестационарность физиологических ритмов рассматривается как динамическая сложность их временной организации [98].
Паттерны электрической активности мозга проявляют фрактальные свойства, т.е. демонстрирует некоторую повторяемость в широком диапазоне временных масштабов [93]. Однако эта повторяемость является не полной, а сохраняется на статистическом уровне, то есть фрактальность сигнала означает повторяемость после усреднения статистически независимых выборок временного ряда, описывающего определенный колебательный процесс [73]. В основе фрактальности физиологических ритмов лежит фрактальность длительностей открытых состояний ионных каналов и связанных с ними микротоковых флуктуаций одиночных ионных каналов, что приводит к флуктуациям интегральных ионных токов, формирующих ритмическое возбуждение нейрона и изменяющих состояния мембранных белков [5, 70, 99]. В некоторых работах паттерны ЭЭГ рассматриваются как монофракталы, т.е. описываются одним показателем скейлинга (фрактальной размерностью) [56, 84, 85]. В других работах паттерны ЭЭГ рассматриваются как мультифракталы. Это связано с тем, что в силу парадоксального сочетания кратковременной декорреляции в паттернах ЭЭГ, вызванных их зашумленностью, и долговременной корреляции, связанной с их фрактальной структурой, паттерны ЭЭГ могут иметь участки с различными локальными свойствами скейлинга [38, 39, 87, 88]. Мультифрактальность здорового мозга обнаружена в ЭЭГ, записанных во время выполнения сложных задач [88, 104], во время различных фаз сна [89], при эпилептическом повреждении [97].
С некоторой повторяемостью в широком диапазоне временных масштабов связано также понятие рекуррентности, которое означает возврат траектории колебательного процесса в окрестность точки, в которой она была ранее, при рассмотрении эволюции сигнала во времени [77]. Изучение фрактальных и рекуррентных характеристик паттернов ЭЭГ помогает выявлять характерные закономерности в этих паттернах для здорового человека и определять изменения в динамической сложности паттернов при возникновении различных патологических состояний.
Изменения в паттернах ЭЭГ при эпилептическом повреждении мозга
При анализе паттернов ЭЭГ при органическом повреждении мозга, связанном с наличием эпилептических локусов, прежде всего, возникает вопрос о возможности предсказания эпилептических приступов для их купирования. Различными авторами были предложены алгоритмы распознавания приближающихся пароксизмальных разрядов в ЭЭГ на основе вычисления таких параметров нелинейных временных рядов, как корреляционная размерность и ляпуновские экспоненты [65, 81, 103]. Для генерализованных форм эпилепсии на основе определения различий в структуре фазовых портретов ЭЭГ по мере приближения к приступу, была показана возможность выделения преиктального состояния за несколько минут до начала клинических проявлений приступа как по интракраниальной ЭЭГ, так и по ЭЭГ, регистрируемой с поверхности головы [65, 68]. Однако, несмотря на значительные успехи в исследованиях нелинейной динамики эпилептических паттернов [55, 64, 66, 67, 69, 71, 91], споры о возможности заранее предсказать приступ продолжаются. Это связано с тем, что в последующих работах было показано снижение возможности распознавания приближающихся пароксизмальных разрядов вследствие чувствительности предложенных алгоритмов к амплитуде ЭЭГ [53, 62] и появления ложного распознавания при рандомизации исходной ЭЭГ, т.е. было показано, что корреляционная размерность рандомизированной и исходной ЭЭГ практически не отличаются [53, 62]. В связи с этим актуальными оказались исследования возможности использования вейвлетных или фрактальных особенностей паттернов ЭЭГ для предсказания эпилептоформной активности, в частности, для случая негенерализованной эпилепсии. Отметим, что, в отличие от приступов генерализованной эпилепсии, простые парциальные приступы не всегда связаны с наличием визуально обнаруживаемых иктальных изменений в ЭЭГ, регистрируемой с поверхности головы [42]. Поэтому автоматическое обнаружение прекурсоров эпилептических разрядов в случае парциальной эпилепсии может быть не связано с появлением в эпилептоформной активности четкой структуры комплекса “спайк–медленная волна” с гармониками фундаментальной частоты и тенденцией их уменьшения в конце эпилептического разряда, как это показано, например, для абсанс-эпилепсии на основе изучения вейвлетных свойств ЭЭГ [26, 54, 96]. Сравнительное исследование изменений в вейвлетных спектрах и в степени мультифрактальности паттернов ЭЭГ больных парциальной симптоматической эпилепсией до, во время и после эпилептических разрядов, а также в периоды их отсутствия проведено в работах [43, 44].
Вейвлетный анализ реактивных паттернов ЭЭГ при сосудистой патологии мозга разной степени выраженности
Изменения в паттернах ЭЭГ, происходящие при нарушении функционального состояния мозга вследствие сосудистых заболеваний, часто неспецифичны и разнообразие этих изменений намного выше, чем в случаях тяжелых органических поражений мозга, приводящих к хорошо выявляемым очаговым нарушениям и пароксизмальным формам ЭЭГ [13, 18]. Именно отсутствие специфичности в паттернах ЭЭГ при диффузной активности, связанной с сосудистой патологией мозга, существенно затрудняет ее анализ. В связи с этим наряду с анализом фоновых паттернов ЭЭГ, в клинике используется анализ реактивных паттернов при функциональной нагрузке, например, ритмической фотостимуляции. Ритмические световые раздражения могут вызвать ответы в проекционной зрительной коре в виде отдельных затылочных спайков или перестройку электрической активности мозга в соответствии с частотой, равной или кратной частоте подаваемых вспышек (феномен усвоения ритма световых импульсов) [6, 8, 27]. При этом ответы на ритмическую фотостимуляцию в виде воспроизведения или отвержения предложенного ритма связаны с уровнем психоэмоциональной возбудимости [29]. Известно, что для здорового человека характерна относительно слабая реакция усвоения ритма световых импульсов в полосе собственных частот ЭЭГ от 8 до 20 Гц, или отсутствие усвоения ритма [40, 101]. Критерием патологии при оценке реакции фотостимуляции считается расширение диапазона усвоения ритма в сторону как более низких (<8 Гц), так и более высоких (>20 Гц) частот [22, 23, 49].
Выраженность реакции мозга на ритмическую фотостимуляцию определяется состоянием специфических проводящих путей от сетчатки глаза через таламические ядра в кору и возбудимостью нейронов коры [9, 23, 28, 101]. При анализе реакции на фотостимуляцию основное внимание обычно уделяется выявлению фотопароксизмальных паттернов с низкими частотами, что указывает, как правило, на патологические изменения функционального состояния нервной системы [58, 95]. Возникновение паттернов в диапазоне бета частот может также указывать на нарушение функционального состояния [41]. Отмечается также, что пониженный или, наоборот, гиперсинхронизированный альфа-ритм может отражать некоторые функциональные изменения в центральной нервной системе [34].
Значительное внимание в настоящее время уделяется диагностике изменений в возбудимости коры в ответ на ритмическую транскраниальную магнитную стимуляцию [33]. Однако данные о таких изменениях и влиянии серии стимулов разной длительности и частоты противоречивы [33, 50]. Показано также отсутствие значительных изменений в возбудимости коры при различных условиях стимуляции [50]. Анализ нелинейной динамики паттернов ЭЭГ при воздействии ритмической фотостимуляции при нарушениях деятельности ЦНС функционального генеза (цереброваскулярные нарушения, вегетативные дисфункции, вазомоторная головная боль) может иметь большое значение для клинической практики, поскольку количественное определение степени психоэмоциональной возбудимости на основании реакции мозга на ритмическую фотостимуляцию может позволить избежать назначения препаратов, имеющих побочный эффект гиперактивации нервной системы.
Для анализа изменений в реактивных паттернах и нахождения количественных показателей, определяющих возможности здорового и больного мозга воспроизводить внешний ритм различных частот используются методы вейвлетного и мультифрактального анализа ЭЭГ в состоянии покоя и при воздействии ритмической фотостимуляции [24, 45, 46].
Нелинейная динамика паттернов ЭЭГ при нарушении сердечного ритма
В многочисленных наблюдениях установлено, что существует прямая связь между нарушением деятельности сердечно-сосудистой и нервной систем [60, 78, 79]. При этом отмечается четкая зависимость степени снижения когнитивных функций ЦНС от времени существования нарушения сердечного ритма, т.е. от постоянной или пароксизмальной форм фибрилляции предсердий [61, 86, 92, 102]. Отмечается также, что фибрилляция предсердий увеличивает риск снижения когнитивных функций и развития деменции независимо от клинически явного инсульта и базовой когнитивной функции [48, 63]. В связи с этим количественная оценка функционального состояния нервной системы на основе анализа нелинейной динамики паттернов ЭЭГ у пациентов с мерцательной аритмией может помочь выявить степень патологических проявлений в ЦНС. В работах [10, 47] методы вейвлетного и рекуррентного анализа успешно применены для выявления различий в реакции усвоения ритма фотостимуляции у лиц с различными формами мерцательной аритмии.
Рассмотрим методы вейвлетного, мультифрактального и рекуррентного анализа, которые позволяют определять динамические изменения в структуре паттернов ЭЭГ при нарушениях функционального состояния ЦНС.
ПРЕИМУЩЕСТВЕННО ИСПОЛЬЗУЕМЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Вейвлет-анализ паттернов ЭЭГ
Вейвлет-анализ нашел широкое применение при исследовании изменений в ЭЭГ мозга [12, 17, 35–37, 94] и ЭКГ сердца [2, 4, 20, 30, 57, 80]. Этот метод позволяет разложить сигнал x(t) по набору копий одной функции – базисного вейвлета, которая растягивается во времени и сдвигается на некоторое расстояние [11]:
В качестве базисного вейвлета обычно применяется комплексный вейвлет Морле c центральной частотой вейвлета ω0 = 2π, в силу чего вейвлет-преобразование сигнала x(t) определяется:
Величина квадрата модуля вейвлет-преобразования |W(f, t0)|2 задает локальный вейвлетный спектр энергии паттерна ЭЭГ в момент времени t0, т.е. мгновенное распределение энергии по частотам f. Этот спектр характеризует локализацию определенной частоты по времени ее возникновения в сигнале. После интегрирования локального спектра по времени [t1, t2] получается глобальный вейвлетный спектр
Вейвлетный анализ позволяет по вейвлетному спектру или его проекции, по осям которой отложены время и частота, определять частотно-временную структуру сигнала и различать, например, сигналы, несущие две частоты одновременно или несущие эти же частоты, но в разные моменты времени.
Вейвлет-когерентность двух сигналов
Для сравнения динамики двух сигналов y(t) и x(t) используются кросс-вейвлетный спектр
определяющий соотношения между сигналами в определенные моменты времени [74], и вейвлет-когерентность этих сигналов [52]:Cимвол S обозначает предварительное сглаживание сигнала до применения к нему вейвлет-преобразования с целью улучшения частотно-временного разрешения и определения статистической значимости [74]. Вейвлет-когерентность WC может принимать значения от 0 до 1 и определяет локальные корреляции между двумя сигналами; при этом чем ближе значение WC к 1, тем более коррелированы сигналы. Под термином “когерентность” понимается согласованное протекание во времени колебательных процессов. Статистически значимая вейвлет-когерентность вычисляется с использованием теста, в котором исходный сигнал рандомизируется по методу Монте-Карло и статистический уровень значимости каждой частоты в сигнале оценивается по нескольким рандомизированным реализациям [52].
Вейвлетный анализ паттернов ЭЭГ при ритмической фотостимуляции
Рассмотрим алгоритм анализа реакции мозга на фотостимуляцию, предложенный в работе [3]. Световой сигнал аппроксимируется на интервале времени последовательностью k гауссовых импульсов, следующих друг за другом с частотой fC. Каждый импульс имеет ширину rO = 10 мс, а центры импульсов расположены в точках ${{t}_{j}} = {{t}_{{\text{A}}}} + {j \mathord{\left/ {\vphantom {j {{{f}_{c}}}}} \right. \kern-0em} {{{f}_{c}}}},$ $j = 0,...,k - 1,$ где tA – время начала первого импульса в последовательности. Тогда световой сигнал описывается функцией [3]:
Непрерывное вейвлет–преобразование такого сигнала p(t) с использованием вейвлета Морле определяется функцией:
Для того чтобы исследовать динамику увеличения и спада энергии фрагмента ЭЭГ во время действия фотостимула, рассмотрим интегральное распределение энергии вейвлетного спектра этого фрагмента в узком диапазоне частот [fС – Δf, fС + Δf] вокруг частоты фотостимуляции fC:
Разность времени tm достижения максимума вейвлетного спектра ЭЭГ и времени t1 первого пересечения интегрального распределения ЭЭГ $e({{t}_{0}}) = {{E({{t}_{0}})} \mathord{\left/ {\vphantom {{E({{t}_{0}})} {{{E}_{{\max }}}({{t}_{0}})}}} \right. \kern-0em} {{{E}_{{\max }}}({{t}_{0}})}}$ с интегральным распределением фотостимула Tinсr = tm – t1 характеризует время запоминания внешнего ритма, т.к. чем меньше эта величина, тем быстрее реакция усвоения ритма [3].
Величину коэффициента удержания ритма заданной частоты (kH) можно оценить по второму пересечению интегральных распределений исследуемого сигнала ЭЭГ и сигнала фотостимула: kH = eH. Чем меньше эта величина, тем слабее удерживается ритм данной частоты в исследуемом паттерне ЭЭГ.
Коэффициент усвоения ритма (kR) в частотном диапазоне [fС – Δf, fС + Δf] может быть определен как отношение максимумов глобальных вейвлетных спектров ЭЭГ во время и до действия фотостимула частоты fC : ${{k}_{{\text{R}}}} = {{E}_{{\max }}}{{{{{(f)}}_{{{\text{during}}}}}} \mathord{\left/ {\vphantom {{{{{(f)}}_{{{\text{during}}}}}} {{{E}_{{\max }}}}}} \right. \kern-0em} {{{E}_{{\max }}}}}{{(f)}_{{{\text{before}}}}}$. При этом значение kR < 1 означает отсутствие нарастания энергии вейвлетного спектра при действии светового сигнала.
Изменения в паттернах ЭЭГ под влиянием ритмической фотостимуляции можно отнести к типу event-related модуляций ЭЭГ [82], поэтому вейвлетный анализ, который дает возможность увидеть не только распределение энергии паттерна по частотам, но и моменты времени, в которые происходят быстрые модуляции частот, оказывается чрезвычайно полезным. При этом, в отличие от оконного преобразования Фурье, вейвлет- анализдает возможность однозначно определить коэффициенты, характеризующие реакцию усвоения ритмической фотостимуляции в анализируемом паттерне ЭЭГ [46].
Мультифрактальный анализ паттернов ЭЭГ
Мультифрактальный анализ позволяет оценить фрактальные свойства сигналов, т.е. определять наличие сходства между сигналом и его отдельными фрагментами. Оценка степени фрактальности важна для исследования флуктуаций ритмов мозга [105].
Для функции, обладающей свойством фрактальности, справедливо следующее соотношение:
где показатель степени H, называемый экспонентой Херста, характеризует нерегулярность функции g(x) в окрестности точки x0. Чем меньше величина H, тем более сингулярна (менее гладкая) функция [21]. Фрактальная размерность D сигнала связана с показателем Херста H простым соотношением: D = 2 – H. Для надежного вычисления фрактальной размерности требуется большой временной ряд, а ЭЭГ при длительной записи может многократно менять характер своего поведения. Поэтому вычисленная фрактальная размерность будет характеризовать некоторую усредненную динамику исследуемого сигнала. В этом смысле для описания динамических изменений в структуре ЭЭГ лучше подходит концепция мультифрактальности, в которой мультифрактальный сигнал характеризуется не одной, а целым спектром фрактальных размерностей.Метод мультифрактального анализа основан на поиске локальных максимумов вейвлетного спектра и определения скорости уменьшения вейвлет-коэффициентов при уменьшении частоты f [83]. Чем быстрее уменьшаются вейвлет-коэффициенты при больших значениях частот f и, соответственно, при a → 0, тем более регулярен сигнал в окрестности точки t0. Медленное уменьшение вейвлет-коэффициентов при a → 0 в окрестности точки t0 свидетельствует о наличии сингулярности (особенности в виде изрезанности сигнала) в этой точке [83]. Таким образом, поиск локальных максимумов вейвлетного спектра и скорости уменьшения вейвлет-коэффициентов при уменьшении частоты f позволяет определять наличие или отсутствие сингулярностей сигнала.
Степень сингулярности сигнала x(t) в точке t0 описывается экспонентой Гельдера, h(t0), т.е. наибольшей экспонентой, при которой анализируемый сигнал может быть представлен суммой двух компонент: полинома Pn(t), описывающего регулярное поведение анализируемого сигнала и слагаемого, описывающего его нерегулярное поведение [21]:
В силу простой зависимости $W(a,{{t}_{0}})\sim {{a}^{{h({{t}_{0}})}}}$ при a → 0 [32], экспонента Гельдера может быть вычислена следующим образом: $h({{t}_{0}})\sim \frac{{{{{\log }}_{{10}}}W(a,{{t}_{0}})}}{{{{{\log }}_{{10}}}a}}.$
Однако при возрастании величины a влияние соседних сингулярностей может приводить к неточности вычисления, поэтому экспонента Гельдера вычисляется на основании статистического описания локальных сингулярностей с помощью частичных функций Z(q, a), которые строятся по методу поиска максимумов модулей вейвлет-коэффициентов [32].
Алгоритм оценивания мультифрактальности сигнала по методу поиска максимумов модулей вейвлет-коэффициентов состоит из следующей последовательности процедур:
1) Применяется вейвлет-преобразование исследуемого сигнала x(t).
2) Для каждого значения a находится множество L(a) линий локальных максимумов модулей вейвлет-коэффициентов (линий, для которых выполняется условие $\frac{{\partial \left| {W(a,{{t}_{0}})} \right|}}{{\partial t}} = 0$).
3) Вдоль каждой линии для значений масштабов, меньших заданного значения a, вычисляются частичные функции Z(q, a) как сумма q степеней максимумов модулей вейвлет коэффициентов вдоль каждой линии на масштабах, меньших заданного значения а (обобщенные статистические суммы):
4) В силу того, что при a → 0 частичная функция $Z(q,a)\sim {{a}^{{\tau (q)}}}$ [32], скейлинговая экспонента τ(q) находится следующим образом
4) Выбирая различные значения степени q, можно получить линейную или нелинейную зависимость τ(q), что дает постоянное значение экспоненты Гельдера $h(q) = {\text{const}}$ для монофрактальных сигналов или большое число экспонент $h(q)$ = ${{d\tau (q)} \mathord{\left/ {\vphantom {{d\tau (q)} {dq}}} \right. \kern-0em} {dq}} \ne {\text{const}}$ для мультифрактальных сигналов, и получить распределение экспонент Гельдера, называемое спектром сингулярности:
Ширина этого спектра ∆h характеризует степень мультифрактальности анализируемого сигнала: чем больше величина Δh, тем выше степень его мультифрактальности.
Основной вклад в спектр сингулярности D(h) при q > 0 дают паттерны, проявляющие большие флуктуации, а при q < 0 доминируют паттерны с малыми флуктуациями [83, 106].
Положение спектра сингулярности D(h) дает информацию о степени коррелированности последовательных значений сигнала, так как величины h < 0.5 соответствуют антикоррелированной динамике, а величины h > 0.5 – коррелированной динамике, поэтому в целом сигнал является более гладким во втором случае, чем в первом [105]. Коррелированность последовательных значений сигнала означает, что с большей вероятностью за большим значением сигнала следует большее, и наоборот. В случае, если динамика является одновременно и коррелированной, и антикоррелированной, спектр сингулярности будет находиться в интервалах значений и h < 0.5, и h > 0.5.
Как отмечается в работах [21, 32, 83, 106], мультифрактальный анализ, являясь методом локального исследования временной структуры сигнала, позволяет оценивать его корреляционные свойства даже при сравнительно не очень длинной регистрации сигнала, что является несомненным преимуществом этого метода нелинейной динамики.
Метод рекуррентного анализа
Метод совместного рекуррентного анализа позволяет визуализировать определенные закономерности в паттернах двух сигналов, полученных от различных физических источников [76, 77]. В основе метода лежит построение и анализ совместной рекуррентной диаграммы этих сигналов. Совместная рекуррентная диаграмма является графическим представлением матрицы
Фазовые траектории состояний z(t) и y(t) получаются из исходных временных рядов {x(t)} и {p(t)} методом временных задержек [100]: y(t) = (x(t), x(t + d), …, x(t + (m – 1)d), где d – временная задержка, m – размерность вложения (минимальная размерность пространства, в котором восстановленная траектория воспроизводит свойства исходной траектории). Оптимальная временная задержка d находится на основании поиска первого минимума функции взаимной информации [51]. Оптимальная размерность вложения m определяется методом поиска минимума ближайших ложных соседей [59]. Величина ε-ошибки выбирается равной 1% от величины стандартного отклонения анализируемого сигнала [76].
Рекуррентные диаграммы показывают структурные свойства паттернов анализируемых сигналов и изменения в паттернах на протяжении их регистрации. Наличие диагональных линий, параллельных линии, проходящей под углом 45°, говорит о сходстве паттернов в различные времена: чем длиннее линии, тем больше сходства между сигналами [77].
На основании анализа совместной рекуррентной диаграммы можно определить численные показатели: L – среднюю длину диагональных линий в совместной рекуррентной диаграмме, скорость возврата (recurrence rate) RR и время возврата τ (рекуррентное время, необходимое для возврата значения сигнала в ε окрестность точки, в которой оно было ранее) [75, 77, 90].
ИЗМЕНЕНИЯ В ПАТТЕРНАХ ЭЭГ ПРИ ЭПИЛЕПТИЧЕСКОМ ПОВРЕЖДЕНИИ МОЗГА
Вейвлетные спектры паттернов ЭЭГ человека при эпилептическом повреждении мозга
Рассмотрим паттерны ЭЭГ, полученные для пациента, страдающего парциальной эпилепсией височной доли мозга, полученные в различных экспериментальных условиях (“закрытые глаза” и “гипервентиляция”) (рис. 1а). Гипервентиляционная нагрузка приводят к небольшому увеличению амплитуды паттерна по сравнению с исходным состоянием закрытых глаз. Распределение энергии ${{\left| {W(a,{{t}_{0}})} \right|}^{2}}$ этих паттернов по частотам показывает наличие множества частот в диапазоне от 1 до 16 Гц с преимущественными максимумами в пределах от 2 до 8 Гц (рис. 1б). Паттерны ЭЭГ и вейвлетный спектр во время эпилептического разряда для того же пациента представлены на рис. 1г, д. Иктальный период характеризуется значительным повышением амплитуды паттерна по сравнению с преиктальным и постиктальным периодами и имеет преимущественную локализацию максимумов частот в диапазоне от 2 до 7 Гц (рис. 1д).
Рис. 1.
Паттерны ЭЭГ и распределения энергии ${{\left| {W(a,{{t}_{0}})} \right|}^{2}}$ вейвлетных спектров паттернов ЭЭГ пациента с эпилептическим повреждением височной доли мозга для различных экспериментальных условий (“закрытые” глаза” и “гипервентиляция”) (отведение T4) (а–в). Вейвлетные спектры в преиктальном, иктальном и постиктальном периодах того же пациента) (д–ж).
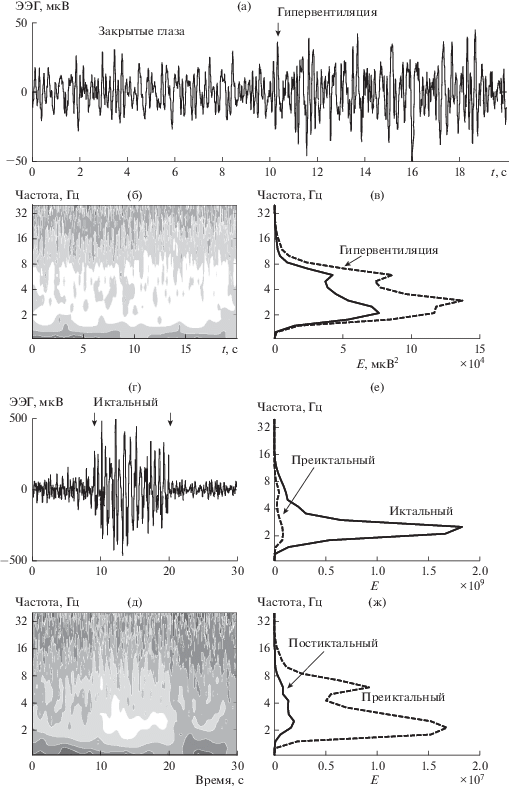
В преиктальный период, непосредственно предшествующий эпилептическому разряду, наблюдается значительное повышение энергии вейвлетного спектра (Emax = 1.1 × 108, рис. 1б) и еще большее увеличение значения Emax происходит в иктальный период (Emax = 2 × 109). Подобная динамика параметра Emax во время развития эпилептического повреждения наблюдается в паттернах ЭЭГ всех пациентов в отведениях, соответствующих зонам доминатного повреждения мозга [43, 44].
Мультифрактальные характеристики паттернов ЭЭГ человека при эпилептическом повреждении мозга
Рассмотрим мультифрактальные характеристики паттернов ЭЭГ при парциальной эпилепсии височной доли мозга. Усредненные зависимости экспоненты Гельдера от момента q (кривые h(q)) и cпектры сингулярности D(h) для различных состояний больного эпилепсией представлены на рис. 2. Форма кривых указывает на то, что во всех состояниях паттерны ЭЭГ проявляют мультафрактальные свойства, т.е. описываются набором экспонент h(q), зависящих от момента q. Для монофрактального сигнала спектр сингулярности вырождался бы в точку. Особенностью анализируемых сигналов является преобладающее влияние слабых флуктуаций (при q < 0), в то время как при сильных флуктуациях (при q > 0) значения h близки к нулю (рис. 2а). Влияние слабых флуктуаций последовательных значений ЭЭГ усиливается в периоде, предшествующем эпилептиформной активности, поэтому спектр сингулярности расширяется в сторону больших значений экспонент Гельдера. В иктальном периоде (во время эпилептического разряда) сильные флуктуации практически отсутствуют (h ~ 0 при q > 0) и влияние слабых флуктуаций еще более нарастает, вызывая дальнейшее расширение спектра сингулярности, т.е. дальнейшее увеличение степени мультифрактальности (рис. 2б). В постиктальном периоде (после эпилептического разряда) ширина спектра сингулярности значительно уменьшается за счет уменьшения влияния слабых флуктуаций. Таким образом, экспоненты Гельдера отличаются до, во время и после эпилептического разряда. Эти различия возникают за счет слабых флуктуаций (q < 0).
Рис. 2.
Зависимости экспонент Гельдера h(q) и спектры сингулярности D(h) для различных функциональных состояний пациента с эпилептическим повреждением височной доли мозга (отведение T3).

При отсутствии эпилептических разрядов динамика ЭЭГ больного парциальной эпилепсией практически не отличима от динамики ЭЭГ здорового мозга и является антикоррелированной (h < 0.5) (рис. 2б). В период, предшествующий эпилептиформной активности, исходный спектр сингулярностей расширяется, и динамика последовательных значений ЭЭГ становится как антикоррелированной (при h < 0.5), так и коррелированной (при h > 0.5). Следовательно, в преиктальный период происходят перестройки, ведущие к возникновению коррелированности последовательных значений ЭЭГ. Это и является причиной роста амплитуды ЭЭГ в иктальный период. Таким образом, мультифрактальный анализ позволяет определить механизм изменений динамической сложности паттернов ЭЭГ при возникновении эпилептического разряда и установить, какие структурные перестройки приводят к увеличению степени мультифрактальности и значительному росту амплитуды сигнала в иктальный период.
Подобная динамика мультифрактальных параметров наблюдается не менее чем для 83% лиц с преимущественными повреждениями коры в височной доле головного мозга, что позволяет усреднить сегменты ЭЭГ различных больных для одинаковых функциональных состояний для того, чтобы выявить различия между этими состояниями [43, 44].
В табл. 1 приведены средние значения максимума глобальной энергии Emax и ширины спектра сингулярностей ∆h. Усреднение проведено по данным для 5 пациентов с левосторонней и 6 пациентов с правосторонней височной эпилепсией. Значимые отличия в параметрах ∆h и Emax определялются как для периода, в котором наблюдается эпилептическое повреждение, и предшествующего ему периода, например, для отведения T3 (∆h = 1.37 ± 0.15, Emax = (430 ± 35) × 105 и ∆h = 1.15 ± 0.11, Emax = (10.5 ± 2.6) × 105, p = 0.005), так и для периодов до и после повреждения (∆h = 1.15 ± 0.11, Emax = (10.5 ± 2.6) × 105 и ∆h = 0.51 ± 0.05, Emax = = (1.71 ± 0.29) × 105, p = 0.009, тест Манна–Уитни) для этого же отведения.
Таблица 1.
Сравнение средних значений мультифрактальных и вейвлетных параметров
| Ширина спектра мультифрактальности ∆h | ||||
|---|---|---|---|---|
| левосторонняя височная эпилепсия (N = 5 из 6) |
правосторонняя височная эпилепсия (N = 6 из 7) | |||
| Отведение | T3 | T5 | T4 | T6 |
| Закрытые глаза | 0.49 ± 0.05 | 0.53 ± 0.05 | 0.51 ± 0.05 | 0.46 ± 0.05 |
| Преиктальный период | 1.15 ± 0.11 | 0.89 ± 0.09 | 0.75 ± 0.06 | 1.09 ± 0.10 |
| Иктальный период | 1.37 ± 0.15 | 1.03 ± 0.11 | 0.98 ± 0.09 | 1.25 ± 0.13 |
| Постиктальный период | 0.51 ± 0.05 | 0.39 ± 0.03 | 0.23 ± 0.03 | 0.46 ± 0.07 |
| Максимум глобального вейвлетного спектра Emax*105 | ||||
| левосторонняя височная эпилепсия | правосторонняя височная эпилепсия | |||
| Отведение | T3 | T5 | T4 | T6 |
| Закрытые глаза | 0.8 ± 0.07 | 1.7 ± 0.9 | 2.8 ± 0.2 | 1.5 ± 0.6 |
| Преиктальный период | 10.5 ± 2.6 | 25 ± 5 | 21 ± 4 | 17 ± 3 |
| Иктальный период | 430 ± 35 | 578 ± 51 | 963 ± 85 | 1430 ± 135 |
| Постиктальный период | 1.71 ± 0.29 | 3.7 ± 0.7 | 2.3 ± 0.5 | 4.9 ± 0.8 |
Несмотря на вариабельность в значениях параметров, полученных для разных электродных отведений, во всех рассмотренных отведениях обнаруживаются значимые статистические различия (p < 0.05) между состояниями в пре- и постиктальные периоды для пациентов с левосторонней или правосторонней височной эпилепсией. Следовательно, изменения в рассмотренных параметрах позволяют достоверно различать пре- и постиктальные состояния в случае симптоматической парциальной эпилепсии с локализацией эпилептогенного очага в височной доле. Таким образом, в работах [43, 44] показано, что при нарушениях функционального состояния мозга при парциальной эпилепсии в структуре паттернов ЭЭГ происходят изменения, отражающиеся в изменениях вейвлетных и мультифрактальных характеристик паттернов. Выполненные вейвлет-анализ и мультифрактальный анализ паттернов ЭЭГ в отведениях на стороне преимущественного повреждения коры у больных парциальной симптоматической эпилепсией раздельно для сегментов “до эпилептического разряда”, “во время разряда” и “после разряда”, демонстрируют возможность не только отличить состояние, в котором наблюдается эпилептиформная активность, но и различить состояния до и после разряда.
Отметим, что в отличие от алгоритмов распознавания приближающихся пароксизмальных разрядов в ЭЭГ на основе вычисления корреляционной размерности и ляпуновских экспонент, метод мультифрактального анализа не чувствителен к амплитуде сигнала, т.е. степень мультифрактальности не зависит от амплитуды ЭЭГ.
Вторым важным преимуществом метода мультифрактального анализа является то, что рандомизация ЭЭГ приводит к нарушению корреляций последовательных значений и, следовательно, к потере мультифрактальности паттерна. Например, на рис. 3 представлен сигнал ЭЭГ и его рандомизированный вариант, полученный по методу amplitude adjusted Fourier transform с сохранением распределений амплитуд сигнала и его суррогатного варианта, однако нарушение корреляций в суррогате приводит к потере мультифрактальности. Это доказывает, что наличие корреляций является внутренним свойством этого сигнала и объясняет то, что ложное распознавание приближающихся пароксизмальных разрядов в ЭЭГ на основе вычисления степени мультифрактальности паттерна при рандомизации ЭЭГ исключено, так как степень мультифрактальности рандомизированной и исходной ЭЭГ будет отличаться.
ВЕЙВЛЕТНЫЙ АНАЛИЗ РЕАКТИВНЫХ ПАТТЕРНОВ ЭЭГ ПРИ СОСУДИСТОЙ ПАТОЛОГИИ МОЗГА РАЗНОЙ СТЕПЕНИ ВЫРАЖЕННОСТИ
У пациентов с сосудистой патологией мозга разной степени выраженности (начальные проявления в виде вегето-сосудистой дистонии, более выраженные проявления в результате гипертонической болезни и вертебрально-базилярной недостаточности, обусловленной шейным остеохондрозом) визуально выделяются несколько основных типов фоновых паттернов ЭЭГ, отражающих динамическую неустойчивость функционального состояния ЦНС [24]. Первый тип характеризуется доминирующим альфа-ритмом, что свидетельствовует о нормальных корково-подкорковых взаимоотношениях и регистрируется у лиц с вегето-сосудистой дистонией. Для второго типа характерен альфа-ритм с разной степенью его “разрушения” тета-, дельта- и бета-составляющими. Подобный тип отмечается у лиц, страдающих гипертонической болезнью. Третий тип характеризуется значительным снижением индекса альфа-ритма вплоть до полного его отсутствия, что типично для лиц с вертебрально-базилярной недостаточностью. Второй и третий типы отражают разный уровень функционального нарушения корково-подкорковых взаимоотношений [23].
В локальных вейвлетных спектрах ЭЭГ здорового человека обнаруживается значительное количество максимумов в диапазоне альфа-ритма, и их величины (~4 × 104) в 10 раз превышают максимумы (~5 × 103), полученные для лиц сосудистой патологией. Особенностью фоновых паттернов в группе пациентов с гипертонической болезнью является наличие максимумов в тета- и альфа-диапазонах а для лиц с вертебрально-базилярной недостаточностью – в дельта- и тета-диапазонах [44].
Рассмотрим далее, какие изменения происходят в паттернах ЭЭГ при ритмической фотостимуляции. Примеры отсутствия реакции усвоения ритма частоты 8 Гц и наличия реакции усвоения ритма частоты 10 Гц в паттернах ЭЭГ здорового человека показаны на рис. 4а–4г. В случае отсутствия усвоения заданной частоты фотостимула интенсивность окраски полосы проекции вейвлетной поверхности (t0, f, |W(f, t0)|2) на плоскость (t0, f), задающей локальный вейвлетный спектр, максимальна до начала действия фотостимула (рис. 4а), а при наличии усвоения максимумы этих полос находятся внутри интервала действия стимула (рис. 4в). При отсутствии усвоения во время действия фотостимула не происходит роста энергии вейвлетного спектра E(t0)/Emax(t0) паттерна ЭЭГ, по сравнению с энергией паттерна до начала фотостимуляции (рис. 4б). Таким образом, наличие реакции усвоения ритма в паттерне ЭЭГ оценивается по нарастанию энергии глобального вейвлетного спектра вблизи частоты фотостимуляции и увеличению нормированного интегрального распределения энергии вейвлетного спектра паттерна ЭЭГ время действия фотостимула.
Рис. 4.
Отсутствие усвоения ритма частоты 8 Гц и наличие усвоения частоты 10 Гц в паттернах ЭЭГ здорового человека (а–г). Медленное нарастание энергии спектра и значительное удержание ритма частоты 8 Гц у пациента из группы с вегето-сосудистой дистонией (д, е). Быстрое нарастание энергии спектра и слабое удержание ритма частоты 8 Гц у пациента из группы с вертебрально-базилярной недостаточностью (ж, з). Проекции вейвлетных спектров |W(f, t0)|2 (а, в, д, ж) и нормированные интегральные распределения энергии вейвлетных спектров E(t0)/Emax(t0) паттерна и фотостимула (сплошная и штрихпунктирная линия соответственно, б, г, е, з).
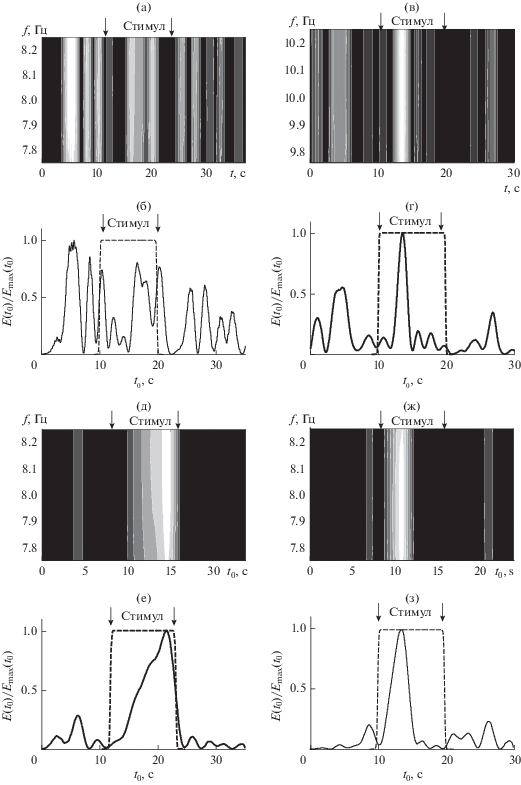
Пример выраженной реакции на частоту 8 Гц с медленным нарастанием энергии спектра вблизи частоты фотостимуляции во время действия фотостимула и значительным удержанием ритма этой частоты в паттерне ЭЭГ у человека из группы с вегето-сосудистой дистонией показан на рис. 4д, е. Быстрое нарастание энергии спектра и слабое удержание ритма этой же частоты у пациента из группы с вертебрально-базилярной недостаточностью представлено на рис. 4ж, з.
Для здоровых лиц значение параметра kR < 1 во всех частотных диапазонах, что означает отсутствие нарастания энергии во время фотостимуляции. Небольшое увеличение энергии обнаруживается только для частоты 10 Гц. Для лиц из группы с вегето-сосудистой дистонией усвоение ритма частот дельта-диапазона отсутствует, частоты этого диапазона усваиваются в паттернах ЭЭГ групп пациентов с гипертонической болезнью и вертебрально-базилярной недостаточностью. Частоты тета-, альфа- и бета-диапазонов усваиваются в паттернах ЭЭГ всех тестируемых групп с сосудистой патологией [46]. Таким образом, вейвлетный анализ электрической активности мозга во время ритмической фотостимуляции позволяет определить количественные динамические изменения, происходящие в вейвлетных спектрах.
Ответы мозга на ритмическую фотостимуляцию определяют состояние баланса процессов возбуждения и торможения [22, 29, 34, 41]. Характерное для здоровых лиц отсутствие реакции усвоения ритма, связанное с отсутствием нарастания энергии вейвлетного спектра вблизи частоты фотостимуляции, отражает сбалансированность процессов возбуждения и торможения, устойчивость корково-подкорковых взаимоотношений и преобладание внутренней синхронизации нейронных структур здорового мозга при навязывании внешнего ритма. Наличие выраженной реакции усвоения ритмов фотостимуляции практически во всем диапазоне предлагаемых частот свидетельствует о повышении процесса возбуждения [22, 23, 29].
В табл. 2 дана обобщенная оценка реакции усвоения ритма и распределение групп по стадиям неустойчивости нейродинамических процессов и степени психоэмоциональной возбудимости. Наиболее характерное усвоение частот бета-диапазона для лиц с вегето-сосудистой дистонией связано с возникновением начальной стадии развития неустойчивости нейродинамических процессов в результате появления в центральной нервной системе патологического очага возбуждения [19, 23]. Для лиц с гипертонической болезнью и вертебрально-базилярной недостаточностью максимум усвоения приходится на альфа- и тета- диапазон, соответственно, для этих групп характерны также большие значения всех показателей реакции усвоения, что, вероятно, связано с вовлечением большего количества нейронных ансамблей в патологический процесс возбуждения и повышением степени психоэмоциональной возбудимости пациента.
Таблица 2.
Оценка реакции усвоения ритма при сосудистой патологии разной степени тяжести
| Вегето-сосудистая дистония (N = 15 из 16) |
Гипертоническая
болезнь (N = 13 из 14) |
Вертебрально-базилярная недостаточность (N = 11 из 12) |
|
|---|---|---|---|
| Диапазон усвоения | Тета, альфа, бета | Весь | Весь |
| Максимум | Бета (kR ~130 ) | Альфа (kR ~800) | Тета (kR ~1400) |
| Удержание ритма | Незначительное (kH~0.25) |
Значительное (kH~0.78) |
Сильное (kH~0.92) |
| Нарастание энергии | Быстрое (Tinсr ~2.5 с) | Быстрое (Tinсr ~3.5 с) | Медленное (Tinсr ~8 с) |
| Стадия неустойчивости нейродинамики | Начальная | Вторaя | Третья |
| Степень психоэмоциональной возбудимости | Незначительная | Высокая | Очень высокая |
Таким образом, мозг здорового человека представляет собой чрезвычайно устойчивую динамическую систему, лабильно реагирующую на внешние сигналы, что не вызывает ее перевозбуждения [24, 46]. Различные нарушения функционального состояния нервной системы в результате сосудистой патологии головного мозга проявляют себя как особенности мозга отвечать несколько отличным образом на определенную функциональную нагрузку. Повышение степени выраженности сосудистой патологии мозга коррелирует с повышением показателей реакции усвоения ритма предложенной частоты и уровнем психоэмоциональной возбудимости. Оценка степени психоэмоциональной возбудимости при разной степени выраженности сосудистой патологии может оказаться полезной в клинической практике для выбора адекватного лечения медленно прогрессирующей недостаточности кровоснабжения мозга и избежать назначения в процессе терапии лекарственных препаратов, приводящих к повышению процессов возбуждения больным, показывающим значительное нарастание энергии вейвлетного спектра в процессе ритмической фотостимуляции.
ВЕЙВЛЕТНЫЙ АНАЛИЗ РЕАКТИВНЫХ ПАТТЕРНОВ ЭЭГ ПРИ ФИБРИЛЛЯЦИЯХ ПРЕДСЕРДИЙ ПАРОКСИЗМАЛЬНОГО И ПОСТОЯННОГО ТИПА
Вейвлетный анализ паттернов ЭЭГ при мерцательной аритмии
Световой сигнал частоты 8 Гц и соответствующие ему реактивные паттерны ЭЭГ во время фотостимуляции пациентов с мерцательной аритмией пароксизмальной и постоянной формы, а также вейвлет-когерентности этих сигналов приведены на рис. 5. Анализ вейвлет-когерентности обнаруживает значительную и статистически значимую когерентность только между паттерном ЭЭГ и фотостимулом заданной частоты для пациента с мерцательной аритмией пароксизмальной формы (рис. 5б), но не для пациента с мерцательной аритмией. Различия в реакции на частоту 8 Гц у пациентов с мерцательной аритмией пароксизмальной и постоянной формы (рис. 5г).
Рис. 5.
Различия в реакции на частоту 8 Гц у пациентов с мерцательной аритмией пароксизмальной и постоянной формы. Световой сигнал частоты 8 Гц (штрихпунктирные линии, а, в) и паттерны ЭЭГ во время фотостимуляции у пациента с мерцательной аритмией пароксизмальной (сплошная линия, а) и постоянной (в) формы (отведение О1). Соответствующие им вейвлет-когерентности (б, г).
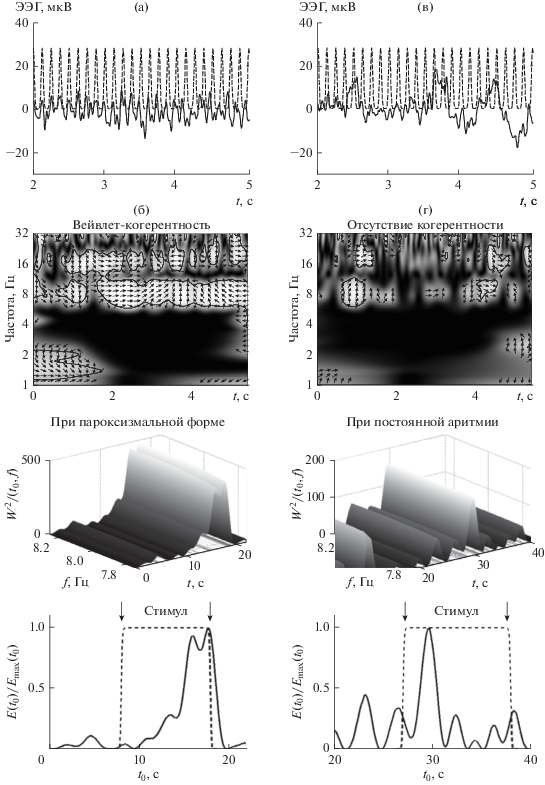
Рассмотрим динамические изменения, происходящие в вейвлетных спектрах паттерна ЭЭГ во время действия фотостимула в узких частотных диапазонах вблизи частоты фотостимуляции. Значительное и медленное нарастание энергии вейвлетного спектра во время действия фотостимула частоты 8 Гц у пациента с мерцательной аритмией пароксизмальной формы показано на рис. 5. Максимум вейвлетного спектра достигается в конце интервала фотостимуляции. Для пациента с мерцательной аритмией постоянной формы наблюдается меньшее по величине увеличение энергии вейвлетного спектра, спектр достигает максимума в середине интервала фотостимуляции, затем происходит уменьшение энергии спектра.
Рекуррентный анализ паттернов ЭЭГ при фибрилляциях предсердий пароксизмального и постоянного типа
Еще одним доказательством различия реакции усвоения ритма в паттернах ЭЭГ у пациентов с фибрилляцией предсердий пароксизмального и постоянного типа является различие в совместных рекуррентных диаграммах этих паттернов и ритмических световых сигналов определенных частот [10, 47]. Примеры таких диаграмм для пациентов с мерцательной аритмией пароксизмальной и постоянной форм представлены на рис. 6. Эти диаграммы построены при величине временной задержки d = 5 и размерности вложения m = 3, величина размера окрестности ε равна 1% от величины стандартного отклонения анализируемых паттернов. Левая диаграмма содержит рекуррентные структуры с длинными диагональными линиями, что свидетельствует о возникновении одновременных рекуррентностей в паттерне ЭЭГ у пациента с мерцательной аритмией пароксизмальной формы и световом сигнале заданной частоты. В отличие от этого, правая диаграмма содержит только редкие и короткие диагональные линии, т.е. почти не имеет совместных рекуррентностей в анализируемом паттерне пациента с фибрилляцией предсердий постоянной формы и данном световом сигнале.
Рис. 6.
Световые сигналы и паттерны ЭЭГ во время фотостимуляции пациентов с мерцательной аритмией пароксизмальной и постоянной форм и совместные рекуррентные диаграммы этих паттернов и световых сигналов.

Усредненные (по числу испытуемых в каждой группе) значения коэффициентов усвоения (kR) ритма заданной частоты, времени запоминания ритма (Tinсr) и значения численных показателей рекуррентных диаграмм (средняя длина диагональных линий (L) и рекуррентное время, необходимое для возврата сигнала в ε окрестность точки, в которой он был ранее (τ)), даны в табл. 3.
Таблица 3.
Усредненные значения коэффициентов усвоения (kR) ритма заданной частоты, времени запоминания ритма (Tinсr) в паттернах ЭЭГ и значения средней длины диагональных линий (L) и рекуррентных времен (τ) в совместных рекуррентных диаграммах паттернов ЭЭГ и световых сигналов.
| Диапазон | kR | Tincr | L | τ |
|---|---|---|---|---|
| Пароксизмальная форма мерцательной аритмии (N = 15 из 16) | ||||
| Тета, 4 Гц | 31 ± 3 | 4.7 ± 0.2 | 5.3 ± 0.5 | 0.45 ± 0.04 |
| 6 Гц | 63 ± 5 | 4.2 ± 0.2 | 4.7 ± 0.4 | 0.40 ± 0.04 |
| Альфа, 8 Гц | 545 ± 38 | 5.4 ± 0.3 | 8.5 ± 0.8 | 0.85 ± 0.08 |
| 12 Гц | 475 ± 29 | 3.2 ± 0.1 | 7.8 ± 0.7 | 0.66 ± 0.06 |
| Постоянная форма мерцательной аритмии (N = 20 из 22) | ||||
| Тета, 4 Гц | 306 ± 27 | 4.8 ± 0.3 | 8.1 ± 0.8 | 0.79 ± 0.07 |
| 6 Гц | 289 ± 17 | 3.5 ± 0.3 | 6.7 ± 0.6 | 0.59 ± 0.06 |
| Альфа, 8 Гц | 3.2 ± 0.1 | 5.2 ± 0.3 | 2.9 ± 0.3 | 0.31 ± 0.02 |
| 12 Гц | 2.7 ± 0.1 | 3.1 ± 0.1 | 2.1 ± 0.2 | 0.28 ± 0.02 |
Для обеих групп пациентов с мерцательной аритмией наблюдается усвоение тета- и альфа- диапазона. При этом для группы с мерцательной аритмией пароксизмального типа характерно слабое усвоение частот тета- диапазона и значительное усвоение частот альфа-диапазона (kR = 31 ± 3, Tinсr = 4.7 ± 0.2 с, L = 5.3 ± 0.5 и τ = 0.45 ± 0.04 для частоты 4 Гц и kR = 545 ± 38, Tinсr = 5.4 ± 0.3 с, L = = 8.5 ± 0.8 и τ = 0.85 ± 0.08 для частоты 8 Гц). В отличие от этого, в группе лиц с мерцательной аритмией постоянного типа реакция усвоения ритма тета-диапазона значительно сильнее (kR = 306 ± 27, Tinсr = 4.8 ± 0.3 с, L = 8.1 ± 0.8 и τ = 0.79 ± 0.07 для частоты 4 Гц), а реакция усвоения ритма альфа- диапазона существенно слабее (kR = 3.2 ± 0.1, Tinсr = 5.2 ± 0.3 с, L = 2.9 ± 0.3 и τ = 0.31 ± 0.02 для частоты 8 Гц). Усвоение ритма бета-диапазона не характерно ни для одной из групп.
Возникновение одновременных рекуррентностей в паттернах ЭЭГ и световых сигналах частот тета- и альфа-диапазонов является характерной особенностью рекуррентных диаграмм пациентов с мерцательной аритмией пароксизмальной формы [10, 47]. Рекуррентные диаграммы лиц с фибрилляцией предсердий в постоянной форме также имеют совместные рекуррентности в паттернах ЭЭГ и световых сигналах частот тета-ритма, однако в альфа-диапазоне проявляют очень слабую рекуррентность. Таким образом, при увеличении времени нарушения сердечного ритма усвоение смещается из альфа- в тета-диапазон. Это может свидетельствовать о преобладании процессов торможения в нервной системе лиц с постоянной формой мерцательной аритмии вследствии хронической гипоксии мозга. Преобладание процессов торможения подтверждается клиническими данными. Так, при нейропсихологическом тестировании были показаны более выраженные изменения когнитивных функций у больных с постоянной формой мерцательной аритмии, по сравнению с больными с пароксизмальной формой [1, 16]. В фоновой ЭЭГ у этих пациентов также выявлено преобладание тета- активности [25], что, как правило, связано с усилением процессов торможения [7, 14, 15].
ЗАКЛЮЧЕНИЕ
В настоящей работе приведены доказательства того, что при нарушениях функционального состояния мозга в структуре паттернов ЭЭГ происходят изменения, которые отражаются в изменениях вейвлетных, мультифрактальных и рекуррентных характеристик этих паттернов. Это позволяет достоверно выделять состояния, предшествующие эпилептическим разрядам при парциальной эпилепсии, оценивать степень психоэмоциональной возбудимости при сосудистой патологии мозга и могут быть использованы для выявления степени патологических проявлений в ЦНС при нарушениях сердечного ритма при мерцательной аритмии. Мультифрактальный анализ позволяет определить механизм изменений динамической сложности паттернов ЭЭГ при возникновении эпилептического разряда и установить, какие структурные перестройки приводят к значительному росту амплитуды сигнала в иктальный период.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 64). Авторы выражают признательность за предоставленные экспериментальные данные врачу-нейрофизиологу И.А. Святогор.
Список литературы
Аланичев А.Е., Гришаев С.Л., Черкашин Д.В. и др. Исследование функционального состояния центральной нервной системы по паттернам электроэнцефалограммы у больных с фибрилляцией предсердий // Вестник военно-медицинской академии. 2015. Т. 51. С. 62–66.
Астафьева Н.М. Вейвлет – анализ: основы теории и примеры применения // Успехи физических наук. 1996. Т. 166. С. 1145–1170.
Божокин С.В. Вейвлет-анализ динамики усвоения и забывания ритмов фотостимуляции для нестационарной электроэнцефалограммы // Журн. технической физики. 2010. Т. 80. № 9. С. 16.
Бойцов С.А., Гришаев С.Л., Солнцев В.Н. и др. Анализ сигнал-усредненной ЭКГ (по данным вейвлет-преобразования) у здоровых и больных ИБС // Вестник аритмологии. 2001. Т. 23. С. 32–36.
Браже А.Р., Асташев М.Е., Максимов Г.В. и др. Расчет локальных показателей Хёрста в последовательностях времен жизни Ca2+ –активируемых K+ каналов // Биофизика. 2004. Т. 49. С. 1075–1083
Гнездицкий В.В. Обратная задача ЭЭГ и клиническая энцефалография (картирование и локализация источников электрической активности мозга). Таганрог: изд-во ТРТУ. 2000. 636 с.
Гриндель О.М., Сазонова О.Б. Введение в клиническую ЭЭГ // В кн.: Нейрофизиологические исследования в клинике / М.: АНТИДОР. 2001. С. 13–16.
Гусельников В.И., Изнак А.Ф. Ритмическая активность в сенсорных система. М.: Изд-во Моск. ун-та, 1983. 214 с.
Данилова Н.Н. Психологическая диагностика функциональных состояний. М.: Изд-во МГУ, 1992. 192 с.
Дик О.Е., Святогор И.А., Дик О.Е. и др. Анализ реактивных паттернов ЭЭГ у лиц с фибрилляцией предсердий // Физиология человека. 2019. Т. 45. С. 49–63.
Добеши И. Десять лекций по вейвлетам. Ижевск: НИЦ Регулярная и стохастическая динамика, 2001. 115 с.
Дремин И.М., Иванов О.В., Нечитайло В.А. Вейвлеты и их использование // Успехи физических наук. 2001. Т. 171. С. 465–501.
Дубикайтис Ю.А., Дубикайтис В.В. Очерки клинической электроэнцефалографии. С-Пб: 2003. 185 с.
Жирмунская Е.А. Клиническая электроэнцефалография. М.: МЭЙБИ, 1991. 77 с.
Жирмунская Е.А. В поисках объяснения феноменов ЭЭГ. М.: Медицина 1996. 118 с.
Ишинова В.А., Сердюков С.В., Гусева Н.Л. и др. Использование психофизиологической саморегуляции в комплексе реабилитационных мероприятий для больных ишемической болезнью сердца и соматоформными расстройствами // Медико-социальная экспертиза и реабилитации. 2013. Т. 3. С. 14–18.
Короновский А.А., Храмов А.Е. Непрерывный вейвлет анализ и его применения. М: Физматлит., 2003. 176 с.
Кропотов Ю.Д., Пронина М.В., Поляков Ю.И. и др. Функциональные биомаркеры в диагностике психических заболеваний: когнитивные вызванные потенциалы // Физиология человека. 2013. Т. 39. С. 14–25.
Крыжановский Г.Н. Общая патофизиология нервной системы. М.: Медицина, 1997. 351 с.
Kуклин С.Г., Дзизинский А.А., Титов Ю.М. и др. Непрерывный вевлет- анализ новый метод для изучения нестационарных колебаний сердечного ритма // Физиология человека. 2006. Т. 32. С. 132–138.
Павлов А.Н., Анищенко В.С. Мультифрактальный анализ сложных сигналов // Успехи физических наук. 2007. Т. 177. С. 859.
Поворинский А.Г., Заболотных В.А. Пособие по клинической энцефалографии. Л.: Наука, 1987. 64 с.
Святогор И.А., Гусева Н.Л. ЭЭГ-реакция усвоения ритма в норме и при нарушении функционального состояния центральной нервной системы // Вестник клинической нейрофизиологии. 2014. Т. 1. С. 13–19.
Святогор И.А., Дик О.Е., Ноздрачев А.Д. и др. Анализ изменений ЭЭГ-паттернов в ответ на ритмическую фотостимуляцию при различных нарушениях функционального состояния ЦНС // Физиология человека. 2015. Т. 41. С. 41–49.
Святогор И.А., Гусева Н.Л., Софронов Г.А. и др. Оценка функционального состояния центральной нервной системы у пациентов с фибрилляцией предсердий по фоновым и реактивным паттернам ЭЭГ // Медицинский академический журнал. 2015. Т. 15. С. 39–45.
Ситникова E.Ю., Короновский A.A., Храмов A.E. Анализ эпилептической активности мозга при абсанс эпилепсии: прикладные аспекты нелинейной динамики // Изв. вузов ПНД. 2011. Т. 19. С. 173–182.
Федотчев А.И., Бондарь А.Т., Акоев И.Г. Резонансные ЭЭГ – реакции при ритмических световых воздействиях разной интенсивности и частоты // Ж. ВНД. 2001. Т. 51. С. 17–23.
Федотчев А.И., Бондарь А.Т., Ларионова А.В. и др. Информационно-вычислительные технологии в познании механизмов деятельности мозга: как нервная система реагирует на поличастотную стимуляцию // Биомедицинская химия. 2004. Т. 50. С. 188.
Федотчев А.И., Бондарь А.Т., Матрусов С.Г. и др. Использование сигналов обратной связи от эндогенных ритмов пациента для нелекарственной коррекции функциональных расстройств // Журн. усп. физиол. наук. 2006. Т. 37. С. 82–93.
Addison P.S. Wavelet transforms and the ECG: a review // Physiol. Meas. 2005. V. 26. P. 155–199.
Andrzejak R.G., Mormann F., Kreuz Th. et al. Testing the null hypothesis of the non–existence of a preseizure state // Phys. Rev. E. 2003. V.67. P. 010901–010905.
Arneodo A., Bacry E., Muzy J.F. The thermodynamics of fractals revisited with wavelets // Physica A. 1995. V. 213. P. 232–275.
Aydin-Abidin S., Moliadze V., Eysel U.T. et al. Effects of repetitive TMS on visually evoked potentials and EEG in the anaesthetized cat, dependence on stimulus frequency and train duration/ / J. Physiology. 2006. V. 574. P. 443–455.
Beydoun S.H., Schechter W., Nasreddine I. Responses to photic stimulation in patients with occipital spikes // Electroenceph. and Clinical Neurophysiology. 1998. V. 107. P. 13–17.
Bosnyakov D., Gabova A., Kuznetsova G. et al. Time–frequency analysis of spike–wave discharges using a modified wavelet transform // J. Neurosci. Methods. 2006. V. 1654. P. 80–88.
Borodina U.V., Aliev R.R. Wavelet spectra of visual evoked potentials; time course of delta, theta, alpha and beta bands // Neurocomputing. 2013. V. 121. P. 551–555.
Bozhokin S.V., Suvorov N.B. Wavelet analysis of transient processes in EEG photic // Biomed. Electron. 2008. V. 3. P. 13–19.
Bullmore E., Barnes A., Bassett D.S. et al. Generic aspects of complexity in brain imaging data and other biological systems // NeuroImage. 2009. V. 47. P. 1125–1134.
Cardo R., Corvalánz A., Figliolay A. et al. Wavelet Leaders versus Multifractal Detrended Fluctuation Analysis in EEG time series // Proc. XII Reunión de Trabajo en Procesamiento de la Información y Control, 16 al 18 de octubre de 2007. P. 301–307.
Chatrian G.E., Bergamini L., Dondey M. et al. A glossary of terms most commonly used by clinical electroencephalographers // Electroenceph. and Clinical Neurophysiology. 1974. V. 37. P. 538–548.
Coull M., Pedley T.A. Intermittent photic stimulation. Clinical usefulness of non–convulsive responses // Electroencepha. and Clinical Neurophysiology. 1978. V. 44. P. 353–363.
Devinsky O. Clinical and electrographic features of simple partial seizures // Neurology. 1988. V. 38. P. 1347–1352.
Dick O.E., Mochovikova I.A. Multifractal and wavelet analysis of epileptic seizures // Chaos Theory: Modeling, Simulation and Applications, Selected Papers from the 3rd Chaotic Modeling and Simulation Intern. Conference, C.H. Skiadas, I. Dimotikalis and C. Skiadas (Eds) World Scientific Publishing. 2011. P. 159–166.
Dick O.E., Svyatogor I.A. Potentialities of the wavelet and multifractal techniques to evaluate changes in the functional state of the human brain // Neurocomputing. 2012. V. 82. P. 207–215.
Dick O.E. Wavelet analysis of the human brain lability to reproduce the external rhythm // J. Chaotic Modeling and Simulation. 2013. V. 3. P. 387–394.
Dick O.E., Svyatogor I.A. Wavelet and multifractal estimation of the intermittent photic stimulation response in the electroencephalogram of patients with dyscirculatory encephalopathy // Neurocomputing. 2015. V. 165. P. 361–374.
Dick O.E. Nonlinear dynamics of reactive EEG patterns under cerebrovascular and cardiovascular distortions // J. Chaotic Modeling and Simulation. 2017. V. 4. P. 501–512.
Drake. J.M.E., Shy K.E., Liss L. Quantitation of photic driving in dementia with normal EEG // Clinical Electroencephalography. 1989. V. 20. P. 153–155.
Fedotchev A.I., Bondar A.T., Akoev I.G. Dynamic characteristics of the human resonance EEG responses to rhythmic photostimulation // Human Physiology. 2000. V. 26. P. 64–72.
Fitzgerald P.B., Fountain S., Hoy K. et al. A comparative study of the effects of repetitive trancranial magnetic stimulation on motor cortical excitability // J. Neurosci. Methods. 2007. V. 165. P. 265–269.
Fraser A.M., Swinney H.L. Independent coordinates for strange attractors from mutual information // Phys. Rev. 1986. V. 33. № 2. 1134.
Grinsted A., Moor J.C., Jevrejeva S. Application of the cross wavelet transform and wavelet coherence to geophysical timeseries // Nonlinear processes in geophysics. 2004. V. 11. P. 561–566.
Harrison M.A.F., Osorio I., Frei M.G. et al. Correlation dimension and integral do not predict epileptic seizures // Chaos. 2005. V. 15. P. 033106-1–033106-15.
Hramov A.E., Koronovsky A.A., Makarov V.A. et al. Wavelets in neuroscience. Springer Series in Synergetics. Berlin: Springer, 2015. 314 p.
Iasemidis L.D. Epileptic seizure prediction and control // IEEE Trans. Biomed Eng. 2003. V. 50. P. 549–558.
Indiradev K.P., Elias E., Sathidevi P.S. Complexity analysis of electroencephalogram records of epileptic patients using Hurst exponent International // J. Medical Engineering and Informatics. 2009. V. 1. P. 368–380.
Ivanov P.C., Rosenblum M.G., Peng C.K. et al. Scaling behaviour of heartbeat intervals obtained by wavelet-based time-series analysis // Nature. 1996. V. 38. P. 323–328.
Jin Y., Castellanos A., Solis E.R. et al. EEG resonant responses in schizophrenia: a photic driving study with improved harmonic resolution // Schizophrenia Research. 2000. V. 44. P. 213–220.
Kennel M.B., Brown R., Abarbanel H.D. Determining embedding dimension for phase-space reconstruction using a geometrical construction // Phys. Rev. A. 1992. V. 45. № 6. P. 3403.
Kilander L., Andrén B., Nyman H. et al. Atrial fibrillation is an independent determinant of low cognitive function: a cross–sectional study in elderly men // Stroke. 1998. V. 29. P. 1816–1820.
Knecht S., Oelschläger C., Duning T. et al. Atrial fibrillation in stroke–free patients is associated with memory impairment and hippocampal atrophy // Eur. Heart J. 2008. V. 29. P. 2125–2132.
Kreuz T., Andrzejak R.G., Mormann F. et al. Measure profile surrogates: a method to validate the performance of epileptic seizure prediction algorithm // Phys. Rev. E. 2004. V. 69. P. 061915–061924.
Kwok C.S., Loke Y.K., Hale R. et al. Atrial fibrillation and incidence of dementia: a systematic review and meta–analysis // Neurology. 2011. V. 76. P. 914–922.
Latka M., Was Z., Kozik A et al. Wavelet analysis of epileptic spikes // Phys. Rev. E. 2003. V. 67. P. 052902–052906.
Lehnertz K., Elger C.E. Can epileptic seizures be predicted? Evidence from nonlinear time series analysis of brain electrical activity // Phys. Rev. Lett. 1998. V. 80. P. 5019–5022.
Lehnertz K., Mormann F., Kreuz T.,et al. Seizure prediction by nonlinear analysis // IEEE Eng. Med. Biol. Mag. 2003. V. 22. P. 57–63.
Le van Quyen M., Martinerie J., Navarro V. et al. Characterizing neurodynamic changes before seizures // J. Clin. Neurophysiol. 2001. V. 18. P. 191–208.
Le van Quyen M., Navarro V., Martinerie J. et al. Toward a neurodynamical understanding of ictogenesis // Epilepsia. 2003. V. 44. P. 30–43.
Le van Quyen M., Soss J., Navarro V. et al. Preictal state identification by synchronization changes in long–term intracranial EEG recordings // Clin. Neurophysiol. 2005. V. 116. P. 559–68.
Liebovitch L.S., Todorov A.T. Using fractals and nonlinear dynamics to determine the physical properties of ion channel proteins // Crit. Rev. Neurobiol. 1996. V. 10. P. 169–187.
Litt B., Lehnertz K. Seizure prediction and the preseizure period // Curr. Opin. Neurol. 2002. V. 15. P. 173–177.
Lehnertz K., Andrzejak R.G., Arnhold J. et al. Nonlinear EEG analysis in epilepsy // J. Clin. Neurophysiol. 2001. V. 18. P. 209–222.
Mandelbrot B.B. The Fractal Geometry of Nature. San Francisco: W.H. Freeman, 1983. 468 p.
Maraun D., Kurths J. Cross wavelet analysis: significance testing and pitfalls // Nonlinear Processes in Geophysics. 2004. V. 11. P. 505–514.
Marwan N., Wessel N., Meyerfeldt U. et al. Recurrence plot based measures of complexity and ist application to heart rate variability data // Physical Review E. 2002. V. 66. P. 26702–26710.
Marwan N., Kurths J. Nonlinear analysis of bivariate data with cross recurrence plots // Physics Letters A. 2002. V. 302. P. 299–307.
Marwan N., Romano M.C., Thiel M. et al. Recurrence plots for the analysis of complex systems // Physics Reports. 2007. V. 438. P. 237–329.
Mead G.E., Keir S. Association between cognitive impairment and atrial fibrillation: a systematic review // J. Stroke Cerebrovasc. Dis. 2005. V. 10. P. 35–43.
Mielke M.M., Rosenberg P.B., Tschanz J. et al. Vascular factors predict rate of progression in Alzheimer disease // Neurology. 2007. V. 69. P. 1850–1858.
Morlet D., Couderc J.P., Touboul P. et al. Wavelet analysis of high–resolution ECGs in post–infarction patients: role of the basic wavelet and of the analyzed lead // Int. J. Biomed Comput. 1995. V. 39. P. 311–325.
Mormann F., Kreuz Th., Rieke Ch. et al. On the predictability of epileptic seizures // Clin. Neurophysiol. 2005. V. 116. P. 569–97.
Mouraux G., Iannetti D. Across–trial averaging of event–related EEG responses and beyond // Magnetic resonance imaging. 2008. V. 26. P. 1041–1054.
Muzy J.F., Bacry E., Arneodo A. Multifractal formalism for fractal signals: the structure–function approach versus the wavelet–transform modulus–maxima method // Phys. Rev. E. 1993. V. 47. P. 875–884.
Natarajan K., Acharya R., Alias F. et al. Nonlinear analysis of EEG signals at different mental states // BioMedical Engineering. 2004. V. 3. P. 7–18.
Natarajan K., Acharya R., Lim C. et al. Characterization of EEG – A comparative study // Comp. Methods and Programs in Biomedicine. 2005. V. 80. P. 17–23.
Park H., Hildreth A., Thomson R. et al. Non–valvular atrial fibrillation and cognitive decline: a longitudinal cohort study // Age Ageing. 2007. V. 36. P. 157–163.
Polychronaki G.E., Ktonas P.Y., Gatzonis S. et al. Comparison of fractal dimension estimation algorithms for epileptic seizure onset detection // J. Neural Engineering. 2010. V. 7. P.60–78.
Popivanov D., Stomonyakov V., Minchev Z. et al. Multifractality of decomposed EEG during imaginary and real visual–motor tracking // Biological Cybernetics. 2006. V. 94. P. 149–156.
Qianli M.A., Xinba N., Jun W. et al. A new measure to characterize multifractality of sleep electroencephalogram // Chinese Science Bulletin. 2006. V. 51. P. 3059–3064.
Rangaprakash D., Pradhan N. Study of phase synchronization in multichannel seizure EEG using nonlinear recurrence measure // Bioledical Signal Processing and Control. 2014. V. 11. P. 114–112.
Rosso O.A., Blanco S., Rabinowicz A. Wavelet analysis of generalized tonic–clonic epileptic seizures // Signal Processing. 2003. V. 83. P. 1275–1289.
Santangeli P., Di Biase L., Bai Rong, et al. Atrial fibrillation and the risk of incident dementia: a meta–analysis // Heart Rhythm. 2012. V. 9. P. 1761–1768.
Scafetta N., Moon R.E., West B.J. Fractal response of physiological signals to stress conditions, environmental changes, and neurodegenerative diseases // Complexity. 2007. V. 12. P. 12–17.
Senhadji L., Wendling F. Epileptic transient detection: wavelets and time–frequency approaches // Neurophysiol. Clin. 2002. V. 32. P. 175–192.
Siniatchkin M., Groppa S., Jerosch B. et al. Spreading photoparoxysmal EEG response is associated with an abnormal cortical excitability pattern // Brain. 2007. V. 130. P. 78–87.
Sitnikova E., Hramov A.E., Koronovskii A.A. et al. Sleep spindles and spike–wave discharges in EEG: their generic features, similarities and distinctions disclosed with Fourier transform and continuous wavelet analysis // J. Neurosci. Methods. 2009. V. 180. P. 304.–316.
Song I.H., Lee D.S. Fluctuation Dynamics in Electroencephalogram Time Series // Mira J., ´Alvarez J.R. (Eds.) / Berlin: Springer, 2005. P. 281–304.
Stam C.J. Nonlinear dynamical analysis of EEG and MEG: Review of an emerging field // Clinical Neurophysiology. 2005. V. 116. P. 2266–2301.
Svozil K., Felix D., Ehrenberger K. Multiple–channel fractal information coding of mammalian nerve signals // Biochem. Biophys. Res. Commun. 1994. V. 199. P. 911–915.
Takens F. Detecting strange attractors in turbulence // In: Dynamical Systems and Turbulence, Lecture Notes in Mathematics / Rand D., Young L.S., eds. / Berlin: Springer, 1981. V.898. P. 366 – 381.
Tyler C.W., Apkarian P., Nakayama K. Multiple spatial–frequency tuning of electrical responses from human visual cortex // Experimental Brain Research. 1978. V. 33. P. 535–550.
Udompanich S., Lip G.Y.H., Apostolakis S. et al. Atrial fibrillation as a risk factor for cognitive impairment: a semi–systematic review // QJM. 2013. V. 106. P. 795–802.
Van Drongelen W., Nayak S., Frim D.M. et al. Seizure anticipation in pediatric epilepsy: use of Kolmogorov entropy // Pediatr. Neurol. 2003. V. 29. P. 207–213.
Wink A.M., Bullmore E., Barnes A. et al. Monofractal and multifractal dynamics of low frequency endogenous brain oscillations in functional MRI // Human Brain Mapping. 2008. V. 29. P. 791–801.
Xu Y., Ma Q.DY., Schmitt D.T. et al. Effects of coarse–graining on the scaling behavior of long–range correlated and anti–correlated signals // Physica A. 2011. V. 390. P. 4057–4072.
Yamamoto M. Fluctuations observed in biological time series signals and their functional significance // Front. Med. Biol. Eng .1991. V. 3. P. 135–137.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук



