Успехи физиологических наук, 2020, T. 51, № 3, стр. 51-68
Стресс, старение и единая гуморальная защитная система организма. Эпигенетические механизмы регуляции
Б. И. Кузник a, b, Н. И. Чалисова с, Н. Н. Цыбиков a, Н. С. Линькова d, *, С. О. Давыдов a, b
a ФГБОУ ВО Читинская государственная медицинская академия
Чита, Россия
b Иновационная клиника “Академия здоровья”
Чита, Россия
d Академия постдипломного образования ФГБУ “Федеральный научно-клинический центр
специализированных видов медицинской помощи и медицинских технологий
Федерального медико-биологического агентства”
Москва, Россия
с Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: miayy@yandex.ru
Поступила в редакцию 01.10.2019
После доработки 08.11.2019
Принята к публикации 10.12.2019
Аннотация
При старении в организме развиваются морфологические и функциональные изменения, сходные с теми, которые наблюдаются при стрессе. Стрессорное воздействие вовлекает в ответ все защитные системы организма: белки теплового шока, врожденный и приобретенный иммунитет, систему гемостаза и антиоксидантную систему. В то же время на стресс реагируют белки “молодости” (GDF11, TIMP-2, MANF, NGF, FGF, NAMPT, ирисин) и “старости” (CCL11, GDF15, JAM, алармин-1, β2-микроглобулин). Все гуморальные защитные системы организма вступают в ответную реакцию практически одновременно, регулируются одними и теми же нервными и гуморальными факторами и составляют единую защитную систему организма. В обзоре обсуждаются возможные эпигенетические механизмы активации гуморальной защитной системы при стрессе и старении организма. Одной из групп веществ-геропротекторов, специфически регулирующих экспрессию генов и синтез белков, являются короткие пептиды – цитогены. Короткие пептиды обладают антиоксидантными свойствами, регулируют синтез белков теплового шока, белков “молодости” и “старости”, функции иммунной, нервной и эндокринной систем, увеличивают продолжительность жизни в эксперименте. Применение коротких пептидов, способствующих нормализации функций единой гуморальной защитой системы организма, может способствовать увеличению продолжительности и улучшению качества жизни лиц старших возрастных групп.
Начало созданию биологической концепции стресса положил Ганс Селье в 1938 г. К настоящему времени все стадии стресса (тревоги, резистентности, истощения) подробно изучены. Однако ежегодно появляются сотни статей, касающихся проявления стрессорных реакций, как в условиях нормы, так и патологии.
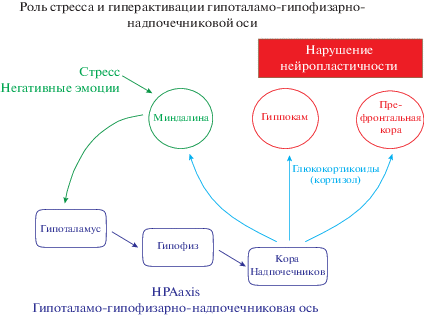
Известно, что стресс сопровождается гиперактивацией гипоталамо-гипофизарно-надпочечниковой оси (рис. 1). При этом активируется миндалина головного мозга, тесно связанная с гипоталамусом, синтезирующим и секретирующим рилизинг факторы (в том числе кортикотропин-рилизинг-гормон), оказывающие непосредственное действие на переднюю долю гипофиза. Последняя выделяет адренокортикотропный гормон (АКТГ), стимулирующий функцию коры надпочечника, благодаря чему усиливается синтез и секреция гормонов стресса – глюкокортикоидов (ГК). Одновременно в реакцию включается гипоталамо-симпато-адреналовая ось, что приводит к выработке в мозговом слое надпочечника адреналина и норадреналина, в избытке поступающих в кровоток.
Все это сопровождается усилением активности префронтальной коры и гиппокампа, ответственных за эмоционально-стрессовую реакцию [116]. Выброс в кровь адреналина и норадреналина сопровождается учащением сердечного ритма и повышением кровяного давления. Норадреналин связывается с рецепторами иммунных клеток и вызывает синтез провоспалительных цитокинов [33]. В свою очередь, воспаление связано с возраст-зависимыми заболеваниями. Поэтому особый интерес представляет вопрос о роли стресса в механизмах старения организма.
Старение – это физиологический и одновременно патологический процесс, характеризующийся прогрессирующим нарушением молекулярно-клеточных взаимодействий и, как следствие, развитию различной соматической патологии. Нестабильность генома, укорочение теломер, нарушение регуляции чувствительности к сигнальным молекулам, дисфункция митохондрий – представляют собой процессы, характерные для старения организмов, находящихся на разных этапах эволюции [107].
Согласно современным взглядам [87], основными факторами, приводящими к старению, являются повреждение ДНК, дисфункция митохондрий и нарушение регуляции внутриклеточных сигнальных путей (рис. 2).
Следует отметить, что любое проявление стресса вовлекает в ответ все без исключения защитные системы организма: белки теплового шока (heat shock proteins, HSP), врожденный и приобретенный (адаптивный) иммунитет, системы гемостаза и антиоксидантной защиты. Одновременно на стресс реагируют пептиды и белки “молодости” и “старости”. Все перечисленные гуморальные защитные системы организма вступают в ответную реакцию практически одновременно, регулируются одними и теми же нервными и гуморальными факторами и составляют единую гуморальную защитную систему организма – ЕГЗСО [16].
БЕЛКИ ТЕПЛОВОГО ШОКА, СТРЕСС И СТАРЕНИЕ
Превалирующее большинство заболеваний начинается с местного повреждения клеток и тканей и нередко сопровождается повышением температуры, что приводит к увеличению концентрации HSP. Эти белки представляют собой класс стресс-индуцируемых протеинов, действующих, в основном, как молекулярные шапероны. Шапероном является белок, резидентный в эндоплазматическом ретикулуме, митохондриях или в цитоплазме, и способный препятствовать неправильному свертыванию (агрегированию) и транспортировке белка, когда эти процессы нарушены или не завершены [80, 106]. Согласно общепринятой классификации, все HSP в соответствии с их молекулярной массой (ММ) распределяются на 6 семейств. При этом HSP, имеющие ММ до 40 кДа, объединяются в малые HSP (small HSP – sHSP). Остальные белки, с ММ до 110 кДа и выше, представлены семействами HSP70, HSP80, HSP90, HSP100. HSP70 являются белками, выполняющими функцию молекулярных шаперонов и участвующими в утилизации необратимо поврежденных белков (фолдинге) [82, 110].
Известно, что деятельность шаперонов чрезвычайно разнообразна и включает процессы, связанные с формированием пространственной структуры белка, регулированием его местоположения и транслокации в клетке. HSP70 и HSP90 имеют множество белков-мишеней. HSP регулируют трансдукционные и рецептор-регулирующие киназы и оказывают непосредственное влияние на функциональную активность рецепторов.
Ключевая роль в сохранении жизнедеятельности клетки в процессе стресса отводится семейству sHSPS. Они эффективно связываются с большим количеством протеинов, благодаря чему эффективно предотвращаются необратимые процессы агрегации белка в клетке. Кроме того, sHSPS представляют собой центральный клеточный компонент, ингибирующий или модулирующий агрегацию белка и улучшающий процессы дезагрегации после стресса [67, 89]. Обычно sHSPS не проявляют рефолдинговую активность, хотя и стабилизируют белки, склонные к агрегации и образующиеся во время различных стрессовых состояний. sHSPS захватывают развернутые белки в качестве первой линии защиты, создавая резервуар белков, способных дезагрегировать после стресса [114]. Экспериментальные данные показывают, что если происходит усиление функции шаперонов sHSPS, то осуществляется защита от возрастных заболеваний, связанных с нарушением агрегации белка [56].
Не все белки после дезагрегации вновь приобретают нативную структуру, часть из них остается необратимо поврежденной. Такие белки должны быть утилизированы. Это осуществляется либо с помощью лизосомальных ферментов, либо в процессе убиквитинзависимого протеолиза. И в том, и в другом случае участвуют HSP70, выполняющие транспортную функцию: они или облегчают перенос денатурированного белка к лизосомам, или доставляют комплекс протеолитических ферментов непосредственно к денатурированному белку [10]. Процесс разрушения денатурированных белков по своему механизму напоминает фибринолиз [16]. Следовательно, гибель клетки должна происходить при стрессе в том случае, если HSP не справляются с осуществлением фолдинга. В подобной ситуации клетка получает сигнал к апоптозу и погибает.
Следует, однако, отметить, что HSP необходимы не только для восстановления структуры и функции поврежденных белков. HSP участвуют в поддержании гомеостаза, пролиферации и дифференцировке клеток, проявляют антиапоптотический эффект [92, 97]. Антиапоптотическая активность присуща белкам HSP70 и HSP90β. Одной из гипотез, объясняющих наступление гибели клетки, является повреждение ее свободными радикалами. При старении несостоятельность шаперонной функции HSP приводит к гибели клеток, которые не справляются со своей функцией. На различных живых объектах (дрозофилы, нематоды, дафнии и др.) показано, что шаперонная функция HSP с возрастом значительно снижается. Следовательно, усиление шаперонной функции HSP должно способствовать продлению жизни. В опытах на нематодах (Caenorhabditis elegans) показано, что мутация гена, способствующего возникновению толерантности к действию температуры, продлевает жизнь животных. Кратковременное повышение температуры у дрозофил приводит к накоплению HSP70 и увеличению срока их жизни [112]. Таким образом, уменьшение уровня HSP при старении связано с нарушением клеточного гомеостаза, которое вызывает рак, ускоренное старение и нейродегенерацию. Уровень HSP снижается при репликативном старении большинства типов клеток, включая нейроны [90].
Таким образом, белок теплового шока HSP70 действует как механизм защиты клеток, его экспрессия индуцируется в стрессовых условиях. Старение связано с нарушением этой индукции, тогда как увеличение продолжительности жизни обусловлено повышенной экспрессией HSP70. Согласно окислительно-воспалительной теории старения, хронический окислительный стресс и воспалительные стрессовые ситуации (с более высоким уровнем окислительных и воспалительных соединений и более низкой антиоксидантной и противовоспалительной защитой) являются основой ускоренного старения клеток. HSP70, обеспечивая защиту от воздействия окислительного стресса, а также модулируя воспалительный статус, способен играть роль регулятора скорости старения [29]. Эта функция может быть различной в митотических и постмитотических тканях из-за различий в их механизмах апоптозного ответа [86].
За последнее время накапливается все больше данных о том, что болезнь Альцгеймера (БА) является следствием “беспорядочного и неправильного свертывания белков”, склонных к агрегации и приводящих к апоптозу нейронов. При БА наблюдаются конформационные изменения τ-протеина (microtubule-associated protein tau, MAPT) и предшественника β-амилоида (amyloid precursor protein, APP). Гиперфосфорилированный τ-белок оказывает влияние на неизмененный τ-протеин, вызывая образование агрегатов. HSP70 способствует правильному скручиванию τ-белка в функциональные микротрубочки, уменьшая его гиперфосфорилирование и предотвращая образование белковых агрегатов. Также HSP70 повышает дезаградацию неправильного свернутого τ-протеина [84]. HSP70 в экспериментах in vitro и in vivo подавляет прогрессирование БА, оказывая влияние на процесс сборки Aβ-олигомера. Более того, присутствие HSP70 уменьшает токсичность Aβ амилоида при культивировании нейронов. Добавление HSP70 к Aβ-мономерам приводит к замедлению процесса олигомеризации, а также ингибированию комплексов с большой ММ, снижая их токсичность [101]. Сверхэкспрессия HSP70 оказывает нейропротекторное действие при нейродегенеративных заболеваниях, в том числе при БА [111]. Таким образом, использование HSP70 и подобных ему соединений создает перспективу для разработки новых препаратов, применимых при лечении БА [84, 101, 111].
HSP могут вызывать “кондиционирующий” эффект, защищая организм от травм и развития патологических состояний. Однако по мере старения организма способность HSP оказывать влияние на антиоксиданты значительно уменьшается, тогда как содержание активных форм кислорода (АФК) резко возрастает. Все это способствует развитию атеросклероза, сердечно-сосудистых заболеваний, диабета 2 типа с развитием резистентности к инсулину, рака и других патологических состояний, ассоциированных с возрастом [54].
HSP также играют большую роль в функционировании иммунной системы. При действии патогенных возбудителей или микроорганизмов HSP могут определяться рецепторами клеток иммунной системы – TLR-2, TLR-4, CD14, CD91, CD94, LOX-1 и др. При этом происходит передача информации о наличии в организме патологического процесса и вовлечении иммунной системы в защитную реакцию [34].
У больных стабильной стенокардией, сопровождающейся загрудинными болями, увеличивается концентрация аутоантител к HSP27. У людей пожилого возраста, при гипертензии и сахарном диабете содержание аутоантител к HSP возрастает, а их концентрация в крови уменьшается. Уровень аутоантител к HSP27 увеличивается в первые 12 ч после инфаркта миокарда (их содержание в среднем в 5 раз выше, чем у здоровых людей), а затем по мере улучшения состояния начинает снижаться. Высказывается мнение, что возрастание титра аутоантител к HSP27 может служить ранним маркером развития инфаркта миокарда [57].
Таким образом, установлено, что белки HSP обладают значительным разнообразием защитных механизмов, позволяющих клеткам выживать в условиях стресса: восстановление и утилизация поврежденных белков, антиапоптотическое действие, регуляция синтеза оксида азота. HSP способствуют дезагрегации внеклеточных β-амилоидных агрегатов, усиливают выведение β-амилоида из межклеточных пространств, защищают нейроны от токсического действия Aβ амилоида. HSP70, HSP90 и HSP32 способны усиливать продукцию провоспалительных цитокинов и оказывать влияние на интенсивность фагоцитарных реакций. Многие HSP являются регуляторами АТФ-азной активности. HSP играют ключевую роль в обработке и презентации антигенов, определяя индивидуальную реактивность организма к антигенным воздействиям. HSP принимают участие в защите миокарда и головного мозга от ишемии, а также в предупреждении или ослаблении сепсиса [57, 67]. При старении функциональная активность HSP снижается, в организме возникают условия, напоминающие стадию истощения при хроническом стрессе, приходящие к апоптозу клеток и дисфункции органов и тканей.
ВРОЖДЕННЫЙ И ПРИОБРЕТЕННЫЙ ИММУНИТЕТ, СТРЕСС И СТАРЕНИЕ
Инволюция вилочковой железы при старении играет ключевую роль в развитии иммунодефицита [33]. Многие из иммунологических изменений, связанных со старением, напоминают те, которые наблюдаются после длительного или хронического воздействия стресса, включая “неразрешимое” воспаление и повышенный окислительный стресс [88]. У людей пожилого и старческого возраста нарушается способность Т-клеток в ответ на антиген активироваться и пролиферировать. Отчасти это связано с возрастными структурными и функциональными изменениями Т-лимфоцитов. Кроме того, способность Т-клеток секретировать интерлейкины снижается с возрастом. Нарушение реакции антител на чужеродные антигены является вторичным по отношению к дефициту Т-хелперов. Также у пожилых людей может наблюдаться сниженный воспалительный ответ, вторичный по отношению к нарушенному хемотаксису полиморфноядерных нейтрофилов и фагоцитозу [105]. При старении изменяется фенотип Т- и В-лимфоцитов, в костном мозге накапливаются высокодифференцированные, стареющие Т-клетки. Такие клетки могут вызывать воспалительную реакцию в костном мозге [33, 91].
Особенности функционирования иммунной системы стареющего организма обозначаются термином иммуносенесценция. Важнейшим свойством иммуносенесценции является накопление в “иммунологическом пространстве” клеток “памяти”, возникающее в результате стимуляции, вызванной повторными клиническими и субклиническими инфекциями и постоянным воздействием антигенов (ингаляционных аллергенов, пищи и т.д.). Можно говорить о том, что стареющий организм постоянно находится в состоянии хронического воспаления, оказывающего существенное влияние на выживаемость и качество жизни [115]. В стареющем организме происходит “ремоделирование” иммунной системы, вызванное окислительным стрессом и сопровождаемое усилением апоптоза. Активация апоптоза, воспаление и иммунный ответ с последующей секрецией провоспалительных лимфокинов представляет собой основной детерминант старения и ассоциированных с возрастом заболеваний. Прежде всего, при старении возникают сдвиги во врожденном иммунитете, обеспечивающем быструю, но неспецифическую защиту за счет моноцитов, NK-лимфоцитов и дендритных клеток. Неспецифические иммунные реакции приводят к активации более медленного, но высокоспецифичного адаптивного иммунного ответа. Маркеры воспаления при адаптивном иммунитете у долгожителей характеризуются уменьшением “наивных” Т-клеток. Снижение количества малодифференцированных Т-лимфоцитов, CD8+ цитотоксических лимфоцитов и повышение количества CD4+ Т-хелперов и CD19+ B-лимфоцитов нередко связано с повышенным риском заболеваемости и смертности. Иммунная функция пожилых людей ослаблена из-за снижения численности CD95– Т-клеток, которые замещаются клональной экспансией CD28+ клеток, выполняющих функцию супрессоров [117].
У лиц старших возрастных групп в период отсутствия патологического процесса уровень TNFα значительно повышен [15]. При этом у лиц старше 60 лет отмечается неадекватная реакция со стороны провоспалительных цитокинов на действие патогенных раздражителей. С возрастом отмечается снижение продукции TNF-β, IL-1β, IL-6 и IL-17 стимулированными липополисахаридами (LPS) мононуклеарами [76, 81]. У лиц старше 60 лет, по сравнению с молодыми, выработка IL-6 и TNFα моноцитами и экспрессия TLR-1 ослаблены [94].
При обследовании 236 больных через 6 ч после возникновения острого инфаркта миокарда (ИМ) с повышением сегмента ST в сыворотке определяли содержание IL-6, адгезивных молекул ICAM-1, VCAМ-2 и растворимого Р-селектина. В течение 3-х лет наблюдения этой группы от сердечно-сосудистых заболеваний (ССЗ) умерло 34 человека. У погибших в момент госпитализации оказалось повышенной концентрация IL-6, тогда как уровень адгезивных молекул оставался в пределах нормы. На основании полученных данных авторы приходят к выводу, что IL-6 является независимым прогностическим фактором смертности от ССЗ. В то же время у больных при острых формах ишемической болезни сердца (ИБС) c наличием сосудистых осложнений концентрация провоспалительных цитокинов, в том числе IL-6 и TNFα, повышалась сильнее, чем в отсутствии выраженных сосудистых нарушений. Одновременно у таких больных снижалось содержание противовоспалительного цитокина IL-10 [85].
Следует заметить, что у многих больных с ИБС и ИМ имеются выраженные симптомы депрессии и тревоги, что утяжеляет течение кардиоваскулярных заболеваний, снижает работоспособность, качество жизни и приводит к смерти [35]. Вместе с тем, при наличии тревоги и депрессии у больных ИБС и ИМ концентрация IL-6 оказалась значительно выше, чем в отсутствии указанных симптомов. У больных с инсультом уровень TNFα в крови коррелирует с тяжестью клинической картины и объемом поражения мозговых структур [12]. Чем выше содержание TNFα и IL-6 перед началом заболевания, чем тяжелее в дальнейшем протекает инсульт [113].
Существуют довольно сложные взаимоотношения между действием стрессорных факторов и иммунной системой. В настоящее время общепризнано, что хронический стресс может изменить физиологическую перекрестную связь между головным мозгом, эндокринной и иммунной системами, что приводит к длительным дезадаптивным эффектам (аллостатическая перегрузка), приводящим к возникновению патологических состояний [53]. Установлено, что существует тесная связь между действием стрессорных факторов и длиной теломер, а также физическими и психическими расстройствами. В условиях хронического стресса теломеры быстрее, чем в норме, достигают критически короткой длины. Это приводит к активации ответа контрольной точки повреждения ДНК и геномной нестабильности, вызывает апоптоз или репликативное старение [50]. Поскольку фермент теломераза является основным регулятором длины теломер, понимание ее регуляторных функций является основной целью разработки стратегий по предотвращению неблагоприятных последствий старения иммунной системы [62].
Первоначально в ответ на острый стресс иммунная система активируется и только после этой первой реакции, на следующих этапах, когда ГК еще больше повышается, начинаются противовоспалительные эффекты. Более высокие концентрации ГК помогают организму восстановиться на ранних этапах реакции на стресс. В то же время при повторной стимуляции стрессорными факторами или при длительном хроническом стрессе иммунная система подавляется, что в значительной степени опосредовано действием ГК [100]. На поздних этапах реакции на стресс, когда минералокортикоидные рецепторы насыщаются, а глюкокортикоидные становятся все более занятыми, они способны осуществлять противовоспалительные действия [120]. С возрастом изменяется содержание в крови многих цитокинов, играющих ключевую роль в активации врожденного и адаптивного иммунитета. Так, связанное со старением слабое воспаление, приводящее к уменьшению длины теломер, одновременно характеризуется увеличением уровня провоспалительных и противовоспалительных цитокинов [124]. Концентрация провоспалительных цитокинов TNFα и IL-1β в крови лиц старших возрастных групп увеличена [27, 37]. Более того, в стареющем мозге микроглия, реагируя на стресс, продуцирует больше провоспалительных цитокинов (IL-1β, IL-6, TNFα) и синтез их длится дольше, чем у лиц молодого возраста. Избыточная воспалительная реакция головного мозга, возникающая в результате старения и вторичного иммунного ответа, может способствовать снижению нейротрофина BDNF (brain-derived neurotrophic factor), необходимого для осуществления процессов пластичности [95]. Все это может способствовать развитию БА и других дегенеративных заболеваний ЦНС, тогда как IL-4, IL-10, IL-13 и TGFβ способны приводить к противоположным результатам [58].
При обследовании здоровых испытуемых в возрасте от 23 до 87 лет выявлена линейная корреляция между уровнем IL-6 и сроком жизни человека: чем выше в крови была концентрация IL-6, тем меньше оказалась продолжительность жизни [66]. Линейно связанными с уровнем IL-6 оказались фибриноген, α2-макроглобулин и D-димер, что свидетельствует о значительном усилении внутрисосудистого свертывания крови и торможении фибринолиза [3, 16, 23]. Согласно данным Kaptoge et al. [70], по мере старения не только возрастает концентрация IL-6 в крови, но и увеличивается риск развития ИБС, в том числе ИМ. Аналогичные данные касаются IL-18 [51]. Установлено, что “стареющие” Т-клетки продуцируют пониженный уровень противовирусного цитокина – IFN-γ, и повышенные концентрации провоспалительных цитокинов – IL-6 и TNFα [64].
Все представленные данные свидетельствуют о том, что в ответ на стресс функции иммунной системы изменяются и во многом зависят от фазы стресса. В то же время сдвиги со стороны иммунной системы при старении во многом похожи на те, которые происходят во время хронического стресса.
ПРОЦЕСС ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ И БЕЛКОВ, СТРЕСС И СТАРЕНИЕ
Производство АФК и активных форм азота (АФА) является частью нормального аэробного клеточного метаболизма. Хотя базальные уровни АФК/АФА необходимы для окислительно-восстановительной сигнализации и выживания клеток, интенсивные процессы АФК/АФА являются токсичными для клеток, сопровождают стресс, а также способствуют старению и развитию многочисленных возраст-ассоциированных заболеваний [96]. При оксидативном стрессе интенсивность синтеза АФК и АФА превосходит антиоксидантную активность защитных систем клетки, происходит повреждение ДНК, липидов и белков. Накопление поврежденных молекул, не восстановленных с помощью репаративной системы клетки и не подвергнутых утилизации, часто приводят к апоптозу. Эти же процессы лежат и в основе старения организма [126] Окислительный стресс является предрасполагающими фактором для возникновения различных заболеваний, вызывая повреждение клеток и ДНК, активацию ферментов, усиление воспалительных реакций. Окислительный стресс, вызванный повышенным уровнем окислителей или ослабленными механизмами антиоксидантной защиты, отмечается при различных дегенеративных расстройствах и может играть роль в этиопатогенезе таких заболеваний, как шизофрения, БА, болезнь Паркинсона [65].
Одной из основных мишеней окислительного стресса являются нуклеотиды. Под влиянием стресса могут возникать разрывы и модификации оснований в ДНК. Мутации ДНК способны влиять на системы внутриклеточных мессенджеров, приводя к аномальной метаболической активности, изменениям в экспрессии генов и мембранным дисфункциям.
Окислительный стресс приводит к укорочению длины теломер, способствует репликативному старению клеток и уменьшению продолжительности жизни [59, 103, 122]. При этом снижается уровень теломеразы, которая не только влияет на длину теломер, но и обладает способностью защищать митохондрии от окислительного стресса [59, 64].
Между тем, многие продукты окисления белков или липидов могут быть полезны для выживания клеток. Такие соединения обычно образуются при умеренной интенсивности окислительного стресса, который можно обозначить как “положительный” окислительным стресс. Этот тип стресса является частью адаптивного ответа, защищающий клетки от распространенного окислительного повреждения и гибели [55].
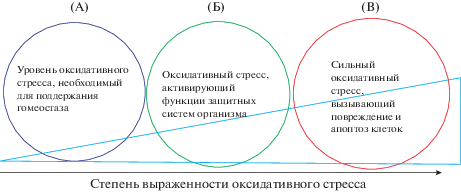
L.J. Yan [126] предлагает следующую схему отрицательного и положительного влияния стресса на деятельность организма (рис. 3).
Рис. 3.
Уровень окислительного стресса и его дифференциальные эффекты в клетке [126]. Примечание. А – базальный уровень окислительного стресса, необходимый для выживания клеток и гомеостаза, Б – положительный окислительный стресс, вызываемый многими жизненными проблемами и приводящий к окислительной модификации белка, В – сильный окислительный стресс, вызывающий повреждение и гибель клеток.
СИСТЕМА ГЕМОСТАЗА, СТРЕСС И СТАРЕНИЕ
Значительные изменения в процессе старения претерпевает система гемостаза. По мере старения у людей наблюдается усиление агрегационной активности тромбоцитов. Индекс лимфоцитарно-тромбоцитарной адгезии у пожилых людей по сравнению с молодыми лишь незначительно снижается, но не выходит за пределы допустимых норм. По мере старения организма развивается гиперкоагуляция, увеличивается содержание фибриногена, растворимых фибринмономерных комплексов (РФМК) и D-димера, падает активность антитромбина III и С-реактивного белка, тормозится фибринолиз. У пожилых людей в периферической крови увеличивается экспрессия тканевого фактора (TF) лейкоцитами, что является одной из причин развития гиперкоагуляции. Кроме того, при старении усиливается постоянное внутрисосудистое свертывание крови и развивается предтромботическое состояние, что при действии стрессирующих факторов способно привести к тромбозу [18].
D.G. Stott et al. [109] изучали взаимосвязь между интенсивностью внутрисосудистого свертывания крови и когнитивными функциями более чем у 5800 людей в возрасте от 70 до 85 лет. При этом оказалось, что повышение уровня маркеров активации внутрисосудистого свертывания крови, в том числе D-димера и фрагментов протромбина 1 и 2, являются независимыми прогностическими факторами увеличения частоты когнитивных нарушений, ухудшения качества и продолжительности жизни. Эта взаимосвязь проявлялась у людей, перенесших инсульт, а также при наличии высокой концентрации IL-6 и С-реактивного белка в крови.
Любые стрессорные воздействия, приводящие к констрикции или дилатации кровеносных сосудов, способствуют усилению агрегации тромбоцитов, увеличению экспрессии TF и активатора плазминогена эндотелиальными клетками, что сопровождается развитием гиперкоагуляции и усилением фибринолиза [1, 11, 16]. Эти приспособительные реакции направлены на остановку кровотечения в случае повреждения кровеносных сосудов. В то же время при действии сильных и длительно действующих стрессорных раздражителей вслед за гиперкоагуляцией возникает фаза вторичной гипокоагуляции, обусловленная недостатком тромбоцитов и основных факторов свертывания крови, в том числе фибриногена, а также появлением вторичных антикоагулянтов – продуктов деградации факторов свертывания крови, фибриногена и фибрина [1, 3, 4]. Подобное состояние может возникать в предполетный период у космонавтов [79]. При старении характер адекватных реакций со стороны системы гемостаза на стресс нарушается, что приводит к торможению фибринолиза за счет увеличения экспрессии и секреции ингибитора активатора плазминогена 1 (PAI-1) и ингибитора фибринолиза, активированного тромбином TAFI (thrombin activated fibrinolysis activation) [16, 125].
При старении эндотелия увеличивается число слущивающихся клеток, обладающих прокоагулянтной активностью, а также усиливается экспрессия TF, фактора фон Виллебранда (vWF) и PAI-1, что является одной из причин возникновения тромбоэмболических осложнений [52]. Экспрессия PAI-1 повышена у пожилых людей и при различных патологических состояниях (ожирение, инсулинорезистентность, эмоциональный стресс, атеросклероз) [125]. Некоторые цитокины и гормоны, включая TNFα, TGFβ, ангиотензин II и инсулин, усиливают экспрессию гена PAI-1. Увеличение числа людей с ожирением может повысить риск развития сердечно-сосудистых заболеваний, поскольку жировая ткань является одним из основных источников PAI-1 и провоспалительных цитокинов. Эмоциональный или психосоциальный стресс и воспаление в пожилом и старческом возрасте также вызывают повышенную экспрессию PAI-1. Следовательно, PAI-1 может играть ключевую роль в прогрессировании старения сердечно-сосудистой системы, способствуя развитию тромбозов и атеросклероза. Cогласно нашим данным, провоспалительные цитокины IL-1α, и β, IL-6, IL-8, TNFα ускоряют процесс свертывания крови, тогда как противовоспалительные цитокины IL-4, IL-10 тормозят этот процесс [4–6, 16, 27].
R. von Känel [121] считает, что …“индуцированная стрессом активация симпатоадреналовой медуллярной системы стимулирует как коагуляцию, так и фибринолитическую систему, что приводит к общей гиперкоагуляции. Острый психический стресс, негативные эмоции и психологическая травма также являются пусковыми факторами атеротромботических явлений и, возможно, венозной тромбоэмболии. Пациенты с атеросклерозом и нарушенной функцией антикоагулянтов являются наиболее уязвимыми для возникновения острых коронарных событий в течение двух часов интенсивных эмоций. Ряд социально-демографических и психосоциальных факторов может критически усиливать и продлевать вызванную стрессом гиперкоагуляцию, способствуя развитию тромботических осложнений”.
У пациентов с атеросклерозом длительная стресс-гиперкоагуляция после разрыва бляшки может ускорить рост коронарного тромба. На фоне риска от приобретенных протромботических состояний и наследственной тромбофилии острый стресс также может спровоцировать венозные тромбоэмболические осложнения. В то же время постоянный стресс вызывает хроническую гиперкоагуляцию, способствующую поражению сосудистой стенки и развитию тромбоза [36].
При старении, когда состояние системы гемостаза свидетельствует о тромботической готовности, сильные стрессирующие факторы могут не только приводить к усилению постоянного внутрисосудистого свертывания крови и развитию тромбоэмболических состояний, но и способствовать усиленному потреблению тромбоцитов и плазменных факторов свертывания крови, что может привести к возникновению кровотечений, на что еще в 1964 г. указывал Ганс Селье в своей работе “Thrombohemorrhagie Phenomena” [104].
Следует отметить, что действие системы гемостаза направлено не только на борьбу с кровотечениями или тромбозами. Известно, что белки системы гемостаза, переходя в активное состояние, и особенно тромбин, являются регуляторами многих физиологических функций. Так, фибриноген, переходя в фибрин, не только обеспечивает остановку кровотечения при травме сосудов, но без него не происходит репарация поврежденных клеток и органов, ибо он является матрицей для образования и разрастания соединительной ткани. В то же время появляющийся в процессе свертывания крови тромбин и другие сериновые протеиназы, воздействуя на моноциты и макрофаги, усиливают синтез и экзоцитоз IL-1, IL-6 и других провоспалительных цитокинов, что способствует образованию белков острой фазы воспаления, в том числе фибриногена. Эта реакция осуществляется через протеиназактивируемый рецептор PAR-1 (proteinase activated receptor) [82]. Под воздействием тромбина значительно усиливается фагоцитоз, а также репаративные процессы в поврежденных клетках и тканях [7, 16, 36].
В нейронах базальных ганглиев, таламуса, гипоталамуса, гиппокампа, мозжечка и коры головного мозга обнаружена экспрессия генов и мРНК протромбина, фактора Х свертывания крови, фибриногена и фибринолитических агентов (активатора плазминогена и др.). В нервной ткани в довольно высоких концентрациях содержится тромбин [2]. После повреждения нервной ткани концентрация тромбина в первые 3 дня резко возрастает и превышает контрольные цифры в 10 раз [7]. Под воздействием тромбина и фактора X значительно возрастает выживаемости гиппокампальных нейронов [7, 37], что играет важную роль в сохранении когнитивных функций, в том числе кратковременной и долговременной памяти. В то же время гипертромбинемия, наблюдаемая при развитии патологических процессов, а также в пожилом и старческом возрасте, способствуя нарушению кровообращения в артериолах, прекапиллярах и капиллярах, приводит к гипоксии и нарушениям функций ЦНС [3, 16, 18]. В клетках нервной системы имеется специфический ингибитор тромбина – нексин-1. При повреждении нерва концентрация нексина-1 в нервной ткани возрастает лишь на 7–9 день [2]. Возникает предположение, что тромбин в нейронах необходим не только для восстановления и репарации поврежденных нервных клеток и их оболочек, но и для проведения нервного импульса [16].
Установлено, что компоненты фибринолиза играют важную роль в удалении внеклеточного матрикса и апоптозе, принимают участие в реакциях врожденного и адаптивного иммунитета, регулируют деление клеток, заживление ран, регенерацию мышц, рост и метастазирование опухолей [63, 102]. В частности, активный протеин С (protein C active, РСа) ингибирует активацию и агрегацию тромбоцитов, тормозит образование провоспалительных цитокинов моноцитами и макрофагами, снижает процессы клеточной адгезии. Если РС связывается с рецептором EPCR, то ускоряется его активация. Последний также способен вступать во взаимодействие с EPCR и при этом образующийся комплекс активирует PAR-1. Благодаря этим взаимосвязям РСа блокирует воспаление, проявляет антиапоптотическое действие и ускоряет заживление ран, изменяя профиль экспрессии генов в эндотелиальных клетках. Кроме того, под влиянием образовавшегося комплекса снижается синтез провоспалительных цитокинов активированными моноцитами. Воздействуя на PAR-1, РСа задерживает появление ранних признаков повреждения сердечной мышцы при моделировании ишемии или реперфузии миокарда, а также блокирует провоспалительный эффект IL-1 [83]. При этом РСа защищает нейроны мозга от глутаматной эксайтотоксичности.
Представленные факты свидетельствуют о том, насколько важно усиление процесса свертывания крови и фибринолиза не только для остановки кровотечения в случае повреждения сосудов, но и для нормализации функций различных клеток, органов и тканей, в том числе нейронов головного мозга. В то же время значительное усиление гиперкоагуляции в пожилом и старческом возрасте, связанное с гипертромбинемией, на фоне стресса нередко приводит к тяжелейшим тромботическим осложнениям и смерти.
БЕЛКИ “МОЛОДОСТИ И СТАРОСТИ”
Ряд исследователей [93, 118, 119, 124], применивших метод гетерохронического парабиоза, показали, что в крови старых особей находятся соединения, вызывающие в мозге молодых животных изменения, свойственные старым особям – у молодых не только ухудшались когнитивные функции, но и усиливались дегенеративные процессы в ЦНС, в том числе в гиппокампе. В то же время у старых мышей под влиянием крови молодых особей психические функции значительно улучшались, они лучше решали пространственно-навигационные задачи, у них улучшалась кратковременная и долговременная память, а в гиппокампе и зубчатой извилине увеличивалось число функционально активных нейронов. На основании полученных результатов авторы предположили, что в крови старых животных имеются соединения, ускоряющие процесс старения у молодых животных, тогда как в крови молодых особей существуют факторы, обладающие “омолаживающим” действием. В последствии эти соединения получили наименование “белки молодости и старости” [20]. К “белкам молодости” можно отнести GDF11 (дифференцировочный фактор роста 11, growth differentiation factor 11) [44, 47, 60, 98], регулятор длины теломер, гормон ирисин [19, 22, 45, 71, 123, 128], регулятор пролиферации клеток поджелудочной железы – бетатрофин [20], соединение, обеспечивающее на самых ранних стадиях развития организма пластичность ЦНС, тканевой ингибитор металлопротеазы 2 (tissue inhibitor of metalloproteinase 2) – TIMP-2 [56, 69], мезэнцефальный астроцитоподобный нейротрофический фактор (mesencephalic astrocyte-derived neurotrophic factor) MANF [56], фактор роста нервов (nerve growth factor) – NGF [108], а также факторы роста фибробластов 19, 21, 23 (fibroblast growth factors) – FGF19, FGF21, FGF23 [31, 40], обладающие геропротекторными свойствами и действующие как эндокринные гормоны. К “белкам молодости” следует также отнести внеклеточную никотинамидфосфорибозилтрансферазу – NAMPT, являющуюся лимитирующим звеном энергетического обмена клеток [127]. Всем “белкам молодости” присуши общие свойства, способствующие продлению и улучшению качества жизни. Их концентрация в крови уменьшается по мере старения [49, 61, 99, 120, 128]. В экспериментах на животных доказано, что эти белки обладают противовоспалительным, антиапоптотическим, антиоксидантным и антисклеротическим действием, способствуют репарации ДНК, стимулируют когнитивные функции, препятствуют развитию дегенеративных и травматических поражений ЦНС [56, 118, 119, 124]. Под их воздействием нормализуется состояние клеточного и гуморального иммунитета, липидного спектра, перикисное окисление липидов, системы гемостаза, синтез половых гормонов и кардиогемодинамические функции [8, 9, 19, 21, 31, 44]. Концентрация “белков молодости” уменьшается при травматических и дегенеративных заболеваниях ЦНС, в том числе при БА и болезни Паркинсона [72, 119], при поражениях сердечно-сосудистой системы, метаболическом синдроме, диабете, онкологических заболеваниях [8, 9, 44, 99].
К “белкам старости” относят хемокин (эотаксин-1) CCL11 [74, 118, 119], макрофагальный ингибитор цитокина-1 MIC-1 (macrophage inhibitory cytokine 1), трансформирующий фактор роста 15 GDF15 (growth differentiation factor 15) – [39], семейство адгезивных молекул JAMs (junctional adhesion molecules), охватывающее три классических молекулы – JAM-A/1, JAM-B/2 и JAM-C/3, β-2-микроглобулин (β2Mg) [118, 124], алармин-1 [32]. Их свойства прямо противоположны “белкам молодости”. Содержание “белков старости” в крови c увеличением возраста повышается. Концентрация этих соединений возрастет при травматических и дегенеративных заболеваниях ЦНС, поражениях сердечно-сосудистой системы, онкологических заболеваниях и другой ассоциированной с возрастом патологии [24, 32, 39]. Подробные сведения о белках “молодости и старости” представлены в зарубежных [68, 73, 100, 123, 124] и отечественных обзорах [19, 24, 31, 32, 39, 41, 44].
Положительные экспериментальные результаты в опытах с гетерохроническим парабиозом [93, 118, 119, 124] а также с переливанием плазмы от молодых к старым животным с наличием признаков БА [56] не могли не привлечь внимание исследователей. Возможно, что омоложение на основе крови может замедлить темп старения организма, а также значительно улучшить когнитивные функции пациентов с БА [69]. Более того, в Стэнфорде (Калифорния, США) было проведено рандомизированное плацебо-контролируемое двойное слепое испытание для проверки безопасности и эффективности использования плазмы молодых людей для лечения дегенеративных заболеваний ЦНС, в том числе БА. Результаты исследования оказались обнадеживающими: метод был признан выполнимым и безопасным для пациентов с легкой и умеренной формой БА [77].
Amico et al. [46] указывают, что …“Молодой возраст донора после переливания крови может повлиять на выздоровление после серьезного травматического инсульта и помочь избежать посттравматического иммунного паралича и связанных с ним осложнений”.
В то же время для оценки эффективности и безопасности вливаний плазмы в качестве профилактического или терапевтического варианта при нейродегенеративных заболеваниях, в том числе БА, необходимы крупные рандомизированные контролируемые исследования: только тогда можно будет выяснить, оправдывают ли преимущества этого лечения его риски [69, 86]. Дальнейшие исследования должны быть сосредоточены на определении “оптимального возраста”, в котором вмешательство у людей может привести к значительному улучшению когнитивных функций, а также на определении типов переливаний с наилучшей эффективностью и переносимостью. Если переливание плазмы молодых людей будет эффективным у пациентов с БА, важно определить ключевые факторы, ответственные за положительные результаты. Задачей молекулярной медицины является также создание на основе полученных данных фармакологически чистых препаратов, способных заменить плазму молодых доноров [124].
ЭПИГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ СИНТЕЗА БЕЛКОВ ТЕПЛОВОГО ШОКА, “МОЛОДОСТИ” И “СТАРОСТИ”, ИММУНИТЕТА, СИСТЕМЫ ГЕМОСТАЗА И ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ
Необходимо подчеркнуть, что переливание плазмы и тем более крови от молодых людей пациентам пожилого и старческого возраста в ряде случаев может быть небезопасным. Даже при самом строгом отборе доноров всегда существует опасность заражения СПИДом, гепатитами В и С, и другими трудно поддающимися терапии заболеваниями. Кровь и плазма содержат чужеродные антигены, способные привести к развитию аллергических реакций [149 ] . Более того, в целях “омоложения” организма и улучшения качества жизни необходимо наличие таких препаратов, которые одновременно воздействуют на все защитные системы организма – белки теплового шока, иммунитет, систему гемостаза, перекисное окисление липидов, белки “молодости и старости”. К таким веществам могу быть отнесены эпигенетические регуляторы, способные одновременно вовлекать в ответную реакцию значительное число генов, в том числе те гены, от которых зависят гуморальные защитные системы организма. Такими регуляторами могут быть короткие пептиды, эпигенетически воздействующие на геном и получившие наименование “цитогены” [42, 43, 73, 75, 76]. Среди них следует выделить геропротекторные пептиды Lys-Glu (вилон), Glu-Trp (тимоген), Ala-Glu-Asp-Gly (эпиталон), Glu-Asp-Arg (пинеалон), Ala-Glu-Asp-Pro (кортаген) и Ala-Glu-Asp-Arg (кардиоген) [24, 42, 43].
Вся информация, поступающая в живой организм, контролируется системой биорегуляции, действие которой направлено на сохранение высокой степени стабильности функционирования генома. Следовательно, основная задача системы биорегуляции заключается в управлении экспрессией генов, процессами биосинтеза и защитными функциями организма. Информация об изменениях внешней и внутренней среды служит фактором, который индуцирует трансформацию в системе биорегуляции, необходимую для сохранения определенного уровня функциональной активности клеток. Поэтому взаимодействие генома с информационными молекулами, в частности, с регуляторными пептидами (РП), играет важную роль в поддержании клеточного гомеостаза [38, 73, 76].
Установлено, что многие РП обладают рядом геропротекторных эффектов – увеличивают продолжительность жизни животных, индуцируют дифференцировку и пролиферацию клеток [42, 43, 75, 76]. Результаты исследований биологической активности РП показали, что они могут стимулировать экспрессию генов HSP, что во многом объясняет широту их стресс-протекторных и геропротекторных эффектов. В промоторной зоне гена белка HSP70 обнаружены сайты связывания для РП вилона и эпиталона.
Промоторный участок гена белка HSP70 содержит пятичленный нуклеотидный блок CATGG, повторяющийся 4 раза и способный взаимодействовать с трипептидом Glu-Asp-Gly [28]. Пептид Lys-Glu способен взаимодействовать с генами провоспалительных (IL-6, IL-17A и TNFα) и противовоспалительных цитокинов (IL-4 и IL-10), а также генами иммунного цитокина IL-5. Пептид Ala-Glu-Asp-Gly также может вступать во взаимосвязь с генами IL-1α и IL-2. Число сайтов связывания для Lys-Glu и Ala-Glu-Asp-Gly в гене IL-6 одинаково; в гене TNFα для Lys-Glu в 2.5 раза, а в гене IL-17A – в 2 раза больше, чем для Ala-Glu-Asp-Gly. Число последовательностей, связывающихся с Ala-Glu-Asp-Gly, в генах IL-4 и IL-10 в 2–3 раза превышает число таковых для Lys-Glu. Количество последовательностей в гене IL-5, способных реагировать с Ala-Glu-Asp-Gly, в 10 раз превышает содержание таковых для Lys-Glu. В промоторной зоне гена IL-2 имеется 16 сайтов связывания с Ala-Glu-Asp-Gly. Наконец, для Lys-Glu в промоторном участке гена IL-3 имеется два сайта связывания, и три сайта связывания для Ala-Glu-Asp-Gly [26, 27].
В промоторном участке гена TF обнаружены 5 сайтов связывания для тетрапептида Ala-Glu-Asp-Gly и 6 сайтов связывания для дипептида Lys-Glu. Следовательно, ди- и тетрапептид могут связываться с геном TF в регуляторной области и активировать или тормозить его экспрессию.
В промоторной зоне гена антитромбина III обнаружено 7 сайтов связывания для тетрапептида и 1 – для дипептида. В промоторном участке гена протеина С были найдены 3 сайта связывания для Ala-Glu-Asp-Gly и 5 – для Lys-Glu [44]. Полученные данные свидетельствуют о том, что состояние системы гемостаза в каждом конкретном случае будет зависеть от сочетания экспрессии и супрессии генов TF и основных естественных антикоагулянтов A-III и РС [16].
Что касается фибринолиза, то выявлены сайты связывания РП в генах плазминогена (Pl), тканевого (t-PA) и урокиназного (u-PA) активаторов плазминогена, а также PAI-1. В промоторном участке гена Pl содержится 7 участков связывания для Lys-Glu и только 3 зоны связи для Ala-Glu-Asp- Gly. В промоторной зоне гена t-PA находится один сайт связывания для Lys-Glu и 3 сайта связывания для Ala-Glu-Asp-Gly. В промоторной зоне гена u-PA находится по 3 участка связывания для каждого из РП. В гене u-PA было найдено по три сайта связывания для каждого пептида. Наконец в промоторном участке PAI-1 выявлено 2 зоны связывания с Lys-Glu и 12 – для Ala-Glu-Asp-Gly.
В промоторах генов практически всех белков “молодости и старости” найдены сайты связывания для целого ряда регуляторных пептидов, в том числе для вилона, тимогена, эпиталона, пинеалона, кортагена и кардиогена. В промоторных участках гена GDF11 человека содержится 3 сайта связывания для Lys-Glu, 2 – для Ala-Glu-Asp-Gly, 2 – для Glu-Asp-Arg, 2 – для Ala-Glu-Asp-Pro и 4 – для Ala-Glu-Asp-Pro [44].
Для белка ирисина (FNDC5) существует 2 транскрипта и соответственно две промоторных области. В первом транскрипте гена FNDC5 выявлена одна зона связывания с Glu-Asp-Arg и 10 – для Lys-Glu. Во втором транскрипте гена FNDC5 обнаружено 5 участков взаимодействия с Glu-Asp-Arg и 13 – с Lys-Glu [45]. Полученные данные позволяют предполагать, что пептиды Glu-Asp-Arg и Lys-Glu проявляют свое геропртекторное и увеличивающее устойчивость к физическим нагрузкам действие путем влияния на ген FNDC5, кодирующий образование гормона ирисина [45].
Ген бетатрофина человека имеет название C19orf80, а аналогичный ген мыши – Gm6484. В промоторном участке гена C19orf80 имеется 4 сайта связывания для Lys-Glu, 1 сайт связывания для Ala-Glu-Asp-Gly, и 5 сайтов связывания для Ala-Glu-Asp-Arg. В промоторе гена Gm6484 найдено 4 сайта связывания для Lys-Glu и 1 сайт связывания для Ala-Glu-Asp-Arg.
Для пептида Lys-Glu в промоторе гена FGF19 человека находится 3 сайта связывания, представленные последовательностями GCAG и GACG, 1 сайт связывания для Lys-Glu-Asp с последовательностью CCTGCC и 1 сайт связывания CTTTA для пептида Ala-Glu-Asp-Gly. В промоторе гена FGF19 мыши находится 2 сайта связывания для пептида Lys-Glu. Анализ промоторного участка гена FGF21 человека указывает на наличие 3 сайтов связывания для пептида Lys-Glu, 1 сайта связывания CCTGCC для пептида Lys-Glu-Asp и 1 – для пептида Ala-Glu-Asp-Gly. В промоторной области гена FGF21 мыши найден 1 сайт связывания для пептида Lys-Glu. Для промоторного участка гена FGF23 человека обнаружено 8 сайтов связывания для пептида Lys-Glu, 1 – для пептида Glu-Asp-Arg и 2 для пептида Ala-Glu-Asp-Gly. Ген FGF23 мыши содержит в своем промоторе по 1 сайту связывания для каждого из пептидов Lys-Glu, Lys-Glu-Asp и Ala-Glu-Asp-Gly [31, 40].
В промоторе гена TIMP-2 выявлен 1 сайт связывания для Lys-Glu.
Для РП также найдены сайты связывания в генах, кодирующих синтез “белков старости”. В промоторе гена CCL11 человека находится 4 сайта связывания для Glu-Trp, 10 сайтов связывания для Ala-Glu-Asp-Pro и 3 сайта связывания для Ala-Glu-Asp-Arg. В промоторных участках генов CCL11 мыши обнаружено по одному сайту связывания для Ala-Glu-Asp-Pro и Ala-Glu-Asp-Gly, а также 3 сайта связывания для Ala-Glu-Asp-Arg [41, 74].
В промоторах 1 и 3 гена HMGB1 содержатся сайты связывания для Lys-Glu (10 и 5 соответственно). В промоторах 2 и 4 гена HMGB1 находится соответственно 5 и 8 сайтов связывания для Lys-Glu и по одному для Ala-Glu-Asp-Gly. В промоторе 5 гена HMGB1 обнаружен один сайт связывания для Lys-Glu и 4 – для Ala-Glu-Asp-Gly [32, 41].
В промоторе гена MIC1/GDF15 находится 6 сайтов связывания для дипептида Lys-Glu, 4 сайта – для Lys-Glu-Asp и 5 – для Ala-Glu-Asp-Gly [39].
В промоторе 1 гена JAM-A находится 11 сайтов связывания для Lys-Glu. В промоторе 2 гена JAM-A обнаружено 4 сайта связывания для Lys-Glu и 6 –для Lys-Glu-Asp. В промоторе 2 выявлен 1 сайт связывания для Ala-Glu-Asp-Gly.
В экспериментах и клинических исследованиях установлено, что РП оказывают влияние на реакции врожденного и приобретенного клеточного и гуморального иммунитета, изменяют состояние сосудисто-тромбоцитарного гемостаза, свертывания крови и фибринолиза, цитокинового обмена, HSP, процессов перекисного окисления липидов и антирадикальной защиты [5, 16, 30, 42, 43]. У больных сахарным диабетом 1 типа [13, 25], болезнью Грейвса [17], хирургической инфекцией, ожогами и отморожениями [30, 42, 43] пептиды Lys-Glu и Ala-Glu-Asp-Gly вызвали нормализацию клеточного и гуморального иммунитета, сосудисто-тромбоцитарного гемостаза, свертывания крови и фибринолиза и процессов перекисного окисления липидов. При этом наблюдалось торможение внешнего и внутреннего пути образования протромбиназы, увеличения содержания основных естественных антикоагулянтов – антитромбина III и протеина С, и стимуляция фибринолиза [13, 16, 25, 27, 29, 30, 42, 43]. Можно полагать, что эти сдвиги обусловлены эпигенетическим действием указанных РП.
ЗАКЛЮЧЕНИЕ
Представленные данные свидетельствуют о том, что гуморальные защитные системы организма, а также белки “молодости и старости” включаются в защитные реакции практически одновременно при действии стрессорных факторов. Инициаторами защитных реакций при действии этих факторов могут быть короткие пептиды, способные эпигенетически регулировать экспрессию генов защитных гуморальных системы организма. При этом защитные реакции в момент действия стрессорного фактора (стадия тревоги) должны вступать в защитную реакцию очень быстро, хотя их пик активности достигается не одновременно. Так, белки теплового шока на действие стрессорного фактора включаются лишь после того, как активируются внутриклеточные сигнальные каскады. Между тем, сосудисто-тромбоцитарный и плазменный гемостаз, а также фибринолитическая активность крови вовлекаются в защитную реакцию практически мгновенно (секунды). Для врожденного иммунитета (фагоцитоз, активация системы комплемента) в зависимости от силы стрессорного фактора требуется минуты и часы, тогда как реакции врожденного иммунитета развиваются относительно медленно и работают в полную силу лишь тогда, когда с чужеродным агентом не справляется врожденный иммунитет.
В стадии резистентности деятельность ЕГЗСО находится на пике своей активности. И, наконец, в стадии истощения снижаются резервные возможности организма. Белки теплового шока при этом не способны проявлять защитные функции и клетки, подвергающиеся действию стрессорного фактора, вступают в апоптоз. В системе перикисного окисления липидов действие оксидантов в эту стадию преобладает над влиянием антиоксидантов. Со стороны системы гемостаза отмечается тромбинемия с одновременным накоплением продуктов деградации фибриногена и фибрина, обладающих антиагрегантным и антикоагулянтным действием. Все это может привести к тромбозу, диссеминированному внутрисосудистому свертыванию крови (ДВС-синдрому), сопровождаемому развитием кровоточивости.
Если организм справляется со стрессом, то резистентность, минуя истощение, переходит в стадию восстановления, когда к норме возвращается активность всех защитных систем организма. Скорость этих реакций определяется силой и продолжительностью действия стрессорного агента и индивидуальными особенностями состояния ЕГЗСО.
Эпигенетическими регуляторами гуморальных защитных систем организма и белков “молодости и старости” являются короткие биорегулирующие пептиды, “цитогены”. Среди них особо следует отметить пептиды Lys-Glu и Ala-Glu-Asp-Gly. При действии стрессорного фактора, оказывает влияние на геном комплекс различных цитогенов. Не исключено, что их состав может меняться в зависимости от характера действующего раздражителя.
То, что различные гуморальные защитные системы организма (белки теплового шока, врожденный и адаптивный иммунитет, системы антиоксидантов и гемостаза, белки “молодости и старости”) активируются при действии различных стрессорных факторов одновременно и под влиянием одних и тех же цитогенов подтверждает наличие единой гуморальной защитной системы организма ЕГЗСО.
Изменение активности гуморальной защитной системы, врожденного и гуморального иммунитета, системы антиоксидантов, сосудисто-тромбоцитарного и коагуляционного гемостаза, фибринолиза и белков “молодости и старости” носят однотипный характер при стрессе и при старении. Исходя из этого можно полагать, что процесс старения представляет из себя затянувшийся хронический стресс, который приводит к полному истощению ЕГЗС. Поэтому усиление ЕГЗС, в том числе с помощью РП, действующих на эту систему и способствующих экспрессии “белков молодости” и супрессии “белков старости”, может не только увеличивать срок жизни, но и значительно улучшить ее качество.
Можно представить включение реакции ЕГЗС в ответ на действие стрессорных факторов следующим образом. Известно существование гипоталамо-гипофизарно-надпочечниковой (ГГНО) и гипоталамо-гипофизарно-симпато-адреналовая (ГГАО) осей, ответственных за комплекс основных физиологических и биохимических реакций, возникающих при стрессе. Но кроме того, существуют гипоталамо-гипофизарно-тиреоидная (ГГТО), гипоталамо-гипофизарно-тимусная (ГГТО) и гипоталамо-гипофизарно-эпифизарная оси (ГГЭО). С некоторой долей вероятности можно предположить, что через ГГТО происходит освобождение пептида Lys-Glu, через ГГЭО – выделение пептида Ala-Glu-Asp-Gly, а через ГТТО – других цитогенов, включающих в реакцию на стресс ЕГЗС. Можно также полагать, что пептид Lys-Glu входит в состав тимопоэтинов, синтезируемых и секретируемых тимусом, а пептид Ala-Glu-Asp-Gly – в состав гормонов эпифиза. При протеолизе этих гормонов могут образовываться цитогены, активирующие ЕГЗС. Такие же реакции могут возникать и через основные стрессорные оси (ГГНО и ГГАО) а также через ГГТО.
Усиливать действие “белков молодости” на различные физиологические функции организма можно путем супрессии генов, ответственных за производство “белков старости” [32, 39, 73]. Пептиды Glu-Asp-Arg и Lys-Glu-Asp in vitro способны восстанавливать число шипиков нейронов в моделях БА и болезни Хантингтона [14, 78].
Не исключено, что в дальнейшем эти вещества могут оказаться эффективными при БА и других дегенеративных заболеваниях. Одним из перспективнейших препаратов, используемых для лечения дегенеративных заболеваний ЦНС, является комплекс полипептидов, выделенных из коры головного мозга (лекарственный препарат Кортексин), в составе которого может находиться пептид Ala-Glu-Asp-Pro. Применение Кортексина в дозировке 20 мг/сутки двумя курсами по 10 дней с перерывом в 3 месяца улучшает самочувствие, снижает выраженность депрессии и улучшает память у пациентов с нейродегенеративными заболеваниями [42, 43].
Можно предположить, что дальнейшие исследования, проводимые в данном направлении, позволят выявить те белки и цитогены, которые будут наиболее эффективными для эпигенетической регуляции экспрессии генов и синтеза белков ЕГЗС, способствующих увеличению продолжительности и улучшению качества жизни.
Список литературы
Алексеева О.В., Бондарчук Ю.А., Шахматов И.И. и др. Роль психоэмоционального компонента стрессорного воздействия в реакции системы гемостаза на дозированные физические нагрузки в эксперименте // Теория и практика физической культуры. 2019. № 1. С. 29–31.
Балезина О.П., Герасименко Н.Ю., Дугина Т.Н. и др. Особенности нейротропного действия тромбина // Успехи физиологических наук. 2004. № 3. С. 39–49.
Баркаган З.С., Момот А.П. Современные аспекты патогенеза, диагностики и терапии ДВС-синдрома // Вестник гематологии. 2005. № 2. С. 3–15.
Витковский Ю.А., Кузник Б.И. Влияние интерлейкина-1 на способность лимфоцитов выделять факторы, влияющие на адгезию и агрегацию тромбоцитов, свертывание крови и фибринолиз // Российский физиологический журнал им. И.М. Сеченова. 2002. Т. 88(4). С. 468–475.
Витковский Ю.А., Кузник Б.И., Солпов А.В. Взаимодействие лейкоцитов и тромбоцитов с эндотелием и ДВС-синдром // Тромбоз, гемостаз и реология. 2006. № 1. С. 15–28.
Витковский Ю.А., Кузник Б.И., Солпов А.В. Влияние интерлейкинов 1β и 8 на секрецию Т- и В-лимфоцитами прокоагулянтов, антикоагулянтов и фибринолитических агентов // Иммунология. 2001. № 6. С. 24–27.
Горбачева Л.Р., Сторожевых Т.П., Пинелис В.Г. и др. Модуляция тромбином и фактором Xa выживаемости гиппокампальных нейронов // Биохимия, 2006. Т. 71(10). С. 1338–1346.
Гусева Е.С. Давыдов С.О. Кузник Б.И. и др. Роль дифференцировочного фактора роста 11 (GDF11) в регуляции липидного обмена и кардиогемодинамических функций у больных гипертонической болезнью при умеренной физической нагрузке// Российский кардиологический журнал. 2018. № 4. С. 93–98.
Давыдов С.О., Кузник Б.И., Степанов А.В. и др. Влияние кинезитерапии на содержание “гормона молодости” ирисина у здоровых и больных ишемической болезнью сердца // Вестник восстановительной медицины. 2015. № 5 С. 91–98.
Драпкина О.М. Особенности синтеза белков теплового шока у больных постинфарктным кардиосклерозом // Клиническая медицина. 2004. № 9. С. 25–28.
Киселев В.И., Шахматов И.И., Вдовин В.М. и др. Однократное длительное действие стрессоров различной природы в развитии ДВС-синдрома у крыс // Бюллетень сибирской медицины. 2014. Т. 13(6). С. 131-138.
Кладова Е.А., Соснина А.В., Доронин Б.М. и др. Оценка медиаторов воспаления при ишемическом инсульте // Цитокины и воспаление. 2011. Т. 10(4). С. 136–141.
Ключерева Н.Н., Колесниченко Л.Р., Кузник Б.И. и др. Влияние иммуномодулирующей терапии на лечение сахарного диабета 1 типа // Аллергология и иммунология. 2003. Т. 4(2). С. 129.
Красковская Н.А., Куканова Е.О., Линькова Н.С. и др. Трипептиды восстанавливают количество шипиков нейронов в модели болезни Альцгеймера in vitro // Клеточные технологии в биологии и медицине. 2017. № 2. С. 101–104.
Кудряшова И.А., Полунина О.С. Сравнительное изучение продукции провоспалительных цитокинов при внебольничной пневмонии в разные сроки заболевания в зависимости от возраста пациентов // Фундаментальные исследования. 2007. № 12. С. 113–114.
Кузник Б.И. Клеточные и молекулярные механизмы регуляции системы гемостаза в норме и патологии. Чита. Экспресс-издательство. 2010. 834 с.
Кузник Б.И., Бышевский А.Ш, Витковский Ю.А. и др. Состояние иммунитета, гемостаза, процессов ПОЛ и лимфоцитарно-тромбоцитарной адгезии при диффузном токсическом зобе // Тромбоз, гемостаз и реология. 2008. № 2. С. 13–19.
Кузник Б.И., Витковский Ю.А., Люлькина Е.В. Возрастные особенности системы гемостаза у людей // Успехи геронтологии. 2005. Т. 18(16). С. 38–48.
Кузник Б.И., Давыдов С.О., Степанов А.В. Роль мышечного гормона ирисина в регуляции физиологических функций в условиях нормы и патологии // Успехи физиологических наук. 2018. Т. 49(4). С. 1–22.
Кузник Б.И., Давыдов С.О, Степанов А.В. и др. Белки “молодости” и “старости” и система гемостаза // Тромбоз, гемостаз и реология. 2016. № 3. С. 234–235.
Кузник Б.И., Давыдов С.О., Степанов А.В. и др. Влияние кинезитерапевтических процедур на содержание ирисина у женщин с заболеваниями сердечно-сосудистой системы в зависимости от массы тела и гормонального статуса // Патологическая физиология и экспериментальная терапия. 2016. Т. 4. С. 47–51.
Кузник Б.И., Давыдов С.О., Степанов А.В. и др. Изменение концентрации ирисина в крови больных гипертонической болезнью после физической нагрузки // Кардиология. 2017. Т. 57(4). С. 77–78.
Кузник Б.И., Давыдов С.О., Степанов О.В. и др. “Белок молодости” GDF11, состояние системы гемостаза и особенности кровотока у женщин, страдающих гипертонической болезнью // Тромбоз, гемостаз и реология. 2018. № 1. С. 39–45.
Кузник Б.И., Давыдов С.О., Поправка Е.С. и др. Эпигенетические механизмы пептидной регуляции и нейропротекторный белок FKBP1B // Молекулярная биология. 2019. Т. 53(2). С. 339–348.
Кузник Б.И., Ключерева Н.Н., Колесниченко Л.Р. и др. Влияние вилона на состояние гемостаза у больных сахарным диабетом 1 типа разного возраста // Успехи геронтологии. 2006. Вып. 19. С. 107–115.
Кузник Б.И., Линькова Н.С., Тарновская С.И. и др. Тетрапептид и транскрипционные факторы: влияние на экспрессию генов иммунных интерлейкинов // Научные ведомости Белгородского государственного университета. 2012. Вып. 20(1). С. 5–10.
Кузник Б.И., Линькова Н.С., Тарновская С.И. и др. Цитокины и регуляторные пептиды: возрастные изменения, развитие атеросклероза и тромботических заболеваний (обзор литературы и собственных данных) // Успехи геронтологии. 2013. Т. 26(1). С. 38–51.
Кузник Б.И., Линькова Н.С., Хавинсон В.Х. Белки теплового шока: возрастные изменения, развитие тромботических осложнений и пептидная регуляция генома // Успехи геронтологии. 2011. Т. 24(4). С. 539–552.
Кузник Б.И., Линькова Н.С., Хавинсон В.Х. и др. Белки теплового шока, атеросклероз, тромбоз, ДВС-синдром и продолжительность жизни. Пептидные механизмы регуляции // Гемостазиология. 2011. № 2. С. 28–52.
Кузник Б.И., Лиханов И.Д., Цепелев В.Л., и др. Теоретические и клинические аспекты биорегулирующей терапии в хирургии и травматологии. Новосибирск: Наука. 2008. 312 с.
Кузник Б.И., Хавинсон В.Х., Линькова Н.С. и др. Факторы роста фибробластов FGF19, FGF21, FGF23 как эндокринные регуляторы физиологических функций и геропротекторы. Эпигенетические механизмы регуляции //Успехи современной биологии. 2017. Т. 137(1). С. 84–99.
Кузник Б.И., Хавинсон В.Х., Линькова Н.С. и др. Алармин1 (hmgb1) и возрастная патология. эпигенетические механизмы регуляции // Успехи физиологических наук. 2017. Т. 48(4). С. 40–55.
Кетлинский С.А., Симбирцев А.С. Цитокины. Санкт-Петербург: “Феникс”. 2008. 550 с.
Нагорнев В.А., Пигаревский П.В., Мальцева С.В. Шапероны и их роль в атерогенезе // Вестник Российской АМН. 2008. № 1. С. 41–45.
Погосова Д.П. Фактор риска развития ишемической болезни сердца и предиктор коронарной смерти: 10 лет научного поиска. Кардиология. 2012. Т. 52(12). С. 4–11.
Струкова С.М. Тромбин – регулятор воспаления и репарации тканей // Биохимия, 2001. Т. 66. С. 14–27.
Сукманова И.А., Яхонтов Д.А., Поспелова Т.И. и др. Клиническая картина, морфофункциональные параметры и функция эндотелия у пациентов с систолической хронической сердечной недостатоностью разных возрастных групп // Цитокины и воспаление. 2010. № 3. С. 30–34.
Хавинсон В.Х. Пептидная регуляция старения. СПб.: Наука, 2010. 50 с.
Хавинсон В.Х., Кузник Б.И., Линькова Н.С. и др. Роль цитокина MIC-1/GDF15 в развитии заболеваний у лиц пожилого возраста (обзор литературы и собственных данных) // Успехи физиологических наук. 2015. Т. 46(4). 38–52.
Хавинсон В.Х., Кузник Б.И., Линькова Н.С. и др. Подсемейство факторов роста фибробластов FGF19, FGF 21, FGF 23 как факторы “молодости”. Эпигенетические механизмы регуляции // Геронтология. 2017. № 1. С. 3–9.
Хавинсон В.Х., Кузник Б.И., Тарновская С.И. и др. Пептиды и молекулярные маркеры старения CCL11 и HMGB1: обзор литературы и собственных данных // Успехи геронтологии. 2014. Т. 27(3). 397–406.
Хавинсон В.Х., Кузник Б.И., Рыжак Г.А. Пептидные регуляторы – новый класс геропротекторов. Результаты клинических исследований // Успехи геронтологии. 2013. Т. 26. № 1. С. 20–37.
Хавинсон ВХ, Кузник БИ, Рыжак ГА. Пептидные геропротекторы – эпигенетические регуляторы физиологических функций организма. 2014. СПб. Изд-во РГПУ им. А.И. Герцена. 271 с.
Хавинсон В.Х., Кузник Б.И., Тарновская С.И. и др. Геропротекторные свойства белка GDF11 // Успехи современной биологии. 2015. Т. 135 (4). 170–179.
Хавинсон В.Х., Кузник Б.И., Тарновская С.И. и др. Короткие пептиды и регулятор длины теломер гормон ирисин // Бюлл. эксп. биол. мед. 2015. Т. 9. С. 332–336.
Amico F., Briggs G., Balogh Z.J. Transfused trauma patients have better outcomes when transfused with blood components from young donors // Med. Hypotheses. 2019. V. 122. P. 141–146.
Añón-Hidalgo J., Catalán V., Rodríguez A. et al. Circulating GDF11 levels are decreased with age but are unchanged with obesity and type 2 diabetes // Aging (Albany NY). 2019. V. 11(6). P. 1733–1744.
Askari H., Rajani S.F., Poorebrahim M. et al. A glance at the therapeutic potential of irisin against diseases involving inflammation, oxidative stress, and apoptosis: An introductory review // Pharmacol. Res. 2018. P. 129: 44–55. https://doi.org/10.1016/j.phrs.2018.01.012
Austin A.W., Wissmann T., von Kanel R. Stress and hemostasis: an update. // Semin Thromb Hemost. 2013. V. 39(8). P. 902–912. https://doi.org/10.1055/s-0033-1357487
Blackburn E.H., Epel E.S., Lin J. Human telomere biology: A contributory and interactive factor in aging, disease risks, and protection // Science. 2015. V. 350. P. 1193–98.
Blankenberg S., Luc G., Ducimetière P. et al. Interleukin-18 and the risk of coronary heart disease in European men: the Prospective Epidemiological Study of Myocardial Infarction (PRIME). PRIME Study Group // Circulation. 2003. V. 108(20). P. 2453–2459.
Bochenek M.L., Schütz E., Schäfer K. Endothelial cell senescence and thrombosis: Ageing clots // Thromb. Res. 2016. V. 147. P. 36–45. https://doi.org/10.1016/j.thromres.2016.09.019
Bottaccioli A.G., Bottaccioli F., Minelli A.Stress and the psyche-brain-immune network in psychiatric diseases based on psychoneuroendocrineimmunology: a concise review // Ann. N. Y. Acad. Sci. 2019. V. 1437(1). P. 31–42. https://doi.org/10.1111/nyas.13728
Brubakk A.O., Ross J.A., Thom S.R. Saturation diving; physiology and pathophysiology // Comp. Physiol. 2014. V. 4(3). P. 1229–12272. https://doi.org/10.1002/cphy.130048
Cai Z., Yan L.J. Protein oxidative modifications: beneficial roles in disease and health // J. Biochem. Pharmacol. Res. 2013. V. 1. P. 15–26.
Castellano J.M. Blood-Based Therapies to Combat Aging. Gerontology. 2018. V. 7. P. 1–6. https://doi.org/10.1159/000492573
Chayour-Mobarhan M., Sahebkar A., Parizaden S.M. et al. Antibody titres to heat shock protein 27 are elevated in patients with acute coronary syndrome // Int. J. Exp. Pathol. 2008. № 3. P. 209–215.
Cherry J.D., Olschowka J.A., O’Banion M.K. Neuroinflammation and M2 microglia: the good, the bad, and the inflamed // J. Neuroinflammation. 2014. V. 3. P. 11–98. https://doi.org/10.1186/1742-2094-11-98
Coluzzi Elisa, Leone Stefano, Sgura Antonella et al. Oxidative Stress Induces Telomere Dysfunction and Senescence by Replication Fork Arrest // Cells. 2019. V. 8(1). P. 19. Published online 2019. https://doi.org/10.3390/cells8010019
De Domenico E., D’Arcangelo G., Faraoni I. et al. // Oncotarget. 2017. V. 8(35). P. 57991–8002. https://doi.org/10.18632/oncotarget.19854
Deng X., Huang W., Peng J. et al. Irisin Alleviates Advanced Glycation End Products-Induced Inflammation and Endothelial Dysfunction via Inhibiting ROS-NLRP3 Inflammasome // Signaling. Inflammation. 2017. https://doi.org/10.1007/s10753-017-0685-3
de Punder K., Heim C., Wadhwa P.D. et al. Stress and immunosenescence: The role of telomerase // Psychoneuroendocrinology.m2019. V. 101. P. 87–100. doi:. 2018.10.019.https://doi.org/10.1016/j.psyneuen
Dobrovolsky A.B., Titaeva E.V. The fibrinolysis system: regulation of activity and physiologic functions of its main components // Biochemistry (Moscow). 2002. V. 67(1). P. 99–108.
Effros R.B., Kleemeier A. Award Lecture – the canary in the coal mine: telomeres and human healthspan // The journals of gerontology. Series A. Biological sciences and medical sciences. 2008. V. 64. P. 511–515.
Ferreira S.T., Clarke J.R., Bomfim T.R. et al. Inflammation, defective insulin signaling, and neuronal dysfunction in Alzheimer’s disease. Alzheimer’s Dement // J. Alzheimer’s Assoc. 2014. V. 10. S. 76–83. https://doi.org/10.1016/j.jalz.2013.12.010
Hager K., Machein U., Krieger S. et al. Interleukin 6 and parameters haemostasis // Fibrinolysis. 1996. Suppl. 1. P. 54.
Haslbeck M., Vierling E.A. first line of stress defense: small heat shock proteins and their function in protein homeostasis // J. Mol. Biol. 2015. V. 427. P. 1537–48.https://doi.org/10.1016/j.jmb.2015.02.002
Hisamatsu T., Miura K., Arima H. et al. SESSA Research Group. Relationship of serum irisin levels to prevalence and progression of coronary artery calcification: A prospective, population-based study // Int. J. Cardiol. 2018. pii: S0167-5273(18)31742-X. https://doi.org/10.1016/j.ijcard.2018.05.075
Hofmann B. Young blood rejuvenates old bodies: a call for reflection when moving from mice to men // Transfus. Med. Hemother. 2018. V. 45(1). P. 67–71.
Kaptoge S., Seshasai S.R. et al. Inflammatory cytokines and risk of coronary heart disease: new prospective study and updated meta-analysis // Eur. Heart. J. 2014. V. 35 (9). P. 578–589. https://doi.org/10.1093/eurheartj/eht367
Kim J.H., Kim D.Y. Aquarobic exercises improve the serum blood irisin and brain-derived neurotrophic factor levels in elderly women // Exp. Gerontol. 2018. V. 104. P. 60–65. https://doi.org/10.1016/j.exger.2018.01.024
Kim O.Y., Song J. The Role of Irisin in Alzheimer’s Disease // J. Clin. Med. 2018. Nov. 1. V. 7. № 11. pii: E407. https://doi.org/10.3390/jcm7110407
Khavinson V.Kh. Peptides and aging // Neuroendocrin. Letters. 2002. V. 23. Suppl. 3. P. 32–8.
Khavinson V.Kh., Kuznik B.I., Tarnovskaya S.I. et al. Peptides and CCL11 and HMGB1 as Molecular Markers of Aging: Literature Review and Own Data // Advances in Gerontology. 2015. V. 5(3). P. 133–140.
Khavinson V.Kh., Linkova N.S., Trofimov A.V. et al. Peptides Regulate Cortical Thymocytes Differentiation, Proliferation, and Apoptosis // Biology Bulletin Reviews. 2011. V. 1.(4). P. 390–394.
Khavinson V.Kh., Malinin V.V. Gerontological Aspects of Genome Peptide Regulation. Basel (Switzerland): Karger A.G. 2005. 104 p.
Khoury R., Ghossoub E. Young blood products: emerging treatment for Alzheimer’s disease? // Neural. Regen Res. 2018. V. 13(4). P. 624–627.
Khavinson V., Linkova N., Kukanova E. et al. Neuroprotective Effect of EDR Peptide in Mouse Model of Huntington’s Disease // J. Neurology and Neuroscience. 2017. V. 8(1). P. 1–11.
Kuzichkin D.S., Markin A.A., Juravlyova O.A. et al. Reference Values of the Hemostasis System Indices in Cosmonauts // Fiziol. Cheloveka. 2017. V. 43(1). P. 126–129.
Kuznik B.I., Linkova N.S., Khavinson V.Kh. Heat Shock Proteins: Changes Related to Aging, Development of Thrombotic Complications, and Peptide Regulation of the Genome1 // Advances in Gerontology. 2012. V. 2(3). P. 175–186.
Li T., Wang H., He S. Induction of interleukin-6 release from monocytes by serine proteinases and its potential mechanisms // Scand. J. Immunol. 2006. № 1. P. 10–16.
Li X., Shao H., Taylor I.R., Gestwicki J.E. Targeting Allosteric Control Mechanisms in Heat Shock Protein 70 (Hsp70) // Curr Top Med Chem. 2016. V. 16(25). P. 2729–2740.
Loubele S., Spec C.A., Leenders P. et al. Activated protein C protects against miocardial ischemia/reperfusion injury via inhibition of apoptosis and inflammation // Artheriosclerosis. Thrombosis and Vasc. Biol. 2010. V. 29(7). P. 1087–1092.
Lu R.C., Tan M.S., Wang H. et al. Heat shock protein 70 in Alzheimer’s disease // Biomed. Res. Int. 2014:435203. https://doi.org/10.1155/2014/435203
Malarstig A., Eriksson P., Hamsten A. et al. Raised interleukin 10 is an indicator of poor outcome and enhaced systemic inflammation in patients with acute coronary syndrome // Heart. 2008. V. 94. P. 724–729.
Martínez de Toda I., De la Fuente M. The role of Hsp70 in oxi-inflamm-aging and its use as a potential biomarker of lifespan // Biogerontology. 2015. V. 16(6). P. 709–21. https://doi.org/10.1007/s10522-015-9607-7
Mc Auley M.T., Guimera A.M., Hodgson D. et al. Modelling the molecular mechanisms of aging // Biosci. Rep. 2017. V. 37. № 1. pii: BSR20160177. https://doi.org/10.1042/BSR20160177
Miller G.E., Murphy M.L., Cashman R. et al. Greater inflammatory activity and blunted glucocorticoid signaling in monocytes of chronically stressed caregivers // Brain, behavior, and immunity. 2014. V. 41. P. 191–199.
Mogk A., Bukau B., Kampinga H. H. Cellular handling of protein aggregates by disaggregation machines // Mol. Cell. 2018. V. 69. P. 214–226. https://doi.org/10.1016/j.molcel.2018.01.004
Murshid A., Eguchi T., Calderwood S.K. // Int. J. Hyperthermia. 2013. V. 29(5). P. 442–4427. https://doi.org/10.3109/02656736.2013.798873
Naismith E., Pangrazzi L. The impact of oxidative stress, inflammation, and senescence on the maintenance of immunological memory in the bone marrow in old age // Biosci Rep. 2019. V. 39. № 5. pii: BSR20190371. https://doi.org/10.1042/BSR20190371
Njemini R., Lambert M., Demanet C.H. et al. Heat shock protein 32 in human peripheral blood mononuclear cells: effect of aging and inflammation // J. Clin. Immunol. 2005. V. 25(5). P. 405–417.
Nydegger U.E., Luginbühl M., Risch M. The aging human recipient of transfusion products // Transfu. Apher. Sci. 2015. V. 52 (3). P. 290–294.
Nyugen J., Sudhanshu A., Sastry G. et al. Impaired functions of peripheral blood monocyte subpopulations in aged humans // J. Clin. Immunol. 2010. V. 30(6). P. 806–813.
Patterson S.L Immune dysregulation and cognitive vulnerability in the aging brain: Interactions of microglia, IL-1β, BDNF and synaptic plasticity // Neuropharmacology. 2015. V. 96 (PtA). P. 11–18. doi: 12.020.https://doi.org/10.1016/j.neuropharm.2014
Pickering A.M., Vojtovich L., Tower J. Oxidative stress adaptation with acute, chronic, and repeated stress // Free Radical Biol. Med. 2013. V. 55. P. 109–18.
Pockley A.G. Heat shock proteins as regulation of the immune response // Lancet. 2003. V. 362. P. 469–476.
Poggioli T., Vujic A., Yang P. Circulating Growth Differentiation Factor 11/8 Levels Decline With Age // Circ. Res. 2016. V. 118(1). P. 29–37.
Polyzos S.A., Anastasilakis A.D., Efstathiadou Z.A. et al. Irisin in metabolic diseases // Endocrine. 2018. V. 59. № 2. P. 260–274. https://doi.org/10.1007/s12020-017-1476-1
Rells S.F., Sapolsky R.M. An inflammatory review of glucocorticoid actions in the CNS // Brain Behav. Immun. 2007. V. 21(3). P. 259–272.
Rivera I., Capone1 R., David M. et al. Modulation of Alzheimer’s amyloid β peptide oligomerization and toxicity by extracellular HSP70 // Cell Stress and Chaperones. 2018. V. 23. P. 269–279.
Rosenwald M., Koppe U., Keppeler H. et al. Serum-derived plasminogen is activated by apoptotic cells and promotes their phagocytic clearance // J. Immunol. 2012. V. 189. P. 5722–5728.
Saretzki G. Extra-telomeric functions of human telomerase: cancer, mitochondria and oxidative stress // Curr. Pharm. Des. 2014. V. 20. № 41. P. 6386–6403.
Selye H. Thrombohemorrhagie Phenomena. Illinois: Charles Thomas. 1966. 496 p.
Simons R.J., Reynolds H.Y. Altered immune status in the elderly // Semin. Respir. Infect. 1990. V. 5(4). P. 251–259.
Stacchiotti A. Exploring Cellular Stress Response and Chaperones // Cells. 2019. V. 8(5). pii: E408. /https://doi.org/10.3390/cells8050408
Stallone G., Infante B., Prisciandaro C. et al. TOR and Aging: An Old Fashioned Dress // Int. J. Mol. Sci. 2019. V. 20. № 11. pii: E2774. https://doi.org/10.3390/ijms20112774
Scott J., Selby M., Urdea M. Isolation and nucleotide sequence of a cDNA encoding the precursor of mouse nerve growth factor // Nature. 1983. V. 302. № 5908. P. 538–540.
Stott D.G., Robertson M., Rumley A. et al. Actyvation of hemostasis and decline in cognitive function in older people // Arteriosclerosis, Thrombosis, and Vasc. Biol. 2010. V. 30(3). P. 605–611.
Streicher J.M. The Role of Heat Shock Proteins in Regulating Receptor Signal Transduction // Mol. Pharmacol. 2019. V. 95(5). P. 468–474. https://doi.org/10.1124/mol.118.114652
Sun Y.1., Zhang J.R.1., Chen S.1. Suppression of Alzheimer’s disease-related phenotypes by the heat shock protein 70 inducer, geranylgeranylacetone, in APP/PS1 transgenic mice via the ERK/p38 MAPK signaling pathway // Experimental and therapeutic medicine. 2017. V. 14. P. 5267–5274.
Tatar M., Khazaeli A.A. Curtsinger J.W. Chaperoning extended life// Nature. 1997. V. 390. P. 30.
Tuttolomondo A., Di Raimondo D., Di Sciacca R. et al. Arterial stiffness and ischemic stroke in subjects with and without metabolic syndrome // Atherosclerosis. 2012. V. 225(1). P. 216–219.
Ungelenk S., Moayed F., Ho C.T. et al. Small heat shock proteins sequester misfolding proteins in near-native conformation for cellular protection and efficient refolding // Nat. Comm.2016. V. 7. P. 13673. .https://doi.org/10.1038/ncomms13673
Vallet H., Fali T., Sauce D. et al. Aging of the immune system: From fundamental to clinical data // Rev. Med. Interne. 2019. V. 40(2). P. 105–111. https://doi.org/10.1016/j.revmed.2018.07.005
Varghese F.P., Brown E.S. The Hypothalamic-Pituitary-Adrenal Axis in Major Depressive Disorder: A Brief Primer for Primary Care Physicians // Primary Care Companion to The Journal of Clinical Psychiatry. 2001. V. 3(4). P. 151–55.
Ventura M.T., Casciaro M., Gangemi S. et al. Immunosenescence in aging: between immune cells depletion and cytokines up-regulation // Clin. Mol. Allergy. 2017. V. 15. P. 21. https://doi.org/10.1186/s12948-017-0077-0
Villeda S.A., Luo J., Mosher K.I. The ageing systemic milieu negatively regulates neurogenesis and cognitive function // Nature. 2011. V. 477. P. 90–94.
Villeda S.A., Plambeck K.E., Middeldorp J. Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice // Nature Medicine. 2014. V. 20(6). P. 659–63.
Vitlic A., Lord J.M., Phillips A.C. Stress, ageing and their influence on functional, cellular and molecular aspects of the immune system // Age (Dordr). 2014. V. 36(3). P. 9631. https://doi.org/10.1007/s11357-014-9631-6
von Känel R. Acute mental stress and hemostasis: When physiology becomes vascular harm // Thromb Res. 2015. V. 135. Suppl. 1. S. 52–55. https://doi.org/10.1016/S0049-3848(15)50444-1
Wang L., Yu X., Liu J.P. Telomere Damage Response and Low-Grade Inflammation // Adv. Exp. Med. Biol. 2017. № 1024. P. 213–224. https://doi.org/10.1007/978-981-10-5987-2_10
Wu H., Guo P., Jin Z., Li X., Yang X., Tang C., Wang Y., Ke J. Serum levels of irisin predict short-term outcomes in ischemic stroke. Cytokine. 2018. pii: S1043-4666(18)30057-7.
Wyss-Coray T. The ageing systemic milieu negatively regulates neurogenesis // Nature. 2016. V. 539. P. 180–86.
Yamamoto K., Takeshita K., Kojima T. et al. Aging and plasminogen activator inhibitor-1 (PAI-1) regulation: implication in the pathogenesis of thrombotic disorders in the elderly // Cardiovasc Res. 2005. V. 66(2). P. 276–285.
Yan L.J. Positive oxidative stress in aging and aging-related disease tolerance. // Redox Biol. 2014. V. 2. P. 165–169. https://doi.org/10.1016/j.redox.2014.01.002
Yoshida M., Satoh A., Lin J.B. et al. Extracellular Vesicle-Contained eNAMPT Delays Aging and Extends Lifespan inMice // Cell Metab.2019. pii: S1550-4131(19)30255-4. https://doi.org/10.1016/j.cmet.2019.05.015
Zhou X., Xu M., Bryant J.L. et al. Exercise-induced myokine FNDC5/irisin functions in cardiovascular protection and intracerebral retrieval of synaptic plasticity // Cell Biosci. 2019. V. 9. P. 32.
Zietzer A., Buschmann E.E., Janke D. et al. Acute physical exercise and long-term individual shear rate therapyincrease telomerase activity in human peripheral blood mononuclear cells // Acta Physiol (Oxf). 2017. V. 220(2). P. 251–262. https://doi.org/10.1111/apha.12820
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук