Успехи физиологических наук, 2020, T. 51, № 3, стр. 23-50
Агматин: двадцатипятилетию с момента “повторного” открытия
А. В. Мальцев a, b, *, Ю. М. Кокоз a
a Институт теоретической и экспериментальной биофизики Российской академии наук,
ИТЭБ РАН
142290 Московская обл., Пущино, Россия
b Институт высшей нервной деятельности и нейрофизиологии Российской академии наук,
ИВНД и НФ РАН
117485 Москва, Россия
* E-mail: alex.v.maltsev88@gmail.com
Поступила в редакцию 24.12.2018
После доработки 28.12.2019
Принята к публикации 29.12.2019
Аннотация
Агматин – продукт вторичного метаболизма, являющийся производным L-аргинина, давно известен как интермедиат при синтезе полиаминов. Накопленные за последние четверть века данные обнаружили, кроме того, множественные влияния агматина на ионные каналы, рецепторы и функциональность энзимов, выявляя гормоноподобную роль этого амина. Агматин синтезируется как в центральной нервной системе, так и в периферических тканях, что, по-видимому, обуславливает сложность и разнонаправленность механизмов его действия. В то время, как эффект эндогенных концентраций агматина (около 5 мкМ) на периферические ткани остается слабо изученным, все больший интерес приобретают исследования экзогенных аппликаций данного амина. Низкая токсичность агматина, наряду с его множественными влияниями на нервную, сердечно-сосудистую, эндокринные системы, снискали ему солидную репутацию в области последних достижений спортивной и экстремальной медицины. Агматин широко используется в спортивных диетах (до 10 г/день) как добавка, способствующая эффективному набору мышечной массы и оптимизации выполняемых нагрузок. В обзоре предпринята попытка охватить все аспекты физиологических влияний агматина с учетом последних (в том числе собственных) исследований в этой области. Рассмотрены вопросы его синтеза и деградации, подробно проанализированы данные касательно транспорта агматина в клетку и внутриклеточные органеллы. Собраны ключевые сведения относительно эффектов агматина на различные системы органов с обсуждением его возможного участия в выполнении тех или иных физиологических функций. В завершение, проанализированы стратегии использования агматина в клинической практике.
1. АГМАТИН: СТРУКТУРА, РАСПРОСТРАНЕНИЕ, МЕТАБОЛИЗМ
Агматин – основной амин, образуемый при декарбоксилировании L-аргинина ферментом аргининдекарбоксилазой (ADC), был впервые идентифицирован нобелевским лауреатом Альбрехтом Косселем (Albrecht Kossel) в сперматозоидах сельди, в 1910 году [84]. Впоследствии агматин был найден у бактерий, растений и большого числа беспозвоночных как интермедиат при синтезе полиаминов [118, 161, 196, 220]. Убиквитарное свойство агматина вовлекаться в процессы клеточного роста через биосинтез полиаминов (путресцина, спермидина, спермина) длительное время считалось его единственной функцией, до тех пор, пока в 1994 году не вышла статья Li и соавторов [92], в которой приведены доводы в пользу того, что агматин может являться эндогенным лигандом имидазолиновых рецепторов, в связи с чем, было показано, что в мозге млекопитающих присутствует как агматин, так и ADC. Позднее, он также был обнаружен в аорте, тонком и толстом кишечнике, селезенке, легких, почках, сердце, печени, мышечной ткани, семенниках и плазме крови [158]. Концентрация эндогенного агматина в плазме составляет около 3 мкМ/л [106]. Кроме эндогенного синтеза в клетках и экзогенного поступления вместе с пищей, агматин синтезируется микрофлорой кишечника [57]. Распределение агматина в тканях сильно варьирует внутри вида, так его максимальная концентрация у крыс линии Sprague–Dawley обнаружена в желудке, а у крыс Long Evans – в надпочечниках. Подобная вариативность может объясняться различиями в регуляции ADC, ферментов деградации, или изменениями в аккумулировании и высвобождении этого амина. Зависимость концентрации агматина в тканях от возраста отсутствует, за исключением коры головного мозга. Так показано, что его количество снижено на 50% в мозге старых крыс [158]. На субклеточном уровне было обнаружено, что агматин локализуется, главным образом, в виде больших плотноядерных везикул в цитоплазме в непосредственной близости от эндоплазматического ретикулума и митохондрий, что согласуется с расположением ADC, ответственной за его синтез [144].
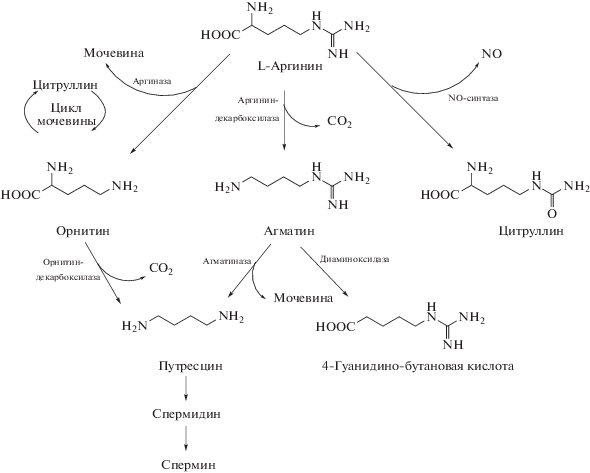
Агматин (4-[аминобутил]-гуанидин) по химическому составу и свойствам представляет из себя следующее (рис. 1): молекулярная масса 130 Да; максимум поглощения в ультрафиолетовой области (200 нм) указывает на алифатическую структуру; положительная нингидриновая реакция подтверждает наличие аминогрупп [159]. Несмотря на широкое распространение агматина, фермент его синтеза (ADC) как по структуре, так и по свойствам, существенно отличается в разных типах клеток. Прокариотическая и растительная ADC были очищены и клонированы [19]. У бактерий ADC экспрессируется в конститутивной (биосинтетической) и индуцибельной (биодеградативной) формах. Обе изоформы являются цитоплазматическими и зависят от пиридоксаль-фосфата и Mg2+ [219]. Растительная ADC синтезируется в виде профермента-предшественника, который в результате протеолитического расщепления образует комплекс из двух полипептидных фрагментов. Образуемый гетеродимерный комплекс представляет собой функционально активный фермент ADC, который локализуется в цитоплазме [109]. ADC в организме млекопитающих была обнаружена в мозге, почках, эндотелии [92, 107]. В отличие от прокариотической и растительной изоформ, ADC млекопитающих является связанной с мембранами митохондрий [166], а также обладает способностью использовать в качестве субстрата кроме L-аргинина еще и орнитин [71]. Недавно была клонирована ADC человека и было показано, что она на 48% идентична орнитиндекарбоксилазе (ODC) [226], однако это не объясняет использование орнитина как дополнительного субстрата, поскольку ADC человека не обладает орнитиндекарбоксилазной активностью. Активность ADC млекопитающих существенно отличается от активности прокариотической или растительной ADC по многим физико-химическим свойствам: ее температурный оптимум около 25°С (в отличие от 37°С у бактерий), сродство к L-аргинину в десятки раз ниже (константа Михаэлиса, KM = 0.75 мМ) [93], активность ингибируется Са2+, не снижается при действии ингибиторов бактериальной ADC, а также ODC или NO-синтазы [169]. Только значения слабощелочного pH-оптимума (8.3 и 8.4) являются сопоставимыми [166]. В клеточной культуре мозга неонатальных крыс активность ADC была низкой в нейронах, но гораздо более высокой в астроцитах [164]. Учитывая тот факт, что подобно другим нейротрансмиттерам, агматин Са2+-зависимо высвобождается из синаптосом в ответ на деполяризацию, можно предположить, что места синтеза агматина и его накопления могут различаться. Т.е. агматин синтезируется в глии, выходит во внеклеточное пространство, и далее – запасается и накапливается в нейронах для дальнейшего высвобождения [168].
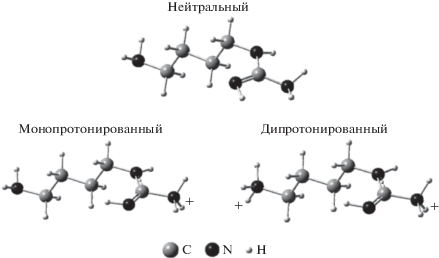
Рис. 1.
Схематическое представление наиболее стабильных структур агматина в водном растворе в различных состояниях протонирования. Наиболее распространенная физиологическая форма агматина – дикатион. По Agostinelli и др., 2010 [4].
В почке активность ADC была обнаружена в митохондриальной фракции как кортекса, так и медуллярного слоя, а тот факт, что микромолярные концентрации агматина были способны влиять на скорость клубочковой фильтрации, наводит на мысль о физиологической значимости агматина для нормального функционирования почек [107]. В сосудистой системе известно, что агматин накапливается в эндотелиальных клетках и гладкомышечных клетках сосудов, но ADC экспрессируется только в эндотелии [167].
Катаболизм агматина в основном осуществляется двумя ферментами: агматиназой и диаминоксидазой [135]. Агматиназа классифицируется как член суперсемейства аргиназ и катализирует превращение агматина в путресцин с отщеплением мочевины [147]. Сравнение первичной структуры агматиназ разных видов позвоночных показывает, что некоторые аминокислотные остатки, необходимые для каталитической активности фермента отсутствуют, например, у мышей. Это указывает на существование видоспецифичных различий в механизмах регулирования уровня агматина [134]. Недавно была клонирована агматиназа человека и было показано, что она на 42% идентична аргиназам I и II [73]. Наибольшая концентрация агматиназы обнаружена в печени, почках, мозге [29, 121]. Агматиназа локализуется на внешней митохондриальной мембране, и что удивительно, обладает довольно низким сродством к агматину (KM = 5.3 мМ) [169]. Принимая во внимание еще и тот факт, что слабым сродством к нему также обладает аргиназа [163], возникает вопрос относительно отсутствия высокоспецифичной системы деградации агматина. До сих пор остается непонятным, с чем это может быть связано.
Еще один фермент катаболизма агматина – диаминоксидаза (субстратами которой являются и другие диамины, например, путресцин), катализирует превращение агматина в агматин-альдегид, который затем под действием алкогольдегидрогеназы превращается в 4-гуанидино-бутановую кислоту [178]. Диаминоксидаза была обнаружена в почках, коже, плаценте, тонком кишечнике, крови, макрофагах, гладкомышечных клетках сосудов, желудке; отсутствовала в мозге, сердце, печени, надпочечниках, скелетной мышце. Константа Михаэлиса для утилизации агматина диаминоксидазой является низкой (около 5 мкМ), что говорит о достаточно высоком сродстве [107]. Однако данные о роли диаминоксидазы в утилизации агматина противоречивы. Так в гепатоцитах крыс около 50% экзогенно добавленного агматина расщепляются диаминоксидазой [23], но при длительной блокаде диаминоксидазы не было обнаружено никаких изменений в плазменном или тканевом уровнях агматина [107]. Кроме того, диаминоксидаза отсутствует в местах наиболее активного синтеза агматина (например, мозг, эндотелий, печень). На рис. 2 показаны основные метаболические пути, ассоциированные с превращениями агматина в организме.
2. ТРАНСПОРТ АГМАТИНА
При нейтральных значениях pH агматин – положительно заряженная гидрофильная молекула, не способная свободно проникать через мембрану. При этом различия в локализации мест эндогенного синтеза агматина и мест его накопления свидетельствуют о наличии специфических систем транспорта агматина. Наличие избирательного H+-зависимого транспортера, работающего против концентрационного градиента [76], а также агматин-путресцинового антипортера [34] было сначала показано у прокариот. Селективный переносчик агматина эукариот (зависимый от АТФ и температуры) был впервые обнаружен в синаптосомах мозга крыс и имел экстремально низкое сродство к агматину (KM = 18.8 мМ) [175]. Позднее в глиобластомных клетках человека (линия SK-MG-1) описали транспортер, отличный от путресцинового транспортера, относящийся к группе переносчиков аминокислот-катионов (Na+-независимая система Y+, член SLC7A2). Транспорт является энергозависимым, с высоким сродством, KM = 8.6 мкМ [122]. Также было показано, что транспорт агматина может обеспечиваться Na+-зависимым переносчиком норэпинефрина (SLC6A2), но не транспортерами органических катионов (семейство OCT) [126]. Переносчиков с микромолярным сродством (KM = = 2.5–30 мкМ) удалось обнаружить также в эндотелиальных клетках, фибробластах, почке, гепатоцитах [13, 23, 126, 176]. В синаптосомах спинного мозга был найден переносчик агматина с экстремально высоким сродством (KM = 18 нМ) [48]. Позднее было показано, что транспорт агматина в нервных окончаниях происходит с затратой энергии, зависит от температуры и внеклеточной концентрации Ca2+, ингибируется в присутствии путресцина и спермидина, что может свидетельствовать о едином транспортере для агматина и полиаминов [49]. В культуре клеток HEK-293, трансдуцированной вектором, несущим OCT1, OCT2 и транспортер MATE-1 (multidrug and toxin extrusion transporter-1), также был обнаружен транспорт агматина с низким миллимолярным сродством, что указывает лишь на возможность переноса агматина данными системами, но заставляет сомневаться в физиологической значимости и роли такого транспорта [55, 215].
В середине 2000-х годов было установлено, что агматин также способен транспортироваться в митохондрии. В исследованиях с незаряженными аналогами агматина показана значимость гуанидиновой группы в молекуле для ее транспорта через митохондриальную мембрану [54]. Были обнаружены различия механизма транспорта агматина в митохондриях мозга и печени. В митохондрии мозга агматин транспортируется посредством переносчика полиаминов, потенциал-зависимым механизмом. Предполагают, что транспортер обладает олигомерной структурой, имеет более чем один транспортный сайт и является каналом с двумя асимметричными энергетическими барьерами [16]. В митохондриях печени транспорт агматина не ингибировался путресцином, аргинином и лизином, что свидетельствует о специфическом унипортере, отличным от транспортеров полиаминов и аминокислот. Предполагается, что переносчик является каналом или односвязной воротной порой [173]. Транспорт агматина в митохондрии идет с KM = 0.7 мМ [173], с одной стороны – это достаточное низкое сродство, если учесть значение эндогенного уровня агматина, с другой – ADC, синтезирующая агматин, располагается на внешней митохондриальной мембране. Возможно, что такая колокализация обеспечивает удельные концентрации агматина, достаточные для эффективной работы переносчиков. Остается лишь непонятным, какую физиологическую роль может выполнять агматин внутри митохондрий, где отсутствуют известные для него рецепторные мишени. На рис. 3 наглядно обобщены данные относительно переносчиков агматина в живых клетках.
3. МИШЕНИ АГМАТИНА: ПРЯМОЕ ДЕЙСТВИЕ
3.1. Рецепторы и каналы
В 1985 году было показано взаимодействие агматина с никотиновым рецептором, поток радиоактивно меченого [3H]-агматина в симпатическом ганглии предотвращался ингибированием никотинового рецептора-канала, из чего был сделан вывод об их возможной проницаемости для агматина [156]. Однако позднее было установлено, что агматин способен неконкурентно ингибировать нейрональные никотиновые рецепторы в сетчатке и шейном ганглии с миллимолярным сродством [105]. С появлением в 1994 году в журнале “Science” работы Li и соавторов [92] начинается “гормональный” этап в изучении агматина. В исследованиях по радиолигандному связыванию на мембранах коры головного мозга, продолговатого мозга и хромаффинных клетках надпочечников показано, что агматин связывается с α2-адренорецепторами (α2-ARs), имидазолиновыми рецепторами первого (I1Rs) и второго типов (I2Rs), ни-I1-/ниI2-имидазолин-связывающими сайтами с микромолярным сродством, а также обладает слабым сродством к α1- и β-адренорецепторам, 5-HT3 серотониновым рецепторам, D2 дофамин-связывающим сайтам [92, 125, 128, 130, 131, 151, 153], κ-опиодиным и аденозиновым A1-рецепторам [194]. Также было показано взаимодействие агматина с σ2-связывающим сайтом и 5-HT2 серотониновым рецептором [124, 229].
В работе Shepherd и соавторов [185] в β-клетках поджелудочной железы агматин дозо-зависимо ингибировал проводимость ${\text{K}}_{{{\text{АТФ}}}}^{ + }$-зависимого канала, снижая вероятность открытого состояния канала. Предполагается, что действие агматина было связано с активацией третьего типа имидазолиновых рецепторов (I3Rs), стимуляция которых приводит к закрытию K+АТФ-каналов, что вызывает деполяризацию, вход Са2+ и высвобождение инсулина [24]. Известно, что I3Rs локализуются исключительно в поджелудочной железе, однако их структура до конца не установлена, и возможно, что они являются сайтом аллостерического регулирования на ${\text{K}}_{{{\text{АТФ}}}}^{ + }$-канальном комплексе [35].
В то же время, в patch-clamp экспериментах на культивируемых нейронах гиппокампа было показано, что агматин индуцирует потенциал- и дозо-зависимое блокирование тока через N-метил-D-аспартатные рецепторы (NMDA-рецепторы), но не влияет на поток катионов через АМРА- или каинатные рецепторы. Ингибирование было обратимым и наиболее эффективным при гиперполяризации мембранного потенциала [222]. Было показано, что агматин не является конкурентным антагонистом NMDA-рецепторов, ингибирует поток катионов через них даже при стимуляции глицинового сайта на NMDA-канальном комплексе [222]. Действие агматина не связано с модуляцией фенциклидин-чувствительного сайта или полиамин-связывающего участка на NMDA-канальном комплексе, из чего был сделан вывод о взаимодействии агматина с сайтом, локализованном непосредственно в NMDA-канальной поре [142]. В экспериментах с использованием структурных аналогов агматина было показано, что необходимой для блокады NMDA-токов является гуанидиновая группа [222], что несколько удивительно, поскольку ранее было обнаружено общее для ряда полиаминов (спермидин, спермин, полиамины из ядов беспозвоночных) свойство ингибировать различные нейрональные ионные каналы (потенциал-зависимые Са2+ P-, Т-, N-типов; AMPA-, NMDA-, каинатные; Са2+-активируемые и GABAергические Cl−-каналы) [181].
Совсем недавно была открыта еще одна мишень прямого действия агматина – Na+-селективный H+-чувствительный ионный канал (acid-sensing ion channel, ASIC). Агматин активирует периферические ASIC3-каналы, являющиеся болевыми сенсорами, связываясь с непротонным, недавно обнаруженным лиганд-чувствительным доменом. Процесс активации ASIC3 агматином был высоко чувствителен к слабому ацидозу, гиперосмолярности, наличию молочной или арахидоновой кислот и снижению внеклеточного Са2+ [98, 99].
В 2018 году было обнаружено, что агматин может модулировать Са2+-сигнализацию в кардиомиоцитах гибернирующих сусликов через Са2+-чувствительный рецептор (CaSR, calcium-sensing receptor). CaSR – мультимодальный рецептор, сопряженный сразу с тремя G-белками (Gq, Gi/0, G12/13). Направленность изменений уровня свободного кальция в цитозоле при этом зависела от концентрации агматина: низкие концентрации действовали преимущественно через Gi/o и G12/13-сопряженные сигнальные пути, тогда как высокие – через Gq и G12/13. Учитывая, что через один и тот же рецептор агматин регулировал и систолический, и диастолический уровень Са2+ в цитозоле, было предположено, что агматин может играть существенную роль в регуляции Са2+-гомеостаза (и, соответственно, миокардиальной сократимости) во время гибернации зимоспящих животных. Крайне любопытным здесь представляется и еще один факт: активность ADC, синтезирующей агматин, при 37°С не является максимальной и существенно увеличивается при снижении температуры. Как известно, температура тела зимоспящих млекопитающих снижена до околонулевых температур (+4°С) [110].
3.2. Ферменты
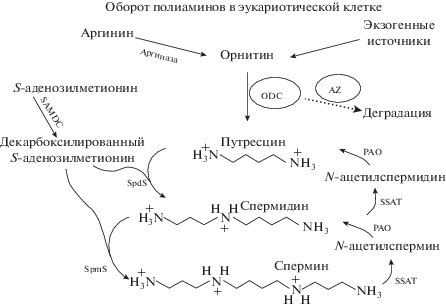
Принимая во внимание то, что полиамины (путресцин, спермидин, спермин) необходимы для нормального протекания клеточного цикла и входа в фазу деления за счет участия в регуляции ДНК-репликации, а также тот факт, что агматиназа превращает агматин в путресцин, было выдвинуто предположение о возможном вовлечении агматина в процессы клеточного роста [148, 167, 196]. Однако было показано, что агматин подавляет пролиферацию в культуре гладкомышечных клеток сосудов, фибробластов, гепатоцитов, эндотелиальных клеток, опухолевых клеток тонкого кишечника [13, 127, 177]. Механизм подавления заключался в индукции агматином антифермента орнитиндекарбоксилазы (Antizyme), который снижал биосинтез путресцина и полиаминов за счет более чем 70%-ного подавления активности орнитиндекарбоксилазы. Кроме того, антифермент ингибировал мембранный транспортер полиаминов, что также приводило к снижению внутриклеточного уровня путресцина, спермидина, спермина. Применение антиферментного ингибитора или IgG антител к антиферменту, а также экзогенное приложение полиаминов предотвращало цитостатический эффект агматина [177]. В изолированных гепатоцитах, культуре печеночных HepG2-клеток и клеток кишечника HT29 [42, 216] антипролиферативный эффект экзогенного агматина коррелировал с увеличением уровня апоптоза, в то время как в культуре фибробластов 3T3, клеточных линиях HTC, JM2, лейкемических клетках HMC1 HL60 был обнаружен только цитостатический эффект без индукции апоптоза [10, 56]. Эти противоречивые данные указывают на разную чувствительность отдельных типов клеток к апоптотическим свойствам агматина. Анализ экспрессии генов и активности ферментов при действии агматина показал, что экзогенная добавка агматина приводит к стимуляции S-аденозилметионин-декарбоксилазы (SAMDC) и спермидин/спермин N-ацетилтрансферазы (SSAT) [56, 64, 204]. SAMDC катализирует превращение путресцина в спермидин и далее – в спермин, а SSAT ответственна за обратный переход (присоединение ацильного остатка к спермину и спермидину, в результате чего они окисляются полиаминоксидазой до путресцина). Вероятно, что этот усиливающийся оборот полиаминов (polyamine turnover) совместно с подавлением активности орнитиндекарбоксилазы и отвечают за снижение величины клеточной пролиферации (рис. 4).
Рис. 4.
Пути синтеза и деградации полиаминов в клетке. Обозначения: ODC – орнитиндекарбоксилаза; AZ – антифермент, подавляющий активность ODC; SAMDC – S-аденозилметиондекарбоксилаза; SpdS – спермидинсинтаза; SpmS – сперминсинтаза; SSAT – спермидин/спермин N-ацетилтрансфераза; PAO – полиаминоксидаза.
Еще одной мишенью агматина является семейство специфических монооксигеназ – NO-синтаз, ферментов, отвечающих за синтез сигнальной молекулы оксида азота из L-аргинина. В гомогенатах мозга и легочной артерии агматин ингибирует все изоформы NO-синтаз с различным сродством, величина полуингибирования (IC50) для нейрональной NO-синтазы – 160 мкМ, индуцибельной NO-синтазы – 260 мкМ и эндотелиальной NO-синтазы – 7.5 мМ [12, 39]. Было показано, что агматин продолжительно увеличивает в три раза NADPH-оксидазную активность нейрональной NO-синтазы, приводя к образованию перекиси, что может быть связано с механизмом, ответственным за инактивацию данного фермента [31]. Механизм ингибирования индуцибельной изоформы NO-синтазы агматином связан с его деградацией диаминоксидазой, в результате чего образуется агматин-альдегид, который подавляет активность индуцибельной NO-синтазы [58]. Однако, в некоторых исследованиях показано увеличение активности NO-синтаз при действии агматина в эндотелиальных клетках [74] и изолированной почке [180]. Данное противоречие объясняется различием уровней регуляции: в случае экспериментов in vitro речь идет о прямом взаимодействии агматина и NO-синтаз, в случае экспериментов in situ на клетках и изолированных органах в наблюдаемые эффекты вносят вклад механизмы, активированные рецепторами. Так, в эндотелиальных клетках увеличение синтеза NO было связано с активацией агматином α2-адренорецепторов и связанной с ними фосфолипазы С [74]. Кроме того, недавно была показана индукция эндотелиальной NO-синтазы (eNOS) при действии агматина. В модели глобальной церебральной ишемии агматин обладал протекторным действием на сосуды за счет увеличения уровня экспрессии и синтеза белка eNOS [136].
Известна способность агматина ингибировать аденозин-5'-дифосфорибозилирование (ADP-рибозилирование) остатков аргинина в различных белках [89]. ADP-рибозилирование – ферментативная обратимая посттрансляционная модификация протеинов, при которой остаток ADP-рибозы переносится с NAD+ на гуанидиновую группу аргинина [201]. ADP-рибозилирование меняет размер и химические свойства сайта в белке-мишени, влияя на его функциональную активность. Так, например, ADP-рибозилирование актина по аргинину-177 стерически блокирует его полимеризацию [113], а ADP-рибозилирование по аргинину-125 нуклеотид-зависимого P2X7 ионного канала в непосредственной близости от лиганд-связывающего сайта приводит к увеличению сродства лигандов к каналу [3]. Низкомолекулярные аналоги аргинина, содержащие гуанидиновую группу (в том числе, агматин) сами по себе являются мишенями ADP-рибозилирования, предотвращая, таким образом, модификацию остатков аргинина в белках [89].
Агматин приводит к снижению уровня экспрессии (down-regulation) некоторых матриксных металлопротеиназ (MMPs), действуя, таким образом, как их ингибитор [75]. MMPs – семейство Zn2+-зависимых эндопептидаз, которые приводят к деградации компонентов внеклеточного матрикса и участвуют в регуляции многих нормально- и патофизиологических процессов: эмбриогенез, дифференцировка и миграция клеток, ангиогенез, апоптоз, восстановление тканей, онкология, сердечная недостаточность, фиброз, артрит, аутоиммунные заболевания, воспаление, атеросклероз [87, 187, 205]. Было показано, что экзогенный агматин снижает экспрессию MMP-2 и MMP-9 как на уровне м-РНК, так и на уровне трансляции, что происходит параллельно с индукцией эндотелиальной NO-синтазы и увеличением экспрессии активирующего транскрипционного фактора 3 (activating transcription factor 3, ATF3). Ингибитор NO-синтаз, L-NAME, предотвращал снижение экспрессии MMP-2, но не MMP-9, что указывает на разные механизмы их подавления (down-regulation) [75, 221]. Также агматин снижал уровень экспрессии белков “водных” каналов – аквапорина-1 и аквапорина-9, предотвращая отек мозга в модели церебральной ишемии у крыс [77].
4. НЕПРЯМОЕ ДЕЙСТВИЕ АГМАТИНА
4.1. Ионные каналы
В организме, как в одно-, так и в многоклеточном, для его нормального функционирования необходимо, чтобы все системы обмена веществ работали слаженно, быстро реагируя на изменение параметров окружающей среды. Это достигается благодаря множеству прямых и обратных связей между различными мишенями. Наблюдаемые при действии агматина сложные эффекты не всегда можно объяснить прямым взаимодействием с эффекторными молекулами, потому как в них оказываются вовлеченными другие системы, активность которых регулируется прямыми мишенями. Так, например, было показано, что агматин дозо-зависимо ингибирует потенциал-зависимые Ca2+-токи в желудочковых кардиомиоцитах и неонатальной культуре нейронов гиппокампа, ускоряя инактивацию Са2+-канала и замедляя возврат из инактивированного состояния [97, 225]. Ингибирование Ca2+-токов L-типа связано с активацией I1Rs и сопряженного с ними сигнального пути, включающего фосфатидилхолин-зависимую фосфолипазу С (PC-PLC) и протеинкиназу С (PKC), но не с активацией α2-адренорецепторов [1]. Кроме того, агматин снижал концентрацию [Ca2+]in в цитозоле и внутриклеточный уровень Ca2+, стимулированный различными агентами, однако механизмы его действия не выяснялись [96]. Недавно, было показано, что в сердечных клетках агматин обладает бифазным действием на внутриклеточный уровень Са2+: микромолярные и субмиллимолярные дозы снижают [Ca2+]in, тогда как агматин в миллимолярных концентрациях приводит к увеличению [Ca2+]in. Механизм действия малых доз был связан с NO-зависимой неферментативной активацией закачивания Са2+ в депо за счет увеличения активности Са2+-АТФазы саркоплазматического ретикулума (SERCA), в то время как высокие дозы агматина действовали через стимуляцию I1Rs и PC-PLC – PKC-сигнального пути, приводящего к активации выброса Са2+ из депо через рианодиновые рецепторы (RyRs) [112]. Кроме того, существуют данные о модуляции агматином депо-зависимых Са2+-проницаемых каналов (SOC, store-operated channels) в сердце гибернирующих животных. SOC-каналы – это потенциал-независимые каналы малой проводимости (менее 1 пСм), включающие суперсемейство TRP-каналов (transient receptor potentials) и специфические кальций-сенсорные белки: ORAI и STIM. Активация SOC-каналов происходит всякий раз, когда случается выброс Са2+ из эндоплазматического ретикулума в цитозоль, и ответственна за низкоамплитудный, но пролонгированный вход Са2+ в клетку, обеспечивающий восполнение депонированного уровня Са2+ для следующего выброса. Агматин в микромолярных и субмиллимолярных концентрациях приводит к существенному накоплению Са2+ в ретикулуме зимоспящих сусликов, эффект агматина был NO-зависимым и исчезал при блокаде SOC-каналов [2]. Регуляция активности основных систем, детерминирующих Са2+-сигнализацию в сердечных клетках (Ca2+-каналы L-типа, SERCA, RyRs, SOC-каналы, CaSR) наводит на мысль о физиологической значимости агматина для функциональной активности миокарда и сердечно-сосудистой системы в целом.
Агматин способен модулировать ионные токи через различные типы K+-каналов. Так было показано, что агматин ингибирует электрическую активность в синоатриальном узле, действуя, частично через ингибирование АТФ-чувствительных K+-каналов (${\text{K}}_{{{\text{АТФ}}}}^{ + }$-каналов) [100]. Однако, в работе [174] было показано, что агматин NO- (и cGMP-) зависимо стимулирует Са2+-активируемые K+-каналы малой проводимости, ${\text{K}}_{{{\text{АТФ}}}}^{ + }$-каналы и K+-каналы входящего выпрямления. Вероятно, опосредованное влияние агматина на K+-каналы может различаться по тканеспецифичности и реализовываться через разные сигнальные пути.
Агматин модулирует ионные каналы в органах выделительной системы. Так, в изолированных клетках почечных канальцев агматин, моксонидин и 2,6-диметилклонидин (агонисты имидазолиновых рецепторов) увеличивали секрецию мочи и осмотический клиренс, что согласуется с ингибированием Na+/H+-обменника – механизмом, связанным с имидазолиновыми рецепторами [20]. Также, агматин увеличивает активность Na+/K+-АТФазы в мембранах почек [20].
4.2. Митохондрии
Известно, что в митохондриях имеется переносчик аргинина и активная ADC, генерирующая агматин [67]. Кроме того, на внешней митохондриальной мембране располагаются имидазолиновые рецепторы второго типа (I2Rs), эндогенным лигандом которых является агматин, а также – агматиназа, его утилизирующая. Колоколизация ферментов синтеза и деградации сигнальной молекулы, а также мишени ее действия представляется интересной внутриклеточной регуляторной связью. I2Rs являются аллостерическими сайтами моноаминоксидаз [160]. Активность моноаминооксидаз связана с продукцией активных форм кислорода (АФК), таким образом, существенно влияя на функциональный статус митохондрий в норме и патологии [33]. Было показано, что агматин модулирует Са2+-связанные процессы в митохондриях мозга, печени и почек (Са2+ емкость, величина трансмембранного потенциала (ΔΨ m), уровень АФК) [17, 18, 52]. Также было показано важное регуляторное влияние агматина на открытие митохондриальной неспецифической поры (mitochondrial permeability transition, mPTP), явление, напрямую связанное с апоптозом [10, 42]. В печени был обнаружен двойственный эффект агматина, при низких концентрациях (мкМ) агматин вызывает снижение синтеза ATP, стимулирует увеличение синтеза супероксид-аниона и перекиси, а также открытие митохондриальной неспецифической поры, вызываемое повышением Ca2+. Увеличение синтеза АФК снижает величину трансмембранного потенциала и связанные с ним параметры (степень восстановленности пиридиновых нуклеотидов, глутатиона, тиолов), снижает дыхательный контроль и отношение ADP/О [52]. В культуре гепатоцитов показано, что агматин индуцирует апоптоз, созревание прокаспазы-3, увеличивает активность каспазы-3 и выход цитохрома С [42]. При действии высоких концентраций (мМ) несмотря на сохраняющийся синтез АФК агматин предотвращает открытие поры, не влияет на продукцию ATP, степень восстановленности тиолов и глутатиона [18]. В митохондриях почек и мозга агматин обладает только протекторным действием, ингибируя открытие поры и увеличивая Са2+ емкость митохондрий [10, 17]. В почках было показано, что агматин предотвращает окисление тиолов, снижает уровень перекиси, экспрессию членов проапоптотического семейства Bcl-2, активацию каспазы-3, защищая таким образом клетки от апоптоза [10]. В митохондриях мозга агматин снижал уровень окислительного стресса, вызываемого продукцией АФК, действуя в качестве скавенджера (перехватчика) свободных радикалов, предотвращал транслокацию NF-κB ядерного фактора, снижение ΔΨ m, ингибировал активность каспазы-3, экспрессию Bax и выброс цитохрома С, проявляя антиапоптотические свойства [27].
Поскольку на митохондриях локализуется и фермент деградации агматина – агматиназа, нельзя исключить возможность влияния на физиологические параметры митохондрий продуктов дезаминирования агматина (путресцин, спермидин, спермин). Так, например, известно, что спермин активирует кальциевый унипортер митохондрий [224].
4.3. Ферменты и метаболизм
Хорошо известно влияние агматина на целый ряд метаболических показателей в организме, опосредованное через взаимодействие с прямыми мишенями. Так агматин увеличивает секрецию инсулина из островковых клеток поджелудочной железы [182], стимулирует поглощение глюкозы и уровень гликогена в диафрагме [213], усиливает окисление глюкозы, липогенез и ингибирует липолиз в жировой ткани [212], проявляя, таким образом, умеренное гипогликемическое действие. Агматин стимулирует β-окисление жирных кислот в митохондриях печени, увеличивает продукцию N-ацетил-глутамата и синтез мочевины [138, 139]. Кроме того, агматин ингибирует образование конечных продуктов глубокого гликирования (неферментативная ковалентная модификация белковой или липидной молекулы остатком сахара) [114]. Повышение уровня конечных продуктов глубокого гликирования наблюдается при ряде патофизиологических состояний (окислительный стресс, гипергликемия, диабет, гиперлипидемия) и служит показателем провоспалительных процессов [214].
В желудочно-кишечном тракте было показано, что агматин обладает просекреторной и ульцерогенной активностью, стимулируя выделение желудочного сока, секрецию пепсина и снижение толщины слизистой оболочки [46]. Действие агматина опосредуется α2-адренорецепторами и/или имидазолин-связывающими сайтами и связано с выбросом гистамина из энтерохромаффин-подобных клеток, поскольку может блокироваться антагонистом гистаминовых рецепторов второго типа [68, 129]. Интересно, что ни в желудке, ни в кишечнике ADC так и не была обнаружена, зато установлено, что патогенная бактерия Helicobacter pylori синтезирует и высвобождает агматин [123], что наводит на мысль о значимости агматина в развитии патофизиологических событий в желудочно-кишечном тракте, например, при его колонизации H. pylori. Так, в желудочном соке H. pylori-положительных пациентов содержание агматина почти вдвое выше, чем у пациентов без данного патогена [123].
5. СИСТЕМНЫЕ ЭФФЕКТЫ АГМАТИНА
5.1. Нервная система
На сегодняшний момент, предполагается, что агматин является важным нейромедиатором в центральной нервной системе (рис. 5), поскольку он способен эндогенно синтезироваться из аргинина ADC и накапливаться в нейронах и глии [50, 164], связан с малыми везикулами в аксонных терминалях и высвобождается из синаптосом Са2+-зависимым механизмом при деполяризации [170], кроме того может инактивироваться обратным захватом в клетку или специфически – агматиназой [175], связывается с рядом рецепторов, локализованных в мозге (имидазолиновые, α2-адренорецепторы и др., см. раздел “Мишени агматина: прямое действие”). Кроме того, в мозге агматин является предшественником таких важных нейротрансмиттеров, как глутамат и γ-аминомасляная кислота (GABA) [150].
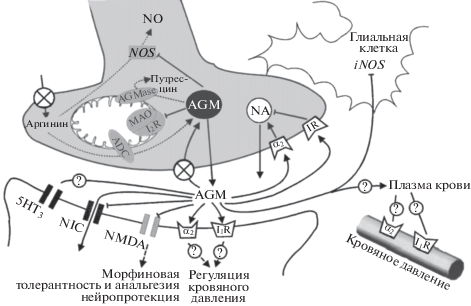
Рис. 5.
Строение агматинергического синапса по Raasch и др., 2001 [159]. Обозначения: NO – оксид азота; NOS – NO-синтаза; iNOS – индуцибельная изоформа NOS; MAO – моноаминоксидаза; AGMase – агматиназа; I2R – имидазолиновый рецептор 2-го типа; ADC – аргининдекарбоксилаза; AGM – агматин; NA – норадреналин; 5HT3 – серотониновые рецепторы 3-его типа; NIC – никотиновые холинорецепторы; NMDA – N-метил-D-аспартатные рецепторы; α2 – α2-адренорецепторы; I1R – имидазолиновый рецептор 1-го типа; IR – имидазолин-связывающий сайт на пресинаптической мембране.
Антиноцицептивные (противоболевые) эффекты
Сам по себе агматин был неэффективен в экспериментах по исследованию болевого порога у мышей, однако после внутривенного или внутрицеребрального введения усиливал анальгетическое действие морфина, предотвращал развитие толерантности к морфиновой анестезии, вызывал ингибирование морфинового и этанол-вызванного абстинентного синдрома [8, 82, 143]. Поскольку агматин напрямую не связывается с опиатными рецепторами, было предположено, что его действие в ЦНС опосредовано NMDA и/или влиянием на NO-синтазы. Выброс глутамата – основное событие, контролирующее возбуждение нейронов в задних рогах спинного мозга, как результат стимулов, приходящих в ноцицептивные волокна [37]. Глутамат, действуя через каинатные АМРА-рецепторы, вызывает кратковременную деполяризацию, которая снимает Mg2+-блок в устье NMDA-канального комплекса, что приводит к развитию продолжительной деполяризации и дальнейшим событиям внутриклеточной сигнализации: активация протеинкиназ, мобилизация внутриклеточного Са2+, индукция экспрессии генов, и дополнительный синтез ноцицептивных и/или воспалительных медиаторов, таких как простагландины, NO, которые способны стимулировать афферентные терминали, вызывая дальнейший выброс ноцицептивных трансмиттеров и активацию связанных с ними сигнальных путей [209]. Таким образом, способность агматина блокировать NMDA-рецепторы, пресинаптические потенцил-зависимые Са2+-токи и NO-синтазу может объяснять его антиноцицептивное действие подавлением глутаматергической передачи [120, 217]. Другим возможным объяснением является влияние агматина на адренорецепторную трансмиссиию. Во-первых, хорошо известна способность агматина ингибировать высвобождение норадреналина на постганглионарных симпатических нервных окончаниях. Вторым механизмом может являться его прямое связывание с α2-адренорецепторами. Так, агонисты α2-ARs (норадреналин, клонидин, моксонидин) играют ключевую роль в модуляции ноцицепции в симпатической нервной системе [22, 80]. Кроме того, агматин сам по себе является предшественником полиаминов, которые также способны оказывать различные центральные эффекты [90]. Недавно был обнаружен альтернативный механизм, поскольку было показано, что ингибирование толерантности к морфиновой анестезии агматином может объясняться предотвращением интернализации и down-regulation μ-опиоидных рецепторов, механизм, который связан с активацией нейрональных I1Rs [41].
На клеточном уровне, адаптация к опиатной анестезии сопровождается повышением активности (up-regulation) cAMP-сигнального пути. Агматин ингибирует синтез сAMP (циклический аденозинмонофосфат) в экспериментах по аппликации морфина на NG108-15 клетки и на срезах мозга крыс, которым продолжительное время инъецировали морфин [9, 218]. Агматин также ингибировал увеличение экспрессии отвечающей за биосинтез всех катехоламинов – тирозингидроксилазы, наблюдаемое при хроническом введении опиатов, в голубом пятне (locus coereleus) и стриатуме (striatum) [211]. Кроме того, агматин подавляет экспрессию транскрипционного фактора FosB, что также относится к механизмам ингибирования толерантности к морфиновой анестезии [210].
Таким образом, имеющиеся данные свидетельствуют в пользу того, что экзогенно приложенный агматин блокирует развитие опиоидной зависимости и может рассматриваться как эндогенный антиноцицептивный модулятор в ряде моделей нейропатических болей.
Противосудорожные эффекты агматина
Эпилепсия и возникающие в различных отделах мозга конвульсивные статусы могут иметь различную природу, например, быть вызваны генетическими нарушениями, патологиями развития или спровоцированы экзогенно приложенными препаратами. Однако, усиление активности ионотропных и метаботропных глутаматергических рецепторов, по-видимому, является общим механизмом инициации и распространения пароксизмальной судорожной активности [117]. Кроме того, во время судорог в мозге резко возрастает продукция NO [195]. Таким образом, NMDA-антагонисты и NOS-блокаторы потенциально представляют интерес как антиэпилептические агенты. Агматин, обладая обеими ингибирующими активностями, наряду с низкой токсичностью, может рассматриваться как перспективное фармакологическое средство. В связи с этим, в экспериментах по индукции судорожного статуса у крыс внутривенной инъекцией GABA-антагониста пентилентетразола (PTZ), агматин был весьма эффективен в снижении тяжести и степени повреждения нервной ткани. Микромолярные дозы агматина значительно повышали порог возникновения PTZ-вызванных судорог, что частично предотвращалось на фоне α2-адренорецепторной блокады иохимбином и при введении субстрата NO-синтаз – L-аргинина [32]. Не исключено, что в противосудорожное действие агматина вовлекается его способность ингибировать выброс глутамата и активность NMDA-рецепторов. Поскольку, Ca2+-токи через NMDA-рецепторы способствуют Са2+-кальмодулин-зависимой активации NOS, ингибирование Са2+ входа в клетку аттенюирует синтез NO. Эти эффекты инвертировались на фоне аппликации ингибитора NOS – L-NAME. Su и др. показали, что интрацеребральное или подкожное введение агматина (от 2 до 160 мг/кг) дозо-зависимым образом укорачивало время развития тонической и клонической фаз судорог, вызванным электрошоковой стимуляцией у мышей [192]. Кроме этого, агматин потенциирует антиконвульсантное действие фенобарбитала, валпроата [108] и лития хлорида у мышей [15], без влияния на фармакокинетический профиль этих препаратов. Ингибирование гипервозбудимости нервных клеток показывает перспективность применения агматина в снятии эпилептического статуса и лечении эпилепсии.
Вовлечение в регуляцию психиатрических состояний
Способность агматина влиять на возбудимость нервных клеток натолкнула на мысль о его вовлечении в регуляцию стрессовых реакций, уровня тревожности и психической активности. Имеющиеся экспериментальные данные по влиянию агматина на тревожные состояния у грызунов противоречивы. Одни исследователи детектируют анксиолитический эффект внутрибрюшинно или подкожно вводимого агматина (несколько десятков мг на кг массы тела) в тесте избегания света/темноты, конфликтном поведении в тесте Вогеля (Vogel’s conflict drinking test) и экспериментах по социальному взаимодействию у крыс и мышей [8, 66, 91]. Так, агматин увеличивал число перемещений животных из освещенных участков в затененные и увеличивал число социальных контактов между особями. Другие исследователи не обнаружили заметного влияния агматина, используя те же тесты и схожие дозы [86, 141]. На данный момент, причина расхождений результатов неизвестна.
Более однозначные результаты получены относительно вовлечения агматина в регуляцию депрессивных состояний. Обнаружено, что плазматические концентрации агматина у пациентов с депрессией почти вдвое выше, чем у здоровых людей. Лечение антидепрессантом бупропионом возвращало уровень агматина к контрольным значениям [59]. Дисфункция нейроэндокринной и катехоламинергической систем во время развития депрессии связана с влиянием кортикотропин-рилизинг фактора на нейроны голубого пятна (locus coereleus). Область голубого пятна, как принято считать, является частью “центра регуляции стрессовых реакций”. Было показано, что агматин увеличивает берстовую активность (firing rate) в нейронах голубого пятна через NO-зависимый механизм [171]. Zomkowski и др. показали, что введение агматина дозо-зависимым образом вызывает антидепрессивный эффект в тестах форсированного плавания (forced swimming test) и в тесте хвостового сжатия у крыс (tail suspension test) [229]. Кроме того, было показано, что метаболит агматина – путресцин в поведенческих тестах проявляет сходное с агматином антидепрессант-подобное действие [232]. Для объяснения механизмов вовлечения агматина в депрессивные расстройства предложены следующие объяснения:
– ингибирование NMDA-рецепторов. Так, показано, что агматин предотвращал снижение уровня моноаминов, вызванное Са2+-перегрузкой нервных клеток вследствие чрезмерной активации NMDA-рецепторов [103]. В пользу этой гипотезы говорит тот факт, что антагонисты NMDA-рецепторов обладают антидепрессант-подобной активностью в поведенческих тестах [188].
– взаимодействие с 5-НТ1А/1B и 5 НТ2 серотониновыми рецепторами. Хорошо известно, что нарушение серотонинергической передачи является одним из ключевых факторов развития депрессивных расстройств [145]. Сообразно с этим, действие агматина частично предотвращалось на фоне блокады 5-НТ1А/1B и 5 НТ2 серотониновых сайтов. Кроме того, агматин усиливал антидепрессивное действие флуоксетина, механизм действия которого основан на блокаде обратного захвата серотонина [230].
– активация имидазолин-связывающих сайтов [199].
– влияние на опиоидную систему. Антидепрессивный эффект агматина полностью ингибировался предварительным введением δ- и μ-опиатных антагонистов [231].
Не так давно появились свидетельства об участии агматина в патогенезе ментальных расстройств, главным образом – шизофрении [191, 203]. Это комплексное заболевание, затрагивающее почти все функции мозга, такие как перцепция, когнитивные способности, концентрация внимания и эмоциональность [186]. На степень тяжести шизофрении влияют генетическая предрасположенность, особенности физиологии и социальное окружение [191]. На уровне сигнальных путей, за некоторые симптомы шизофрении ответственна гипофункция NMDA-рецепторов [142]. Кроме того, у пациентов с этим психическим расстройством обнаружены повышенные уровни полиаминов (спермина и спермидина) в плазме и различных отделах головного мозга [162]. Агматин, являясь предшественником полиаминов, и обладая NMDA-рецептор-антагонистической активностью, может быть участником патогенеза шизофрении. Препараты, подавляющие активность ADC, и, соответственно, биосинтез агматина рассматриваются как перспективная мишень для компенсации сенсоримоторных нарушений, развивающихся в ряде психотических нарушений, в том числе, при шизофрении [83, 146].
В 2017 году появилось первое исследование относительно участия агматина в регуляции расстройств аутистического спектра (РАС). РАС – общее нарушение развития, характеризующееся стойким дефицитом способности начинать и поддерживать социальное взаимодействие и общественные связи, а также ограниченными интересами и часто повторяющимися поведенческими действиями. Одна из моделей РАС, используемая в исследованиях, заключается во введении высоких доз вальпроевой кислоты беременным самкам мышей или крыс на ранних сроках развития плода. Возникающий при такой аппликации в эмбриональном мозге дисбаланс между возбуждением и торможением приводит к усиленной дифференциации глутаматергических и снижению GABA-ергических синапсов, что приводит к появлению у рожденных особей некоторых признаков РАС в поведении. Однократное введение агматина (десятки мг на кг массы тела животного) восстанавливало уровень социальных взаимодействий и предотвращало зацикленность действий крыс с моделью РАС. Механизм протекторного действия агматина еще только предстоит выяснить, однако удалось установить, что он сдерживает чрезмерную активацию ERK1/2-сигнального пути (extracellular-regulated kinases) в префронтальной коре и гиппокампе [79].
Вовлечение агматина в нейропротекции при нейротравмах
Активность агматина была протестирована в ряде моделей повреждения головного и спинного мозга: ишемии-реперфузии и механических травмах in vitro и in vivo [45, 155]. Известно, что глуматат, активирующий поток Ca2+ через NMDA-рецепторы, приводит к Са2+-перегрузке нейронов, запуская патофизиологические события, ведущие к некротической гибели клеток [6]. Глутамат широко используется в исследовательской практике как модель эксайтотоксичности, индуцирующая повреждения нервной ткани [25]. В конце 90-х годов XX века Olmos и др. обнаружили, что культуры гранулярных клеток мозжечка крыс, предварительно обработанные агматином, устойчивы к некротической гибели, индуцируемой микромолярными (1–100) концентрациями глутамата [142]. Примерно в то же время и была открыта способность агматина ингибировать NMDA-опосредуемые токи, блокируя NMDA-комплекс непосредственно в устье канала [222]. Нейропротекторный эффект агматина не был специфичен для клеток мозжечка, поскольку был обнаружен и для других типов нейронов: кортикальных, гиппокампальных и т.д. [208, 227].
Агматин также был эффективен в предотвращении апоптотической гибели клеток гиппокампа, вызванной хроническим увеличением глюкокортикоидов в организме крыс и приматов при симпатоадреналовом стрессе, проявляя, таким образом, терапевтическую ценность в профилактике нейродегенеративных состояний. Механизм его действия, кроме NMDA-блокады, также был связан с ингибированием потенциал-зависимых Са2+-токов, лимитирующих секрецию везикул с нейромедиатором в пресинаптических нейронах [208, 228].
Известно, что оксид азота и глутамат ответственны за нарушения, возникающие в проводящих путях спинного и головного мозга при механических травмах, а также при ишемии, вызванной гипоксическими стимулами [202]. Агматин, как ингибитор синтеза NO и антагонист NMDA-рецепторов был эффективен в компенсации повреждений нервной системы, вызванных гипоксией или нанесением травмы. Введение агматина улучшает возврат функций, утраченных в поврежденных отделах мозга, улучшает локомоторную функцию и снижает общее повреждение тканей в модели травмы спинного мозга [43]. Кроме того, агматин обладал выраженной нейропротекцией в модели ишемии-подобного инсульта, вызванного общей кислородной и глюкозной депривацией кортикальных нейронов [78]. Апплицированный до или сразу после ишемических эпизодов, агматин снижал общие показатели клеточной смертности, что было связано с ингибированием активности нейрональной, но не индуцибельной изоформы NOS (iNOS). Аналогично, агматин предотвращал повреждения мозга при окклюзии средней церебральной артерии, снижая зону инфарктного повреждения во всех группах, кроме группы с сильно отсроченным введением (спустя 5 ч после окклюзии) [78]. Кроме блокады iNOS-сигналинга, механизм агматиновой протекции включает конкурентное ингибирование ADP-рибозилирования белков, поскольку увеличение данного процесса вовлечено в патофизиологические события в нервных клетках после индукции ишемии, как было отмечено ранее [43]. Результаты, полученные Sengul и др. показывают, что агматин проявлял свои нейропротекторные эффекты даже в присутствии пролиферирующей микроглии спустя 3–4 дня после мозговой травмы, что указывает на его терапевтическую ценность не только на ранней фазе компенсаторного травматического ответа, но и в поздней фазе развития травмы. Стоит отметить, что агматин сдерживает чрезмерную активность микроглии через ингибирование продукции NO индуцибельной изоформой NOS, что предотвращает повреждение нервных клеток в ситуациях, связанных с гиперактивацией иммунного ответа в мозге, наблюдаемых, в том числе, во время гипоксического воздействия, инсульта и механических травмах [183].
Низкие дозы агматина были также эффективны в нейропротекции в модели мозговой травмы, индуцированной перкуссией жидкости [88]. В эксперименте у крыс с повреждением мозга, вызванного аппликацией жидкости с приложением повышенного давления, агматин снижал накопление глутамата, отношение лактат/пируват и внутричерепное давление, минимизируя, таким образом, область инфаркта и нарушений некоторых функций, связанных с нейропередачей, например, моторных [88, 223]. Он был также эффективен против повреждений нервной ткани в модели мозгового отека, вызванного либо окллюзией срединной церебральной артерии, либо прямым введением искусственной спинномозговой жидкости в мозг [207]. Агматин предотвращал экспрессию iNOS, и переэкспрессию белков водных каналов – аквапоринов (1, 4 и 9-го типов), сохраняя клеточный объем, функциональность плазмалемм и гомеостатический водно-солевой баланс [77]. Агматин также предотвращал апоптоз, вызванный гипоксией или аппликацией фактора некроза опухоли α в ганглионарных нейронах сетчатки, как в культуре in vitro, так и при in vivo введении крысам, что позволяет рассматривать его как новую терапевтическую стратегию компенсации нарушений, возникающих при повреждении сетчатки недостаточным снабжением кислорода или некоторыми нейротоксинами [30, 65].
Обучение, память, агматин
С начала 2000-х, примерно в то же время, когда формировалась концепция “агматин – еще один нейротрансмиттер”, стали появляться исследования по влиянию агматина на механизмы формирования памяти и обучение. Было показано, что системно апплицируемый агматин избирательно нарушает научение животных в поведенческих тестах по отвращению вкуса. Кроме того, агматин снижал время замирания на контекстный стимул в экспериментах по кондиционированию страха, не влияя на реакцию при предъявлении звукового стимула. Агматин не влиял на латентность и время поиска скрытой под водой платформы в водном лабиринте Морриса [11, 116]. Полученные данные свидетельствуют скорее о влиянии агматина на отдельные типы контекстуальной, нежели на пространственную память. В то же время, само пространственное обучение (в водном лабиринте Моррисе или тесте форсированного плавания) приводит к достоверному локальному увеличению эндогенного уровня агматина в СА1 поле гиппокампа, зубчатой извилине, энторинальной коре и вестибулярных ядрах [104]. Кроме того есть свидетельства о влиянии агматина на реконсолидацию памяти в задаче избегающего поведения (inhibitory avoidance) у крыс. Агматин фасилитировал извлечение памяти через механизмы, связанные с еNOS и адренергическими рецепторами в locus coereleus [184]. Агматин был эффективен в различных моделях нарушения памяти, предотвращая нарушения ее формирования и перезаписи. Так, он был эффективен в модели стрептозоцин-индуцируемого ухудшения научения в водном лабиринте Морриса [133], предотвращал когнитивные нарушения при синдроме отмены никотина [85] или вызванные хроническим введением амфетамина у грызунов [140]. Механизмы его действия были связаны с протекцией Akt-GSK3β сигнального пути [133], активацией α2-адренорецепторов [85], или увеличением экспрессии Са2+-кальмодулин зависимой киназы II α [140]. Агматин обладал антиамнетическими свойствами в модели скополамин-индуцируемой амнезии, предотвращая нарушения Akt и ERK-ассоциированных сигнальных путей в гиппокампе [132]. Кроме того, некоторые успехи агматина были показаны при когнитивных нарушениях у старых крыс. Внутрибрюшинное введение агматина (40 мг/кг) улучшало пространственную рабочую память и память, ответственную за распознавание объектов, снижая связанное с возрастом увеличение общей активности NOS [172]. Связь между повышением эндогенного агматина в префронтальной коре и гиппокампе, и эффективностью обучения (памяти) поддерживает ранее сделанные наблюдения, в которых было показано 50%-снижение уровня агматина в коре старых крыс [158].
Аппетит и анорексия
Вовлечение агматина в регуляцию энергетического обмена в организме навело на предположение о его участии в патогенезе пищевых расстройств. Пищевые расстройства характеризуются вялостью, снижением аппетита, ангедонией и беспокойством. Их статус у экспериментальных животных может быть индуцирован инъекцией бактериальных эндотоксинов, липополисахаридов различного состава (LPS). Агматин, апплицированный интрацеребровентрикулярно (несколько мкг), предотвращал развитие LPS-опосредуемой воспалительной реакции, предотвращая гипертермию, анорексию, беспокойство и снижение массы тела [197]. При этом, уровень медиаторов воспаления интерлейкина-6 и фактора некроза опухоли α у LPS-инъецированных животных снижались до контрольного уровня [197]. Внутрибрюшинное введение агматина было также эффективно против стрессовой реакции в модели анорексии, вызванной увеличением двигательной активности у самок крыс [198]. Животные в такой модели проявляют избыточную двигательную активность, снижение потребления пищи, нарушения эстрального цикла и потерю веса. Лечение агматином (10–40 мг/кг, в течение 10 дней) снижало активность бега на колесах, увеличивало потребление пищи и восстанавливало массу тела по сравнению с животными, получавшими физиологический раствор. Кроме того, обработка агматином снижала уровни кортикостерона у самок с вызванной анорексией и предотвращала нарушения эстрального цикла [198].
Сократимость сосудов
Помимо нейрофизиологических эффектов, агматин оказывает существенное влияние на сердечно-сосудистую систему. Введение агматина крысам снижает артериальное давление дозо-зависимым образом [40, 193]. Механизмы регуляции кровяного давления агматином в настоящий момент не очень понятны, поскольку данные о его прямом влиянии на сосуды противоречивы. Так, в исследованиях одних авторов, агматин не оказывал никакого эффекта на α2-ARs-опосредуемые сократительные ответы латеральной вены ладони, предварительно контрактированной деполяризующим раствором KCl [154]. Кроме того, в отличие от клонидина, агматин не увеличивал сократительную способность эндотелия грудной артерии крыс [154]. Эти результаты были подтверждены как в интактных, так и в эндотелий-денудированных сегментах грудного отдела аорты [47, 179]. Согласно другим авторам, агматин ингибирует сокращения легочной артерии и портальной вены, вызываемые электрической стимуляцией [137, 174, 200]. Действие агматина было нечувствительно к предварительной блокаде α2-ARs, и реализовалось как через пре-, так и постсинаптические механизмы [200]. Ранее было показано, что агматин может ингибировать высвобождение норадреналина на постганглионарных симпатических нервных волокнах [51]. Недавно было показано, что микромолярные концентрации агматина эффективны в релаксации брыжеечных артериол через NO-зависимый механизм [38]. По-видимому, действие агматина является “сосудоспецифичным”, т.е. зависит от молекулярно-физиологического статуса тех или иных сосудов, в силу чего, роль прямого действия агматина на уровень кровяного давления оценить крайне затруднительно. Можно предположить, что бóльший вклад в регуляцию артериального давления агматином вносят опосредованные механизмы, т.е. его влияние на систолический/диастолический объемы, объем сердечного кровяного выброса и контрактура миокардиальных клеток.
Предсердные влияния
Данные по влиянию агматина на сократимость предсердий также весьма разнятся. Примерно в одно и то же время, одни авторы показали, что агматин не обладал какой-либо прямой инотропной активностью в изолированном, электрически стимулированном предсердии крысы [157]. Напротив, производные имидазолина, циразолин и моксонидин, приводят к значительному увеличению сократительной способности, что, как было установлено, обусловлено механизмом, опосредованным α1-адренорецепторами [157]. Другой коллектив авторов сообщил, что агматин (1–10 мМ) уменьшает амплитуду потенциала действия, максимальную скорость в фазе подъема деполяризации (фаза 0), скорость диастолической деполяризации (фаза 4), частоту пейсмекерной активности и длительность потенциалов действия (на уровне 50 и 90% реполяризации) в председных волокнах человека дозо-зависимым образом [102]. Предварительная обработка метиловым эфиром NG-нитро-L-аргинина (L-NAME, ингибитор NOS) не влияла на действие агматина, указывая на NO-независимые эффекты. Влияние агматина полностью блокировалось предварительной обработкой идазоксаном, антагонистом α2-ARs и I1Rs. Эти результаты указывают на то, что воздействие агматина на предсердные волокна человека, вероятно, связано с уменьшением внутриклеточного кальция, опосредованного α2-ARs и I1Rs [102]. Также было показано, что агматин обладает негативным хронотропным действием, снижая частоту сердечных сокращений, амплитуду потенциала действия, максимальную величину деполяризации, а также пролонгируя дозо-зависимым образом длительность потенциала действия в пейсмекерных клетках сино-атриального узла кролика [100]. В сосочковой мышце морских свинок агматин ингибирует раннюю и отсроченную следовую деполяризацию, вызванную изопротеренолом [101].
Вентрикулярные влияния
В начале 2000-х было показано, что агматин ингибирует потенциал-зависимые Са2+-токи в желудочковых кардиомиоцитах [97]. Агматин ускорял кинетику инактивации Са2+-каналов и пролонгировал время нахождения канала в закрытом состоянии. Однако подробные механизмы действия не выяснялись [225]. Детальное исследование таких механизмов показало интересные результаты, указывающие на вовлечение агматина в миокардиальную сократимость при физиологических концентрациях, достигаемых в плазме (рис. 6).
Рис. 6.
Влияния агматина на сократимость миокардиальных клеток по Maltsev и др., 2014 [111]. Обозначения: α2-AR – α2-адренорецептор; I1R – имидазолиновый рецептор 1-го типа; Gi – ингибиторный G-белок, сопряженный с α2-AR; PI3K – фосфатидилинозитол-3-гидроксикиназа; PDK – фосфатидилинозитол-зависимая киназа; Akt(PKB) – Akt-киназа (протеинкиназа B); eNOS – эндотелиальная изоформа NO-синтазы; S1179 и T497 – остатки серина и треонина в eNOS, фосфорилирование по которым меняет активность фермента (активная/неактивная); PP2A – протеинфосфатаза 2А; PC-PLC – фосфатидилхолин-зависимая фосфолипаза С; DAG – диацилглицерол; PKC – протеинкиназа С; PP1 – протеинфосфатаза 1; SERCA – Са2+-ATPаза саркоплазматического ретикулума; PLB – фосфоламбан, ингибиторный белок SERCA-комплекса; RyR – рианодиновые рецепторы, отвечающие за выброс Са2+ в цитозоль; P – остаток фосфорной кислоты, транслоцирующийся в процессах фосфорилирования/дефосфорилирования эффекторных молекул.
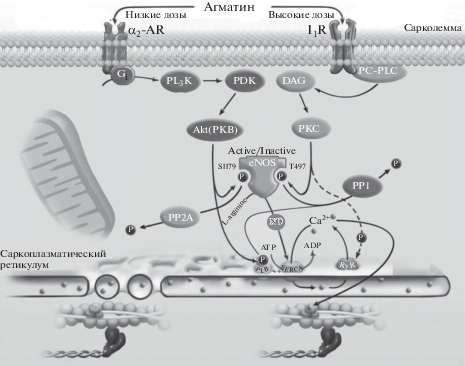
Было показано, что действие агматина на потенциал-зависимые Са2+-каналы L-типа (VGCC, voltage-gated calcium channels) связано с активацией I1Rs и сопряженного с ними сигнального пути, включающего фосфатидилхолин-специфическую фосфолипазу С (PC-PLC) и изоформы протеинкиназы С (PKC) [112]. Кроме того, было обнаружено бифазное действие агматина на [Ca2+]in: малые концентрации (1–500 мкМ) снижают уровень Са2+ в цитозоле, высокие (2–15 мМ) приводят к реверсии эффекта вплоть до увеличения внутриклеточного уровня Са2+ [216]. Cнижение [Ca2+]in связано с активацией α2-ARs, сопряженного с ними PI3K–Akt сигнального пути, который приводит к стимуляции eNOS, и, соответственно, повышению продукции NO. Оксид азота, в свою очередь, cGMP-независимо усиливает активность Са2+-АТФазы саркоплазматического ретикулума (SERCA), эффективно увеличивая закачку Са2+ в депо [111]. Агонист α2-ARs, гуанабенц, полностью воспроизводил эффекты малых доз агматина, и, по имеющимся данным, это первое свидетельство вовлечения α2-ARs в регуляцию цитозольного уровня Са2+ в сердечных клетках [81]. Действие высоких концентраций агматина (2–15 мМ) связано с активацией I1Rs–PC-PLC–PKC, что приводит к снижению синтеза NO и увеличению Са2+-выброса в цитозоль через рианодиновые рецепторы (RyRs). Стоит отметить, что общепринятой парадигмой считалось отсутствие в желудочковых кардиомиоцитах α2-ARs и I1Rs, а влияние их агонистов приписывали исключительно центральному механизму, реализующемуся в центре контроля кровяного давления в продолговатом мозге. Таким образом, исследования действия агматина открыли в миокардиальных клетках две разнонаправленные системы управления сократимостью миокарда: α2-ARs и I1Rs [111]. Переключение процессов клеточной сигнализации с одной на другую может быть значимым для нормально- и патофизиологических событий, в которые вовлекается изменение плазменных и тканевых уровней агматина в сердце.
Агматин и гемодинамика
При внутривенном введении агматин снижает сердечный выброс, общее периферическое сопротивление сосудов у нормотензивных и гипертензивных солечувствительных крыс [95]. Однако дозы агматина, необходимые для существенного снижения артериального давления (10–100 мг/кг), были достаточно высоки, что противоречит гипотезе специфической вазодилатации и может рассматриваться как неспецифическая защитная реакция. Несмотря на это, эффекты агматина были длительными, а рецидивирующей тахикардии не наблюдалось [60]. Если сравнивать агматин с другими вазоактивными веществами, такими как брадикинин, норадреналин или ангиотензин II, для достижения того же эффекта на уровень артериального давления требуются, в среднем, на 3 порядка большие дозы [40]. Возможно, что сниженная эффективность агматина может представлять собой аддитивность его вазоконстрикторских и дилатирующих влияний на разные сосуды кругов кровообращения. В любом случае, никаких эффектов внутрицеребровентрикулярного применения агматина (1–1000 нМ) на артериальное давление и частоту сердечных сокращений не наблюдалось, что свидетельствует скорее о периферических механизмах действия агматина, нежели о центральном [149]. Кроме того, вероятно, нужно учитывать локальность действия агматина, в зависимости от места его синтеза. Что касается потенциальных взаимодействий агматина с релаксирующими нейротрансмиттерами, было показано взаимодействие с NO [12, 39], но не с ацетилхолином [26] или брадикинином [40]. Кроме того, отмечено взаимодействие агматина и с вазоконстрикторными нейротрансмиттерами, например, с ангиотензином II [165] и катехоламинами [47].
В модели артериальной гипертензии на спонтанно-гипертензивных крысах (SHR) было показано, что гипотензивные свойства внутривенно вводимого агматина усиливались на анестезированных животных [179]. При центральном введении, Head и соавторы не наблюдали увеличения частоты сердечных сокращений у бодрствующих кроликов, за исключением высоких доз (100 мкг/кг), которые вызывали возбуждение, тахипноэ, повышение артериального давления и обращение дозо-зависимой брадикардии, наблюдаемой для низких доз агматина (1–10 мкг/кг) [62]. Для центральной аппликации агматина была показана значимость места введения, что, вероятно связано с множественностью его мишеней и указывает на несколько специфичных мест регуляции [193, 194].
Сравнение действий моксонидина и агматина после инъекции в IV желудочек бодрствующих кроликов показало, что оба вещества вызывали сходной выраженности брадикардиальный эффект. Эти эффекты были ослаблены эфароксаном (смешанным антагонистом I1Rs и α2-ARs) и 2-метоксидазоксаном (антагонистом α2-ARs) [62]. Как у бодрствующих кроликов, так и у анестезированных SHR, центрально вводимый агматин не оказывает влияния на артериальное давление после индукции гипотонии клонидином или моксонидином [62, 179], в то время как агматин-индуцируемая брадикардия усиливается [179]. Из полученных результатов был сделан вывод о том, что агматин может являться агонистом α2-ARs [62]. Тот факт, что центрально вводимый агматин не оказывает гипотензивного действия, в отличие от других агонистов α2-ARs (клонидин, моксонидин), наводит на мысль о важности периферических α2-ARs при реализации гипотензивного действия агматина, вводимого внутривенно. В 2014 году все известные в настоящий момент подтипы α2-ARs (α2А-, α2В-, α2С-) были обнаружены в левожелудочковых кардиомиоцитах взрослых здоровых крыс и была показана их важность для регуляции диастолического уровня кальция в цитозоле и сократимости миокардиальных клеток в целом [111].
5.3. Выделительная система
Регуляция натрия в почках важна для регуляции кровообращения как при нормальных, так и при патологических условиях. Роль α2-ARs в этом контексте ранее была продемонстрирована [119]. В исследованиях по радиолигандному связыванию удалось продемонстрировать, что в почках присутствуют как α2-ARs, так и имидазолин-связывающие сайты [28, 36]. Исследования моксонидина позволили предположить функциональное участие имидазолиновых рецепторов в натрийурезе [5], но пока неясно, центральный и/или периферический механизмы влияют на экскрецию натрия и образование мочи при действии моксонидина [190]. Возникает вопрос о значимости агматина для регуляции функций выделительной системы, особенно учитывая тот факт, что он был широко распространен как в мозге, так и почках [107, 158]. В концентрациях, которые не вызывают изменений в гемодинамике или клиренсе креатинина, агматин, клонидин, а также I1-лиганды, моксонидин и 2,6-диметил-клонидин увеличивают скорость образования первичной мочи [5, 94]. Наблюдаемые увеличения при действии 2,6-диметилклонидина и агматина являлись результатом повышенного осмотического клиренса, в то время как клонидин увеличивал клиренс свободной воды, что согласуется с I1Rs-опосредуемым ингибированием Na+/H+-обменника в изолированных клетках почечных канальцев [20]. Это говорит о том, что осмотический клиренс является I1Rs-зависимым процессом, тогда как клиренс свободной воды может быть связан с α2-ARs-ассоциированными механизмами [189].
В перфузированных изолированных почках крыс агматин после введения в почечный интерстиций или область мочеточника дозо-зависимо и значительно увеличивает величину клубочковой фильтрации одиночного нефрона, а также абсолютную проксимальную реабсорбцию. Влияние на реабсорбцию было чувствительно к блокаде Na+/K+-АТФазе, что указывает на участие этой ионной помпы в эффектах агматина [107]. После денервации таких почек, агматин влиял на величину клубочковой фильтрации, но не на скорость проксимальной реабсорбции. Эффекты агматина были транзиентными, что, возможно, было связано с его катаболизмом диаминоксидазой [107]. Тот факт, что агматин увеличивает величину клубочковой фильтрации после денервации в той же степени, что и в иннервированных почках, исключает возможность пресинаптического механизма. В то же время, его влияние на реабсорбцию затрагивает пресинаптические влияния. Также было показано, индуцируемое агматином увеличение фильтрации может опосредоваться через механизм, связанный с увеличением продукции NO [180].
6. СТРАТЕГИИ УПРАВЛЕНИЯ УРОВНЕМ АГМАТИНА В ОРГАНИЗМЕ
Учитывая множественность, сложность и разнонаправленность влияний агматина в организме, особую терапевтическую значимость имеют стратегии управления его эндогенным уровнем. Основные из них представлены ниже:
● Имуннонейтрализация. Заключается в использовании специфично сконструированных антител против агматина. Такие антитела были успешны, например, для повышения чувствительности у мышей к последующей индукции толерантности к морфиновой анальгезии [206].
● Переэкспрессия ADC. Генетические конструкты, содержащие ген, кодирующий фермент синтеза агматина, могут быть использованы для повышения эндогенных концентраций амина. Учитывая факт того, что можно подобрать относительно тканеспецифичные промоторы, то экспрессию ADC, в зависимости от задач, можно также менять только в целевых тканях/органах [21].
● Переэкспрессия агматиназы. Генетические конструкты могут быть сконструированы и для увеличения количеств фермента, отвечающего за деградацию агматина в случае, если нужно снизить эндогенный уровень амина. Кроме того, такой подход увеличивает оборот полиаминов (polyamine turnover), меняя уровни орнитина, спермина, спермидина в клетках [73, 121].
● Малые интерферирующие РНК (миРНК) против ADC/агматиназы. Явление РНК-интерференции позволяет влиять на уровень синтезируемых с мРНК белков, поскольку миРНК, связываясь с мРНК ингибируют процессы трансляции соответствующих белков. Этот подход может использоваться как для ингибирования активности ферментов как синтеза, так и деградации агматина.
● Фармакологические ингибиторы. Высокоспецифичные блокаторы для ADC в настоящий момент неизвестны, однако ADC (наряду с орнитиндекарбоксилазой) млекопитающих ингибируется α-дифторметилорнитином [166]. Не так давно, был обнаружен потенциальный ингибитор агматиназы (пиперазин-1-карбоксамидин), приводивший к селективному повышению агматина в мозге, без явных побочных эффектов [69].
● Блокаторы транспортеров-переносчиков агматина. В частности, были, например, разработаны ингибиторы митохондриального транспорта агматина [54], а также аналоги агматина, проникающие через гематоэнцефалический барьер [61]. Ведется поиск блокаторов плазмалеммального транспорта агматина. Он осложняется тем фактом, что перенос агматина через клеточную мембрану осуществляется многочисленными транспортерами (см. раздел “Транспорт агматина”). С другой стороны, вариативность систем транспорта, будучи тканеспецифичной, может обеспечивать более точную направленность эффектов с минимизацией побочных действий.
● Экзогенная аппликация агматина. Наиболее простой способ, привлекательный крайне низкой токсичностью агматина и минимумом нежелательных эффектов в широком диапазоне используемых доз. Пероральный прием приводит к тому, что агматин всасывается из желудочно-кишечного тракта и легко распределяется по всему организму [57], при этом только малое количество амина пересекает гемато-энцефалический барьер [152]. Фармакокинетические исследования показали, что период полувыведения неметаболизированного агматина почками составляет около 2 часов [70].
7. ВОЗМОЖНЫЕ ОБЛАСТИ ПРИМЕНЕНИЯ АГМАТИНА В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Терапевтический потенциал использования большого диапазона доз агматина определяется широким спектром рецептивных мишеней и может включать (но не ограничиваться):
● Ишемические повреждения миокарда (инфаркт). Экзогенный агматин обладает кардиопротекторным действием в модели ишемии-реперфузии у крыс, снижая ишемические повреждения миокардиальных клеток и предотвращая окислительный стресс и апоптотическую гибель при последующей реперфузии [53].
● Утилизация глюкозы и диабетические состояния. Гипогликемические эффекты агматина, связанные с увеличением поглощения клетками глюкозы и стимуляцию секреции инсулина в поджелудочной железе, а также влияние на почечные функции, могут быть полезны не только для компенсации диабетических нарушений, но также и для сложных расстройств, в которых участвует нарушение регуляции глюкозы (например, невропатия, болезнь Альцгеймера, депрессия и судороги).
● Нейродегенеративные заболевания. Влияние агматина на митохондриальную Са2+-пору и связанный с ее открытием Са2+-зависимый апоптоз, наводит на цитопротекторную роль агматина. Некоторые положительные результаты в этом направлении были получены на животных с моделями болезней Паркинсона и Альцгеймера [44, 115].
● Нефропротекция. Действие агматина на клубочковую фильтрацию и реабсорбцию натрия, наряду с его цитопротекторными свойства указывает на явные нефропротекторные свойства. Так, В модели мезангиального пролиферативного гломерулонефрита у крыс, агматин снижал пролиферацию мезангиальных клеток ингибированием орнитиндекарбоксилазы, а также улучшал почечную функцию [72].
● Нейротравмы, отек мозга, инсульт. Блокада NMDA-рецепторов, NO-сигнализации и аквапоринов в нервных тканях показывает терапевтическую ценность агматина против гибели нервных клеток при развитии патофизиологических изменений. Польза агматина была верифицирована множественными моделями таких патологий (См. раздел “Вовлечение агматина в нейропротекции при нейротравмах”).
● Нейропатические боли и анальгезия. Влияние агматина на ASIC3-каналы и вовлечение в усиление анальгизирующего эффекта опиатов показывают успешность применения агматина в компенсации болевых синдромов. В этой связи, агматин уже представлен на рынке как нутрицевтический препарат при лечении радикулопатии и ишиаса.
● Эпилептический статус. Противосудорожные эффекты агматина могут быть полезны для снятия статуса тонических и клонических судорог, а также для снижения повреждений, возникающих во время индукции эпилептического статуса.
● Глаукома. Агматин, предотвращающий NMDA-зависимую смерть ганглиозных клеток сетчатки может быть эффективно применен для предотвращения дегенерации сетчатки и падения зрения при развитии глаукомы.
● Депрессивные состояния. Во многих поведенческих моделях на животных агматин обладал выраженным антидепрессивным действием (См. раздел “Вовлечение в регуляцию психиатрических состояний”).
● Деменция. В экспериментах на животных, было показано, что введение агматина предотвращает ухудшения памяти и когнитивные нарушения, что было особенно выраженным для старых крыс (См. раздел “Обучение, память, агматин”).
● Онкология. Вовлечение аминов в процессы клеточного роста и ингибирование агматином клеточной пролиферации могут оказаться полезны в ряде моделей неконтролируемого клеточного роста. Исследования в этой области пока еще недостаточны для убедительности эффектов, однако обладающий еще и нейропротекторными свойствами агматин представляется перспективным для смягчения невропатий, вызванных химиотерапией опухолей.
8. ЗАКЛЮЧЕНИЕ
В настоящем обзоре предпринята попытка охватить весь спектр физиологической значимости агматина, на основании данных об исследованиях механизмов его действия на разных уровнях организации живых систем. Имеющиеся данные указывают на важность агматина для регуляции множества функций нервной, сердечно-сосудистой, выделительной, эндокринной систем. Наличие в организме млекопитающих эндогенных систем синтеза, транспорта, рецепции и деградации указывают на то, что агматин фактически может рассматриваться как гормоноподобный регулятор процессов метаболизма. Отдельные разделы посвящены обсуждению возможных стратегий регуляции уровня этого амина в организме, а также терапевтической ценности использования агматина в клинической практике.
Работа поддержана грантом РФФИ: № 18-015-00165А (Ю.М.К.).
Список литературы
Мальцев А.В., Евдокимовский Э.В., Пименов О.Ю. и др. Регуляция потенциал-зависимых Ca2+-токов L-типа агматином. Имидазолиновые рецепторы в изолированных кардиомиоцитах // Биол. мембраны. 2012. Т. 29. № 5. С. 307–316.
Накипова О.В., Аверин А.С., Тарлачков С.В. и др. Действие агматина на ритмоинотропные явления в папиллярной мышце сердца зимоспящих животных // Доклады Академии Наук. 2013. Т. 451. № 5. С. 203–208.
Adriouch S., Bannas P., Schwarz N. et al. ADP-ribosylation at R125 gates the P2X7 ion channel by presenting a covalent ligand to its nucleotide binding site // FASEB J. 2008. V. 22. P. 861–869.
Agostinelli E., Marques M.P., Calheiros R. et al. Polyamines: fundamental characters in chemistry and biology // Amino Acids. 2010. V. 38. № 2. P. 393–403.
Allan D.R., Penner S.B., Smyth D.D. 1993. Renal imidazoline preferring sites and solute excretion in the rat // Br. J. Pharmacol. V. 108. P. 870–875.
Ankarcrona M., Dypbukt J.M., Bonfoco E. et al. Glutamate-induced neuronal death: a succession of necrosis or apoptosis depending on mitochondrial function // Neuron. 1995. V. 15. P. 961–973.
Aricioglu F., Altunbas H. Is agmatine an endogenous anxiolytic/antidepressant agent // Ann. N. Y. Acad. Sci. 2003. V. 1009. P. 136–140.
Aricioglu F., Korcegez E., Bozkurt A. et al. Effect of agmatine on acute and mononeuropathic pain // Ann. N. Y. Acad. Sci. 2003a. V. 1009. P. 106–115.
Aricioglu F., Means A., Regunathan S. Effect of agmatine on the development of morphine dependence in rats: potential role of cAMP system // Eur. J. Pharmacol. 2004. V. 504. № 3. P. 191–197.
Arndt M.A., Battaglia V., Parisi E. et al. The arginine metabolite agmatine protects mitochondrial function and confers resistance to cellular apoptosis // Am. J. Physiol. Cell. Physiol. 2009. V. 296. P. 1411–1419.
Arteni N.S., Lavinsky D., Rodrigues A.L. et al. Agmatine facilitates memory of an inhibitory avoidance task in adult rats // Neurobiol. Learn. Mem. 2002. V.78. № 2. P. 465–469.
Auguet M., Viossat I., Marin J.G. et al. Selective inhibition of inducible nitric oxide synthase by agmatine // Jpn. J. Pharmacol. 1995. V. 69. P. 285–287.
Babál P., Ruchko M., Campbell C.C. et al. Regulation of ornithine decarboxylase activity and polyamine transport by agmatine in rat pulmonary artery endothelial cells // J. Pharmacol. Exp. Ther. 2001. V. 296. № 2. P. 372–377.
Babal P., Ruchko M., Olson J.W. et al. Interactions between agmatine and polyamine uptake pathways in rat pulmonary artery endothelial cells // Gen. Pharmacol. 2000. V. 34. P. 255–61.
Bahremand A., Ziai P., Khodadad T.K. et al. Agmatine enhances the anticonvulsant effect of lithium chloride on pentylenetetrazole-induced seizures in mice: involvement of L-arginine/nitric oxide pathway // Epilepsy Behav. 2010. V. 18. P. 186–192.
Battaglia V., Grancara S., Mancon M. et al. Agmatine transport in brain mitochondria: a different mechanism from that in liver mitochondria // Amino Acids. 2010. V. 38. P. 423–30.
Battaglia V., Grancara S., Satriano J. et al. Agmatine prevents the Ca2+-dependent induction of permeability transition in rat brain mitochondria // Amino Acids. 2010. V. 38. № 2. P. 431–437.
Battaglia V., Rossi C.A., Colombatto S. et al. Different behavior of agmatine in liver mitochondria: inducer of oxidative stress or scavenger of reactive oxygen species? // Biochim. Biophys. Acta. 2007. V. 1768. № 5. P. 1147–1153.
Bell J., Malmberg R.L. Analysis of a cDNA encoding arginine decarboxylase from oat reveals similarity to the E. Coli arginine decarboxylase and evidence of protein processing // Mol. Genet. 1990. V. 224. P. 431–436.
Bidet M., Tauc M., Koechlin N. et al. Video microscopy of intracellular pH in primary cultures of rabbit proximal and early distal tubules // Pflugers Arch. 1990. V. 416. № 3. P. 270–280.
Bokara K.K., Kvon K.H., Nho Y. et al. Retroviral expression of arginine decarboxylase attenuates oxidative burden in mouse cortical neural stem cells // Stem Cells Dev. 2010. V. 20. P. 527–537.
Browning S., Lawrence D., Livingston A. et al. Interactions of drugs activate at opiate receptors and drugs active at alpha 2-receptors on various test systems // Br. J. Pharmacol. 1982. V. 77. P. 487–491.
Cabella C., Gardini G., Corpillo D. et al. Transport and metabolism of agmatine in rat hepatocyte cultures // Eur. J. Biochem. 2001. V. 268. P. 940–947.
Chan S.L., Brown C.A., Scarpello K.E. et al. The imidazoline site involved in control of insulin secretion: characteristics that distinguish it from I1- and I2-sites // Br. J. Pharmacol. 1994. V. 112. № 4. P. 1065–1070.
Choi D.W. Calcium-mediated neurotoxicity: relationship to specific channel types and role in ischemic damage // Trends Neurosci. 1988. V. 11. P. 465–469.
Colucci R., Blandizzi C., Carignani D. et al. Effects of imidazoline derivatives on cholinergic motility in guinea-pig ileum: involvement of presynaptic alpha2-adrenoceptors or imidazoline receptors? // Naunyn-Schmiedebergs. Arch. Pharmacol. 1998. V. 357. P. 682–691.
Condello S., Currò M., Ferlazzo N. et al. Agmatine effects on mitochondrial membrane potential and NF-κB activation protect against rotenone-induced cell damage in human neuronal-like SH-SY5Y cells // J. Neurochem. 2011. V. 116. № 1. P. 67–75.
Coupry I., Atlas D., Podevin R.A. et al. Imidazoline-guanidinium receptive site in renal proximal tubule: asymmetric distribution, regulation by cations and interaction with an endogenous clonidine displacing substance // J. Pharmacol. Exp. Ther. 1990. V. 252. P. 293–9.
Dallmann K., Junker H., Balabanov S. et al. Human agmatinase is diminished in the clear cell type of renal cell carcinoma // Int. J. Cancer. 2004. V. 108. P. 342–347.
Dastan A., Kocer I., Erdogan F. et al. Agmatine as retinal protection from ischemia-reperfusion injury in guinea pigs // Jpn. J. Ophthalmol. 2009. V. 53. № 3. P. 219–224.
Demady D.R., Jianmongkol S., Vuletich J.L. et al. Agmatine enhances the NADPH oxidase activity of neuronal NO synthase and leads to oxidative inactivation of the enzyme // Mol. Pharmacol. 2001. V. 59. № 1. P. 24–29.
Demehri S., Homayoun H., Honar H. et al. Agmatine exerts anticonvulsant effect in mice: modulation by alpha2- adrenoceptors and nitric oxide // Neuropharmacol. 2003. V. 45. P. 534–542.
Di Lisa F., Kaludercic N., Carpi A. et al. Mitochondria and vascular pathology // Pharmacol. Rep. 2009. V. 61. № 1. P. 123–130.
Driessen A.J., Smid E.J., Konings W.N. Transport of diamines by Enterococcus faecalis is mediated by an agmatine-putrescine antiporter // J. Bacteriol. 1988. V. 170. № 10. P. 4522–7.
Eglen R.M., Hudson A.L., Kendall D.A. et al. 'Seeing through a glass darkly': casting light on imidazoline 'I' sites // Trends Pharmacol. Sci. 1998. V. 19. № 9. P. 381–390.
Evans R.G., Haynes J.M. Alpha2-adrenoceptor- and imidazoline-preferring binding sites in the dog kidney // Ann NY Acad. Sci. 1995. V. 763. P. 357–360.
Fundytus M.E. Glutamate receptors and nociception: implications for the drug treatment of pain // CNS Drugs. 2001. V. 15. № 1. P. 29–58.
Gadkari T.V., Cortes N., Madrasi K. et al. Agmatine induced NO-dependent rat mesenteric artery relaxation and its impairment in salt-sensitive hypertension // Nitric Oxide. 2013. V. 35. P. 65–71.
Galea E., Regunathan S., Eliopoulos V. et al. Inhibition of mammalian nitric oxides synthases by agmatine, an endogenous polyamine formed by decarboxylation of arginine // Biochem. J. 1996. V. 313. P. 247–249.
Gao Y., Gumusel B., Koves G. et al. Agmatine: a novel endogenous vasodilator substance // Life Sci. 1995. V. 57. P. 83–86.
Gao Y., Li F., Wu N. et al. Effect of agmatine on DAMGO-induced mu-opioid receptor down-regulation and internalization via activation of IRAS, a candidate for imidazoline I1 receptor // Eur. J. Pharmacol. 2008. V. 599. № 1–3. 18–23.
Gardini G., Cabella C., Cravanzola C. et al. Agmatine induces apoptosis in rat hepatocyte cultures // J. Hepatol. 2001. V. 35. № 4. P. 482–489.
Gilad G.M., Gilad V.H. Accelerated functional recovery and neuroprotection by agmatine after spinal cord ischemia in rats // Neurosci Lett. 2000. V. 296. № 2–3. P. 97–100.
Gilad G.M., Gilad V.H., Finberg J.P. et al. Neurochemical evidence for agmatine modulation of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) neurotoxicity // Neurochem Res. 2005. V. 30. P. 713–719.
Gilad G.M., Salame K., Rabey J.M. et al. Agmatine treatment is neuroprotective in rodent brain injury models // Life Sci. 1996. V. 58. P. 41–46.
Glavin G.B., Carlisle M.A., Smyth D.D. Agmatine, an endogenous imidazoline receptor agonist, increases gastric secretion and worsens experimental gastric mucosal injury in rats // J. Pharmacol. Exp. Ther. 1995. V. 274. № 2. P. 741–744.
Gonzalez C., Regunathan S., Reis D.J. et al. Agmatine, an endogenous modulator of noradrenergic neurotransmission in the rat tail artery // Br. J. Pharmacol. 1996. V. 119. P. 677–684.
Goracke-Postle C.J., Nguyen H.O., Stone L.S. et al. Release of tritiated agmatine from spinal synaptosomes // Neuroreport. 2006. V. 17. № 1. 13–17.
Goracke-Postle C.J., Overland A.C., Stone L.S. et al. Agmatine transport into spinal nerve terminals is modulated by polyamine analogs // Neurochem. 2007. V. 100. P. 132–141.
Gorbatyuk O.S., Milner T.A., Wang G. et al. Localization of agmatine in vasopressin and oxytocin neurons of the rat hypothalamic paraventricular and supraoptic nuclei // Exp. Neurol. 2001. V. 171. № 2. P. 235–245.
Gother M., Molderings G.J. Involvement of presynaptic imidazoline receptors in the alpha-2-adrenoreceptor-independent inhibition of noradrenaline release by imidazoline derivaties // N-S Arch Pharmacol. 1991. V. 343. № 3. P. 271–282.
Grancara S., Battaglia V., Martinis P. et al. Mitochondrial oxidative stress induced by Ca2+ and monoamines: different behaviour of liver and brain mitochondria in undergoing permeability transition // Amino Acids. 2012. V. 42. № 2–3. P. 751–759.
Greenberg S., George J., Wollman Y. et al. The effect of agmatine administration on ischemic-reperfused isolated rat heart // J. Cardiovasc. Pharmacol. Ther. 2001. V. 6. P. 37–45.
Grillo M.A., Battaglia V., Colombatto S. et al. Inhibition of agmatine transport in liver mitochondria by new charge-deficient agmatine analogues // J. Biochem. Soc. Trans. 2007. V. 35. P. 401–404.
Gründemann D., Hahne C., Berkels R. et al. Agmatine is efficiently transported by non-neuronal monoamine transporters extraneuronal monoamine transporter (EMT) and organic cation transporter 2 (OCT2) // J. Pharmacol. Exp. Ther. 2003. V. 304. № 2. P. 810–817.
Haenisch B., Bonisch H., Cichon S. et al. Effects of exogenous agmatine in human leukemia HMC-1 and HL-60 cells on proliferation, polyamine metabolism and cell cycle // Leuk. Res. 2011. V. 35. P. 1248–1253.
Haenisch B., von Kügelgen I., Bönisch H. et al. Regulatory mechanisms underlying agmatine homeostasis in humans // Am. J. Physiol. Gastrointest. Liver Physiol. 2008. V. 295. № 5. P. 1104–1110.
Halaris A., Piletz J. Agmatine: metabolic pathway and spectrum of activity in brain // CNS Drugs. 2007. V. 21. P. 885–900.
Halaris A., Zhu H., Feng Y. et al. Plasma agmatine and platelet imidazoline receptors in depression // Ann. N. Y. Acad. Sci. 1999. V. 881. P. 445–451.
Hauser W., Dominiak P. Effects of agmatine on catecholamine release and blood pressure of spontaneously hypertensive rats. A possible role for imidazoline receptors? // Pharm Pharmacol Lett. 1995. V. 5. P. 87–89.
He H., Liu M., Zheng Z. et al. Synthesis and analgesic activity evaluation of some agmatine derivatives // Molecules. 2006. V. 11. P. 393–402.
Head G.A., Chan C.K., Godwin S.J. Central cardiovascular actions of agmatine, a putative clonidinedisplacing substance, in conscious rabbits // Neurochem Int. 1997. V. 30. P. 37–45.
Heinen A., Brüss M., Bönisch H. et al. Pharmacological characteristics of the specific transporter for the endogenous cell growth inhibitor agmatine in six tumor cell lines // Int. J. Colorectal Dis. 2003. V. 18. № 4. P. 314–319.
Higashi K., Yoshida K., Nishimura K. et al. Structural and functional relationship among diamines in terms of inhibition of cell growth // J. Biochem. 2004. V. 136. P. 533–539.
Hong S., Lee J.E., Kim C.Y. et al. Agmatine protects retinal ganglion cells from hypoxia-induced apoptosis in transformed rat retinal ganglion cell line // BMC Neurosci. 2007. V. 8. e81. https://doi.org/10.1186/1471-2202-8-81
Hoog S. A review of the validity and variability of the elevated plus-maze as an animal model of anxiety // Pharmacol. Biochem. Behav. 1996. V. 54. P. 21–30.
Horyn O., Luhovyy B., Lazarow A. et al. Biosynthesis of agmatine in isolated mitochondria and perfused rat liver: studies with 15N-labelled arginine // Biochem. J. 2005. V. 388. № 2. P. 419–425.
Houi N., Kamisaki Y., Itoh T. Effects of histamine H2 receptor antagonists on acid secretion stimulated by imidazoline derivatives in isolated parietal cells // Eur. J. Pharmacol. 1987. V. 144. № 1. P. 67–76.
Huang M.J., Regunathan S., Botta M. et al. Structure-activity analysis of guanidine group in agmatine for brain agmatinase // Ann NY Acad Sci. 2003. V. 1009. P. 52–63.
Huisman H., Wynveen P., Nichkova M. et al. 2010. Novel ELISAs for screening of the biogenic amines GABA, glycine, beta-phenylethylamine, agmatine, and taurine using one derivatization procedure of whole urine samples // Anal Chem. V. 82. P. 6526–6533.
Hunter K.J., Strobos C.A., Fairlamb A.H. Inhibition of polyamine biosynthesis in Crithidia fasciculata by D,L-alpha-difluoromethylornithine and D,L-alpha-difluoromethylarginine // Mol. Biochem. Parasitol. 1991. V. 46. № 1. P. 35–43.
Ishizuka S., Cunard R., Poucell-Hatton S. et al. Agmatine inhibits cell proliferation and improves renal function in Anti-Thy-1 glomerulonephritis // J. Am. Soc. Nephrol. 2000. V. 11. P. 2256–2264.
Iyer R.K., Kim H.K., Tsoa R.W. et al. Cloning and characterization of human agmatinase // Mol. Genet. Metab. 2002. V. 75. № 3. P. 209–218.
Joshi M.S., Ferguson T.B., Johnson F.K. et al. Receptor-mediated activation of nitric oxide synthesis by arginine in endothelial cells // Proc. Natl. Acad. Sci. USA. 2007. V. 104. № 24. P. 9982–9987.
Jung H.J., Yang M.Z., Kwon K.H. et al. Endogenous agmatine inhibits cerebral vascular matrix metalloproteinases expression by regulating activating transcription factor 3 and endothelial nitric oxide synthesis // Curr. Neurovasc. Res. 2010. V. 7. № 3. P. 201–212.
Kashiwagi K., Kobayashi H., Igarashi K. Apparently unidirectional polyamine transport by proton motive force in polyamine-deficient Escherichia coli // J. Bacteriol. 1986. V. 165. № 3. P. 972–977.
Kim J.H., Lee Y.W., Park K.A. et al. Agmatine attenuates brain edema through reducing the expression of aquaporin-1 after cerebral ischemia // J. Cereb. Blood Flow Metab. 2010. V. 30. № 5. P. 943–949.
Kim J.H., Yenari M.A., Giffard R.G. et al. Agmatine reduces infarct area in a mouse model of transient focal cerebral ischemia and protects cultured neurons from ischemia-like injury // Exp. Neurol. 2004. V. 189. № 1. 122–130.
Kim J.W., Seung H., Kim K.C. et al. Agmatine rescues autistic behaviors in the valproic acid-induced animal model of autism // Neuropharmacol. 2017. V. 113. P. 71–81.
Kinnman E., Levine J.D. Involvement of the sympathetic postganglionic neuron in capsaicin-induced secondary hyperalgesia in the rat // Neuroscience. 1995. V. 65. P. 283–291.
Kokoz Y.M., Evdokimovskii E.V., Maltsev A.V. et al. 2016. Sarcolemmal α2-adrenoceptors control protective cardiomyocyte-delimited sympathoadrenal response // Mol. Cell. Cardiol. V. 100. P. 9–20.
Kolesnikov Y., Jain S., Pasternak G.W. Modulation of opioid analgesia by agmatine // Eur. J. Pharmacol. 1996. V. 296. P. 17–22.
Kopieczna-Grzebieniak E., Goss M. The importance of regulation of endogenous methylarginine concentrations in clinical practice // Przegl. Lek. 2005. V. 62. P. 1494–1501.
Kossel A. Uber das agmatin // Zeitschr. Physiol. Chem. 1910. V. 66. P. 257–261.
Kotagale N.R., Ali M.T., Chopde C.T. et al. Agmatine inhibits nicotine withdrawal induced cognitive deficits in inhibitory avoidance task in rats: Contribution of α2-adrenoceptors // Pharmacol Biochem Behav. 2018. V. 167. P. 42–49.
Krass M., Wegener G., Vasar E. et al. Antidepressant-like effect of agmatine is not mediated by serotonin // Behav. Brain Res. 2008. V. 188. P. 324–328.
Kumar D., Kumar M., Saravanan C. et al. Curcumin: a potential candidate for matrix metalloproteinase inhibitors // Expert Opin. Ther. Targets. 2012. V. 16. № 10. P. 959–972.
Kuo J.R., Lo C.J., Chio C.C. et al. Resuscitation from experimental traumatic brain injury by agmatine therapy // Resuscitation. 2007. V. 75. № 3. P. 506–514.
Laing S., Unger M., Koch-Nolte F. et al. ADP-ribosylation of arginine // Amino Acids. 2011. V. 41. № 2. P. 257–269.
Laschet J., Trottier S., Leviel V. et al. Heterogeneous distribution of polyamines in temporal lobe epilepsy // Epilepsy Res. 1999. V. 35. P. 161–172.
Lavinsky D., Sarmento N., Carlos A. et al. Agmatine induces anxiolysis in the elevated plus maze task in adult rats // Behav. Brain Res. 2003. V. 141. P. 19–24.
Li G., Regunathan S., Barrow C. et al. Agmatine: an endogenous clonidine-displacing substance in the brain // Science. 1994. V. 263. P. 966–969.
Li G., Regunathan S., Reis D.J. Agmatine is synthesized by a mitochondrial arginine decarboxylase in rat brain // Ann. N. Y. Acad. Sci. 1995. V. 763. P. 325–329.
Li P., Penner S.B., Smyth D.D. Attenuated renal response to moxonidine and rilmenidine in one kidney- one clip hypertensive rats // Br. J. Pharmacol. 1994. V. 112. P. 200–206.
Li Q., He R.R. Hemodynamic effects of agmatine in Dahl salt-sensitive hypertensive and Dahl salt-resistant rats // Acta Physiol Sin. 2001. V. 53. № 5. P. 355–360.
Li Q., Shang Z.L., Yin J.X. et al. Effect of agmatine on intracellular free calcium concentration in isolated rat ventricular myocytes // Sheng Li Xue Bao. 2002. V. 54. № 6. P. 467–472.
Li Q., Yin J.X., He R.R. Effect of agmatine on L-type calcium current in rat ventricular myocytes // Acta Pharmacol. Sin. 2002. V. 23. № 3. P. 219–224.
Li W.G., Xu T.L. ASIC3 channels in multimodal sensory perception // ACS Chem. Neurosci. 2011. V. 2. № 1. P. 26–37.
Li W.G., Yu Y., Zhang Z.D. et al. ASIC3 channels integrate agmatine and multiple inflammatory signals through the nonproton ligand sensing domain // Mol. Pain. 2010. V. 6. e88. https://doi.org/10.1186/1744-8069-6-88
Li X.T., Fan Z.Z., He R.R. Electrophysiologic effects of agmatine on pacemaker cells in sinoatrial node of rabbits // Zhongguo Yao Li Xue Bao. 1999. V. 20. P. 897–901.
Li X.T., He R.R. Effects of agmatine on afterdepolarizations induced by isoproterenol in guinea pig papillary muscles // Acta Pharmacol Sin. 1999. V. 20. P. 1039–1042.
Li X.T., He R.R., Liu S. et al. Electrophysiological effects of agmatine on human atrial fibers // Life Sci. 2000. V. 66. P. 2351–2356.
Li Y.F., Gong Z.H., Cao J.B. et al. Antidepressant-like effects of agmatine and its possible mechanism // Eur. J. Pharmacol. 2003. V. 469. P. 81–88.
Liu P., Collie N.D., Chary S. et al. Spatial learning results in elevated agmatine levels in the rat brain // Hippocampus. 2008. V. 18. № 11. P. 1094–1098.
Loring R.H. Agmatine acts as an antagonist of neuronal nicotinic receptors // Br. J. Pharmacol. 1990. V. 99. № 1. P. 207–211.
Lortie M.J., Ishizuka S., Schwartz D. et al. Bioactive products of arginine in sepsis: tissue and plasma composition following LPS and iNOS blockade // Am. J. Physiol. Cell. 2000. V. 278. № 5149. P. 1191–1199.
Lortie M.J., Novotny W.F., Peterson O.W et al. Agmatine, a bioactive metabolite of arginine. Production, degradation, and functional effects in the kidney of the rat // J. Clin. Invest. 1996. V. 97. № 2. P. 413–420.
Luszczki J.J., Czernecki R., Wojtal K. et al. Agmatine enhances the anticonvulsant action of phenobarbital and valproate in the mouse maximal electroshock seizure model // J. Neural. Transm. 2008. V. 115. P. 1485–1494.
Malmberg R.L., Cellino M.L. Arginine decarboxylase of oats is activated by enzymatic cleavage into two polypeptides // J. Biol. Chem. 1994. V. 269. № 4. P. 2703–2706.
Maltsev A.V. Agmatine modulates calcium handling in cardiomyocytes of hibernating ground squirrels through calcium-sensing receptor signaling // Cell Signal. 2018. V. 51. P. 1–12.
Maltsev A.V., Kokoz Y.M., Evdokimovskii E.V. et al. Alpha-2 adrenoceptors and imidazoline receptors in cardiomyocytes mediate counterbalancing effect of agmatine on NO synthesis and intracellular calcium handling // Mol. Cell. Cardiol. 2014. V. 68. P. 66–74.
Maltsev A.V., Nenov M.N., Pimenov O.Y. et al. Modulation of L-type Ca2+ currents and intracellular calcium by agmatine in rat cardiomyocytes // Biochem. (Moscow) Suppl. Series A: Membr. Cell. Biol. 2013. V. 7. P. 100–112.
Margarit S.M., Davidson W., Frego L. et al. A steric antagonism of actin polymerization by a salmonella virulence protein // Structure. 2006. V. 14. P. 1219–1229.
Marx M., Trittenwein G., Aufricht C. et al. Agmatine and spermidine reduce collagen accumulation in kidneys of diabetic db/db mice // Nephron. 1995. V. 69. № 2. P. 155–158.
Matheus F.C., Aguiar A.S., Castro A.A. et al. Neuroprotective effects of agmatine in mice infused with a single intranasal administration of 1-methyl-4phenyl-1,2,3,6-tetrahydropyridine (MPTP) // Behav Brain Res. 2012. V. 235. P. 263–272.
McKay B.E., Lado W.E., Martin L.J. et al. Learning and memory in agmatine-treated rats // Pharmacol Biochem Behav. 2002. V. 72. № 3. P. 551–557.
Meldrum B.S., Akbar M.T., Chapman A.G. Glutamate receptors and transporters in genetic and acquired models of epilepsy // Epilepsy Res. 1999. V. 36. P. 189–204.
Melnykowycz J., Johansson K.R. Formation of amines by intestinal microorganisms and the influence of chlortetracycline // J. Exp. Med. 1955. V. 101. № 5. P. 507–517.
Michel M.C., Rump L.C. Alpha-adrenergic regulation of human renal function // Fundam Clin Pharmacol. 1996. V. 10. P. 493–503.
Millan M.J. The induction of pain: an integrative review // Prog. Neurobiol. 1999. V. 57. P. 1–164.
Mistry S.K., Burwell T.J., Chambers R.M. et al. Cloning of human agmatinase. An alternate path for polyamine synthesis induced in liver by hepatitis B virus // Am. J. Physiol. Gastrointest. Liver Physiol. 2002. V. 282. P. 375–381.
Molderings G.J., Bonisch H., Gothert M. et al. Agmatine and putrescine uptake in the human glioma cell line SK-MG-1 // Naunyn Schmiedebergs Arch. Pharmacol. 2001. V. 363. P. 671–679.
Molderings G.J., Burian M., Homann J. et al. Potential relevance of agmatine as a virulence factor of Helicobacter pylori // Dig. Dis. Sci. 1999. V. 44. № 12. P. 2397–2404.
Molderings G.J., Donecker K., Burian M. et al. Characterization of I2 imidazoline and sigma binding sites in the rat and human stomach // J. Pharmacol. Exp. Ther. 1998. V. 285. № 1. P. 170–177.
Molderings G.J., Göthert M. Inhibitory presynaptic imidazoline receptors on sympathetic nerves in the rabbit aorta differ from I1- and I2-imidazoline binding sites // Naunyn Schmiedebergs Arch Pharmacol. 1995. V. 351. № 5. P. 507–516.
Molderings G.J., Haenisch B. Agmatine (decarboxylated L-arginine): physiological role and therapeutic potential // Pharmacol. Ther. 2012. V. 133. № 3. P. 351–365.
Molderings G.J., Kribben B., Heinen A. et al. Intestinal tumor and agmatine (decarboxylated arginine): low content in colon carcinoma tissue specimens and inhibitory effect on tumor cell proliferation in vitro // Cancer. 2004. V. 101. № 4. P. 858–868.
Molderings G.J., Likungu J., Jakschik J. et al. Presynaptic imidazoline receptors and non-adrenoceptor [3H]-idazoxan binding sites in human cardiovascular tissues // Br. J. Pharmacol. 1997. V. 122. № 1. P. 43–50.
Molderings G.J., Menzel S., Göthert M. Imidazoline derivatives and agmatine induce histamine release from the rat stomach // Naunyn Schmiedebergs Arch. Pharmacol. 1999. V. 360. № 6. P. 711–714.
Molderings G.J., Menzel S., Kathmann M. et al. Dual interaction of agmatine with the rat alpha(2D)-adrenoceptor: competitive antagonism and allosteric activation // Br. J. Pharmacol. 2000. V. 130. P. 1706–1712.
Molderings G.J., Schmidt K., Bönisch H. et al. Inhibition of 5-HT3 receptor function by imidazolines in mouse neuroblastoma cells: potential involvement of sigma 2 binding sites // Naunyn Schmiedebergs Arch. Pharmacol. 1996. V. 354. № 3. P. 245–252.
Moosavi M., Khales G.Y., Abbasi L. et al. Agmatine protects against scopolamine-induced water maze performance impairment and hippocampal ERK and Akt inactivation // Neuropharmacology. 2012. V. 62. № 5–6. P. 2018–2023.
Moosavi M., Zarifkar A., Farbood Y. et al. Agmatine protects against intracerebroventricular streptozotocin-induced water maze memory deficit, hippocampal apoptosis and Akt/GSK3β signaling disruption // Eur J Pharmacol. 2014. V. 736. P. 107–114.
Morris S.M. Jr. Vertebrate agmatinases: what role do they play in agmatine catabolism? // Ann. N. Y. Acad. Sci. 2003. V. 1009. P. 30–33.
Morris S.M. Jr. Recent advances in arginine metabolism // Curr. Opin. Clin. Nutr. Metab. Care. 2004. V. 7. № 1. P. 45–51.
Mun C.H., Lee W.T., Park K.A. et al. Regulation of endothelial nitric oxide synthase by agmatine after transient global cerebral ischemia in rat brain // Anat. Cell. Biol. 2010. V. 43. № 3. P. 230–240.
Nader M.A., Gamiel N.M., El-Kashef H. et al. Effect of agmatine on experimental vascular endothelial dysfunction // Hum. Exp. Toxicol. 2016. V. 35. № 5. P. 573–582.
Nissim I., Daikhin Y., Nissim I. et al. Agmatine stimulates hepatic fatty acid oxidation: a possible mechanism for up-regulation of ureagenesis // J. Biol. Chem. 2006. V. 281. № 13. P. 8486–8496.
Nissim I., Horyn O., Daikhin Y. et al. Regulation of urea synthesis by agmatine in the perfused liver: studies with 15N // Am. J. Physiol. Endocrinol. Metab. 2002. V. 283. № 6. P. 1123–1134.
Noorbakhshnia M., Rashidkaboli A., Pakatchian M. et al. Agmatine attenuates methamphetamine-induced passive avoidance learning and memory and CaMKII-α gene expression deteriorations in hippocampus of rat // Physiol Behav. 2018. V. 194. P. 491–496.
Olivier B., van Wijngaarden I., Soudijn W. 2000. 5-HT3 receptor antagonists and anxiety; a preclinical and clinical review // Eur. Neuropsychopharmacol. V. 10. P. 77–95.
Olmos G., DeGregorio-Rocasolano N., Paz Regalado M. et al. Protection by imidazol(ine) drugs and agmatine of glutamate-induced neurotoxicity in cultured cerebellar granule cells through blockade of NMDA receptor // Br. J. Pharmacol. 1999. V. 127. № 6. P. 1317–1326.
Onal A., Soykan N. Agmatine produces antinociception in tonic pain in mice // Pharmacol. Biochem. Behav. 2001. V. 69. P. 93–97.
Otake K., Ruggiero D.A., Regunathan S. et al. Regional localization of agmatine in the rat brain: an immunocytochemical study // Brain Res. 1998. V. 787. P. 1–14.
Owens M.J., Nemeroff C.B. Role of serotonin in the pathophysiology of depression: focus on the serotonin transporter // Clin. Chem. 1994. V. 40. P. 288–295.
Palsson E., Fejgin K., Wass C. et al. Agmatine attenuates the disruptive effects of phencyclidine on prepulse inhibition // Eur. J. Pharmacol. 2008. V. 590. P. 212–216.
Panagiotidis C.A., Blackburn S., Low K.B. et al. Biosynthesis of polyamines in ornithine decarboxylase, arginine decarboxylase, and agmatine ureohydrolase deletion mutants of Escherichia coli strain K-12 // Proc. Natl. Acad. Sci. USA. 1987. V. 84. P. 4423–4427.
Pegg A.E., McCann P.P. Polyamine metabolism and function // Am. J. Physiol. 1982. V. 243. № 5. P. 212–221.
Penner S.B., Smyth D.D. Natriuresis following central and peripheral administration of agmatine in the rat // Pharmacology. 1996. V. 53. P. 160–169.
Petroff O.A. GABA and glutamate in the human brain // Neuroscientist. 2002. V. 8. № 6. P. 562–573.
Piletz J.E., Chikkala D.N., Ernsberger P. Comparison of the properties of agmatine and endogenous clonidine-displacing substance at imidazoline and alpha-2 adrenergic receptors // J. Pharmacol. Exp. Ther. 1995. V. 272. № 2. P. 581–587.
Piletz J., May P.J., Wang J. et al. Agmatine crosses the blood-brain barrier // Ann NY Acad Sci. 2003. V. 1009. P. 64–74.
Pinthong D., Hussain J.F., Kendall D.A. et al. Comparison of the interaction of agmatine and crude methanolic extracts of bovine lung and brain with alpha2-adrenoceptor binding sites // Br. J. Pharmacol. 1995a. V. 115. P. 689–695.
Pinthong D., Wright I.K., Hanmer C. et al. Agmatine recognizes alpha 2-adrenoceptor binding sites but neither activates nor inhibits alpha 2-adrenoceptors // Naunyn Schmiedebergs Arch Pharmacol. 1995b. V. 351. P. 10–16.
Qiu W.W., Zheng R.Y. Neuroprotective effects of receptor imidazoline 2 and its endogenous ligand agmatine // Neurosci Bull. 2006. V. 22. № 3. P. 187–191.
Quik M. Inhibition of nicotinic receptor mediated ion fluxes in rat sympathetic ganglia by BGT II-S1 a potent phospholipase // Brain Res. 1985. V. 325. № 1–2. P. 79–88.
Raasch W., Chun K.R., Dendorfer A. et al. Positive inotropic effects of imidazoline derivatives are not mediated via imidazoline binding sites but alpha1-adrenergic receptors // Jpn J Pharmacol. 2000. V. 84. P. 1–6.
Raasch W., Regunathan S., Li G. et al. Agmatine, the bacterial amine, is widely distributed in mammalian tissues // Life Sciences. 1995. V. 56. № 26. P. 2319–2330.
Raasch W., Schafer U., Chun J. et al. Biological significance of agmatine, an endogenous ligand at imidazoline binding sites // Br. J. Pharmacol. 2001. V. 133. P. 755–780.
Raddatz R., Parini A., Lanier S.M. Imidazoline/guanidinium binding domains on monoamine oxidases. Relationship to subtypes of imidazoline-binding proteins and tissue-specific interaction of imidazoline ligands with monoamine oxidase B // J. Biol. Chem. 1995. V. 270. № 46. P. 27961–27968.
Ramakrishna S., Adiga P.R. Arginine decarboxylase from Lathyrus sativus seedlings. Purification and properites // Eur. J. Biochem. 1975. V. 59. № 2. P. 377–386.
Ramchand C.N., Das I., Gliddon A. et al. Role of polyamines in the membrane pathology of schizophrenia. A study using fibroblasts from schizophrenic patients and normal controls // Schizophr. Res. 1994. V. 13. P. 249–254.
Reczkowski R.S., Ash D.E. Rat liver arginase: kinetic mechanism, alternate substrates, and inhibitors // Arch. Biochem. Biophys. 1994. V. 312. № 1. P. 31–37.
Regunathan S., Feinstein D.L., Raasch W. et al. Agmatine (decarboxylated arginine) is synthesized and stored in astrocytes // Neuroreport. 1995. V. 6. № 14. P. 1897–1900.
Regunathan S., Reis D.J. Stimulation of imidazoline receptors inhibits proliferation of human coronary artery vascular smooth muscle cells // Hypertension. 1997. V. 30. P. 295–300.
Regunathan S., Reis D.J. Characterization of arginine decarboxylase in rat brain and liver: distinction from ornithine decarboxylase // J. Neurochem. 2000. V. 74. № 5. P. 2201–2208.
Regunathan S., Youngson C., Raasch W. et al. Imidazoline receptors and agmatine in blood vessels: a novel system inhibiting vascular smooth muscle proliferation // J. Pharmacol. Exp. Ther. 1996. V. 276. № 3. P. 1272–1282.
Reis D.J., Regunathan S. Agmatine: a novel neurotransmitter? // Adv. Pharmacol. 1998. V. 42. P. 645–649.
Reis D.J., Regunathan S. Is agmatine a novel neurotransmitter in brain? // Trends Pharmacol Sci. 2000. V. 21. № 5. P. 187–193.
Reis D.J., Yang X.C., Milner T.A. Agmatine containing axon terminals in rat hippocampus form synapses on pyramidal cells // Neurosci. Lett. 1998. V. 250. № 3. 185–188.
Ruiz-Durántez E., Ruiz-Ortega J.A., Pineda J. et al. Effect of agmatine on locus coeruleus neuron activity: possible involvement of nitric oxide // Br. J. Pharmacol. 2002. V. 135. P. 1152–1158.
Rushaidhi M., Collie N.D., Zhang H. et al. Agmatine selectively improves behavioural function in aged male Sprague-Dawley rats // Neuroscience. 2012. V. 218. P. 206–15.
Salvi M., Battaglia V., Mancon M. et al. Agmatine is transported into liver mitochondria by a specific electrophoretic mechanism // Biochem. J. 2006. V. 396. P. 337–345.
Santhanam A.V., Viswanathan S., Dikshit M. Activation of protein kinase B/Akt and endothelial nitric oxide synthase mediates agmatine-induced endothelium-dependent relaxation // Eur. J. Pharmacol. 2007. V. 572. № 2–3. P. 189–196.
Sastre M., Regunathan S., Reis D.J. Uptake of agmatine into rat brain synaptosomes: possible role of cation channels // J. Neurochem. 1997. V. 69. P. 2421–2426.
Satriano J., Isome M., Casero R.A. Jr. et al. Polyamine transport system mediates agmatine transport in mammalian cells // Am. J. Physiol. Cell. Physiol. 2001. V. 281. P. 329–334.
Satriano J., Matsufuji S., Murakami Y. et al. Agmatine suppresses proliferation by frameshift induction of antizyme and attenuation of cellular polyamine levels // J. Biol. Chem. 1998. V. 273. № 25. P. 15313–15316.
Satriano J., Schwartz D., Ishizuka S. et al. Suppression of inducible nitric oxide generation by agmatine aldehyde: beneficial effects in sepsis // J. Cell. Physiol. 2001. V. 188. P. 313–20.
Schaefer U., Raasch W., Qadri F. et al. Effects of agmatine on the cardiovascular system of spontaneously hypertensive rats // Ann NY Acad Sci. 1999. V. 881. P. 97–101.
Schwartz D., Peterson O.W., Mendonca M. et al. Agmatine affects glomerular filtration via a nitric oxide synthase-dependent mechanism // Am. J. Physiol. 1997. V. 272. № 5. P. 597–601.
Scott R.H., Sutton K.G., Dolphin A.C. Interactions of polyamines with neuronal ion channels // Trends Neurosci. 1993. V. 16. № 4. P. 153–160.
Sener A., Lebrun P., Blachier F. et al. Stimulus-secretion coupling of arginine-induced insulin release. Insulinotropic action of agmatine // Biochem. Pharmacol. 1989. V. 38. № 2. 327–330.
Sengul G., Takci E., Malcok U.A. et al. A preliminary histopathological study of the effect of agmatine on diffuse brain injury in rats // J. Clin. Neurosci. 2008. V. 15. № 10. P. 1125–29.
Shelkar G.P., Gakare S.G., Chakraborty S. et al. Interactions of nitric oxide with α2-adrenoceptors within the locus coeruleus underlie the facilitation of inhibitory avoidance memory by agmatine // Br J Pharmacol. 2016. V. 173. № 17. P. 2589–2599.
Shepherd R.M., Hashmi M.N., Kane C. et al. Elevation of cytosolic calcium by imidazolines in mouse islets of Langerhans: implications for stimulus-response coupling of insulin release // Br. J. Pharmacol. 1996. V. 119. № 5. P. 911–916.
Shoval G., Weizman A. The possible role of neurotrophins in the pathogenesis and therapy of schizophrenia // Eur. Neuropharmacol. 2005. V. 15. P. 319–329.
Siefert S.A., Sarkar R. Matrix metalloproteinases in vascular physiology and disease // Vascular. 2012. V. 20. № 4. P. 210–216.
Skolnick P. Antidepressant for the new millennium // Eur. J. Pharmacol. 1999. V. 375. P. 31–40.
Smyth D.D., Penner S.B. Renal I1-imidazoline receptor selective compounds mediate natriuresis in the rat // J. Cardiovasc. Pharmacol. 1995. V. 26. № S2. P. 63–67.
Smyth D.D., Penner S.B. Peripheral and central imidazoline receptor-mediated natriuresis in the rat // Ann. NY. Acad. Sci. 1999. V. 881. P. 344–357.
Stefan M., Travis M., Murray R.M. An Atlas of Schizophrenia / The Parthenon Publishing Group, London. 2002. P. 1–56.
Su R.B., Wei X.L., Zheng J.Q. et al. Anticonvulsive effect of agmatine in mice // Pharmacol. Biochem. Behav. 2004. V. 77. P. 345–349.
Sun M.K., Regunathan S., Reis D.J. Cardiovascular responses to agmatine, a clonidine-displacing substance, in anesthetized rat // J. Clin. Exp. Hypertens. 1995. V. 17. P. 115–128.
Szabo B., Urban R., Limberger N. et al. Cardiovascular effects of agmatine, a “clonidine-displacing substance”, in conscious rabbits // Naunyn Schmiedebergs Arch. Pharmacol. 1995. V. 351. № 3. P. 268–273.
Szabó C. Physiological and pathophysiological roles of nitric oxide in the central nervous system // Brain Res. Bull. 1996. V. 41. P. 131–141.
Tabor C.W., Tabor H. Polyamines // Annu. Rev. Biochem. 1984. V. 53. P. 749–790.
Taksande B.G., Chopde C.T., Umekar M.J. et al. Agmatine attenuates lipopolysaccharide induced anorexia and sickness behavior in rats // Pharmacol Biochem Behav. 2015. V. 132. P. 108–114.
Taksande B.G., Chopde C.T., Umekar M.J. et al. Agmatine attenuates hyperactivity and weight loss associated with activity-based anorexia in female rats // Pharmacol Biochem Behav. 2015. V. 132. P. 136–141.
Taksande B.G., Kotagale N.R., Tripathi S.J. et al. Antidepressant-like effect of selective serotonin reuptake inhibitors involve modulation of imidazoline receptors by agmatine // Neuropharmacol. 2009. V. 57. P. 415–424.
Török J., Zemančíková A. Agmatine modulation of noradrenergic neurotransmission in isolated rat blood vessels // Chin. J. Physiol. 2016. V. 59. № 3. P. 131–138.
Tsuchiya M., Shimoyama M. Target protein for eucaryotic arginine-specific ADP-ribosyltransferase // Mol. Cell. Biochem. 1994. V. 138. № 1–2. P. 113–118.
Tsuji M., Higuchi Y., Shiraishi K. et al. Protective effect of aminoguanidine on hypoxic–ischemic brain damage and temporal profile of brain nitric oxide in neonatal rat // Pediatr. Res. 2000. V. 47. P. 79–83.
Uzbay I.T., Kayir H., Goktalay G. et al. Agmatine disrupts prepulse inhibition of acoustic startle reflex in rats // J. Psychopharmacol. 2010. V. 24. P. 923–929.
Vargiu C., Cabella C., Belliardo S. et al. Agmatine modulates polyamine content in hepatocytes by inducing spermidine/spermine acetyltransferase // Eur. J. Biochem. 1999. V. 259. P. 933–938.
Vargová V., Pytliak M., Mechírová V. Matrix metalloproteinases // EXS. 2012. V. 103. P. 1–33.
Wade C.L., Eskridge L.L., Nguyen H.O. et al. Immunoneutralization of agmatine sensitizes mice to micro-opioid receptor tolerance // J. Pharmacol. Exper. Ther. 2009. V. 331. P. 539–546.
Wang C.C., Chio C.C., Chang C.H. et al. Beneficial effect of agmatine on brain apoptosis, astrogliosis, and edema after rat transient cerebral ischemia // BMC Pharmacol. 2010. V. 10. e11. https://doi.org/10.1186/1471-2210-10-11
Wang W.P., Iyo A.H., Miguel-Hidalgo J. et al. Agmatine protects against cell damage induced by NMDA and glutamate in cultured hippocampal neurons // Brain Res. 2006. V. 1084. P. 210–216.
Wang Y., Wu J., Wu Z. et al. Regulation of AMPA receptors in spinal nociception // Mol. Pain. 2010. V. 6. e5. https://doi.org/10.1186/1744-8069-6-5
Wei X.L., Su R.B., Lu X.Q. et al. Inhibition by agmatine on morphine-induced conditioned place preference in rats // Eur. J. Pharmacol. 2005. V. 515. № 1–3. P. 99–106.
Wei X.L., Su R.B., Wu N. et al. Agmatine inhibits morphine-induced locomotion sensitization and morphine-induced changes in striatal dopamine and metabolites in rats // Eur. Neuropsychopharmacol. 2007. V. 17. № 12. P. 790–799.
Weitzel G., Pfeiffer B., Stock W. Insulin-like partial effects of agmatine derivatives in adipocytes // Hoppe Seylers Z. Physiol. Chem. 1980. V. 361. № 1. P. 51–60.
Weitzel G., Renner R., Guglielmi H. Metabolic effects of arginine derivatives. I. Insulin like activity of arginyl compounds in vitro // Hoppe Seylers Z. Physiol. Chem. 1971. V. 352. № 12. P. 1617–1630.
Willemsen S., Hartog J.W., Heiner-Fokkema M.R. et al. Advanced glycation end-products, a pathophysiological pathway in the cardiorenal syndrome // Heart Fail. Rev. 2012. V. 17. № 2. P. 221–228.
Winter T.N., Elmquist W.F., Fairbanks C.A. OCT2 and MATE1 provide bidirectional agmatine transport // Mol. Pharm. 2011. V. 8. P. 133–142.
Wolf C., Bruss M., Hanisch B. et al. Molecular basis for the antiproliferative effect of agmatine in tumor cells of colonic, hepatic, and neuronal origin // Mol. Pharmacol. 2007. V. 71. P. 276–283.
Wozniak K.M., Rojas C., Wu Y. et al. The role of glutamate signaling in pain processes and its regulation by GCP II inhibition // Curr Med Chem. 2012. V. 19. № 9. P. 1323-1334.
Wu N., Su R.B., Li J. Agmatine and imidazoline receptors: their role in opioid analgesia, tolerance and dependence // Cell. Mol. Neurobiol. 2008. V. 28. P. 629–641.
Wu W.H., Morris D.R. Biosynthetic arginine decarboxylase from Escherichia coli: purification and properties // J. Biol. Chem. 1973. V. 248. 1687–1695.
Yamamoto S., Nakao H., Yamasaki K. et al. Activities and properties of putrescine-biosynthetic enzymes in Vibrio parahaemolyticus // Microbiol Immunol. 1988. V. 32. № 7. P. 675–687.
Yang M.Z., Mun C.H., Choi Y.J. et al. Agmatine inhibits matrix metalloproteinase-9 via endothelial nitric oxide synthase in cerebral endothelial cells // Neurol. Res. 2007. V. 29. № 7. P. 749–754.
Yang X.C., Reis D.J. Agmatine selectively blocks the N-methyl-D-aspartate subclass of glutamate receptor channels in rat hippocampal neurons // J. Pharmacol. Exp. Ther. 1999. V. 288. № 2. P. 544–549.
Zauner A., Bullock R. The role of excitatory amino acids in severe brain trauma: opportunities for therapy: a review // J. Neurotrauma. 1995. V. 12. № 4. P. 547–554.
Zhao Q., Wang S., Li Y. et al. The role of the mitochondrial calcium uniporter in cerebral ischemia/reperfusion injury in rats involves regulation of mitochondrial energy metabolism // Mol. Med. Rep. 2013. V. 7. № 4. P. 1073–1080.
Zheng J.Q., Weng X.C., Gai X.D. et al. Mechanism underlying blockade of voltage-gated calcium channels by agmatine in cultured rat hippocampal neurons // Acta Pharmacol. Sin. 2004. V. 25. № 3. P. 281–285.
Zhu M.Y., Iyo A., Piletz J.E. et al. Expression of human arginine decarboxylase, the biosynthetic enzyme for agmatine // Biochim. Biophys. Acta. 1995. V. 1670. № 2. P. 156–64.
Zhu M.Y., Piletz J.E., Halaris A. et al. Effect of agmatine against cell death induced by NMDA and glutamate in neurons and PC12 cells // Cell. Mol. Neurobiol. 2003. V. 23. P. 865–872.
Zhu M.Y., Wang W.P., Bissette G. Neuroprotective effects of agmatine against cell damage caused by glucocorticoids in cultured rat hippocampal neurons // Neurosci. 2006. V. 141. P. 2019–2027.
Zomkowski A.D., Hammes L., Lin J. et al. Agmatine produces antidepressant-like effects in two models of depression in mice // Neuroreport. 2002. V. 13. № 4. P. 387–391.
Zomkowski A.D., Rosa A.O., Lin J. et al. Evidence for serotonin receptor subtypes involvement in agmatine antidepressant like-effect in the mouse forced swimming test // Brain Res. 2004. V. 1023. P. 253–263.
Zomkowski A.D., Santos A.D., Rodrigues A.L. Evidence for the involvement of the opioid system in the agmatine antidepressant-like effect in the forced swimming test // Neurosci. Lett. 2005. V. 381. P. 279–283.
Zomkowski A.D., Santos A.D., Rodrigues A.L. Putrescine produces antidepressant-like effects in the forced swimming test and in the tail suspension test in mice // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2006. V. 30. P. 1419–1425.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук