Успехи физиологических наук, 2020, T. 51, № 4, стр. 51-63
COVID-19: влияние на иммунитет, систему гемостаза и возможные пути коррекции
Б. И. Кузник a, b, В. Х. Хавинсон c, d, Н. С. Линькова c, e, f, *
a Читинская государственная медицинская академия МЗ РФ
672090 Чита, Россия
b Инновационная клиника “Академия здоровья”
672038 Чита, Россия
c Санкт-Петербургский институт биорегуляции и геронтологии
191180 Санкт-Петербург, Россия
d Институт физиологии им. И.П. Павлова РАН
630099 Санкт-Петербург, Россия
e Федеральный научно-клинический центр специализированных видов медицинской помощи
и медицинских технологий ФМБА
119435 Москва, Россия
f Белгородский национальный исследовательский государственный университет
308007 Белгород, Россия
* E-mail: linkova8101984@gmail.com
Поступила в редакцию 21.02.2020
После доработки 18.03.2020
Принята к публикации 20.06.2020
Аннотация
В обзоре представлены молекулярные аспекты патогенеза и перспективы терапии коронавирусной инфекции COVID-19. При тяжелой форме COVID-19 возникает гиперактивация иммунной системы, “цитокиновый шторм”, нарушение функций системы гемостаза. При COVID-19 наблюдается активация системы комплемента по классическому и лектиновому путям, лейкопения, лимфоцитопения, нейтрофилез, нарушение соотношения субпопуляций Т-лимфоцитов. У пациентов возникает гиперкоагуляция, сопровождаемая повышением экспрессии тканевого фактора и фактора фон Виллебранда на эндотелии кровеносных сосудов, усиленной агрегацией тромбоцитов, увеличением D-димера и продуктов деградации фибриногена/фибрина. При этом развивается микроангиопатия, иммунотромбоз, диссеминированное внутрисосудистое свертывание крови. Это приводит к выраженной воспалительной реакции и развитию тромбоза, что сопровождается деструкцией ткани легких и полиорганной недостаточностью, часто приводящей к летальному исходу. У 40% пациентов с тяжелой формой COVID-19 наблюдаются нарушения функций центральной нервной системы. Перспективными препаратами для коррекции дисфункции иммунной системы и системы гемостаза являются иммуномодулирующие пептиды (тимопентин, тималин, тимоген), антикоагулянты и антиагреганты. Для нормализации функций нервной системы при COVID-19 может быть рекомендован лекарственный комплексный пептидный нейропротекторный препарат кортексин, выделенный из мозга телят.
Актуальность. В конце 2019 г. в г. Ухань (Китай) было зарегистрировано несколько случаев заболевания людей новой коронавирусной инфекцией. В январе 2020 г. возбудитель этой инфекции был идентифицирован Всемирной организацией здравоохранения (ВОЗ) как SARS-CoV-2, а вызываемое им заболевание названо CоronaVirus Disease 2019 (COVID-19). С начала ХХI в. в разных странах мира периодически появляются новые штаммы коронавирусов. В 2002 г. у 8422 человек выявлен тяжелый острый респираторный синдром, вызванный коронавирусом SARS-CoV. Коронавирус MERS-CoV, также приводящий к возникновению респираторного синдрома, был впервые выявлен в 2012 г. MERS-CoV был обнаружен у 1401 больных из которых 543 умерли [44]. В марте 2020 г. ВОЗ объявила COVID-19 пандемией. COVID-19 протекает менее тяжело и реже заканчивается летальным исходом, чем заболевания, вызванные вирусами SARS-CoV и MERS-CoV. SARS-CoV-2 более заразен и чаще инфицирует пожилых людей, преимущественно мужчин, по сравнению с другими вирусами этого семейства [88].
К настоящему времени эпидемия COVID-19 охватила все Европейские, Азиатские и Африканские страны, Австралию, Северную и Южную Америку. В июне 2020 г. в мире зарегистрировано более 8 млн человек, заразившихся COVID-19, из которых более 400 000 скончались. Большое число заразившихся COVID-19 и предыдущие эпидемии показывают, что коронавирусы создают угрозу возникновения критических ситуаций в экономике и социуме. В связи с этим изучение патогенеза острого респираторного синдрома, вызванного SARS-CoV-2, и поиск эффективных методов терапии этого заболевания являются актуальной задачей молекулярной биологии и медицины.
СТРОЕНИЕ КОРОНАВИРУСОВ И ИХ ПРОНИКНОВЕНИЕ В КЛЕТКИ ЛЕГКИХ
Коронавирусы состоят из нуклеокапсида и РНК. Геном коронавирусов содержит от 26 000 до 32 000 азотистых оснований РНК [87]. Белки нуклеокапсида расположены в фосфолипидном бислое мембраны вируса. К ним прикреплены шиповидные белки. У всех коронавирусов присутствует триммерный шиповидный белок. У некоторых вирусов дополнительно имеется шиповидный белок гемагглютининэстераза [49].
Коронавирусы разделяют на 4 рода: α, β, γ, δ. Существует около 30 типов коронавирусов, которые инфицируют людей, млекопитающих и птиц. Для человека патогенными являются α- и β-коронавирусы [49]. SARS-CoV-2 относится к семейству β-коронавирусов. Этот вирус генетически сходен с коронавирусом SARS-CoV-1 и имеет одноцепочечную РНК. В состав SARS-CoV-2 входит структурный белок спайк (spike), состоящий из трех гетеродимеров S1–S2 [83]. Вирусный спайк SARS-CoV задействует ангиотензинпревращающий фермент 2 (ACE2) в качестве входного рецептора и использует клеточные сериновые протеазы TMPRSS2 и катепсин L для праймирования [35, 36, 51]. После связывания с ACE2 на мембране альвеолоцита SARS-CoV-2 проникает в клетку путем эндоцитоза, размножается и приводит к ее апоптозу. РНК SARS-CoV-2 действует как патоген-ассоциированный молекулярный паттерн и распознается toll-подобными рецепторами (TLR). Это является причиной высвобождения цитокинов, вызывающих миграцию и активацию нейтрофилов и моноцитов, что сопровождается разрушением альвеолярно-капиллярных стенок. Развивающийся в лeгких патологический процесс приводит к исчезновению границы раздела между альвеолярным пространством и окружающей стромой [48]. Кроме клеток легких белок ACE2 экспрессируется в холангиоцитах печени, ободочной кишке, кератиноцитах пищевода, эпителиальных клетках подвздошной, прямой кишки, желудка, проксимальных канальцев почек. Экспрессия ACE2 в перечисленных тканях, особенно в легких, находится на низком уровне. Для проникновения в клетку вирус SARS-CoV-2 может использовать и другие белки-мишени. Предполагается, что пептидазы ANPEP, DPP4, ENPEP являются рецепторами для коронавирусов [65]. Кроме того, SARS-CoV-2 может инфицировать иммунные клетки путем рецептор-зависимого слияния S-белка вируса с мембраной клетки-хозяина и привести к их апоптозу [78].
СОСТОЯНИЕ ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА ПРИ COVID-19
У пациентов с COVID-19 повышается концентрация белков острой фазы воспаления (C-реактивный белок, сывороточный амилоид А, ферритин) в крови и скорость оседания эритроцитов, что свидетельствует о быстрой активации врожденного иммунитета [93]. Макрофаги могут взаимодействовать с ACE2+ клетками, зараженными SARS-CoV-2, в легких, печени, желудке. Кроме того, макрофаги способны вступать в реакцию с клетками-мишенями коронавируса через сигнальный путь CD74-MIF [65]. При COVID-19 возникает дисбаланс врожденного и приобретенного иммунного ответа, что выражается в гиперактивации синтеза цитокинов макрофагами и нейтрофилами [52, 60]. У пациентов с COVID-19 с сопутствующими ожирением, диабетом 2 типа, поражениями лeгких, гипертензией и другими соматическими заболеваниями наблюдается активация системы комплемента и повышение синтеза провоспалительных цитокинов, в том числе IL-6. Это отягощает течение коронавирусной инфекции [79]. Активность системы комплемента у пациентов с заболеваем средней степени тяжести и тяжелой формой COVID-19 достоверно не различается [66].
Известно, что внутри клеток РНК содержащие вирусы идентифицируются врожденной системой иммунитета через паттерн-распознающие рецепторы. К ним относятся TLR, RIG-I-подобные рецепторы и NOD-подобные рецепторы. Среди TLR только TLR-7 и TLR-8 распознают одноцепочечную вирусную геномную РНК. Тем не менее, рецепторы TLR-3 и RIG-I/MDA5 могут обнаруживать генетический материал вирусов при внутриклеточной репликации РНК [67]. Затем активируются сигнальные эффекторы NF-ϰB и IRF3/7. NF-promoteB активирует синтез провоспалительных цитокинов TNF-α, IL-1β, IL-6, вызывая воспалительные реакции с участием Т-хелперов Th1, Th17, секретирующими IFNγ и IL-17. IRF3/7 способствует выработке IFN I типа, который активирует путь JAK1/TYK2–STAT1/2, STAT1 и STAT2, и образует комплекс с IRF9, который транслоцируется в ядро, где инициирует транскрипцию IFN-стимулируемых генов. IFN типа I является ранним механизмом подавления репликации вируса. IFN I типа способствует деградации вирусной РНК, репарации тканей и стимуляции адаптивного иммунитета [44]. Этот механизм свидетельствует о тесной взаимосвязи врожденного и приобретенного иммунитета.
Проведено исследование образцов ткани кожи и легких у 5 пациентов с тяжелой формой COVID-19 (дыхательная недостаточность и пурпурная сыпь на коже). Причиной пневмонии стало повреждение капилляров межальвеолярной перегородки, которое характеризовалось отложением фибрина и большим количеством нейтрофилов в микроциркуляторном русле. В легких обнаружено диффузное повреждение альвеол с наличием гиалиновых мембран, воспалением и гиперплазией альвеолоцитов II типа. В микроциркуляторном русле поврежденной и здоровой кожи пациентов верифицированы отложения мембраноатакующего комплекса С5b, белка C4d и лектиновой сериновой протеазы, связанной с маннозой. У больных с тяжелым течением COVID-19 наблюдается гиперактивация системы комплемента по альтернативному и лектиновому путям. У этих пациентов выявлено повышенное внутрисосудистое свертывание крови, о чем свидетельствует отложение фибрина в микроциркуляторном русле и высокая концентрация D-димера в крови. Таким образом, пациенты, инфицированные SARS-CoV-2 и находящиеся в критическом состоянии, страдают генерализованным тромботическим микрососудистым повреждением, опосредованным гиперактивацией комплемента [55]. Эти данные подтверждают наличие корреляции между активацией системы комплемента, свертыванием крови и фибринолизом [2, 5].
У больных COVID-19 можно блокировать образование С5-конвертазы экулизумабом, чтобы не допустить формирование мембраноатакующих комплексов и гиперактивацию системы комплемента. Применение экулизумаба у 4 пациентов с тяжелым течением COVID-19 привело к снижению концентрации С-реактивного белка в крови и быстрому выздоровлению. Следует отметить, что в терапию был включен антикоагулянт эноксапарин, что также могло способствовать улучшению состояния пациентов [31]. Для окончательного решения вопроса об эффективности экулизумаба у больных COVID-19 требуется проведение дополнительных исследований.
У пациентов с COVID-19 повышается синтез хемокинов CXCL 1, 2, 8, 10, CCL 2, 3, 7, 8, 20 иммунных клетками [42, 95]. Эти результаты согласуются с данными патологоанатомического исследования, свидетельствующего об инфильтрации легких моноцитами, макрофагами, нейтрофилами и, в меньшей степени, лимфоцитами [86]. Чем тяжелее протекает COVID-19, тем сильнее выражены нарушения в системе клеточного и гуморального иммунитета. Высвобождение хемокинов из инфицированных клеток приводит к локальному накоплению нейтрофилов. Необходимо отметить, что нейтрофилы участвуют в противовирусной реакции, но синтезируемые ими медиаторы воспаления активируют хемотаксис моноцитов и Т-лимфоцитов. У пациентов, скончавшихся от COVID-19, уровень нейтрофилов в легких и крови был выше, чем у выздоровевших. При COVID-19 наблюдается нарушение соотношения CD4+/СD8+ Т-клеток. CD4+ Т-лимфоциты стимулируют синтез вирус-специфических антител В-клетками. CD8+ Т-лимфоциты обеспечивают цитотоксическую функцию и ограничивают распространение вирусной инфекции в ткани. В связи с этим нарушение баланса Т-хелперов и цитотоксических Т-лимфоцитов приводит к прогрессирующему воспалению при COVID-19 [58]. Повреждение ткани, вызванное вирусом, может сопровождаться повышенным синтезом провоспалительных цитокинов, хемотаксисом макрофагов и гранулоцитов в очаг повреждения. Это приводит к “цитокиновому шторму” и сопровождается дальнейшим повреждением тканей и полиорганной недостаточностью. Предполагается, что применение кортикостероидов и ингибиторов JAK-киназы может давать положительный эффект при гипервоспалительном процессе у пациентов с COVID-19 [58]. В других исследованиях повышенный уровень цитокинов IL-6, IL-10, TNF-α, лимфоцитопения, снижение числа CD4+, CD8+ Т-лимфоцитов и экспрессии IFNγ также коррелировали с тяжелым течением COVID-19 [29, 57, 64, 85]. Для терапии этих патологических изменений предлагается применять плазму крови реконвалесцентов с высоким титром антител к SARS-CoV-2 [64].
У 286 пациентов с тяжелой формой COVID-19 наблюдалась лимфоцитопения, нейтрофилия, повышенное соотношение нейтрофилы/лимфоциты, снижение числа моноцитов, эозинофилов и базофилов в крови. Нейтрофилия оказалась фактором риска развития острого респираторного дистресс-синдрома (ОРДС) с прогрессированием до летального исхода [82]. Предполагается, что эозинофилия играет важную роль в патогенезе COVID-19 и ее коррекция может являться одной из стратегий лечения этого заболевания [69]. При COVID-19 отмечено снижение количества NK-клеток, в то время как содержание В-лимфоцитов в крови находились на нижней границе нормы. Лимфоцитопения выявлена при тяжелом течении COVID-19 у 83.2% пациентов. У этих больных было снижено количество CD4+ и, в меньшей степени, CD8+ Т-лимфоцитов, хотя соотношение CD4+/CD8+ клеток оставалось в норме. У пациентов с тяжелой формой коронавирусной инфекции снижалось число CD45RO+ эффекторных T-лимфоцитов памяти, CD25+CD127+ регуляторных T-лимфоцитов и повышался процент CD45RA+ “наивных” T-клеток [66]. Чем выше было соотношение “наивные” Т-лимфоциты/Т-клетки памяти, тем тяжелее протекало заболевание. Подавление активности регуляторных Т-лимфоцитов в тяжелых случаях заболевания свидетельствует о том, что не наступает своевременное торможение функции Th1. В результате этого гиперпродукция провоспалительных цитокинов может усугублять воспаление и повреждение тканей. Угнетение регуляторных Т-клеток, подавляющих активацию, пролиферацию и провоспалительную функцию Т-, В-лимфоцитов и NK-клеток, может способствовать развитию “цитокинового шторма”, полиорганной недостаточности и летальному исходу [32]. Неблагоприятным прогностическим признаком у пациентов с COVID-19 после окончания лечения является увеличение соотношения CD4+/CD8+ и снижение соотношения CD8+/B-лимфоциты [76]. У пациентов с тяжелым и легким течением COVID-19 количество B-лимфоцитов, IgA, IgG, IgM в крови не различалось. Это может свидетельствовать об отсутствии нарушений функции B-клеток при COVID-19 [66].
При тяжелой форме COVID-19 у 123 пациентов с лимфоцитопенией лимфоциты оставались активированными. Экспрессия HLA-DR в CD4+ и CD8+ клетках была повышена. При COVID-19 также повышалось число CD4+, CCR4+, CCR6+ Th17 в крови и цитотоксических ферментов (перфорин и гранэнзим) в CD8+ лимфоцитах [84].
При анализе 21 исследования, включающего 3377 пациентов с COVID-19, установлено, что у пациентов с тяжелой формой заболевания повышалось количество лейкоцитов, уменьшалось число лимфоцитов и тромбоцитов по сравнению с легкой формой течения коронавирусной инфекции. Тяжесть течения заболевания коррелировала с концентрацией IL-6, IL-10, D-димера и ферритина в крови [39].
В другом исследовании у пациентов с COVID-19 выявлено повышение концентрации прокальцитонина, С-реактивного белка, D-димера и ферритина в крови [81]. При тяжелой форме заболевания повышался уровень TNF, IL-2R, IL-6, IL-8, IL-10 в крови [66]. У 35 пациентов с COVID-19, находящихся в отделении интенсивной терапии, отмечена высокая концентрация IL-1β, IL-1RA, IL-2, IL-4, IL-6, IL-7, IL-8, IL-9, IL-10, IL-13, IL-17, FGF, G-CSF, GM-CSF, IFNγ, TNF, VEGF, IP-10, MCP-1, MIP-1α, PDGF, MIP-1β в крови, тогда как уровень RANTES, IL-5, IL-12, IL-15 не изменился [33, 91]. Это может быть связано с продукцией цитокинов и хемокинов эпителиальными клетками различных тканей, нейтрофилами, моноцитами, Т-лимфоцитами и свидетельствует о гиперреактивности иммунной системы.
Таким образом, цитокины служат центральным звеном в патогенезе COVID-19. Гиперцитокинемию следует рассматривать как адекватный иммунный ответ при коронавирусной инфекции легкой и средней степени тяжести. Термин “цитокиновый шторм” применим для характеристики сильно выраженной воспалительной реакции при тяжелой форме COVID-19, сопровождающейся полиорганной недостаточностью и, в ряде случаев, заканчивающейся летальным исходом.
РАЗВИТИЕ “ЦИТОКИНОВОГО ШТОРМА” ПРИ COVID-19
Репликация SARS-CoV-2 в эпителиальных клетках дыхательных путей может привести к развитию пироптоза с повреждением сосудов. Пироптоз является апоптозом клеток с последующим развитием воспалительного ответа. IL-1β, высвобождаясь при пироптозе из клеток, распознает вирусную РНК. В результате возникает локальное воспаление, инициирующее секрецию FCN1+ макрофагами провоспалительных цитокинов и хемокинов IL-6, IFNγ, MCP1, IP-10 [42]. Цитокины способствуют миграции CD14+ и CD16+ моноцитов из крови в ткань легкого. Данные субпопуляции моноцитов секретируют воспалительные цитокины MCP1, IP-10, MIP1α, привлекая в очаг воспаления другие иммунные клетки.
Инфильтрацией лимфоцитов в легкие и дыхательные пути можно объяснить лимфопению и увеличение соотношения нейтрофилов и лимфоцитов, наблюдаемое у 80% пациентов с коронавирусной инфекцией и являющееся неблагоприятным прогностическим признаком. Данный процесс может провоцировать деструкцию легких через усиленную секрецию протеаз и активных форм кислорода. Это приводит к диффузному повреждению альвеол, включая десквамацию альвеолярных клеток, образование гиалиновой мембраны и отек легких. Данный процесс ограничивает эффективность газообмена, вызывая затруднение дыхания и низкую оксигенацию гемоглобина. В результате легкое становится более уязвимым для вторичных инфекций [61, 66].
В патогенезе “цитокинового шторма” важную роль могут играть дендритные клетки. В норме дендритные клетки секретируют противовоспалительные цитокины и алармины, которые контролируют воспалительную реакцию при вирусных инфекциях. Нарушение функции дендритных клеток может способствовать развитию патологически сильного иммунного ответа. Еще одной причиной развития “цитокинового шторма” могут быть возрастные изменения микроокружения альвеолоцитов легких, нарушение дифференцировки дендритных клеток и их миграции в лимфоидные органы, что приводит к некорректной активации Т-лимфоцитов [75].
Показано, что макрофаги могут взаимодействовать с клетками легких, зараженными SARS-CoV-2. Этот процесс приводит к дифференцировке Т-клеток, повышению синтеза цитокинов и хемокинов IL-1, IL-6, IL-8, IL-21, TNF-β, MCP-1, которые активируют миграцию лимфоцитов и лейкоцитов в очаг инфекции [49, 61]. Активация Th2, сопровождаемая синтезом IL-4 и IL-10, индуцирует иммунный ответ В-лимфоцитов, продуцирующих иммуноглобулины. B-клеточный ответ у пациентов с COVID-19 возникает приблизительно через 1 неделю после появления первых симптомов заболевания. Продуцируемые В-лимфоцитами иммуноглобулины IgG, IgM, IgG являются антителами к белкам нуклеокапсида и спайка вируса. Эти антитела блокируют проникновение вируса в клетки легкого и снижают интенсивность воспалительной реакции. У пациентов с легкой формой COVID-19 отмечен высокий титр антител против белков спайка вируса. При тяжелой форме течения коронавирусной инфекции выявлено увеличение концентрации антител к капсиду вируса [34].
СОСТОЯНИЕ СИСТЕМЫ ГЕМОСТАЗА ПРИ COVID-19
При тяжелой форме COVID-19 наблюдается тромбоцитопения, повышенное содержание фибриногена и D-димера в крови и может развиваться полиорганная недостаточность, в основе которой лежит усиление свертывания крови.
При исследовании состояния системы гемостаза у 283 пациентов с тяжелой формой коронавирусной пневмонии выявлено повышение концентрации D-димера, продуктов деградации фибрина и фибриногена в крови, протромбинового времени (ПВ), активированного парциального тромбопластинового времени (АПТВ). Эти результаты коррелировали с развитием острого респираторного дистресс-синдрома, острого повреждения сердца, почек, шока и ДВС-синдрома (синдром диссеминированного внутрисосудистого свертывания крови) [74]. Применение низкомолекулярных гепаринов у 449 пациентов с тяжелой формой COVID-19, сопровождающейся повышением D-димера в крови и развитием ДВС-синдрома, способствовало снижению летальности [73, 92]. Одним из показаний для поступления пациентов в отделение интенсивной терапии при COVID-19 является дисфункция системы гемостаза, выражающаяся в повышении ПВ, АПТВ и уровня D-димера в крови [93].
Неблагоприятное течение коронавирусной инфекции наблюдается у пациентов с эссенциальной гипертонией, сахарным диабетом, ишемической болезнью сердца, цереброваскулярными заболеваниями, хронической обструктивной болезнью легких и дисфункцией почек. Это может быть связано с повышенной концентрацией плазмина в крови пациентов с указанными сопутствующими заболеваниями. Плазмин модифицирует спайковый белок SARS-CoV-2, что способствует быстрому проникновению вируса в клетки легкого [41]. “Цитокиновый шторм” при коронавирусной инфекции у пациентов старших возрастных групп, лиц с иммунопатологией и сердечно-сосудистыми заболеваниями является причиной воспаления в сосудистой системе, которое сопровождается усилением внутрисосудистого свертывания крови и может привести к диффузной тромботической микроангиопатии и тромбозу [52].
Тяжелые случаи COVID-19 часто характеризуются гипервоспалением, дисбалансом ренин-ангиотензин-альдостероновой системы и васкулопатией, тромботической микроангиопатией и внутрисосудистой коагулопатией. Вероятно, повышение концентрации D-димера в крови может отражать вызванное COVID-19 воспаление легких с локальной активацией тромбоцитов, повышенным свертыванием крови и гипофибринолизом. Повышение концентраций лактатдегидрогеназы и билирубина, снижение уровня гемоглобина в крови у пациентов с тяжелой формой COVID-19 свидетельствуют о развитии “цитокинового шторма” и тромботической микроангиопатии. При прогрессирующем гипервоспалении системная микроангиопатия может привести к синдрому полиорганной дисфункции, включающему кардиомиопатию, острую почечную и печеночную недостаточность, ишемию и инсульт [10, 13, 14, 39, 40].
Повышение концентрации провоспалительных цитокинов IL-1α, IL-6, TNF-α в крови способствует экспрессии на эндотелии, моноцитах и макрофагах тканевого фактора, являющегося триггером коагуляции. При этом из эндотелия высвобождается фактор фон Виллебранда, приводящий к адгезии и агрегации тромбоцитов на стенках сосудов. Экспрессия тканевого фактора способствует переходу фактора FVII в FVIIa, что приводит к активации фактора Х. Одновременно из активированных тромбоцитов высвобождается фактор FVa, образующий комплекс с белком FXa, который трансформирует протромбин в тромбин. Провоспалительные цитокины приводят к снижению в крови эндогенных антикоагулянтов – ингибитора внешнего пути тканевого фактора, антитромбина III и активированного протеина C [27, 40]. Взаимодействие эндотелиоцитов, тромбоцитов, моноцитов, макрофагов, лимфоцитов и лейкоцитов при “цитокиновом шторме” повышает экспрессию тканевого фактора и усиливает коагуляцию [40]. Эндотелиальная дисфункция, развивающаяся при тяжелой форме COVID-19, приводит к активации фактора Хагемана, прекалликреина, высокомолекулярного кининогена, что способствует повышению свертываемости крови [6, 9].
Важную роль в развитии гиперкоагуляции и депрессии фибринолиза при COVID-19 играет альдостерон-ангиотензин-рениновая система, активация которой приводит к увеличению концентрации ангиотензина II (AngII) в крови [53]. AngII активирует экспрессию тканевого фактора в эндотелии сосудов, что способствует гиперкоагуляции. Вазоконстрикция легочных сосудов, возникающая в результате действия AngII, способствует усилению гипоксии и экспрессии тканевого фактора в эндотелиоцитах легких, что приводит к развитию ОРДС. AngII индуцирует экспрессию тканевого фактора и PAI-1 эндотелиальными клетками через рецептор AT1, способствуя дисбалансу PAI-1/tPA и торможению фибринолиза [59]. Кроме того, повышение концентрации альдостерона, выявленное при тяжелой форме коронавирусной инфекции [40], стимулирует экспрессию PAI-1 в различных органах и тканях [54]. На ранней стадии COVID-19 наблюдается активация системы комплемента, что приводит к образованию молекул С3а и С5а, активирующих тромбоциты и экспрессию тканевого фактора на эндотелиоцитах и моноцитах. Продукты расщепления С3а и C5а участвуют в образовании мембраноатакующего комплекса, приводящего к лизису клеток, и ускоряют образование фибринового сгустка.
У пациентов с COVID-19 часто наблюдается нейтрофилия, что является неблагоприятным прогностическим признаком. При вирусных инфекциях нейтрофилы образуют экстрацеллюлярные ловушки (NET), которые способствуют развитию гиперкоагуляции и тромбообразованию, ускоряя свертывание крови [62]. Образующиеся активные прокоагулянты, в том числе тромбин (FIIa), активируют тромбоциты, которые также усиливают образование NET [17]. Кроме того, NET стимулируют моноциты и макрофаги, которые экспрессируют тканевой фактор и IL-1β, способствующие дальнейшему образованию NET [26]. При тяжелой форме COVID-19 содержание NET в крови и сосудистой сети легких повышено, что приводит к тромбозу и развитию ОРДС [96].
Механизмы формирования гиперкоагуляции и иммунотромбоза при COVID-19 можно представить в виде последовательности следующих процессов. Коронавирус связывается с белком АСЕ2 и/или другими молекулярными мишенями на клетках легких и сосудов. Размножение вируса в клетках приводит к развитию иммунной реакции. В случае нарушения функции иммунной системы или другой тяжелой сопутствующей патологии возникает гиперэкспрессия провоспалительных цитокинов и хемокинов, получившая название “цитокиновый шторм”. Это способствует возникновению воспалительного процесса в тканях легких, сосудов и других органах (локальное и системное воспаление). Воспалительная реакция становится причиной гиперкоагуляции и эндотелиальной дисфункции. Оба этих процесса характеризуются активацией макрофагов, лимфоцитов, лейкоцитов, тромбоцитов и преобладанием коагулирующих факторов над антикоагулянтами. Этот каскад событий приводит к развитию гипоксии, микро- и макроангиопатии, тромбозу, полиорганной недостаточности и летальному исходу [46].
ПЕПТИДНЫЕ ПРЕПАРАТЫ И АНТИКОАГУЛЯНТЫ: ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ В ТЕРАПИИ COVID-19
Терапию COVID-19 рекомендуется проводить в зависимости от состояния иммунной системы пациента. Противовирусные препараты и иммуностимуляторы возможно применять сразу после появления симптомов заболевания, тогда как иммунодепрессанты предпочтительно вводить в начале “цитокинового шторма” для ингибирования IL-6 и TNF. В качестве одного из первых средств иммунотерапии при коронавирусной инфекции был предложен блокатор рецептора IL-6R тоцилизумаб [89]. Азитромицин и доксициклин также применялись для лечения COVID-19. Эти препараты ингибируют репликацию некоторых РНК-содержащих вирусов и синтез IL-6 [68]. Все указанные лекарственные средства обладают выраженными побочными эффектами и их применение при ряде хронических заболеваний ограничено [47].
В США было проведено ретроспективное исследование применения противомалярийных препаратов при COVID-19. Эффективность препаратов оценивалась по снижению смертности или предотвращению ухудшения состояния пациентов. Больные с тяжелой формой COVID-19 в дополнение к стандартной терапии получали гидроксихлорохин или гидроксихлорохин в комбинации с азитромицином. В контрольной группе умерли 11.4% пациентов, а среди тех, кто принимал гидроксихлорохин или его сочетание с азитромицином, летальный исход зарегистрирован соответственно у 27.8% и 22% больных. Анализ летальных исходов показал, что гидроксихлорохин повышал смертность пациентов с COVID-19 [63].
Перспективным представляется применение при тяжелой форме COVID-19 плазмы реконвалесцентов (ПР) [28, 30]. При терапии ПР пациентам вводят антитела против SARS-CoV-2 [94]. Согласно исследованиям, проведенным в Китае, применение ПР эффективно при развитии полиорганной недостаточности у пациентов с COVID-19 [43]. Однако применение ПР при коронавирусной инфекции пока не получило широкого распространения.
Применение пептидных иммуномодулирующих препаратов при COVID-19 имеет ряд преимуществ перед описанными выше подходами. Пептиды практически не обладают побочными эффектами и имеют физиологический механизм действия. Пептидные препараты могут использоваться у пациентов старших возрастных групп и у лиц с тяжелыми сопутствующими заболеваниями.
При тяжелой форме COVID-19 применялся иммуномодулирующий пентапептид тимопентин (Arg-Lys-Asp-Val-Tyr, RKDVY, TP5), являющийся активным центром гормона тимуса тимопоэтина [72, 77]. Тимопентин способствует нормализации иммунологических показателей при иммунодефицитных и аутоиммунных заболеваниях [37, 70]. Этот пентапептид влияет на функцию Т-клеток и моноцитов, повышая уровень вторичного посредника цГМФ и активируя внутриклеточные сигнальные каскады [25]. Ранее тимопентин был эффективен в терапии атипичной пневмонии, вызванной вирусом SARS-CoV [90].
В комплексном лечении COVID-19 возможно применение иммуномодулирующих пептидных лекарственных препаратов тималина и тимогена. Полипептиный комплекс тималин был выделен из тимуса крупного рогатого скота [15]. Дипептид тимоген (Glu-Trp, EW) входит в состав тималина [16]. Тималин и тимоген регулируют состояние врожденного и адаптивного иммунитета. У пациентов со вторичными иммунодефицитами тимоген нормализует содержание CD4+ Т-лимфоцитов и восстанавливает соотношение CD4+/CD8+ Т-клеток [16, 22]. Тималин и тимоген предотвращают развитие “цитокинового шторма”, уменьшая концентрацию провоспалительных цитокинов IL-1α, IL-6, IL-8, TNF-α в крови [7, 8, 15]. Тималин и тимоген снижают интенсивность внутрисосудистого свертывания крови при развитии гиперкоагуляционного синдрома в эксперименте и клинике [7, 8]. Тималин и тимоген эффективны при различных инфекционных заболеваниях (гепатит А и В, рожистое воспаление, менингококковая инфекция, брюшной тиф), острых респираторных заболеваниях, пневмониях различной этиологии, кавернозном туберкулeзе лeгких [7, 11, 18, 20, 23]. Проведено двойное слепое рандомизированное плацебо-контролируемое исследование эффективности тимогена у пациентов пожилого возраста после удаления солидных опухолей в брюшной полости и забрюшинном пространстве. Дооперационное использование тимогена восстанавливало структурные и функциональные параметры иммунитета и приводило к достоверному уменьшению количества и спектра послеоперационных осложнений, а также к сокращению послеоперационного периода [21].
После применения тималина или тимогена при различных заболеваниях снижение уровня провоспалительных цитокинов наблюдалось на 5–7 сут [7, 8, 12, 15]. В этот период времени при COVID-19 развивается “цитокиновый шторм”. Тималин или тимоген, по-видимому, могут предотвращать развитие “цитокинового шторма” у пациентов с коронавирусной инфекцией и нарушением иммунной функции (тромбоцитопения, лейкопения, нейтрофилия, лимфопения, увеличение отношения нейтрофилы/лимфоциты). В этом случае тималин рекомендуется применять в дозировке 10 мг, а тимоген – 100 мкг в течение 5–10 дней.
Однако применение различных иммуномодуляторов у тяжелых больных с COVID-19 требует осторожности, учитывая недостаточность клинических данных.
Для предупреждения развития тромбоза у пациентов с коронавирусной инфекцией целесообразно с первого дня поступления в стационар вводить фракционированные или низкомолекулярные гепарины. При заболеваниях, сопровождаемых гиперкоагуляцией, максимальный эффект наблюдается в случаях, когда гепарин сочетается с малыми дозами (не более 100 мг на прием) дезагрегантов. В связи с этим пациентам с COVID-19 можно рекомендовать с первых дней поступления в стационар принимать кардиомагнил, аспирин и другие дезагреганты [73, 74].
SARS-CoV-2 в основном поражает легкие, вызывая интерстициальную пневмонию и ОРДС. Однако при тяжелом течении COVID-19 наблюдается поражение центральной нервной системы (ЦНС) [56], желудочно-кишечного тракта [45, 71] и сердечно-сосудистой системы [38]. Установлено, что вирус SARS-CoV-2 способен проникать в сому корковых нейронов. SARS-CoV-2 локализуется в нейронах вместе с фосфорилированным тау-протеином. Это свидетельствует о возможности развития нейродегенеративных процессов. Глиальные клетки после инфицирования SARS-CoV-2 секретируют провоспалительные цитокины IL-6, IL-12, IL-15, TNF-α. Активация иммунных клеток головного мозга под действием цитокинов вызывает хроническое воспаление [82]. У 40% пациентов с COVID-19 возникали головная боль, нарушение сознания и другие симптомы дисфункции ЦНС. У некоторых больных выявлены судороги или цереброваскулярные нарушения [56, 66]. У погибших от COVID-19 пациентов наблюдался отек головного мозга, что подтверждает наличие инфекционной токсической энцефалопатии [84]. Поражение ЦНС часто было связано с неблагоприятным прогнозом течения COVID-19 [50].
Одним из препаратов, способствующих профилактике и лечению осложнений COVID-19 со стороны ЦНС, может быть кортексин, который представляет собой комплекс полипептидов с молекулярной массой до 10 кДа. Препарат оказывает церебропротекторное, ноотропное, антиоксидантное и противосудорожное действие, снижает токсические эффекты нейротропных веществ, активирует репаративные процессы в головном мозге, улучшает память, нормализует функции ЦНС [19]. Кортексин обладает иммуномодулирующим действием и стимулирует регенерацию тканей [3, 4]. Кортексин эффективен при эпилепсии, энцефалопатии, нейроинфекциях, судорожном синдроме, черепно-мозговых травмах у детей и взрослых. После применения кортексина у пациентов улучшилось самочувствие и сон, снижалась тревожность и гипервозбудимость, повышались внимание и память [1]. Применение кортексина у больных с COVID-19 с критическими состояниями различного генеза, приводящими к развитию синдрома полиорганной недостаточности и сопровождающимися энцефалопатией, приводило к быстрому снижению тяжести симптоматики, нормализации функций коры головного мозга и снижению летальности [24]. Это свидетельствует о перспективности применения кортексина при тяжелой форме COVID-19, сопровождающейся нарушениями функций ЦНС.
Можно предположить, что применение пептидных иммуномодуляторов (тимопентин, тималин, тимоген), антикоагулянтов, дезагрегантов и кортексина (при осложнениях со стороны ЦНС) будет способствовать снижению количества осложнений и летальных исходов при COVID-19.
ЗАКЛЮЧЕНИЕ
Пандемия, вызванная вирусом SARS-CoV-2 в 2019–2020 гг, имеет неблагоприятные социальные и экономические последствия для большинства сран мира. В связи с этим изучение патогенеза COVID-19 и поиск эффективных методов терапии заболевания становится приоритетным направлением научных исследований. Пандемия COVID-19 поставила перед молекулярной биологией и медициной задачу поиска эффективных и безопасных лекарственных средств.
SARS-CoV-2, проникая в клетки легких, активирует все звенья врожденного и адаптивного иммунитета. На начальной стадии заболевания у пациентов с отягощенным анамнезом выявляется гиперактивация системы комплемента, повышение концентрации провоспалительных цитокинов в крови и ткани легких, что отягощает дальнейшее течение патологического процесса. При тяжелой форме COVID-19 наблюдаются генерализованные тромботические повреждения сосудов, опосредованные активацией системы комплемента. Тяжелая форма COVID-19 часто характеризуются гипервоспалением, дисбалансом ренин-ангиотензин-альдостероновой системы и коагулопатией. При неблагоприятном течении коронавирусной инфекции в крови пациентов повышается концентрация IL-1β, IL-1RA, IL-2, IL-4, IL-6, IL-7, IL-8, IL-9, IL-10, IL-13, IL-17, FGF, G-CSF, GM-CSF, IFNγ, TNF, VEGF, IP-10, MCP-1, MIP-1α, PDGF, MIP-1β и, вследствие этого, развивается “цитокиновый шторм”. В крови пациентов с коронавирусной инфекцией возрастает концентрация D-димера, уровень фибриногена, активируются факторы гемокоагуляции, развивается тромбоцитопения. При тяжелой форме COVID-19 активируются белки системы комплемента (C3а, С5а), возникает эндотелиальная дисфункция, усиливается процесс свертывания крови, что приводит к тромбозу. Тромбоз является причиной полиорганной недостаточности и тяжелых осложнений со стороны сердечно-сосудистой и центральной нервной систем.
Перспективными препаратами для лечения COVID-19, в патогенез которой вовлечены иммунная система и гемостаз, являются иммунорегуляторные пептиды (тимопентин, тималин, тимоген) и антикоагулянты. Тимопентин, тималин и тимоген нормализуют состояние врожденного и адаптивного иммунитета, предотвращая развитие “цитокинового шторма”. Тималин и тимоген снижают гиперкоагуляцию, предупреждая развитие тромбозов и тромбоэмболий. Эти препараты нормализуют показатели клеточного и гуморального иммунитета, в том числе уровень провоспалительных и противовоспалительных цитокинов, снижают интенсивность внутрисосудистого свертывания крови. Следует подчеркнуть, что пептиды тимуса не обладают аллергизирующими свойствами и не вызывают побочных реакций.
Для предупреждения развития тромбоза при тяжелой форме COVID-19 в дополнение к иммуномодулирующей терапии можно рекомендовать применение фракционированных или низкомолекулярных гепаринов и дезагрегантов.
Приблизительно у 40% пациентов с COVID-19 возникают осложнения со стороны ЦНС: головная боль, потеря сознания, судороги, цереброваскулярные нарушения. В случае осложнений со стороны ЦНС при COVID-19 можно рекомендовать нейропротекторный пептидный препарат кортексин. Кортексин оказывает церебропротекторное, ноотропное, антиоксидантное и противосудорожное действие, снижает токсические эффекты нейротропных веществ, активирует репаративные процессы в головном мозге, улучшает память.
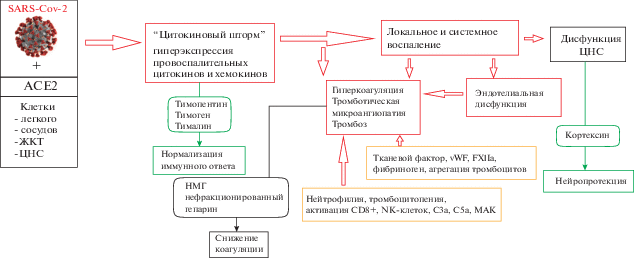
Таким образом, перспективными препаратами для терапии COVID-19 могут явиться иммуномодуляторы (тимопентин, тималин, тимоген), антикоагулянты, антиагреганты и нейропротекторы (кортексин) (рис. 1).
Рис. 1.
Предполагаемая схема патогенеза и терапии COVID-19. Обозначения на рисунке: ЖКТ – желудочно-кишечный тракт, МАК – мембраноатакующий комплекс, НМГ – низкомолекулярный гепарин, ЦНС – центральная нервная система, ACE – ангиотензинпревращающий фермент, CD – кластер дифференцировки, NK – натуральные киллеры.
Список литературы
Аниол В.А., Новицкая Ю., Бородина Т.Л. и др. Оценка противоэпилептических эффектов кортексина на модели судорожной активности // Журн. неврологии и психиатрии им. С.С. Корсакова. 2011. № 12. С. 67–73.
Башилов Н.И, Цыбиков Н.Н, Кузник Б.И. Роль внеклеточных микровезикул в условиях нормы и патологии // Успехи современной биологии. 2017. Т. 137. № 6. С. 553–565.
Белокрылов Г.А., Морозов В.Г., Хавинсон В.Х. Влияние веществ полипептидной природы, выделенных из коры головного мозга, на иммунный ответ у мышей // Бюлл. эксп. биол. мед. 1978. № 12. С. 703–705.
Гранстрем О.К., Сорокина Е.Г., Салыкина М.А. и др. Кортексин: нейропротекция на молекулярном уровне // Нейроиммунология. 2010. № 1–2. С. 39–46.
Зубаиров Д.М., Зубаирова Л.Д. Микровезикулы в крови, функция и их роль в тромбообразовании. М.: Геотар-Медиа, 2009. 168 с.
Кузник Б.И., Васильев В.Н., Цыбиков Н.Н. Иммуногенез, гемостаз и неспецифическая резистентность организма. М.: Медицина, 1989. 320 с.
Кузник Б.И., Лиханов И.Д., Будажабон Г.Б., Даренская С.Д. Влияние тималина на иммунитет и гемостаз у больных с абсцессами легких // Тромбоз, гемостаз и реология. 2002. № 3. С. 55–61.
Кузник Б.И., Лиханов И.Д., Цепелев В.Л., Сизоненко В.А. Теоретические и клинические аспекты биорегулирующей терапии в хирургии и травматологии. Новосибирск, Наука, 2008. 312 с.
Кузник Б.И., Ложкина А.Н. Взаимосвязь системы комплемента, калликреин-кининовой системы и системы гемостаза. Физиологические системы гемостаза. М., 1995. С. 150–160.
Кузник Б.И., Стуров В.Г., Левшин Н.Ю. и др. Геморрагические и тромботические заболевания и синдромы у детей и подростков. Новосибирск. Наука, 2018. 524 с.
Кузник Б.И., Хавинсон В.Х., Морозов В.Г. и др. Влияние тималина на течение острых пневмоний у детей раннего возраста // Педиатрия. 1982. № 4. С. 22–25.
Кузник Б.И., Хавинсон В.Х., Морозов В.Г. и др. Лечение тималином больных с тяжелыми и рецидивирующими формами вирусного гепатита // Клин. мед. 1983. № 11. С. 109–113.
Кузник Б.И., Цыбиков Н.Н. Взаимосвязь между иммуногенезом и системой гемостаза: единая система защиты организма // Успехи современной биологии. 1981. № 2. С. 243–260.
Лиханов И.Д., Кузник Б.И., Цыбиков Н.Н. Состояние иммунитета, свёртываемости и реологических свойств крови при гнойной хирургической инфекции // Российский иммунологический журн. 2008. № 2–3. С. 254–257.
Морозов В.Г., Хавинсон В.Х. Выделение из костного мозга, лимфоцитов и тимуса полипептидов, регулирующих процессы межклеточной кооперации в системе иммунитета // Докл. АН СССР. 1981. Т. 261. № 1. С. 235–239.
Морозов В.Г., Хавинсон В.Х., Малинин В.В. Пептидные тимомиметики. СПб. Наука, 2000. 157 с.
Паршина А.А., Цыбиков Н.Н. Нейтрофильные внеклеточные ловушки // Успехи современной биологии. 2018. Т. 138. № 5. С. 488–502.
Патеюк В.Г., Будажабон Г.Б., Кузник Б.И. и др. Тималин в лечении больных рожей // Клин. мед. 1987. № 7. С. 110–113.
Рыжак Г.А., Малинин В.В., Платонова В.Н. Кортексин и регуляция функций головного мозга. СПб, 2001. 160 с.
Салина Т.Ю., Худзик Л.Б. Иммунопатогенетические механизмы в течении туберкулезной инфекции // Пробл. туб. 2001. № 8. С. 32–34.
Смирнов В.С., Петленко С.В., Ельцин С.С. Применение тимогена для предоперационной подготовки больных пожилого возраста с опухолевыми процессами в брюшной полости // Успехи геронтологии. 2011. Т. 24. № 2. С. 278–284.
Хавинсон В.Х., Кузник Б.И., Рыжак Г.А. Пептидные геропротекторы – эпигенетические регуляторы физиологических функций организма. СПб: Из-во РГПУ им. И.А Герцена, 2014. 279 с.
Худзик Л.Б. Иммунотерапия туберкулеза органов дыхания // Пробл. туб. 1998. № 6. С. 46–50.
Шоломов И.И., Коноплева О.П., Щуковский Н.В. и др. Профилактика хронической ишемии головного мозга на фоне артериальной гипертензии // Медицинская кафедра. 2006. № 3–4. С. 88–92.
Audhya T., Heavner G.A., Kroon D.J., Goldstein G. Cooperativity of thymopoietin 32–36 (the active site) and thymopoietin 38–45 in receptor binding // Regulatory Peptides. 1984. V. 9. P. 155–164. https://doi.org/10.1016/0167-0115(84)90068-5
Barnes B.J., Adrover J.M., Baxter-Stoltzfus A., et al. Targeting potential drivers of COVID-19: neutrophil extracellular traps // J. Exp. Med. 2020. V. 217. № 6. pii: e20200652. https://doi.org/10.1084/jem.20200652
Beristain-Covarrubias N., Perez-Toledo M., Thomas M.R., et al. Understanding infection-induced thrombosis: lessons learned from animal models // Front. Immunol. 2019. V. 10:2569. https://doi.org/10.3389/fimmu.2019.02569
Bobati S.S., Naik K.R. Therapeutic plasma exchange - an emerging treatment modality in patients with neurologic and non-neurologic diseases // J. Clin. Diagn. Res. 2017. V. 11. EC35–EC37. https://doi.org/10.7860/JCDR/2017/27073.10480
Chen G., Wu D., Guo W. et al. Clinical and immunologic features in severe and moderate Coronavirus Disease 2019 // J. Clin. Invest. 2020. V. 130. № 5. P. 2620–2629. https://doi.org/10.1172/JCI137244
Chen L., Xiong J., Bao L., Shi Y. Convalescent plasma as a potential therapy for COVID-19 // Lancet Infect. Dis. 2020. V. 20. P. 398–400. https://doi.org/10.1016/S1473-3099(20)30141-9
Diurno F., Numis F.G., Porta G., et al. Eculizumab treatment in patients with COVID-19: preliminary results from real life ASL Napoli 2 Nord experience // Rev. Med. Pharmacol. Sci. 2020. V. 24. № 7. P. 4040–4047. doi _202004_20875https://doi.org/10.26355/eurrev
Ganji A., Farahani I. Khansarinejad B. et al. Increased expression of CD8 marker on T-cells in COVID-19 patients // Blood Cells Mol. Dis. 2020. V. 83. P. 102437. https://doi.org/10.1016/j.bcmd.2020.102437
Gao Y., Li T., Han M. et al. Diagnostic utility of clinical laboratory data determinations for patients with the severe COVID-19 // J. Med. Virol. 2020. https://doi.org/10.1002/jmv.25770
Gasparyan A.Y., Misra D.P., Yessirkepov M., Zimba O.J. Perspectives of immune therapy in coronavirus disease 2019 // Korean Med. Sci. 2020. V. 35. № 18. e176. https://doi.org/10.3346/jkms.2020.35.e176
Gheblawi M., Wang K., Viveiros A. et al. Angiotensin converting enzyme 2: SARS-CoV-2 receptor and regulator of the renin-angiotensin system // Circ. Res. 2020. https://doi.org/10.1161/CIRCRESAHA.120.317015
Glowacka I., Bertram S., Müller M.A., et al. Evidence that TMPRSS2 activates the severe acute respiratory syndrome coronavirus spike protein for membrane fusion and reduces viral control by the humoral immune response // J. Virol. 2011. V. 85. P. 4122–4134. https://doi.org/10.1128/JVI.02232-10
Goldstein G., Scheid M.P., Boyse E.A. et al. A synthetic pentapeptide with biological activity characteristic of the thymic hormone thymopoietin // Science. 1979. V. 204. P. 1309–1310. https://doi.org/10.1126/science.451537
Guzik T.J., Mohiddin S.A., Dimarco A. et al. COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options // Cardiovasc. Res. 2020. cvaa106. https://doi.org/10.1093/cvr/cvaa106
Henry B.M., de Oliveira M.H.S., Benoit S. et al. Hematologic, biochemical and immune biomarker abnormalities associated with severe illness and mortality in coronavirus disease 2019 (COVID-19): a meta-analysis // Chem. Lab Med. 2020. j/cclm.ahead-of-print/cclm-2020-0369/cclm-2020-0369.xml. https://doi.org/10.1515/cclm-2020-0369
Henry B.M., Vikse J., Benoit S., et al. Hyperinflammation and derangement of renin-angiotensin-aldosterone system in COVID-19: a novel hypothesis for clinically suspected hypercoagulopathy and microvascular immunothrombosis // Clin. Chim. Acta. 2020. V. 507. P. 167–173. https://doi.org/10.1016/j.cca.2020.04.027
Hong-Long J., Zhao R., Matalon S., Matthay M.A. Elevated plasmin(ogen) as a common risk factor COVID-19 susceptibility // Physiol. Rev. 2020. V. 100. № 3. P. 1065–1075. https://doi.org/10.1152/physrev.00013.2020
Huang C., Wang Y., Li X. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China // Lancet. 2020. V. 395. P. 497–506. https://doi.org/10.1016/S0140-6736(20)30183-5
Iyer M., Jayaramayya K., Subramaniam M.D. et al. COVID-19: an update on diagnostic and therapeutic approaches // BMB Rep. 2020. V. 53. № 4. P. 191–205. https://doi.org/10.5483/BMBRep.2020.53.4.080
Jamilloux Y., Henry T., Belot A. et al. Should we stimulate or suppress immune responses in COVID-19? Cytokine and anti-cytokine interventions // Autoimmun. Rev. 2020. 102567. https://doi.org/10.1016/j.autrev.2020.102567
Jin X., Lian J.S., Hu J.H. et al. Epidemiological, clinical and virological characteristics of 74 cases of coronavirus-infected disease 2019 (COVID-19) with gastrointestinal symptoms // Gut. 2020. V. 69. № 6. P. 1002–1009. https://doi.org/10.1136/gutjnl-2020-320926
Joly B.S., Siguret V., Veyradier A. Understanding pathophysiology of hemostasis disorders in critically ill patients with COVID-19 // Intensive Care Med. 2020. P. 1–4. https://doi.org/10.1007/s00134-020-06088-1
Jones G., Panova E. New insights and long-term safety of tocilizumab in rheumatoid arthritis // Ther. Adv. Musculoskelet Dis. 2018. V. 10. P. 195–199. https://doi.org/10.1177/1759720X18798462
Kakodkar P., Kaka N., Baig M.N. A comprehensive literature review on the clinical presentation, and management of the pandemic coronavirus disease 2019 (COVID-19) // Cureus. 2020. V. 12. № 4. e7560. https://doi.org/10.7759/cureus.7560
Li G., Fan Y., Lai Y. et al. Coronavirus infections and immune responses // Med. Virol. 2020. V. 92. № 4. P. 424–432. https://doi.org/10.1002/jmv.25685
Li H., Xue Q., Xu X. Involvement of the nervous system in SARS-CoV-2 infection // Neurotox. Res. 2020. https://doi.org/10.1007/s12640-020-00219-8
Li W., Moore M.J., Vasilieva N. et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus // Nature. 2003. V. 426. P. 450–454. https://doi.org/10.1038/nature02145
Liu P.P., Blet A., Smyth D., Li H. The science underlying COVID-19: implications for the cardiovascular system // Circulation. 2020. https://doi.org/10.1161/CIRCULATIONAHA.120.047549
Liu Y., Yang Y., Zhang C. et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury // Sci. China Life Sci. 2020. V. 63. P. 364–374. https://doi.org/10.1007/s11427-020-1643-8
Ma J., Weisberg A., Griffin J.P. et al. Plasminogen activator inhibitor-1 deficiency protects against aldosterone-induced glomerular injury // Kidney Int. 2006. V. 69. P. 1064–1072. https://doi.org/10.1038/sj.ki.5000201
Magro C., Mulvey J.J., Berlin D. et al. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: a report of five cases // Ransl. Res. 2020. S1931-5244(20)30070-0. https://doi.org/10.1016/j.trsl.2020.04.007
Mao L., Wang M.D., Chen S.H. et al. Neurological manifestations of hospitalized patients with COVID-19 in Wuhan, China: a retrospective case series study // Med. Rxiv 2020.02.22.20026500
McGonagle D., Sharif K., O’Regan A., Bridgewood C. The Role of Cytokines including interleukin-6 use in COVID-19 pneumonia related macrophage activation syndrome // Autoimmunity Reviews. 2020. V.19. № 6. P. 102 537. https://doi.org/10.1016/j.autrev.2020.102537
Mehta P., McAuley D.F., Brown M. et al. COVID-19: consider cytokine storm syndromes and immunosuppression // Lancet. 2020. V. 395(10229). P. 1033–1034. https://doi.org/10.1016/S0140-6736(20)30628-0
Nakamura S., Nakamura I., Ma L. et al. Plasminogen activator inhibitor-1 expression is regulated by the angiotensin type 1 receptor in vivo // Kidney Int. 2000. V. 58. P. 251–259. https://doi.org/10.1046/j.1523-1755.2000.00160.x
Nelemans T., Kikkert M. Viral innate immune evasion and the pathogenesis of emerging RNA virus infections // Viruses. 2019. V. 11. № 10. P. 961. https://doi.org/10.3390/v11100961
Neurath M.F. Covid-19 and immunomodulation in IBD // Gut. 2020. gutjnl-2020-321269. https://doi.org/10.1136/gutjnl-2020-321269
Oehmcke S., Mörgelin M., Herwald H. Activation of the human contact system on neutrophil extracellular traps // J. Innate Immun. 2009. V. 1. P. 225–230. https://doi.org/10.1159/000203700
Outcomes of hydroxychloroquine usage in United States veterans hospitalized with Covid-19. medRxiv 2020. 04.16.20065920. https://doi.org/10.1101/2020.04.16.20065920
Pedersen S.F., Ho Y-C. SARS-CoV-2: a storm is raging // J. Clin. Invest. 2020. V. 130. № 5. P. 2202–2205.https://doi.org/10.1172/ JCI137647
Qi F., Qian S., Zhang S., Zhang Z. Single cell RNA sequencing of 13 human tissues identify cell types and receptors of human coronaviruses // Biochem. Biophys. Res. Commun. 2020. V. 526. № 1. P. 135–140. https://doi.org/10.1016/j.bbrc.2020.03.044
Qin C., Zhou L., Hu Z. et al. Dysregulation of immune response in patients with COVID-19 in Wuhan, China // Clinical Infectious Diseases. 2020. https://doi.org/10.1093/cid/ciaa248
Rehwinkel J., Gack M.U. RIG-I-like receptors: their regulation and roles in RNA sensing // Nat. Rev. Immunol. 2020. V. 13. P. 1–15. https://doi.org/10.1038/s41577-020-0288-3
Sargiacomo C., Sotgia F., Lisanti M.P. COVID-19 and chronological aging: senolytics and other anti-aging drugs for the treatment or prevention of corona virus infection? // Aging (Albany NY). 2020. V. 12. № 8. P. 6511–6517. https://doi.org/10.18632/aging.103001
Simon H.-W., Karaylov A.V., Bachmann M.F. Strategies to prevent SARS-CoV-2-mediated eosinophilic disease in association with COVID-19 vaccination and infection // Int Arch Allergology Immunol. 2020. https://doi.org/10.1159/000509368
Singh V.K., Biswas S., Mathur K.B. et al. Thymopentin and splenopentin as immunomodulators. Current status // Immunol. Res. 1998. V. 17. P. 345–368. https://doi.org/10.1007/BF02786456
Smyk W., Janik M.K., Portincasa P. et al. COVID-19: focus on the lungs but do not forget the gastrointestinal tract // Eur. J. Clin. Invest. 2020. e13276. https://doi.org/10.1111/eci.13276
Solmajer T. Design of a novel thymopoietin analogue based on conformational analyses // Drug Des. Deliv. 1990. V. 6. P. 213–221.
Tang N., Bai H., Chen X. et al. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy // J. Thromb. Haemost. 2020. V. 18. № 5. P. 1094–1099. https://doi.org/10.1111/jth.14817
Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia // J. Thromb. Haemost. 2020. V. 18. № 4. P. 844–847. https://doi.org/10.1111/jth.14768
Tay M.Z., Poh C.M., Rénia L. et al. The trinity of COVID-19: immunity, inflammation and intervention // Nat. Rev. Immunol. 2020. P. 1–12. https://doi.org/10.1038/s41577-020-0311-8
Tufan A., Güler A.A., Matucci-Cerinic M. COVID-19, immune system response, hyperinflammation and repurposing antirheumatic drugs // Turk. J. Med. Sci. 2020. V. 50(SI-1). P. 620–632. https://doi.org/10.3906/sag-2004-168
Wang Q., Zhao Y., Chen X., Hong A. Virtual screening of approved clinic drugs with main protease (3CLpro) reveals potential inhibitory effects on SARS-CoV-2. Preprints 2020, 2020030144
Wang X., Xu W., Hu G. et al. SARS-CoV-2 infects T lymphocytes through its spike protein-mediated membrane fusion // Cell Mol. Immunol. 2020. P. 1–3. https://doi.org/10.1038/s41423-020-0424-9
Watanabe M., Risi R., Tuccinardi D. et al. Obesity and SARS-CoV-2: a population to safeguard // Diabetes Metab. Res. Rev. 2020. e3325. https://doi.org/10.1002/dmrr.3325
Werner C., Scullen T., Mathkour M. et al. Neurological impact of coronavirus disease of 2019: practical Considerations for the Neuroscience community // World Neurosurg. 2020. V. 139. P. 344–354. https://doi.org/10.1016/j.wneu.2020.04.222
Wu C., Chen X., Cai Y. et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China // JAMA Intern. Med. 2020. https://doi.org/10.1001/jamainternmed.2020.0994
Wu Y., Xu X., Chen Z. et al. Nervous system involvement after infection with COVID-19 and other coronaviruses // Brain Behav. Immun. 2020. pii: S0889-1591(20)30357-3. https://doi.org/10.1016/j.bbi.2020.03.031
Xu X., Chen P., Wang J. et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission // Sci. China Life Sci. 2020. V. 63. P. 457–460. https://doi.org/10.1007/s11427-020-1637-5
Xu Z., Shi L., Wang Y. et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome // Lancet Respir. Med. 2020. V. 8. № 4. P. 420–422. https://doi.org/10.1016/S2213-2600(20)30076-X
Yao X.H., Li T.Y., He Z.C. et al. A pathological report of three COVID-19 cases by minimal invasive autopsies // Zhonghua Bing Li Xue Za Zhi. 2020. V. 49. № 5. P. 411–417. https://doi.org/10.3760/cma.j.cn112151-20200312-00193
Yao X.H., Li T.Y., He Z.C. et al. A pathological report of three COVID-19 cases by minimal invasive autopsies // Zhonghua Bing Li Xue Za Zhi. 2020. V. 8(49). № 5. P. 411–417. https://doi.org/10.3760/cma.j.cn112151-20200312-00193
Ye Q., Wang B., Mao J.J. The pathogenesis and treatment of the “Cytokine Storm” in COVID-19 // Infect. 2020. V. 80. № 6. P. 607–613. https://doi.org/10.1016/j.jinf.2020.03.037
Yu F., Du L., Ojcius D.M. et al. Measures for diagnosing and treating infections by a novel coronavirus responsible for a pneumonia outbreak originating in Wuhan, China // Microbes Infect. 2020. V. 22. № 2. P. 74–79. https://doi.org/10.1016/j.micinf.2020.01.003
Zhang C., Wu Z., Li J.W. et al. The cytokine release syndrome (CRS) of severe COVID-19 and interleukin-6 receptor (IL-6R) antagonist Tocilizumab may be the key to reduce the mortality // Int. J. Antimicrob. Agents. 2020. V. 28. P. 105954. https://doi.org/10.1016/j.ijantimicag.2020.105954
Zhang R., Jiao Q., Wang B. Controlled clinical study on 49 patients of SARS treated by integrative Chinese and Western medicine // Zhongguo Zhong Xi Yi Jie He Za Zhi. 2003. V. 23. P. 654–657.
Zhang W., Zhao Y., Zhang F. et al. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): the perspectives of clinical immunologists from China // Clin. Immunol. 2020. V. 214. P. 108393. https://doi.org/10.1016/j.clim.2020.108393
Zhang Y., Cao W., Xiao M. et al. Clinical and coagulation characteristics of 7 patients with critical COVID-2019 pneumonia and acro-ischemia // Za Zhi. 2020. 41(0). E006. https://doi.org/10.3760/cma.j.issn.0253-2727.2020.0006
Zhou F., Yu T., Du R. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study // Lancet Lond. Engl. 2020. V. 395. P. 1054–1062. https://doi.org/10.1016/S0140-6736(20)30566-3
Zhou G., Zhao Q. Perspectives on therapeutic neutralizing antibodies against the Novel Coronavirus SARS-CoV-2 // Int. J. Biol. Sci. 2020. V. 16. № 10. P. 1718–1723. https://doi.org/10.7150/ijbs.45123
Zhou Z., Kang H., Li S., Zhao X. Understanding the neurotropic characteristics of SARS-CoV-2: from neurological manifestations of COVID-19 to potential neurotropic mechanisms // J. Neurol. 2020. P. 1–6. https://doi.org/10.1007/s00415-020-09929-7
Zuo Y., Yalavarthi S., Shi H. et al. Neutrophil extracellular traps in COVID-19 // JCI Insight. 2020. pii: 138 999. https://doi.org/10.1172/jci.insight.138999
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


