Успехи физиологических наук, 2021, T. 52, № 1, стр. 49-63
Влияние дофамина на взаимозависимое функционирование мозжечка, базальных ганглиев и новой коры (гипотетический механизм)
И. Г. Силькис *
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: isa-silkis@mail.ru
Поступила в редакцию 05.10.2020
После доработки 20.10.2020
Принята к публикации 29.10.2020
Аннотация
Предлагаемый механизм участия дофамина во взаимозависимом функционировании мозжечка, базальных ганглиев, новой коры и таламуса базируется на его модулирующем влиянии на эффективность синаптической передачи. Сформулированы правила модификации, из которых следует, что активация Д1 рецепторов способствует индукции длительной потенциации в синапсах, образованных мшистыми волокнами на клетках-зернах коры мозжечка, а также нейронах глубоких ядер мозжечка (при условии тормозного влияния на них со стороны клеток Пуркинье). В результате усиливается дисинаптическое возбуждение (через таламические ядра) клеток-мишеней мозжечка в новой коре, стриатуме и дофаминергических структурах. Усиление таламо-стриатного возбуждения, а также активация Д1 рецепторов на стрионигральных клетках, способствующая индукции на них длительной потенциации, а также активация Д2 рецепторов на стриопаллидарных клетках, способствующая индукции на них длительной депрессии, облегчают синергичное растормаживание по прямому и непрямому пути через базальные ганглии тех же таламических клеток и связанных с ними нейронов новой коры. При увеличении концентрации дофамина могут активироваться Д3 рецепторы на клетках Пуркинье и нейронах глубоких ядер мозжечка. Последующая индукция длительной депрессии на возбудительных входах к этим нейронам приведет к ослаблению возбуждения таламических и дофаминергических клеток. Предлагаемый механизм может лежать в основе участия мозжечка в выполнении задач, ранее ассоциировавшихся с участием только базальных ганглиев и новой коры.
Ранее полагали, что такие подкорковые структуры, как базальные ганглии (БГ) и мозжечок, выполняют разные функции. Однако получены экспериментальные свидетельства того, что мозжечок активен и при выполнении задач, которые ассоциировали с участием БГ, и наоборот [18]. Полагают, что в основе этих эффектов лежат связи между нейронами БГ и мозжечка. Эти две филогенетически древние структуры расширялись по мере эволюции. Возможно, связи между ними предшествовали образованию связей между корой и БГ, а также новой корой и мозжечком. Мозжечок и БГ оказывают на новую кору взаимозависимое и дополняющее влияние [18, 42]. Хотя нейроны выходных ядер БГ и глубоких ядер мозжечка (ГЯМ) проецируются в разные ядра таламуса, но последние могут оказывать влияние на одни и те же области коры [42]. Показано на людях и на нечеловекообразных приматах, что зубчатое ядро мозжечка (ЗЯМ), а у грызунов латеральное ядро мозжечка (ЛЯМ) активируются при выполнении когнитивных задач [79]. Мозжечок может быть вовлечен в не моторные функции, поскольку реципрокно связан с префронтальной корой (ПфК) и задне-теменной областью коры [17, 58].
Дофамин, выделяющийся в разных участках вышеуказанных нейронных цепей в ответ на условный сигнал и на подкрепление, оказывает существенное влияние на функционирование этих цепей при обучении, благодаря модулирующему действию на эффективность синаптической передачи. Поскольку активность передней части коры мозжечка коррелирует с подкреплением [97], можно полагать, что дофамин влияет на функционирование нейронов мозжечка. Нами был предложен гипотетический механизм влияния дофамина на выбор двигательной активности, а также на обработку сенсорной информации [116, 117]. Этот механизм базируется на модуляции эффективности кортико-стриатных входов и последующей реорганизации активности нейронов в параллельных цепях кора–БГ–таламус–кора (К–БГ–Т–К) [116]. Выдвинуто предположение, что поскольку мозжечок дисинаптически модулирует активность нейронов входного ядра БГ – стриатума, этот коротколатентный путь может облегчить оптимальный моторный контроль, влияя на знак длительной модификации кортико-стриатных входов и облегчая участие БГ в этом процессе [29].
В течение длительного времени полагали, что основную роль в функционировании мозжечка играет модификация эффективности синаптической передачи (длительная потенциация (ДП) и длительная депрессия (ДД)) между клетками зернами (КЗ) и клетками Пуркинье (КП), на которые влияет сигнал из нижней оливы (НО), поступающий по лианным волокнам (ЛВ), а также торможение со стороны интернейронов коры мозжечка [65]. Однако в настоящее время показано, что модифицируются также синапсы, образованные мшистыми волокнами (МВ) на КЗ, входы к интернейронам коры мозжечка, а также входы от КП и от МВ к нейронам ГЯМ. Полагают, что комплексный характер участия мозжечка в обучении зависит от модификации всех указанных синапсов [37]. В частности, для моторного обучения критичной является пластичность на возбудительном входе к нейронам ГЯМ [8], а при зрительно-вестибулярном обучении доминирующими являются ДП на возбудительных входах к КЗ и КП [49].
Правила модификации эффективности синаптических входов к КЗ, КП и нейронам ГЯМ были сформулированы нами ранее [3, 114]. В задачу настоящей работы входило обоснование правил модулирующего влияния дофамина на эффективность входов к нейронам мозжечка, анализ возможных механизмов влияния мозжечка на выделение дофамина, определение роли дофамин-зависимой модуляции синаптической передачи в функционировании нейронной сети, включающей мозжечок, БГ, новую кору и таламус. Упрощенная схема этой сети представлена на рис. 1.
ОРГАНИЗАЦИЯ МЕЖНЕЙРОННЫХ СВЯЗЕЙ В СЕТИ, ВКЛЮЧАЮЩЕЙ МОЗЖЕЧОК, БАЗАЛЬНЫЕ ГАНГЛИИ, НОВУЮ КОРУ, ТАЛАМУС И ДОФАМИНЕРГИЧЕСКИЕ СТРУКТУРЫ
Организация нейронной сети мозжечка
Некоторые особенности функциональной организации нейронной сети мозжечка подробно анализировались нами ранее [5, 115]. Внешнее возбуждение поступает по МВ в гранулярный слой коры мозжечка на КЗ, клетки Гольджи (КГ) и интернейроны в виде униполярной кисточки (УКК), которые участвуют в усилении активности КЗ [1]. Аксоны КЗ – параллельные волокна (ПВ) моносинаптически возбуждают и дисинаптически тормозят КП, активируя звездчатые и корзинчатые клетки (ЗК и КК), а также возбуждают клетки Лугаро (КЛ). Клетки Лугаро ингибируют другие ГАМКергические клетки, т.е. КГ, ЗК и КК. Таким образом, в мозжечке имеются условия не только для торможения, но и растормаживания КП, проецирующихся на нейроны ГЯМ. Возбуждение к КП, КГ и нейронам ГЯМ поступает из НО по ЛВ (НО и интернейроны мозжечка не представлены на рисунке с целью его упрощения).
Мозжечок связан с новой корой и БГ через таламус (рис. 1). Возбуждение поступает в мозжечок из новой коры через нейроны ядер моста (ЯМ). В частности, через ЯМ в мозжечок поступают сигналы, вызванные зрительными и звуковыми стимулами [53, 54]. Аксонные коллатерали нейронов ЯМ–МВ оканчиваются на КЗ и интернейронах коры мозжечка, а также на нейронах ГЯМ [113]. Синаптические контакты МВ с нейронами ГЯМ отличаются от контактов, образованных МВ в коре мозжечка [89]. Активность КЗ контролируется КГ, которые вовлечены в цепи афферентного и возвратного торможения КЗ [39]. Аксон одной КГ иннервирует сотни КЗ и десятки УКК [43]. В коре мозжечка имеются также клетки Лугаро (КЛ) [2], которые являются тормозными интернейронами. Они получают возбуждение от МВ и ПВ и образуют множественные аксо-соматические и аксо-дендритные контакты с КП, КГ, КЗ, КК и УКК [2].
Рис. 1.
Упрощенная схема организации межнейронных связей в нейронной сети, включающей новую кору, базальные ганглии, мозжечок и таламус. КОРА – новая кора; СТР – стриатум; КЗ – клетки зерна; КП – клетки Пуркинье; ГЯМ – глубокие ядра мозжечка; СТР. – стриатум, входное ядро базальных ганглиев; БШн – наружная часть бледного шара; ЧВр – ретикулярная часть черного вещества, выходное ядро базальных ганглиев; ЯМ – ядра моста; ТАЛ. – таламус; СТЯ – субталамическое ядро; ДА – дофаминергические структуры: вентральное поле покрышки и компактная часть черного вещества. МВ – мшистые волокна; ПВ – параллельные волокна; ПП и НП – прямой и непрямой пути через базальные ганглии соответственно. Линии, заканчивающиеся белыми и черными кружками – возбудительные и тормозные входы соответственно; пунктирные линии со стрелками – дофаминергические входы.
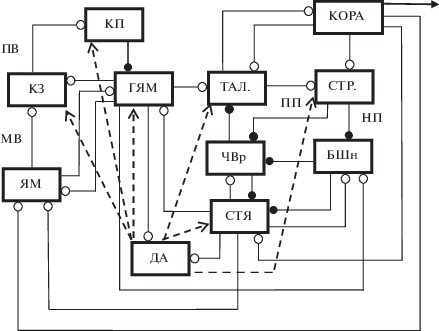
Синхронное срабатывание КП в широкой области частот может привести к разрядам глутаматергических, но не ГАМКергических клеток ГЯМ [95]. При этом частота срабатывания глутаматергических клеток не меняется, если нет входа из НО [95]. В свою очередь, в НО проецируются мелкие ГАМКергические клетки ГЯМ [46]. Этот вход подавляет фоновую и вызванную активность нейронов НО [16], благодаря чему формируется цепь отрицательной обратной связи. В отсутствие входа из ГЯМ в НО, в КП появляются комплексные спайки и сильно подавляются простые спайки, что указывает на сильное возбуждение КП [16]. Проекции их ГЯМ в НО организованы таким образом, что цепи НО–кора мозжечка–ГЯМ являются замкнутыми. Существует обратное влияние ГЯМ на кору мозжечка через МВ [48]. Этот вход вызывает моносинаптическое возбуждение КЗ, КГ и дисинаптическое торможение КП. Оптогенетическая активация или ингибирование волокон из ГЯМ в кору мозжечка у обученных животных приводит к увеличению и уменьшению соответственно мигательного ответа [48].
Организация связей мозжечка с базальными ганглиями и новой корой
Нейроны мозжечка и БГ связаны как непосредственно, так и опосредованно через подкорковые структуры. Нейроны ГЯМ связаны с БГ через ядра таламуса [17, 60] (рис. 1). Возрастание силы стимуляции таламуса увеличивало возбудительную реакцию шипиковых клеток стриатума более чем втрое, а подавление активности таламических клеток блокировало ответ нейронов стриатума на стимуляцию мозжечка [29]. Если при инактивации новой коры спонтанная частота нейронов стриатума снижалась на 50%, то стимуляция мозжечка приводила к коротколатентному возбуждению всех зарегистрированных нейронов стриатума [121]. Таким образом, дисинаптический вход из мозжечка в стриатум является эффективным и может функционировать независимо от новой коры.
Кроме того, аксоны нейронов ЗЯМ проецируются в наружную часть бледного шара (БШн) [60] (рис. 1), причем эти проекции топографически организованы. Нейроны БШн оказывают ингибирующее влияние на клетки выходных ядер БГ, а также на нейроны субталамического ядра (СТЯ). В свою очередь, нейроны СТЯ возбуждают разные ядра БГ и дофаминергические структуры. Также СТЯ является источником возбуждения ГЯМ [27], ядер таламуса [73], педункулопонтийного ядра (ППЯ), ЯМ [23, 50] и дисинаптического возбуждения коры мозжечка [18]. У крыс дисинаптические входы из моторных и ассоциативных частей СТЯ в моторные и не моторные части мозжечка топографически организованы [18, 21]. У приматов топической организации входов из СТЯ в кору мозжечка нет. Нейроны СТЯ получают возбуждение от разных областей новой коры и ППЯ [27]. У нечеловекообразных приматов СТЯ проецируется в КЗ через ЯМ [18] (рис. 1). У крыс СТЯ проецируется в КЗ через ППЯ [18]. Стимуляция СТЯ приводила к увеличению активности клеток ГЯМ на 45% и снижению активности КП на 28% [18], возможно, вследствие возбуждения ЗК и КК.
Замкнутость является важным элементом организации цепей БГ–кора и мозжечок–кора. Области коры, проецирующиеся в БГ или мозжечок, получают иннервацию из выходных ядер этих структур [72]. Следует подчеркнуть, что таламические клетки иннервируют те же области стриатума, что и нейроны ПфК, на которые проецируются эти таламические клетки [133]. Топографически организованные связи между соответствующими компартментами коры мозжечка, ГЯМ и НО образуют параллельные модули, которые играют существенную роль в функционировании мозжечка. Эти модули вовлечены в различные не соматосенсорные двигательные задачи [109].
Мозжечок и новая кора являются частями цепи: новая кора–ЯМ–КЗ–ГЯМ–таламус–кора. В ЯМ поступают сигналы от моторной, первичной соматосенсорной, зрительной и слуховой областей коры, причем кортико-понтийные и кортико-стриатные клетки располагаются в разных подслоях слоя V [53]. Повреждение входа в ЯМ из экстрастриарных зрительных областей приводит к зрительно-моторным нарушениям [53]. На нейронах ЯМ входы из новой коры конвергируют с входами из ГЯМ. Кроме того, аксонные коллатерали нейронов ГЯМ иннервируют НО [78]. Терминали из разных областей новой коры в ЯМ четко разделены и практически не перекрываются, тогда как терминали из ЯМ в кору мозжечка распределены диффузно [20]. Поэтому на нейронах мозжечка может конвергировать разномодальная информация. Поскольку цепи, связывающие мозжечок, БГ и новую кору, топографически организованы, моторные, когнитивные и эмоциональные области, расположенные в каждой из структур цепи, взаимосвязаны [18]. Данные визуализации на человеке также поддерживают точку зрения, что имеются функциональные взаимодействия между лимбическими частями БГ, мозжечка и новой коры [25].
Связи мозжечка с дофаминергическими структурами
Поскольку имеются прямые возбуждающие проекции из ГЯМ в вентральное поле покрышки (ВПП) и компактную часть черного вещества (ЧВк) [24, 130] (рис. 1), мозжечок влияет на выделение дофамина. Электрическая стимуляция мозжечка приводила к выделению дофамина в хвостатом ядре стриатума (ХЯ), являющемся частью моторной цепи, в прилежащем ядре (ПЯ), являющемся частью лимбической цепи [59], и в ПфК [90]. Показано, что оптогенетическая стимуляция входа из ГЯМ в ВПП, приводящая к увеличению активности нейронов ВПП, облегчает выполнение задачи [24]. Кроме того, нейроны ГЯМ могут влиять на выделение дофамина опосредованно за счет передачи возбуждения по цепи ГЯМ–таламус–новая кора–СТЯ–дофаминергические клетки (рис. 1). На это указывают результаты работы [104], в которой показано, что стимуляция ЗЯМ с частотой 50 Гц приводит к увеличению выделения дофамина в мПфК, но после введения антагониста глутаматных рецепторов в медиодорзальное или вентролатеральное таламические ядра количество выделившегося дофамина снижалось соответственно на 35 и 15%. Благодаря влиянию на выделение дофамина, нейроны ГЯМ являются частью цепи подкрепления.
Поскольку активность нейронов ГЯМ зависит от входов в ГЯМ от КП (рис. 1), они также влияют на выделение дофамина. Так, показано, что хотя электрическая стимуляция ЗЯМ приводит к увеличению выделения дофамина в ПфК как у нормальных мышей, так и генно-модифицированных мышей с отсутствием КП, но у последних выделение дофамина в ПфК было на 60% меньше [90]. Показано, что уменьшение выделения дофамина в мПфК у мутантных мышей с отсутствием КП связано с реорганизацией активности в цепях, включающих, кроме ВПП, таламические ядра – вентролатеральное и медиодорзальное, которые получают возбуждение от нейронов ГЯМ [105]. Подавление активности нейронов ростральных интраламинарных ядер таламуса снижало выделение дофамина из нигростриатных терминалей [34].
ОСОБЕННОСТИ МОДИФИКАЦИИ ЭФФЕКТИВНОСТИ СИНАПТИЧЕСКИХ ВХОДОВ К НЕЙРОНАМ МОЗЖЕЧКА
Клетки Пуркинье
К настоящему времени наибольшее внимание уделяется изучению особенностей и механизмов изменений эффективности синаптических входов к КП. Полагают, что в изменении эффективности входов к КП могут участвовать все нейроны коры мозжечка кроме КГ, поскольку КЗ, ЗК, КК и УКК разряжаются в фазе с комплексным спайком КП, тогда как КГ разряжаются не в фазе [11]. Характер модификации входов к КП зависит от внутриклеточной концентрации Са2+, который поступает через потенциал-зависимые каналы и выделяется из внутриклеточных депо [77]. При низких концентрациях Са2+ в КП на синаптических входах ПВ–КП индуцируется ДПв, а при высоких – ДДв. [32, 56]. Изолированная низкочастотная стимуляция ПВ приводила к ДПв, а высокочастотная – к ДДв. Сочетанная стимуляция ПВ и ЛВ также приводила к ДДв [56]. При значительном повышении концентрации Са2+ в КП генерируются сложные спайки. Показано, что активация примерно 85% синаптических входов ПВ–КП не приводит к заметному электрическому ответу КП [63]. Поскольку входы ПВ–КП слабые, поступающие от КЗ сигналы могут вызывать небольшое увеличение концентрации Са2+, так что чаще всего на КП создаются условия для индукции ДПв.
Модифицируются и тормозные входы к КП от ЗК и КК. Характер модификации также зависит от концентрации Са2+. При высокой концентрации Са2+ в КП индуцируется ДПт (названная потенциацией отдачи), а при низкой – ДДт [56, 124]. Влияние тормозного действия на КП может быть снижено при поступлении возбуждения из НО по ЛВ. Активация ЛВ могла приводить к индукции ДПт при наличии как спонтанных ТПСТ, так и ТПСТ, вызванных стимуляцией тормозных интернейронов [69]. Поскольку возбуждение и торможение поступают на КП практически одновременно, при высокой внутриклеточной концентрации Са2+ индуцируются ДДв и ДПт, а при низкой – ДПв и ДДт.
Большинство авторов связывают ДДв в синапсах ПВ-КП и ЛВ-КП с фосфорилированием А-МПА рецепторов, а ДПт – с фосфорилированием ГАМКа рецепторов кальций-кальмодулин-зависимой протеинкиназой II (СаМКII) и протеинкиназой А (ПКА), а также с ингибированием протеинфосфатазы 1 (ПФ1) [56, 69, 124], а ДПв в синапсах ПВ-КП связывают с активацией протеинфосфатаз [14], т.е. с дефосфорилированием АМПА рецепторов. Полагают также, что в индукции ДДв на КП при совместной стимуляции ПВ и ЛВ участвуют протеинкиназы С и G (ПКС и ПКG) [55] и активация пути NO–цГМФ–ПКG [70]. Однако, при обсуждении механизмов синаптической пластичности в КП авторы вышеуказанных исследований игнорировали то обстоятельство, что в новой коре и гиппокампе увеличение концентрации Са2+ и фосфорилирование АМПА рецепторов на постсинаптическом нейроне приводит к ДПв [101, 120]. За счет фосфорилирования ГАМКа рецепторов протеинкиназами ПКС, CaMКII и ПКА депрессируется ток через ГАМКа рецепторы (т.е. индуцируется ДДт) [76, 93, 107]. На ГАМКа рецепторах есть также сайт для их фосфорилирования ПКG [83].
В новой коре и гиппокампе преобладают А-МПА рецепторы, содержащие субъединицы GluR1, GluR2 и GluR3, тогда как в мозжечке, таламусе и сетчатке велика концентрация АМПА рецепторов с субъединицей GluR4 с наибольшей проницаемость для Са2+ [33]. Однако фосфорилирование АМПА рецепторов и этого типа ПКС приводит к усилению возбудительной передачи [33], что указывает на ДПв. В ганглиозных клетках сетчатки активация ПКG (что должно увеличить фосфорилирование рецепторов) также приводила к существенному увеличению ВПСП [12]. При увеличении активности ПКG наблюдалось и подавление тока через ГАМКа рецепторы на нейронах сетчатки [131], т.е. имела место депрессия торможения. Приведенные данные позволяют полагать, что ДДв и ДПт, наблюдавшиеся на синаптических входах к КП при увеличении концентрации Са2+, должны являться следствием дефосфорилирования АМПА и ГАМКа рецепторов, а не их фосфорилирования, как принято считать. На это указано в наших предшествующих работах [4, 114]. С нашей точки зрения, при увеличении концентрации Са2+ в КП возрастает активность цАМФ-зависимой фосфодиестеразы, разлагающей цГМФ. То, что цАМФ негативно влияет на цГМФ, показано в работе [91]. В результате снижается активность цГМФ-зависимой ПКG и хотя активность CaMКII, ПКС и ПКА не убывает, снижена суммарная активность протеинкиназ, так что индукция ДДв является следствием дефосфорилирования АМПА рецепторов.
Согласно правилам модификации для нейронов новой коры и гиппокампа [6], ослабление ГАМК торможения постсинаптического нейрона должно способствовать индукции ДПв, а усиление торможения – индукции ДДв. Это условие должно выполняться и для КП при относительно низких концентрациях Са2+. При низкочастотной стимуляции ПВ, при которой концентрация Са2+ в КП обычно невелика, для индукции ДДв на синаптическом входе ПВ-КП, было необходимо активировать НМДА рецепторы на интернейронах молекулярного слоя (т.е. на КК и ЗК) [74]. Судя по результатам этой работы, можно полагать, что активация НМДА рецепторов на ЗК и КК способствует индукции ДПв на входах ПВ-ЗК и ПВ-КК и последующему усилению ингибирования КП. Тогда правила модификации для ЗК и КК сходны с правилами для нейронов новой коры и гиппокампа [6].
Нейроны глубоких ядер мозжечка
Возбуждение поступает к нейронам ГЯМ по МВ и ЛВ. Знак модификации синаптического входа МВ-ГЯМ, как и входа ПВ-КП, зависит от концентрации Са2+ [98]. Для индукции ДПв, концентрация Са2+ не должна превышать определенного порогового значения [98]. В частности, можно индуцировать ДПв, подавляя ток через кальциевые каналы L-типа [96]. Эта ДПв является входо-специфичной, и ее индукции препятствует ингибирование СаМКII [98]. Эти данные указывают на то, что в основе ДПв на входе МВ-ГЯМ лежит фосфорилирование ионотропных глутаматных рецепторов. Поскольку в нейронах ГЯМ имеется цГМФ [28], на пластичность их входов может влиять ПКG. Высокочастотная стимуляция только МВ или сочетание стимуляции МВ с деполяризацией нейронов ГЯМ (при этом должна существенно увеличиться концентрация Са2+) приводили к индукции ДДв в синапсах МВ-ГЯМ [137]. Эта ДДв блокировалась при введении в постсинаптическую клетку хелатора Са2+, а для ее индукции требовалась активация мГлу1 рецепторов [135], которые связаны с Gq/11 белками, поэтому воздействие на них должно привести к выходу Са2+ из внутриклеточных депо.
Низкочастотная (10 Гц) стимуляция тормозного входа к нейронам ГЯМ приводила к индукции ДДт, для которой требовалось увеличение внутриклеточной концентрации Са2+ [92]. Судя по тому, что этот эффект наблюдался при блокировании НМДА-каналов, но требовал активации кальциевых каналов L-типа, для появления эффекта было достаточно небольшого увеличения концентрации Са2+. При поступлении высокочастотного пачечного разряда от КП в синапсах КП-ГЯМ индуцируется ДПт, но если при этом уменьшали возбуждение постсинаптической клетки (т.е. снижали концентрацию Са2+), индуцировалась ДДт [7]. В работе [94] также показано, что индукция ДПт на нейроне ГЯМ зависит от увеличения внутриклеточной концентрации Са2+. Из приведенных данных следует, что при относительно низкой внутриклеточной концентрации Са2+ правила модификации эффективности синаптических входов к нейронам ГЯМ, как и входов к КП, такие же, как у нейронов новой коры и гиппокампа.
По-видимому, если тормозное действие на нейроны ГЯМ со стороны КП слабое, концентрация Са2+ в них высока. Если в результате индукции ДПв на входе ПВ-КП тормозное действие КП на нейроны ГЯМ возрастает, внутриклеточная концентрация Са2+ в нейронах ГЯМ будет сравнительно небольшой. Тогда на входах МВ-ГЯМ будет индуцироваться ДПв, а на входах КП-ГЯМ – ДДт. То, что в индукции ДПв на нейронах ГЯМ участвует не только возбуждение, но и торможение, показано в работе [139]. Нейроны ГЯМ спонтанно активны даже без дополнительного возбуждения [139], причем увеличение спонтанной частоты срабатывания КП не уменьшает тоническую частоту разрядов нейронов ГЯМ [15], т.е. не приводит к ослаблению их возбуждения. Более того, если обычная тетанизация МВ не приводила к индукции ДПв на входе МВ-ГЯМ, то эффективность возбуждения увеличивалась при совпадении сигналов от МВ с тормозным входом от КП [99] и усилении торможения со стороны КП [134], причем ДПв в пути МВ-ГЯМ поддерживается столько времени, сколько длится торможение
Клетки-зерна
При высокочастотной стимуляции МВ на синаптическом входе МВ-КЗ наблюдалась индукция НМДА-зависимой ДПв [38, 80] и увеличение тока через АМПА и НМДА каналы [118]. Эти данные указывают на необходимость значительного увеличения концентрации Са2+ для индукции ДПв. Эта ДПв зависела также от активации ПКС и от NO, действующей ретроградно и способствующей выделению глутамата из МВ [38, 80]. Поскольку в КЗ имеется каскад NO–цГМФ–ПКG [68], в фосфорилировании рецепторов может участвовать ПКG
Торможение к КЗ поступает от КГ. На соме и дендритах КЗ имеются ГАМКа рецепторы, ток через которые зависит от входа Са2+ через НМДА-каналы [35]. При активации ПКА или ПКG ток через ГАМКа рецепторы депрессировался [35]. Активация ПКG уменьшала вероятность и время открывания ГАМКа каналов на КЗ, так что ток через них уменьшался [103]. Эти данные указывают на то, что фосфорилирование ГАМКа рецепторов приводит к депрессии торможения. Таким образом, правила модификации эффективности входов к КЗ аналогичны тем, которые характерны для нейронов новой коры и гиппокампа. Большое увеличении концентрации Са2+ в КЗ, вызванном открыванием НМДА-каналов, способствует индукции ДПв на входе МВ-КЗ и ДДт на входе КГ-КЗ. Показано, что пластичность в синапсах МВ-КЗ зависит от пластичности в синапсах КГ-КЗ [49]. Обычно на входах МВ-КЗ регистрировали ДДв, но в присутствии антагониста ГАМКа рецепторов преобладала ДПв [106]. Поскольку действие ГАМК может уменьшить величину ДПв в синапсах МВ-КЗ [41, 106], можно полагать, что пластичность входа находится под тормозным контролем со стороны КГ. Это торможение критически влияет на число разряжающихся КЗ. В стандартных условиях это число составляет 11%, но оно снижается до 3% при ДДв и увеличивается до 21% при ДПв в синапсах МВ-КЗ. При ослаблении торможения число разряжающихся КЗ может увеличиться до 50% [41]. Хотя число КЗ очень велико, в состоянии покоя большинство из них не разряжается. Поэтому было предположено, что индуцировать ДПв более вероятно, чем ДДв [111].
Интернейроны коры мозжечка
Обзор данных о пластичности синаптических входов к интернейронам коры мозжечка в гранулярном слое (КГ и УКК) и молекулярном слое (ЗК и КК) приведен в работе [49]. Показано, что в синапсах ПВ-ЗК/КК могут индуцироваться как постсинаптическая ДПв, так ДДв [100]. Входоспецифичная ДДв на входе ПВ-ЗК индуцировалась при низкочастотной стимуляции ПВ (2 Гц 60 с), а при сочетании с деполяризацией ЗК индуцировалась ДПв. При высокочастотной стимуляции (8 Гц 15 с) также могла индуцироваться ДПв, которая зависела от увеличении входа Са2+ через проницаемые для него АМПА рецепторы, а также от активности ПКА [100, 119]. Таким образом, правила модификации для ЗК и КК такие же, как для нейронов новой коры и гиппокампа. Полагают, что изменения эффективности синаптических входов ПВ-КК, ПВ-ЗК, как и входов ПВ-КП, тесно связаны с функциями, в контроле которых участвует мозжечок [65].
Клетки Гольджи являются пейсмекерами и преимущественно срабатывают в тета-ритме. Они влияют на пластичность в синапсах МВ-КЗ, поскольку контролируют деполяризацию КЗ и открывание НМДА каналов [36]. Возбуждение к КГ поступает от КЗ и из НО, а торможение – от КЛ, которых активируют ГАМКа рецепторы [44]. Высокочастотная стимуляция ПВ (т.е. большое увеличение концентрации Са2+) приводила к индукции гомосинаптической ДДв, причем показано, что эффект постсинаптический [102]. Ответ КГ на периферическую стимуляцию сильно уменьшался при одновременной активации ПВ и ЛВ [66]. Поскольку в фоне вход ПВ-КГ слабый, полагают, что периферическая активация НО и вход НО-КГ депрессирующе влияет на спайковую активность КГ [135]. Поскольку эффективность возбудительного входа ПВ-КГ уменьшается при сильном возбуждение, не исключено, что правила модификации этого входа аналогичны тем, которые характерны для КП и нейронов ГЯМ при большой концентрации Са2+, но противоположны тем, которые свойственны нейронам новой коры/гиппокампа.
Клетки Гольджи регулируют численность активных КЗ, время их срабатывания, когерентность разрядов, а также влияют на возможность индукцию ДПв в синапсах МВ-КЗ [47]. Имеются косвенные доказательства того, что пластичность на входе ПВ-КГ важна для моторного обучения [135]. Известно, что в состоянии покоя интернейроны более активны, чем КЗ [11], поэтому первоначально они более предрасположены к индукции ДДв. Депрессия возбуждения КГ должна приводить к ослаблению торможения КЗ и способствовать индукции на них ДПв. Если индукция ДПв на входе МВ-КЗ и на входе ПВ-КП развивается одновременно с индукцией ДДв на входах к интернейронам, можно ожидать, что при обучении активность КЗ возрастет.
ОСОБЕННОСТИ МОДУЛИРУЮЩЕГО ВЛИЯНИЯ ДОФАМИНА НА ЭФФЕКТИВНОСТЬ СИНАПТИЧЕСКИХ ВХОДОВ К НЕЙРОНАМ МОЗЖЕЧКА
Дофаминергические волокна иннервируют и гранулярный слой коры мозжечка, где располагаются КЗ и КГ [51], и молекулярный слой, в котором располагаются КП, ЗК и КК, причем плотность окончаний вблизи КП наибольшая [85]. Дофамин выделяется и в ГЯМ [79]. На нейронах мозжечка имеется несколько типов рецепторов, чувствительных к дофамину [67]. В частности, на КЗ имеются Д1 рецепторы [136], которые связаны с Gs белками. Воздействие на рецепторы такого типа должно приводить к повышению уровня цАМФ и активности ПКА. С учетом указанных выше особенностей постсинаптических процессов можно ожидать, что активация Д1 рецепторов на КЗ будет способствовать увеличению выраженности ДПв в синапсах МВ-КЗ, если концентрация Са2+ в них меньше определенного значения. На КЗ имеются также Д4 рецепторы, активация которых приводила к уменьшению входа Са2+ через потенциал-зависимые каналы [88]. Воздействие на связанные с Gi/0 белками Д4 рецепторы должно снижать концентрацию цАМФ в нейроне и уменьшать активность цАМФ-зависимой ПКА. Поэтому, если концентрация Са2+ в КЗ меньше определенного значения, при воздействии на Д4 рецепторы выраженность ДПв в синапсах МВ-КЗ может уменьшиться или будет индуцироваться ДДв. В ГЯМ Д1 рецепторы располагаются в основном на ГАМКергических клетках, которые как указано выше, проецируются в НО, и в меньшем количестве Д1 рецепторы присутствуют на глутаматергических клетках [79]. Если правила модуляции для этих ГАМКергических клеток такие же, как для нейронов новой коры и гиппокампа, активация Д1 рецепторов должна способствовать индукции ДПв на синаптических входах МВ-ГЯМ, а также на входах от МВ к тормозным нейронам ГЯМ. В результате в ГЯМ увеличится активность как тормозных нейронов, так и возбудительных.
На КП и нейронах ГЯМ, а также в слое, где располагаются КГ, обнаружены связанные с Gi/0 белками Д3 рецепторы [10, 84], причем на КП Д3 рецепторы располагаются только в дольках 9 и 10 [40]. Из правил модуляции следует, что при малых концентрациях Са2+ активация Д3 рецепторов должна уменьшать выраженность ДПв в синапсах ПВ-КП и МВ-ГЯМ. В результате активность КП и нейронов ГЯМ уменьшится. При больших концентрациях Са2+ активация Д3 рецепторов может уменьшить выраженность ДДв в указанных синапсах. Это приведет к увеличению активности КП и нейронов ГЯМ по сравнению с их активностью в отсутствие дофамина. Увеличение экспрессии мРНК c-fos в мозжечке крыс при использовании агониста Д3 рецепторов, наблюдавшееся в работе [62], что указывает на повышение активности нейронов мозжечка. Количество Д2 рецепторов в мозжечке мало и составляет примерно 4% от их плотности в стриатуме [82]. Если Д2 рецепторы располагаются на КП, их активация может препятствовать индукции ДПв или уменьшать ее выраженность. В этом случае активность КП снизится, а выделение ими ГАМК уменьшится. То, что активация Д2 рецепторов уменьшает синтез ГАМК в мозжечке, показано в работе [122], что указывает на снижение активности ГАМКергических клеток.
Из-за разного сродства рецепторов с дофамином, его действие на эффективность синаптических входов к нейронам мозжечка должно зависеть от концентрации. Известно, что рецепторы групп Д1 и Д2 могут находиться в состояниях высокой и низкой связываемости [127]. Показано, что Д1 рецепторы активировались дофамином, когда его концентрация была мала, тогда как Д2 рецепторы активировались только при увеличении концентрации дофамина [75]. Для активации Д3 рецепторов требовалась еще большая концентрация дофамина, так как эффективность активации Д3 рецепторов дофамином в 2–5 раз меньше, чем Д2 рецепторов [30]. Оба типа рецепторов Д2 и Д3 могут экспрессироваться в одной клетке, так что воздействие на них усиливает эффект снижения активности цАМФ [30].
Показано, что по мере обучения с подкреплением меняется активность КЗ, которые составляют половину от всех клеток мозга и реагируют как на условный сенсорный стимул, так и безусловный подкрепляющий стимул [19, 128]. По мере прогресса обучения у двух третей зарегистрированных КЗ наблюдался ответ, обусловленный подкреплением [52]. Поскольку подкрепление обычно приводит к выделению дофамина и поскольку у Д1 рецепторов высокое сродство с дофамином, то даже при низкой концентрации они могут активироваться и способствовать увеличению активности КЗ. При этом изменится функционирование всей нейронной сети мозжечка. То, что выходной сигнал из мозжечка ассоциируется с сигналом подкрепления из ВПП, показано в работе [57].
ПРАВИЛА МОДИФИКАЦИИ И ДОФАМИН-ЗАВИСИМОЙ МОДУЛЯЦИИ ЭФФЕКТИВНОСТИ СИНАПТИЧЕСКИХ ВХОДОВ К НЕЙРОНАМ ТАЛАМУСА И СУБТАЛАМИЧЕСКОГО ЯДРА
Эффективность возбудительных синаптических входов к нейронам таламуса может потенциироваться. Так, показано, что высокочастотная стимуляция вызывает ДПв в нейронах вентропостеролатерального ядра таламуса [108]. Стимуляция прямого синаптического входа из гиппокампа в передние ядра таламуса также может вызывать ДПв [125]. Поскольку показано, что ДПв на синаптических входах в таламус связана с фосфорилированием ионотропных глутаматных рецепторов протеинкиназами: ПКА, ПКС и СаМКII [132], можно полагать, что правила модификации возбудительной синаптической передачи в таламусе такие же, как в новой коре и гиппокампе.
В таламус также поступает дофаминергическая иннервация. В частности, дофаминергические волокна обнаружены в медиодорзальном ядре таламуса, которое связано с ПфК [86]. На нейронах латеральных ядер таламуса имеются Д1 и Д2 рецепторы, причем в согласии с правилами модуляции показано, что воздействие на них оказывает разнонаправленные эффекты [129]. Согласно правилам модуляции, активация Д2 рецепторов должна способствовать индукции ДДв и приводить к снижению количества разрядов таламических клеток. Действительно, активация Д2 рецепторов на нейронах паравентрикулярного ядра и вентральных срединных ядер таламуса уменьшала спайковую активность этих нейронов [31].
Синаптические входы к нейронам СТЯ также модифицируются. Высокочастотная стимуляция входов в СТЯ приводит к индукции ДПв, причем этот эффект зависел от активации НМДА рецепторов и являлся постсинаптическим [112]. Таким образом, правила модификации возбудительной синаптической передачи для СТЯ такие же, как для новой коры и гиппокампа. В модуляции синаптического входа к нейронам СТЯ участвует дофамин. В согласии с правилами модуляции показано, что активация связанных с Gs белками Д5 рецепторов усиливала активность подгруппы нейронов СТЯ, которые генерируют пачечные разряды, и что этот эффект связан с активацией ПКА [13]. Поскольку возбуждение из СТЯ, поступающее к КЗ, увеличивает их активность (см. выше), выделение дофамина в СТЯ должно способствовать этому эффекту.
ВЗАИМОДЕЙСТВИЕ МОЗЖЕЧКА, БАЗАЛЬНЫХ ГАНГЛИЕВ И НОВОЙ КОРЫ ПРИ ВЫДЕЛЕНИИ ДОФАМИНА
Взаимодействия между пластическими процессами в мозжечке, новой коре и БГ, которые формируют интегрированную систему, лежащую в основе ряда моторных и когнитивных функций, обсуждаются в работе [22]. Предлагаемый в настоящей работе механизм базируется на других принципах. Из этого механизма следует, что активность нейронов ГЯМ больше и, следовательно, больше их возбуждающее влияние на нейроны таламуса в отсутствие сигнала из НО. Этот вывод противоречит широко распространенной точке зрения, что сигнал из НО необходим для обучения и выполнения движения, поскольку облегчает индукцию ДДв в синапсах ПВ-КП, последующему ослаблению тормозного действия на нейроны ГЯМ и увеличению их активности. В пользу предложенного нами механизма свидетельствуют данные о том, что для моторного обучения не требуется индукция ДДв на КП и что двигательное обучение нарушается после блокады ДПв на КП [110], а не ДДв, как следует из лющепринятого механизма. Для вестибуло-окулярного рефлекса индукция ДДв в синапсах ПВ-КП также не требовалась [61]. Более того, ДДв в синапсах ПВ-КП подавляла сигналы, управляющие движением глаз, тогда как ДПв их усиливала [61, 62]. Отмечено, что нет прямых доказательств участия входа из НО в выполнении движения, которое подкрепляется [87]. Двигательное обучение у обезьян наблюдалось и без инструктирующего сигнала из НО [71].
Как указано выше, у генно-модифицированных мышей с отсутствием КП выделение дофамина в ПфК, вызванное электрической стимуляцией ЗЯМ, было на 60% меньше, чем у нормальных мышей [90]. Этот эффект свидетельствует в пользу предлагаемого механизма, согласно которому наличие тормозного входа от КП способствует индукции ДПв в синапсах МВ-ГЯМ, увеличению активности нейронов ГЯМ и последующему возбуждению дофаминергических клеток. В отсутствие входа от КП будет меньше и активность нейронов ГЯМ. Следовательно, снизится их возбуждающее действие на дофаминергические клетки.
Ранее нами было указано на то, что и в отсутствие дофамина модификация возбудительных и тормозных синаптических входов к нейронам мозжечка может происходить одновременно и взаимозависимо [5, 115]. Аналогичное предположение было сделано позднее в работах [49, 81]. Как указывалось выше, при небольших концентрациях дофамина активируются Д1 рецепторы. Если вход МВ-КЗ первоначально не был сильным, активация Д1 рецепторов на КЗ, а также на возбудительных и тормозных нейронах ГЯМ может способствовать увеличению их активности. Поскольку тормозные нейроны ГЯМ проецируются в НО, увеличится торможение клеток НО и уменьшится их возбуждающее действие на нейроны ГЯМ. При этом уровень Са2+ в нейронах ГЯМ будет относительно низким, на входе МВ-ГЯМ сможет индуцироваться ДПв и активность нейронов ГЯМ возрастет. В результате увеличится их возбуждающее влияние на таламус, а через него на новую кору и стриатум. Блокада Д1 рецепторов должна приводить к противоположному эффекту. Действительно показано, что блокада Д1 рецепторов приводит к снижению активности нейронов в медиальной фронтальной коре и ухудшению выполнения поведенческой задачи [58]. О важной роли тормозных нейронов ГЯМ свидетельствует тот факт, что их избирательное ингибирование приводит к нарушению пространственной навигации [79].
Поскольку при высоких концентрациях дофамина смогут активироваться Д3 рецепторы, выраженность ДПв в синапсах МВ-ГЯМ должна снизиться. В результате уменьшится возбуждение нейронов таламуса, а также их клеток-мишеней в новой коре и стриатуме. По-видимому, такой механизм может лежать в основе данных о том, что введение агониста Д2/Д3 рецепторов в дольки 9 и 10 мозжечка снижает локомоторную активность [9].
Нейроны ГЯМ могут влиять на активность нейронных цепей К–БГ–Т–К, включающих моторные, зрительные и слуховые области новой коры, поскольку через ядра таламуса возбуждают клетки новой коры, шипиковые клетки стриатума и дофаминергические нейроны. Показано, что таламо-стриатный вход оказывает существенное влияние на активность шипиковых клеток [64]. Стимуляция дисинаптического пути из мозжечка в стриатум через вентролатеральное ядро таламуса меняла коротколатентные (около 10 мс) ответы примерно у половины нейронов стриатума [29]. Если изолированная высокочастотная стимуляция коры приводила к ДДв на кортико-стриатном входе, то одновременная стимуляция коры и мозжечка меняла знак модификации на ДПв [29]. Как следует из предложенного нами механизма функционирования БГ [116], улучшение условий модификации кортико-стриатных входов способствует синергичному растормаживанию по прямому и непрямому пути через БГ нейронов таламуса, СТЯ и ППЯ. Поскольку нейроны СТЯ и ППЯ возбуждают дофаминергические клетки, активность последних должна возрасти.
Методом визуализации показано, что при различных стратегиях улучшения выполнения задачи в активность вовлекаются разные участки цепей БГ–мозжечок–новая кора [45], причем активность топографически связанных БГ, мозжечка и новой коры меняется во время обучения. Вначале активируется цепь, включающая вентромедиальную ПфК, вентральный стриатум, заднюю часть мозжечка. По мере прогресса обучения активируется ассоциативная когнитивная цепь, включающая дорзолатеральную ПфК, дорзомедиальный стриатум и латеральную заднюю часть мозжечка. Затем активность смещается в моторную часть цепи, которая включает дополнительную моторную область коры, скорлупу стриатума и переднюю часть мозжечка [18]. Известно, что выбор и параметры движения регулируются мотивацией. С помощью метода визуализации показано, что активация мозжечка коррелирует с параметрами движения, которые модулируются мотивацией [126].
ЗАКЛЮЧЕНИЕ
Анализ особенностей взаимодействий в нейронных сетях, включающих мозжечок, БГ и новую кору, представляет интерес в связи с тем, что нарушения функционирования этих цепей связаны с различными заболеваниями. Так, перенос аномальной активности мозжечка в БГ может привести к дистонии [29]. Анормальное функционирование цепи, которая включает хвостатое ядро стриатума, латеральную часть мозжечка и дорзолатеральную ПфК, ассоциируют с когнитивной дисфункцией при болезни Альцгеймера [138] и состоянии тревожности [26]. Червь мозжечка участвует в процессах, связанных с эмоциональной памятью и с двигательными ответами на эмоционально значимые стимулы. Нарушения функционирования этой структуры ассоциируют с аутизмом и шизофренией [123]. Проведенный в настоящей работе анализ возможных механизмов взаимосвязанного функционирования указанных структур может быть полезен для поиска подходов к лечению некоторых неврологических заболеваний.
Список литературы
Калиниченко С.Г., Охотин В.Е. Униполярные кисточковые клетки – новый тип возбудительных интернейронов коры мозжечка и улитковыых ядер мозгового ствола // Морфология. 2003. Т. 124. № 6. С. 7–21.
Мелик-Мусян А.Б., Фанарджян В.В. Морфологические особенности клеток Лугаро коры мозжечка // Морфология. 2003. Т. 123. № 2. С. 42–47.
Силькис И.Г. Унифицированный постсинаптический механизм пластичности в стриатуме, новой коре, гиппокампе и мозжечке // Росс. физиол. журн. им. И.М. Сеченова. 2000. Т. 86. № 5. С. 519–531.
Силькис И.Г. Механизм модификации возбудительных и тормозных входов к различным нейронам оливо-мозжечковой сети // Журн. высш. нерв. деят. им. И.П. Павлова. 2000. Т. 50. № 3. С. 372–387.
Силькис И.Г. Взаимозависимая модификации возбудительных и тормозных связей в оливо-мозжечковой нейронной сети // Журн. высш. нерв. деят. им. И.П. Павлова. 2000. Т. 50. № 6. С. 899–912.
Силькис И.Г. Унифицированный постсинаптический механизм влияния различных нейромодуляторов на модификацию возбудительных и тормозных входов к нейронам гиппокампа (Гипотеза) // Успехи физиол. наук. 2002. Т. 33. № 1. С. 40–56.
Aizenman C.D., Manis P.B., Linden D.J. Polarity of long-term synaptic gain change is related to postsynaptic spike firing at a cerebellar inhibitory synapse // Neuron. 1998. V. 21. № 4. P. 827–835.
Bagnall M.W., du Lac S. A new locus for synaptic plasticity in cerebellar circuits // Neuron. 2006. V. 51. № 1. P. 5–7.
Barik S., de Beaurepaire R. Dopamine D3 modulation of locomotor activity and sleep in the nucleus accumbens and in lobules 9 and 10 of the cerebellum in the rat. Prog Neuropsychopharmacol // Biol. Psychiatry. 2005. V. 29. № 5. P. 718–726.
Barili P., Bronzetti E., Ricci A. et al. Microanatomical localization of dopamine receptor protein immunoreactivity in the rat cerebellar cortex // Brain Res. 2000. V. 854. № 1–2. P. 130–138.
Barmack N.H., Yakhnitsa V. Functions of interneurons in mouse cerebellum // J. Neurosci. 2008. V. 28. № 5. P. 1140–1152.
Barnstable C.J., Wei J.Y., Han M.H. Modulation of synaptic function by cGMP and cGMP-gated cation channels // Neurochem. Int. 2004. 45. № 6. P. 875–884.
Baufreton J., Garret M., Rivera A. et al. D5 (not D1) dopamine receptors potentiate burst-firing in neurons of the subthalamic nucleus by modulating an L-type calcium conductance // J. Neurosci. 2003. V. 23. № 3. P. 816–825.
Belmeguenai A., Hansel C. A role for protein phosphatases 1, 2A, and 2B in cerebellar long-term potentiation // J. Neurosci. 2005. V. 25. № 46. P. 10768–10772.
Belmeguenai A., Hosy E., Bengtsson F. et al. Intrinsic plasticity complements long-term potentiation in parallel fiber input gain control in cerebellar Purkinje cells // J. Neurosci. 2010. V. 30. № 41. P. 13630–13643.
Bengtsson F., Hesslow G. Cerebellar control of the inferior olive // Cerebellum (Norway). 2006. V. 5. № 1. P. 7–14.
Bostan A.C., Dum R.P., Strick P.L. Cerebellar networks with the cerebral cortex and basal ganglia // Trends Cogn. Sci. 2013. V. 17. P. 241–254.
Bostan A.C., Strick P.L. The basal ganglia and the cerebellum: nodes in an integrated network // Nat. Rev. Neurosci. 2018. V. 19. № 6. P. 338–350.
Bray N. Cerebellum: The little learning brain // Nat. Rev. Neurosci. 2017. V. 18. № 5. P. 263.
Brodal P., Bjaalie J.G. Salient anatomic features of the cortico-ponto-cerebellar pathway // Prog. Brain Res. 1997. V. 114. P. 227–249.
Caligiore D., Arbib M.A., Miall R.C., Baldassarre G. The super-learning hypothesis: Integrating learning processes across cortex, cerebellum and basal ganglia // Neurosci. Biobehav. Rev. 2019. V. 100. P. 19–34.
Caligiore D., Pezzulo G., Baldassarre G. et al. Consensus paper: towards a systems-level view of cerebellar function: the interplay between cerebellum, basal ganglia, and cortex // Cerebellum 2017. V. 16. № 1. P. 203–229.
Carpenter M.B., Carleton S.C., Keller J.T., Conte P. Connections of the subthalamic nucleus in the monkey // Brain Res. 1981. V. 224. № 1. P. 1–29.
Carta I., Chen C.H., Schott A.L. et al. Cerebellar modulation of the reward circuitry and social behavior // Science. 2019. V. 363. № 6424. eaav0581.
Cauda F., Geminiani G., D’Agata F. et al. Functional connectivity and coactivation of the nucleus accumbens: a combined functional connectivity and structure-based meta-analysis // J. Cogn. Neurosci. 2011. V. 23. P. 2864–2877.
Caulfield M.D., Zhu D.C., McAuley J.D., Servatius R.J. Individual differences in resting-state functional connectivity with the executive network: support for a cerebellar role in anxiety vulnerability // Brain Struct. Funct. 2016. V. 221. № 6. P. 3081–3093.
Cavdar S., Özgür M., Çakmak Y.Ö. et al. Afferent projections of the subthalamic nucleus in the rat: emphasis on bilateral and interhemispheric connections // Acta Neurobiol. Exp. (Wars). 2018. V. 78. № 3. P. 251–263.
Chan-Palay V., Palay S.L. Immunocytochemical localization of cyclic GMP: light and electron microscope evidence for involvement of neuroglia // Proc. Natl. Acad. Sci. USA. 1979. V. 76. № 3. P. 1485–1488.
Chen C.H., Fremont R., Arteaga-Bracho E.E., Khodakhah K. Short latency cerebellar modulation of the basal ganglia // Nat. Neurosci. 2014. V. 17. № 12. P. 1767–1775.
Chio C.L., Lajiness M.E., Huff R.M. Activation of heterologously expressed D3 dopamine receptors: comparison with D2 dopamine receptors // Mol. Pharmacol. 1994. V. 45. № 1. P. 51–60.
Clark A.M., Leroy F., Martyniuk K.M, et al. Dopamine D2 receptors in the paraventricular thalamus attenuate cocaine locomotor sensitization // eNeuro. 2017. V. 4. № 5. ENEURO.0227-17. 2017.
Coesmans M., Weber J.T., De Zeeuw C.I., Hansel C. Bidirectional parallel fiber plasticity in the cerebellum under climbing fiber control // Neuron. 2004. V. 44. № 4. P. 691–700.
Correia S.S., Duarte C.B., Faro C.J. et al. Protein kinase C gamma associates directly with the GluR4 alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate receptor subunit. Effect on receptor phosphorylation // J. Biol. Chem. 2003. V. 278. № 8. P. 6307–6313.
Cover K.K., Gyawali U., Kerkhoff W.G. et al. Activation of the rostral intralaminar thalamus drives reinforcement through striatal dopamine release // Cell Rep. 2019. V. 26. № 6. P. 1389–1398.
Cupello A., Robello M. GABA(A) receptor modulation in rat cerebellum granule cells // Recept. Channels. 2000. V. 7. № 2. P. 151–171.
D'Angelo E. The critical role of Golgi cells in regulating spatio-temporal integration and plasticity at the cerebellum input stage // Front. Neurosci. 2008. V. 2. № 1. P. 35-46.
D'Angelo E., Mapelli L., Casellato C. et al. Distributed circuit plasticity: new clues for the cerebellar mechanisms of learning // Cerebellum. 2016. V. 15. № 2. P. 139–151.
D'Angelo E., Rossi P., Gall D. et al. Long-term potentiation of synaptic transmission at the mossy fiber-granule cell relay of cerebellum // Prog. Brain Res. 2005. V. 148. P. 69–80.
D'Angelo E., Solinas S., Mapelli J. et al. The cerebellar Golgi cell and spatiotemporal organization of granular layer activity // Front. Neural Circuits. 2013. V. 7. Article 93.
Diaz J., Lévesque D., Lammers C.H. et al. Phenotypical characterization of neurons expressing the dopamine D3 receptor in the rat brain // Neuroscience. 1995. V. 65. № 3. P. 731–745.
Diwakar S., Lombardo P., Solinas S. et al. Local field potential modeling predicts dense activation in cerebellar granule cells clusters under LTP and LTD control // PLoS One. 2011. V. 6. № 7. P. e21928.
Doya K. Complementary roles of basal ganglia and cerebellum in learning and motor control. This opinion paper provides a perspective on the learning-oriented specializations of the basal ganglia and the cerebellum // Curr. Opin. Neurobiol. 2000. V. 10. № 6. P. 732–739.
Dugué G.P., Dumoulin A., Triller A., Dieudonné S. Target-dependent use of co-released inhibitory transmitters at central synapses // J. Neurosci. 2005. V. 25. № 28. P. 6490–6498.
Eyre M.D., Nusser Z. Only a Minority of the inhibitory inputs to cerebellar golgi cells originates from local GABAergic cells // eNeuro. 2016. V. 3. № 2. ENEURO.0055-16.2016.
Fermin A.S., Yoshida T., Yoshimoto J. et al. Model-based action planning involves cortico-cerebellar and basal ganglia networks // Sci. Rep. 2016.V. 6. P. 31378.
Fredette B.J., Mugnaini E. The GABAergic cerebello-olivary projection in the rat // Anat. Embryol. (Berl). 1991. V.184. № 3. P. 225–243.
Galliano E., Mazzarello P., D’Angelo E. Discovery and rediscoveries of Golgi cells // J. Physiol. 2010. V. 588. Pt 19. P. 3639–3655.
Gao Z., Proietti-Onori M., Lin Z. et al. Excitatory cerebellar nucleocortical circuit provides internal amplification during associative conditioning // Neuron. 2016. V. 89. № 3. P. 645–657.
Gao Z., van Beugen B.J., De Zeeuw C.I. Distributed synergistic plasticity and cerebellar learning // Nat. Rev. Neurosci. 2012. V. 13. № 9. P. 619–635.
Giolli R.A., Gregory K.M., Suzuki D.A. et al. Cortical and subcortical afferents to the nucleus reticularis tegmenti pontis and basal pontine nuclei in the macaque monkey // Vis. Neurosci. 2001. V. 18. № 5. P. 725–740.
Giompres P, Delis F. Dopamine transporters in the cerebellum of mutant mice // Cerebellum. 2005. V. 4. № 2. P. 105–111.
Giovannucci A., Badura A., Deverett B. et al. Cerebellar granule cells acquire a widespread predictive feedback signal during motor learning // Nat. Neurosci. 2017. V. 20. № 5. P. 727–734.
Glickstein M. Mossy-fibre sensory input to the cerebellum // Prog. Brain Res. 1997. V. 114. P. 251–259.
Guell X., D’Mello A.M., Hubbard N.A. et al. Functional territories of human dentate nucleus // Cereb Cortex. 2020. V. 30. № 4. P. 2401–2417.
Hartell N.A. Inhibition of cGMP breakdown promotes the induction of cerebellar long-term depression // J. Neurosci. 1996. V. 16. № 9. P. 2881–2890.
Hashimoto K., Kano M. Calcium dependent forms of synaptic plasticity in cerebellar Purkinje cells // Clin. Calcium. 2001. V. 11. № 11. P. 1432–1439.
Heffley W., Hull C. Classical conditioning drives learned reward prediction signals in climbing fibers across the lateral cerebellum // Elife. 2019. V. 8. e46764.
Heskje J., Heslin K., De Corte B.J. et al. Cerebellar D1DR-expressing neurons modulate the frontal cortex during timing tasks // Neurobiol. Learn. Mem. 2020. V. 170. P. 107067.
Holloway Z.R., Paige N.B., Comstock J.F. et al. Cerebellar modulation of mesolimbic dopamine transmission is functionally asymmetrical // Cerebellum. 2019. V. 18. № 5. P. 922–931.
Hoshi E., Tremblay L., Feger J. et al. The cerebellum communicates with the basal ganglia // Nat. Neurosci. 2005. V. 8. P. 1491–1493.
Inagaki K., Hirata Y. Computational theory underlying acute vestibulo-ocular reflex motor learning with cerebellar long-term depression and long-term potentiation // Cerebellum. 2017. V. 16. № 4. P. 827–839.
Ishibashi T., Wakabayashi J., Ohno Y. 7-Hydroxy-N,N'-di-n-propyl-2-aminotetraline, a preferential dopamine D3 agonist, induces c-fos mRNA expression in the rat cerebellum // Jpn. J. Pharmacol. 2002. V. 89. № 3. P. 309–315.
Isope P., Barbour B. Properties of unitary granule cell–Purkinje cell synapses in adult rat cerebellar slices // J. Neurosci. 2002. V. 22. № 22. P. 9668–9678.
Johnson K.A., Mateo Y., Lovinger D.M. Metabotropic glutamate receptor 2 inhibits thalamically-driven glutamate and dopamine release in the dorsal striatum // Neuropharmacology. 2017. V. 117. P. 114–123.
Jörntell H. Cerebellar synaptic plasticity and the credit assignment problem // Cerebellum. 2016. V. 15. № 2. P. 104–111.
Jörntell H., Ekerot C.F. Receptive field plasticity profoundly alters the cutaneous parallel fiber synaptic input to cerebellar interneurons in vivo // J. Neurosci. 2003. V. 23. № 29. P. 9620–9631.
Joseph B., Nandhu M.S., Paulose C.S. Dopamine D1 and D2 receptor functional down regulation in the cerebellum of hypoxic neonatal rats: neuroprotective role of glucose and oxygen, epinephrine resuscitation // Pharmacol. Res. 2010. V. 61. № 2. P. 136–141.
Jurado S., Sánchez-Prieto J., Torres M. Elements of the nitric oxide/cGMP pathway expressed in cerebellar granule cells: biochemical and functional characterisation // Neurochem. Int. 2004. V. 45. № 6. P. 833–843.
Kawaguchi S.Y., Hirano T. Signaling cascade regulating long-term potentiation of GABA(A) receptor responsiveness in cerebellar Purkinje neurons // J. Neurosci. 2002. V. 22. № 10. P. 3969–3976.
Kawaguchi S.Y., Hirano T. Gating of long-term depression by Ca2+/calmodulin-dependent protein kinase II through enhanced cGMP signalling in cerebellar Purkinje cells // J. Physiol. 2013. V. 591. № 7. P. 1707–1730.
Ke M.C., Guo C.C., Raymond JL. Elimination of climbing fiber instructive signals during motor learning // Nature Neurosci. 2009. V. 12. № 9. P. 1171–1179.
Kelly R.M., Strick P.L. Cerebellar loops with motor cortex and prefrontal cortex of a nonhuman primate // J. Neurosci. 2003. V. 23. № 23. P. 8432–8444.
Kitai S.T., Kita H. in: The Basal Ganglia II. // Advances in Behavioral Biology V. 32 (eds. Carpenter M.B. & Jayaraman A.) Springer. Boston, 1987. P. 357–373.
Kono M., Kakegawa W., Yoshida K., Yuzaki M. Interneuronal NMDA receptors regulate long-term depression and motor learning in the cerebellum // J. Physiol. 2019. V. 597. № 3. P. 903–920.
Korchounov A., Meyer M.F., Krasnianski M. Postsynaptic nigrostriatal dopamine receptors and their role in movement regulation // J. Neural Transm. (Vienna). 2010. V. 117. № 12. P. 1359–1369.
Krishek B.J., Xie X., Blackstone C., Huganir R.L. et al. Regulation of GABAA receptor function by protein kinase C phosphorylation // Neuron. 1994. V. 12. № 5. P. 1081–1095.
Lamont M.G., Weber J.T. The role of calcium in synaptic plasticity and motor learning in the cerebellar cortex // Neurosci. Biobehav. Rev. 2012. V. 36. № 4. P. 1153–1162.
Lee H.S., Kosinski R.J., Mihailoff G.A. Collateral branches of cerebellopontine axons reach the thalamus, superior colliculus, or inferior olive: a double-fluorescence and combined fluorescence-horseradish peroxidase study in the rat // Neuroscience. 1989. V. 28. № 3. P. 725–734.
Locke T.M., Soden M.E., Miller S.M. et al. Dopamine D(1) receptor-positive neurons in the lateral nucleus of the cerebellum contribute to cognitive behavior // Biol. Psychiatry.2018. V. 84. № 6. P. 401–412.
Maffei A., Prestori F., Shibuki K. et al. NO enhances presynaptic currents during cerebellar mossy fiber-granule cell LTP // J. Neurophysiol. 2003. V. 90. № 4. P. 2478–2483.
Mapelli L., Pagani M., Garrido J.A., D’Angelo E. Integrated plasticity at inhibitory and excitatory synapses in the cerebellar circuit // Front. Cell. Neurosci. 2015. V. 9. Article 169.
Martres M.P., Sales N., Bouthenet M.L., Schwartz J.C. Localisation and pharmacological characterisation of D-2 dopamine receptors in rat cerebral neocortex and cerebellum using [125I]iodosulpride // Eur. J. Pharmacol. 1985. V. 118. № 3. P. 211–219.
McDonald B.J., Moss S.J. Differential phosphorylation of intracellular domains of gamma-aminobutyric acid type A receptor subunits by calcium/calmodulin type 2-dependent protein kinase and cGMP-dependent protein kinase // J. Biol. Chem. 1994. V. 269. № 27. P. 18111–18117.
Mehdizadeh M., Ashtari N., Jiao X. et al. Alteration of the dopamine receptors' expression in the cerebellum of the lysosomal acid phosphatase 2 mutant (Naked-Ataxia (NAX)) mouse // Int. J. Mol. Sci. 2020. V. 21. № 8. P. 2914.
Melchitzky D.S., Lewis D.A. Tyrosine hydroxylase- and dopamine transporter-immunoreactive axons in the primate cerebellum. Evidence for a lobular- and laminar-specific dopamine innervation // Neuropsychopharmacology. 2000. V. 22. № 5. P. 466–472.
Melchitzky D.S., Lewis D.A. Dopamine transporter-immunoreactive axons in the mediodorsal thalamic nucleus of the macaque monkey // Neuroscience. 2001. V. 103. № 4. P. 1033–1042.
Medina J.F. Teaching the cerebellum about reward // Nat. Neurosci. 2019. V. 22. № 6. P. 846–848.
Mei Y.A., Griffon N., Buquet C. et al. Activation of dopamine D4 receptor inhibits an L-type calcium current in cerebellar granule cells // Neuroscience. 1995. V. 68. № 1. P. 107–116.
Mihailoff G.A. Identification of pontocerebellar axon collateral synaptic boutons in the rat cerebellar nuclei // Brain Res. 1994. V. 648. № 2. P. 313–318.
Mittleman G., Goldowitz D., Heck D.H., Blaha C.D. Cerebellar modulation of frontal cortex dopamine efflux in mice: relevance to autism and schizophrenia // Synapse. 2008. V. 62. № 7. P. 544–550.
Moon C., Jaberi P., Otto-Bruc A. et al. Calcium-sensitive particulate guanylyl cyclase as a modulator of cAMP in olfactory receptor neurons // J. Neurosci. 1998. V. 18. № 9. P. 3195–3205.
Morishita W., Sastry B. Postsynaptic mechanisms underlying long term depression of gabaergic transmission in neurons of the deep cerebellar nuclei // J. Neurophysiol. 1996. V. 76. № 1. P. 59–68.
Moss, S.J., Smart, T.G., Blackstone C.D., Huganir R.L. Functional modulation of GABAA rcccptors by CAMP-dcpendent protein phosphorylation // Science. 1992. V. 257. № 5070. P. 661–665.
Ouardouz M., Sastry B.R. Mechanisms underlying LTP of inhibitory synaptic transmission in the deep cerebellar nuclei // J. Neurophysiol. 2000. V. 84. № 3. P. 1414–1421.
Özcan O.O., Wang X., Binda F. et al. Differential coding strategies in glutamatergic and gabaergic neurons in the medial cerebellar nucleus // J. Neurosci. 2020. V. 40. № 1. P. 159–170.
Person A.L., Raman I.M. Deactivation of L-type Ca current by inhibition controls LTP at excitatory synapses in the cerebellar nuclei // Neuron. 2010. V. 66. № 4. P. 550–569.
Ploghaus A., Tracey I., Clare S. et al. Learning about pain: the neural substrate of the prediction error for aversive events // Proc. Natl. Acad. Sci. USA. 2000. V. 97. № 16. P. 9281–9286.
Pugh J.R., Raman I.M. Mechanisms of potentiation of mossy fiber EPSCs in the cerebellar nuclei by coincident synaptic excitation and inhibition. Version 2 // J. Neurosci. 2008. V. 28. № 42. P. 10549–10560.
Pugh J.R., Raman I.M. Nothing can be coincidence: synaptic inhibition and plasticity in the cerebellar nuclei // Trends Neurosci. 2009. V. 32. № 3. P. 170–177.
Rancillac A., Crépel F. Synapses between parallel fibres and stellate cells express long-term changes in synaptic efficacy in rat cerebellum // J. Physiol. 2004. V. 554. Pt. 3. P. 707-720.
Ren S.Q., Yan J.Z., Zhang X.Y. et al. PKCλ is critical in AMPA receptor phosphorylation and synaptic incorporation during LTP // EMBO J. 2013. V. 32. № 10. P. 1365–1380.
Robberechts Q., Wijnants M., De Schutter E. Long-term depression at parallel fiber to Golgi cell synapses // J. Neurophysiol. 2010. V. 104. № 6. P. 3413–3423.
Robello M., Amico C., Cupello A. Cerebellar granule cell GABA(A) receptors studied at the single-channel level: modulation by protein kinase G // Biochem. Biophys. Res. Commun. 1998. V. 253. № 3. P. 768–773.
Rogers T.D., Dickson P.E., Heck D.H. et al. Connecting the dots of the cerebro-cerebellar role in cognitive function: neuronal pathways for cerebellar modulation of dopamine release in the prefrontal cortex // Synapse. 2011. V. 65. № 11. P. 1204–12.
Rogers T.D., Dickson P.E., McKimm E. et al. Reorganization of circuits underlying cerebellar modulation of prefrontal cortical dopamine in mouse models of autism spectrum disorder // Cerebellum. 2013. V. 12. № 4. P. 547–556.
Roggeri L., Rivieccio B., Rossi P., D’Angelo E. Tactile stimulation evokes long-term synaptic plasticity in the granular layer of cerebellum // J. Neurosci. 2008. V. 28. № 25. P. 6354–6359.
Sachidanandan D., Reddy H.P., Mani A. et al. The neuropeptide orexin-a inhibits the GABAA receptor by pkc and Ca2+/CaMKII-dependent phosphorylation of its β1 subunit // J. Mol. Neurosci. 2017. V. 61. № 4. P. 459–467.
Sanoja R., Taepavarapruk N., Benda E. et al. Enhanced excitability of thalamic sensory neurons and slow-wave EEG pattern after stimuli that induce spinal long-term potentiation // J. Neurosci. 2013. V. 33. № 38. P. 15109–15119.
Sarpong G.A., Vibulyaseck S., Luo Y. et al. Cerebellar modules in the olivo-cortico-nuclear loop demarcated by pcdh10 expression in the adult mouse // J. Comp. Neurol. 2018. V. 526. № 15. P. 2406–2427.
Schonewille M., Gao Z., Boele H.J. et al. Reevaluating the role of LTD in cerebellar motor learning // Neuron. 2011. V. 70. № 1. P. 43–50.
Seja P., Schonewille M., Spitzmaul G. et al. Raising cytosolic Cl− in cerebellar granule cells affects their excitability and vestibulo-ocular learning // EMBO J. 2012. V. 31. № 5. P. 1217–1230.
Shen K.Z., Zhu Z.T., Munhall A., Johnson S.W. Synaptic plasticity in rat subthalamic nucleus induced by high-frequency stimulation // Synapse. 2003. V. 50. № 4. P. 314–319.
Shinoda Y., Sugihara I., Wu H.S., Sugiuchi Y. The entire trajectory of single climbing and mossy fibers in the cerebellar nuclei and cortex // Prog. Brain Res. 2000. V. 124. P. 173–186.
Silkis I.G. The unitary modification rules for neural networks with excitatory and inhibitory synaptic plasticity // Biosystems. 1998. V.48. № 1–3. P. 205–213.
Silkis I. Interrelated modification of excitatory and inhibitory synapses in three-layer olivary-cerebellar neural network // Biosystems. 2000. V. 54. № 3. P. 141–149.
Silkis I. The cortico-basal ganglia-thalamocortical circuit with synaptic plasticity. II. Mechanism of synergistic modulation of thalamic activity via the direct and indirect pathways through the basal ganglia // Biosystems. 2001. V. 59. № 1. P. 7–14.
Silkis I. A hypothetical role of cortico-basal ganglia-thalamocortical loops in visual processing // Biosystems. 2007. V. 89. № 1–3. P. 227–235.
Sola E., Prestori F., Rossi P. et al. Increased neurotransmitter release during long-term potentiation at mossy fibre-granule cell synapses in rat cerebellum // J. Physiol. 2004. V. 557. Pt. 3. P. 843–861.
Soler-Llavina G.J., Sabatini B.L. Synapse-specific plasticity and compartmentalized signaling in cerebellar stellate cells // Nature Neurosci. 2006. V. 9. № 6. P. 798–806.
Song Q., Zheng H.W., Li X.H. et al. Selective Phosphorylation of AMPA receptor contributes to the network of long-term potentiation in the anterior cingulate cortex // J. Neurosci. 2017. V. 37. № 35. P. 8534–8548.
Stern E.A., Kincaid A.E., Wilson C.J. Spontaneous subthreshold membrane potential fluctuations and action potential variability of rat corticostriatal and striatal neurons in vivo // J. Neurophysiol. 1997. V. 77. P. 1697–1715.
Steulet A.F., Bernasconi R., Leonhardt T. et al. Effects of selective dopamine D1 and D2 receptor agonists on the rate of GABA synthesis in mouse brain // Eur. J. Pharmacol. 1990. V. 191. № 1. P. 19–27.
Strata P. The emotional cerebellum // Cerebellum. 2015. V. 14. № 5. P. 570–577.
Sugiyama Y., Kawaguchi S.Y., Hirano T. mGluR1-mediated facilitation of long-term potentiation at inhibitory synapses on a cerebellar Purkinje neuron // Eur. J. Neurosci. 2008. V. 27. № 4. P. 884–896.
Tsanov M., Vann S.D., Erichsen J.T. et al. Differential regulation of synaptic plasticity of the hippocampal and the hypothalamic inputs to the anterior thalamus // Hippocampus. 2011. V. 21. № 1. P. 1–8.
Turner R.S., Desmurget M., Grethe J. et al. Motor subcircuits mediating the control of movement extent and speed // J. Neurophysiol. 2003. V. 90. № 6. P. 3958–3566.
Vessotskie J.M., Kung M.P., Chumpradit S., Kung H.F. Quantitative autoradiographic studies of dopamine D3 receptors in rat cerebellum using [125I]S(-)5-OH-PIPAT // Brain Res. 1997. V. 778. № 1. P. 89–98.
Wagner M.J., Kim T.H., Savall J. et al. Cerebellar granule cells encode the expectation of reward // Nature. 2017. V. 544. № 7648. P. 96–100.
Wang Z., Liang S., Yu S. et al. Distinct Roles of Dopamine Receptors in the Lateral Thalamus in a Rat Model of Decisional Impulsivity // Neurosci. Bull. 2017. V. 33. № 4. P. 413–422.
Watabe-Uchida M., Zhu L., Ogawa S.K. Whole-brain mapping of direct inputs to midbrain dopamine neurons // Neuron. 2012. V. 74. № 5. P. 858–873.
Wexler E.M., Stanton P.K., Nawy S. Nitric oxide depresses GABAA receptor function via coactivation of cGMP-dependent kinase and phosphodiesterase // J. Neurosci. 1998. V. 18. № 7. P. 2342–2349.
Willis W.D. Long-term potentiation in spinothalamic neurons // Brain Res. Rev. 2002. V. 40. № 1–3. P. 202–214.
Wright C.I., Groenewegen H.J. Patterns of overlap and segregation between insular cortical, intermediodorsal thalamic and basal amygdaloid afferents in the nucleus accumbens of the rat // Neuroscience. 1996. V. 73. № 2. P. 359–373.
Wu Y., Raman I.M. Facilitation of mossy fibre-driven spiking in the cerebellar nuclei by the synchrony of inhibition // J. Physiol. 2017. V. 595. № 15. P. 5245–5264.
Xu W., Edgley S.A. Climbing fibre-dependent changes in Golgi cell responses to peripheral stimulation // J. Physiol. 2008. V. 586. № 20. P. 4951–4959.
Yang G., Zhou M.H., Ren Z. et al. Amoxapine inhibits delayed outward rectifier K(+) currents in cerebellar granule cells via dopamine receptor and protein kinase A activation // Cell Physiol. Biochem. 2011. V. 28. № 1. P. 163–174.
Zhang W., Linden D.J. Long-term depression at the mossy fiber deep cerebellar nucleus synapse // J. Neurosci. 2006. V. 26. № 26. P. 6935–6944.
Zheng W., Liu X., Song H. et al. Altered functional connectivity of cognitive-related cerebellar subregions in Alzheimer’s disease // Front. Aging Neurosci. 2017. V. 9. Article 143.
Zheng N., Raman I.M. Synaptic inhibition, excitation, and plasticity in neurons of the cerebellar nuclei // Cerebellum. 2010. V. 9. № 1. P. 56–66.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


