Успехи физиологических наук, 2021, T. 52, № 3, стр. 81-92
Nampt, Nad, когнитивные функции и продолжительность жизни
Б. И. Кузник a, b, *, С. О. Давыдов a, b, Н. И. Чалисова c, d, Н. С. Линькова c, e, f, О. М. Ивко c
a Кафедра нормальной физиологии, ФГБОУ ВО “Читинская государственная медицинская академия” МЗ РФ
Чита, Россия
b Инновационная клиника “Академия здоровья”
Чита, Россия
c Отдел биогеронтологии АНО НИЦ “Санкт-Петербургский институт биорегуляции и геронтологии”
Санкт-Петербург, Россия
d Группа пептидной регуляции старения Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
e Кафедра терапии, гериатрии и антивозрастной медицины академии постдипломного образования
ФГБУ “Федеральный научно-клинический центр специализированных видов медицинской помощи
и медицинских технологий ФМБА”
Москва, Россия
f Лаборатория “Проблем старения” ФГАОУ ВО “Белгородский государственный
национальный исследовательский университет”
Белгород, Россия
* E-mail: miayy@yandex.ru
Поступила в редакцию 20.12.2020
После доработки 26.12.2020
Принята к публикации 29.12.2020
Аннотация
В связи с увеличением продолжительности жизни актуальным направлением молекулярной медицины является поиск новых подходов к лечению патологии, ассоциированной с возрастом, в том числе нейродегенеративных заболеваний. При старении в крови и тканях уменьшается концентрация фермента никотинамидфосфорибозилтрансферазы (nicotinamide phosphoribosyltransferase, NAMPT) – лимитирующего звена энергетического обмена клеток. В связи с этим в клетках при старении снижается синтез никотинамидадениндинуклеотида (nicotinamide adenine dinucleotide, NAD), необходимого для обеспечения энергообмена и метаболизма. Уменьшение концентрации NAMPT и NAD при старении организма выявлено в печени, почках, скелетных мышцах, жировой ткани, сердце и в центральной нервной системе [22, 50, 59]. Обнаружено снижение экспрессии NAMPT и NAD при нейродегенеративных заболеваниях (болезни Альцгеймера, Паркинсона, деменции различного генеза). Повышение экспрессии NAMPT не только восстанавливает содержание NAD, но и способствует замедлению старения организма. Предшественник NAD, никотинамид рибозид (NR), является природным соединением, с помощью которого можно повысить синтез NAD в клетках. NR, являясь веществом с высокой пероральной биодоступностью, может оказывать положительное влияние на восстановление когнитивных функций при нейродегенеративных заболеваниях, ассоциированных с возрастом.
В настоящее время в мире наблюдается увеличение продолжительности жизни, благодаря чему доля пожилых людей в общей численности населения возрастает. В связи с этим повышается количество заболеваний, ассоциированных с возрастом. Поэтому актуальной задачей молекулярной медицины и биологии является поиск новых средств для профилактики развития возрастной патологии. Актуальным направлением молекулярной геронтологии служит поиск белков, обладающих геропротекторными свойствами [2]. К ним относятся дифференцировочный фактор роста 11 [1, 3, 4, 23], регулятор длины теломер, гормон ирисин [3, 4], регулятор функций клеток поджелудочной железы – бетатрофин [9], тканевой ингибитор матриксных металлопротеиназ-2 (tissue inhibitor of metalloproteinase-2, TIMP-2), мезэнцефальный астроцитоподобный нейротрофический фактор (mesencephalic astrocyte-derived neurotrophic factor, MANF), фактор роста нервов (nerve growth factor, NGF), факторы роста фибробластов-19, 21, 23 (fibroblast growth factors, FGF19, FGF21, FGF23) [5–8, 10]. Все “белки молодости” способствуют продлению и улучшению качества жизни. Эти белки способствуют репарации ДНК, обладают противовоспалительным, антиапоптотическим, антиоксидантным и антисклеротическим действием, стимулируют когнитивные функции, препятствуют развитию дегенеративных и травматических поражений центральной нервной системы (ЦНС), в том числе при болезнях Альцгеймера (БА) и Паркинсона (БП).
“Белки молодости” нормализуют состояние клеточного и гуморального иммунитета, липидного спектра, процессов перекисного окисления липидов (ПОЛ), системы гемостаза, синтез половых гормонов и кардиогемодинамические функции. Концентрация этих белков в крови уменьшается при старении организма.
В настоящее время появились данные о том, что в крови у животных и человека при старении наблюдается снижение концентрации внеклеточной формы фермента никотинамидфосфорибозилтрансферазы (nicotinamide phosphoribosyltransferase, NAMPT), лимитирующего звена энергетического обмена клеток. В результате при старении клетки менее эффективно синтезируют никотинамидадениндинуклеотид (nicotinamide adenine dinucleotide, NAD), необходимый для обеспечения энергетических процессов. Поэтому, наряду с “белками молодости”, NAMPT и NAD могут рассматриваться в качестве протеинов, препятствующих и замедляющих процессы старения организма.
NAMPT И NAD: МЕТАБОЛИЗМ И ФУНКЦИИ
NAD был открыт как кофермент, участвующий в дрожжевом брожении, и считался классическим метаболитом. В настоящее время показано, что NAD является кофактором, который служит для реализации различных биологических процессов, включая метаболизм, репарацию ДНК и экспрессию генов.
NAD играет центральную роль в регуляции путей энергетического метаболизма, включая гликолиз, окисление жирных кислот (β-окисление), цикл трикарбоновых кислот и окислительное фосфорилирование [20]. Взаимодействие между окисленными (NAD) и восстановленными (NADH) формами кофермента реализует различные сигнальные каскады клетки [12]. NAD контролирует дыхание митохондрий посредством ферментов цикла трикарбоновых кислот, β-окисления и окислительного фосфорилирования, а также служит субстратом для посттрансляционных модификаций белка, таких как деацетилирование и АДФ-рибозилирование сиртуинами [35]. Белки CD38 и CD157 превращают NAD в ADP-рибозу (ADPR) или циклический-ADPR [53]. Биосинтез NAD, опосредованный NAMPT, необходим для регуляции адаптивного термогенеза, липолиза и энергетического метаболизма животных и человека [80].
У млекопитающих NAD синтезируется из триптофана de novo, из никотиновой кислоты (NA) и из никотинамида (NAM). Никотинамид рибозид (NR) также используется для генерирования NAD (рис. 1). Установлено, что предшественник NAD – никотинамид мононуклеотид (NMN) после внутрибрюшинной инъекции мышам появляется в плазме, печени, белой жировой ткани и поджелудочной железе и используется для биосинтеза NAD, что приводит к увеличению его концентрации в 2–3 раза в печени в течение 60 мин [85]. Перорально вводимый NMN абсорбируется и превращается в NAD в печени и скелетных мышцах [15, 16, 48].
Рис. 1.
Схема метаболизма NAMPT в крови и тканях (адаптировано из [85]). Обозначения на рисунке: NAD – никотинамидадениндинуклеотид, NAM – никотинамид, NA – никотиновая кислота, NAMPT – никотинамидфосфорибозилтрансфераза, NMN – никотинамид мононуклеотид.
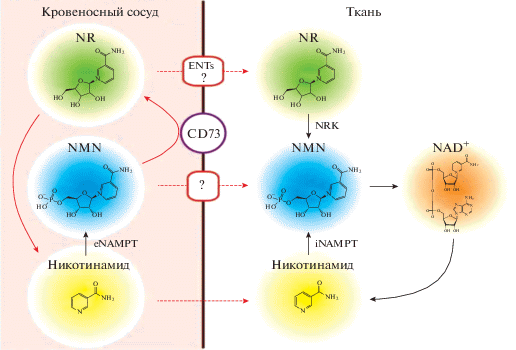
Химическое или генетическое ингибирование 5'-нуклетидазы или Nrk1/2 отменяет использование NMN в культивируемых клетках [56, 63]. Внеклеточный NMN может транспортироваться в клетки и из него синтезируется NAD [27]. Дефицит NAD при старении является следствием активации АДФ-рибозы, полимеразы-1 (PARP-1), снижения активности NAMPT и повышения функциональности CD38, катализирующего деградацию NAD [90].
Установлены внеклеточное превращение и деградация NMN и NR и их возможные механизмы поглощения [85, 86]. NAMPT, являющаяся ферментом, ответственным за продукцию NMN, имеет две изоформы – внутриклеточную (iNAMPT) и внеклеточную (eNAMPT). eNAMPT верифицирован в системе кровообращения, ликворе и семенной жидкости у мышей и человека [31, 36, 57, 83]. eNAMPT продуцируют адипоциты [83], гепатоциты [62], лейкоциты [31], кардиомиоциты [52], глиальные и эпителиальные клетки, моноциты [81]. iNAMPT является ацетилированным, а его сиртуин-зависимое деацетилирование в лизине по 53 аминокислотному остатку повышает ферментативную активность адипоцитов [83].
При нарушениях обмена веществ и старении уровень NAMPT и NAD в крови снижается [32]. Благодаря NAD-биосинтетической активности, NAMPT влияет на активность NAD-зависимых ферментов, регулируя клеточный метаболизм. eNAMPT обладает свойствами цитокинов. NAMPT способен модулировать процессы, участвующие в патогенезе ожирения и связанных с ним расстройств, таких как неалкогольная жировая болезнь печени и сахарный диабет 2 типа. NAMPT регулирует процессы окислительного стресса, апоптоза, метаболизма липидов и глюкозы, воспаление и резистентность к инсулину [67]. NAMPT принадлежит основная роль в метаболизме раковых клеток. Часто NAMPT сверхэкспрессируется в опухолевых тканях и является экспериментальной мишенью для противоопухолевой терапии.
NAMPT, NAD И СТАРЕНИЕ
Уровень NAD снижается с возрастом во многих тканях и органах, включая печень, почки, скелетные мышцы, жировую ткань, сердце, мозг [20]. Предполагается, что концентрация NAD в различных органах и тканях определяются балансом между его синтезом и деградацией, и что старение влияет на оба этих пути [79].
Содержание NAD и NAMPT в крови подвержено циркадным колебаниям, которые могут усиливаться через регуляторную петлю NAMPT–NAD–SIRT1. Нарушение циркадного ритма при старении может снизить содержание NAMPT и NAD в различных органах. Так, у старых мышей концентрации NAMPT и SIRT1 были снижены в супрахиазматическом ядре (SCN) и области гипоталамуса, контролирующей циркадные ритмы. Амплитуда циркадных колебаний в SCN с возрастом уменьшается и тогда блокада NAMPT–NAD–SIRT1 может привести к дальнейшему снижению экспрессии NAMPT [13].
Другой возможной причиной снижения уровня NAMPT в крови и тканях при старении является хроническое воспаление (inflamm-aging). Cтрессорный ответ усиливается при старении и способствуют хроническому воспалению во всех типах тканей. Хроническое воспаление вызывает выделение провоспалительных цитокинов (IL-1β, IL-6, TNF-α) и способствует повреждению клеток [28]. Эти цитокины снижают экспрессию гена, кодирующего NAMPT [85]. TNF-α и IL-1β ингибируют CLOCK и BMAL1-опосредованную экспрессию генов циркадных ритмов [51].
Гиперэкспрессия NAMPT восстанавливает репликацию в клетках гладких мышц человека. В присутствии никотинамида NAMPT может замедлять дегенерацию аксонов in vitro. Снижение NAMPT в стареющем мозге может снизить уровень NADH, что способно вызвать окислительный стресс и способствовать нейродегенерации.
Экспрессия Nmnat3 у мышей способствовала увеличению содержания NAD в различных тканях и предотвращала связанное со старением снижение концентрации NAD. Мыши со сверхэкспрессией Nmnat3 были защищены от резистентности к инсулину, индуцированной диетой и связанной со старением. В скелетных мышцах мышей линии Nmnat3 Tg активность цикла трикарбоновых кислот была выше, а источник энергии для окислительного фосфорилирования смещался в сторону усиленного окисления жирных кислот. Продукция активных форм кислорода (АФК) у старых мышей линии Nmnat3 Tg была снижена. В то же время концентрация NAD-аналога никотинамид-гуанин-динуклеотида у мышей линии Nmnat3 Tg резко возрастала. Представленные данные позволили высказать предположение о том, что гиперэкспрессия Nmnat3 улучшает метаболизм и ген Nmnat3 является возможной терапевтической мишенью при лечении метаболических нарушений, вызванных старением.
Инъекция NAMPT-нейтрализующих антител снижает уровень NAD в гипоталамусе, тогда как очищенный eNAMPT в ткани гипоталамуса может усиливать синтез NAD, активность SIRT1 и повышать нейропластичность. Таким образом eNAMPT играет решающую роль в регуляции биосинтеза и функции NAD в гипоталамусе [83].
При старении в скелетных мышцах концентрация NAD снижается [29, 30, 79]. У мышей, нокаутированных по NAMPT, на фоне прогрессивного снижения уровня NAD происходит дегенерация скелетных мышц. Применение NR восстанавливает содержание NAMPT в мышечной ткани у нокаутных по этому гену мышей [29, 30]. Нейрональный NAMPT необходим для реализации пре- и постсинаптической функции нервно-мышечного синапса, а также для поддержания структуры и функции скелетных мышц [45].
Установлено, что NAD играет критическую роль в старении стволовых клеток (СК). При старении в СК развивается митохондриальная дисфункция, включающая снижение окислительного фосфорилирования и концентрации NAD. Применение NR предотвращает клеточное старение [88, 89].
Учитывая патофизиологическое значение eNAMPT и фармакокинетические особенности NMN для системного механизма регуляции старения была предложена концепция “NAD World”. Первоначально концепция “NAD World” рассматривалась как системная регуляторная сеть, связывающая метаболизм NAD, биологический ритм и контроль старения и долголетия у млекопитающих [39–41]. Согласно этой концепции, SIRT1 и NAMPT являются двумя ключевыми компонентами, которые регулируют синтез NAD. SIRT1 функционирует в качестве критического метаболического регулятора в различных органах и тканях в ответ на изменения доступности NAD, а NAMPT обеспечивает циркадный ритм продукции NAD [55]. В этой концепции eNAMPT и NMN играют ключевую роль в системном регулировании синтеза NAD. Доступность NMN особенно важна для тканей и органов, которые обладают очень низким уровнем iNAMPT, таких как β-клетки поджелудочной железы и нейроны ЦНС. Недавно эта концепция была пересмотрена и названа “NAD World 2.0” [40]. Новая концепция для контроля старения и долголетия млекопитающих учитывает важность взаимосвязи между тремя ключевыми органами и тканями: гипоталамусом, жировой тканью и скелетными мышцами. Предполагается, что NMN функционирует как системная сигнальная молекула, которая поддерживает биологическую устойчивость NAD. Известно, что концентрация NAD в различных органах и тканях снижается с возрастом [17, 18, 29, 30, 39, 41]. Применение NMN или NR для усиления системного биосинтеза NAD может быть эффективным средством для поддержания физиологических функций и замедления процесса старения у млекопитающих.
У старых мышей линии Nampt knockin (ANKI) с гиперэкспрессией eNAMPT в жировой ткани содержание eNAMPT в крови и концентрация NAD в тканях (гипоталамус, гиппокамп, поджелудочная железа, сетчатка) сохранялись на уровне молодых животных дикого типа. У старых мышей линии Nampt knockin отмечено повышение физической активности, улучшение качества сна, когнитивных функций, метаболизма глюкозы и функции фоторецепторов [83].
Предшественники NAD, NR и NMN, являются соединениями, с помощью которых можно повысить уровень NAD в клетках различных органов и тканей [69]. Так как NR и NMN могут устранять нарушения метаболизма глюкозы, сердечно-сосудистых и нервных функций и поддерживать развитие СК, то, возможно, таким способом можно способствовать увеличению продолжительности жизни.
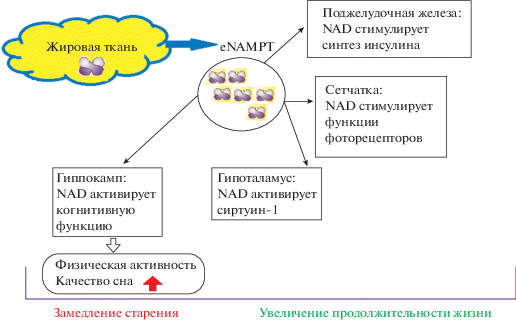
У мышей и человека с возрастом концентрация NAMPT в крови снижается [84]. Введение микровезикул, содержащих NAMPT, старым животным вызывает стимуляцию синтеза NAD и предотвращает старение организма. При этом отмечается усиление синтеза инсулина, увеличение активности фоторецепторов сетчатки глаза, значительное улучшение качества сна и когнитивных функций, увеличение подвижности и беговой активности. К такому же эффекту приводило пероральное применение NAMPT у мышей. Авторы считают, что ведущая роль в регуляции процесса старения принадлежит гипоталамусу, деятельность которого во многом зависит от синтеза NAD. В гипоталамусе под воздействием NAMPT, синтезируемой в жировой ткани и переносимой в головной мозг кровью, усиливается синтез NAD. Поэтому применение NAMPT-содержащих микровезикул увеличивает продолжительность жизни у старых животных (рис. 2).
Рис. 2.
Влияние NAMPT на продолжительность жизни (адаптировано из [84]). Обозначения на рисунке: NAD – никотинамидадениндинуклеотид, NAMPT – никотинамидфосфорибозилтрансфераза.
В другой работе изучали влияние физических нагрузок на содержание NAMPT и NAD в крови. Аэробная тренировка у молодых и пожилых людей увеличила содержание NAMPT в крови на 12 и 28% соответственно, тогда как тренировка с отягощениями у тех же испытуемых повышала концентрацию NAMPT на 25 и 30% [24, 25].
NAMPТ, NAD И НЕЙРОДЕГЕНЕРАТИВНЫЕ ЗАБОЛЕВАНИЯ
С возрастом число полипотентных клеток головного мозга снижается [14]. Делеция в гене, кодирующем белок NAMPT в этих клетках нарушает их пролиферацию и дифференцировку [65, 66]. У мышей с отсутствием экспрессии NAMPT в нейронах переднего отдела мозга (CaMKIIα Nampt (–/–)) к 2–3 месячному возрасту развивается астроглиоз, микроглиоз, атрофия гиппокампа и коры, а также аномалия структуры CA1-дендрита [65, 66]. Указанные гистологические изменения сопровождаются нарушением внутри гиппокампальных связей между нейронами и нарушениями в поведении: гиперактивностью, дефектами двигательных навыков, ухудшением памяти и снижением чувства тревоги, тогда как сенсорные функции остаются неизмененными. Эти результаты свидетельствуют о том, что нейроны переднего мозга в основном используют внутриклеточный NAMPT-опосредованный биосинтез NAD.
Концентрация NAMPT в SCN при старении снижается. В гипоталамусе уровень NAD является критическим регулятором активности SIRT1 и оказывает влияние на различные связанные со старением функции как локально, так и системно. У мышей, нокаутированных по гену SIRT1, обнаруживается циркадный спад, напоминающий старение, в то время как гиперэкспрессия SIRT1 в мозге защищает таких животных от проявлений ускоренного старения [21].
Установлено, что нейронам в дугообразном ядре гипоталамуса принадлежит основная роль в регуляции энергетического баланса. С возрастом уровень белка SIRT1 в нейронах уменьшается. В то же время сверхэкспрессия SIRT1 в этих нейронах предотвращает возрастное увеличение веса. SIRT1 in vitro и in vivo повышал в нейронах гипоталамуса чувствительность к лептину, подавляя синтез протеин-тирозин-фосфатазы 1B и T-клеточной протеин-тирозин-фосфатазы. Следовательно, SIRT1 в нейронах дугообразного ядра является негативным регулятором энергетического баланса. Угнетение его функции приводит при старении к нарушению энергетического гомеостаза [60]. Следует отметить, что специфическая для адипоцитов делеция NAMPT оказывает влияет на уровень NAD не только в жировой ткани, но и в гипоталамусе. Это действие скорее всего осуществляется за счет влияния eNAMPT [83].
Установлено, что концентрация NAD в гиппокампе у старых мышей снижается, хотя при этом отмечается незначительные снижение способности к пространственному обучению у животных [44]. У старых мышей в ответ на проведение контекстуальных тестов, вызывающих чувство страха, развивается когнитивная гиперчувствительность. Применение NMN у таких животных улучшило сенсорный процессинг гиперчувствительности. Потенциальным эффектором, приводящим к снижению концентрации NAD в гиппокампе у старых мышей, является кальций/кальмодулин-зависимая-серин-протеинкиназа (Cask). Кратковременное добавление NMN может усиливать экспрессию Cask в гиппокампе старых животных.
Установлено, что гиперэкспрессия NAMPT через 2 ч после искусственно вызванной церебральной ишемии (перевязка средней мозговой артерии) усиливала аутофагию. На ранней стадии церебральной ишемии индуктор аутофагии рапамицин защищал нейроны от повреждения, вызванного нокдауном NAMPT, в то время как ингибитор аутофагии 3-метиладенин частично устранял описанный нейропротекторный эффект. NAMPT во время церебральной ишемии способствует выживанию нейронов посредством индукции аутофагии с помощью регуляции сигнального пути TSC2–mTOR–S6K1 SIRT1-зависимым образом [70].
Установлено, что нейрон-специфическая сверхэкспрессия NAMPT уменьшает область инсульта при моделировании ишемии головного мозга у мышей [71]. Сверхэкспрессия NAMPT увеличивает площадь миелиновых волокон нейронов в полосатом и мозолистом теле. Эти данные свидетельствуют о том, что NAMPT защищает от повреждения белое вещество головного мозга. Обнаруженный механизм защиты, видимо, обусловлен внеклеточным высвобождении NAMPT. Об этом свидетельствуют следующие факты. NAMPT секретировался во внеклеточную среду первичными корковыми нейронами, подвергавшимися ишемии-подобной кислородно-глюкозной депривации (oxygen-glucose deprivation, OGD). Кондиционированная среда из NAMPT-сверхэкспрессирующих нейронов, подвергшихся воздействию OGD, защищала культивируемые олигодендроциты от OGD. Приведенные данные свидетельствуют о наличии новой нейропротекторной роли секретируемого NAMPT в защите белого вещества после ишемического повреждения [43].
Сверхэкспрессия NAMPT в нейронах может способствовать их выживанию, уменьшать транслокацию из митохондрий фактора AIF, индуцирующего апоптоз, ингибировать активацию каспазы-3 в модели болезни Альцгеймера у животных с применением глутамат-экситотоксичности. Кроме того, NAMPT способен подавлять индуцированную глутаматом фрагментацию митохондрий, снижать экспрессию PGC-1 и NRF-1. Перечисленные эффекты NAMPT зависят от его ферментативной активности, связанной с синтезом NAD [73, 76]. При исследовании первичных корковых нейронов и препаратов коры головного мозга мыши, показано, что что NAMPT и никотинамидмононуклеотид аденилаттрансфераза 3 (NMNAT3) локализованы в митохондриальном матриксе [72, 75].
Известно, что дисфункция NAMPT вызывает митохондриальную дисфункцию, сопровождаемую нарушением синаптической функции в нервно-мышечных синапсах. У мышей линии NamptcKO введение NMN сопровождалось снижением двигательной функции и увеличением продолжительности жизни [74]. Оказалось, что уровень белка iNAMPT снижается в спинном мозге пациентов с амиотрофическим латеральным склерозом, что указывает на участие NAMPT в патогенезе этого заболевания. Полученные данные свидетельствуют о том, что нейрональный NAMPT играет существенную роль в митохондриальной биоэнергетике и моторной функции. Предполагается что NAMPT-опосредованный путь биосинтеза NAD является потенциальной терапевтической мишенью при лечении дегенеративных нейромышечных заболеваниях.
Высказано предположение, что NAMPT является терапевтической мишенью при ишемическом инсульте. Использование NAMPT при этой патологии может обеспечить нейропротекцию посредством регуляции митохондриального биогенеза, активации SIRT1, ингибирования активности PARP1. Кроме того, лечение с применением NAMPT может стимулировать неоваскуляризацию и нейрогенез после возникновения ишемического инсульта [72, 75].
NAMPT способствует выживанию клеток млекопитающих при окислительном стрессе посредством SIRT1-зависимого, p53-CD38 и SIRT1-независимого пути NRF2-PPARα/AMPKα [87]. При обработке клеток перекисью водорода их мембранный потенциал и количество митохондрий в них были снижены. Активация пути NRF2-PPARα/AMPKα посредством избыточной экспрессии NAMPT восстанавливала мембранный потенциал митохондрий.
Старение является основным фактором риска развития БА и во многом связано со снижением защиты от окислительно-восстановительного стресса и увеличения образования свободных радикалов, связанных с дисфункцией митохондрий. Если NADH является основным донором электронов для многих окислительно-восстановительных реакций, включая окислительное фосфорилирование, то глутатион (GSH) служит основным буфером окислительно-восстановительного потенциала в клетке. При ингибировании синтеза NADH и GSH выяснялось, какую роль играют указанные ферменты при старении в норме и при моделировании БА у мышей [33]. В нейронах, полученных от старых животных, способность к регенерации NADH и уровень GSH снижались, а содержание свободных радикалов увеличивалось. В нейронах трансгенных мышей с БА способность к регенерации NADH, уровень GSH были ниже, чем в нейронах мышей дикого типа. Отмечено также возрастное снижение экспрессии генов ключевых редокс-зависимых биосинтетических ферментов нейронов, NAMPT, NADPH и NNT. В модели ранней формы БA (трансгенные мыши линии APPswe/PS1ΔE9) применение NAD привело к ускорению пространственного обучения и улучшению памяти и уменьшало наличие склеротических бляшек в сосудах. Введение NAD животным с БА сопровождалось усилением экспрессии NAMPT и SIRT1 [78].
Применение NR у мышей с БА ослабляет когнитивные нарушения, что совпадает с увеличением уровня NAD в коре головного мозга. Нанесение NR на срезы гиппокампа устраняет дефицит долговременного потенцирования, зарегистрированного в области CA1 головного мозга мышей с БА. Обработка NR способствует экспрессии в мозге PGC-1α, что совпадает с усилением деградации β-секретазы (BACE1) и снижением продукции амилоидного пептида. Экспрессия белка BACE1 в первичной культуре нейронов, полученных от мышей с БА, снижается под действием NR [34]. Применение NR уменьшает агрегацию амилоида и количество амилоидных бляшек в нейронах мышей с БA (линия APPswe/PSEN1dE9). Полученные данные подтвердили важность усиления митохондриального протеостаза для снижения амилоидной синаптотоксичности при БA [64].
Применение NAD для восстановления поврежденных митохондрий является многообещающей стратегией лечения БА и других нейродегенеративных заболеваний, в том числе деменции. Применение NR у трансгенных мышей линии APP/PS1 (модель БA) и старых мышей улучшало кратковременную пространственную память и контекстную память о страхе, ингибировало активацию астроцитов и повышение NAMPT в крови, препятствовало увеличению массы тела животных. У мышей с БA применение NR ингибировало накопление амилоидного пептида. На основании полученных данных исследователи приходят к выводу, что NR является перспективным веществом для терапии БA и прогрессирования деменции [77].
Введение NR улучшало когнитивную функцию и синаптическую пластичность гиппокампа у мышей с БA, уменьшало повреждения ДНК, активность воспалительного процесса и апоптоза в нейронах гиппокампа [38]. Применение NMN при БA у животных замедляло гибель нейронов, улучшало когнитивные и поведенческие показатели, снижало продукцию β-амилоида, потерю синапсов и интенсивность воспалительной реакции [73, 76, 82]. NMN ингибировал активацию JNK (jun N terminal kinase). Установлено, что NMNAT1 и NMNAT2 играют нейропротекторную роль и восстанавливают поведенческие нарушения в моделях у мышей с таупатией [49, 58].
Показано, что FGF21 в культуре дофаминергических клеток человека увеличивает содержание PGC-1α и митохондриальных антиоксидантов. Активация PGC-1α под влиянием FGF21 происходила с участием NAD-зависимой деацетилазы SIRT1 и проявлялась после повышения активности NAMPT. FGF21 также усиливает дыхательную способность митохондрий в дофаминергических нейронах человека. Следовательно, FGF21, активируя PGC-1α и повышая эффективность митохондрий в дофаминергических нейронах человека, может играть положительную роль в жизнеспособности дофаминергических нейронов, в частности при БП [46].
Для создания модели БП in vitro клетки РС12 обрабатывали нейротоксином 6-гидроксидопамином (6-OHDA). При этом наблюдалось значительное снижение уровня NAMPT и NAD, а также изменение соотношения NAD/NADH. Предварительная инкубация PC12 с высокоспецифичным ингибитором NAMPT FK866 усилила ингибирующее действие 6-OHDA на жизнеспособность этих клеток, в то время как предварительная инкубация с NMN вызывала противоположный эффект. NMN в клетках PC12 ослаблял вызванное 6-OHDA снижение активности супероксиддисмутазы, уровня глутатиона, малонового диальдегида и лактатдегидрогеназы. На основании полученных данных авторы приходят к выводу, что применение NMN для активации SIRT1 может представлять новую стратегию при лечении БП.
Высказывается предположение, что митохондриальная дисфункция является ключевым патогенетическим фактором БП [42]. Имеются данные о том, что нейроны пациентов с БП проявляют стрессовые реакции, приводящие к гибели митохондрий и изменения метаболизма NAD [61]. Применение NR приводило к повышению NAD, значительно улучшало функцию митохондрий в нейронах пациентов с БП. Таким образом, для поддержания концентрации NAD в нейронах требуется NAMPT, а также NRK1 – для синтеза NAD из его предшественников. NR предотвращает связанную с возрастом дофаминергическую потерю нейронов и снижение моторных функций.
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ВЕЩЕСТВ, СТИМУЛИРУЮЩИХ СИНТЕЗ NAMPТ И NAD, В ГЕРОПРОТЕКЦИИ
Установлено, что применение NR в рамках I фазы клинических испытаний увеличивает содержание NAD в мононуклеарах периферической крови [11, 69]. На основании полученных данных авторы приходят к выводу, что NR увеличивает у людей концентрацию NAD в крови, он может применяться в качестве терапевтического средства у пациентов с митохондриальной дисфункцией, обусловленной генетическими и/или приобретенными заболеваниями. В другом рандомизированном плацебо-контролируемом исследовании сообщалось, что применение NR повышает уровень NAD в крови лиц пожилого возраста на 40–90%. Применение NR у людей с повышенным артериальным давлением приводило к его снижению. Кроме того, использование NR сопровождалось улучшением работоспособности пациентов [47]. В 2016 г. было успешно завершено двойное слепое рандомизированное плацебо-контролируемое исследование по оценке безопасности применения препарата NAD в течение 6 недель у здоровых пожилых людей [37].
Некоторые исследования противоречат приведенным выше данным. В рандомизированном плацебо-контролируемом клиническом исследовании у мужчин среднего возраста применение NR привело к снижению содержания NAMPT в скелетных мышцах на 14%. В этом исследовании NR не влиял ни на дыхательную способность митохондрий скелетных мышц, ни на количество митохондриальных белков [26]. Для окончательного решения вопроса о влиянии перорального приема NR и NAD на течение физиологических функций здоровых и больных людей требуется проведение дополнительных исследований [54, 69].
ЗАКЛЮЧЕНИЕ
NAMPT и NAD являются ключевыми звеньями энергетического обмена клеток и белками, замедляющим старение и развитие возраст-ассоциированных заболеваний. При старении происходит снижение концентрации NAMPT и NAD в различных органах: печени, почках, скелетных мышцах, жировой ткани, сердце и различных структурах ЦНС. Одной из важнейших причин нарушения синтеза NAMPT и NAD в стареющем организме является изменение циркадного ритма, особенно сильно выраженного в различных отделах ЦНС, включая гиппокамп и другие структуры, связанные с когнитивной деятельностью. Кроме того, причинами снижения уровня NAMPT и NAD при старении организма является хроническое воспаление, вызванное различными стрессорными факторами и заболеваниями, ассоциированными с возрастом. В то же время было показано, что гиперэкспрессия NAMPT не только восстанавливает содержание NAD, но и способствует замедлению старения организма животных.
У человека и животных с увеличением возраста снижается концентрация NAMPT в крови. Применение NAMPT стимулирует синтез NAD и предотвращет ускоренное старение у животных. Имеются сведения о том, что ведущая роль в регуляции старения принадлежит гипоталамусу, деятельность которого во многом зависит от синтеза NAD. В гипоталамусе под воздействием NAMPT, переносимого в ЦНС микровезикулами, усиливается синтез NAD. По мере снижения уровня NAMPT в крови гипоталамус теряет способность нормально функционировать, что сокращает продолжительность жизни. Повышение уровня NAMPT и NAD в крови сопровождается усилением когнитивных функций у старых мышей. Введение мышам NAD, ведущее к его гиперэкспрессии, в значительной степени ликвидирует те нарушения, которые возникают при моделировании ишемии головного мозга у животных. Показано, что после глутамат-экситотоксичности сверхэкспрессия NAMPT в нейронах может способствовать их выживанию, ингибируя активацию капазы-3.
Снижение синтеза NAMPT и NAD выявлено при нейродегенеративных заболеваниях, таких как БА и БП. Применение NR, активирующего синтез NAMPT и NAD в нейронах головного мозга, способствовало снижению выраженности проявлений БА в моделях на животных. Установлено, что NR является безопасным предшественником NAD с высокой пероральной биодоступностью и оказывает положительное влияние на восстановление когнитивных функций при нейропатологии. Таким образом, белки NAMPT и NAD могут являться потенциальными мишенями действия или биологически активными молекулами, эффективными при лечении нейродегенеративных заболеваний и другой, ассоциированной с возрастом, патологии.
Список литературы
Гусева Е.С., Давыдов С.О., Кузник Б.И. и др. Роль дифференцировочного фактора роста 11 (GDF11) в регуляции липидного обмена и кардиогемодинамических функций у больных гипертонической болезнью при умеренной физической нагрузке // Российский кардиологический журнал. 2018. № 4. С. 93–98.
Кузник Б.И., Давыдов С.О, Степанов А.В. и др. Белки “молодости” и “старости” и система гемостаза. // Тромбоз, гемостаз и реология. 2016. № 3. С. 234–235.
Кузник Б.И., Давыдов С.О., Степанов А.В. Роль мышечного гормона ирисина в регуляции физиологических функций в условиях нормы и патологии // Успехи физиологических наук. 2018. Т. 49. № 4. С. 1–22.
Кузник Б.И., Давыдов С.О., Степанов О.В. и др. “Белок молодости” GDF11, состояние системы гемостаза и особенности кровотока у женщин, страдающих гипертонической болезнью // Тромбоз, гемостаз и реология. 2018. № 1. С. 39–45.
Кузник Б.И., Давыдов С.О., Ланда И.В. Фактор роста нервов (NGF) и его роль в условиях нормы и патологии // Успехи физиологических наук. 2019. Т. 50. № 4. С. 64–80.
Кузник Б.И., Давыдов С.О., Чалисова Н И. Роль белков MANF, TIMP-2 и ирисина в старении организма // Успехи современной биологии. 2019. Т. 139. № 6. С. 540–52.
Кузник Б.И., Давыдов С.О., Чалисова Н.И. “Омолаживающий” белок MANF и его функции в норме и при патологии // Молекулярная медицина. 2019. Т. 17. № 5. С. 3–12.
Кузник Б.И., Хавинсон В.Х., Линькова Н.С. и др. Факторы роста фибробластов FGF19, FGF21, FGF23 как эндокринные регуляторы физиологических функций и геропротекторы. Эпигенетические механизмы регуляции // Успехи современной биологии. 2017. Т. 137. № 1. С. 84–99.
Хавинсон В.Х., Кузник Б.И., Линькова Н.С. и др. Подсемейство факторов роста фибробластов FGF19, FGF 21, FGF 23 как факторы “молодости”. Эпигенетические механизмы регуляции // Геронтология. 2017. № 1. С. 3–9.
Хавинсон В.Х., Кузник Б.И., Рыжак Г.А. и др. Ирисин, бетатрофин, сахарный диабет, ожирение и метаболический синдром. Эпигенетические механизмы регуляции // Успехи физиологических наук. 2018. Т. 49. № 1. С. 72–86.
Airhart S.E., Shireman L.M., Risler L.J. et al. An open-label, non-randomized study of the pharmacokinetics of the nutritional supplement nicotinamide riboside (NR) and its effects on blood NAD+ levels in healthy volunteers // PLoS One. 2017. № 12. e0186459. https://doi.org/10.1371/journal.pone.0186459
Anderson K.A., Madsen A.S., Olsen C.A. et al. M.D. Metabolic control by sirtuins and other enzymes that sense NAD(+), NADH, or their ratio // Biochim. Biophys. Acta. 2017. V. 18. № 58. P. 991–998.
Baburski A.Z., Sokanovic S.J., Bjelic M.M. et al. Circadian rhythm of the Leydig cells endocrine function is attenuated during aging // Exp. Gerontol. 2016. № 73. P. 5–13.
Ben Abdallah N.M., Slomianka L., Vyssotski A.L. et al. Early age-related changes in adult hippocampal neurogenesis in C57 mice // Neurobiol. Aging. 2010. № 31. P. 151–161.
Bieganowski P., Brenner C. Discoveries of nicotinamide riboside as anutrient and conserved NRK genes establish a Preiss-Handler independent route to NAD+ in fungi and humans // Cell. 2004. № 117. P. 495–502.
Bockwoldt M., Houry D., Niere M. et al. // Proc. Natl. Acad. Sci. U.S.A. 2019. V. 116. № 32. P. 15957–15966. https://doi.org/10.1073/pnas.1902346116
Braidy N., Guillemin G.J., Mansour H. et al. Age related changes in NAD+ metabolism oxidative stress and Sirt1 activity in Wistar rats // PLoS One. 2011. V. 6. № 4. e19194. https://doi.org/10.1371/journal.pone.0019194
Camacho-Pereira J., Tarrago M.G., Chin C.C.S. et al. CD38 dictates age-related NAD decline and mitochondrial dysfunction through an SIRT3-dependent mechanism // Cell Metab. 2016. № 23. P. 1127–1139.
Canto C., Menzies K.J., Auwerx J. et al. NAD(+) metabolism and the control of energy homeostasis: a balancing act between mitochondria and the nucleus // Cell Metab. 2015. № 22. P. 31–53.
Chaleckis R., Murakami I., Takada J. et al. Individual variability in human blood metabolites identifies age-related differences // Proc. Natl. Acad. Sci. U.S.A. 2016. № 113. P. 4252–4259.
Chang H.C., Guarente L. SIRT1 mediates central circadian control in the CNS by a mechanism that decays with aging // Cell. 2013. № 153. P. 1448–1460.
Dall M., Trammell S.A.J., Asping M. et al. Mitochondrial function in liver cells is resistant to perturbations in NAD+ salvage capacity // J. Biol. Chem. 2019. V. 294. № 36. P. 13304–13326. https://doi.org/10.1074/jbc.RA118.006756
De Domenico E., D’Arcangelo G., Faraoni I. et al. Modulation of GDF11 expression and synaptic plasticity by age and training. // Oncotarget. 2017. V. 8. № 35. P. 57991–8002. doi: 10.18632.
de Guia R.M., Agerholm M., Nielsen T.S. et al. Aerobic and resistance exercise training reverses age-dependent decline in NAD+ salvage capacity in human skeletal muscle // Physiol. Rep. 2019. V. 7. № 12. P. 93–97. https://doi.org/10.14814/phy2.14139
de Guia R.M., Agerholm M., Nielsen T.S. et al. Aerobic and resistance exercise training reverses age-dependent decline in NAD+ salvage capacity in human skeletal muscle // Physiol. Rep. 2019. V. 7. № 12. e14139. https://doi.org/10.14814/phy2.14139
Dollerup O.L., Chubanava S., Agerholm M. et al. Nicotinamide riboside does not alter mitochondrial respiration, content or morphology in skeletal muscle from obese and insulin resistant men // J. Physiol. 2019. Nov 11. https://doi.org/10.1113/JP278752
Fletcher R.S., Ratajczak J., Doig C.L. et al. Nicotinamide riboside kinases display redundancy in mediating nicotinamide mononucleotide and nicotinamide riboside metabolism in skeletal muscle cells // Mol. Metab. 2017. № 6. P. 819–832.
Franceschi C., Campisi J. Chronic inflammation (inflamm-aging) and its potential contribution to age-associated diseases // J. Gerontol. A. Biol. Sci. Med. Sci. 2014. V. 69. Suppl. 1. P. 4–9.
Frederick D.W., Davis J.G., Davila Jr. et al. Increasing NAD synthesis in muscle via nicotinamide phosphoribosyltransferase is not sufficient to promote oxidative metabolism // J. Biol. Chem.2015. № 290. P. 1546–1558.
Frederick D.W., Loro E., Liu L. et al. Loss of NAD homeostasis leads to progressive and reversible degeneration of skeletal muscle // Cell Metab. 2016. V. 24. P. 269–282.
Friebe D., Neef M., Kratzsch J. et al. Leucocytes are a major source of circulating nicotinamide phosphoribosyltransferase (NAMPT)/pre-B cell colony (PBEF)/visfatin linking obesity and inflammation in humans // Diabetologia. 2011. № 54. P. 1200–1211.
Garten A., Schuster S., Penke M. et al. Physiological and pathophysiological roles of NAMPT and NAD metabolism // Nat. Rev. Endocrinol. 2015. V. 11. № 9. P. 535–546. https://doi.org/10.1038/nrendo.2015.117
Ghosh D., Levault K.R., Brewer G.J. Relative importance of redox buffers GSH and NAD(P)H in age-related neurodegeneration and Alzheimer disease-like mouse neurons // Aging Cell. 2014. V. 13. P. 631–640.
Gong B., Pan Y., Vempati P. et al. Nicotinamide riboside restores cognition through an upregulation of proliferator-activated receptor-gamma coactivator 1alpha regulated beta-secretase 1 degradation and mitochondrial gene expression in Alzheimer’s mouse models // Neurobiol. Aging. 2013. V. 34. P. 1581–1588.
Gulshan M., Yaku K., Okabe K. et al. Overexpression of Nmnat3 efficiently increases NAD and NGD levels and ameliorates age-associated insulin resistance // Aging Cell. 2018 V.17. № 4. e12798. https://doi.org/10.1111/acel.12798
Hallschmid M., Randeva H., Tan B.K. et al. Relationship between cerebrospinal fluid visfatin (PBEF/Nampt) levels and adiposity in humans // Diabetes. 2009. V.58. P. 637–640.
Heilbronn L.K. Clinical trials corner // Nutr. Healthy Aging. 2017. № 4. P. 193–194.
Hou Y., Lautrup S., Cordonnier S. et al. NAD(+) supplementation normalizes key Alzheimer’s features and DNA damage responses in a new AD mouse model with introduced DNA repair deficiency // Proc. Natl. Acad. Sci. U.S.A. 2018. V. 115. E1876–E1885.
Imai S. “Clocks” in the NAD World: NAD as a metabolic oscillator for the regulation of metabolism and aging // Biochim. Biophys. Acta. 2010. V. 1804. № 8. P. 1584–1590. https://doi.org/10.1016/j.bbapap.2009.10.024
Imai S. The NAD World 2.0: the importance of the inter-tissue communication mediated by NAMPT/ NAD+/SIRT1 in mammalian aging and longevity control // NPJ Syst. Biol. Appl. 2016. V.1 8. № 2. P. 16018.
Imai S. The NAD World: a new systemic regulatory network for metabolism and aging–Sirt1, systemic NAD biosynthesis, and their importance // Cell Biochem. Biophys. 2009. V. 53. № 2. P. 65–74.
Jansen I.E., Ye H., Heetveld S., Lechler M.C. et al. Discovery and functional prioritization of Parkinson’s disease candidate genes from large-scale whole exome sequencing // Genome Biol. 2017. V. 18. № 22. P. 164–169.
Jing Z., Xing J., Chen X. et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury // J. Cereb. Blood Flow Metab. 2014. V. 34. № 10. P. 1613–1621. https://doi.org/10.1038/jcbfm.2014.119
Johnson S., Wozniak D.F., Imai S. CA1 Nampt knockdown recapitulates hippocampal cognitive phenotypes in old mice which nicotinamide mononucleotide improves // NPJ Aging Mech. Dis. 2018. V. 8. № 4. P. 10–16. https://doi.org/10.1038/s41514-018-0029-z
Lundt S., Zhang N., Wang X. et al. The effect of NAMPT deletion in projection neurons on the function and structure of neuromuscular junction (NMJ) in mice // Sci Rep. 2020 V. 10. № 1. P. 99. https://doi.org/10.1038/s41598-019-57085-4
Mäkelä J., Tselykh T.V., Maiorana F. et al. Fibroblast growth factor-21 enhances mitochondrial functions and increases the activity of PGC-1α in human dopaminergic neurons via Sirtuin-1 // Springer Plus. 2014. V. 2. № 3. P. 214. https://doi.org/10.1186/2193-1801-3-2
Martens C.R., Denman B.A., Mazzo M.R. et al. Chronic nicotinamide riboside supplementation is well-tolerated and elevates NAD(+) in healthy middle-aged and older adults // Nat. Commun. 2018. V. 9. P. 1286–1292.
Mills K.F., Yoshida S., Stein L.R., et al. Long-Term Administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice // Cell Metab. 2016. V. 24. P. 795–806.
Musiek E.S., Xiong D.D., Patel T. et al. 2016. Nmnat1 protects neuronal function without altering phospho-tau pathology in a mouse model of taupathy // Ann. Clin. Transl. Neurol. 2013. V. 3. P. 434–442.
Oakey L.A., Fletcher R.S., Elhassan Y.S. et al. Metabolic tracing reveals novel adaptations to skeletal muscle cell energy production pathways in response to NAD + depletion. Version 2 // Wellcome Open Res. 2019. V. 3. P. 147–149.
Petrzilka S., Taraborrelli C., Cavadini G. et al. Clock gene modulation by TNF-alpha depends on calcium and p38 MAP kinase signaling // J. Biol. Rhythms. 2009. V. 24. P. 283–294.
Pillai V.B., Sundaresan N.R., Kim G. et al. Nampt secreted from cardiomyocytes promotes development of cardiac hypertrophy and adverse ventricular remodeling // Am. J. Physiol. Heart Circ. Physiol. 2013. V. 304. P. 415–426.
Quarona V., Zaccarell G., Chillemi A. et al. CD38 and CD157: a long journey from activation markers to multifunctional molecules // Cytometry B Clin. Cytom. 2013. V. 84. P. 207–217.
Rajman L., Chwalek K., Sinclair D.A. Therapeutic potential of NAD-boosting molecules: the in vivo evidence // Cell Metab. 2018 V. 27 P. 529–547.
Ramsey K.M., Yoshino J., Brace C.S. et al. J. Circadian clock feedback cycle through NAMPT-mediated NAD+ biosynthesis // Science. 2009. V. 324. P. 651–654.
Ratajczak J., Joffraud M., Trammell S.A. et al. NRK1 controls nicotinamide mononucleotide and nicotinamide riboside metabolism in mammalian cells // Nat. Commun. 2016. V. 7. P.13103. https://doi.org/10.1038/ncomms13103
Riammer S., Garten A., Schaab M. et al. Nicotinamide phosphoribosyltransferase production in human spermatozoa is influenced by maturation stage // Andrology. 2016. V. 4. P. 1045–1053.
Rossi F., Geiszler P.C., Meng W. et al. NAD-biosynthetic enzyme NMNAT1 reduces early behavioral impairment in the tau mouse model of tauopathy // Behav. Brain Res. 2018. V. 339. P. 140–152.
Ryu D., Zhang H., Ropelle E.R., Sorrentino V. et al. NAD+ repletion improves muscle function in muscular dystrophy and counters global PARylation // Sci. Transl. Med. 2016. V. 8. № 361. P. 139–145.
Sasaki T., Kikuchi O., Shimpuku M. et al. HypothalamicSIRT1preventsage-associatedweight gain by improving leptin sensitivity in mice // Diabetologia. 2014. V. 57. P. 819–831.
Schöndorf D.C., Ivanyuk D., Baden P. et al. The NAD+ precursor nicotinamide riboside rescues mitochondrial defects and neuronal loss in iPSC and fly models of Parkinson’s disease // Cell Rep. 2018. Jun. V. 23. № 10. P. 2976–2988. https://doi.org/10.1016/j.celrep.2018.05.009
Schuster S., Penke M., Gorski T. et al. Resveratrol differentially regulates NAMPT and SIRT1 in Hepatocarcinoma cells and primary human hepatocytes // PLoS One. 2014. V. 9. e91045. https://doi.org/10.1371/journal.pone.0091045
Sociali G., Raffaghello L., Magnone M. et al. Antitumor effect of combined NAMPT and CD73 inhibition in an ovarian cancer model // Oncotarget. 2016. V. 7. P. 2968–2984.
Sorrentino V., Romani M., Mouchiroud L. et al. Enhancing mitochondrial proteostasis reduces amyloid-beta proteotoxicity // Nature. 2017. V. 552. P. 187–193.
Stein L.R., Imai S. Specific ablation of Nampt in adult neural stem cells recapitulates their functional defects during aging // EMBO J. 2014. V. 33. P. 1321–1340.
Stein L.R., Wozniak D.F., Dearborn J.T. et al. Expression of Nampt in hippocampal and cortical excitatory neurons is critical for cognitivefunction // J. Neurosci. 2014. V. 34. № 17. P. 5800–5815.
Stromsdorfer K.L., Yamaguchi S., Yoon M.J. et al. NAMPT-Mediated NAD(+) biosynthesis in adipocytes regulates adipose tissue function and multi-organ insulin sensitivity in mice // Cell Rep. 2016. V. 16 № 7. P. 1851–1860. https://doi.org/10.1016/j.celrep.2016.07.027
Trammell S.A., Schmidt M.S., Weidemann B.J. et al. Nicotinamide riboside is uniquely and orally bioavailable in mice and humans // Nat. Commun. 2016. V. 7. P. 12948. https://doi.org/10.1038/ncomms12948
Tsubota K. The first human clinical study for NMN has started in Japan // Npj Aging and Mechanisms of Disease. 2016 V. 27. P. 21–60. https://doi.org/10.1038/npjamd.2016.21
Wang P., Guan Y.F., Du H. et al. Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyltransferase in cerebral ischemia // Autophagy. 2012. V.8. № 1. P. 77–87. https://doi.org/10.4161/auto.8.1.18274
Wang P., Xu T.Y., Guan Y.F. et al. Nicotinamide phosphoribosyltransferase protects against ischemic stroke through SIRT1-dependent adenosine monophosphate-activated kinase pathway // Ann. Neurol. 2011. V.69. № 2. P. 360–374. https://doi.org/10.1002/ana.22236
Wang S.N., Miao C.Y. Targeting NAMPT as a therapeutic strategy against stroke // Stroke Vasc. Neurol. 2019. V. 4. № 2. P. 83–89. https://doi.org/10.1136/svn-2018-000199
Wang X., Hu X., Yang Y. et al. 2016. Nicotinamide mononucleotide protects against beta-amyloid oligomer-induced cognitive impairment and neuronal death // Brain Res. 2016. № 1643. P. 1–9.
Wang X., Zhang Q., Bao R. et al. Deletion of Nampt in projection neurons of adult mice leads to motor dysfunction, neurodegeneration, and death // Cell Rep. 2017. V. 20. № 9. P. 2184–2200.
Wang X., Zhang Z., Zhang N. et al. Subcellular NAMPT-mediated NAD+ salvage pathways and their roles in bioenergetics and neuronal protection after ischemic injury // J. Neurochem. 2019. V. 151. № 6. P. 732–748. https://doi.org/10.1111/jnc.14878
Wang X., Li H., Ding S. Pre-B-cell colony-enhancing factor protects against apoptotic neuronal death and mitochondrial damage in ischemia // Sci. Rep. 2016. V. 6. P. 32416. https://doi.org/10.1038/srep32416
Xie X., Gao Y., Zeng M. et al. Nicotinamide ribose ameliorates cognitive impairment of aged and Alzheimer’s disease model mice // Metab. Brain Dis. 2019. V. 34. № 1. P. 353–366.
Xing S., Hu Y., Huang X. et al. Nicotinamide phosphoribosyltransferase‑related signaling pathway in early Alzheimer’s disease mouse models // Mol. Med. Rep. 2019. V. 20. № 6. P. 5163–5171. https://doi.org/10.3892/mmr.2019.10782
Yaku K., Okabe K., Nakagawa T. Simultaneous measurement of NAD metabolome in aged mice tissue using liquid chromatography tandem–mass spectrometry (LC/MS/MS) // Biomed. Chromatogr. 2018. V. 32. e4205. https://doi.org/10.1002/bmc.4205
Yamaguchi S., Franczyk M.P, Chondronikola M. et al. Adipose tissue NAD+ biosynthesis is required for regulating adaptive thermogenesis and whole-body energy homeostasis in mice // Proc. Natl. Acad. Sci. USA. 2019. V. 116. № 47. P. 23822–23828. https://doi.org/10.1073/pnas.1909917116
Yano M., Akazawa H., Oka T. et al. Monocyte-derived extracellular Nampt-dependent biosynthesis of NAD(+) protects the heart against pressure overload // Sci. Rep. 2015. V. 5. P. 15857–15864.
Yao Z., Yang W., Gao Z. et al. Nicotinamide mononucleotide inhibits JNK activation to reverse Alzheimer disease // Neurosci. Lett. 2017. V. 647. P. 133–140.
Yoon M.J., Yoshida M., Johnson S. et al. SIRT1-mediated eNAMPT secretion from adipose tissue regulates hypothalamic NAD+ and function in mice // Cell Metab. 2015. V. 21. P. 706–717.
Yoshida M., Satoh A., Lin J.B. et al. Extracellular Vesicle-Contained eNAMPT Delays Aging and Extends Lifespan in Mice // Cell Metab. 2019. V. 30. № 2. P. 329–342.e5. https://doi.org/10.1016/j.cmet.2019.05.015
Yoshino J., Baur J.A., Imai S.I. NAD+ Intermediates: The Biology and Therapeutic Potential of NMN and NR // Cell Metab. 2018. V. 27. № 3. P. 513–528. https://doi.org/10.1016/j.cmet.2017.11.002
Yoshino J., Mills K.F., Yoon M.J. et al. Nicotinamide mononucleotide, a key NAD(+) intermediate, treats the pathophysiology of diet- and age-induced diabetes in mice // Cell Metab. 2011. V. 14. P. 528–536.
Yu A., Zhou R., Xia B. et al. NAMPT maintains mitochondria content via NRF2-PPARα/AMPKα pathway to promote cell survival under oxidative stress // Cell Signal. 2020. V. 66. P. 109–496. https://doi.org/10.1016/j.cellsig.2019.109496
Zhang H., Ryu D., Wu Y. et al. NAD(+) repletion improves mitochondrial and stem cell function and enhances life span in mice // Science. 2016. V. 352. P. 1436–1443.
Zhang H., Ryu D., Wu Y. et al. NAD+ repletion improves mitochondrial and stem cell function and enhances life span in mice // Science. 2016. V. 352. № 6292. P. 1436–1443.
Zhang M., Ying W. NAD+ Deficiency Is a Common Central Pathological Factor of a Number of Diseases and Aging: Mechanisms and Therapeutic Implications // Antioxid. Redox Signal. 2019. V. 30. № 6. P. 890–905. https://doi.org/10.1089/ars.2017.7445
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


