Успехи физиологических наук, 2021, T. 52, № 4, стр. 54-71
Интегративные функции кортико-стрио-таламо-кортикальной системы мозга
С. В. Альбертин *
ФГБУН Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
* E-mail: salber1@rambler.ru
Поступила в редакцию 14.04.2021
После доработки 30.04.2021
Принята к публикации 20.05.2021
Аннотация
В статье обсуждаются нейрофизиологические механизмы, лежащие в основе пространственно-временной интеграции различных структур мозга и физиологических систем организма при выполнении разных форм мотивированного целенаправленного поведения.
КОРТИКО-СТРИО-ТАЛАМО-КОРТИКАЛЬНАЯ СИСТЕМА ГОЛОВНОГО МОЗГА: АНАТОМИЯ И СТРУКТУРНАЯ ОРГАНИЗАЦИЯ
При изучении интегративных функций головного мозга важное значение имеет выяснение сложных взаимоотношений различных областей коры больших полушарий с подкорковыми ядерными структурами – базальными ганглиями (хвостатое ядро, скорлупа, бледный шар, ограда), а также тесно связаными с ними структурами среднего мозга: субталамусом, прилежащим ядром, вентральной покрышкой и черной субстанцией. Базальные ганглии, по определению И.П. Павлова [27] “являются вместе со зрительным бугром ближайшими подкорковыми образованиями, представляющими собой субстрат сложнейших безусловных рефлексов и первую инстанцию для сложных отношений организма с окружающей средой…”.
Основными компонентами базальных ганглиев являются дорсальный и вентральный стриатум и бледный шар – globus pallidum (GP). Дорсальный стриатум образован хвостатым ядром (n. caudatus) и скорлупой (putamen). Вентральный стриатум представлен прилежащим ядром (n. accumbens), состоящим из двух частей – ядра (core part) и оболочки (shell part). Бледный шар (GP) состоит из внутреннего (GPi) и внешнего (GPe) сегментов, известных под названием дорсального паллидума (DP) и вентрального паллидума (VP). Черная субстанция (SN), вентральная тегментальная область (VTA) и субталамическое ядро (STN), учитывая их взаимные тесные связи с основными структурами базальных ганглиев, считаются ассоциированными базальными ганглиозными образованиями. Черная cубстанция состоит из двух частей: компактной (SNpc) и ретикулярной (SNpr) [110]. Ядра базальных ганглиев образуют частично замкнутые нейрональные петли с неокортексом и таламусом (рис. 1).
Рис. 1.
Связи дорсального и вентрального стриатума с двигательными, сенсомоторными и лимбическими структурами мозга. SMC – сенсомоторная кора; DS – дорсальный стриатум (каудатопутамен); GPe – внешний сегмент бледного шара; GPi – внутренний сегмент бледного шара; VA/VL – вентральное переднее и вентральное латеральное ядра таламуса; CM/Pf – интраламинарные ядра таламуса. STN – субталамус; SNpc – компактная область черной субстанции; SNpr – ретикулярная область черной субстанции; PPN – ножково-мостовое ядро; PFC – префронтальная кора; VS – вентральный стриатум (прилежащее ядро); EС – энторинальная кора; SHS – септо-гиппокампальная система; Subic – субикулярная область гиппокампа; Amy – амигдала; DM – дорсо-медиальное ядро таламуса; VP – вентральный паллидум; A10 – отдел А10 вентральной тегментальной области (VTA); SC – верхнии бугорки четверохолмия; STN – субталамус; HYP – гипоталамус. Нейрональные структуры дорсального (“моторного”) отдела стриатума для отличия от структур вентрального (“лимбического”) стриатума на схеме выделены тоном. Пунктирной линией отмечены кратчайшие нейрональные проекции между вентральным и дорсальным отделами стриатума. Нейромедиаторы: DA – дофамин; GABA – гамма-аминомаслянная кислота; GLU – глутамат.
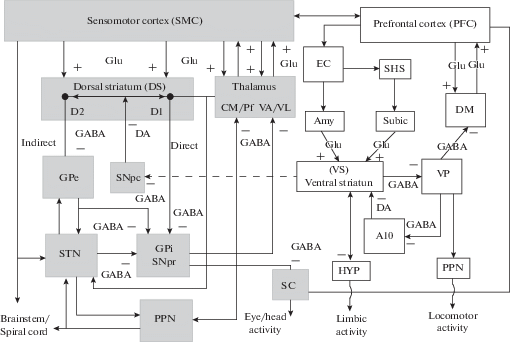
Нейроны большинства областей неокортекса проецируются в стриатум [67]. Сенсомоторные субталамические структуры также непосредственно контактируют со стриатумом, или иннервируют другие таламические области, которые проецируются на стриатум [102]. В отличие от дорсального стриатума, вентральный отдел стриатума (n. accumbens) получает Glu-ергические проекции из префронтальной коры (PFC), субикулярной области гиппокампа (SHS), амигдалы (AMY) и DA-ергические проекции из лимбической структуры среднего мозга – вентральной тегментальной области (VTA). Нейроны стриатума проецируются на GP или SNpr, которые посылают свои проекции в таламические ядра, после чего проецируются обратно в лобную кору. Вентральный стриатум (n. accumbens) посылает ГАМК-ергические проекции в вентральный паллидум, нейроны которого проецируются в дорсо-медиальное ядро (DM) таламуса. Последний посылает Glu-проекции в префронтальную кору. Проекции нейронов неокортекса, субталамуса и таламуса являются активирующими (Glu-ергические), а проекционные нейроны стриатума, GP и SNR – тормозными (ГАМК) проекциями. Активность различных областей неокортекса влияет на активность базальных ганглиев, которые, в свою очередь, модулируют моторную и ассоциативные области коры головного мозга. Положительная модуляция, осуществляемая таламическими нейронами в лобной коре, находится под ингибирующим контролем GPi и SNr. Это торможение может быть заблокировано прямым путем, либо усилено косвенным путем. Прямой путь – проекции стриатума на GPi/SNr. Непрямой путь формируется нейронами стриатума, которые проецируются на STN, посылающий эфферентные проекции на нейроны GPe. Последний затем посылает проекции на GPi/SNr и GPe, а STN посылают взаимные проекции на многие ядра этой нейрональной системы, работая, таким образом, как ретрансляционные станции. Дофаминергические нейроны среднего мозга проецируются, главным образом, в стриатум. Дофамин, высвобождаемый этими нейронами, активирует прямой путь и ингибирует непрямой путь, воздействуя на “D1-подобные” (D1 и D5) или “D2-подобные” (D2, D3 и D4) дофаминовые рецепторы соответственно. Оба действия приводят к модуляции моторных и когнитивных функций лобной коры [45, 61, 67, 110]. Разделение прямых и непрямых путей, по-видимому, является неполным, причем многие проекционные нейроны стриатума оказывают экспрессию как на D1, так и на D2 рецепторы [125]. В этих случаях в каждой субпопуляции нейронов может преобладать одно семейство дофаминовых рецепторов.
Почти 95% нейронов стриатума состоят из ГАМК-ергических проекционных нейронов, называемых средними шипиковыми нейронами (MSNs). Другие нейроны стриатума – это интер-нейроны, которые взаимодействуют и модулируют активность MSNs, включая парвальбумин-содержащие, ГАМК-высвобождающие интернейроны; соматостатин-позитивные интернейроны и гигантские холинергические нешипиковые интернейроны, также называемые тонически активными нейронами – TANs [88, 114, 127]. Однородность цитоархитектуры стриатума ясно выражена. MSN клетки прямого и не прямого путей гомогенно смешаны [76, 77]. При этом MSNs нейроны образуют участки бедных ацетилхолинэстеразой, но богатых μ-опиоидными рецепторами областей, называемых стриосомами (striosomes), которые окружены плотными богатыми ацетилхолинэстеразой матрицами [79].
Ключевой структурой базальных ганглиев является стриатум. Практически все модальности кортикальных областей проецируются на стриатум. Сенсомоторные, ассоциативные или лимбические кортикальные проекции в стриатуме существуют в виде множества параллельных сегрегированных нейрональных петель [45, 46, 66, 67, 87].
Изучение проекций первичной соматосенсорной и моторной коры обезьян на стриатум, проведенные Флагерти и Грейбил [72, 73] показали, что единицы различных модальностей соматосенсорной и моторной информации, закодированные в разных областях коры, могут проецироваться на одну и ту же область стриатального матрикса. Авторы назвали каждую область матрикса, представляющую часть тела, матрицей. Корковые области, кодирующие, например, моторные и сенсорные свойства (болевая, температурная и мышечная чувствительность), могут накладыватся друг на друга в одной матрисоме. При этом авторы обнаружили несколько матрисом в стриатуме, кодирующих одну и ту же функциональную часть тела. Это указывает на то, что области коры, представляющие часть тела, проецируются на несколько матрисом в стриатуме. В этом отношении распределение матрисом в стриатуме представляет собой мозаику из множества сенсомоторных единиц, которые могут быть многократно представлены.
Концепция кортикостриатальной конвергенции и дисперсного повторения матрисом в стриатуме противоположна концепции разделенных, сегрегированных и параллельных кортико-стриатных петель. В настоящее время ведутся споры о том, какая из этих концепций лучше объясняет кортико-стриатальное функционирование [58, 77]. Следует, однако, отметить, что кортико-стриатная конвергенция может быть неполной и, безусловно, неоднородной по всему стриатуму.
Вышеописанные физиологические, анатомические и гистохимические исследования среди изученных структур головного мозга выделяют кортико-стрио-таламо-кортикальную систему мозга, состоящую из ряда параллельных, функционально сегрегированных петель, которые связывают различные области коры, базальные ганглии, ядра таламуса и мезолимбические структуры среднего мозга и возвратно фокусируются на различных участках префронтальной коры. Имея сенсорный вход, опосредованный импульсацией, поступающей из таламуса, прямые и опосредованные эфферентные выходы на структуры, участвующие в регуляции двигательных, лимбических и локомоторных функций организма, данная система может играть ведущую роль в интеграции различных структур мозга и всего организма при выполнении мотивированного целенаправленного поведения. Очевидно, что для выполнения этой задачи в различные фазы планируемого поведения нейроны головного мозга, находящиеся в сегрегированных параллельных нейрональных сетях и петлях, включая мозаики распределенных в стриатуме матриосом, должны объединятся в функциональные блоки, определяющие формирование доминантного состояния центров и вектора целенаправленного поведенческого акта в данной конкретной ситуации и в данное время.
В дальнейших разделах статьи будут рассмотрены нейрофизиологические механизмы, лежащие в основе пространственно-временной интеграции различных структур мозга и физиологических систем организма при выполнении разных форм мотивированного целенаправленного поведения.
НАРУШЕНИЯ ИНТЕГРАТИВНОЙ ДЕЯТЕЛЬНОСТИ МОЗГА ПОСЛЕ ОПЕРАТИВНОГО ВЫКЛЮЧЕНИЯ КОРЫ И РАЗЛИЧНЫХ ПОДКОРКОВЫХ ОБРАЗОВАНИЙ
В отличие от выраженной органической патологии базальных ганглиев, сопровождаемой возникновением экстрапирамидных двигательных расстройств и развитием таких тяжелых заболеваний, как хорея, атетоз, болезни Паркинсона и Альцгеймера, экспериментаторы, исследующие зависимость нарушений интегративной деятельности мозга после оперативного выключения коры и различных подкорковых образований, входящих в состав кортико-стрио-таламо-кортикальой системы мозга, выявили ряд интересных особенностей, зависящих от размера и характера повреждения мозговой ткани. Отмечено, что при сравнительно небольших (локальных) повреждениях исследуемой структуры мозга, как правило, трудно выявить однозначные изменения поведения, а если они наблюдаются, то отличаются вариативностью и быстро проходят (компенсируются) за счет оставшихся интактными клеток этой структуры мозга. Показательным примером восстановления (реинтеграции) функций при локальных повреждениях мозга являются исследования, показывающие отсутствие каких-либо изменений двигательной активности и поведения у животных при повреждении дофаминергических нейронов черной субстанции – substania nigra, если количество сохранившихся клеток не падает ниже 20% от общего числа нейронов этого образования среднего мозга [59, 115]. По данным Э. Кастанеда [59], при снижении числа неповрежденных нигральных ДА-клеток до 5–15% у животных наблюдались отчетливые, но быстро проходящие изменения поведения и двигательной активности, при этом внеклеточное содержание стриатного дофамина возвращалось к дооперационному уровню, и лишь при 95–100% повреждении ДА нейронов указанные нарушения приобретали необратимый характер [59].
Следует отметить, что при моделировании патологии нервной системы путем значительных повреждений, или полном разрушении структуры (минус функции ядра), получаемые нарушения поведения опосредованы не только разрушением тестируемого ядра, но и расстройствами, связанными с разрывом многочисленных афферентных и эфферентных путей, связывающих выключаемое ядро с другими образованиями мозга, возможными сопутствующими повреждениями соседних структур мозга, а также осложняются последствиями, обусловленными общей тяжелой реакцией организма на травму мозга и посттравматической интоксикацией.
Попытки экспериментаторов исследовать функции мозга путем использования менее травматического обратимого (холодового) выключения тестируемых областей неокортекса и подкорковых структур [13, 32] дали неожиданные результаты. Так, опыты В.А. Сосенкова [32] показали, что условная пищевая реакция, выработанная у кошек при холодовом выключении височной коры пропадает после включения раннее охлаждавшихся отделов коры. Это опыты позволили сделать важный вывод: формирование условного рефлекса у подопытных кошек при модельном упрощении анатомической организации мозга может происходить при интеграции оставшихся интактными образований мозга, которая, однако, разрушается при последующем включении височной коры, то есть создании новых (плюс функция височной коры) межструктурных взаимоотношений мозга.
Полученные данные дали возможность Н.Ю. Беленкову [14] обосновать представление о системной организации целостного мозга, впервые сформулированного Л.С. Выготским еще в 1934 г., который отмечал, что “…функция мозга, как целого, представляет собой продукт интегративной деятельности расчлененных, дифференцированных и снова иерархически объединенных между собой функций отдельных участков мозга” [19]. При этом по Выготскому [19] специфическая функция каждой особой межцентральной системы заключается прежде всего в обеспечении совершенно новой продуктивной, а не только тормозящей и возбуждающей деятельности низших центров, формы сознательной деятельности.
Дальнейшие нейрофизиологические исследования, выполненные с использованием системного подхода [11, 14, 33] позволили упрочить представление о мозге как особой сверхсистеме, состоящей из макро- и микросистем и сетей взаимосвязанных нервных клеток и ядерных образований головного мозга. При этом исследователи [12, 29, 33, 35] основную роль в организации различных форм интегративного поведения отводили наличию многообразных корково-подкорковых систем: стриопаллидарной, нигро-стрио-нигральной, стрио-таламо-кортикальной, амигдало-таламо-кортикальной и другим системам и подсистемам переднего мозга, характерной особенностью которых является наличие между структурами хорошо выраженных двусторонних связей (тормозных или активирующих), образующими данную систему.
Сравнительный анализ результатов проведенных нами модельных исследований, связанных с системным упрощением различных отделов нервной системы: перерезка кортико-спинальных проводящих путей [3, 41], повреждение неостриатума [2, 34, 126], нейрональная изоляция неокортекса [15–17] позволили выявить специфику соотношения структуры и функции на различных уровнях нервной системы – спинальном, подкорковом и корковом и их роль в реинтеграции утраченных функций. Показано, что компенсация нарушенных функций имела место во всех указанных опытах, но происходила при определенных условиях, с различной скоростью и с разной степенью выраженности. Наименьшая компенсация утраченных функций мозга наблюдалась при повреждениях на спинальном, а наиболее полная – на корковом уровне. При этом компенсация функций при повреждениях на подкорковом уровне (неостриатум), по сравнению со спинальным уровнем, в большей степени зависела от условий проведения опыта.
При интерпретации вышеуказанных данных важно учитывать, что, если в процессах структурно-функциональной реинтеграции центральной нервной системы, наблюдаемых при повреждениях на спинальном (кортико-спинальные проводящие пути) и подкорковом (неостриатум) уровнях, могут участвовать другие, оставшиеся интактными образования мозга, то при повреждениях на корковом уровне (нейрональная изоляция коры от подкорки) практически полная компенсация функций корковых нейронов происходит за счет своих внутренних резервов, связанных с высокими пластическими возможностями нейронально-изолированного неокортекса, сохранившего многочисленные морфофункциональные связи между различными слоями коры и цитоархитектоническими полями неокортекса, а также трофические и гуморальные влияния целого организма [17].
Полученные результаты также показали, чем филогенетически моложе являются нейрональные образования, тем менее выражены последствия, связанные с нарушением их целостности и тем значительнее должны быть усилия экспериментатора для выявления морфофункциональных нарушений центральной нервной системы, другими словами, чем генетически моложе изучаемое образование мозга, тем менее строгим является принцип локализации функций. Это согласуется с клиническими наблюдениями [18], которые показывают, что в патогенезе многих заболеваний (Корсаковский синдром, болезни Альцгеймера, Хантингтона) у наблюдаемых пациентов в течение длительного периода времени могут отсутствовать симптомы заболевания и какие-либо жалобы на состояние здоровья, несмотря на наличие нейродегенеративных изменений, выявляемых в коре головного мозга при объективном диагностическом обследовании.
ПРОЦЕССЫ ПРЕДПУСКОВОЙ ИНТЕГРАЦИИ КОРТИКО-СТРИО-ТАЛАМО-КОРТИКАЛЬНОЙ СИСТЕМЫ ПРИ ПОДГОТОВКЕ И ОСУЩЕСТВЛЕНИИ РАЗЛИЧНЫХ ВИДОВ ПОВЕДЕНИЯ
Наряду с изучением влияния оперативного повреждения различных отделов центральной нервной системы на нарушение упроченной интегративной деятельности мозга, важное значение имеет исследование физиологического процесса предпусковой интеграции, развиваемого во времени, и связанного с мобилизацией нервной, мышечной и вегетативной систем организма, необходимого для выполнения предстоящих действий. Следует подчеркнуть, что точный и надежный расчет времени – важный компонент не только пространственно-организованного, но и практически любого целенаправленного поведения у человека и животных. Подобно тому, как мозг содержит механизмы для отслеживания и ориентации тела в пространстве, он также должен уметь ориентироваться во времени. Обнаружение совпадений – интеграция одновременной активации нескольких входов – это предлагаемое решение вопроса о том, как мозг отслеживает продолжительность событий в диапазоне от секунд до минут с использованием нейронных процессов суб- и супрасекундного масштаба.
Структурно-функциональная организация кортико-стрио-таламо-кортикальной системы, имеющей прямое и опосредованные влияние на когнитивные процессы (внимание, память), а также на исполнительные элементы основных физиологических систем организма, играет ведущую роль в организации сложного процесса предпусковой интеграции, тесно связанного с формированием внутреннего торможения при временной отсрочке предстоящего действия.
Впервые на важность оценки времени организмом животного указал И.П. Павлов в 1903 году при проведении опытов с формированием классических слюноотделительных рефлексов и желудочного сока у собак [27]. Павлов обнаружил, что, когда колокольчик – условный сигнал (У/С) регулярно звучит непосредственно перед кормлением, звук колокольчика в конечном итоге вызывает слюноотделение. При отставлении безусловного подкрепления (БУ/С) у собак слюноотделение происходило не в течение всего интервала условного сигнала, а преимущественно к концу интервала, при этом латентность слюноотделения увеличивалась как функция продолжительности между У/С и БУ/С. Более поздние исследования показали, что повреждение и электрическая стимуляция хвостатого ядра, орбитальной коры [21–23, 33, 126], а также гипоталамуса и амигдалы [91, 101], критически влияют на процесс классического обусловливания слюноотделения.
ЭЭГ-исследования слюноотделительного рефлекса, проведенные на собаках [33, 39, 126], позволили выявить фазность изменений кросскорреляции в стрио-таламо-кортикальных структурах в период изолированного действия условных раздражителей, что свидетельствует о динамичности процессов объединения компонентов ЭЭГ в общую систему временных функциональных связей (рис. 2). При выработанном рефлексе регистрировались общие ритмические процессы, в частности по δ- и θ-ритмам, между отдельными структурами системы. Важно отметить, что сдвиги cуммарной электрической активности на условный сигнал были аналогичны тем, которые наблюдались при акте поедания пищи. Такое опережающее воспроизведение паттернов ЭЭГ в хвостатом ядре, обусловленное анализом временных параметров условного сигнала, может свидетельствовать о способности нервных элементов стриатума формировать ответы по механизму опережающего возбуждения на предстоящее подкрепление.
Рис. 2.
Слева – Трехфазные изменения электрокаудатограммы собаки при изолированном действии пищевого условного раздражителя – М6 [33, 126]. а – фон; б – первая фаза изменения электрокаудатограммы; в – вторая фаза; г – третья фаза; д – М6 поедание пищи; е – последействие. Ges – gyrus ectosilvius; Gor – gyrus orbitalis; nCd – nucl. caudatus; CM – centrum medianum thalami. Вверху – отметка времени (0.1 с) и подачи кормушки; справа – калибровка амплитуды ЭЭГ (100мкВ). 1 – электрограмма дыхания; 2 – жевательные движения челюстей; 3 – общего движения собаки; 4 – регистрация капель слюны. Справа вверху – Динамика саливации при выработке секреторного у/р на предъявление позитивного сигнала у интактных (1) и каудатэктомированных (2) собак (вверху – локализация повреждений хвостатого ядра). Внизу – Схематическое изображение гомеостатических (1) и ДА – ергических (вознаграждение/мотивация) проводящих путей (2); VT – вентральная тегментальная область, SN – черная субстанция, NA – прилежащее ядро, PFC – префрональная кора, СР – каудато-путамен, AMG – амигдала, (ARC) – дугообрaзное ядро.
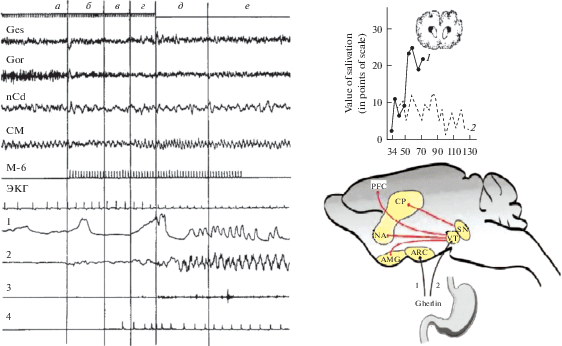
Способность торможения секреции слюны и желудочного сока при у/р задержке пищи сопровождается сложным процесс подготовки (предпусковой интеграции) исполнительных механизмов вырабатываемого условного рефлекса к моменту подачи отсроченного пищевого подкрепления, что играет важную роль в организации адаптивного пищевого поведения и сохранения нормального функционирования висцеральных органов животного в процессе интеграции исполнительных механизмов. Эксперименты, проведенные на крысах с регистрацией ДА-активности нейронов неостриатума показали градуальное повышение их активности при ожидании пищевого вознаграждения [94, 113], аналогичные результаты были получены в опытах на обезьянах при регистрации активности нейронов вентрального стриатума, получающими DA-ергические проекции из вентральной тегментальной области мозга [64, 71, 90, 116]. При этом ожидание предстоящего подкрепления сопровождалось повышением секреции желудочного гормона – грелина (ghrelin), воздействующего на нейрональную активность ДА-ергических нейронов среднего мозга, гипоталамус и дугообразное ядро [86, 97, 98, 128]. Таким образом, в механизме опережающего возбуждения на предстоящее пищевое подкрепление важную роль играет взаимодействие гомеостатических и ДА-ергических влияний, поступающих из мезолим-бических структур среднего мозга в дорсальные и вентральные отделы стриатума, амигдалу и префронтальную кору головного мозга. На рис. 2 дано схематическое изображение гомеостатических и ДА-ергических проводящих путей. Основные пути, вовлеченные в процесс пищевой мотивации – дофаминергические проекции вентральной тегментальной области (VT) и черной субстанции (SN), посылаемые соответственно в прилежащее ядро (NA), префрональную кору (PFC) и каудато-путамен (СР). Пептидный гормон желудка грелин (ghrelin) активирует этот путь на уровне VTA/SN. Это обеспечивает потенциальную возможность для грелина обеспечить потребление пищи даже в том случае, когда дугообрaзное ядро – arcuate nucleus (ARC), или латеральный гипоталамус показывают состояние насыщения пищей. Это также возможно, если грелин воздействует на пищевую мотивацию непрямым образом, например, активируя афферентный путь посредством μ- и NPY-опиоидных рецепторов [120, 121].
На важность предпусковой интеграции для подготовки исполнительных механизмов вырабатываемого пищедобывательного рефлекса к моменту подачи отсроченного подкрепления указывают проведенные нами опыты [1, 8] с отставлением пищевого подкрепления у кошек при реализации двигательного рефлекса удержания передней лапой выжатой педали до отмены действия условного раздражителя и подачи подкрепления (рис. 3). В результате проведенных исследований показано различное влияние стимуляции ДА-реактивной системы хвостатого ядра на два вида инструментальных условных рефлексов, различающихся по времени подачи безусловного подкрепления от начала действия условного раздражителя. В отличии от фазического условного рефлекса, где получение пищевого подкрепления осуществлялось непосредственно после выжима педали (на 1–2-й с действия условного раздражителя), в тоническом инструментальном рефлексе выжим педали означал лишь принятие исходного положения, поддержание которого на период изолированного действия условного раздражителя составляло недеятельную фазу инструментального условного рефлекса. Приспособительное поведение животных в этом случае строилось на выработке запаздывающего торможения в период изолированного действия условного раздражителя. Следует подчеркнуть, что быстрая смена в течение одного сочетания противоположных по своему поведенческому выражению функциональных состояний: условнорефлекторного торможения – недеятельная фаза, связанная с удержанием педали рабочей лапой, и условнорефлекторного возбуждения – деятельная фаза, связанная с осуществлением той же конечностью пищедобывательной реакции, представляет сложную задачу в связи с высокой возбудимостью и подвижностью нервных процессов в двигательном анализаторе [25, 30]. Для ее успешного выполнения подопытным животным необходимо в недеятельную фазу инструментального условного рефлекса не только ограничить излишнюю локомоторную активность, но и осуществить сложный процесс подготовки двигательных исполнительных механизмов к предстоящей пищедобывательной реакции. Показателем этого процесса в наших опытах являлось четкое снижение тонической активности экстензора – m. triceps brachii рабочей конечности животного по мере изолированного действия зрительного условного раздражителя, т.е. наблюдалось перераспределение активности мышцы-антагониста, направленное на более адекватное выполнение двигательной пищевой реакции, запуск которой приурочен к моменту подачи пищевого подкрепления (рис. 3).
Рис. 3.
Динамика предпусковой интеграции при реализации тонической двигательной реакции у животных после внутристриатной инъекции физиологического раствора (контроль) и нейромедиатора дофамина: ДА1 – исходная мотивация, ДА2 – после предварительного кормления [1, 8]. На электрограмме сверху вниз: механограмма (МХГ) движения рабочей лапы животного (выжима рычага манипулятора и его удержание в течение 8–12 с, необходимого для подачи пищи и ее захвата рабочей лапой); электромиограммы (ЭМГ) мышцы-сгибателя (m. biceps brachii) и мышцы-разгибателя (m. triceps brachii) рабочей лапы; У/С – условный сигнал; БУ/С – безусловный сигнал (подкрепление); отметка включения сенсорных сигналов. Калибровка времени – 1 с. Скорость движения на экране зрительных сигналов – 6°/с.
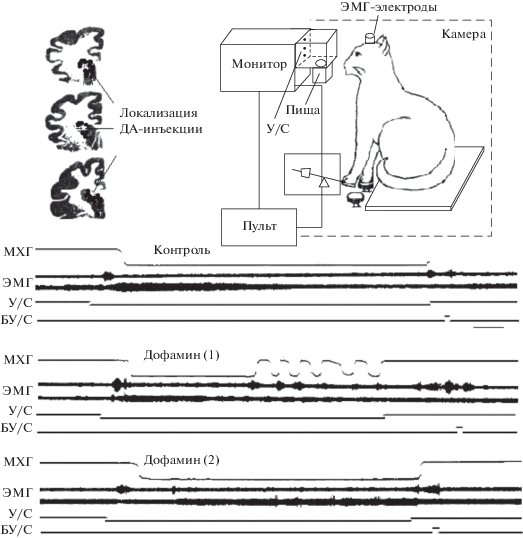
Как показали наши исследования, стимуляция ДА-реактивной системы хвостатого ядра не оказывала существенного влияния на реализацию и выработку инструментальных условных рефлексов на совпадающие раздражители. Вместе с тем инъекция дофамина критическим образом отразилась на осуществлении запаздывающих инструментальных условных рефлексов при ожидании отмены условного сигнала. У подопытных животных практически оказалось невозможным выработать тоническую фазу инструментального ответа при отставлении безусловного подкрепления более чем на 2–3 с. У кошек с предварительно упроченными запаздывающими инструментальными рефлексами при осуществлении условнорефлекторной деятельности наблюдались две формы расстройств недеятельной фазы инструментального условного рефлекса: 1) недеятельная фаза рефлекса заменялась быстрыми повторными выжимами педали рабочей конечностью (максимальное время удержания педали при этом составляло 2–3 с); 2) при замене недеятельной фазы инструментального рефлекса на деятельную наблюдалось появление значительной задержки (250–450 мс) в осуществлении последующей пищедобывательной реакции. В обоих случаях у подопытных животных, по сравнению с контрольными, наблюдалась потеря способности приурочить пищедобывательную реакцию, осуществляемую рабочей конечностью, к моменту отмены условного сигнала и подаче безусловного подкрепления. Характер ЭМГ-нарушений, выявленных в недеятельную фазу инструментального рефлекса при стимуляции ДА-реактивной системы хвостатого ядра, позволяет предположить, что в основе вышеуказанных расстройств лежат нарушения нормального перераспределения тонической активности мышц-антагонистов рабочей конечности, связанные с подготовкой к захвату отставленного пищевого подкрепления. Между тем инъекция дофамина вызывает нарушение перестройки тонической активности мышцы-антагониста и сопутствующие двигательные расстройства лишь в недеятельную фазу запаздывающего инструментального рефлекса, причем, чем выше уровень исходной мотивации, тем эти нарушения значительнее. На важную роль уровня дофамина в регуляции функции стриатума, связанной с ограничением локомоторной активности при выполнении предстоящего условнорефлекторного ответа ранее указывали Э.Б. Арушанян и В.А. Отеллин [9].
Картина участия стриатного дофамина в регуляции запаздывающих инструментальных рефлексов будет неполной, если не рассмотреть связь выявленных двигательных расстройств с уровнем мотивационного возбуждения. В отличие от других видов внутреннего торможения (дифференцировочного, угасательного) при выработке запаздывающего торможения имеет место не полная отмена безусловного подкрепления, а лишь его отставление. Последнее ведет к возникновению дополнительного источника мотивационного напряжения, растущего по мере изолированного действия условного раздражителя и ожидания предстоящего подкрепления. Следовательно, для успешного выполнения запаздывающих инструментальных условных рефлексов наряду с мобилизацией двигательных исполнительных механизмов важное значение имеет процесс регуляции мотивационного возбуждения в недеятельной фазе рефлекса.
В условиях наших экспериментов трудно оценить характер влияния стриатного дофамина на процесс регуляции мотивационного возбуждения в недеятельной фазе запаздывающего инструментального рефлекса. Однако однонаправленность обоих процессов, их синхронное изменение по мере изолированного действия условного раздражителя предполагает наличие единого нейрохимического механизма, лежащего в основе подготовки как двигательного, так и вегетативного компонентов недеятельной фазы инструментального запаздывающего условного рефлекса. В этой связи значительный интерес представляют исследования изменений метаболизма дофамина у кошек при выполнении инструментальной (go-, no-go) задачи, в которой основным условием получения животными пищевого подкрепления являлось воздержание от выполнения двигательной пищевой реакции в течение 7 с действия зрительного условного сигнала [89]. Показано, что из всех исследованных структур мозга (лобная кора, стриатум, миндалина, гиппокамп, таламус, гипоталамус, ядра шва среднего и продолговатого мозга и моста) после достижения критерия обученности изменения (снижение содержания дофамина) наблюдались лишь в стриатуме и миндалине. Отметим также, что исследования инструментальных рефлексов у обезьян [108, 117, 118], проведенные с регистрацией электрической активности мышц рабочей и опорной лап животного, а также мышц туловища, подтвердили результаты наших опытов на кошках и собаках о критической роли ДА-реактивной системы стриатума в процесссах синергической подготовки не только рабочих мышц конечности, но и перестройки исходной позы для выполнения предстоящих двигательных реакций [1, 8, 34].
Описанные нарушения классических секреторных и пищедобывательных рефлексов, выявленные при повреждении ядер стриатума, или их фармакологической стимуляции, а также изменения нейрональной активности ДА-ергических нейронов вентрального стриатума, полученные при временной задержке подкрепления, показаны в опытах на разных видах животных: крысах [94, 113, 123], кошках [1, 8, 89], собаках [33, 39, 126] и обезьянах [90, 116, 118], что свидетельствует о ведущей роли стриатума и дофамина в сложном процессе предпусковой интеграции, связанной с оценкой временной последовательности условных раздражителей и подготовкой различных физиологических систем (сенсорной, гуморальной и двигательной) организма к выполнению предстоящих действий.
ОЦЕНКА ВРЕМЕНИ ПРИ ПЛАНИРОВАНИИ И ОСУЩЕСТВЛЕНИИ ЦЕЛЕНАПРАВЛЕННОГО ПОВЕДЕНИЯ И СИНХРОНИЗАЦИЯ НЕЙРОНАЛЬНЫХ ПРОЦЕССОВ, ОСУЩЕСТВЛЯЕМАЯ КОРТИКО-СТРИО-ТАЛАМО-КОРТИКАЛЬНОЙ СИСТЕМОЙ
При изучении поведения живого организма необходимо учитывать, что точный и надежный расчет времени – важный компонент не только пространственно-организованного, но и практически любого целенаправленного поведения. В отличие от других физических и перцептивных измерений, время действует повсеместно: все стимулы и действия имеют временную протяженность, а восприятие времени опирается на непрерывный опыт поведения у животных и человека [47, 57, 80, 93, 132]. Оценка времени занимает центральное место практически во всех формах адаптивного поведения, таких как избегание опасности, поиск пищи и общение, принятие решения о реагировании. Однако, в отличие от других основных измерений, для времени не существует специального органа чувств. Внутренне ощущаемое живыми организмами время – это эпифеномен функционирования мозга, который создается на основе индивидуального опыта, чтобы фиксировать последовательность событий [49, 80, 81, 96].
Подобно тому, как мозг содержит механизмы для отслеживания и ориентации тела в пространстве, он также должен уметь ориентироваться во времени. Обнаружение совпадений, интеграция одновременной активации нескольких входов – это предлагаемое решение вопроса о том, как мозг отслеживает продолжительность событий в диапазоне от секунд до минут с использованием нейронных процессов субсекундного масштаба.
Попытки ученых выявить нейрональный механизм оценки временных событий, воспринимаемых животными, в основном, связаны с исследованием ритмически организованной активности нейронов стриатума и неокортекса [10, 31, 83, 99, 119].
В настоящее время наиболее популярным объяснением нейронной основы интервального времени, с точки зрения обнаружения совпадений колебательных процессов, является модель “частоты биений стриатума” – Striatal Beat Frequency (SBF) [95, 99, 109]. Модель SBF включает набор кортикальных нейронов-хронометристов, которые колеблются с регулярными, но разными частотами, что позволяет уникальному паттерну активации происходить в каждый момент времени (рис. 4). Эти паттерны активации проецируются на интеграторов стриатума, которые объединяют свою информацию с обратной связью (например, ввод вознаграждения) и формируют основу для определения временных интервалов. Независимые направления исследований сходятся в выводе о том, что функциональные цепи, состоящие из префронтальной коры, стриатума и таламуса, играют важную роль, как в восприятии времени, так и в измерении времени [48, 57, 62, 63, 84, 103].
Рис. 4.
Схематическое изображение взаимодействия нейрональных структур стрио-таламо-кортикальной системы мозга в соответствии с SBF (striatal beat frequency)-моделью [99]. Верхний рисунок показывает, как кортикальные нейроны, колеблющиеся на разных частотах, проецируются на шипиковые нейроны стриатума. Набор осцилляторов, которые активны в момент соответствующего сигнала (например, смещение стимула), обеспечивает код длительности. Нижний рисунок иллюстрирует, как тета- и гамма-осцилляции коры могут лежать в основе поддержания представлений стимулов в рабочей памяти: отдельные элементы кодируются в пространственном паттерне клеток, запускаемых в течение данного гамма-цикла, с повторением всей последовательности на последующих тета-циклах и с емкостью STM, зависящей от количества элементов, которые могут быть “вписаны” в каждый тета-цикл. Путем моделирования авторами показано, что представления рабочей памяти и хронометраж могут быть закодированы в рамках одного осциллятора, причем различные размеры нейронных колебаний обеспечивают основу о деталях, порядке и длительности информации.
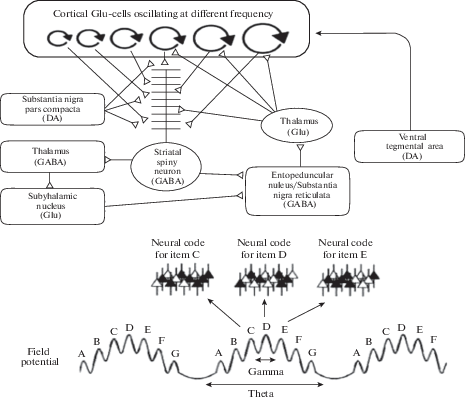
Кортико-стриатная система соответствует функциональным компонентам модели SBF [99, 103], при этом осцилляторные нейроны коры и вознаграждение, поступающее от черной субстанции, интегрируются средними шипиковыми нейронами стриатума (MSN). Эти нейроны могут удерживать временные “воспоминания” через долгосрочную потенциацию с помощью дофамина и долгосрочную депрессию, возможно, через транспортировку рецептора α-амино-3-гидрокси-5-метил-4-изоксазолепропионовой кислоты [60], модулирующего синаптические веса. Позже, когда такая же длительность сигнала снова синхронизируется, эти нейроны сравнивают текущий паттерн корковой активации с сохраненными “воспоминаниями”; если совпадение обнаружено, то шипиковые нейроны срабатывают, показывая, что заданная продолжительность истекла. Однако эти нейронные структуры, содержащиеся в кортико-стриатном образовании, могут быть не единственными, участвующими в интервальном времени. Следует отметить, что некоторые исследователи [31] полагают, что временные интервалы кодируются не путем возбуждения корковыми осцилляторами шипиковых клеток в стриатуме, а непосредственно в неокортексе, тогда как роль ДА-зависимой модуляции корково-стриатных входов состоит в реорганизации активности выходных ядер базальных ганглиев, влияющей на время повторного возвращения возбуждения в кору, от которого зависит тактовая частота восприятия времени.
Описанная SBF-модель, основанная на согласованном взаимодействии дорсального отдела хвостатого ядра, таламуса, черной субстанции, лобной коры и выходных путей стриатума, в целом, удовлетворительно объясняет нейрональный механизм оценки времени при выполнении животным относительно простых форм секреторного и локального двигательного рефлексов.
Более сложные формы мотивированного поведения, связанные с ориентацией животных в пространстве и последовательной сменой тактики поведения, требуют координированной работы сенсорной, двигательной и гуморальной систем организма. В этих условиях оценка времени происходит в другом, супрасекундном масштабе времени, а поведенческий акт может быть разбит на несколько этапов поведения, последовательно приближающих животное к появлению целевого сигнала, связанного с предъявлением ожидаемого вознаграждения. При этом в оценке времени резко возрастает роль избирательного внимания и эпизодической памяти при выполнении последовательных этапов поведения [105].
В проведенных нами опытах [5–7, 42, 43, 131] по изучению поискового поведения крыс в 4-х рукавном лабиринте (рис. 5) животным в процессе поиска предпочитаемого подкрепления необходимо было последовательно реагировать на различные условнорефлекторные раздражители, сигнализирующие о приближении к моменту получения предпочитаемого (наибольшего) подкрепления: на изолированное предъявление локальных внутрилабиринтных сигналов, затем их одновременное включение, которое требует смены тактики поведения – поиску наибольшего подкрепления в лабиринте путем ориентации животных по экстралабиринтным навигационным сигналам, определяющим местонахождение в лабиринте предпочитаемой пищи. Очевидно, что в этом случае подкрепляющие аттрактивные свойства предпочитаемого подкрепления переносились на все вышеуказанные условнорефлекторные сигналы, предшествующие подкреплению, мотивационное значение которых усиливалось по мере поэтапного приближения животного к предпочитаемому наибольшему подкреплению. В наших опытах инвариантный памятный след на целевой условнорефлекторный сигнал (конфигурация экстралабиринтных навигационных знаков) у животных сохранялся при частичном изменении егo конфигурации, указывающей на точное местоположение пищевого подкрепления в лабиринте. Момент опознания целевого сигнала сопровождался у крыс разрядами активности нейронов гиппокампа и вентрального стриатума (n. аccumbens) в тетадиапазоне частот, что свидетельствовало о пространственной синхронизации этих структур, необходимой для выполнения заключительного этапа поведенческого акта – получение ожидаемого подкрепления.
Рис. 5.
Выбор подопытными животными предпочитаемого подкрепления в лабиринте с дифференцированным подкреплением при последовательном и одновременном включениях локальных зрительных сигналов во всех рукавах радиального лабиринта [42, 43]. Цифры на рисунке – количество капель подкрепления в рукавах лабиринта. Кружки со стрелками – направление обзорного движения при ориентации животного с помощью экстралабиринтных навигационных сигналов (геометрические знаки (+, ⚪, –, △) для определении локализации предпочитаемого подкрепления в лабиринте. Справа сверху – кроскоррелограмма синхронной активности в тета-диапазоне нейронной активности прилежащего ядра и гиппокампа, регистрируемой при выборе предпочитаемого (наибольшего) подкрепления. Справа внизу – уровень правильных ответов при выборе наибольшего подкрепления до и после повреждения прилежащего ядра.
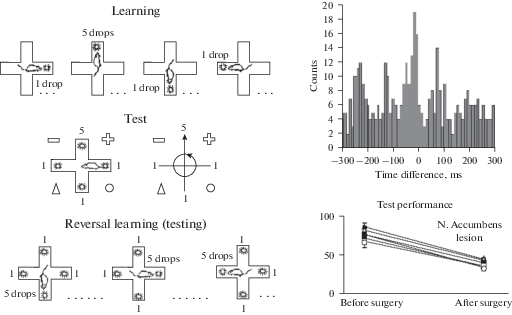
Повреждение прилежащего ядра в наших опытах сопровождалось нарушением синхронизации указанных структур мозга и потерей способности животных к безошибочному реагированию на предъявление целевых условнорефлекторных сигналов (поиску наибольшего подкрепления в лабиринте путем ориентации животных по экстралабиринтным навигационным сигналам, определяющим местонахождение в лабиринте предпочитаемой пищи) при сохранении рефлекторных реакций по типу стимул–ответ на изолированное предъявление внутрилабиринтных условных сигналов.
Известно, что кросскорреляционные взаимодействие в ритме тета (8–12 Гц) и гамма (40–80 Гц) частот трактуется как взаимодействие кортикальных и подкорковых структур [61]. Показано, что продолжительность действия – тета-активности и количество содержащихся в нем гамма-колебаний коррелирует с продолжительностью различных этапов поведенческого акта и близостью предстоящего подкрепления [69, 82, 92]. Гиппокампальные нейроны при этом кодируют энграмму эпизодической памяти, лежащую в основе формирования так называемого ментального времени на различных этапах целенаправленного поведения. Возрастание пищевой мотивации при приближении животного к предстоящему подкреплению поддерживается с помощью градуального повышения уровня дофамина в вентральном стриатуме [54, 111, 112].
АЛЬТЕРНАТИВНЫЕ ТРАКТОВКИ НЕЙРОНАЛЬНОГО МЕХАНИЗМА ФУНКЦИОНИРОВАНИЯ КОРТИКО-СТРИО-ТАЛАМО-КОРТИКАЛЬНОЙ СИСТЕМЫ И ЕЕ ВЛИЯНИЕ НА ПОВЕДЕНИЕ
Современные исследования позволили упрочить представление о мозге как особой сверхсистеме, состоящей из макро- и микросистем и сетей взаимосвязанных нервных клеток и ядерных образований головного мозга. Ряд ученых [12, 29, 33, 35, 45] основную роль в организации разных форм интегративного поведения отводили наличию многообразных корково-подкорковых систем: стрио-паллидарной, стрио-таламо-кортикальной, нигро-стрио-нигральной, амигдало-таламо-кортикальной и другим системам и подсистемам переднего мозга, характерной особенностью которых является наличие между структурами хорошо выраженных двусторонних (тормозных или активирующих) связей.
Другие исследователи [14, 37] подчеркивали важность сетевой организации мозга с многочисленными полисинаптическими связями, которые являются основой для многократной обработки сигнала на различных уровнях нейронной сети. В.А. Черкес [37], исходя из данных эволюционного морфогенеза мозга позвоночных животных, а также анализа взаимодействия моно- и полисинаптических ответов ряда мозговых структур, высказал предположение о том, что некоторые образования переднего мозга – гиппокамп, субикулюм, амигдалярный комплекс, скорлупа, хвостатое ядро, паллидум, прилежащее ядро, субстация иномината, центральное серое вещество и часть ассоциативной коры, с относящимися к каждой из них афферентными и эфферентными проводящими путями образуют, по сравнению с проекционными системами и узкоспециализированными центрами, единую нейронную сеть (так называемый интерцессорный мозг), морфофункциональной основой которой является наличие в отдельных морфологических образованиях этой сети функционально сходных, или идентичных нейронных пулов, повреждение которых (или проводящих путей, связывающих эти пулы) может явиться причиной развитие различных заболеваний, патогенез которых причинно связывают с нейро-дегенеративными изменениями данной области мозга.
Своеобразным развитием идеи сетевой обработки сигналов является так называемая голографическая теория памяти, основанная на возможности извлечения ранее запечатленной информации, которая при ее обработке распределяется на всех нейронах головного мозга [20, 24, 29]. Сотрудники лаборатории Г.И. Шульгиной [38] показали, что при наличии синхронных ритмических колебаний потенциала и соответствующих групповых нейронных разрядов в фазу генерализованной активации возможна фиксация информации повсеместно, в любых нервных элементах, одновременно получающих импульсацию из других источников. При этом, согласно этим представлениям, в фазу отсутствия генерализованной активации возможно выявление зафиксированных в памяти образов в виде пространственно-структурной импульсации нейронов.
Следует подчеркнуть, что возможности сетевой организации при осуществлении интегративной деятельности мозга не отрицают, а расширяют и дополняют интегративные возможности при взаимодействии структур мозга, объединенных в различные морфофункциональные системы, предназначенные для выполнения специализированных элементов адаптивного поведения. В этой связи Б.Ф. Толкунов [36] подчеркивает важную роль сетевого принципа организации кортико-стриатных взаимоотношений при обработке поступающей в стриатум сенсорной информации. Есть основания полагать, что наличие многоуровневой и многозвенной организации головного мозга определяет высокую пластичность центральной нервной системы, обеспечивающую адаптивное поведение животных и большие компенсаторные возможности у больных при повреждениях мозга.
Оригинальную трактовку функций кортикo-стрио-таламо-кортикальной системы мозга и ее влияние на поведение предложили бразильские исследователи [65], используя представление о кортико-стриатной конвергенции и дисперсном распределении матриосом в стриатуме. Согласно этой модели [65], нейроны сенсорной, моторной и ассоциативной коры посылают в стриатум конвергентные проекции, в результате чего образуются функциональные единицы. Эти стриатальные единицы кодируют сочлененные части тела и части окружающего мира. Они также кодируют определенные места, в которые субъект может переместиться. Объединение этих функциональных единиц приводит к формированию программ для выполнения двигательных навыков и движений рук, глаз или других частей тела к определенной цели (объекту или месту), или движению субъекта к определенным целям. Комбинаторная сила этих ассоциаций усиливается многократным и широким распределением функциональных единиц в стриатуме. Обучение в этой системе зависит от изменения силы синапсов между кортико-стриатальными нейронами и шипиковыми клетками, кодирующими функциональные единицы. Это происходит, когда раздражитель окружающей среды становится значимым (salient). В это время дофаминергические нейроны среднего мозга выделяют дофамин в стриатуме по фазической схеме. Активация дофаминэргических нейронов является условием возникновения синаптической пластичности в стриатуме. Синхронизация нейронов повторяющих функциональных единиц, кодирующих одно и то же действие по отношению к выделяемому стимулу, осуществляется при паузе в высвобождении ацетилхолина тонически-активными (ТАН) клетками. Стриатальные единицы, кодирующие один и тот же стимул/действие, посылают сходящиеся проекции в GPi и SNr, которые, в свою очередь, запускают кодированные импульсы во фронтальную кору, минуя таламус. Частично замкнутые петли, включающие GPe, STN, таламус и стриатум, могут привести к реверберации, которая облегчает индукцию LTP или LTD в стриатуме. Эти нейрональные петли могут также иметь другие модулирующие функции в этой системе. Более сильная ассоциация между функциональными единицами стриатума, кодирующими действие, вызванное значимым стимулом, делает возникновение этой ассоциации более предсказуемым. По мере того как новизна уменьшается, значимость стимула уменьшается, и дальнейшее обучение не происходит. В этом отношении эта система обучения основана на новизне. После фазического дофаминового ответа высокая концентрация дофамина распадается в синапсах прилежащего ядра (n. accumbens) продолжительнее, чем в дорсальном стриатуме [107, 124, 130]. Другими словами, обучающий сигнал, обеспечивающий синаптическую пластичность, сохраняется в прилежащем ядре дольше, чем в дорсальном стриатуме. Этот обучающий сигнал достаточно длинный, чтобы включить оценку ценности вознаграждения результата действия в n.acсumbens, но не в дорсальном стриатуме. Это объясняет, почему обучение, опосредованное прилежащим ядром, поддерживается ожидаемым вознаграждением результата действия, в то время как обучение, опосредованное дорсальным стриатумом, формирует стереотипные ответные реакции, которые менее чувствительны к вознаграждению. Эта модель объясняет постепенное обучение и многие известные свойства различных типов процедурных воспоминаний, такие как способность к репликам и эгоцентрической навигации, а также их неявную, негибкую и ассоциативную природу. Авторы данной модели [65] сравнивают стриатум с “мозаикой разбитых зеркал”. Это означает, что кортикальные репрезентации не отражаются непосредственно в стриатуме, а распадаются, причем фрагменты кортикальных репрезентаций широко распределены по стриатальным шипиковым клеткам. Каждая такая клетка, в свою очередь, получает фрагменты кортикальных представлений комбинаторным образом. По мнению авторов, введение комбинаторных измерений позволяет создать более обширный и мощный субстрат для дискриминативного отбора, по сравнению с точным повторением, или зеркальным отражением кортикальных представлений дискретно в стриатуме.
ЗАКЛЮЧЕНИЕ
В физиологических исследованиях важное значение имеет выяснение того, каким образом отдельные физиологические процессы обеспечивают функционирование организма как целого. По утверждению Ю.В. Наточина “Достижения любой из наук о живом приобретают законченный вид, когда становится очевидной их роль в реалиях целостного организма” [26]. Изучение роли кортико-стрио-таламо-кортикальной системы мозга и ее выходных путей в интегративной деятельности головного мозга при формировании мотивированного целенаправленного поведения показало, что нейрональная регуляции физиологических процессов в целостном организме основана на кортикостриатном механизме оценки суб- и супрасекундных временных параметров поведенческого акта и служит для активации и координации различных нейрональных структур, распределенных в параллельных путях кортико-стрио-таламо-кортикальной системы и ее выходных путей, необходимых для последовательного включения в сложную цепь рефлекса сенсорных, двигательных и гормональных звеньев.
Описанные у подопытных животных нарушения классических секреторных, пищедобывательных рефлексов и поискового поведения после повреждения, или фармакологической стимуляции ядер стриатума, а также выявленные изменения нейрональной активности ДА-ергических нейронов вентрального стриатума при временной задержке подкрепления, выявленные в опытах на крысах [94, 113], кошках [1, 8], собаках [33, 39, 126] и обезьянах [90, 117, 118], показывают ведущую роль дофамина в сложном процессе предпусковой интеграции, связанной с подготовкой различных физиологических систем организма (сенсорной, двигательной и гуморальной) к выполнению предстоящего действия.
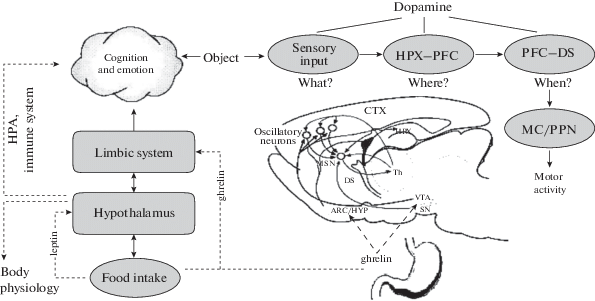
На рис. 6 изображена структурная схема и алгоритм взаимодействия различных структур кортико-стрио-таламо-кортикальной системы головного мозга и ее основных выходных путей в организации мотивированного целенаправленного поведения. Согласно этой схеме, эфферентная импульсация нейронов неокортекса (СТХ) поступает в средние шипиковые нейроны (MSNs) дорсального стриатума, который получает дофаминергический проекции из компактной части черной субстанции (SNpc). ДА-ергические проекции, поступающие из вентральной тегментальной области среднего мозга в неокортекс, способны модулировать частоту кортикальных осцилляций. Двусторонние проекции, поступающие из гиппокампа (НРХ) в дорсальный стриатум (DS), модулируют пороги импульсации шипиковых нейронов (MSNs) стриатума путем тонического торможения или фазической активации. Повреждение гиппокампа способно приводить к освобождению дорсального стриатума (DS) от этого торможения, после-довательно редуцируя пороги импульсации для шипиковых клеток стриатума и вызывая пропорциональный сдвиг временных функций. Цепочка структур мозга, отвечающих за процесс оценки мозгом временных интервалов, завершается проекциями стриатума к таламусу (TH) и обратно к неокортексу (СТХ) для обеспечения обратной связи в процессе формирования и оценки мозгом временных интервалов [95].
Рис. 6.
Структурная схема и алгоритм взаимодействия различных структур кортико-стрио-таламо-кортикальной системы головного мозга и ее основных выходных путей в организации мотивированного целенаправленного поведения (адаптировано по [104]). СТХ – неокортекс; SN – компактная часть черной субстанции; VTA – вентральная тегментальная области среднего мозга; НРХ – гиппокамп; DS – дорсальный стриатум; MSN – шипиковые нейроны стриатума; TH – таламус; ARC – дугообразное ядро; HYP – гипоталамус; PFC – префронтальное кора; MC – сенсомоторная кора; PN – ножково-мостовое ядро; DA – дофамин; HPA – гипоталамо-адреналовая система мозга.
Учитывая критическую роль мезолимбического дофамина в прогнозировании предстоящего подкрепления и подготовке животного к его получению [8, 90, 116] важное значение имеют исследования, направленные на исследование влияния объемного выброса дофамина на синхронизацию активности нейронов, терминальные окончания которых широко распространены в различных структурах головного мозга [78, 129, 133].
Известно, что ДА-содержащие ядра среднего мозга у крыс содержат небольшое количество нейронов – 20 000–40 000 нейронов [55]. Каждый нейрон активно проецируется на большую территорию целевого региона(ов). Отдельные SNC-дофаминовые нейроны, составляют у крыс 100 000–250 000 синапсов [56], покрывают 6% стриатального объема и влияют на 75 000 средних шипиковых нейронов (MSNs) [100]. И наоборот, каждый MSN принимает от нескольких сотен до нескольких тысяч дофаминовых терминалов [50, 56], при этом каждый MSN, по оценкам, находится под влиянием 100–200 различных дофаминовых нейронов [100]. Исследователи, анализируя характер распределения и плотность синаптических контактов ДА-клеток и средних шипиковых нейронов стриатума, обращают внимание на широкое аксональное распределение с перекрывающимися сферами влияния, что характерно для объемной передачи, приписываемой дофамину [40, 133]. В отличие от механизма дискретного освобождения нейромедиатора в синапсе с целью передачи точечных целевых синаптических сигналов, действие которых быстро прекращается путем обратного захвата, мезолимбический дофамин работает путем модуляции его содержания во внеклеточной жидкости [70, 75, 78, 106]. Эти характеристики дофамина среднего мозга предполагают, что для эффективной передачи сигнала дофаминовые клетки должны работать совместно.
В этой связи Билер и Дреер [53] полагают, что наряду с процессами селективного влияния дофамина на оценку аттрактивности сенсорного объекта “что?” и определения его места в пространстве “где?”, важнейшей функцией дофаминовой сигнализации является ответ на вопрос “когда?”. Дофамин мобилизует и заряжает энергией предстоящую реакцию и облегчает обучение. Фазическое освобождение дофамина, как сигнал консенсуса, эффективно говорит “сейчас”, что служит для активации и координации различных целевых областей, распределенных в параллельных путях стрио-таламо-кортикальной системы и ее выходных путей, чтобы совместно быстро и эффективно реагировать. На важнейший вопрос “когда сейчас?” можно ответить с различной степенью временной точности: от сигнала, указывающего на вознаграждение в течение одной секунды, до контекстуальных стимулов, таких как нахождение в среде задач с более высоким уровнем доступности вознаграждения [5, 43, 52, 85].
Отмечая важную роль мезолимбического дофамина в прогнозировании предстоящего подкрепления [90, 116], а также в активации и координации различных структур, распределенных в параллельных путях стрио-таламо-кортикальной системы и ее выходных путей с помощью синхронной активации SN/VTA-нейронов среднего мозга [53], пока остается открытым следующий вопрос. Какую роль в вышеуказанных процессах играют другие нейротрансмитеры (глутамат, ГАМК), также выделяемые ДА-клетками? Некоторые исследователи [74] полагают, что глутамат, выделяемый ДА-окончаниями может играть роль в регуляции осцилляторной синхрониизации нейронов VTA, префронтальной коры и гиппокампа. Проверка этого предположения нуждается в дальнейшем изучении с применением новых, более совершенных экспериментальных технологий.
Список литературы
Альбертин С.В. Участие ДА-реактивной системы хвостатого ядра в регуляции инструментальных условных рефлексов разной сложности // Физиол. журн. им. И.М. Сеченова. 1985. Т. 71. № 1. С. 87–94.
Альбертин С.В. Участие прилежащего ядра в формировании реакций пространственного выбора у крыс в радиальном лабиринте // Рос. физиол. журн. им. И.М. Сеченова. 2002. Т. 88. № 5. С. 545–552.
Альбертин С.В. Модельные исследования центральной нервной системы. СПб., Политехника-Сервис. 2011. 274 с.
Альбертин С.В., Винер С.И. Нейрональная активность прилежащего ядра и гиппокампа крыс при формировании поискового поведения в радиальном лабиринте // Бюл. эксп. биол. и медицины. 2014. Т. 158(10): 400–406.
Альбертин С.В. Влияние стимуляции ДА-ергической системы мозга на пищевое предпочтение у крыс // Рос. физиол. журн. им. И.М. Сеченова. 2016. Т. 102(10). С. 1137–1145.
Альбертин С.В. Влияние режима условнорефлекторного переобучения крыс на поисковое поведение в радиальном лабиринте // Рос. физиол. журн. им. И.М. Сеченова. 2016. Т. 102(11): С. 1302–13011.
Альбертин С.В. Влияние фрагментации зрительных навигационных сигналов на ориентацию крыс в радиальном лабиринте // Рос. физиол. журн. им. И.М. Сеченова. 2017. Т. 103(8). С. 854–865.
Альбертин С.В. Способ тестирования сенсомоторных реакций животных в условиях зрительного слежения // Сенсорные системы. 2017. Т. 31(4). С. 290–296.
Арушанян Э.Б., Отеллин В А. Хвостатое ядро. Л., Наука. 1976. 223 с.
Арушанян Э.Б. Вклад неостриатумав ритмическую организацию мозговой деятельности // Успехи физиол. наук 1992. Т. 23. № 1. C. 58–73.
Анохин П.К. Системный анализ интегративной деятельности нейрона // Успехи физиол. наук. 1974. Т. 5. № 2. С. 3.
Батуев А.С. Функциональная структура поведенческого акта // В кн. Методологические аспекты науки о мозге. М., 1983. С. 116–123.
Беленков Н.Ю., Сосенков В.А., Сапожников В.Н., Щербаков В.И. Метод обратимого холодового выключения неокортекса в хроническом эксперименте // Бюл. эксп. биол. 1969. № 8. С. 121–125.
Беленков Н.Ю. Принципы целостности в деятельности мозга. М., Медицина. 1980. 312 с.
Богословский М.М., Альбертин С.В. Электрическая активность слоев изолированной коры мозга при засыпании и разных стадиях сна // Физиол. журн. СССР им. И.М. Сеченова. 1976. Т. 62. № 12. С. 1753–1759.
Богословский М.М., Красильников В.Г., Цешке Г., Альбертин С.В. Характеристика локальной температуры изолированной коры при бодрствовании и смене стадий сна // Физиол. журн. СССР им. И.М. Сеченова. 1977. Т. 63. № 11. С. 1631–1637.
Богословский М.М., Карманова И.Г., Максимук В.Ф., Альбертин С.В. Электрографические изменения в изолированной коре кошек под влиянием нейропептида сна // Журн. эвол. биохимии и физиологии. 1979. Т. 15. № 4. С. 430433.
Буклина С.Б. Нарушение памяти и глубинные структуры головного мозга // Журн. неврологии и психиатрии им. С.С. Корсакова. 1999. Т. 99. № 9. 10–15.
Выготский Л.С. Развитие высших психических функций. М., 1950.
Гуляев А.А., Санталов Б.Ф. Голография в нервной системе Клеточные механизмы памяти. Пущино-на-Оке. 1973. С. 95.
Данилова Л.К. О роли орбитальной коры в пищевом поведении. ЖВНД. 1975. Т. 25. № 3. С. 520–527.
Данилова Л.К. Влияние длительной электростимуляции головки хвостатого ядра на пищевые секреторные рефлексы у собак // ЖВНД. 1979. Т. 29. № 2. С. 237–244.
Денисова А.С. Формирование пищевых условных рефлексов у собак с поврежденными хвостатыми ядрами. В кн.: Стриопаллидарная система. Л., 1973. С. 13–22.
Кузнецов О.П. Неклассические парадигмы в искусственном интеллекте // Теория и системы управления, 1995. № 5. С. 3.
Купалов П.С., Воеводина О.Д., Волкова В.Д., и др. Ситуационные рефлексы у собак в норме и патологии. Л., Медицина.1964. 276 с.
Наточин Ю.В. Физиология и медицина // Вестник РАМН. 2004. Т. 74(11). С. 1594–1600.
Павлов И.П. Двадцатилетний опыт объективного изучения высшей нервной деятельности (поведения) животных. М., Л., Биомедгиз. 1938. 770 с.
Павлов И.П. Павловские среды. М., Л., 1949.
Отеллин В.А., Арушанян Э.Б. Нигро-стрио-нигральная система. М. 1989. 272 с.
Селиванова А.Т., Голиков С.Н. Холинергические механизмы высшей нервной деятельности. Л.: Медицина, 1975. 183 с.
Силькис И.Г. Возможный механизм участия цепей кора-базальные ганглии-таламус-кора в восприятии времени // Успехи физиологических наук. 2011. Т. 42(2). С. 41–56.
Сосенков В.А. Исследование поведения кошек при функциональных (холодовых) выключениях неокортекса и его отделов // Дисс. ... докт. биол. наук. Горький, 1974. 293 с.
Суворов Н.Ф. Стриарная система и поведение. Л.: Наука, 1980.
Суворов Н.Ф., Шаповалова К.Б., Альбертин С.В. Участие неостриатума в механизмах инструментального поведения. Журн. высш. нервн. деят. им. И.П. Павлова. 1983. Т. 33. № 2. С. 256–266.
Суворов Н.Ф. Системная организация кортико-стриатного взаимодействия // Успехи физиол. наук. 1994. Т. 25. № 4. С. 78.
Толкунов Б.Ф. О принципах определения функции нервного центра (на примере неостриатума) // Журн. эвол. биох. и физиол. 1991. Т. 27. № 5. С. 598–607.
Черкес В.А. Мозговые структуры или нейронные сети. Киев. Наукова Думка. 1988. 90 с.
Шульгина Г.И. Синронизация ритмов ЭЭГ и голографическая теория памяти // Журн. высш. нервн. деят. им. И.П. Павлова. 1997. Т. 47. № 5. С. 878–889.
Шустов В.Н. ЭЭГ-исследование роли головки хвостатого ядра собак в пищевой условнорефлекторной деятельности. Автореф дис. 1978. 28 с.
Agnati L.F., Zoli M., Strömberg I., Fuxe K. Intercellular communication in the brain: wiring versus volume Transmission // Neuroscience. 1995. 69: 711–726.
Albertin S.V. Effects of injury of Cortico- and Rubro – Spinal Pathways on Operant Food-Procuring Reflexes // Neurophysiology. 2014. 46(4): 352–360.
Albertin S.V., Mulder A.B., Tabuchi E. et al. Lesions of the medial shell of the nucleus accumbens impair rats in finding larger rewards, but spare reward-seeking behavior // Behav. Brain Res. 2000. 117: 173–183.
Albertin S.V., Wiener S.I. Neuronal Activity in the Nucleus Accumbens and Hippocampus in Rats during Formation of Seeking Behavior in a Radial Maze // Bul. of Exp. Biol. and Med. 2015. 158(4): 405–409.
Alexander G.E., Crutcher M.D. Functional architecture of basal ganglia circuits: neural substrates of parallel processing // Trends Neurosci. 1990. 13: 266–272.
Alexander G.E., DeLong M.R., Strick P.L. Parallel organization of functionally segregated circuits linking basal ganglia and cortex // Annu. Rev. Neurosci. 1986. 9: 357–81.
Alexander G.E. Basal ganglia-thalamocortical circuits: their role in the control of movements // J. Clin. Neurophysiol. 1994. 11: 420–431.
Allan L.G. The perception of time // Perception & Psychophysics. 1979. 26: 340–354.
Allman M.J., Meck W.H. Pathophysiological distortions in time perception and timed performance // Brain: A J. Neurology. 2012. 135: 656–677.
Allman M.J., Yin B., Meck W.H. Time in the psychopathological mind. In D. Lloyd & V. Arstila (Eds.), Subjective time: The philosophy, psychology, and neuroscience of temporality. Cambridge, MA: MIT Press, 2014. P. 637–654.
Arbuthnott G.W., Wickens J. Space, time and dopamine // Trends Neurosci. 2007. V. 30: 62–69.
Bar-Gad I., Morris G, Bergman H. Information processing, dimensionality reduction and reinforcement learning in the basal ganglia // Prog. Neurobiol. 2003. 71: 439–73.
Beeler J.A., Mourra D. To do or not to do: dopamine, affordability and the economics of opportunity // Front. Integr. Neurosci. 2018. 12: 6.
Beeler J.A., Dreyer J.K. Synchronicity: The Role of Midbrain Dopamine in Whole-Brain Coordination // eNeuro. 2019. 6(2): 1–17.
Berridge K.C. The debate over dopamine’s role in reward: the case for incentive salience // Psychopharmacology (Berl). 2007. 191: 391–431.
Björklund A., Dunnett S.B. Dopamine neuron systems in the brain // Trends Neurosci. 2007. 30: 194–202.
Bolam J.P., Pissadaki E.K. Living on the edge with too many mouths to feed: why dopamine neurons die // Mov. Disord. 2012. 27: 1478–483.
Buhusi C.V., Meck W.H. What makes us tick? Functional and neural mechanisms of interval timing // Nature Reviews Neuroscience, 2005. V. 6. P. 755–765.
Calzavara R., Mailly P., Haber S.N. Relationship between the corticostriatal terminals from areas 9 and 46, and those from area 8A, dorsal and rostral premotor cortex and area 24c: an anatomical substrate for cognition to action // Eur. J. Neurosci. 2007. 26: 2005–2024.
Castaneda E., Whishaw I.Q., Robinson T.E. Change in striatal dopamine neurotransmission assessed with microdialysis following recovery from a bilateral 6-OHDA lesion: variation as a function of lesion size // The J. of Neurosci. 1990. 10: 1847–1854.
Centonze D., Grande C., Usiello A. et al. Receptors subtypes involved in the presynaptic and postsynaptic actions of dopamine on striatal interneurons // J. Neurosci. 2003: 6245–6254.
Cohen M.X., Elger C.E., Ranganath C. Reward expectatuin modulates feed-back related negativity and EEG spectra // Neuroimage. 2007. 35: 968–978.
Coull J.T., Vidal F., Nazarian B., Macar F. Functional anatomy of the attentional modulation of time estimation // Science. 2004. V. 303. P. 1506–1508.
Coull J.T., Cheng R.K., Meck W.H. Neuroanatomical and neurochemical substrates of timing // Neuropsychopharmacology. 2011. 36: 3–25.
Cromvell H.C., Schultz W. Effects of expectations for different reward magnitude on neuronal activity in primate striatum // J. Neurophysiol. 2003. 89: 2823–2838.
Da Cunha C, Wietzikoski E.C., Dombrowski M. et al. Learning processing in the basal ganglia: A mosaic of broken mirror // Behav. Brain Res. 2009. 199: 157–170.
De Long M.R., Wichmann T. Basal ganglia-thalamocortical circuits in Parkinsonian signs // Clinical Neurosci. 1993. 1: 18–26.
DeLong M.R., Wichmann T. Circuits and circuit disorders of the basal ganglia // Arch. Neurol. 2007. 64: 20–24.
Denny-Brown D., Yanagisawa N. The role of basal ganglia in the initiation of movements // In: the Basal Ganglia (Ed. Be Yahr M.D.). Raven Press. N.Y., 1976. P. 113–159.
Dragoi G., Buzsaki G. Temporal encoding of place sequences by hippocampal cell assemblies // Neuron. 2006. 50: 145–157.
Dreyer J.K., Herrik K.F., Berg R.W., Hounsgaard J.D. Influence of phasic and tonic dopamine release on receptor activation // J. Neurosci. 2010. 30: 14273–14283.
Fiorillo C.D., Newsome W.T., Schultz W. The temporal precision of reward prediction in dopamine neurons // Nature Neurosci. 2008. 11(8): 966–975.
Flaherty A.W., Graybiel A.M. Corticostriatal transformations in the primate somatosensory system – projections from physiologically mapped body-part representations // J. Neurophysiol. 1991. 66: 1249–63.
Flaherty A.W., Graybiel A.M. Input–output organization of the sensorimotor striatum in the squirrel–monkey // J. Neurosci. 1994. 14: 599–610.
Fujisawa S., Buzsaki K. A 4 Hz oscillation adaptively synchronizes prefrontal, VTA and hippocampal activities // Neuron. 2011. 72: 6084–6093.
Garris P.A., Ciolkowski E.L., Pastore P, Wightman R.M. Efflux of dopamine from the synaptic cleft in the nucleus accumbens of the rat brain // J. Neurosci. 1994. 14: 6084–6093.
Gerfen C.R., Engber T.M., Mahan L.C., Susel Z., Chase T.N. et al. D1 and D2 dopamine receptor regulated gene-expression of striatonigral and striatopallidal neurons // Science. 1990. V. 250: 429–1432.
Gerfen C.R. Indirect-pathway neurons lose their spines in Parkinson disease // Nat. Neurosci. 2006. 9: 157–8.
Gonon F. Prolonged and extrasynaptic excitatory action of dopamine mediated by D1 receptors in the rat striatum in vivo // J. Neurosci. 1997. 17: 5972–5978.
Graybiel A.M., Ragsdale Jr. C.W. Histochemically distinct compartments in the striatum of human, monkeys and cat demonstrated by acetylthiocholinesterase staining // Proc. NY Acad. Sci. USA. 1978. 75: 5723–5726.
Grondin S. From physical time to the first and second moments of psychological time // Psychological Bulletin. 2001. 127: 22–44.
Grondin S. Timing and time perception: A review of recent behavioral and neuroscience findings and theoretical directions // Attention, Perception & Psychophysics. 2010. V. 72. P. 561–582.
Gupta A.S. van der Meer V.F.F., Nouretsky D.S., Redish A.D. Segmentation of spatial experience by hippocampal theta sequences // Nature Neuroscience. 2012. 15(7): 1032–1039.
Harrington D.L., Castillo G.N., Fong C.H., Reed J.D. Neural underpinnings of distortions in the experience of time across the senses // Frontiers in Integr. Neurosci. 2011. 5: 32. https://doi.org/103389/fnint.2011.00032
Hinton S.C., Meck W.H. Frontal-striatal circuitry activated by human peak-interval timing in the supra-seconds range // Cognitive Brain Research. 2004. V. 21. P. 171–182.
Howe M.W., Tierney P.L., Sandberg S.G., Phillips P.M., Graybiel A.M. Prolonged dopamine signalling in striatum signals proximity and value of distant rewards // Nature. 2013. 500: 575–579.
Jerhlag E., Egecioglu E., Dicson S.L. et al. Ghrelin administration into tegmental area stimulates locomotor activity and increases extracellular concentration of DA in the n. accumbens // Addict. Biol. 2007. 12: 6–16.
Joel D., Weiner I. The connections of the dopaminergic system with the striatum in rats and primates: an analysis with respect to the functional and compartmental organization of the striatum // Neuroscience. 2000. 96: 451–74.
Kawaguchi Y., Emson P.C. Striatal interneurones: chemical, physiological and morphological characterization // Trends Neurosci. 1995. 18: 527–35.
Kitsikis A., Robergs A.G. Changes in brain biogenic amines in cats performing a symmetrically reinforced go- no-go visual discrimination task // Behav. Neurol. Biol. 1981. 32(2): 133–147.
Kobayashi S., Schultz W. Influence of reward delays on responses of dopamine neurons // J. Neurosci. 2008. 28(31): 7837–7846.
Lagowska J., Fonberg E. Salivary reaction in dogs with dorsomedial amygdala lesions // Acta Neurobiol. Exp. 1975. 35: 17–26.
Lisman J., Redish A.D. Prediction, sequences and hippocampus // Phil. Trans. R. Soc. Lond. B. Biol. Sci. 2009. 364: 1193–1201.
Lloyd D., Arstila V. Subjective time: The philosophy, psychology, and neuroscience of temporality. Cambridge. MA: MIT Press, 2014.
Lavoie A.M., Mizumory S.J. Spatial movement and reward sensitive discharge by medial ventral striatum neurons in rats // Brain Res. 1994. 638: 157–168
Lustig C., Matell M.S., Meck W.H. Not “just” a coincidence: frontal-striatal interactions in working memory and interval timing // Memory. 2005. V. 13. P. 441–448.
Macar F., Vida F. Timing processes: An outline of behavioural and neural indices not systematically considered in timing models // Canadian J. Experimental Psychology. 2009. V. 63. P. 227–239.
Maldonado-Irizarry C.S., Swanson C.J., Kelley A.N. Glutamate Receptors in the Nucl. Accumbens Shell Control Feeding Behavior via the Lateral Hypothalamus // The J. Neurosci. 1995. 15(10): 6779–6788.
Malik S., McGlone F., Bedrossian D., Dagher A. Ghrelin modulates brain activity in areas that control appetite behavior // Cell Metab. 2008. 7: 400–409.
Matell M.S., Meck W.H. Neurophysiological mechanisms of interval timing behavior // BioEssays. 2000. 22: 94–103.
Matsuda W., Furuta T., Nakamura K.C. et al. Single nigro-striatal DA-ergic neurons from widely spread and highly dense axonal arborizations in the neostriatum // J. Neurosci. 2009. 29: 444–453.
Matsuo R., Kusano K. Lateral hypothalamic modulation of the gustatory-salivary reflex in rats // J. Neuroscience. 1984. 4: 12081216.
McHaffie J.G., Stanford T.R., Stein B.E. et al. Subcortical loops through the basal ganglia // Trends Neurosci. 2005. 28: 401–407.
Meck W.H. Neuroanatomical localization and internal clock: A functional link between mesolimbic, nigrostriatal and mesocortical dopaminergic systems // Brain Res. 2006. 1109: 93–107.
Meck W.H., Church R.M., Matell M.S. Hippocampus, Time and Memory – A Retrospective Analysis // Behav. Neuroscience. 2013. 127(5): 642–654.
Morton N.W., Sherill K.R., Preston A.R. Memory integration constructs maps of space, time and concepts // Behav. Sci. 2017. 17: 161–168.
Moss J, Bolam J.P. A dopaminergic axon lattice in the striatum and its relationship with cortical and thalamic terminals // J. Neurosci. 2008. 28: 11221–11230.
Nirenberg M.J, Chan J., Pohorille A. et al. The dopamine transporter: comparative ultrastructure of DA-ergic axons in limbic and motor compartments of the n. accumbens // J. Neurosci. 1997. 17: 6899–907.
Nishino H., Hattory S., Muramoto K. et al. Basal ganglia neural activity during operant feeding behavior in the monkey: relation to sensory integration and motor execution // Brain Res. Bull. 1992. 27: 463–468.
Oprisan S.A., Buhusi C.V. Modeling pharmacological clock and memory patterns of interval timing in a striatal beat-frequency model with realistic, noisy neurons // Front. in Integr., Neurosci. 2011. 5: 52.
arent A., Hazrati L.N. Functional anatomy of the basal ganglia. I. The corticobasal ganglia-thalamo-cortical loop // Brain Res. Rev. 1995. 20: 91–127
Parkinson J.A., Olmstead M.C., Burns L.H., Robbins T.W., Everitt B.J. Dissociations in effects of lesions of the nucleus accumbens core and shell on appetitive Pavlovian approach behavior and the potentiation of conditioned reinforcement and locomotor activity by amphetanine // J. Neurosci. 1999. 19: 3401–3411.
Parkinson J.A., Dalley J.W., Cardinal R.L. et al. Nucleus accumbens dopamine depletion impairs both acquisition and performance of appetitive approach behavior: implications for mesoaccumbens function // Behav. Brain Res. 2002. 137: 149–163.
Richardson N.R., Gratton A. Behavior-relevant changes in nucleus accumbens dopamine transmission elicited by food reinforcement: an electrochemical study in rat // J. Neurosci. 1996. 16(24): 8160–8169.
Pisani A., Bernardi G., Ding J., Surmeier D.J. Re-emergence of striatal cholinergic interneurons in movement disorders // Trends Neurosci. 2007. 30(10): 545–53.
Robinson T.E., Whishaw I.Q. Normalization of extracellular DA in striatum following recovery from a partial unilateral 6-OHDA lesion of the substantia nigra: a microdialysis study in freely moving rats // Brain Res., 1988. 450: 209–224.
Schultz W., Apicella P., Scarnati E., Ljungberg T. Neuronal activity in monkey ventral striatum related to the expectation of reward // J. Neurosci. 1992. 12: 4595–4610.
Schultz W., Romo R. Role of primate basal ganglia and frontal cortex in the internal generation of movements. 1. Preparatory activity n the anterior striatum // Exp. Brain Res. 1992. 91(33): 63–84.
Schultz W. How to cite this article: Recent advances in understanding the role of phasic dopamine activity // https://doi.org/10.12688/f1000research.19793.1
Shih L.Y., Kuo W.J., Yeh T.C. et al. Common neural mechanisms for explicit timing in the sub-second range // Neuroreport. 2009. 20. 10: 897–901.
Skibicka K.P., Hansson C., Alvarez-Crespo M. et al. Ghrelin directly targets the ventral tegmental area to increase food motivation // Neuroscience. 2011. 180: 129–137.
Skibicka K.P. et al. Ghrelin interact with neuropeptide YY1 and opioid receptors to increase food reward // Endocrinology. 2012. 153: 1194–1206.
Smith G.P. Dopamine and food reward // Progr. in Psychobiol. Psychology. 1995. 16: 83–144.
Smith G.P. Signals from the abdomen for satiety and feeding // The Abstracts of International Pavlov Centenary Symposium “Integrative Physiology and Behavior”, St. Petersburg, 2004. P. 21.
Suaud-Chagny M., F, Dugast C., Chergui K., Msghina M., Gonon F. Uptake of dopamine released by impulse flow in the rat mesolimbic and striatal systems in vivo // J. Neurochem. 1995. 65: 2603–2611.
Surmeier D.J., Song W.J., Yan Z. Coordinated expression of dopamine receptors in neostriatal MSNs // J. Neurosci. 1996. 16: 6579–6591.
Suvorov N.F., Albertin S.V., Voilokova N.L. The Neostriatum: Neurophysiology and Behaviour // Sov. Sci. Review., F. Physiol. Gen. Biol. Harwood Academic Publishers GmbH. 1988. 2: 597–677.
Tepper J.M., Bolam J.P. Functional diversity and specificity of neostriatal interneurons // Curr. Opin. Neurobiol. 2004. 14: 685–92.
Van der Plasse G., Merkestein M., Luijendijk M.C.M. et al. Food cues and ghrelin recruit the same neuronal activity // Int. J. Obesity. 2013. 37: 1012–1019.
Watabe-Uchida M., Zhu L., Ogawa S.K., Vamanrao. A, Uchida N. Whole-brain mapping of direct inputs to midbrain dopamine neurons // Neuron. 2012. 74: 858–873.
Wickens J.R., Budd C.S., Hyland B.I. et al. Striatal contributions to reward and decision making. Making sense of regional variations in a reiterated processing matrix // Ann. NY Acad. Sci. 2007. 1104: 192–212.
Wiener S.I., Shibata R., Albertin S.V. et al. Spatial and behavioral correlates in nucleus accumbens neurons in zones receiving hippocampal or prefrontal cortical inputs // Intern. Congr. Ser., Amsterdam, Excerpta Med. 2003. 1250. P. 275–292.
Wittmann M. The inner sense of time: How the brain creates a representation of duration // Nature Reviews Neuroscience. 2013. 14: 217–223.
Zoli M., Torri C., Ferrari R., Jansson A., Zini I., Fuxe K., Agnati L.F. The emergence of the volume trans-mission concept // Brain Res. Rev. 1998. 26: 136–147.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


