Успехи физиологических наук, 2021, T. 52, № 4, стр. 33-53
Забытые ступени нейровизуализации
А. А. Савелов a, Е. Д. Петровский a, А. М. Коростышевская a, М. Б. Штарк b, *
a ФГБУН Институт “Международный томографический центр” СО РАН
Новосибирск, Россия
b ФГБНУ Федеральный исследовательский центр фундаментальной и трансляционной медицины,
НИИ Молекулярной биологии и биофизики
Новосибирск, Россия
* E-mail: mark_shtark@mail.ru
Поступила в редакцию 17.05.2021
После доработки 22.05.2021
Принята к публикации 30.06.2021
Аннотация
Совершенствование технологии нейровизуализации в значительной степени определяет сегодня вектор развития и возможности многочисленных областей нейронаук. Нейровизуализационные технологии из сервисной атрибутики конвертировались в обязательный компонент исследовательского регламента. Появились принципиально новые исследования и содержательные прикладные инструкции, в частности, проявилась заметная тенденция к on line сценариям с использованием фМРТ-сигнала как в традиционном качестве в виде изобразительного средства, так и в виде “мишени”, организующей интерактивные по своей организации нейроисследования различной степени сложности и разнообразной тематической ориентации. Однако, соблазнившись реальным временем, были забыты, особенно в российской публикационной сфере, фундаментальные технологии визуализации, базирующиеся на базовых математических и физических принципах: масс-спектроскопия, куртозис-сканирование, магнитно-резонансная томография на основе индикаторов, методы создания “моделей” оптической прозрачности тканей, МР-спектроскопия. Этот комплекс способов и средств должен позволить существенно расширить территорию компетенции в понимании ключевых механизмов нервной деятельности, и непосредственно влиять на эффективность широкого спектра нейротерапевтических вмешательств. В обзоре рассмотрены биофизические и физиологические принципы, лежащие в основе некоторых из этих технологий визуализации, непростительно мало использованных и относимых нами к категории “забытых”, описаны варианты их применения для исполнения физиологических задач и принятия клинических решений.
ВВЕДЕНИЕ
В последнее десятилетие нейронауки характеризовались интенсивным освоением визуализационных технологий на всех уровнях исследований структурно-функциональной организации головного мозга [1–5, 7, 9, 66]. Обычно используемые для наблюдения за нейронной активностью и обнаружения действующих функциональных маркеров, представляющие собой достаточную информацию о работе мозга, тем не менее, каждая из них обладает рядом недостатков. Функциональная магнитно-резонансная томография (фМРТ) и анализ тензора диффузии (DTI) обеспечивают наблюдения за деятельностью всего мозга и характеристиками ориентации проводящих путей, но, согласитесь, регистрируемые при этом сигналы являются косвенными, а их разрешение достаточно низким. Технология оптической визуализации in vivo позволяет обнаруживать работающие нейронные ансамбли в локальных областях мозга с высоким пространственным и временным разрешением, но глубина и область проникновения при этом весьма ограничены. Электрофизиологические и оптогенетические регистрации в отдельности и в режиме их сочетания могут быть использованы для морфологической маркировки нейронов и контроля функционирования в определенных регионах интереса, но не в состоянии анализировать физиологическую структуру восходящих и нисходящих влияний. Иммуногистохимические исследования обеспечивают локализацию нейроспецифических белков и факторов транскрипции, связанных с нервной деятельностью, но фон, на котором это приходится наблюдать, очень высокий. Таковы некоторые предпосылки, мотивирующие нас на обращение к целому ряду “томографических” технологий и определению их роли и места в современных нейрофизиологических исследованиях.
К истории нейровизуализации
Медицинская и физиологическая визуализация началась с Вильгельма К. Рентгена (1896), получившего Нобелевскую премию по физике в 1901 г. за открытие рентгеновских лучей, с помощью которых были получены первые изображения “внутреннего” тела, открывая путь в область функциональной (физиологической) радиологии. Однако с помощью рентгенографии оказалось возможным проявить в основном костные структуры из-за высокого содержания в них кальция, электроны которого эффективно взаимодействуют с рентгеновскими лучами. Со временем некоторые иные органы могли быть идентифицированы на рентгенограммах, в основном из-за улучшения чувствительности пленки, но при этом приходилось иметь дело больше с тенями, чем с реальными изображениями, используя некие “хитрости”, такие, как инъекция контрастных веществ, заполняющих сосуды или полости органов, чтобы сделать их форму видимой.
Второе не менее значимое открытие состоялось, когда появилась возможность действительно рассмотреть “влажные” ткани, а не только “сухие” кости или тени органов, путем объединения рентгеновских систем с датчиками и компьютерами в формате так называемой томографии или КТ. Она была изобретена Годфри Хаунсфилдом, который в 1979 г. разделил Нобелевскую премию с Аланом Кормаком. Революционизирующий эффект носил двоякий характер. Во-первых, мозг впервые совершенно неинвазивно стал виден внутри черепа. Во-вторых, физиологи и радиологи имели перед глазами не спроецированные тени на пленке, а виртуальные кусочки органов, которыми они могли манипулировать на экране компьютера, обнаруживая контрастные особенности в тканях, здоровых или патологически измененных. Кроме того это означало, что исследователям, которые до этого должны были мысленно воссоздавать трехмерную анатомию систем, чаще всего по переднезадним проекциям, теперь приходилось реконструировать 3D-пространство из поперечных срезов.
Однако и этого было недостаточно, хотя впервые удавалось увидеть некоторые внутримозговые патологии, например, опухоли мозга. Структура же самого мозга с обозначенными деталями не могла быть проявлена или, скажем, оказаться доступной on line, позволяя наблюдать работающие церебральные образования и их взаимосвязи. Попутно появилась позитронно-эмиссионная томография (ПЭТ), которая предоставила функциональные или “метаболические” изображения головного мозга на фоне инъекции пациентам короткоживущих позитронно-эмиссионных индикаторов, полученных с помощью циклотрона [102]. Изображения были сконструированы с использованием математического обеспечения КТ, но их пространственное разрешение оказалось слишком грубым, чтобы оценить реальную функциональную анатомию мозга, к тому же создание специальных радиоизотопов оказалось делом далеко не тривиальным.
Затем появилась магнитно-резонансная томография (МРТ), с помощью которой удалось наконец увидеть мозг в мельчайших деталях из-за радикального изменения характера взаимодействия физической природы процедуры получения изображений с биологическими тканями: с помощью МРТ сильное магнитное поле сначала используется для намагничивания молекул воды, точнее, ядер (протонов) атомов водорода. Эта “пара” оказалась идеальной для физиологической и медицинской визуализации по сравнению с рентгеном, ибо наши органы на 70% состоят из воды, в мозге этот параметр существенно больше. Свойства намагниченности ядер водорода в мозге не одинаковы для белого и серого вещества и/или кровеносных сосудов, и тогда эта намагниченность может быть обнаружена с помощью радиоволн уже в принципах ЯМР, основанных на квантовой механике, разработанных Феликсом Блохом и Эдвардом Пёрселлом (Нобелевская премия 1952 г.) и широко использующихся в физике и химии. Однако длина волны фотонов, связанных с этими радиоволнами, слишком велика (в отличие от рентгеновских фотонов), чтобы обеспечить точную локализацию, подходящую для решения физиологических задач и формирования изображения. Хитрость локализации ядерной намагниченности состоит в том, чтобы заставить магнитное поле изменяться контролируемым образом во времени с помощью так называемых градиентов, которые модулируют частоту радиоволн в пространстве [54].
Таким образом, ядерная намагниченность становится пространственно кодированной, и компьютерные алгоритмы позволяют создавать изображения, демонстрирующие распределение свойств намагниченности водорода в воде. Кристиан Лаутербур, химик, и Питер Мэнсфилд, физик, были удостоены Нобелевской премии по медицине в 2003 г. именно за это изобретение. Управляя намагничиванием молекул воды, подбирая радиоволны, создаются контрасты между тканями тела и, в частности, мозгом, который совершенно неинвазивно раскрывает свою функциональную организацию с субмиллиметровым разрешением в 3х измерениях; изображения при этом могут быть очень впечатляющими, имитируя фотографии реальных образцов мозга.
ДИФФУЗИОННОЕ КУРТОЗИС-СКАНИРОВАНИЕ – ТЕХНОЛОГИЯ ОЦЕНКИ МИКРОСТРУКТУРНОЙ СРЕДЫ МОЗГА
Диффузионное куртозис-сканирование (ДКС) – это начавшая развиваться технология, основанная на негауссовой диффузии воды в биологических системах. Целью настоящего раздела обзора является введение в технологию, обсуждение текущих физиологических исследований и потенциальных клинических приложений ДКС. ДКС обеспечивает независимую и комплементарную информацию по отношению к данным, которые получаются с помощью традиционных диффузионных методик. Эта информация указывает на сложность микроструктурной среды сканированной ткани и может привести к появлению перспективных приложений во всех областях нейрофизиологии.
Диффузионно-взвешенная томография (ДВТ/DWI, diffusion-weighted imaging), основанная на броуновском движении молекул воды, находится в клиническом употреблении не более 25 лет. Первоначально сконцентрированная на сканировании в случае инсульта [8, 13, 19, 23, 67, 106], эта модальность быстро развивалась, получив применение во множестве физиологических и клинических приложений. Диффузионно-тензорная томография (ДТТ/DTI) – это недавно разработанное приложение диффузионного сканирования, основанное на определении направленности диффузии. ДТТ обеспечила получение новых сведений о микроструктуре мозга и оказалась элегантным, неинвазивным методом отображения анатомических признаков трактов белого вещества, что крайне важно, ибо трактография – это часть парадигмы функциональной коннективности (ФК) – числового выражения нейропластичности. Организованная структура мозга, включая клеточные мембраны, миелинизированные аксоны и внутриклеточные органеллы, влияет на ориентацию диффузии воды. Фракционная анизотропия (ФА) – это мерило степени этой направленности, которое и являлось первичной метрикой сканирования, использовавшейся при оценке широкого круга нейропатологических процессов от травматического повреждения мозга (TBI/ТПМ) до демиелинизирующих заболеваний.
Несмотря на потенциальную полезность при определении физиологически “пограничных” состояний и “мягких” заболеваний, которые трудно идентифицировать с помощью традиционных последовательностей МРТ, отсутствие специфичности ограничивает клинические применения ДТТ. Недавние события в области исследований ДТТ расширили угол зрения – теперь возможна не только оценка простого диффузионного скаляра, но обозначена важность более сложных трехмерных паттернов диффузии. Дополнительные метрики сканирования, такие как осевой коэффициент диффузии (ОКД/AD, axial diffusivity), радиальный коэффициент диффузии (РКД/RD, radial diffusivity) и индекс инфильтрации на примере инсульта и опухолей эффективно используются все чаще.
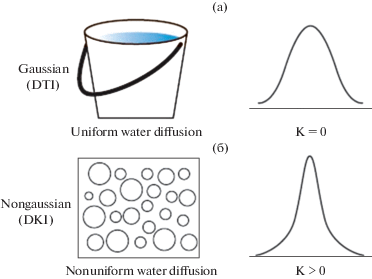
Были получены серьезные результаты для обновленного понимания функциональной конструкции мозга и характеристик болезней, достигнутых с помощью ДВТ и ДТТ. Эти томографические модальности основаны на упрощенной предпосылке гауссова распределения вероятности диффузии воды в биологических системах. Гауссово распределение является математической моделью, описывающей нормальное распределение популяции, соответствующей хорошо известной куполообразной кривой. В реальности же, сложная внутриклеточная и внеклеточная среда in vivo способствует тому, что диффузия молекул воды значительно отклоняется от этого паттерна.
В теории вероятности и статистике, изменение нормального паттерна распределения называется “куртозис”. Диффузионное куртозис-сканирование (diffusion kurtosis imaging, ДКС/DKI) представляет собой попытку учесть такую вариабельность для построения более точной модели диффузии и “схватывания” негауссова поведения молекул при диффузии как рефлексивного маркера гетерогенности тканей [116]. Исследования показали, что оценка паттерна вариативного распределения может дать важную микроструктурную информацию о мозге и уточнить характеристики белого вещества; ДКС предлагает также независимую метрику для улучшения как чувствительности, так и специфичности при оценке динамики заболевания и важный параметр сканирования в случае анализа прогрессирования и реакции на лечение. ДКС рождает полностью независимую и отдельную метрику сканирования, отличающуюся от традиционных методов диффузионной томографии [49].
В гауссовой модели диффузии (т.е., в ДТТ) предполагается, что молекулы воды диффундируют однородно в определенном направлении, как в стакане воды. И диффузионно-взвешенный сигнал следует моноэкспоненциальному затуханию. Однако в реальной ткани со сложными клеточными структурами, молекулы воды в пределах томографического вокселя (обычно 2 × 2 × 2 мм) диффундируют через среду, которая является высоко гетерогенной в любом направлении, что приводит к отклонению от гауссова распределения (рис. 1). Модель ДКС включает избыточный член куртозиса (К) для того, чтобы “ухватить” это отклонение от гауссова распределения.
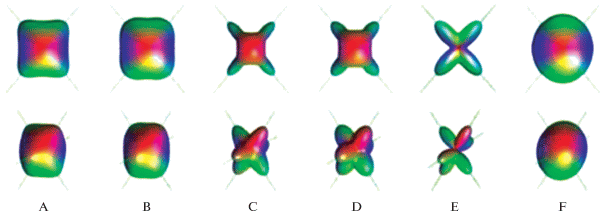
Положительный куртозис имеет более высокий пик и более мощные “хвосты”, а отрицательный – низкий пик и слабо выраженные “хвосты” (рис. 2). Когда Кapp = 0, модель ДКС сводится к модели ДТТ. Хотя отрицательный куртозис возможен с точки зрения математической теории, мнококомпартментные модели диффузии (а они в нейроматериале только такие) и эмпирические факты показывают, что куртозис всегда не отрицателен (К больше или равен 0) [99]. Диффузия на коротких временах может считаться гауссовой, замедляясь по мере того как молекулы воды имеют все больше времени для взаимодействия со структурами клетки. Более высокие значения куртозиса подразумевают большие затруднения для нормальной диффузии и более высокую сложность в пределах системы, подвергавшейся сканированию, что далеко не безынтересно для широких возможностей физиологической трактовки изучаемых явлений.
Рис. 2.
Куртозис. (а) График вероятностного распределения диффузионного смещения с различными степенями куртозиса [96]. (b) График показывает, что измеренное затухание диффузионно-взвешенного сигнала ln (S(b)/S0) (голубые кружки) четко отклоняется от линейной диффузионной функции (зеленая линия) и хорошо укладывается в модель. Probability = вероятность; Displacement = смещение; Signal attenuation = затухание сигнала; b value = величина b; Measured data = измеренные данные; Diffusion fit = модель нормальной диффузии; Kurtosis fit = модель диффузии с куртозисом.
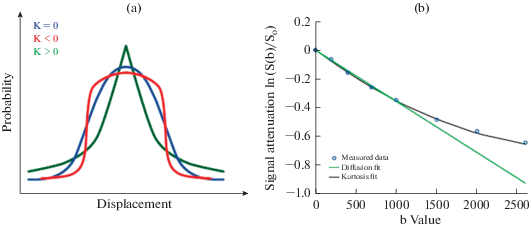
На рис. 2б показан диффузионно-взвешенный сигнал, измеренный в мозолистом теле и соответствующий модели диффузии и модели куртозиса. Когда используются более высокие значения параметра диффузионного взвешивания b-фактора (b > > 1500 с/мм2) и методика становится более чувствительной к коротким молекулярным расстояниям и гетерогенным клеточным структурам, затухание диффузионно-взвешенного сигнала отклоняется от моноэкспоненциального, предсказанного в соответствии с гауссовой моделью ДТТ. Модель ДКС, однако, прекрасно описывает реальную динамику сигнала.
Параметры диффузионного куртозис-сканирования. Поскольку диффузия имеет направленный характер, диффузионный куртозис также варьирует во всех измеряемых направлениях. Направленный диффузионный профиль можно понять с помощью тензорной матрицы 3 × 3 с тремя собственными векторами, ориентированными по трем основным осям эллипсоида диффузии, и соответствующими собственными величинами, представляющими коэффициент диффузии по каждой из основных осей (рис. 3). Направленный куртозис характеризуется тензорной матрицей 3 × 3 × 3 × 3 и представляет собой более сложное пространственное распределение. Интерпретация полной характеристики тензора куртозиса еще должна быть исследована в будущем. Самые часто используемые параметры ДКС – это те из них, которые имеют более непосредственную физическую связь с тензором диффузии, а именно, средний куртозис (СК) – среднее куртозиса диффузии по всем направлениям; осевой (ОК) – куртозис вдоль осевого направления эллипсоида, и радиальный (РК) – вдоль радиального вектора.
Рис. 3.
Диаграмма показывает распределение куртозиса по отношению к диффузионному эллипсоиду [96]. V1, V2 и V3 – эйгенвекторы; лямбда-1, лябмда-2 и лямбда-3 – эйгенвеличины тензора диффузии; и К1, К2 и К3 – значения куртозиса по принципиальным направлениям диффузионного эллипсоида. Kurtosis distribution = распределение куртозиса.
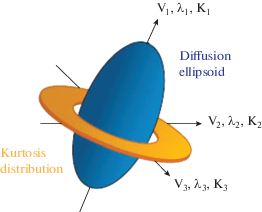
На рис. 3 показано упрощенное распределение куртозиса диффузии по отношению к тензору диффузии в типичном белом веществе. Куртозис идеального гауссова распределения должен быть равен нулю, и его численное значение возрастает по мере отклонения диффузии от этого паттерна. В белом веществе ОК обычно низкий, поскольку диффузия в осевом направлении аксонов идет свободно и относительно неограниченно, что приводит к меньшему отклонению от гауссового распределения. Также в белом веществе РК обычно имеет высокие значения, ибо клеточные мембраны и миелиновые оболочки вызывают существенно негауссово распределение смещения и приводят к гетерогенному паттерну диффузии.
Патофизиологические трактовки и клинические приложения
Ишемическая болезнь мозга и инсульт. ДВТ было колоссальным достижением в области томографии при инсульте в 1990-х гг. Ограниченная диффузия, как раньше считали, является характерным для острого инсульта симптомом, но с накоплением опыта этот бинарный подход устарел. Степень повреждения тканей часто является гетерогенной в ишемическом мозге, что приводит к разной степени ограничения диффузии. Улучшенное разграничение между необратимо поврежденной при инсульте ткани мозга и “пенумброй” в целях идентификации, могущей быть спасенной ткани, приобрело особое значение по мере того, как продолжалось усовершенствование внутриартериальных и реперфузионных восстановительных вмешательств.
Hui et al. обнаружили, что гетерогенные характеристики куртозис-сканирования в ишемической ткани были не видны с помощью традиционной диффузионной томографии, измеряющей средний коэффициент диффузии [47]. Используя ретроспективный анализ данных сканирования для пациентов с острым и подострым инсультом, эти авторы продемонстрировали значительное более высокое абсолютное изменение в процентах в случае куртозис-сканирования и, конкретнее, наибольшее увеличение ОК. Считается, что этот факт имеет место благодаря повышенной неоднородности тканей и осмотическому неравновесию из-за увеличения параметров аксонов и дендритов во время инсульта. ОК (параллельно направлению аксонов), как полагают, в основном затрагивается внутриклеточными структурами, тогда на РК (перпендикулярно направлению аксонов) считают, что большее влияние оказывают клеточные мембраны и миелиновые оболочки. Факты наибольшего изменения ОК сочетаются с предложенным физиологически значимым механизмом утолщения аксонов в ишемической ткани и поддерживают теорию, основной смысл которой сводится к тому, что изменения паттерна куртозиса во время ишемической болезни в основном возникают из-за внутриклеточного микроокружения, что, как правило, не учитывается даже при физиологически обоснованных восстановительных вмешательствах.
Cheung et al. использовали модель окклюзии средней церебральной артерии у крыс для сравнения модели куртозиса с традиционными данными по диффузии [24]. Области аномальной средней диффузии (СД) и СК измеряли во время артериальной окклюзии и через 20 мин после реперфузии, сравнивая с Т2-взвешенным повреждением на снимке, сделанном через 24 ч в ходе последующего наблюдения. Авторы обнаружили, что “повреждение СД было значительно большим, чем повреждение СК во время окклюзии средней церебральной артерии” и что “повреждение СД значительно уменьшилось после реперфузии, тогда как повреждение СК не показало практически никаких изменений”. Области с параллельными аномалиями сигнала СД и СК показывают плохое восстановление на снимках, сделанных в ходе последующего наблюдения. Эти открытия позволяют предположить, что включение данных о куртозисе может существенно дополнить традиционную диффузионную томографию, создавая более точную модель инсульта и обеспечивая физиологически интерпретируемую помощь в характеристике ишемической ткани и ее восстановления.
Нейродегенеративные расстройства. ДКС применяется как попытка измерить сложность ткани мозга в степени, превышающей возможности разрешения у традиционных методов МРТ. Было обнаружено [125], что повышенная микроструктурная сложность является результатом глиальной активности и реактивного астроглиоза. Было выдвинуто предположение, что потери нейронов приводят к пониженным значениям куртозиса. Разумно предположить, что ДКС может в потенциале служить для оценки стареющего мозга и в качестве суррогатного маркера для широкого разнообразия нейродегенеративных заболеваний.
Falangola et al. сравнили паттерны диффузионного и куртозис-сканирования у здоровых добровольцев и нашли “отчетливые паттерны среднего куртозиса (в префронтальной коре) у пациентов в различном возрастном диапазоне, со значительной, связанной с возрастом корреляцией для среднего куртозиса и положения пика СК” [36]. Wang et al. исследовали применение ДКС при паркинсонизме, обнаружив статистически значимое увеличение СК в путамене и черной субстанции у пациентов с болезнью Паркинсона по сравнению с контрольной группой [112].
Falangola et al. также провели оценку региональных изменений в извлеченной с помощью ДКС метрике у пациентов со слабой когнитивной недостаточностью и болезнью Альцгеймера по сравнению с контрольной группой [37]. Gong et al. в рамках аналогичных исследований оценили возможности применения ДКС у пациентов со слабой когнитивной недостаточностью и болезнью Альцгеймера [38]. Обе группы авторов обнаружили пониженные региональные СК и РК, ассоциировавшиеся с болезнью. Это, возможно, происходит “благодаря потере тел, синапсов и дендритов нейронов” и росту внеклеточного пространства [38]. Результаты обоих исследований поощряли мысль о том, что информация о куртозисе может показывать ранние микроструктурные изменения у пациентов со слабой когнитивной недостаточностью и болезнью Альцгеймера до наступления морфологических изменений, которые уже видны на традиционной МРТ; требуется расширение и валидация этой работы, ибо ясно, что ДКС может служить биомаркером определения болезни, облегчая оценку степени тяжести когнитивного дефицита и прогрессирования заболевания.
Демиелинизирующие заболевания. ДВТ и ДТТ уже долгое время применяются для оценки характера и динамики демиелинизирующих заболеваний. Существует сильная направленная зависимость распределения воды в миелинизированных трактах белого вещества, а воспаление и демиелинизация имеют тенденцию увеличивать коэффициент диффузии и уменьшать степень направленности. Исследования концентрировались на РД (диффузии, перпендикулярной длинной оси) как маркере заболевания. Хотя ДТТ с умеренным значением b (1000 с/мм2) в основном чувствительна к диффузии внеклеточной воды, ДТТ с более высоким значением b (2500 с/мм2) обеспечивает более глубокий анализ внутриклеточного пространства и мембранных взаимодействий [57]. Результаты, полученные с помощью многокомпартментных моделей диффузии, позволяют предположить, что ДКС может оказаться более чувствительным, чем коэффициент диффузии, к изменениям скорости водообмена между двумя компартментами, напрямую связанным с целостностью миелина и интрааксонным-экстрааксонным обменом воды [123]. В условиях демиелинизации повышен интрааксонный-экстрааксонный обмен воды, что будет влиять на меру диффузионного куртозиса (РК) более, чем на коэффициент диффузии (РД), и обретет в этом случае клинико-физиологическую интерпретацию.
Yoshida et al. исследовали изменения параметров куртозис-сканирования у пациентов с рассеянным склерозом, чтобы определить, может ли ДКС служить более чувствительным индикатором заболевания [123]. Несмотря на маленький объем выборки, эта группа обнаружила снижение СК у пациентов с рассеянным склерозом по сравнению с контролем, характеризующемся отсутствием изменений в белом веществе. Дальнейшая оценка с привлечением дополнительных параметров куртозиса, включая РК, может быть полезна.
Трекинг волокон
Трехмерное моделирование трактов белого вещества, которое называется трактографией, находит все более широкое применение в физиологическом эксперименте и в клинике, чаще всего при дооперационной оценке пациентов с опухолями или эпилепсией [79]. Визуализация важнейших функциональных трактов помогает в оперативном планировании и используется в целях, как минимизации послеоперационной заболеваемости, так и для улучшения неврологических исходов. ДТТ позволяет добиться превосходной пространственной визуализации этих трактов и улучшить, таким образом, понимание функциональной архитектуры мозга.
Трактография работает путем соединения, воксель за вокселем, направлений максимальной диффузии. Это надежная технология для случая, когда большие пучки миелинизированных волокон ориентированы в одном и том же направлении; однако она становится ограниченной в сложных областях мозга из-за неспособности добиться достаточного разрешения применительно к пересекающимся волокнам в пределах конкретного вокселя. Усреднение двух сильно анизотропных тензоров приводит к получению дискообразного тензора с неопределенной направленностью. Несколько методик использовалось для преодоления этого ограничения, включая моделирование трехмерной функции распределения ориентации (orientation distribution function, ODF/ФРО) в плане традиционного простого тензора диффузии [107]. Эти методы обычно называются методами высокого диффузионного сканирования с угловым разрешением, например, q-шаровое сканирование (q-ball imaging, QBI) и диффузионная спектральная томография, в которых большой вес диффузии (максимальная величина b 3000–8000 c/мм2) обычно используется вместе с большим числом направлений кодирования диффузии (больше 40) [108, 114]. Для диффузионной спектральной томографии требуется много значений b для заполнения q-пространства диффузионных весов, что приводит к большой продолжительности сканирования (более 30 мин). Для QBI необходимо только одно большое значение b (3000 с/мм2) и поэтому этот метод клинически более приемлем. Его недостатком, однако, является то, что, благодаря более высокому использованному диффузионному весу, QBI не обеспечивает клинически осмысленные параметры диффузии (СД или ФА), поскольку измеряемый коэффициент диффузии зависит от значения b.
Lazer et al. описали альтернативный подход к аппроксимации ФРО, который включает компоненты негауссовой диффузии в модель ДКС и истинное улучшенное разрешение двух и трех пересекающихся волокон в данном вокселе [55]. На рис. 4 показана трехмерная поверхность ФРО для симуляции моделей пересечения от двух до трех волокон. ФРО, оцененная с помощью негауссовой части модели ДК (рис. 4г), хотя и не столь чисто описанная, как аппроксимация QBI (рис. 4д), тем не менее, прекрасно соответствует направлению волокон и пикам аппроксимированной ФРО. По сравнению с QBI, ДКС имеет то преимущество, что здесь используются меньшие значения b (<2500 с/мм2), обеспечивая лучшее соотношение сигнал-шум для диффузионно-взвешенного сигнала и добавочные параметры, связанные как с диффузией, так и с куртозисом.
Рис. 4.
На диаграмме показаны трехмерные поверхности точных (из моделирования) и оцененных функций распределения ориентации (ODF) для диффузионных моделей с двумя (верхний ряд) и тремя (нижний ряд) пересекающимися волокнами с одинаковым вкладом. Направления компонентных волокон показаны зелеными линиями [96]. Ориентация волокон: (θ1, ϕ1) = (50°, 90°) и (θ2, ϕ2) = (130°, 90°) для n = 2 и (θ1, ϕ1) = (60°, 90°), (θ2, ϕ2) = (120°, 40°), (θ3, ϕ3) = (120°, 130°) для n = 3. A: Точное решение ODF. B: Оценка диффузионного куртозиса (ДК) ODF. C: Точное решение ODF из негауссовского компонента в модели DK (NG-ODF). D: DK оценка NG-ODF. E: Q-ball оценка ODF (масштабированный минимум-максимум) для значения b = 4000 с/мм2. F: гауссовская оценка ODF.
Ограничения. У ДКС есть ряд ограничений, первое из которых заключается в сравнительно длительном времени получения изображений по сравнению с ДТТ: как минимум, нужно использовать два ненулевых значения b и по меньшей мере 15 направлений диффузии, чтобы оценить ее и тензор куртозиса; длительное сканирование повышает чувствительность к движениям пациента и уменьшает производительность. Однако были предложены клинически приемлемые протоколы сканирования (7–10 мин) и для ДКС [118]. Далее, если только средний куртозис клинически интересен, то вместо оценки полных тензоров можно провести быстрое получение сканов ДКС в течение 1–2 мин [42]. Эта возможность делает клиническое приложение ДКС высоко приемлемым, когда нужна только быстрая оценка, основанная на карте СК, по аналогии с ДВТ против ДТТ.
Еще одним ограничением ДКС является то, что эта модель сложнее (21 параметр), чем ДТТ (6 параметров). При использовании краткого протокола сканирования (например, 7-минутный протокол), параметры ДКС могут варьировать, и эта вариативность различается по регионам мозга [98].
Итак, следует уделить внимание дизайну исследования и оценке статистической мощности работ по ДКС; отсутствие значимости может быть обязано высокой вариативности данных. Более того, точный смысл СК, ОК и РК до сих пор изучается. Новые работы требуются для дальнейшей валидации появляющихся данных и сопоставления изменений ДКС с его физиологическими параметрами и их патологическими вариантами.
Дальнейшие направления работ включают проведение большего числа исследований связи параметров ДКС с разнообразными физиологическими и гистологическими материалами, лежащими в основе клеточных изменений. Это направление мало освещено в современной литературе. Интересны вопросы включающие клеточные основы увеличения и уменьшения несовпадения СК и СК-СД. Lee et al. попытались решить эти вопросы путем симуляции методом Монте-Карло диффузионно-взвешенных сигналов, но, заметим, экспериментальные модели с корреляциями данных сканирования и гистологических доказательств, несомненно, окажутся особенно предпочтительными [56].
Большинство исследователей концентрировалось только на параметре СК, так как это одно из преимуществ ДКС – добавочная чувствительность СК в тканях со сравнительно изотропной диффузией. Однако РК, схватывающий гетерогенность диффузии от аксонных мембран и миелинизации, возможно, будет более чувствительным фактором в белом веществе. Новые исследования требуются для связи изменений РК непосредственно с целостностью мембран и миелина.
Бòльшая часть работ до сих пор была проведена в маленьких популяциях добровольцев и пациентов, более экстенсивные исследования необходимы для подтверждения первоначальных заключений, следующих из этих экспериментов. Корреляция с альтернативными физиологически интерпретируемыми модальностями сканирования, которые уже используются сегодня, также будет небесполезна для подтверждения ценности и углубления понимания возможностей и перспектив ДКС.
МАСС-СПЕКТРОМЕТРИЧЕСКАЯ ВИЗУАЛИЗАЦИЯ
MSI (MALDI-TOF MSI) – это технология молекулярной визуализации без меток, которая быстро развивается в последние годы, сочетая в себе высокую чувствительность и селективность масс-спектрометрии с пространственным анализом традиционной оценки спектров, обеспечивая пространственное выравнивание различных молекул в тканях, как качественно, так и количественно. По этой технологии (рис. 5) образцы биологических тканей готовятся в виде тонких замороженных ломтиков [104]. Матрица равномерно распыляется на поверхность ткани и совместно кристаллизуется с небольшими молекулами образца. Когда кристалл облучается лазером, луч сканирует образец, матрица поглощает энергию, в результате чего образец десорбируется. Далее происходит перенос заряда между матрицей и образцом, ионизируя молекулы образца, после чего они проходят через вакуумную трубку, на которую воздействует электрическое поле, и идентифицируются в соответствии с их временем полета до детектора. Эта идентификация зависит от времени полета, пропорционального отношениям массы ионизированных молекул к заряду, что позволяет рассчитать молекулярную массу образцов. Наконец, пространственное расположение молекул образца в ткани визуализируется на мониторе. Считается, что обнаружение молекул в анализе MALDI в значительной степени зависит от выбора матрицы. Разработка различных матриц и постоянное улучшение разрешающей способности технологии позволили расширить возможности его применения. В последние годы появилось много новых перспективных матриц: пористый кремний, наноматериалы, низкомолекулярные органические матрицы и органические соли показали хорошие перспективы для применения in situ визуализации малых молекул [61].
Рис. 5.
Схема процесса MALDI-TOF MSI. В MALDI-TOF MSI молекулы на поверхности среза ткани сначала смешиваются с матрицей. Когда лазер попадает на поверхность ткани, матрица поглощает энергию лазера и разрешается. Эти разделенные матрица и молекулы в ткани вместе входят в газовую фазу, а затем подвергаются переносу протона с образованием ионов. Наконец, молекулярное распределение в ткани обнаруживается с помощью масс-спектрометрии и наносится на карту с использованием программного обеспечения реконструкции изображений [21, 64, 104].
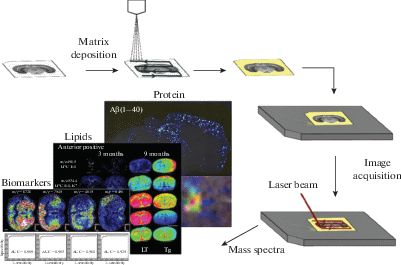
Этот метод позволяет обнаруживать белки, полипептиды, липиды, глюкозу и распределение различных лекарственных средств в биологических тканях; несколько молекул могут быть обнаружены одновременно с высокой чувствительностью [41, 77, 109, 121]. Методика дает прямую информацию о распределении молекул с разным весом в срезах тканей, предоставляя в распоряжение экспериментатора структурную информацию о молекулах-мишенях [22].
Поскольку технология MALDI-TOF MSI является высокоэффективной, она обеспечивает высокую пропускную способность, широко используясь в области анализа и скрининга лекарственных средств для исследований мозга и лечения заболеваний ЦНС. Ее область применения может быть проиллюстрирована несколькими примерами. MALDI-TOF MSI был использован для обнаружения дипептида ZP1609 в срезах тканей головного мозга мыши после его внутрибрюшинной инъекции, создавая изображение распределения препарата [113]. Этот пример показывает, что методика не ограничивается локализацией молекул в тканях мозга; она может быть использована для непосредственного обнаружения распределения препарата в срезах. Кроме того, скорость, с которой лекарства достигают органы-мишени после их введения, может быть оценена. Перспективность технологии можно продемонстрировать на примере изучения механизмов, лежащих в основе острого нарушения мозгового кровообращения (инсульта). Была создана модель постоянной окклюзии средней мозговой артерии на крысах и использована MALDI-TOF MSI для визуализации различных небольших молекул в срезах тканей мозга. Исследования визуализации мозга MALDI-TOF MSI на мышиной модели с ишемическим инсультом проявили три белка: ATP5i, COX6C и UMP-CMP киназу, которые могут участвовать в “создании” инсульта и быть потенциальными биомаркерами или молекулярными мишенями при церебральной ишемии [64]. Такие исследования являются основой для дальнейшего изучения физиологических механизмов и патогенеза инсульта, а также разработок новых антиишемических препаратов.
Как известно, патогенез болезни Альцгеймера (AD) связан с агрегацией бета-амилоидного белка (Aβ). MALDI-TOF MSI был использован в мышиной модели AD для визуализации “мишени” накопления и специфичности областей мозга, содержащих агрегированный Aβ, а также распределения родственных белков и фосфолипидов для изучения патогенеза AD, прогнозирования развития и характера прогредиентности заболевания [51, 80].
Еще несколько применений MALDI-TOF MSI включают а) исследования болевых нейропептидов в спинном мозге крыс для выяснения механизмов передачи сигналов, проявляющихся в виде алгических синдромов; б) анализ экспрессированных белков в глиоме и нормальных тканях головного мозга для определения их функции и поисков новых терапевтических мишеней [10, 97].
Магнитно-резонансная томография на основе трассера
Ткань мозга по существу состоит из двух компонентов: клеточных элементов (нейронов и глиальных клеток) и промежутков между ними, организующих внеклеточное пространство, на которое приходится примерно от 15 до 20% всего объема ткани, ширина его примерно 20–60 нм. Оно включает ионы, нейротрансмиттеры, метаболиты, пептиды, нейрогормоны и иные нейроактивные вещества. Нейроны и глиальные клетки выделяют большое количество нейроактивных веществ, которые затем диффундируют через эту среду для достижения своих целей-мишеней, которые расположены на нейронах и глиальных клетках, обычно вдали от места высвобождения, обеспечивая внесинаптическое соприкосновение. Таким образом, теория молекулярной диффузии применяется для количественного анализа и изучения физиологических параметров, то есть для наблюдения диффузии внутри мозга путем выбора подходящих молекул-индикаторов.
Магнитно-резонансная томография (МРТ) на основе индикаторов – это метод, который можно использовать для визуализации интерстициального пространства (ИП) на моделях животных in vivo. Процедура суммирована на рис. 6. Стереотаксис используется для инъекции гадолиния-диэтилентриаминпента уксусной кислоты (Gd-DTPA), молекулярного индикатора для целевых областей головного мозга животного, таких как хвостатое ядро, кора или таламус. Это позволяет визуализировать межклеточную среду в мозге in vivo с помощью МРТ. Кроме того, трассировщик усиливает сигнал обнаружения МРТ в зависимости от времени; усиление уменьшается вследствие диффузии и выведения молекул воды из ИП. Увеличение интенсивности сигнала является линейной функцией локальной концентрации Gd-DTPA; следовательно, динамические процессы на межклеточной территории, которые включают Gd-DTPA, могут отслеживаться в режиме реального времени путем измерения интенсивности сигнала, отображаемого с помощью МР. Это позволяет проводить количественную оценку параметров локальной диффузии в межклеточной среде мозга в соответствии с традиционной моделью. Воспалительные факторы, белки и другие вещества, образующиеся во время развития заболеваний центральной нервной системы, могут изменять состав интерстициальной жидкости и параметры диффузии мозга, уменьшая объемную долю и увеличивая извилистость λ соответственно. Действительно, введение лекарств через интерстициальную систему мозга может повысить эффективность лечения, что, в свою очередь, окажется полезным для анализа механизмов действия и оценки эффективности разработки и скрининга лекарств.
На примере оценки патогенеза болезни Паркинсона (БП), предположительно связанного с расстройством интерстициальной среды, удалось подтвердить, что накопление метаболитов, таких как дофамин, является одной из причин, лежащих в основе дофаминергической дисфункции нейронных сетей при БП. [58, 65, 92]. Была использована модель, основанная на трассировке МРТ в исследовании крыс с БП, вызванной 6-гидроксидопамином, которое показало, что 6-гидроксидопамин снижает константы извилистости λ и клиренса среды в черной субстанции и увеличивает период полураспада индикатора. Более того, экстракт сафлорового флавоноида обращал вспять эти изменения параметров диффузии, тем самым обеспечивая определенную степень нейропротекции [86]. Такие результаты показывают, что МРТ на основе индикаторов может быть новым жизнеспособным подходом для анализа физиологической архитектуры центральных дисфункций и эффективности лечения целого ряда заболеваний центральной нервной системы.
МРТ на основе индикаторов также используется для “разграничения” территорий в головном мозге: Gd-DTPA вводили в хвостатое ядро и таламус крыс, наблюдая его динамический перенос в интерстиций on line [46]. Установлено, что Gd-DTPA транспортируется из хвостатого ядра в ипсилатеральные лобные и височные кортикальные зоны; никаких изменений в таламусе не наблюдалось, и не было обнаружено следового транспорта между двумя граничащими областями зрительного бугра и хвостатого ядра [46]. Это указывает на то, что мозг действительно содержит физиологически разделенные области и инициирует переоценку существующих представлений о распределении индикаторов, свидетельствуя о необходимости смены ориентиров при разработке новых лекарственных средств.
Функциональная МР-спектроскопия
Отдельно стоит рассмотреть функциональную МР-спектроскопию (фМРС), направленную на изучение изменений концентраций метаболитов в веществе головного мозга в связи с нейрональной активностью. Как правило, такой вариант технологии состоит в измерении сигналов глутамина (Gln), глутамата (Glu), и гамма-аминомасляной кислоты (ГАМК, γ-aminobutyric acid, GABA). Glu является основным возбуждающим нейромедиатором на территории человеческого мозга, GABA – основным тормозным трансмиттером, а Gln является их базовым прекурсором. Через метаболический цикл Glu–Gln–GABA проходит до 80% всей глюкозы, потребляемой корой головного мозга, и баланс возбуждения/торможения при этом играет ключевую роль в функционировании мозга как на локальном, так и на сетевом уровне [68, 87, 95, 100]. Именно таким образом фМРС позволяет проводить непосредственные измерения ключевых биохимических характеристик мозга on line, не опосредованные гемодинамическими и прочими осложняющими эффектами.
Методологически сложная задача фМРС в этом случае обусловлена высокой степенью взаимного перекрытия спектров Glu, Gln, GABA с другими метаболитами мозга. В связи с этим Glu и Gln часто объединяют и измеряют их суммарный сигнал, обозначаемый как Glx. Сигнал GABA на спектрах in vivo существенно затенен и “заретуширован” широкими спектральными линиями макромолекул (ММ), так и Cr, Glx, NAA, вследствие чего для его измерения используется специальная методика спектрального редактирования [71]. Результирующий сигнал не содержит эха других метаболитов, но включает в себя индикатор ММ, и обозначается как GABA+ (рис. 7). Использование методов подавления сигнала ММ позволяет оценить долю ММ в GABA+ на уровне 50%, что вносит существенную погрешность в изучение функциональных изменений концентрации GABA, обуславливая возрастающую популярность методик, включающих подавление сигнала ММ, хотя, тем не менее, подавляющее большинство работ, выполненных сегодня, проводят, концентрируясь на измерение сигнала GABA+ [18, 28, 35, 39, 43–45, 72, 73, 81, 117].
Рис. 7.
Адаптировано из Mescher et al., 1998, (а) – in vivo МРС ткани мозга человека, отмечены основные наблюдаемые метаболиты. (б) – in vivo МРС ткани мозга человека с использованием методики спектрального редактирования, отчетливо визуализируются пики GABA [71].
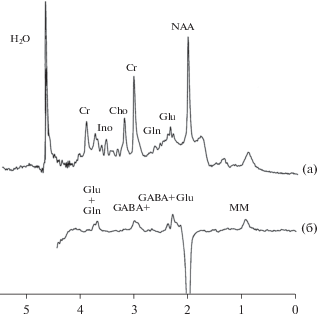
Представленные в литературе работы демонстрируют достоверное увеличение концентрации глутамата в областях нейрональной активности в ходе формулирования решения и анализа широкого круга задач, при этом величина эффекта (2–18%) и его временные параметры подвержены значительному разбросу [69, 75]. Так, наблюдалось достоверное увеличение сигнала Glx в затылочной коре при предъявлении визуальных стимулов, увеличение сигнала на 2–12% в ходе выполнения когнитивных заданий, а также сходные по тенденции результаты, связанные с необходимостью восприятия боли и выполнением сенсомоторных проб [12, 14, 16, 40, 76, 89, 90, 101]. При этом систематическое обобщение имеющейся литературы приводят к неоднозначным следствиям, показывая наличие связи уровня Glu как с нейрональной активностью в области непосредственного измерения сигнала МРС, так и в других регионах, что говорит о необходимости дальнейшего изучения [34, 52, 69, 75].
Работы, посвященные измерению сигнала GABA показывают отрицательную корреляцию концентрации основного тормозного нейромедиатора с уровнем нейрональной активности, однако результаты зависят от того, какая территория является регионом интереса. Так, для сочетания визуальных стимулов в затылочных областях мозга, как отдельные работы, так и тщательный мета-анализ показывают слабую, но достоверную отрицательную взаимосвязь GABA–BOLD; для сенсомоторной коры такой корреляции не наблюдается [16, 20, 33, 35, 44, 110]. Наиболее яркий эффект взаимосвязи показан для области передней поясной/префронтальной коры, где для широкого круга задач, включающих эмоциональное восприятие, внимание, и когнитивную деятельность, констатирована отрицательная связь GABA+ и нейрональной активности, измеренной методом фМРТ; аналогичный результат показал масштабный мета-анализ [17, 23, 59, 78, 94].
Совокупность имеющихся в литературе сведений позволяет судить о фМРС как о перспективной и незаслуженно “забытой” технологии непосредственного измерения функциональных маркеров в головном мозге человека; очевидна необходимость развития направления как в области методик сканирования и обработки данных, так и в интерпретации результатов и их соотнесении с заключениями, полученными иными методами.
К преимуществам фМРС следует отнести прямое измерение абсолютных концентраций метаболитов мозга и отсутствие при этом возможных “модификаций” со стороны сосудистой системы. Получение информации об абсолютных концентрациях позволяет делать заключение не только о нарушении регуляции и масштаба ответа на предлагаемые стимулы, но и об измененных параметрах состояния покоя. Такая информация в меньшей степени доступна, например, функциональной МРТ, и может быть предпочтительной при изучении патологий и изменений, связанных с возрастом. Отсутствие нейроваскулярной модуляции, кроме того, позволяет снизить погрешность измерений характера ответных реакций со стороны сосудистой системы, вызванной возрастом и другими факторами.
К ограничениям метода стоит отнести относительно низкие пространственное и временное разрешение, обусловленные концентрациями исследуемого продукта и, как следствие, необходимостью получения сигнала от относительно большого объема вещества мозга, и неизбежной при этом суперпозиции многочисленных повторных измерений.
Оптическая прозрачность ткани: техника CLARITY
Метод CLARITY, впервые разработанный Chung et al. (2013) – экспериментальное получение изображений всего мозга с использованием оптической прозрачности ткани; эта технология инициировала новые направления в нейровизуализации [6, 26, 27].
Подход в CLARITY демонстрируется на рис. 8. В методике используется прозрачный гидрогель для замены липидов и для фиксации белков и нуклеиновых кислот в образцах тканей. Этот процесс обеспечивает тканям органов, которые структурно не повреждены, но оптически прозрачны, сохранение их молекулярной организации. Молекулы-мишени могут быть окрашены и помечены с использованием флуоресцентной маркировки; в сочетании с методами оптической визуализации это позволяет получать трехмерное представление высокого разрешения структурно интактных тканей на клеточном и/или молекулярном уровне, получив, таким образом, крупномасштабную и многоуровневую, интерпретируемую в физиологической лексике, визуализацию структур мозга.
Рис. 8.
Схема техники CLARITY для получения оптической прозрачности тканей. При 0 ~ 4°C параформальдегид, акриламид и бис-акриламид вводятся животному путем перфузии через сердце. После того, как белки и нуклеиновые кислоты полностью фиксируются параформальдегидом, образец ткани нагревают до 37°C, вызывая полимеризацию акриламида и бис-акриламида. Внутри ткани образуется гидрогель, сохраняющий информацию о локализации белков и нуклеиновых кислот. Применение анионного поверхностно-активного вещества додецилсульфата натрия для удаления фосфолипидов в образце дополнительно обеспечивает соответствие показателя преломления образца, так что оптическая проницаемость его значительно увеличивается [31, 103].
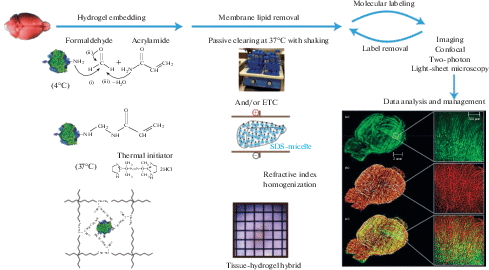
Первым шагом в этом процессе является внедрение в ткани путем введения в образец холодного (4°C) прозрачного раствора мономера гидрогеля, содержащего акриламид, бисакриламид, формальдегид и термический инициатор. Затем образец инкубируют при 37°С, чтобы обеспечить формирование волокнистой сети, которая сохраняет молекулярную структуру. Липиды в ткани удаляют с использованием пассивной термической элиминации в очищающем растворе на основе сильных ионных детергентов (SBS; 4%-ный додецилсульфат натрия с буфером) при 37°C. Электрофоретическая очистка применяется для получения полного “гибрида” ткани с гидрогелем. Наконец, повторные молекулярные маркировки и их удаление выполняются для образцов ткани и оптической микроскопии, используя далее для визуализации в различных целях [102].
Описанная технология визуализации имеет несколько преимуществ. Используя гидрогели, встроенные в ткани для фиксации белков и нуклеиновых кислот, она может создавать оптически прозрачные, но структурно неповрежденные ткани органов с сохранением молекулярной и структурной организации. Прозрачный орган можно многократно окрашивать, маркировать и визуализировать, используя для маркировки различные типы клеток и идентификации молекулярных мишеней в мозге; удается не только сохранять непрерывность структуры органа, но и отслеживать нейроны внутри мозга с помощью 3D-визуализации [103, 119]. CLARITY и его различные модернизированные версии могут быть использованы для реконструкции толстых неповрежденных тканей в сочетании с различными системами микроскопии, обеспечивая тем самым идеальные возможности для изучения физиологической архитектуры структурно сложных центральных сетевых систем [119]. Например, эта технология позволяет анализировать нейронные цепи в мозге мыши и тонкие различия в этих цепях, наблюдая связи между клетками, характеризуя субклеточную структуру и, кроме того, обеспечивая возможность изучения химических ассоциаций между белковыми комплексами, нуклеиновыми кислотами и нейротрансмиттерами.
Картирование системы сосудистой сети головного мозга мыши с использованием CLARITY было выполнено для оценки структурных трансформаций всей цереброваскулярной системы в модели мышиного инсульта [124]. Комбинируя количественные методы CLARITY и 3D-структуры церебральной микрососудистой системы на мышиной модели с глиомой и у здоровых животных были визуализированы в 3D и количественно проанализированы на предмет их связи с клетками глиобластомы; это продемонстрировало разницу между опухолевой тканью в областях серого и белого вещества и показало паттерн клеток глиобластомы, проникающих в паренхиму мозга, что послужило основой для изучения патофизиологических механизмов глиом и их микроокружения [31, 53].
Пассивная CLARITY (ПACT) – это быстрая и эффективная техника наблюдения прозрачности тканей [119]. Когда реагент ПACT вводили в мозжечок или субдуральную канюлю над обонятельной луковицей, он быстро транспортировался к полушариям через систему кровообращения или спинномозговой жидкости, таким образом, достигался системный клиренс и маркировка центральных структур, этот вывод расширил приложения для CLARITY. ПACT доказал свою эффективность в обеспечении прозрачности мозга мышей при сохранении информации об РНК и обеспечении максимальной глубины изображения, пользуясь для изучения структуры и функций центральной нервной системы у мышей, крыс и нескольких водных животных [50, 111]. Сочетание ПACT с флуоресцентной маркировкой для наблюдения за нейронами и митохондриальными белками в тканях мозга мыши и человека проявило дефекты дыхательной цепи, связанные с “митохондриальными заболеваниями”, что позволило изменить понимание сложных патологических метаморфоз этого семейства болезней [84].
Другой улучшенный метод CLARITY был использован для изучения плотности парвальбумин-позитивных промежуточных нейронов в генетической мышиной модели шизофрении, вызванной микроделецией Df (h15q13) [15]. Результаты показали значительное снижение плотности парвальбумин-позитивных нейронов в коре головного мозга мыши, что позволило выяснить патофизиологические механизмы этой модели заболевания. Кроме того, CLARITY и оптическая микроскопия использовались для картирования входов и выходов дофаминовых нейронов в интактном мозге мыши [70]. Исследования показали, что функциональная специализация дофаминовой системы происходит из области вентрального сегмента и компактной части черной субстанции, где наблюдались дофаминергические нейроны (или ниже по течению от этих областей), и что регуляция активности подмножеств этих клеток проецируется на хвост стриатума, отличаясь от такового у других клеточных субпопуляций [115].
Оптогенетика
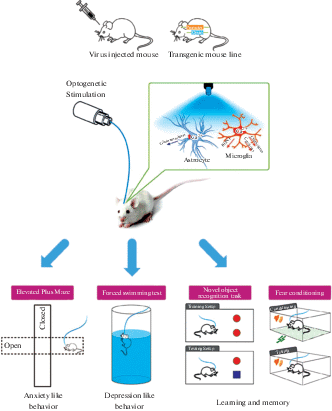
Карл Дайссерот, невролог, участвующий в первоначальном развитии CLARITY, и Эд Бойден – пионеры в фотогенетике. В 2005 г. лаборатория Дайссерота достигла серьезных результатов в области регуляции нервных функций, экспрессируя белки в нервных клетках, которые реагируют на световую стимуляцию различных длин волн, открывая эру прецизионных манипуляций с мозгом. С тех пор исследования межнейронного взаимодействия были сосредоточены на изучении причинно-следственной связи между конкретными нервными цепями и функциями мозга. Уже более десяти лет оптогенетические методы используются для изучения новых способов лечения различных заболеваний и состояний, включая эпилепсию, болезнь Паркинсона и БА [82, 88, 91, 118]. Например, оптогенетика была применена в мышиной модели AD. Мыши модели AD (APP/PS1) были скрещены с мышами ArcCreERT2 для получения генов потомков. Линия ArcCreERT2 позволяет сравнивать неизменно помеченные ячейки, активированные во время кодирования и экспрессии памяти [30]. Затем мышей-потомков скрещивали с мышами ROSA26-CAG-stopflox-ChR2 (H134R)-EYFP (Ai32) для получения мышей модели ADP/PS1 × ArcCreERT2 × канал-родопсин (ChR2) AD. Впоследствии изучилась пространственная, фобическая и когнитивная память. Удалось обнаружить, что у мышей с АД, экспериментально фиксируются разные варианты фобической памяти по сравнению с контрольными мышами (рис. 9). Фотогенетическая стимуляция нейронов в зубчатой извилине инициировала восстановление памяти и реактивировала нейронные цепи мышей AD, которые ранее были активированы во время кодирования. Такие результаты предполагают, что активация ранее изученных следов памяти в зубчатой извилине может улучшить когнитивные нарушения и что оптогенетическая стимуляция зубчатой извилины открывает новые направления в исследованиях и лечении AD [83].
Рис. 9.
Схема оптогенетического исследования in vivo, посвященного изучению функций глии в механизмах высшей нервной деятельности. Используя вирусные векторы или трансгенных мышей, глиальные клетки экспрессировали ген опсина, специфичный для определенного типа клеток. На мышах была проведена серия поведенческих тестов с целью оценки in vivo изменений функций глии, вызванных оптогенетической активацией/ингибированием. Функцию глиальных клеток при тревожных расстройствах можно оценить с помощью перекрестного лабиринта, основанного на отвращении мышей к открытому пространству, и теста принудительного плавания, часто используемого поведенческого критерия для анализа поведения, связанного с депрессией. Чтобы оценить воспоминания об узнавании и отвращении, можно использовать эти поведенческие тесты и задачи по распознаванию новых объектов для регулирования страха [25].
Сравнительно недавно исследователи из Массачусетского технологического института и Парижского университета Декарта успешно повысили точность существующих фотогенетических методов, объединив новый светочувствительный белок soCoChR с двухфотонной компьютерной голографией путем светочувствительных манипуляций с классом нейронов, сократив таким образом время отклика до 1 мс, что позволило манипулировать независимыми клеточными ансамблями и отдельными клетками с целью изучения их взаимодействия.
Табл. 1 подчеркивает и сравнивает сильные и слабые стороны четырех различных методов MALDI-TOF MSI, обеспечивая одновременную визуализацию разнообразной информации о пространственном распределении молекул, что позволяет с высокой пропускной способностью оценивать множество мишеней и проводить поиск лекарств.
Таблица 1.
Сравнение преимуществ четырех описанных технологий
| Категории | Масс-спектрометрическая визуализация | МРТ | CLARITY | Оптогенетика |
|---|---|---|---|---|
| Пространственно- временное разрешение | Молекула | Межклеточное пространство | Клеточная или субклеточная структура | Электрическая активность в миллисекундах или субмиллисекундах |
| Масштаб изображения | Срез мозга | Весь мозг | Весь мозг | Срез мозга |
| Живая ткань | – | + | – | + |
| Трассировка нейронных цепей | – | + | – | + |
Знак “+” означает, что соответствующая технология квалифицирована, а знак “–” обратное.
Использованию технологий визуализации в самых широких областях физиологии в настоящее время уделяется явно недостаточное внимание. С непрерывным развитием и оптимизацией этих технологий восстановится возможность использования их в комбинации для достижения многоуровневой визуализации, что может революционизировать исследования наук о жизни, в первую очередь, их физиологический форватер.
ЗАКЛЮЧЕНИЕ
Выполненный в рамках гранта РНФ № 21-15-00209 обзор продолжает обсуждение смыслов и инструментов, ориентированных на анализ молекулярно-клеточных и системных механизмов нейропластичности и роли этого императива в формировании т.н. “интерактивного мозга” [2–5, 66]. Основным инструментом исследований по-прежнему остается фМРТ-ЭЭГ синергия и количественный МРТ-мониторинг как числовое выражение пластичности. Главное действующее лицо – феномен функциональной коннективности (ФК), а основным местом, в котором развиваются события и которое всегда является источником визуализации – нейрососудистое сцепление (НСС), и его неизменные функционалы – нейронный комплекс, астроцитарная глия и сосудистый компонент.
1. ФК – это совокупность характеристик, определяющих параметры формирования новых нейросетей – продуктов фМРТ; интенсивность формирования связей между мозговыми структурами, рост аксонов и создание новых конфигураций, описываемых в лексике трактографики. Это придает количественный характер формату пластичности, позволяет визуализировать и оценить скоростные параметры вновь возникающих проводящих каналов. Элементы сетей, их узловые характеристики становятся “мишенями” когнитивного и любого иного, в частности, лекарственного, управления.
2. Микроструктурная изменчивость нейронного пула НСС теперь оценивается на базе современных технологий количественного фМРТ: картирования макромолекулярной протонной фракции (МПФ) и диффузий молекул воды, последнее в связи с построением куртозис-структур.
3. Предлагаемые современные количественные технологии МРТ основаны на методах быстрого картирования МПФ и диффузионных характеристик, всесторонне верифицированных в последние годы, они обеспечивают наиболее точный и эффективный по времени подход к изучению нормального и аномального развития мозгового вещества и готовы к клинической апробации.
Совокупность этих средств позволяет прикоснуться к проблеме НСС на уровне его макро- и микроскопических следствий. НСС становится предметом клинического внимания и, таким образом, приобретает числовое выражение и визуализационные контуры, становясь интерпретируемыми “симптомами” эффективности восстановления нарушенных морфо-функциональных механизмов мозга.
4. В 2012 г. Ярных (2018) был предложен принципиально новый способ одноточечного МПФ-картирования, который преодолевает многочисленные ограничения: обладает приемлемым для клиники временем сканирования, высокой количественной точностью и отличным качеством изображений, методически разработан и апробирован в пре- и постнатальных нейроисследованиях, гистологически верифицирован на мышиных моделях. Этот метод трехмерного картирования МПФ с высоким разрешением основан на одноточечном подходе с использованием минимально возможного количества исходных изображений, что значительно сокращает время сканирования. Для получения одной МПФ-карты требуется всего четыре исходных изображения – МТ-взвешенное эталонное изображение без внерезонансного насыщения, протон- и Т1-взвешенное изображения [122].
5. Региональный кровоток, способы визуализации его in vitro и in vivo предлагается исследовать, используя варианты получения оптической прозрачности, позволяющей в срезах контролировать динамку сосудистого русла.
6. Следует понимать, что в традиционный контекст нейрофизиологического поиска, реализуемого фМРТ, органично включается феномен миэлинизации, его нарушение играет критическую роль в обеспечении нервной передачи, формировании новых межструктурных связей, их прочности и пластичности, обеспечивая при этом быстропроводящие коммуникации. Прижизненное картирование миелинизации прошло несколько этапов понимания и освоения, последний из которых базируется на многокомпонентном анализе релаксационных кривых в режиме Т2, где одна из компонент ассоциирована с водной фракцией, связанной с миелином.
6. Магнитно-резонансная спектроскопия (МРС), к сожалению, не попадает в перечень обязательных технологий, несмотря на хорошо разработанные исследовательские и математические алгоритмы, а также очевидную необходимость присутствия МРС при наблюдении за динамикой физиологически активных “продуктов”, сопровождающую формирование новых сетей в процессе обучения в томографе [5]. Принципиальной представляется возможность, используя МРС, локализовать нейротрансмиттеры, определяющие работоспособность НСС. Речь идет как о месте ГАМК в организации контура, реализующего параметры кровотока в регионах интереса, так и об исследуемых изменениях метаболитов, прямо или косвенно связанных с механизмами нейропластичности – конкретно на территории НСС в цепи ГАМК–глютаматергические нейроны–астроциты–сосудистый компонент, ответственный за локальную гемодинамику [9].
И еще о не менее важном: в физиологической науке полисистемный и многофункциональный подход к любым проблемам был постоянным императивом. Физиология как главная наука о жизни всегда нарушала территории, как будто предназначенные и “отведенные” ей, заимствуя при этом новейшие технологии и экспериментальный инструментарий для проникновения вглубь явлений, определявших затем формирование нового функционального аппарата или совершенствуя уже предсуществующий. Сила “привычки” часто уводила нашу область интересов от новых идей, несвойственных установленному “порядку” и новых экспериментальных решений. Предлагаемый обзор – одна из попыток напомнить, что то время безвозвратно ушло, физиология восстанавливает свою заметную роль концентратора новейших сведений о живом и способах превращения этих сведений в инструмент познания человеческой сущности во всех ее проявлениях.
При поддержке гранта РНФ № 21-15-00209.
Список литературы
Коростышевская А.М. Диагностические возможности магнитно-резонансной спектроскопии (обзор перспективных направлений) // Медицинская визуализация. 2007. № 3. С. 130–143.
Лисачев П.Д., Мельников М.Е., Штарк М.Б. Генетические аспекты фМРТ исследований головного мозга // Успехи физиол. наук. 2020. Т. 51. С. 58–71. https://doi.org/10.31857/S0301179820010075
Мельников М.Е., Штарк М.Б. Нейровизуализационные исследования идентичности // Успехи физиологических наук. 2015. Т. 46. № 4. С. 15–27.
Мельников М.Е., Штарк М.Б. Функциональная магнитнорезонансная томография и динамическая нейроанатомия аддиктивных расстройств // Успехи физиол. наук. 2014. Т. 45. № 4. С. 51–69.
Мельников М.Е., Штарк М.Б., Савелов А.А., Брюль А. Биоуправление по сигналу фМРТ, регистрируемому в реальном времени: новое поколение нейротерапии // Журн. высш. нервн. деят. 2017. Т. 67. № 1. С. 1–30.
Рогожникова О.С., Ивашкина О.И., Торопова К.А., Солотёнков М.А., Федотов И.В., Анохин К.В. Исследование активности нейронов ретросплениальной коры методом оптоволоконной фотометрии при обследовании нового пространства и объектов у мышей // В сб. Оптогенетика. 2020. II Всерос. Науч. Конф. с междунар. участием и Школа по современным методам неинвазивного контроля нейрональной активности / Сборник научных трудов. Санкт-Петербург. 2020. С. 47–48.
Соколова О.О., Штарк М.Б., Лисачев П.Д. Нейрональная пластичность и экспрессия генов // Успехи физиол. наук. 2010. Т. 41. № 1. С. 26–44.
Тоноян А.С. Диффузионно-куртозисная магнитно-резонансная томография: новый метод характеристики структурной организации мозгового вещества (предварительные результаты у здоровых добровольцев) // Радиология – Практика. 2015. Т. 1. № 49. С. 57–67.
Штарк М.Б., Коростышевская А.М., Резакова М.В., Савелов А.А. Функциональная магнитно-резонансная томография и нейронауки. Успехи физиол. наук. 2012. Т. 43. № 1. С. 3–29.
Ait-Belkacem R., Berenguer C., Villard C. et al. MALD Iimagingandin-sourcedecayfor top-down characterization of glioblastoma // Proteomics. 2014. № 14. P. 1290–1301.
Andrew J. Steven, Jiachen Zhuo, Elias R. Melhem Diffusion Kurtosis Imaging: An Emerging Technique for Evaluating the Microstructural Environment of the Brain // Neuroradiology/Head and Neck Imaging. 2013. P. 26–33. https://doi.org/10.2214/AJR.13.11365
Apšvalka D., Gadie A., Clemence M., Mullins P.G. Event-related dynamics of glutamate and BOLD effects measured using functional magnetic resonance spectroscopy (fMRS) at 3T in a repetition suppression paradigm // Neuroimage. 2015. № 118. P. 292–300.
Arab A., Wojna-Pelczar A., Khairnar A. et al. Principles of diffusion kurtosis imaging and its role in early diagnosis of neurodegenerative disorders // Brain Res. Bull. 2018. № 139. P. 91–98.
Asemi A., Ramaseshan K., Burgess A. et al. Dorsal anterior cingulate cortex modulates supplementary motor area in coordinated unimanual motor behavior // Front. Hum. Neurosci. 2015. № 9. P. 1–10.
Bastrup J., Larsen P.H. Optimized CLARITY technique detects reduced parvalbumin density in a genetic model of schizophrenia // J. Neurosci. Methods. 2017. № 283. P. 23–32.
Bednařík P. et al. Neurochemical and BOLD responses during neuronal activation measured in the human visual cortex at 7 Tesla // J. Cereb. Blood Flow Metab. 2015. № 35. P. 601–610.
Bell T. et al. In vivo Glx and Glu measurements from GABA-edited MRS at 3 T // NMR Biomed. 2021. № 34. P. 1–11.
Bell T., Stokoe M., Harris A.D. Macromolecule suppressed GABA levels show no relationship with age in a pediatric sample // Sci. Rep. 2021. № 11. P. 6–12.
Benitez A., Fieremans E., Jensen J.H. et al. White matter tract integrity metricsreflect the vulnerability of late-myelinating tracts in Alzheimer’s disease // Neuroimage Clin. 2014. № 4. P. 64–71.
Bhattacharyya P.K., Phillips M.D., Stone L.A. et al. Sensorimotor cortex gamma-aminobutyric acid concentration correlates with impaired performance in patients with MS // Am. J. Neuroradiol. 2013. № 34. P. 1733–1739.
Carlred L., Michno W., Kaya I. et al. Probing amyloid-beta pathology in transgenic Alzheimer’s disease (tgArcSwe) mice using MALDI imaging mass spectrometry // J Neurochem. 2016. № 138. P. 469–478.
Cerruti C.D., Benabdellah F., Laprevote O. et al. MALDI imaging and structural analysis of rat brain lipid negative ions with 9-aminoacridine matrix // Anal Chem. 2012. № 84. P. 2164–2171.
Chen X. et al. Regional GABA Concentrations Modulate Inter-network Resting-state Functional Connectivity // Cereb. Cortex. 2019. V. 29. № 11. P. 1607–1618. https://doi.org/10.1093/cercor/bhy059
Cheung J.S., Wang E., Lo E.H. et al. Stratification of heterogeneous diffusion MRI ischemic lesion with kurtosis imaging // Stroke. 2012. № 43. P. 2252–2254.
Cho W.H., Barcelon E., Lee S.J. Optogenetic glia manipulation: possibilities and future prospectsи // Exp. Neurobiol. 2016. № 25. P. 197–204.
Chung K., Deisseroth K. CLARITY for mapping the nervous sys-tem // Nat. Methods. 2013. № 10. P. 508–513.
Chung K., Wallace J., Kim S.Y. et al. Structural and molecular interro-gation of intact biological systems // Nature. 2013. P. 497: 332.
Deelchand D.K., Marjańska M., Henry P.G., Terpstra M. MEGA-PRESS of GABA+: Influences of acquisition parameters // NMR Biomed. 2021. № 34. P. e4199.
Denis Le Bihan How MRI Makes the Brain Visible // Electronic Supplementary Material. 2020. P. 201–212. https://doi.org/10.1007/978-981-13-7908-6_20
Denny C.A., Kheirbek M.A., Alba E.L. et al. Hippocampal memory traces are differentially modulated by expe-rience, time, and adult neurogenesis // Neuron. 2014. № 83. P. 189–201.
Di Giovanna A.P., Tibo A., Silvestri L. et al. Whole-brain vasculature reconstruction at the single capillary level // SciRep. 2018. № 8. P. 12573. https://doi.org/10.1038/s41598-018-30533-3
Dilillo M., Ait-Belkacem R., Esteve C. et al. Ultra-high mass resolution MALDIimagingmassspectrometry ofproteinsand metabolites in a mouse model of glioblastoma // Sci. Rep. 2017. № 7. P. 603.
Draper A. et al. Increased GABA contributes to enhanced control over motor excitability in tourette syndrome // Curr. Biol. 2014. № 24. P. 2343–2347.
Duncan N.W., Wiebking C., Northoff G. Associations of regional GABA and glutamate with intrinsic and extrinsic neural activity in humans-A review of multimodal imaging studies // Neuroscience and Biobehavioral Reviews. 2014. № 47. P. 36–52.
Duncan N.W., Zhang J., Northoff G., Weng X. Investigating GABA concentrations measured with macromolecule suppressed and unsuppressed MEGA-PRESS MR spectroscopy and their relationship with BOLD responses in the occipital cortex // J. Magn. Reson. Imaging. 2019. № 50. P. 1285–1294.
Falangola M.F., Jensen J.H., Babb J.S. et al. Age-related non-Gaussian diffusion patterns in the prefrontal brain // J. Magn. Reson. Imaging. 2008. № 28. P. 1345–1350.
Falangola M.F., Jensen J.H., Tabesh A. et al. Nongaussian diffusion MRI assessment of brain microstructure in mild cognitive impairment and Alzheimer’s disease // Magn. Reson. Imaging. 2013. № 31. P. 840–846.
Gong N.J., Wong C.S., Chan C.C. et al. Correlations between microstructural alterations and severity of cognitive deficiency in Alzheimer’s disease and mild cognitive impairment: a diffusional kurtosis imaging study // Magn. Reson. Imaging. 2013. № 31. P. 688–694.
Gu M. et al. GABA editing with macromolecule suppression using an improved MEGA-SPECIAL sequence // Magn. Reson. Med. 2018. № 79. P. 41–47.
Gussew A. et al. Time-resolved functional 1H MR spectroscopic detection of glutamate concentration changes in the brain during acute heat pain stimulation // Neuroimage. 2010. № 49. P. 1895–1902.
Hanrieder J., Ljungdahl A., Andersson M. MALDI imaging mass spectrometry of neuropeptides in Parkinson’s disease // J. Visualized Experiments 2012. https://doi.org/10.3791/3445
Hansen B., Lund T.E., Sangill R., Jespersen S.N. Experimentally and computationally fast method for estimation of a mean kurtosis // Magn. Reson. Med. 2013. № 69. P. 1754–1760.
Harris A.D. et al. Multi-regional investigation of the relationship between functional MRI blood oxygenation level dependent (BOLD) activation and GABA concentration // PLoS One. 2015. № 10. P. 1–17.
Harris A.D., Puts N.A.J., Barker P.B., Edden R.A.E. Spectral-editing measurements of GABA in the human brain with and without macromolecule suppression // Magn. Reson. Med. 2015. № 74. P. 1523–1529.
Harris A.D., Saleh M.G., Edden R.A.E. Edited 1H magnetic resonance spectroscopy in vivo: Methods and metabolites // Magn. Reson. Med. 2017. № 77. P. 1377–1389.
Hou J., Wang W., Quan X., Liang W. et al. Quantitative visualization of dynamic tracer transportation in the extracellular space of deep brain regions using tracer-based magnet-ic resonance imaging // Med. Sci. Monit. 2017. № 23. P. 4260–4268.
Hui E.S., Fieremans E., Jensen J.H. et al. Stroke assessment with diffusional kurtosis imaging // Stroke. 2012. № 43. P. 2968–2973.
J Vis Exp. Hong J.H., Kang J.W., Kim D.K. et al. Global changes of phospholipids identified byMALDI imaging mass spectrometry in a mouse model of Alzheimer’s disease // J. Lipid. Res. 2016. № 57. P. 36–45.
Jensen J.H., Helpern J.A., Ramani A. et al. Diffusional kurtosis imaging: the quantification of non-Gaussian water diffusion by means of magnetic resonance imaging // Magn. Reson. Med. 2005. № 53. P. 1432–1440.
Jensen K.H.R., Berg R.W. Advancesand perspectivesintissueclear-ing using CLARITY // J. Chem. Neuroanat. 2017. № 86. P. 19–34.
Kaya I., Zetterberg H., Blennow K., Hanrieder J. Shedding light on the molecular pathology of amyloid plaques in transgenic Alzheimer’s disease mice using multimodal MALDI imaging mass spectrometry // ACS Chem. Neurosci. 2018. № 9. P. 1802–1817.
Kiemes A. et al. GABA, Glutamate and Neural Activity: A Systematic Review With Meta-Analysis of Multimodal 1H-MRS-fMRI Studies // Frontiers in Psychiatry. 2021. № 12. P. 644315.
Lagerweij T., Dusoswa S.A., Negrean A. et al. Optical clearing and fluorescence deep-tissue imaging for 3D quantitative analysis of the brain tumor mi-croenvironment // Angiogenesis. 2017. № 20. P. 533–546.
Lauterbur P.C. Image Formation by Induced Local Interactions: Examples Employing Nuclear Magnetic Resonance // Nature. 1973. № 242. P. 190–191. https://doi.org/10.1038/242190a0
Lazar M., Jensen J.H., Xuan L., Helpern J.A. Estimation of the orientation distribution function from diffusional kurtosis imaging // Magn. Reson. Med. 2008. № 60. P. 774–781.
Lee C.Y., Bennett K.M., Debbins J.P. Sensitivities of statistical distribution model and diffusion kurtosis model in varying microstructural environments: a Monte Carlo study // J. Magn. Reson. 2013. № 230. P. 19–26.
Le Bihan D. Apparent diffusion coefficient and beyond: what diffusion MR imaging can tell us about tissue structure // Radiology. 2013. № 268. P. 318–322.
Lei Y., Han H., Yuan F., Javeed A., Zhao Y. The brain interstitial system: anatomy, modeling, in vivo measurement, and applications // Prog. Neurobiol. 2017. № 157. P. 230–246.
Levar N., Van Leeuwen J.M.C., Puts N.A.J. et al. GABA concentrations in the anterior cingulate cortex are associated with fear network function and fear recovery in humans // Front. Hum. Neurosci. 2017. № 11. P. 1–13.
Li K., Han H., Zhu K. et al. Real-time magnetic resonance imaging visualization and quantitative assess-ment of diffusion in the cerebral extracellular space of C6 glioma-bearing rats // Neurosci. Lett. 2013. № 543. P. 84–89.
Liu H.H., Zhou Y.M., Wang J.Y. et al. N-Phenyl-2-naphthylamine as a novel MALDI matrix for analysis and in situ imaging of small molecules // Anal. Chem. 2018. № 90. P. 729–736.
Liu R.Z., Fan C.X., Zhang Z.L. et al. Effects of Dl-3-n-butylphthalide on cerebral ischemia infarc-tion in rat model by mass spectrometry imaging // Int. J. Mol. Sci. 2017. № 18.
Liu X., Madhankumar A.B., Miller P.A. et al. MRI contrast agent for targeting glioma: interleukin-13 labeled liposome encapsulating gadolinium-DTPA // Neuro-Oncology. 2016. № 18. P. 691–699.
Llombart V., Trejo S.A., Bronsoms S. et al. Profiling and identification of new proteins involved in brain ischemia using MALDI-imaging-mass-spectrom-etry // J. Proteome. 2017. № 152. P. 243–253.
Lohr K.M., Masoud S.T., Salahpour A., Miller G.W. Membranetrans-porters as mediators of synaptic dopamine dynamics: implications for disease // Eur. J. Neurosci. 2017. № 45. P. 20–33.
Melnikov M.Ye. The Current Evidence Levels for Biofeedback and Neurofeedback Interventions in Treating Depression: A Narrative Review // Hindawi Neural Plasticity Volume 2021, Article ID 8878857. P. 1–31. https://doi.org/10.1155/2021/8878857
Spampinato M.V., Chan C., Jensen J.H. et al. Diffusional Kurtosis Imaging and Motor Outcome in Acute Ischemic Stroke // American J. Neuroradiology. 2017. V. 38. № 7. P. 1328–1334.
Maria Y.L. et al. Simultaneous quantification of GABA, Glx and GSH in the neonatal human brain using magnetic resonance spectroscopy // Neuroimage. 2021. № 233. P. 117930.
Marsman A., Emir U., Rowland L.M. et al. Functional Magnetic Resonance Spectroscopy: The ‘New’ MRS for Cognitive // Neuroscience and Psychiatry Research. 2018. № 9. P. 1.
Menegas W., Bergan J.F., Ogawa S.K. et al. Dopamine neurons projecting to the posterior striatum form an anatomically distinct subclass // Elife. 2015. № 4.
Mescher M., Merkle H., Kirsch J. et al. Simultaneous in vivo spectral editing and water suppression // NMR Biomed. 1998. № 11. P. 266–272.
Mikkelsen M., Harris A.D., Edden R.A.E., Puts N.A.J. Macromolecule-suppressed GABA measurements correlate more strongly with behavior than macromolecule-contaminated GABA+ measurements // Brain Res. 2018. № 1701. P. 204–211.
Mikkelsen M., Singh K.D., Sumner P., Evans C.J. Comparison of the repeatability of GABA-edited magnetic resonance spectroscopy with and without macromolecule suppression // Magn. Reson. Med. 2016. P. 946–953.
Moriah E. Thomason Development of Brain Networks In Utero: Relevance for Common Neural Disorders // Human Prenatal Brain Network Development. 2020. № 88. P. 40–50. https://doi.org/10.1016/j.biopsych.2020.02.007
Mullins P.G. Towards a theory of functional magnetic resonance spectroscopy (fMRS): A meta-analysis and discussion of using MRS to measure changes in neurotransmitters in real time // Scand. J. Psychol. 2018. № 59. P. 91–103. https://doi.org/10.1111/sjop.12411
Mullins P.G., Rowland L.M., Jung R.E., Sibbitt W.L. A novel technique to study the brain’s response to pain: Proton magnetic resonance spectroscopy // Neuroimage. 2005. № 26. P. 642–646.
Munyeza C.F., Shobo A., Baijnath S. et al. Rapid and widespread distribution of doxycycline in rat brain: a mass spectrometric imaging study // Xenobiotica. 2016. № 46. P. 385–392.
Northoff G. et al. GABA concentrations in the human anterior cingulate cortex predict negative BOLD responses in fMRI // Nat. Neurosci. 2007. № 10. P. 1515–1517.
Nucifora P.G., Verma R., Lee S.K., Melhem E.R. Diffusion-tensor MR imaging and tractography: exploring brain microstructure and connectivity // Radiology. 2007. № 245. P. 367–384.
Oakley H., Cole S.L., Logan S. et al. Intraneuronal beta-amyloid aggregates, neurodegenera-tion, and neuron loss in transgenic mice with five familial Alzheimer’s disease mutations: potential factors in amyloid plaque formation // J. Neurosci. 2006. № 26. P. 10129–10140.
Oeltzschner G. et al. Hadamard editing of glutathione and macromolecule-suppressed GABA // NMR Biomed. 2018. № 31. P. 1–8.
Paz J.T., Davidson T.J., Frechette E.S. et al. Closed-loop optogenetic con-trol of thalamus as a tool for interrupting seizures after cortical inju-ry // Nat. Neurosci. 2013. № 16. P. 64–70.
Perusini J.N., Cajigas S.A., Cohensedgh O. et al. Optogenetic stimulation of dentate gyrus engrams restores memory in Alzheimer’s disease mice // Hippocampus. 2017. № 27. P. 1110–1122.
Phillips J., Laude A., Lightowlers R. et al. Development of passive CLARITY and immunoflu-orescent labelling of multiple proteins inhuman cerebellum: under-standing mechanisms of neurodegeneration in mitochondrial dis-ease // Sci. Rep. 2016. № 6.
Qing H. Neural changes in Alzheimer’s disease from circuit to molecule: perspective of optogenetics // Neurosci Biobehav Rev. 2017. № 79. P. 110–118.
Ren R., Shi C., Cao J. et al. Neuroprotective effects of a standardized flavonoid extract of saf-flower against neurotoxin-induced cellular and animal models of Parkinson’s disease // Sci. Rep. 2016. № 6. P. 22135.
Rothman D.L., Behar K.L., Hyder F., Shulman R.G. In vivo NMR Studies of the Glutamate Neurotransmitter Flux and Neuroenergetics: Implications for Brain Function // Annual Review of Physiology. 2003. № 65. P. 401–427.
Roy D.S., Arons A., Mitchell T.I. et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer’s disease // Nature. 2016. № 531. P. 508–512.
Schaller B., Mekle R., Xin L. et al. Net increase of lactate and glutamate concentration in activated human visual cortex detected with magnetic resonance spectroscopy at 7 tesla // J. Neurosci. Res. 2013. № 91. P. 1076–1083.
Schaller B., Xin L., O’Brien K. et al. Are glutamate and lactate increases ubiquitous to physiological activation? A 1H functional MR spectroscopy study during motor activation in human brain at 7Tesla // Neuroimage. 2014. № 93. P. 138–145.
Seeger-Armbruster S., Bosch-Bouju C., Little S.T. et al. Patterned, but not tonic, optogenetic stimulation in motor thalamus improves reaching in acute drug-induced Parkinsonian rats // J. Neurosci. 2015. № 35. P. 1211–1216.
Shi C., Lei Y., Han H. et al. Transportation in the interstitial space of the brain can be regulated by neuronal excitation // Sci. Rep. 2015. № 5. P. 17673.
Song G., Luo T., Dong L., Liu Q. Extracellular diffusion quantified by magnetic resonance imaging during rat C6 glioma cell progres-sion // Braz. J. Med. Biol. Res. 2017. № 50. P. e5403.
Stan A.D. et al. Glutamate and GABA contributions to medial prefrontal cortical activity to emotion: Implications for mood disorders // Psychiatry Res. – Neuroimaging. 2014. № 223. P. 253–260.
Stanley J.A., Raz N. Functional magnetic resonance spectroscopy: The ‘new’ MRS for cognitive neuroscience and psychiatry research // Frontiers in Psychiatry. 2018. № 9. P. 1.
Andrew J. Steven, Jiachen Zhuo, Elias R. Melhem Diffusion Kurtosis Imaging: An Emerging Technique for Evaluating the Microstructural Environment of the Brain / 2014. https://doi.org/10.2214/A JR.13.11365
Sui P., Watanabe H., Artemenko K. et al. Neuropeptide imaging in rat spinal cord with MALDI-TOF MS: method development for the application in pain-related disease studies // European J. Mass Spectrometry. 2017. № 23. P. 105–115.
Szczepankiewicz F., Lдtt J., Wirestam R. et al. Variability in diffusion kurtosis imaging: impact on study design, statistical power and interpretation // Neuroimage. 2013. № 76. P. 145–154.
Tabesh A., Jensen J.H., Ardekani B.A., Helpern J.A. Estimation of tensors and tensor-derived measures in diffusional kurtosis imaging // Magn. Reson. Med. 2011. № 65. P. 823–836.
Tatti R., Haley M.S., Swanson O.K. et al. Neurophysiology and Regulation of the Balance Between Excitation and Inhibition in Neocortical Circuits // Biological. Psychiatry. 2017. № 81. P. 821–831.
Taylor R. et al. Increased glutamate levels observed upon functional activation in the anterior cingulate cortex using the Stroop Task and functional spectroscopy // Neuroreport. 2015. № 26. P. 107–112.
Ter-Pogossian M.M., Phelps M.E., Hoffman E.J. et al. A positron-emission transaxial tomograph for nuclear imaging (PETT) // Radiology. 1975. № 114. P. 89.
Tomer R., Ye L., Hsueh B., Deisseroth K. Advanced CLARITY for rapid and high-resolution imaging of intact tissues // Nat. Protoc. 2014. № 9. P. 1682–1697.
Touboul D., Brunelle A., Laprevote O. Massspectrometry imaging: towards a lipid microscope? // Biochimie. 2011. № 93. P. 113–119.
Towner R.A., Smith N., Doblas S. et al. In vivo detection of c-Met expression in a rat C6 glioma model // J. Cell. Mol. Med. 2008. № 12. P. 174–186.
Tu M.C., Huang S.M., Hsu Y.H. et al. Discriminating subcortical ischemic vascular disease and Alzheimer’s disease by diffusion kurtosis imaging in segregated thalamic regions // Hum. Brain Mapp. 2021. № 42. P. 2018–2031.
Tuch D.S., Reese T.G., Wiegell M.R., Wedeen V.J. Diffusion MR of complex neural architecture // Neuron. 2003. № 40. P. 885–895.
Tuch D.S. Q-ball imaging // Magn. Reson. Med. 2004. № 52. P. 1358–1372.
Vegvari A. Drug localizations in tissue by mass spectrometry im-aging // Biomark Med. 2015. № 9. P. 869–876.
Violante I.R. et al. GABA deficit in the visual cortex of patients with neurofibromatosis type 1: Genotype-phenotype correlations and functional impact // Brain. 2013. № 136. P. 918–925.
Wan P., Zhu J., Xu J., Li Y. et al. Evaluationofseven optical clearing methods in mouse brain // Neurophotonics. 2018. № 5. P. 035007.
Wang J.J., Lin W.Y., Lu C.S. et al. Parkinson disease: diagnostic utility of diffusion kurtosis imaging // Radiology. 2011. № 261. P. 210–217.
Wang J.S.H., Freitas-Andrade M., Bechberger J.F. et al. Matrix-assisted laser desorption/ionization imaging mass spectrometry of intraperitoneally injected danegaptide (ZP1609) for treatment of stroke-reperfusion injury in mice // Rapid Commun Mass Spectrom. 2018. № 32. P. 951–958.
Wedeen V.J., Wang R.P., Schmahmann J.D. et al. Diffusion spectrum magnetic resonance imaging (DSI) tractography of crossing fibers // Neuroimage. 2008. № 41. P. 1267–1277.
Willard A.M., Gittis A.H. DOPAMINE SYSTEM mapping neural circuits with CLARITY // Elife. 2015. № 4. P. 11409.
Wu E.X., Cheung M.M. MR diffusion kurtosis imaging for neural tissue characterization // NMR Biomed. 2010. № 23. P. 836–848.
Yakovlev A. et al. The Effect of Visual Stimulation on GABA and Macromolecule Levels in the Human Brain in vivo // Biophys. (Russian Fed). 2020. № 65. P. 51–57.
Yan X., Zhou M., Ying L. et al. Evaluation of optimized b-value sampling schemas for diffusion kurtosis imaging with an application to stroke patient data // Comput. Med. Imaging. Graph. 2013. № 37. P. 272–280.
Yang B., Treweek J.B., Kulkarni R.P. et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing // Cell. 2014. № 158. P. 945–958.
Yang Q., Song D., Yan X., Zhou M. et al. Evaluation of optimized b-value sampling schemas for diffusion kurtosis imaging with an application to stroke patient data // Comput. Med. Imaging. Graph. 2013. № 37. P. 272–280.
Yano K., Takimoto S., Motegi T. et al. Role of P-glycoprotein in regulating cilnidipine distribution to intact and is-chemic brain // Drug. Metab. Pharmacokinet. 2014. № 29. P. 254–258.
Yarnykh, V.L., Prihod’ko, I.Y., Savelov, A.A., Korostyshevskaya, A.M. // Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping. American Journal of Neuroradiology. 2018. 39(7), 1341–1348.
Yoshida M., Hori M., Yokoyama K. et al. Diffusional kurtosis imaging of normal-appearing white matter in multiple sclerosis: preliminary clinical experience // Jpn. J. Radiol. 2013. № 31. P. 50–55.
Zhang L.Y., Lin P., Pan J.J. et al. CLARITY for high-resolution imaging and quantification of vasculature in the whole mouse brain // Aging Dis. 2018. № 9. P. 262–272.
Zhuo J., Xu S., Proctor J.L. et al. Diffusion kurtosis as an in vivo imaging marker for reactive astrogliosis in traumatic brain injury // Neuroimage. 2012. № 59. P. 467–477.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук