Успехи физиологических наук, 2022, T. 53, № 1, стр. 16-27
Сиртуины и старение
А. Э. Пухальская a, И. М. Кветной b, c, Н. С. Линькова a, d, e, *, А. С. Дятлова a, Е. О. Гутоп a, К. Л. Козлов a, М. А. Пальцев f
a Отдел биогеронтологии АНО ВО НИЦ “Санкт-Петербургский институт биорегуляции и геронтологии”
197110 Санкт-Петербург, Россия
b Кафедра патологии Санкт-Петербургского государственного университета
199034 Санкт-Петербург, Россия
c Центр молекулярной биомедицины ФГБУ “Санкт-Петербургский научно-исследовательский
институт фтизиопульмонологии” МЗ РФ
191036 Санкт-Петербург, Россия
d Кафедра терапии, гериатрии и антивозрастной медицины Академии постдипломного образования
ФГБУ ФНКЦ ФМБА России
125371 Москва, Россия
e Кафедра медико-биологических дисциплин, ФГАОУ ВО “Белгородский национальный исследовательский государственный университет”
308015 Санкт-Петербург, Россия
f Центр иммунологии и молекулярной биомедицины, ФГБОУ ВПО “Московский государственный университет
им. М.В. Ломоносова”
119991 Москва, Россия
* E-mail: miayy@yandex.ru
Поступила в редакцию 20.06.2021
После доработки 02.07.2021
Принята к публикации 30.08.2021
- EDN: KUNLXB
- DOI: 10.31857/S0301179821040056
Аннотация
Белки семейства сиртуинов (SIRT) участвуют в репарации ДНК, ремоделировании хроматина, эпигенетической регуляции экспрессии генов метаболизма, антиоксидантной системы, апоптоза, иммуно- и нейрогенеза и др. Цель обзора – анализ геропротекторых свойств сиртуинов в норме и при ассоциированной с возрастом патологии. SIRT1,2,3,4,6 способствуют увеличению продолжительности жизни. SIRT1,2,6,7 замедляют клеточное старение и поддерживают пул стволовых клеток. Сиртуины являются потенциальными мишенями для терапии нейродегенеративных, онкологических, сердечно-сосудистых заболеваний, метаболического синдрома и сахарного диабета. Все эти заболевания в большинстве случаев характерны для лиц пожилого и старческого возраста, поэтому геропротекторные эффекты сиртуинов, реализуемые на молекулярном и клеточном уровнях, могут играть важную роль в их терапии.
ВВЕДЕНИЕ
Сиртуины (sirtuins, SIRT) – семейство НАД-зависимых гистоновых деацетилаз, регулирующих функции клеток и различных метаболических путей в норме, при старении и возраст-ассоциированной патологии [17]. Сиртуины относят к III классу гистоновых деацетилаз. Основным отличием сиртуинов от других классов этих белков является необходимость наличия никотинамидадениндинуклеотида (НАД+) в качестве кофактора для протекания реакции.
Филогенетический анализ делит 7 сиртуинов млекопитающих (SIRT1–7) на 4 класса: SIRT1–3 относятся к классу I, SIRT4 – к классу II, SIRT5 – к классу III, SIRT6–7 – к классу IV [24]. Кроме того, сиртуины млекопитающих также можно разделить на категории в соответствии с их субклеточной локализацией: SIRT1,6,7 локализованы в ядре, SIRT3,4,5 – в митохондриях, SIRT2 – преимущественно в цитоплазме [34]. Разница в субклеточной локализации, различия в паттернах экспрессии и многообразие субстратов определяют широкий спектр биологических функций сиртуинов.
Первоначально сиртуины были описаны как гистоновые деацетилазы у дрожжей Saccharomyces cerevisiae [38, 43]. Помимо функции деацетилирования гистонов, сиртуины также осуществляют деацетилирование лизина у большого диапазона негистоновых клеточных белков, регулируя их активность. Спектр функций сиртуинов расширялся с момента их открытия; имеются данные о роли сиртуинов в осуществлении посттрансляционных модификаций [71]. SIRT3,4,5,6 могут функционировать как АДФ-рибозилтрансферазы [29, 56, 90], а SIRT5 способен к десукцинилированию и демалонилированию [19, 76].
Помимо доступности НАД+ и субклеточной локализации, существует несколько дополнительных механизмов регуляции, которые вносят вклад в активность сиртуинов. Таким образом, существует возможность активации различных сиртуинов с последующей стимуляцией разнообразных субстратов. К дополнительным механизмам регуляции функций сиртуинов относят факторы транскрипции, микроРНК, посттрансляционные модификации, белок-белковые взаимодействия и регуляцию с помощью “малых молекул”, например, коротких пептидов [34, 48, 101]. При помощи таких регуляторных механизмов стимулы окружающей среды, например, ограничение калорийности питания, контролируют экспрессию и/или активность сиртуинов. Поэтому сиртуины считаются чувствительными к стрессу ферментами, которые регулируют адаптацию клеток к изменению гомеостаза, модулируя профиль ацетилирования белков. Установлено, что сиртуины регулируют продолжительность жизни различных видов организмов, включая дрожжи, нематод, дрозофил [12, 28] и млекопитающих [40].
Большое количество исследований сиртуинов посвящено их роли в старении и развитии ассоциированных с возрастом заболеваний. Многообразие белков, активность которых может изменяться посредством ацетилирования лизина, дает основание полагать, что сиртуины являются основными регуляторами жизнедеятельности клеток: экспрессии генов, метаболизма, активности теломеразы, клеточного цикла, дифференцировки, апоптоза, пролиферации, репарации ДНК, клеточного старения и реакции на окислительный стресс [70].
Цель обзора – анализ геропротекторых свойств белков семейства сиртуинов в норме и при ассоциированной с возрастом патологии.
ГЕРОПРОТЕКТОРНЫЕ СВОЙСТВА СИРТУИНА 1
Упоминания о сиртуинах как о регуляторах клеточного старения появились в 1997 г. при обнаружении их в дрожжах Saccharomyces cerevisiae: у дрожжей с избыточной экспрессией гена sir2 наблюдалось повышенное число делений по сравнению с контрольным штаммом [38, 43]. Далее было показано, что белок, кодируемый у дрожжей геном sir2, регулирует экспрессию генов посредством эпигенетических механизмов, а также участвует в репарации ДНК. У животных и человека белком, гомологичным дрожжевому Sir2, является SIRT1. Последующие исследования показали, что повышенная экспрессия гена Sirt1 также повышает продолжительность жизни Caenorhabditis elegans, мух и нематод. Сверхэкспрессия гомологов SIRT1 у мышей может способствовать увеличению продолжительности жизни [79].
Экспрессия SIRT1 снижается с возрастом в печени, сердце, почках, головном мозге и легких человека [1, 2, 8, 15, 41]. Установлено, что синтез SIRT1 в эндотелии и гладкомышечных клетках при старении снижается [16, 19, 46]. Применение активатора SIRT1, ресвератрола, ингибировало апоптоз и способствовало выживаемости клеток миобластов линии C2C12 [33]. Повышенная экспрессия SIRT1, по-видимому, играет важную роль в замедлении процесса старения клеток пульпозного ядра, способствуя их пролиферации и снижению апоптоза [27].
Гиперэкспрессия SIRT1 в головном мозге мышей коррелирует с увеличением продолжительности жизни [79]. Активация SIRT1 замедляет ускоренное старение дермальных фибробластов человека, вызванное ультрафиолетовым излучением [54].
Одной из ключевых мишеней SIRT1, задействованной в процессах клеточного старения, является транскрипционный фактор p53 [14]. Известно, что при стрессе и воспалении из-за повреждений ДНК, гипоксии и образования активных форм кислорода (АФК) происходит ацетилирование p53 в ядре, что приводит к его стабилизации и увеличению ДНК-связывающей активности. Это ведет к увеличению транскрипции генов, участвующих в проапоптотических каскадах. Протекторная роль SIRT1 заключается во взаимодействии с белком p53 через деацетилирование 382-го остатка лизина на C-конце белка [91]. НАД+ играет роль кофактора и связывается с тетрамерами p53, изменяя его конформацию и предотвращая связывание с ДНК. Это снижает p53-опосредованную транскрипционную активность и экспрессию проапоптотических белков, таких как ингибитор клеточного цикла p21. Таким образом, SIRT1 может ингибировать p53-зависимую остановку клеточного цикла и апоптоз, усиливая репарацию ДНК, способствуя поддержанию целостности генома и выживаемости клеток.
Помимо p53, транскрипционным фактором, участвующим в регуляции процессов клеточного старения и апоптоза является белок NF-kB. Активация NF-kB наблюдается при многих патологических процессах, таких как диабет, болезнь Альцгеймера (БА) и болезнь Паркинсона (БП). Продолжительная активация NF-kB не только связана с клеточным старением, но и ускоряет его [105]. SIRT1 является негативным регулятором сигнального пути NF-kB [21], деацетилируя 310-й остаток лизина белка p65 – субъединицы NF-kB. Ацетилирование p65 увеличивает транскрипционную активность комплекса NF-κB, а SIRT1 – опосредованное деацетилирование, и подавляет сигналинг NF-κB [100]. SIRT1 обладает антиатеросклеротическим действием, ингибируя сигналинг NF-κB в эндотелии сосудов [16]. Показано, что дефицит SIRT1 у мышей в остеобластах и остеокластах активирует NF-κB за счет увеличения ацетилирования p65 по 310-му лизину, что приводит к снижению костной массы и ускоряет старение костей [21].
Следующим путем, в регуляцию которого вовлечен SIRT1, является сигнальный путь AMPK. AMPK – высококонсервативная серин/треониновая протеинкиназа, регулирующая энергетический метаболизм и выживаемость клеток [36]. Активация AMPK способствует увеличению продолжительности жизни C. elegans на 13% [11]. SIRT1 и AMPK могут взаимно усиливать активность друг друга [85]. AMPK усиливает активность SIRT1 посредством увеличения клеточного уровня НАД+ в результате деацетилирования PGC1α, нижестоящей мишени SIRT1 [106]. Кроме того, активация AMPK замедляет старение клеток, индуцируя аутофагию [22].
Установлено, что клеточное старение тесно связано с дисфункцией митохондрий [92]. Митохондриальная дисфункция способствует синтезу АФК и усугубляет прогрессирующий с возрастом окислительный стресс [78]. PGC1α – основной транскрипционный коактиватор в регуляции митохондриальных функций и поддержании гомеостаза клетки. SIRT1 деацетилирует PGC1α и, таким образом, участвует в регуляции функции митохондрий, повышая митохондриальный биогенез [47]. Активация SIRT1 предотвращает старение эндотелия за счет деацетилирования PGC-1α и PPARα, что приводит к подавлению продукции АФК, опосредованной НАДФН-оксидазой, и инактивации оксида азота [102].
mTOR – еще один ключевой регулятор процессов старения организма. Подавление активности mTOR увеличивает продолжительность жизни у различных организмов [6, 18, 95]. SIRT1 и mTOR участвуют в регуляции старения посредством регуляции аутофагии. При окислительном стрессе происходит нарушение процессов аутофагии, а SIRT1 восстанавливает их до нормального уровня и улучшает выживаемость эмбриональных стволовых клеток за счет блокирования пути mTOR [72]. Кроме того, ингибирование SIRT1 активирует сигналинг mTOR, что ведет к нарушениям аутофагии. Показано, что SIRT1 взаимодействует с белком TSC2, который является вышестоящим ингибитором TORC1 и негативно регулирует сигналинг mTOR TSC2-зависимым способом [26]. Подавление SIRT1 увеличивает ацетилирование TSC2 в его N-концевом домене, что сопровождается повышением его статуса белка убиквитинирования и приводит к активации mTORC1 [25].
Факторы транспозиции FOXO представляют семейство белков, которые функционируют как сенсоры в сигнальном пути инсулина. FOXO участвуют в различных физиологических и патологических процессах, включая окислительный стресс, репарацию ДНК, аутофагию, остановку клеточного цикла. Семейство FOXO состоит из FOXO1, FOXO3, FOXO4 и FOXO6 у млекопитающих [4]. На транскрипционную активность FOXO влияют посттрансляционные модификации, такие как фосфорилирование и ацетилирование [60]. FOXO1, FOXO3, FOXO4 ацетилируются ацетилтрансферазой CBP/p300 в ответ на клеточный стресс. SIRT1 регулирует функции белков FOXO путем деацитилирования, предотвращая окислительный стресс и старение [67].
Таким образом, геропротекторное действие SIRT1 реализуется через регуляцию сигнальных путей р53, NF-kB, mTOR, PGC1α, FOXO (рис. 1). Указанные механизмы регуляции с участием SIRT1 способствуют замедлению старения на уровне клеток, органов и тканей. Это выражается в замедлении темпов старения головного мозга, сердца, печени, легких, кожи, гладкомышечной ткани, эндотелия сосудов и повышении продолжительности жизни.
ГЕРОПРОТЕКТОРНЫЕ СВОЙСТВА СИРТУИНА 2
SIRT2 экспрессирутся в большом количестве структур центральной нервной системы (ЦНС), включая гиппокамп, стриатум, кору головного мозга и спинной мозг. Показано, что изоформа SIRT2.3 накапливается в ЦНС мышей при старении [9]. Установлено, что субстратами SIRT2 являются более 40 белков, задействованных в разнообразных внутриклеточных сигнальных путях, регулирующих канцерогенез, окислительно-восстановительный баланс, пролиферацию и дифференцировку клеток [93].
SIRT2 замедляет старение гемопоэтических стволовых клеток (ГСК). С возрастом ГСК становятся более чувствительными к митохондриальному стрессу, и в них наблюдается повышенная активация основного компонента инфламмосом NLRP3. Вероятно, это происходит из-за подавления экспрессии SIRT2. Сверхэкспрессия SIRT2 может ингибировать активацию NLRP3 и замедлять старение ГСК [59]. Экспрессия SIRT2 снижается при старении ооцитов крупного рогатого скота. Обработка ооцитов ингибитором SIRT2 приводила к высокому уровню окислительного стресса, аномальному распределению митохондрий и низкой продукция АТФ. Старение ооцитов сопровождалось апоптозом, а ингибирование SIRT2 увеличивало интенсивность апоптоза ооцитов при старении. Таким образом, инактивация SIRT2 является ключевым механизмом, лежащим в основе клеточного старения ооцитов [96].
У мышей, гипоморфных по гену протеинкиназы митотической контрольной точки, BubR1, продолжительность жизни ниже, чем у животных со сверхэкспрессией этого гена. По мере старения мышей дикого типа синтез белка BubR1 снижается во многих тканях. Предполагается, что этот процесс лежит в основе нормального старения и ассоциированных с возрастом заболеваний. Показано, что снижение уровня белка BubR1 в различных органах и тканях с возрастом происходит из-за уменьшения уровня НАД+ и способности SIRT2 поддерживать лизин K668 в белке BubR1 в деацетилированном состоянии. Сверхэкспрессия SIRT2 повышает количество белка BubR1 in vivo и среднюю продолжительность жизни у самцов мышей [69].
SIRT2 может предотвращать дегенерацию межпозвоночных дисков, связанную со старением клеток пульпозного ядра. Установлено, что IL-1β способствовал увеличению степени дегенерации клеток межпозвоночного диска и снижению в них экспрессии гена Sirt2. При этом гиперэкспрессия Sirt2 может отменять эффекты IL-1β, приводя к увеличению экспрессии гена антиоксидантного фермента супероксиддисмутазы (СОД) и снижая уровень окислительного стресса. Кроме того, сверхэкспрессия Sirt2 ингибирует путь p53/p21, предотвращая клеточное старение и деградацию клеток пульпозного ядра [99]. Взаимодействие SIRT2 с маркером клеточного старения p53 подтверждается результатами иммунопреципитации хроматина, которая выявила присутствие сайтов связывания p53 на промоторе SIRT2 [5].
Таким образом, геропротекторные эффекты SIRT2 связаны с его способностью регулировать сигнальные каскады с участием NLRP3, BubR1, IL-1β, p53/p21. В результате SIRT2 замедляет старение стволовых клеток, оказывает антиоксидантное, противовоспалительное и нейропротекторное действие, повышая продолжительность жизни животных.
ГЕРОПРОТЕКТОРНЫЕ СВОЙСТВА СИРТУИНА 3
SIRT3 главным образом локализован в клетках тканей с высокой метаболической активностью и рассматривается в качестве регулятора митохондриального метаболизма [68]. Уровень SIRT3 на 40% снижается в клетках различных органов и тканей у пожилых людей, ведущих малоподвижный образ жизни, но его синтез может быть активирован ограничением калорийности питания [52].
У мышей с нокаутом гена Sirt3 наблюдались гипертрофия и фиброз миокарда, снижение продолжительности жизни [7]. Вероятно, это происходит потому, что одной из мишеней SIRT3 является белок FOXO3, деацетилирование и активация которого приводят к увеличению транскрипции антиоксидантных генов, СОД и каталазы [84].
SIRT3 активирует множество белковых мишеней, модулируя ключевые клеточные и физиологические процессы, что приводит к увеличению продолжительности жизни. Многие из этих процессов опосредуются снижением продукции АФК за счет деацетилированных СОД2 и IDH2. [58].
В культуре эндотелиальных клеток гипоксия стимулирует экспрессию SIRT3 и SIRT3-зависимую передачу антиоксидантных сигналов, что предотвращает повреждение митохондрий и способствует выживаемости клеток. Дефицит SIRT3 вызывает митохондриальную дисфункцию гладкомышечных клеток легочной артерии у грызунов и человека, что приводит к ремоделированию сосудов и возникновению легочной гипертензии [77]. Нокаут гена Sirt3 способствует развитию метаболического синдрома, являющегося фактором возникновения сердечно-сосудистых заболеваний. У старых мышей в ткани почек наблюдается снижение синтеза SIRT3 на 50% по сравнению с этим показателем у молодых животных [55]. Снижение синтеза SIRT3 в митохондриях связана с рядом возрастных патологий, включая рак, инсулинорезистентность, болезни сердца, фиброз и нейродегенерацию [63].
Экспрессия SIRT3 снижена при некоторых формах рака молочной железы, печени и желудка [23, 98] и связана с низкой выживаемостью при гепатоцеллюлярной карциноме [104]. Эти исследования демонстрируют способность SIRT3 замедлять рост опухолей.
Снижение функции митохондрий при старении сопровождается развитием гипергликемии и гиперинсулинемии. В печени мышей линии SIRT3KO с нокаутом гена Sirt3 накапливаются длинноцепочечные ацилкарнитиновые формы кофермента А дегодрогеназы, что нарушает окисление жирных кислот и приводит к развитию метаболической патологии [32]. У мышей линии SIRT3KO на диете с высоким содержанием жиров выявлено ускоренное развитие метаболического синдрома: дисфункция β-клеток поджелудочной железы, нарушение толерантности к глюкозе, инсулинорезистентность, увеличение веса [31]. Временный нокдаун SIRT3 в культуре β-клеток поджелудочной железы приводит к повышению генерации АФК и нарушению секреции инсулина, а сверхэкспрессия SIRT3 устраняет липотоксические нарушения [44]. Экспрессия и активность SIRT3 в печени снижаются при питании с высоким содержанием жиров, что приводит к гиперацетилированию белков, усилению липотоксических состояний и стеатозу печени [41]. У диабетиков в островках Лангерганса поджелудочной железы наблюдается снижение синтеза SIRT3. У мышей с нокаутом гена Sirt3 нарушаются процессы β-окисления липидов в кардиомиоцитах, снижена активность комплекса окислительного фосфорилирования и продукция АТФ [3]. Эти данные свидетельствуют о том, что SIRT3 играет важную роль в развитии метаболического синдрома, сахарного диабета и кардиоваскулярной патологии, являющихся ассоциированными с возрастом заболеваниями.
SIRT3 экспрессируется в головном мозге и других тканях нервной системы [103]. Поскольку SIRT3 регулирует метаболический гомеостаз, предполагают, что он может способствовать защите от развития нейродегенеративных заболеваний. SIRT3 может восстанавливать потерю нейронов в различных моделях нейродегенерации. В культуре первичных кортикальных нейронов при добавлении токсичного пептида Aβ42 развивается апоптоз. Полипептид, активирующий аденилатциклазу гипофиза (PACAP) защищает нейроны от воздействия Aβ42 путем повышения экспрессии SIRT3. Опосредованный PACAP нейропротекторный эффект теряется при подавлении в культивируемых нейронах экспрессии SIRT3. Сверхэкспрессия SIRT3 вызывает устойчивость нейронов к окислительному стрессу и увеличивает их жизнеспособность [30]. Боковой амиотрофический склероз связан с митохондриальной дисфункцией, что может быть смоделировано в культуре нейронов с экспрессией мутантного гена СОД1 G93A. Мутантный ген СОД1 вызывает митохондриальную дисфункцию и апоптоз нейронов, который ингибируется при сверхэкспрессии SIRT3 и PGC1α – фактора транскрипции, регулирующего экспрессию SIRT3 [82].
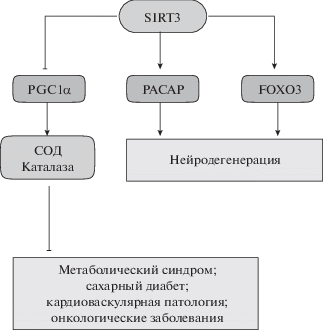
Таким образом, SIRT3, регулируя синтез FOXO3, PGC1α, PACAP, каталазы и СОД, препятствует развитию ряда ассоциированных с возрастом патологий: сахарного диабета, метаболического синдрома, кардиоваскулярной дисфункции, рака и нейродегенеративных заболеваний (рис. 2).
СИРТУИН 4: ГЕРОПРОТЕКТОР ИЛИ БЕЛОК, УСКОРЯЮЩИЙ СТАРЕНИЕ?
Данные о роли SIRT4 в процессах старения носят противоречивый характер. Имеются данные, что у Drosophila melanogaster с нокаутом гена Sirt4, снижается продолжительность жизни, повышается чувствительность к голоданию, снижается фертильность, гликолиз, метаболизм аминокислот с разветвленной цепью и катаболизм жирных кислот. У дрозофил со сверхэкспрессией Sirt4 наблюдалось увеличение продолжительности жизни [94]. По другим данным нокаут гена Sirt4 у Drosophila melanogaster приводит к сокращению продолжительности жизни и нарушению двигательной функции [75].
При этом имеются данные о роли SIRT4 в формировании фенотипа, ассоциированного со старением (SASP) в коже. Ультрафиолетовое излучение, стимулирующее ускоренное старение клеток дермы, активирует экспрессию Sirt4. SIRT4 ингибирует активацию СОД2 [61], что может способствовать формированию SASP посредством увеличения генерации АФК. Установлено, что при воздействии ультрафиолетового излучения на дермальные фибробласты человека в них повышается уровень мРНК и белка SIRT4, который ингибирует микроРНК-15b, что приводит к формированию SASP [51]. Также показано, что SIRT4 может повышать синтез АФК в кардиомиоцитах мышей [61].
В культурах эндотелия сосудов сверхэкспрессия SIRT4 ингибировала ядерную транслокацию NF-κB, которая запускает экспрессию провоспалительных цитокинов IL-1β, IL-6 и молекулы адгезии ICAM-1 [87]. Таким образом, SIRT4 может обладать антиатеросклеротическими и противовоспалительными свойствами.
Отмечается, что SIRT4 является опухолевым супрессором, что объясняется его способностью регулировать митохондриальный метаболизм при онкогенезе [64]. Уровни мРНК Sirt4 были снижены при раке легких, поджелудочной железы, яичников, желудка, кишечника, предстательной железы, почек, печени и эндометрия, при гематологических опухолях. Более низкие уровни экспрессии Sirt4 в опухолевых тканях часто связаны со снижением выживаемости у онкологических больных [89].
SIRT4 способствует повышению продолжительности жизни у дрозофилы, но активирует фенотип, ассоциированный со старением, в фибробластах кожи человека. Эти противоречивые данные требуют проведения дополнительных исследований, детализирующих молекулярный механизм действия SIRT4. Кроме того, SIRT4 нормализует митохондриальный метаболизм, что выражается в его онконстатическом эффекте, и регулирует синтез цитокинов.
ГЕРОПРОТЕКТОРНЫЕ СВОЙСТВА СИРТУИНА 5
SIRT5 обладает нейропротекторными свойствами, замедляя развитие эпилепсии и ассоциированной с возрастом болезни Паркинсона. Дефицит SIRT5 вызывает реактивный астроглиоз, усугубляет потерю нейронов и дегенерацию гиппокампа, повышает тяжесть эпилептических припадков и увеличивает смертность у мышей при моделировании эпилепсии [80]. Экспрессия митохондриального SIRT5 повышается при повреждении гиппокампа. Это указывает на способность SIRT5 повышать выживаемость клеток гиппокампа [53]. У мышей с нокаутом гена Sirt5 при моделировании БП наблюдалась более тяжелая нигростриатная дофаминергическая дегенерация, чем у животных без мутации в этом гене. Делеция гена Sirt5 у мышей с БП приводит к снижению синтеза СОД2. Эти данные показывают, что SIRT5 замедляет нигростриатальную дофаминергическую дегенерацию за счет сохранения поддержания функций антиоксидантной системы нейронов [57].
ГЕРОПРОТЕКТОРНЫЕ СВОЙСТВА СИРТУИНА 6
SIRT6 – гистоновая деацетилаза, мишенями которой являются ацетилированные остатки лизина K9, K56 и K18 (H3K9ac, H3K56ac и H3K18ac) в гистоне H3. Деацетилирование этих аминокислотных остатков с участием SIRT6 необходимо для уплотнения хроматина, репрессии транскрипции и регуляции репарации ДНК. SIRT6 действует как ко-репрессор нескольких факторов транскрипции NF-κB, HIF-1, c-Myc, замедляющих старение, предотвращающих канцерогенез и регулирующих метаболизм. SIRT6 способствует ремоделированию хроматина, необходимому для репарации ДНК и поддержанию структуры теломер для предотвращения геномной нестабильности и клеточного старения [49].
Гиперэкспрессия SIRT6 приводит к увеличению продолжительности жизни самцов мышей [40]. У мышей с нарушением синтеза SIRT6 развивается прогерия и смерть наступает через 4 недели после рождения. Это связано с нестабильностью клеточного генома и системными метаболическими дефектами [66]. Эмбриональные стволовые клетки человека (hESCs) с нарушением экспрессии Sirt6, дифференцированные в мезенхимальные стволовые клетки (hMSCs), имели повышенную чувствительность к окислительному стрессу и проявляли признаки ускоренного клеточного старения [73]. Авторы предполагают, что SIRT6 положительно модулирует регулируемый фактором транскрипции NRF2 и гемоксигеназой-1 антиоксидантный путь в hMSC.
Имеются данные об участии SIRT6 в регуляции циркадных ритмов [62] и его способности подавлять рост опухолей [49]. SIRT6 взаимодействует с белком BMAL1, регулирующим экспрессию циркадных генов и участвующем в ремоделировании хроматина. Также SIRT6 взаимодействует с деацетилированной формой белка PER2, предотвращая ее деградацию [83]. В другом исследовании показано, что SIRT6 взаимодействует с белками CLOCK и BMAL1, регулирующими циркадные ритмы, и белком SREBP-1, регулирующим периодичность метаболизма жирных кислот [62]. Таким образом, геропротекторные эффекты SIRT6 могут реализовываться через регуляцию экспрессии циркадных генов, вовлеченных в поддержание метаболизма.
Установлено, что SIRT6 подавляет рост карциномы поджелудочной железы. Нарушение экспрессии SIRT6 приводит к гиперацетилированию промотора гена гистона Lin28b, активации гена Myc и положительной регуляции синтеза белков HMGA2, IGF2BP1, IGF2BP3, экспрессируемых при росте и метастазировании карциномы поджелудочной железы [50]. SIRT6 подавляет экспрессию генов, вовлеченных в развитие колоректального рака путем модуляции сигнального каскада PTEN/AKT, что может иметь важное значение для разработки новых методов терапии этой патологии [88].
Высокий уровень экспрессии SIRT6 выявлен в нейронах головного мозга млекопитающих [11]. С возрастом отмечено снижение этого показателя [9]. У мышей с нокаутом гена Sirt6 выявлены дефекты передачи нервных импульсов в сетчатки, связанные со снижением количества ионотропных и метаботропных рецепторов глутамата [81]. В головном мозге пациентов и мышей с БА экспрессия SIRT6 снижается. Амилоидные бляшки, образованные конъюгатами пептида Aβ42, подавляли синтез SIRT6 в нейронах коры головного мозга мышей с БА, а также в линии нейронов гиппокампа мыши HT22. Это сопровождалось ацетилированием гистонов H3K9 и H3K56. Пептид Aβ42 в клетках линии HT22 подавлял экспрессию SIRT6 при участии JNK-киназы и белка p53 [37]. Снижение синтеза SIRT6 в головном мозге у мышей с делецией в гене Sirt6 приводит к гиперфосфорилированию τ-белка, что также является одним из звеньев патогенеза БА [39, 86].
Таким образом, SIRT6 обладает наиболее широким спектром геропротекторых эффектов среди семейства сиртуинов. SIRT6 регулирует активность циркадных генов, замедляет процесс клеточного старения (в том числе старения стволовых клеток человека), обладает онкостатическим и нейропротекторным действием, регулирует метаболизм и способствует увеличению продолжительности жизни (рис. 3).
ГЕРОПРОТЕКТОРНЫЕ СВОЙСТВА СИРТУИНА 7
SIRT7 является регулятором синтеза рРНК и участвует в поддержании клеточного гомеостаза. Белки p53, H3K18, PAF53, NPM1, GABP-β1 являются субстратами деацетилазной активности SIRT7 [45]. SIRT7 способствует выживаю клеток в условиях стресса, в том числе и при старении, за счет регуляции синтеза HIF-1 и IRE1α [35]. Повышенная нестабильность рДНК – фенотип, связанный со старением у человека. Являясь единственным сиртуином, который в основном расположен в ядрышках, SIRT7 противодействует старению hMSCs, поддерживая стабильность рДНК в областях гетерохроматина [74]. SIRT7 подавляет ретротранспозоны LINE1, регулирует экспрессию кластеров генов рДНК в регионах гетерохроматина, и способствует выживаемости гемопоэтических стволовых клеток [65]. SIRT7 обладает кардиопротекторным действием, участвуя в деацетилировании GATA4 в кардиомиоцитах [97]. Таким образом, SIRT7 играет важную роль в замедлении клеточного старения, поддержания пула стволовых клеток и кардиопротекции.
ЗАКЛЮЧЕНИЕ
Сиртуины играют ключевую роль в обеспечении антиоксидантной защиты, регуляции синтеза АФК и репарации ДНК. Предотвращение окислительного стресса способствует замедлению клеточного старения и поддержанию пула стволовых клеток. Геропротекторные свойства SIRT1,2,3,6,7, реализуемые через различные сигнальные клеточные каскады, подробно описаны в литературе. В отношении SIRT4 в настоящее время нет единого мнения, обладает ли он геропротекторным действием или ускоряет старение. SIRT5 остается недостаточно изученным, хотя имеются данные о его нейропротекторной активности и антиоксидантных свойствах, что позволяет рассматривать этот белок в качестве потенциального геропротектора. Предполагается, что сиртуины человека являются потенциальными мишенями для терапии различных заболеваний, ассоциируемых с возрастом: сердечно-сосудистой системы (гипертония и сердечная недостаточность), нервной системы (БА, БП), обменных нарушений (диабет второго типа, метаболический синдром), онкопатологии (рис. 4).
Список литературы
Пухальская А.Э., Дятлова А.С., Линькова Н.С. и др. Сиртуины как возможные предикторы старения и развития болезни Альцгеймера: верификация в гиппокампе и слюне // Бюллетень экспериментальной биологии и медицины. 2020. Т. 169. № 6. С. 769–772.
Пухальская А.Э., Дятлова А.С., Линькова Н.С., Кветной И.М. Сиртуины: роль в регуляции окислительного стресса и патогенезе нейродегенеративных заболеваний // Успехи физиологических наук. 2021. Т. 52. № 1. С. 90–104.
Ahn B.H., Kim H.S., Song S. et al. A role for the mitochondrial deacetylase Sirt3 in regulating energy homeostasis // Proc. Natl. Acad. Sci. USA. 2008. V. 105(38). P. 14447–14452. https://doi.org/10.1073/pnas.0803790105
Almeida M., Porter R.M. Sirtuins and FoxOs in osteoporosis and osteoarthritis // Bone. 2019. V. 121. P. 284–292. https://doi.org/10.1016/j.bone.2019.01.018
Anwar T., Khosla S., Ramakrishna G. Increased expression of SIRT2 is a novel marker of cellular senescence and is dependent on wild type p53 status // Cell Cycle. 2016. V. 15(14). P. 1883–1897. https://doi.org/10.1080/15384101.2016.1189041
Bai H., Post S., Kang P., Tatar M. Drosophila longevity assurance conferred by reduced insulin receptor substrate chico partially requires d4eBP // PLoS One. 2015. V. 10: e0134415. https://doi.org/10.1371/journal.pone.0134415
Benigni A., Cassis P., Conti S. et al. Sirt3 Deficiency shortens life span and impairs cardiac mitochondrial function rescued by Opa1 gene transfer // Antioxid. Redox. Signal. 2019. V. 31(17). P. 1255–1271. https://doi.org/10.1089/ars.2018.7703
Braidy N., Guillemin G.J., Mansour H. et al. Age related changes in NAD+ metabolism oxidative stress and SIRT1 activity in wistar rats // PLoS One. 2011. V. 6(4): e19194. https://doi.org/10.1371/journal.pone.0019194
Braidy N., Poljak A., Grant R. et al. Differential expression of sirtuins in the aging rat brain // Front. Cell. Neurosci. 2015. V. 9. P. 167. https://doi.org/10.3389/fncel.2015.00167
Brunet A., Sweeney L.B., Sturgill J.F. et al. Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase // Science. 2004. V. 303(5666). P. 2011–2015. https://doi.org/10.1126/science.1094637
Burkewitz K., Zhang Y.E., Mair W.B. AMPK at the nexus of energetics and aging // Cell Metab. 2014. V. 20. P. 10–25. https://doi.org/10.1016/j.cmet.2014.03.002
Burnett C., Valentini S., Cabreiro F. et al. Absence of effects of Sir2 overexpression on lifespan in C. elegans and Drosophila // Nature. 2011. V. 477. P. 482–485. https://doi.org/10.1038/nature10296
Cardinale A., de Stefano M.C., Mollinari C. et al. Biochemical characterization of sirtuin 6 in the brain and its involvement in oxidative stress response // Neurochem. Res. 2015. V. 40(1). P. 59–69. https://doi.org/10.1007/s11064-014-1465-1
Chen C., Zhou M., Ge Y., Wang X. SIRT1 and aging related signaling pathways // Mech. Ageing Dev. 2020. V. 187:111215. https://doi.org/10.1016/j.mad.2020.111215
Cho S.H., Chen J.A., Sayed F. et al. SIRT1 deficiency in microglia contributes to cognitive decline in aging and neurodegeneration via epigenetic regulation of IL-1 beta // J. Neurosci. 2015. V. 35. P. 807–818. https://doi.org/10.1523/JNEUROSCI.2939-14.2015
D’Onofrio N., Vitiello M., Casale R. et al. Sirtuins in vascular diseases: emerging roles and therapeutic potential // Biochim. Biophys. Acta. 2015. V. 1852(7). P. 1311–1322. https://doi.org/10.1016/j.bbadis.2015.03.001
Dang W. The controversial world of sirtuins // Drug Discov Today Technol. 2014. V. 12: e9-e17. https://doi.org/10.1016/j.ddtec.2012.08.003
Deprez M.A., Eskes E., Winderickx J., Wilms T. The TORC1-Sch9 pathway as a crucial mediator of chronological lifespan in the yeast Saccharomyces cerevisiae // FEMS Yeast Res. 2018. V. 18:18. https://doi.org/10.1093/femsyr/foy048
Donato A.J., Magerko K.A., Lawson B.R. et al. SIRT-1 and vascular endothelial dysfunction with ageing in mice and humans // J. Physiol. 2011. V. 589. P. 4545–4554. https://doi.org/10.1113/jphysiol.2011.211219
Du J., Zhou Y., Su X. et al. Sirt5 is a NAD-dependent protein lysine demalonylase and desuccinylase // Science. 2011. V. 334. P. 806–809. https://doi.org/10.1126/science.1207861
Edwards J.R., Perrien D.S., Fleming N. et al. Silent information regulator (Sir)T1 inhibits NF-κB signaling to maintain normal skeletal remodeling // J. Bone Miner. Res. 2013. V. 28 (4). P. 960–969. https://doi.org/10.1002/jbmr.1824
Fang E.F., Lautrup S., Hou Y.J. et al. NAD+ in aging: molecular mechanisms and translational implications // Trends Mol. Med. 2017. V. 23. P. 899–916. https://doi.org/10.1016/j.molmed.2017.08.001
Finley L.W., Carracedo A., Lee J. et al. SIRT3 opposes reprogramming of cancer cell metabolism through HIF1α destabilization // Cancer Cell. 2011. V. 19(3). P. 416–428. https://doi.org/10.1016/j.ccr.2011.02.014
Frye R.A. Phylogenetic classification of prokaryotic and eukaryotic Sir2-like proteins // Biochem. Biophys. Res. Commun. 2000. V. 273(2). P. 793–798. https://doi.org/10.1006/bbrc.2000.3000
García-Aguilar A., Guillén C., Nellist M. et al. TSC2 N-terminal lysine acetylation status affects to its stability modulating mTORC1 signaling and autophagy // Biochim. Biophys. Acta. 2016. V. 1863(11). P. 2658–2667. https://doi.org/10.1016/j.bbamcr.2016.08.006
Ghosh H.S., McBurney M., Robbins P.D. SIRT1 negatively regulates the mammalian target of rapamycin // PLoS One. 2010. V. 5(2):e9199. https://doi.org/10.1371/journal.pone.0009199
Guo J., Shao M., Lu F. et al. Role of SIRT1 plays in nucleus pulposus cells and intervertebral disc degeneration // Spine (Phila Pa 1976). 2017. V. 49(13): E757–E766. https://doi.org/10.1097/BRS.0000000000001954
Haigis M.C., Guarente L.P. Mammalian sirtuins–emerging roles in physiology, aging, and calorie restriction // Genes Dev. 2006. V. 20. P. 2913–2921. https://doi.org/10.1101/gad.1467506
Haigis M.C., Mostoslavsky R., Haigis K.M. et al. SIRT4 inhibits glutamate dehydrogenase and opposes the effects of calorie restriction in pancreatic beta cells // Cell. 2006. V. 126. P. 941–954. https://doi.org/10.1016/j.cell.2006.06.057
Han P., Tang Z., Yin J. et al. Pituitary adenylate cyclase-activating polypeptide protects against β-amyloid toxicity // Neurobiol. Aging. 2014. V. 35(9). P. 2064–2071. https://doi.org/10.1016/j.neurobiolaging.2014.03.022
Hirschey M.D., Shimazu T. Jing E. et al. SIRT3 deficiency and mitochondrial protein hyperacetylation accelerate the development of the metabolic syndrome // Mol. Cell. 2011. V. 44(2). P. 177–190. https://doi.org/10.1016/j.molcel.2011.07.019
Hirschey M.D., Shimazu T., Goetzman E. et al. SIRT3 regulates mitochondrial fatty-acid oxidation by reversible enzyme deacetylation // Nature. 2010. V. 464(7285). P. 121–125. https://doi.org/10.1038/nature08778
Hori Y.S., Kuno A., Hosoda R., Horio Y. Regulation of FOXOs and p53 by SIRT1 modulators under oxidative stress // PLoS One. 2013. V. 8(9): e73875. https://doi.org/10.1371/journal.pone.0073875
Houtkooper R.H., Pirinen E., Auwerx J. Sirtuins as regulators of metabolism and healthspan // Nat. Rev. Mol. Cell Biol. 2012. V. 13. P. 225–238. https://doi.org/10.1038/nrm3293
Hubbi M.E., Hu H., Kshitiz et al. Sirtuin-7 inhibits the activity of hypoxia-inducible factors // J Biol Chem. 2013. V. 288(29). P. 20768–20775. https://doi.org/10.1074/jbc.M113.476903
Jeon S.M. Regulation and function of AMPK in physiology and diseases // Exp. Mol. Med. 2016. V. 48:e245. https://doi.org/10.1038/emm.2016.81
Jung E.S., Choi H., Song H. et al. p53-dependent SIRT6 expression protects Aβ42-induced DNA damage // Sci. Rep. 2016. V. 6: 25628. https://doi.org/10.1038/srep25628
Kaeberlein M., McVey M., Guarente L. The SIR2/3/4 complex and SIR2 alone promote longevity in Saccharomyces cerevisiae by two different mechanisms // Genes Dev. 1999. V. 13(19). P. 2570–2580. https://doi.org/10.1101/gad.13.19.2570
Kaluski S., Portillo M., Besnard A. et al. Neuroprotective Functions for the Histone Deacetylase SIRT6 // Cell Rep. 2017. V. 18(13). P. 3052–3062. https://doi.org/10.1016/j.celrep.2017.03.008
Kanfi Y., Naiman S., Amir G. et al. The sirtuin SIRT6 regulates lifespan in male mice // Nature. 2012. V. 483(7388). P. 218–221. https://doi.org/10.1038/nature10815
Kao C.L., Chen L.K., Chang Y.L. et al. Resveratrol protects human endothelium from H2O2- induced oxidative stress and senescence via SIRT1 activation // J. Atheroscler. Thromb. 2010. V. 17. P. 970–979. https://doi.org/10.5551/jat.4333
Kendrick A.A., Choudhury M., Rahman S.M. et al. Fatty liver is associated with reduced SIRT3 activity and mitochondrial protein hyperacetylation // Biochem. J. 2011. V. 433(3). P. 505–514. https://doi.org/10.1042/BJ20100791
Kennedy B.K., Gotta M., Sinclair D.A. et al. Redistribution of silencing proteins from telomeres to the nucleolus is associated with extension of life span in S. cerevisiae // Cell. 1997. V. 89(3). P. 381–391. https://doi.org/10.1016/s0092-8674(00)80219-6
Kim M., Lee J.S., Oh J.E. et al. SIRT3 Overexpression Attenuates Palmitate-Induced Pancreatic β-Cell Dysfunction // PLoS One. 2015. V. 10(4):e0124744. https://doi.org/10.1371/journal.pone.0124744
Kiran S., Anwar T., Kiran M., Ramakrishna G. Sirtuin 7 in cell proliferation, stress and disease: Rise of the Seventh Sirtuin! Cell Signal // 2015. V. 27(3). P. 673–682. https://doi.org/10.1016/j.cellsig.2014.11.026
Kitada M., Ogura Y., Koya D. The protective role of SIRT1 in vascular tissue: its relationship to vascular aging and atherosclerosis // Aging (Albany NY). 2016. V. 8(10). P. 2290–2307. https://doi.org/10.18632/aging.101068
Kitada M., Ogura Y., Monno I., Koya D. Sirtuins and type 2 diabetes: role in inflammation, oxidative stress, and mitochondrial function // Front. Endocrinol. (Lausanne). 2019. V. 10:187. https://doi.org/10.3389/fendo.2019.00187
Klein MA, Denu J.M. Biological and catalytic functions of sirtuin 6 as targets for small-molecule modulators // J. Biol. Chem. 2020. V. 295(32). P. 11021–11041. https://doi.org/10.1074/jbc.REV120.011438
Kugel S., Mostoslavsky R. Chromatin and beyond: the multitasking roles for SIRT6 // Trends Biochem. Sci. 2014. V. 39(2). P. 72–81. https://doi.org/10.1016/j.tibs.2013.12.002
Kugel S., Sebastián C., Fitamant J. et al. SIRT6 Suppresses Pancreatic Cancer through Control of Lin28b // Cell. 2016. V. 165(6). P. 1401–1415. https://doi.org/10.1016/j.cell.2016.04.033
Lang A., Grether-Beck S., Singh M. et al. MicroRNA-15b regulates mitochondrial ROS production and the senescence-associated secretory phenotype through sirtuin 4/SIRT4 // Aging (Albany NY). 2016. V. 8(3). P. 484–505. https://doi.org/10.18632/aging.100905
Lanza I.R., Short D.K., Short K.R. et al. Endurance exercise as a countermeasure for aging // Diabetes. 2008. V. 57(11). P. 2933–2942. https://doi.org/10.2337/db08-0349
Li F., Liu L. SIRT5 Deficiency Enhances Susceptibility to Kainate-Induced Seizures and Exacerbates Hippocampal Neurodegeneration not through Mitochondrial Antioxidant Enzyme SOD2 // Front. Cell Neurosci. 2016. V. 10: 171. https://doi.org/10.3389/fncel.2016.00171
Lim C.J., Lee Y.M., Kang S.G. et al. Aquatide activation of SIRT1 reduces cellular senescence through a SIRT1-FOXO1-autophagy axis // Biomol. Ther. (Seoul). 2017. V. 25 (5). P. 511–518. https://doi.org/10.4062/biomolther.2017.119
Lin C.H., Chen J., Ziman B. et al. Endostatin and kidney fibrosis in aging: a case for antagonistic pleiotropy? // Am. J. Physiol. Heart Circ. Physiol. 2014. V. 306(12): H1692–H1699. https://doi.org/10.1152/ajpheart.00064.2014
Liszt G., Ford E., Kurtev M., Guarente L. Mouse Sir2 homolog SIRT6 is a nuclear ADP-ribosyltransferase // J. Biol. Chem. 2005. V. 280. P. 21313–21320. https://doi.org/10.1074/jbc.M413296200
Liu L., Peritore C., Ginsberg J. et al. Protective role of SIRT5 against motor deficit and dopaminergic degeneration in MPTP-induced mice model of Parkinson’s disease // Behav. Brain Res. 2015. V. 281. P. 215–221. https://doi.org/10.1016/j.bbr.2014.12.035
Lombard D.B., Zwaans B.M. SIRT3: as simple as it seems? // Gerontology. 2014. V. 60(1). P. 56–64. https://doi.org/10.1159/000354382
Luo H., Mu W.C., Karki R. et al. Mitochondrial stress-initiated aberrant activation of the NLRP3 inflammasome regulates the functional deterioration of hematopoietic stem cell aging // Cell Rep. 2019. V. 26. P. 945–954. https://doi.org/10.1016/j.celrep.2018.12.101
Luo X.Y., Qu S.L., Tang Z.H. et al. SIRT1 in cardiovascular aging // Clin. Chim. Acta. 2014. V. 437. P. 106–114. https://doi.org/10.1016/j.cca.2014.07.019
Luo Y.X., Tang X., An X.Z. et al. SIRT4 accelerates Ang II-induced pathological cardiac hypertrophy by inhibiting manganese superoxide dismutase activity // Eur. Heart J. 2017. V. 38(18). P. 1389–1398. https://doi.org/10.1093/eurheartj/ehw138
Masri S., Rigor P., Cervantes M. et al. Partitioning circadian transcription by SIRT6 leads to segregated control of cellular metabolism // Cell. 2014. V. 158(3). P. 659–672. https://doi.org/10.1016/j.cell.2014.06.050
McDonnell E., Peterson B.S., Bomze H.M., Hirschey M.D. SIRT3 regulates progression and development of diseases of aging // Trends Endocrinol. Metab. 2015. V. 26(9). P. 486–492. https://doi.org/10.1016/j.tem.2015.06.001
Min Z., Gao J., Yu Y. The Roles of Mitochondrial SIRT4 in Cellular Metabolism // Front. Endocrinol. (Lausanne). 2019. V. 9. P. 783. https://doi.org/10.3389/fendo.2018.00783
Mohrin M., Shin J., Liu Y. et al. Stem cell aging. A mitochondrial UPR-mediated metabolic checkpoint regulates hematopoietic stem cell aging // Science. 2015. V. 347(6228). P. 1374–1377. https://doi.org/10.1126/science.aaa2361
Mostoslavsky R., Chua K.F., Lombard D.B. et al. Genomic instability and aging-like phenotype in the absence of mammalian SIRT6 // Cell. 2006. V. 124(2). P. 315–329. https://doi.org/10.1016/j.cell.2005.11.044
Motta M.C., Divecha N., Lemieux M. et al. Mammalian SIRT1 represses forkhead transcription factors // Cell. 2004. Vol. 116. P. 551–563. https://doi.org/10.1016/s0092-8674(04)00126-6
Nogueiras R., Habegger K.M., Chaudhary N. et al. Sirtuin 1 and sirtuin 3: physiological modulators of metabolism // Physiol Rev. 2012. V. 92(3). P. 1479–1514. https://doi.org/10.1152/physrev.00022.2011
North B.J., Rosenberg M.A., Jeganathan K.B. et al. SIRT2 induces the checkpoint kinase BubR1 to increase lifespan // EMBO J. 2014. V. 33(13). P. 1438–1453. https://doi.org/10.15252/embj.201386907
O'Callaghan C., Vassilopoulos A. Sirtuins at the crossroads of stemness, aging, and cancer // Aging Cell. 2017. V. 16(6). P. 1208–1218. https://doi.org/10.1111/acel.12685
O'Callaghan C., Vassilopoulos A. Sirtuins at the crossroads of stemness, aging, and cancer //Aging Cell. 2017. V. 16(6). P. 1208–1218. https://doi.org/10.1111/acel.12685
Ou X., Lee M.R., Huang X. et al. SIRT1 positively regulates autophagy and mitochondria function in embryonic stem cells under oxidative stress // Stem Cells. 2014. V. 32. P. 1183–1194. https://doi.org/10.1002/stem.1641
Pan H., Guan D., Liu X. et al. SIRT6 safeguards human mesenchymal stem cells from oxidative stress by coactivating NRF2 // Cell Res. 2016. V. 26(2). P. 190–205. https://doi.org/10.1038/cr.2016.4
Paredes S., Angulo-Ibanez M., Tasselli L. et al. The epigenetic regulator SIRT7 guards against mammalian cellular senescence induced by ribosomal DNA instability // J. Biol. Chem. 2018. V. 293(28). P. 11242–11250. https://doi.org/10.1074/jbc.AC118.003325
Parik S., Tewary S., Ayyub C., Kolthur-Seetharam U. Loss of mitochondrial SIRT4 shortens lifespan and leads to a decline in physical activity // J. Biosci. 2018. V. 43(2). P. 243–247.
Park J., Chen Y., Tishkoff D.X. et al. SIRT5-mediated lysine desuccinylation impacts diverse metabolic pathways // Mol. Cell. 2013. V. 50. P. 919–930. https://doi.org/10.1016/j.molcel.2013.06.001
Paulin R., Dromparis P., Sutendra G. et al. Sirtuin 3 deficiency is associated with inhibited mitochondrial function and pulmonary arterial hypertension in rodents and humans // Cell Metab. 2014. V. 20(5). P. 827–839. https://doi.org/10.1016/j.cmet.2014.08.011
Salminen A., Kaarniranta K., Kauppinen A. Crosstalk between oxidative stress and SIRT1: impact on the aging process // Int. J. Mol. Sci. 2013. V. 14(2). P. 3834–3859. https://doi.org/10.3390/ijms14023834
Satoh A., Brace C.S., Rensing N. et al. SIRT1 extends life span and delays aging in mice through the regulation of Nk2 homeobox 1 in the DMH and LH // Cell Metab. 2013. V. 18. P. 416–430. https://doi.org/10.1016/j.cmet.2013.07.013
Shih J., Liu L., Mason A., Higashimori H., Donmez G. Loss of SIRT4 decreases GLT-1-dependent glutamate uptake and increases sensitivity to kainic acid // J Neurochem. 2014. V. 131(5). P. 573–581. https://doi.org/10.1111/jnc.12942
Silberman D.M., Ross K., Sande P.H. et al. SIRT6 is required for normal retinal function // PLoS One. 2014. V. 9(6):e98831. https://doi.org/10.1371/journal.pone.0098831
Song W., Song Y., Kincaid B. et al. Mutant SOD1G93A triggers mitochondrial fragmentation in spinal cord motor neurons: neuroprotection by SIRT3 and PGC-1α // Neurobiol. Dis. 2013. V. 51. P. 72–81. https://doi.org/10.1016/j.nbd.2012.07.004
Sun S., Liu Z., Feng Y. et al. Sirt6 deacetylase activity regulates circadian rhythms via Per2 // Biochem. Biophys. Res. Commun. 2019. V. 511(2). P. 234–238. https://doi.org/10.1016/j.bbrc.2019.01.143
Sundaresan N.R., Gupta M., Kim G. et al. Sirt3 blocks the cardiac hypertrophic response by augmenting Foxo3a-dependent antioxidant defense mechanisms in mice // J. Clin. Invest. 2009. V. 119(9). P. 2758–2771. https://doi.org/10.1172/JCI39162
Sung B., Chung J.W., Bae H.R. et al. Humulus japonicus extract exhibits antioxidative and anti-aging effects via modulation of the AMPK-SIRT1 pathway // Exp. Ther. Med. 2015. V. 9(5). P. 1819–1826. https://doi.org/10.3892/etm.2015.2302
Tang B.L. Is SIRT6 Activity Neuroprotective and How Does It Differ from SIRT1 in This Regard? // Front Cell Neurosci. 2017. V. 11:165. https://doi.org/10.3389/fncel.2017.00165
Tao Y., Huang C., Huang Y. et al. SIRT4 Suppresses Inflammatory Responses in Human Umbilical Vein Endothelial Cells // Cardiovasc. Toxicol. 2015. V. 15(3). P. 217–223. https://doi.org/10.1007/s12012-014-9287-6
Tian J, Yuan L. Sirtuin 6 inhibits colon cancer progression by modulating PTEN/AKT signaling // Biomed Pharmacother. 2018. V. 106. P. 109–116. https://doi.org/10.1016/j.biopha.2018.06.070
Tomaselli D., Steegborn C., Mai A., Rotili D. Sirt4: A Multifaceted Enzyme at the Crossroads of Mitochondrial Metabolism and Cancer // Front Oncol. 2020. V. 10. P. 474. https://doi.org/10.3389/fonc.2020.00474
van de Ven R.A.H., Santos D., Haigis M.C. Mitochondrial Sirtuins and Molecular Mechanisms of Aging // Trends Mol Med. 2017. V. 23(4). P. 320–331. https://doi.org/10.1016/j.molmed.2017.02.005
Vaziri H., Dessain S.K., Ng Eaton E. et al. HSIR2(SIRT1) functions as an NAD-dependent p53 deacetylase // Cell. 2001. V. 107(2). P. 149–159. https://doi.org/10.1016/s0092-8674(01)00527-x
Wang N., Luo Z., Jin M. et al. Exploration of age-related mitochondrial dysfunction and the anti-aging effects of resveratrol in zebrafish retina // Aging (Albany NY). 2019. V. 11 (10). P. 3117–3137. https://doi.org/10.18632/aging.101966
Wang Y., Yang J., Hong T. et al. SIRT2: Controversy and multiple roles in disease and physiology // Ageing Research Reviews. 2019. P. 100961. https://doi.org/10.1016/j.arr.2019.100961
Wood J.G., Schwer B., Wickremesinghe P.C. et al. Sirt4 is a mitochondrial regulator of metabolism and lifespan in Drosophila melanogaster // Proc. Natl. Acad. Sci. USA. 2018. V. 115(7). P. 1564–1569. https://doi.org/10.1093/geroni/igy023.345
Wu J.J., Liu J., Chen E.B. et al. Increased mammalian lifespan and a segmental and tissue-specific slowing of aging after genetic reduction of mTOR expression // Cell Rep. 2013. V. 4. P. 913–920. https://doi.org/10.1016/j.celrep.2013.07.030
Xu D., Jiang X., He H. et al. SIRT2 functions in aging, autophagy, and apoptosis in post-maturation bovine oocytes // Life Sci. 2019. V. 232: 116639. https://doi.org/10.1016/j.lfs.2019.116639
Yamamura S., Izumiya Y., Araki S. et al. Cardiomyocyte Sirt (Sirtuin) 7 Ameliorates Stress-Induced Cardiac Hypertrophy by Interacting With and Deacetylating GATA4 // Hypertension. 2020. V. 75(1). P. 98–108. https://doi.org/10.1161/HYPERTENSIONAHA.119.13357
Yang B., Fu X., Shao L. et al. Aberrant expression of SIRT3 is conversely correlated with the progression and prognosis of human gastric cancer // Biochem. Biophys. Res. Commun. 2014. V. 443(1). P. 156–160. https://doi.org/10.1016/j.bbrc.2013.11.068
Yang M., Peng Y., Liu W. et al. Sirtuin 2 expression suppresses oxidative stress and senescence of nucleus pulposus cells through inhibition of the p53/p21 pathway // Biochem. Biophys. Res. Commun. 2019. V. 513(3). P. 616–622. https://doi.org/10.1016/j.bbrc.2019.03.200
Yeung F., Hoberg J.E., Ramsey C.S. et al. Modulation of NF-kappa B- dependent transcription and cell survival by the SIRT1 deacetylase // EMBO J. 2004. V. 23(12). P. 2369–2380. https://doi.org/10.1038/sj.emboj.7600244
You W., Rotili D., Li T.M. et al. Structural Basis of Sirtuin 6 Activation by Synthetic Small Molecules // Angew Chem Int Ed Engl. 2017. V. 56(4). P. 1007–1011. https://doi.org/10.1002/anie.201610082
Zarzuelo M.J., López-Sepúlveda R., Sánchez M. et al. SIRT1 inhibits NADPH oxidase activation and protects endothelial function in the rat aorta: implications for vascular aging // Biochem. Pharmacol. 2013. V. 85(9). P. 1288–1296. https://doi.org/10.1016/j.bcp.2013.02.015
Zeng L., Yang Y., Hu Y. et al. Age-related decrease in the mitochondrial sirtuin deacetylase Sirt3 expression associated with ROS accumulation in the auditory cortex of the mimetic aging rat model // PLoS One. 2014. V. 9(2): e88019. https://doi.org/10.1371/journal.pone.0088019
Zhang C.Z., Liu L., Cai M. et al. Low SIRT3 expression correlates with poor differentiation and unfavorable prognosis in primary hepatocellular carcinoma // PLoS One. 2012. V. 7(12): e51703. https://doi.org/10.1371/journal.pone.0051703
Zhang H., Yang X., Pang X. et al. Genistein protects against ox- LDL-induced senescence through enhancing SIRT1/LKB1/AMPK- mediated autophagy flux in HUVECs // Mol. Cell. Biochem. 2019. V. 455(1–2). P. 127–134. https://doi.org/10.1007/s11010-018-3476-8
Zhang Y., Mi S.L., Hu N. et al. Mitochondrial aldehyde dehydrogenase 2 accentuates aging-induced cardiac remodeling and contractile dysfunction: role of AMPK, SIRT1, and mitochondrial function // Free Radic. Biol. Med. 2014. V. 71. P. 208–220. https://doi.org/10.1016/j.freeradbiomed.2014.03.018
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук