Успехи физиологических наук, 2022, T. 53, № 1, стр. 3-15
Пуринергическая регуляция защитных реакций при инфекции Mycobacterium tuberculosis
Н. Б. Серебряная a, b, *, М. Камран Сарканди a
a ФГБНУ Институт экспериментальной медицины Минобрнауки РФ
197376 Санкт-Петербург, Россия
b ФБГОУВО Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: nbvma@mail.ru
Поступила в редакцию 25.05.2021
После доработки 20.08.2021
Принята к публикации 28.08.2021
- EDN: MJANCZ
- DOI: 10.31857/S030117982104007X
Аннотация
Туберкулез, инфекционный процесс, вызванный Mycobacterium tuberculosis (Mtb), является основной причиной смерти от инфекционных заболеваний в мире. Вирулентные Mtb приспособились к выживанию в макрофагах хозяина за счет использования различных стратегий уклонения от иммунного ответа. Цель настоящего исследования – определить компоненты пуринергического метаболизма, которые Mtb использует как факторы вирулентности. При проведении работы проанализированы публикаций в PubMed, Wiley Online Library, Google Scholar, Elsevier, eLIBRARY за 1972–2020 гг. Пуринергический сигнальный путь инициируется внеклеточными пуриновыми нуклеотидами (еАТФ и др.), высвобождаемыми при повреждении клеток. Высокие концентрации АТФ вызывают активацию рецепторов P2X7 на Mtb-инфицированных макрофагах и способствуют уничтожению патогена. При хронической Mtb-инфекции общая генерация АТФ снижена, но вирулентные Mtb могут значительно увеличивать соотношения АТФ/АДФ. Белки, секретируемые вирулентным Mtb, могут стимулировать апоптоз макрофагов. Mtb способны противодействовать бактерицидности макрофагов, продуцируя каталазу-пероксидазу, которая деактивирует реактивные радикалы кислорода и азота. Приток нейтрофилов создает воспалительное микроокружение, которое способствует выживанию Mtb, благоприятствует их росту и репликации. При туберкулезе легких нейтрофилы в основном участвуют в иммуноопосредованном повреждении ткани. Эти фагоциты привлекаются в очаг воспаления молекулами АТФ, а затем ферменты нейтрофилов CD39 и CD73 могут преобразовывать АТФ в АМФ и аденозин, который обеспечивает местную иммуносупрессию. Для поддержания необходимого уровня АТФ и выживания при переходе в фазу покоя в Mtb активируется АТФ-синтаза. Ферменты нуклеозиддифосфаткиназы (NDPK) Mtb продуцирует нуклеозидтрифосфаты для синтеза РНК, ДНК и полисахаридов. Для эффективного лечения туберкулеза необходимо противодействовать бактериальной вирулентности, что невозможно без нормализации пуринового метаболизма организма хозяина и восстановления пуринергических сигналов.
ВВЕДЕНИЕ
Mycobacterium tuberculosis (Mtb), возбудитель туберкулеза (TБ), широко распространенного заболевания в развивающихся странах, по-прежнему является серьезной проблемой для здравоохранения во всем мире [18]. Согласно отчету Всемирной организации здравоохранения (ВОЗ) в 2019 г. 10 млн человек в мире болеют туберкулезом и 1.4 миллиона человек умерли от этой инфекции [115]. Туберкулез легких – хроническое инфекционное заболевание, характеризующееся образованием гранулем в ткани легких и выраженной воспалительной реакцией [56].Существенной особенностью патогенеза ТБ как хронической инфекции является выживание бацилл в макрофагах инфицированного хозяина.
В последние годы определена роль пуринергической системы в регуляции функциональной активности клеток различных органов и тканей. Составляющими пуринергической системы являются сигнальные молекулы, образующихся при метаболизме пуринов (от АТФ через AДФ и AМФ до аденозина, лишенного фосфатных групп), пуринергические рецепторы (типы Р1 и Р2), а также ферменты-нуклеотидазы, необходимые для образования этих медиаторов. Показано, что нуклеотиды и аденозин регулируют выраженность, продолжительность и исход воспалительного ответа при активации специфических рецепторов, широко представленных на иммунных клетках [15, 62, 63].
Однако при туберкулезе легких регуляторная пуринергическая система остается малоизученной. Цель этого обзора – рассмотреть изученные механизмы, участвующие в пуринергической регуляции, которые Mtb использует для ускользания от иммунного ответа. Для этого были проанализированы публикации в PubMed, Wiley Online Library, Google Scholar, Elsevier, eLIBRARY за 1972–2020 годы, посвященные данному вопросу (ключевые слова: Mycobacterium tuberculosis, Tuberculosis, purinergic signaling pathway, inflammation, P2X7, secretion systems of Mtb, macrophage apoptosis, mitochondria, purinergic pathway enzymes, immune responses to Mtb).
ПУРИНЕРГИЧЕСКАЯ РЕГУЛЯЦИЯ ВОСПАЛЕНИЯ И ИММУННЫХ РЕАКЦИЙ
Впервые концепцию пуринергического сигнального пути сформулировал Джеффри Бернсток в 1972 г. [9, 26]. Первые связанный с G-белком рецепторы для аденозинтрифосфата (АТФ), рецепторы P2Y1 и P2Y2, были клонированы в 1970-х годах Бернстоком и Джулиусом. Вскоре гипотеза Бернстока о пуринергической передаче сигналов стала одной из самых горячих тем в нейрофизиологии и нейрофармакологии. В начале 1990-х годов несколько важных открытий окончательно подтвердили правильность концепции пуринергической регуляции [43, 45]. Однако до сих пор этот путь недостаточно учитывается при описании патогенеза различных заболеваний и состояний.
В физиологических условиях, при стрессе и повреждении все типы клеток организма секретируют нуклеозиды и нуклеотиды. Взаимодействуя со своими рецепторами, эти медиаторы-аутакоиды (АТФ, аденозин) становятся стимуляторами процессов нейромодуляции и нейротрансмиссии, секреции гормонов, взаимодействия глии и нейронов, тромбоцитов и эндотелия, они регулируют активности клеток почки, сердечно-сосудистой, иммунной системы, желудочно-кишечного тракта, воспаления, способны регулировать боль и рост злокачественных клеток [18, 23, 27, 28, 39, 40, 55, 65, 110]. Уровни внеклеточных нуклеотидов и нуклеозидов могут динамически контролироваться группой ферментов, называемых эктонуклеотидазами. Эти ферменты включают семейство эктонуклеозидтрифосфатдифосфогидролаз (E-NTPDase) (E-NTPDase1, эктоапиразу CD39), которые гидролизуют три- и дифосфаты нуклеотидов, и экто-5'-нуклеотидазу (CD73), которая гидролизует монофосфаты нуклеотидов до аденозина [123]. Завершает каскад гидролиза нуклеозидов аденозиндезаминаза (ADA), фермент, ответственный за превращение аденозина в инозин [17, 51, 124]. ADA представлена двумя изоферментами, ADA1 и ADA2, проявляющими активность в различных компартментах [121]. Для пуринергических медиаторов имеются несколько типов рецепторов на поверхности различных клеток, включая рецепторы P1 для аденозина и P2 для АТФ, АДФ и некоторых других нуклеотидов (рис. 1). Передача пуринергических сигналов через P2R и P1R часто обеспечивает противоположные эффекты с точки зрения модуляции функций иммунных клеток [13]. В частности, АТФ-опосредованная передача сигналов через P2 рецепторы в основном способствует активации иммунных клеток, тогда как АДО-опосредованная передача сигналов P1R в основном ограничивает активацию иммунных клеток [28].
Рис. 1.
Пурины в клеточных сигнальных и метаболических сетях. На рисунке изображены две клетки, которые обмениваются данными, используя пурины в качестве сигнальных молекул. Высвобожденный АТФ распознается двумя типами рецепторов (P2X, ионотропными, и P2Y, метаботропными). АТФ может гидролизоваться различными эктонуклеотидазами (такими как CD39 и CD73) для трансформации в менее фосфорилированные нуклеотиды (АДФ и АМФ) и, в конечном итоге, в нуклеозид-аденозин (АДО). Все рецепторы, опосредующие действия АДО, являются метаботропными. Таким образом, передача пуринергических сигналов является результатом взаимодействия типов рецепторов, присутствующих на клетоках, с адениновыми нуклеотидами и АДО в переменной пропорции, которая зависит от ферментативной активности экспрессируемых эктонуклеотидаз. На клетках представлены мембранные транспортеры, способные переносить АДО внутрь клетки. Внутри клетки АДО может трансформироваться во множество метаболитов и действовать как модулятор стратегических метаболических путей. АДО катаболизируется аденозиндезаминазой (ADA), в результате чего образуется инозитол и далее – набор пуринов, конечным метаболитом является мочевая кислота (мягкий антиоксидант) и ксантин в качестве промежуточного звена, способный генерировать супероксид анион $\left( {{\text{O}}_{2}^{ - }} \right).$ Под действием аденозинкиназы (АДК) АДО может превращаться в нуклеотид (AMФ), который является модулятором AMФ-киназы (AMФK), важного фермента, регулирующего энергетический гомеостаз. АМФ можно дополнительно фосфорилировать до АДФ и АТФ. АТФ попадает во внеклеточное пространство посредством экзоцитоза или через специализированные каналы (полуканалы паннексина и коннексина), где выполняет роль медиатора.
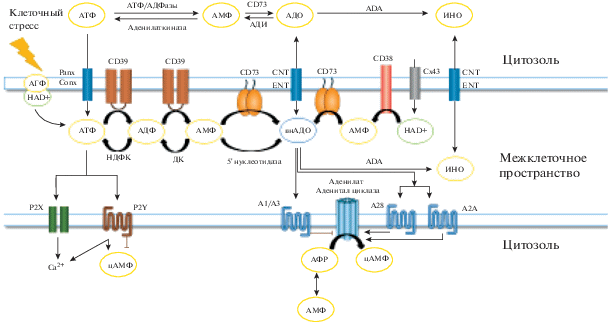
Рецепторы Р2 классифицируют как ионотропные (P2X) и метаботропные (P2Y) рецепторы [120]. Среди аденозиновых рецепторов P1существует четыре различных подтипа рецепторов, A1, A2A, A2B и A3, различающихся по аффинности и характеру взаимодействия с аденилатциклазой (стимуляция или ингибиция) [75, 101, 108].
Взаимодействуя с Р1-рецепторами, различные (милли- и микромолярные) концентрации аденозина могут положительно и/или отрицательно регулировать процессы в клетках различных тканей [25]. При воздействии на клетки иммунной системы аденозин может стимулировать продукцию некоторых медиаторов или ингибировать активность иммунных клеток, модулировать воспаление и снижать активность противоопухолевых иммунных реакций [106].
Важнейшим пуринергическим медиатором является АТФ. В легких АТФ увеличивает секрецию муцина из бокаловидных клеток бронхов и активирует высвобождение хлора (Cl–) из эпителиальных клеток в верхних дыхательных путях [34, 71, 81]. Кроме того, АТФ является эффективным агонистом для стимуляции высвобождения сурфактанта из альвеолярных пневмоцитов 2 типа [114]. Было показано, что обработка АТФ праймирует альвеолярные макрофаги крысы к усилению высвобождения супероксида при их стимуляции иммунными комплексами [60]. Обработка макрофагов АТФ может стимулировать уничтожение вакцинного штамма микобактерий Bacillus Calmette-Guérin (БЦЖ). При этом АТФ может придавать бактерицидную активность штамму БЦЖ по отношению к вирулентным микобактериям [35, 74]. То есть, АТФ изменяет свойства не только иммунных клеток, но и микроорганизмов.
Примечательно, что патогенные микроорганизмы, включая бактерии и грибы, могут выделять внеклеточный АТФ [83], однако их роль в обеспечении пуринергической передачи сигналов в макроорганизме хозяина не выяснена.
ОСОБЕННОСТИ ПУРИНЕРГИЧЕСКОЙ РЕГУЛЯЦИЯ ВОСПАЛЕНИЯ В УСЛОВИЯХ Mtb ИНФЕКЦИИ
Способность Mtb устанавливать хроническую инфекцию и их вирулентность связана со способностью выживать и сохраняться в альвеолярных макрофагах после захвата в процессе фагоцитоза. Для установления и поддержания продуктивной инфекции Mtb необходима начальная фаза роста в макрофагах [72]. Макрофаги, инфицированные Mtb, имеют высокий уровень внутриклеточного кальция (Ca2+). Повышение уровня Ca2+ в основном вызвано активацией рецепторов P2Y2 и P2Y7 на поверхности макрофагов под действием АТФ [22]. При повышении уровня Ca2+ в клетке повышается активность фосфолипазы D, что способствует АТФ-индуцированному слиянию фагосом с лизосомами и противодействует стратегии выживания Mtb [42].
При фагоцитозе Mtb в фагосомах происходит сборка ферментного комплекса NADPH-оксидазы, что способствует образованию реактивных радикалов кислорода (РРК) [105]. Однако, для уничтожения Mtb макрофагами необходимы дополнительно реактивные радикалы азота (РРА), такие как оксид азота (NO), поскольку именно они обладают микробицидным действием по отношению к внутриклеточным патогенам. В моноцитах/макрофагах NO генерируется в кислой среде фагосом в результате окисления L-аргинина с участием фермента индуцибельной синтазы окиси азота (iNOS). Для индукции активности iNOS требуется активация моноцитов/макрофагов цитокинами клеток Тh1, такими как фактор некроза опухоли-α (TNF-α) и интерферон γ (IFN-γ) [48, 58] и другими [57]. Оксид азота в свою очередь способен модулировать иммунный ответ. Показано, что NO регулирует процессы дифференцировки Т-хелперов (Тh), обеспечивая поляризацию иммунного ответа в направлении Th1 посредством индукции синтеза интерлейкина-12 (IL-12) моноцитами [7]. Кроме того, NO может напрямую ингибировать воспаление [84, 104], защищать Т-лимфоциты от апоптоза, опосредованного Mtb [111] и подавлять вызванную воспалением активность 12/15-липоксигеназы, обеспечивающую привлечение нейтрофилов [85].
Собственные клетки организма защищены от реактивных радикалов кислорода и азота механизмами, известными как система антиоксидантной защиты [36]. Однако в условиях гипергенерации NO может проявляться токсический эффект, связанный как с прямым окислением железосодержащих групп клеточных ферментов, так и с образованием сильного окислителя, очень реакционного и токсичного пероксинитрита (ПН). Пероксинитрит (ONOO–) образуется при взаимодействии NO с супероксидным анион-радикалом (O2–). Токсический эффект NO и ПН проявляется, прежде всего, в ингибировании митохондриальных ферментов, что приводит к дисфункции митохондрий, снижению продукции АТФ [50, 88] и может вызывать апоптоз и некроз как самих клеток-продуцентов NO, так и окружающих клеток [24].
Mtb способны избегать разрушения внутри макрофагов, успешно выживая в течение длительного времени как внутри клеток, так и внутри гранулем [21]. Некоторые из стратегий, которые Mtb использует для выживания в макрофагах и ускользания от иммунного ответа, включают предотвращение слияния фагосом с лизосомами и ограничение закисления фагосом [37, 107]. Mtb могут ускользать из фагосом, перемещаясь в цитозоль. Распознавание Mtb цитоплазматическими сенсорами может приводить к аутофагии, однако Mtb могут противодействовать элиминации, опосредованной аутофагосомами, высвобождая факторы вирулентности через специализированные системы секреции [99, 126]. Важнейшим фактором вирулентности Mtb являются антиоксидантные ферменты метионин-сульфоксид-редуктазы А и В, которые защищают бактерии от NO и пероксинитрита (ONOO–) [76]. Показано, что блокирование продукции NO приводит к увеличению популяции бактерий в легких мышей, инфицированных Mtb. При недостаточной активности iNOS и дефиците цитокина IFN-γ или его рецептора (IFNγR), развиваются тяжелые формы туберкулеза, характеризующимся высокой бактериальной нагрузкой и гранулоцитарным воспалением [85].
Традиционно основным источником NO при воспалении считаются макрофаги [31], однако нейтрофилы, активные участники воспаления при ТБ, также могут продуцировать NO [102]. В нейтрофилах присутствует конститутивная изоформа синтазы NO, подобная таковой в эндотелиальных клетках (eNOS), а в условиях воспаления нейтрофилы экспрессируют также и вторую, индуцибельную изоформу NO-синтазы (iNOS) [87, 89]. Конститутивная активность eNOS обеспечивает генерацию небольших количества NO в течение коротких периодов времени, в то время как активация iNOS приводит к замедленному, но длительному высвобождения больших количеств NO [30, 38]. Таким образом, в отличие от активированных макрофагов, нейтрофилы не производят значительных количеств NO и обладают очень ограниченной способностью ограничивать репликацию Mtb [85]. Показано, что у мышей с дефицитом iNOS приток нейтрофилов создает хорошие условия для роста Mtb и способствует репликации бактерий [84].
Привлеченные в очаг микобактериального воспаления нейтрофилы быстро подвергаются апоптозу и становятся основным источником аденозина, который выделяется через коннексиновые полуканалы 43 (Cx43) или каналы паннексина-1 (panx-1) [14, 113]. Нейтрофилы, экспрессирующие апиразу CD39, при взаимодействии с клетками, экспрессирующими экто-5'-нуклеотидазу (CD73), могут участвовать в производстве аденозина, а при связывании фермента АDА2, могут также контролировать активность клеток в аденозиновой среде [69]. Интересно, что при повышении концентрации внеклеточного аденозина реализуются механизмы отрицательной обратной связи и привлечение нейтрофилов в очаг воспаления в легких ингибируется [96]. Таким образом, регуляция активности нейтрофилов в очаге микробного воспаления существенно контролируется пуринергической системой: их привлечение связано с рецепторами Р2Y, а полная активация с рецептором P2X7 [113], дальнейшая модуляция обеспечивается различными концентрациями аденозина при его взаимодействии с различными рецепторами семейства Р1.
В присутствии NO (при нитрозативном стрессе) в моноцитах/макрофагах наблюдается возрастание активности и выделение из клеток изоформы 2 фермента аденозиндезаминазы (АDА2). При поступлении в плазму крови АDА2 закрепляется на поверхности нейтрофилов, что способствует высвобождению из них реактивных радикалов кислорода. АDА2 снижает уровень аденозина и уменьшает его доступность, но возможность его связывания с высоко аффинным ингибирующим аденилатциклазу рецептором A1 на нейтрофилах сохраняется, что поддерживает высокую продукцию РРК [70]. Однако в том случае, если аденозин связывается с активирующим аденилатциклазу рецептором A2A, образование РРК нейтрофилами снижается [53]. Таким образом, функциональное состояние нейтрофилов связано с типом экспрессируемых рецепторов и существенно влияет на модуляцию, осуществляемую аденозином.
У больных туберкулезом легких отмечают существенные нарушения продукции оксида азота мононуклеарными клетками периферической крови (МПК), причем наиболее выраженным это угнетение становится на фоне антибактериальной терапии [7]. Снижение продукции NO МПК при ТБ, как полагают, является одним из ключевых факторов патогенеза заболевания [4]. Однако некоторые данные, напротив, указывают на то, что спонтанная и стимулированная генерация NO в МПК при активном туберкулезе может становиться чрезмерной, что способствует индукции апоптоза Т-лимфоцитов и развитию специфической анергии [5].
РОЛЬ РЕЦЕПТОРА P2X7 В АКТИВАЦИИ ИММУННЫХ КЛЕТОК ПРИ ТУБЕРКУЛЕЗЕ
В экспериментах in vitro было показано, что высокие концентрации внеклеточного (е)АТФ (~1 мМ) вызывают уничтожение микобактерий моноцитами человека, а при концентрации eATФ 3 мМ и активации АТФ-специфического рецептора P2X7 (P2X7R) в течение 30 мин запускался апоптоз макрофагов, инфицированных БЦЖ, причем механизм киллинга бактерий не зависел от РРК/РРА [74]. Дальнейшие исследования показали, что механизм уничтожения микобактерий зависит либо от активации фосфолипазы D [46, 73], либо от апоптоза инфицированных макрофагов (рис. 2) [74, 86].
Рис. 2.
Пуринергическая регуляция функций митохондрий и индукция апоптоза инфицированных макрофагов при инфекции Mtb. Для производства АТФ и обеспечения метаболических потребностей клетки митохондрии используют Ca2+. Ионизированный кальций проникает в митохондрии в основном через два кальциевых канала VDAC (на внешней митохондриальной мембране) и MCU (на внутренней митохондриальной мембране). Для поддержания клеточного гомеостаза Ca2+ удаляется из митохондрий с помощью ионообменника (exchanger) NCLX. Однако, если Ca2+ накапливается в митохондриях, открывается переходная пора проницаемости (PTP), внешняя мембрана деполяризуется и высвобождается цитохром с. После выхода из митохондрий цитохром с связывается с апоптотическим фактором активации пептидазы 1 (APAF-1), что приводит к образованию апоптосомы. Апоптосома активирует прокаспазу-9, а затем каспазу-3, что в конечном итоге приводит к гибели клетки. Перегрузка Ca2+ может также увеличить производство РРК за счет транспорта электронов, что в конечном итоге приводит к повреждению ДНК и гибели клеток.

Исследование показало, что мыши с дефицитом рецептора P2X7 (P2X7–/–), инфицированные Mtb, имели более низкую бактериальную нагрузку по сравнению с мышами дикого типа, а в их легких отмечена умеренная инфильтрация мононуклеарными лейкоцитами без видимых признаков некроза, причем выживание таких животных было более длительным [11, 20]. Инфицированные Mtb макрофаги в присутствии низких концентраций АТФ выделяют меньше провоспалительных цитокинов. Установленный уровень АТФ, в зависимости от скорости его деградации, может ограничивать повреждение тканей, однако может также способствовать ускользанию Mtb от иммунного ответа [90]. У мышей с дефицитом P2X7R восприимчивость к туберкулезной инфекции критически зависит от дозы микобактерий и используемых штаммов. Гипервирулентные микобактерии вызывают некроз макрофагов по P2X7R-зависимому механизму [11]. Участие P2X7R в развитии тяжелых форм туберкулеза может быть объяснено порочным кругом, вызванным высвобождением высоких концентраций ATФ из некротических клеток, что приводит к повреждению легких и распространению бактерий.
С использованием экспериментальных моделей было выявлено участие рецептора P2X7 в различных процессах при туберкулезе. Так, макрофаги, полученные от людей с полиморфизмом 1513A → C в гене P2X7R и инфицированные Mtb, не подвергались апоптозу и не вызывали гибели микобактерий при обработке АТФ [47]. Placido et al. показали, что eATФ вызывает апоптоз в моноцитах/макрофагах, инфицированных Mtb через P2X7R, и снижает жизнеспособность бацилл [91]. Иммуномодулирующий эффект внеклеточного АТФ был также описан через активацию P2X7R, которая увеличивает экспрессию MHC II в макрофагах, инфицированных Mycobacterium bovis (БЦЖ) или Mtb, и способствует возникновению антимикробного Т-клеточного ответа [93].
МЕХАНИЗМЫ УСКОЛЬЗАНИЯ Mtb ОТ ГИБЕЛИ В МАКРОФАГАХ, СВЯЗАННЫЕ С БЛОКИРОВАНИЕМ СИНТЕЗА АТФ
При установлении инфекции, Mtb активно подавляют сигнальные пути в инфицированной клетке [29]. Для своего выживания в клетке, Mtb изменяет функцию и структуру митохондрий, воздействуя на них с помощью батареи секреторных факторов [37, 107]. Митохондрии – важнейшие клеточные органеллы, обеспечивающие синтез АТФ, биосинтез жирных кислот, хранение кальция, биогенез железа. Кроме того, митохондрии играют решающую роль в регуляции апоптоза и тесно связаны с пуринергическим сигнальным путем, влияющим на уровень иона кальция (рис. 3). Активные радикалы кислорода из митохондриальных кластеров в макрофагах могут проникать в фагосомы и угрожать выживанию Mtb. Показано, что митохондрии приобретают особую удлиненную структуру и имеют тенденцию накапливаться вокруг фагосом, содержащих Mtb. В митохондриях клеток макрофагальной линии THP-1, инфицированных Mtb, изменяются уровни различных компонентов цепи переноса электронов, такие как АТФ-синтаза FoF1 (ATP50), сукцинатдегидрогеназа, NADH-дегидрогеназа, цитохром с-оксидаза и NADH-цитохром b5-редуктаза [68]. Недавно было показано, что циклоспорин А, ингибитор проницаемости митохондриальной поры, увеличивает выживаемость макрофагов, происходящих из моноцитов человека, инфицированных Mtb, и усиливает их антимикобактериальную активность [54].
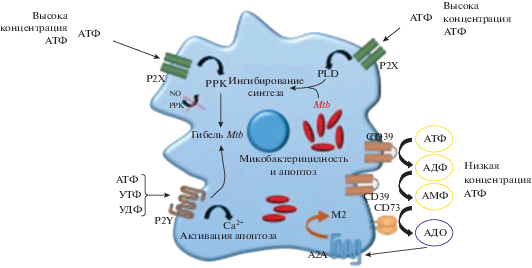
Рис. 3.
Последствия активации макрофагов, инфицированных Mbt, различными концентрациями eATФ. Высокие концентрации eATФ (3–5 мМ) индуцируют активацию P2X7R на макрофагах, инфицированных M. tuberculois, и вызывают уничтожение патогена. Уничтожение бактерий связано с образованием РРК, однако микобактерицидная активность обусловлена активацией фосфалипазы D (PLD). Высокие уровни eATФP также вызывают апоптоз макрофагов. Рецепторы P2Y, представленные на макрофагах, менее специфичны и могут связывать уридинтрифосфат и уридиндифосфат, усиливая активацию клетки. Совместная активация рецепторов P2X7 и P2Y2,4.6 приводит повышению концентрации внутриклеточного ионизированного кальция (Са2+), а при длительной стимуляции стимулируют запуск апоптоза макрофага. При низких концентрациях молекулы eATФ (100 мкМ) быстро превращаются в eAMФ и eАДО при участии ферментов CD39 и CD73. eAMФ и eАДО связывают аденозиновый рецептор A2A, что приводит к поляризации в сторону M2-подобного профиля макрофагов, инфицированных M. tuberculosis (Адаптировано из [81]).
ФЕРМЕНТЫ ПУРИНОВОГО МЕТАБОЛИЗМА, ИСПОЛЬЗУЕМЫЕ ИММУННЫМИ КЛЕТКАМИ И Mtb
Пуринергический сигнальный путь контролируется несколькими важными ферментами, такими как ранее упоминаемые CD39 и CD73, аденозинкиназой (АК) и аденозиндезаминазой (ADA). Mtb также имеют некоторые ферменты, участвующие в метаболизме пуринов, которые задействованы в инфекционном процессе.
E-NTPDase1, эктоапираза CD39. Показано, что CD39 является маркером регуляторных CD4+ или CD8+ Т-клеток человека и важным компонентом в реализации супрессорного действия популяции CD8+ Т-лимфоцитов, активированных M. bovis [19]. Хотя клетки CD39+ не способны продуцировать IFNγ, они участвуют в подавлении неблагоприятного иммунного ответа, вовлекая рецепторы A2A на CD8+ T-лимфоцитах, и супрессируют продукции IFNγ [16]. В крови больных активной формой туберкулеза выявили расширение популяции регуляторных Т-клеток CD4+CD25+CD39+ [32], что свидетельствует о подавлении защитного иммунного ответа к Mtb у таких больных.
CD38. CD38 – бифункциональный фермент, сочетающий в себе активность рибозилциклазы АДФ и гидролазы циклической АДФ-рибозы (цАДФР) [64, 100]. CD38 катализирует образование цАДФР и адениндинуклеотидфосфата никотиновой кислоты, выполняющих функцию мобилизаторов кальция из внутриклеточных депо. CD38 может также контролировать гомеостаз никотинамидадениндинуклеотида (NAD+) в клетках различной природы и процессы, связанные с АДФ-рибозилированием белков, активацией NAD+-зависимых ферментов и выступать в качестве сенсора редокс-состояния [80, 116]. В иммунных клетках CD38 отвечает за передачу сигналов от рецепторов в активированных лимфоцитах и дендритных клетках (ДК). В Т-лимфоцитах передача сигналов от CD38 осуществляется через рецептор CD3 [6, 113, 125]. CD38 регулирует активацию зрелых моноцитарных ДК, играет важную роль в хемотаксисе, миграции и способствует выживанию зрелых ДК, обеспечивая поляризацию в сторону Th1-ответа [52, 123]. Экспрессия CD38 повышается на активированных клетках [6]. Показана информативность изучения экспрессии CD38 для прогнозирования прогрессии воспаления при мониторинге терапии больных ТБ и ВИЧ-инфекцией [98, 103]. Более того, несколько исследований показали возможность разделения активного туберкулеза и латентной туберкулезной инфекции с помощью активационных маркеров CD38+ и HLA-DR+ на Mtb-реактивных CD4 Т-клетках крови [10, 97].
АТФ-синтаза. АТФ-синтаза используется Mtb, когда инфекция становится неактивной. В этот период АТФ-синтаза активируется, поддерживая выживание бактерий [79]. Для синтеза АТФ АТФ-синтаза использует АДФ и пирофосфат [59]. При ингибировании АТФ-синтазы в Mtb происходит истощение АТФ, что вызывает гомеостатический дисбаланс (нарушение pH), который угрожает выживанию бактерий [12, 94]. АТФ-синтазу потенциально рассматривают как терапевтическую мишени при лечении ТБ и других инфекционных заболеваниях [49].
Аденозиндезаминаза (ADA). Изоферменты ADA1 и ADA2 контролируют уровень аденозина и дезоксиаденозина, путем необратимого дезаминирования при их трансформации в инозин. IFNγ может регулировать скорость секреции ADA2 макрофагами [122], однако Mtb способны блокировать транскрипцию IFNγ-зависимых генов, нарушая тем самым и метаболизм аденозина [109].
Экто-АДА-1 на поверхности клетки связывается с дипептидилпептидазой IV (ДПП IV) (CD26/ДПП IV), создавая комплекс, который защищает лимфоциты от действия внеклеточного аденозина. ADA1 и ADA2 также способствуют пролиферации СD4+ Т-клеток и, следовательно, могут поддерживать активацию лимфоцитов [122]. Для диагностики туберкулезного процесса активность АDА определяется в жидкостях, “локальных” для пораженного органа (например, в плевральном выпоте, синовиальной, спинномозговой или перитонеальной жидкости). При введении туберкулина степень активности АDА в сыворотке крови возрастает, что также используется в диагностических целях. После успешной терапии или удаления пораженного органа в условиях затихания туберкулезного воспалительного процесса наблюдается снижение активности АDА, а также снижается прирост ее активности в ответ на введение туберкулина [2]. При определении активности туберулезного процесса АDА в сыворотке крови используют как дополнительный критерий оценки состояния больных с тяжелыми формами туберкулеза легких [1]. Определение активности АDА позволяет оценивать эффективность проводимой противотуберкулезной терапии [3, 4, 8]. Активность ADA в бронхоальвеолярной лаважной жидкости, в спинномозговой жидкости, может использоваться в качестве диагностического инструмента у детей, страдающих туберкулезным менингитом [67]. Повышение уровня АDА в перечисленных ситуациях связано с преимущественным повышением активности экто-ADA2. В частности, дифференциальная диагностика больных туберкулезом и раком легких облегчается тем, что у больных ТБ активность и содержание ADA2 в исследуемых жидкостях выше, чем ADA1 [41]. Снижение общей активности ADA после успешного лечения также в основном связано с уменьшением активности ADA2 [3, 61]. Для определения причин появления плеврального выпота эффективно также исследование активности щелочной фосфатазы (ЩФ), поскольку у больных ТБ уровень активности ЩФ в мокроте гораздо выше, чем у больных раком легких [66].
Аденилциклаза является одним из важнейших факторов вирулентности бактериальных патогенов. Этот фермент обеспечивает синтез циклического аденозинмонофосфата (цАМФ) из АТФ. Одна из функций цАМФ, поступающего из Mtb, заключается в предотвращении слияния фагосом и лизосом [82, 95]. цАМФ из Mtb также влияет на передачу сигналов в клетках-хозяевах.
Приведенные данные свидетельствуют, что изучение активности ферментов пуринергического пути у больных ТБ дает важную информацию о ходе воспалительного процесса, помогает в дифференциальной диагностике и прогнозировании течения заболевания. Возможно, информация о различиях между структурами ферментов пуринергического метаболизма человека и Mtb может быть использована для разработки новых лекарственных препаратов. Например, активные сайты аденозинкиназы (АДК) Mtb биохимически и структурно отличаются от других известных АДК [77]. Это позволяет рассматривать этот фермент как мишень для разработки новых препаратов, блокирующих метаболические процессы в Mtb [78]. Другими мишенями могут стать ферменты нуклеозиддифосфаткиназа (NDPK) и АТФаза Mtb [92, 118, 119]. Активность растворимой NDPK Mtb связана с появлением цитотоксичности по отношению к макрофагам, гибель клеток в этом случае опосредована активацией P2X-рецепторов [33]. Предполагают, что скрининг на нетоксичные ингибиторы ферментов NDPK и АТФазы может быть успешным, поскольку специфические домены этих ферментов в достаточной степени отличаются от ферментов хозяина, и процесс их ингибирования может быть достаточно специфичным по отношению к ферментам патогенов. Такие ингибиторы будут тестироваться на использование в качестве лекарств, возможно, в сочетании с другими антибактериальными препаратами, блокирующими синтез структур клеточной стенки, таких как полисахариды или миколиновая кислота [117].
ЗАКЛЮЧЕНИЕ
Многочисленные исследования показали, что Mtb могут ускользать от иммунного ответа с помощью различных механизмов. Одним из этих механизмов является использование Mtb пуринергических сигнальных путей и пуриновых медиаторов, которые контролируют большинство физиологических и патологических состояний. Приведенные в обзоре данные свидетельствуют, что Mtb прямо и косвенно задействованы в изменении/нарушении пуринергической регуляции как внутри инфицированной клетки, так и межклеточных пуринергических сигналах, что изменяет состояние тканеспецифичных клеток и клеток иммунной системы. Однако нельзя не признать, что имеющиеся данные все еще фрагментарны и не раскрывают всей картины сложных наложений и интерференции пуринергических сигналов макро- и микроорганизма. При получении более детальных знаний о влиянии Mtb на изменение внутриклеточной и тканевой пуринергической регуляции можно ожидать выявления новых мишеней для разработки противотуберкулезных препаратов, создания новых методов противовоспалительной терапии при ТБ и новых противотуберкулезных вакцинных препаратов в будущем.
Список литературы
Баласанянц Г.С., Титаренко О.Т., Дьякова М.Е. Диагностическое и прогностическое значение определения АДА у больных острым прогрессирующим туберкулезом легких // Проблемы туберкулеза. 2001. № 8. С. 46–49. https://www.elibrary.ru/item.asp?id=29714500
Гурьева О.И., Аксенова В.А. Диагностическое значение определения активности аденозиндезаминазы для раннего выявления туберкулезного лимфаденита у детей и подростков // Дальневосточный медицинский журн. 2011. № 3. URL: https://cyberleninka.ru/article/n/diagnosticheskoe-znachenie-opredeleniya-aktivnosti-adenozindezaminazy-dlya-rannego-vyyavleniya-tuberkuleznogo-limfadenita-u-detey-i
Дьякова М.Е., Алексеева Н.П., Эсмедляева Д.С. и др. Динамика показателей функциональной активности лейкоцитов у больных инфильтративным туберкулезом легких // Мед Альянс. 2018. № 2. С. 34–41. https://www.elibrary.ru/contents.asp?id=35259977
Краснов В., Зенков Н.К., Колпаков А.Р. и др. Активированные кислородные метаболиты при туберкулезе // Проблемы туберкулеза и болезней легких. 2005. V. 92(9). P. 9–17. https://www.elibrary.ru/item.asp?id=21198462
Сахно Л.В., Хонина Н.А., Норкина О.В. и др. Участие оксида азота в развитии туберкулезной анергии у больных туберкулезом легких // Проблемы туберкулеза. 2001. V. 78(8). С. 42–46. https://www.elibrary.ru/item.asp?id=36778497
Соловьева И.А., Собко Е.А., Крапошина А.Ю. и др. Современные представления о роли CD38 в патогенезе бронхиальной астмы // Пульмонология. 2013. (5). 81–84. https://doi.org/10.18093/0869-0189-2013-0-5-81-84
Стрелис А., Новицкий В.В., Уразова О.И. и др. Продукция оксида азота мононуклеарами крови у больных лекарственно-чувствительным и лекарственно-устойчивым туберкулезом легких // Бюллетень сибирской медицины. 2006. V. 5(4). P. 57–61. https://doi.org/10.20538/1682-0363-2006-4-57-61
Титаренко О.Т., Дьякова М.Е., Маничева О.А. и др. Биологические свойства Mycobacterium tuberculosis и характеристика воспалительного ответа при инфильтративном туберкулезе легких // Инфекция и иммунитет. 2014. Т. 4. № 3. С. 221–228. https://www.elibrary.ru/item.asp?id=22257477
Abbracchio M.P., Jacobson K.A., Müller C.E. et al. Professor Dr. Geoffrey Burnstock (1929–2020) // Purinergic Signal. 2020. V. 16. P. 137–149. https://doi.org/10.1007/s11302-020-09709-y
Adekambi T., Ibegbu C.C., Cagle S. et al. Biomarkers on patient T cells diagnose active tuberculosis and monitor treatment response // J. Clin. Invest. 2015. V. 125(5). P. 1827–1838. https://doi.org/10.1172/JCI77990
Amaral E.P., Ribeiro S.C., Lanes V.R. et al. Pulmonary infection with hypervirulent Mycobacteria reveals a crucial role for the P2X7 receptor in aggressive forms of tuberculosis // PLoS Pathog. 2014. V. 10(7). P. e1004188. https://doi.org/10.1371/journal.ppat.1004188
Andries K., Verhasselt P., Guillemont J. et al. A diarylquinoline drug active on the ATP synthase of Mycobacterium tuberculosis // Science. 2005. V. 307(5707). P. 223–227. https://doi.org/10.1126/science.1106753
Antonioli L., Pacher P., Vizi E.S., Haskó G. CD39 and CD73 in immunity and inflammation // Trends Mol. Med. 2013. V. 19(6). P. 355–367. https://doi.org/10.1016/j.molmed.2013.03.005
Antonioli L., Fornai M., Blandizzi C. et al. Adenosine signaling and the immune system: When a lot could be too much // Immunol. Let. 2019. V. 205. P. 9–15. https://doi.org/10.1016/j.imlet.2018.04.006
Antonioli L., Giron M.C., Colucci R. et al. Involvement of the P2X7 purinergic receptor in colonic motor dysfunction associated with bowel inflammation in rats // PloS one. 2014. V. 9(12). P. e116253. https://doi.org/10.1371/journal.pone.0116253
Bai A., Moss A., Rothweiler S. et al. NADH oxidase-dependent CD39 expression by CD8+ T cells modulates interferon gamma responses via generation of adenosine // Nat. Commun. 2015. V. 6(1). P. 1–12. https://doi.org/10.1038/ncomms9819
Banerjee R.K. Ecto-ATPase // Mol. Cel. Biochem. 1981. V. 37(2). P. 91–99. https://doi.org/10.1007/BF02354932
Bentata K., Berrabah Y., Benahmed M. The Impact of the Clinician Group Discussion in the Management of Extrapulmonary Tuberculosis in Developing Countries; A Comparative Cohort Study // C53. Global Experiences in TB and NTM care. 2020, American Thoracic Society. P. A5445–A5445. https://www.atsjournals.org/doi/book/10.1164/ajrccm-conference.2020.C53
Boer M.C., van Meijgaarden K.E., Bastid J. et al. CD 39 is involved in mediating suppression by Mycobacterium bovis BCG-activated human CD 8+ CD 39+ regulatory T cells // Eur. J. Immunol. 2013. V. 43(7). P. 1925–1932. https://doi.org/10.1002/eji.201243286
Bomfim C.C.B., Amaral E.P., Cassado A.D.A. et al. P2X7 receptor in bone marrow-derived cells aggravates tuberculosis caused by hypervirulent Mycobacterium bovis // Front. Immunol. 2017. V. 13(8). P. 435. https://doi.org/10.3389/fimmu.2017.00435
BoseDasgupta S., Pieters J. Macrophage-microbe interaction: lessons learned from the pathogen Mycobacterium tuberculosis / Semin. Immunopathol. 2018. V. 40(6). P. 577–591. https://doi.org/10.1007/s00281-018-0710-0
Bouchonnet F., Boechat N., Bonay M., Hance A.J. Alpha/beta interferon impairs the ability of human macrophages to control growth of Mycobacterium bovis BCG // Infect. Immun. 2002. V. 70(6). P. 3020–3025. https://doi.org/10.1128/iai.70.6.3020-3025.2002
Bours M.J., Dagnelie P.C., Giuliani A.L. et al. P2 receptors and extracellular ATP: a novel homeostatic pathway in inflammation // Front. Biosci. (Schol Ed.). 2011. V .3. P. 1443–1456. https://doi.org/10.2741/235
Brüne B., A. von Knethen A., Sandau K.B. Nitric oxide and its role in apoptosis // Eur. J. Pharmacol. 1998. V. 351(3). P. 261–272. https://doi.org/10.1016/s0014-2999(98)00274-x
Burnstock G. Introduction to Purinergic Signaling // Methods Mol. Biol. 2020. V. 2041. P. 1–15. https://doi.org/10.1007/978-1-4939-9717-6_1
Burnstock G. Purinergic nerves. // Pharmacol Rev. 1972. V. 24(3). P. 509–81. PMID: .4404211
Burnstock G., Arnett T.R., Orriss I.R. Purinergic signalling in the musculoskeletal system. // Purinergic signal. 2013. V. 9(4). P. 541–572. https://doi.org/10.1007/s11302-013-9381-4
Burnstock G., Boeynaems J.-M. Purinergic signalling and immune cells // Purinergic signal. 2014. V. 10(4). P. 529–564. https://doi.org/10.1007/s11302-014-9427-2
Chen M., Gan H., Remold H.G. A mechanism of virulence: virulent Mycobacterium tuberculosis strain H37Rv, but not attenuated H37Ra, causes significant mitochondrial inner membrane disruption in macrophages leading to necrosis // J. Immunol. 2006. V. 176(6). P. 3707–3716. https://doi.org/10.4049/jimmunol.176.6.3707
Chi D.S., Neumann J.K., Mota-Marquez M., Dubberley F.A. Effects of acute stress on lymphocyte beta 2-adrenoceptors in white males // J. Psychosom. Res. V. 1993. V. 37(7). P. 763–770. https://doi.org/10.1016/0022-3999(93)90105-o
Chi D.S., Qui M., Krishnaswamy G. et al. Regulation of nitric oxide production from macrophages by lipopolysaccharide and catecholamines // Nitric Oxide. 2003. V. 8(2). P. 127–132. https://doi.org/10.1016/s1089-8603(02)00148-9
Chiacchio T., Casetti R., Butera O. et al. Characterization of regulatory T cells identified as CD4+ CD25highCD39+ in patients with active tuberculosis // Clin. Exp. Immunol. 2009. V. 156(3). P. 463–470. https://doi.org/10.1111/j.1365-2249.2009.03908.x
Chopra P., Singh A., Koul A. et al. Cytotoxic activity of nucleoside diphosphate kinase secreted from Mycobacterium tuberculosis // Eur. J. Biochem. 2003. V. 270(4). P. 625–634.
Clarke L., Boucher R. Chloride secretory response to extracellular ATP in human normal and cystic fibrosis nasal epithelia // Am. J. Physiol. 1992. V. 263(2 Pt 1). P. C348–C356. https://doi.org/10.1152/ajpcell.1992.263.2.C348
Cohn D.L. Use of the bacille Calmette-Guerin vaccination for the prevention of tuberculosis: renewed interest in an old vaccine // Am. J. Med. Sci. 1997. V. 313(6). P. 372–376. https://doi.org/10.1097/00000441-199706000-00010
Coleman J.W. Nitric oxide in immunity and inflammation // Int. Immunopharmacol. 2001. V. 1(8). P. 1397–1406. https://doi.org/10.1016/s1567-5769(01)00086-8
Danial N.N., Korsmeyer S.J. Cell death: critical control points // Cell. 2004. V. 116(2). P. 205–219. https://doi.org/10.1016/s0092-8674(04)00046-7
Davies A.O. Lefkowitz R.J. Agonist-promoted high affinity state of the β-adrenergic receptor in human neutrophils: modulation by corticosteroids // J. Clin. Endocrinol. Metab. 1981. V. 53(4). P. 703–708. https://doi.org/10.1210/jcem-53-4-703
Di Virgilio F., Dal Ben D., Sarti A.C., Giuliani A.L., Falzoni S. The P2X7 receptor in infection and inflammation. // Immunity. 2017. V. 47(1). P. 15–31. https://doi.org/10.1016/j.immuni.2017.06.020
Di Virgilio F., Falzoni S., Giuliani A.L., Adinolfi E. P2 receptors in cancer progression and metastatic spreading // Curr Opin. Pharmacol. 2016. V. 29. P. 17–25. https://doi.org/10.1016/j.coph.2016.05.001
Dimakou K., Hillas G., Bakakos P. Adenosine deaminase activity and its isoenzymes in the sputum of patients with pulmonary tuberculosis // Int. J. Tuberc. Lung. Dis. 2009. V. 13(6). P. 744–748. PMID: .19460251
Dove S.L., Darst S.A., Hochschild A. Region 4 of σ as a target for transcription regulation // Mol. Microbiol. 2003. V. 48(4). P. 863–874. https://doi.org/10.1046/j.1365-2958.2003.03467.x
Edwards F.A., Gibb A.J., Colquhoun D. ATP receptor-mediated synaptic currents in the central nervous system. Nature. 1992. V. 359(6391). P. 144–147. https://doi.org/10.1038/359144a0
Eltzschig H.K., Sitkovsky M.V., Robson S.C. Purinergic signaling during inflammation // N. Engl. J. Med. 2012. V. 367(24). P. 2322–2333. https://doi.org/10.1056/NEJMra1205750
Evans R.J., Derkach V., Surprenant A. ATP mediates fast synaptic transmission in mammalian neurons // Nature. 1992. V. 357(6378). P. 503–505. https://doi.org/10.1038/357503a0
Fairbairn I.P., Stober C.B., Kumararatne D.S., Lammas D.A. ATP-mediated killing of intracellular mycobacteria by macrophages is a P2X7-dependent process inducing bacterial death by phagosome-lysosome fusion // J. Immunol. 2001. V. 167(6). P. 3300–3307. https://doi.org/10.4049/jimmunol.167.6.3300
Fernando S.L., Saunders B.M., Sluyter R. et al. A polymorphism in the P2X7 gene increases susceptibility to extrapulmonary tuberculosis // Am. J. Respir. Crit. Care Med. 2007. V. 175(4). P. 360–366. https://doi.org/10.1164/rccm.200607-970OC
Flesch I., Kaufmann S. Mechanisms involved in mycobacterial growth inhibition by gamma interferon-activated bone marrow macrophages: role of reactive nitrogen intermediates // Infect. Immun. 1991. V. 59(9). P. 3213–3218. https://doi.org/10.1128/IAI.59.9.3213-3218.1991
Formentini L., Santacatterina F., Núñez de Arenas C. et al. Mitochondrial ROS production protects the intestine from inflammation through functional M2 macrophage polarization // Cell Rep. 2017. V. 19(6). P. 1202–1213. https://doi.org/10.1016/j.celrep.2017.04.036
Förstermann U., Sessa W.C. Nitric oxide synthases: regulation and function // Eur. Heart J. 2012. V. 33(7). P. 829–837. https://doi.org/10.1093/eurheartj/ehr304
Franco R., Casadó V., Ciruela F. et al. Cell surface adenosine deaminase: much more than an ectoenzyme // Prog. Neurobiol. 1997. V. 52(4). P. 283–294. https://doi.org/10.1016/s0301-0082(97)00013-0
Frasca L., Fedele G., Deaglio S. et al. CD38 orchestrates migration, survival, and Th1 immune response of human mature dendritic cells // Blood. 2006. V. 107(6). V. 2392–2399. https://doi.org/10.1182/blood-2005-07-2913
Frasson A.P., Menezes C.B., Goelzer G.K. et al. Adenosine reduces reactive oxygen species and interleukin-8 production by Trichomonas vaginalis-stimulated neutrophils // Purinergic signal. 2017. V. 13(4). P. 569–577. https://doi.org/10.1007/s11302-017-9584-1
Gan H., He X., Duan L. et al. Enhancement of antimycobacterial activity of macrophages by stabilization of inner mitochondrial membrane potential // J. Infect. Dis. 2005. V. 191(8). P. 1292–1300. https://doi.org/10.1086/428906
Giuliani A.L., Sarti A.C., Di Virgilio F. Extracellular nucleotides and nucleosides as signalling molecules // Immunol. lett. 2019. V. 205. P. 16–24. https://doi.org/10.1016/j.imlet.2018.11.006
Gonzalez-Angulo Y., Wiysonge C.S., Geldenhuys H. et al. Sputum induction for the diagnosis of pulmonary tuberculosis: a systematic review and meta-analysis // Eur. J. Clin. Microbiol. Infect. Dis. 2012. V. 31. P. 1619–1630. https://doi.org/10.1007/s10096-011-1485-6.4
Gordon S. The role of the macrophage in immune regulation // Res. Immunol. 1998. V. 149(7–8). P. 685–688. https://doi.org/10.1016/s0923-2494(99)80039-x
Greenberg S.S., Xie J., Kolls J. et al. Rapid induction of mRNA for nitric oxide synthase II in rat alveolar macrophages by intratracheal administration of Mycobacterium tuberculosis and Mycobacterium avium // Proc. Soc. Exp. Biol. Med. 1995. V. 209(1). P. 46–53. https://doi.org/10.3181/00379727-209-43876
Haagsma A.C., Driessen N.N., Hahn M.M. et al. ATP synthase in slow- and fast-growing mycobacteria is active in ATP synthesis and blocked in ATP hydrolysis direction // FEMS Microbiol. Lett. 2010. V. 313(1). P. 68–74. https://doi.org/10.1111/j.1574-6968.2010.02123.x
Hagenlocker B.E, Walker B.A., Ward P.A. Superoxide responses of immune complex-stimulated rat alveolar macrophages. Intracellular calcium and priming // J. Immunol. 1990. V. 144(10). P. 3898–3906. PMID: .2159036
Haro M., Ruiz Manzano J., Morera J. et al. Analysis of 90 cases of pleural tuberculosis in relation to adenosine deaminase levels // Med. Clin. (Barc). 1997. V. 108(12). P. 452–454. PMID: .9235414
Haskó G., Linden J., Cronstein B., Pacher P. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases // Nat. Rev. Drug. Discov. 2008. V. 7(9). P. 759–770. PMID: https://doi.org/10.1038/nrd263818758473
Haskó, G., Pacher P. A2A receptors in inflammation and injury: lessons learned from transgenic animals // J. Leuk. Biol. 2008. V. 83(3). P. 447–455. https://doi.org/10.1189/jlb.0607359
Higashida H., Salmina A.B., Olovyannikova R.Y. et al. Cyclic ADP-ribose as a universal calcium signal molecule in the nervous system // Neurochem. Int. 2007. V. 51(2–4). P. 192–199. https://doi.org/10.1016/j.neuint.2007.06.023
Idzko M., Ferrari D., Eltzschig H.K. Nucleotide signalling during inflammation // Nature. 2014. V. 509(7500). P. 310–317. https://doi.org/10.1038/nature13085
Jadhav A.A., Jain A. Sputum adenosine deaminase and alkaline phosphatase activity in pulmonary tuberculosis // Arch. Physiol. Biochem. 2012. V. 118(1). P. 6–9. https://doi.org/10.3109/13813455.2011.645545
Jakka S., Veena S., Rao A.R., Eisenhut M. Cerebrospinal fluid adenosine deaminase levels and adverse neurological outcome in pediatric tuberculous meningitis // Infection. 2005. V. 33(4). P. 264–266. https://doi.org/10.1007/s15010-005-5005-4
Jamwal S., Midha M.K., Verma H.N. et al. Characterizing virulence-specific perturbations in the mitochondrial function of macrophages infected with Mycobacterium tuberculosis // Scic reports. 2013. V. 3(1). P. 1–10. https://doi.org/10.1038/srep01328
Kaljas Y., Liu C., Skaldin M. et al. Human adenosine deaminases ADA1 and ADA2 bind to different subsets of immune cells // Cell. Mol. Life Sci. 2017. V. 74(3). P. 555–570. https://doi.org/10.1007/s00018-016-2357-0
Kälvegren H., Fridfeldt J., Bengtsson T. The role of plasma adenosine deaminase in chemoattractant-stimulated oxygen radical production in neutrophils // Eur. J. Cell. Biol. 2010. V. 89(6). P. 462–467. https://doi.org/10.1016/j.ejcb.2009.12.004
Kim K.C., Lee B.C. P2 purinoceptor regulation of mucin release by airway goblet cells in primary culture // Br. J. Pharmacol. 1991. V. 103(1). P. 1053–1056. https://doi.org/10.1111/j.1476-5381.1991.tb12299.x
Knapp S., Leemans J.C., Florquin S., Branger J. et al. Alveolar macrophages have a protective antiinflammatory role during murine pneumococcal pneumonia // Am. J. Respir. Crit. Care Med. 2003. V. 167(2). P. 171–179. https://doi.org/10.1164/rccm.200207-698OC
Kusner D.J., Adams J. ATP-induced killing of virulent Mycobacterium tuberculosis within human macrophages requires phospholipase D // J. Immunol. 2000. V. 164(1). P. 379–388. https://doi.org/10.4049/jimmunol.164.1.379
Lammas D.A., Stober C., Harvey C.J., Kendrick N. ATP-induced killing of mycobacteria by human macrophages is mediated by purinergic P2Z (P2X7) receptors // Immunity. 1997. V. 7(3). P. 433–444. https://doi.org/10.1016/s1074-7613(00)80364-7
Ledent C., Vaugeois J.M., Schiffmann S.N. et al. Aggressiveness, hypoalgesia and high blood pressure in mice lacking the adenosine A 2a receptor // Nature. 1997. V. 388(6643). P. 674–678. https://doi.org/10.1038/41771
Lee W.L., Gold B., Darby C. et al. Mycobacterium tuberculosis expresses methionine sulphoxide reductases A and B that protect from killing by nitrite and hypochlorite // Mol. Microbiol. 2009. V. 71(3). P. 583–593. https://doi.org/10.1111/j.1365-2958.2008.06548.x
Long M.C., Escuyer V., Parker W.B. Identification and characterization of a unique adenosine kinase from Mycobacterium tuberculosis // J. Bacteriol. 2003. V. 185(22). P. 6548–6555. https://doi.org/10.1128/jb.185.22.6548-6555.2003
Long M.C., Shaddix S.C., Moukha-Chafiq O. et al. Structure–activity relationship for adenosine kinase from Mycobacterium tuberculosis: II. Modifications to the ribofuranosyl moiety // Biochemi. Pharmacol. 2008. V. 75(8). P.1588–1600.
Lu P., Lill H., Bald D. ATP synthase in mycobacteria: special features and implications for a function as drug target // Biochim. Biophys. Acta. 2014. V. 1837(7). P. 1208–1218. https://doi.org/10.1016/j.bbabio.2014.01.022
Malavasi F., Deaglio S., Ferrero E. et al. CD38 and CD157 as receptors of the immune system: a bridge between innate and adaptive immunity // Mol. Med. 2006. V. 12(11). P. 334–341.
Mason S., Paradiso A., Boucher R. Regulation of transepithelial ion transport and intracellular calcium by extracellular ATP in human normal and cystic fibrosis airway epithelium // Br. J. Pharmacol. 1991. V. 103(3). P. 1649–1656. https://doi.org/10.1111/j.1476-5381.1991.tb09842.x
Masure H.R., Shattuck R.L., Storm D.R. Mechanisms of bacterial pathogenicity that involve production of calmodulin-sensitive adenylate cyclases // Microbiol. Rev. 1987. V. 51(1). P. 60. PMID: .2882409
Mempin R., Tran H., Chen C. et al. Release of extracellular ATP by bacteria during growth // BMC Microbiol. 2013. V. 13(1). P. 1–13. https://doi.org/10.1186/1471-2180-13-301
Mishra B.B., Rathinam V.A., Martens G.W. et al. Nitric oxide controls the immunopathology of tuberculosis by inhibiting NLRP3 inflammasome–dependent processing of IL-1β // Nature immunology. 2013. V. 14(1). P. 52–60. https://doi.org/10.1038/ni.2474
Mishra B.B., Lovewell R.R., Olive A.J. et al. Nitric oxide prevents a pathogen-permissive granulocytic inflammation during tuberculosis // Nat. Microbiol. 2017. V. 2(7). P. 1–11. https://doi.org/10.1038/nmicrobiol.2017.72
Molloy A., Laochumroonvorapong P., Kaplan G. Apoptosis, but not necrosis, of infected monocytes is coupled with killing of intracellular bacillus Calmette-Guérin // J. Exp. Med. 1994. V. 180(4). P. 1499–1509. https://doi.org/10.1084/jem.180.4.1499
Monastra G., Secchi E.F. β-Adrenergic receptors mediate in vivo the adrenaline inhibition of lipopolysaccharide-induced tumor necrosis factor release // Immunol. Lett. 1993. V. 38(2). P. 127–130. https://doi.org/10.1016/0165-2478(93)90177-4
Omar S.A., Webb A.J. Nitrite reduction and cardiovascular protection // J. Mol. Cell Cardiol. 2014. V. 73. P. 57–69. https://doi.org/10.1016/j.yjmcc.2014.01.012
Ortega E., Garcia J., De la Fuente M. Modulation of adherence and chemotaxis of macrophages by norepinephrine. Influence of ageing // Mol. Cel. Biochem. 2000. V. 203(1–2). P. 113–117. https://doi.org/10.1023/a:1007094614047
Petit-Jentreau L., Tailleux L., Coombes J.L. Purinergic signaling: a common path in the macrophage response against Mycobacterium tuberculosis and Toxoplasma gondii // Front. Cell Infect. Microbiol. 2017. V. 7. P. 347. https://doi.org/10.3389/fcimb.2017.00347
Placido R., Auricchio G., Falzoni S. et al. P2X7 purinergic receptors and extracellular ATP mediate apoptosis of human monocytes/macrophages infected with Mycobacterium tuberculosis reducing the intracellular bacterial viability // Cell Immunol. 2006. V. 244(1). P. 10–18. https://doi.org/10.1016/j.cellimm.2007.02.001
Punj V., Zaborina O., Dhiman N. et al. Phagocytic cell killing mediated by secreted cytotoxic factors of Vibrio cholera // Infect. Immun. 2000. V. 68(9). P. 4930–4937. https://doi.org/10.1128/iai.68.9.4930-4937.2000
Ramachandra L., Qu Y., Wang Y., Lewis C.J. et al. Mycobacterium tuberculosis synergizes with ATP to induce release of microvesicles and exosomes containing major histocompatibility complex class II molecules capable of antigen presentation // Infect. Immune. 2010. V. 78(12). P. 5116–5125. https://doi.org/10.1128/IAI.01089-09
Rao M., Streur T.L., Aldwell F.E. et al. Intracellular pH regulation by Mycobacterium smegmatis and Mycobacterium bovis BCG // Microbiology (Reading). 2001. V. 147(4). P. 1017–1024. https://doi.org/10.1099/00221287-147-4-1017
Reddy S.K., Kamireddi M., Dhanireddy K. et al. Eukaryotic-like Adenylyl Cyclases in Mycobacterium tuberculosis H37Rv: cloning and characterization // J. Biol. Chem. 2001. V. 276(37). P. 35141–35149. https://doi.org/10.1074/jbc.M104108200
Reutershan J., Vollmer I., Stark S. et al. Adenosine and inflammation: CD39 and CD73 are critical mediators in LPS-induced PMN trafficking into the lungs // The FASEB J. 2009. V. 23(2). P. 473–482. https://doi.org/10.1096/fj.08-119701
Riou C., Gray C.M., Lugongolo M. et al. A subset of circulating blood mycobacteria-specific CD4 T cells can predict the time to Mycobacterium tuberculosis sputum culture conversion // PloS one, 2014. V. 9(7). e102178. https://doi.org/10.1371/journal.pone.0102178
Rodrigues D.S., Medeiros E.A., Weckx L.Y. et al. Immunophenotypic characterization of peripheral T lymphocytes in Mycobacterium tuberculosis infection and disease // Clin. Exp. Immunol. 2002. V. 128(1). P. 149–154. https://doi.org/10.1046/j.1365-2249.2002.01809.x
Romagnoli A., Etna MP, Giacomini E. et al. ESX-1 dependent impairment of autophagic flux by Mycobacterium tuberculosis in human dendritic cells // Autophagy. 2012. V. 8(9). P. 1357–1370. https://doi.org/10.4161/auto.20881
Salmina A.B., Noda M., Higashida H. ADP-ribosyl cyclase as a therapeutic target for central nervous system diseases// Cent. Nerv. Syst. Agents. Med. Chem. (Formerly Curr Med. Chem-Central Nervous System Agents), 2006. V. 6(3). P. 193–210. https://doi.org/10.2174/187152406778226699
Salvatore C.A., Tilley S.L., Latour A.M. Disruption of the A3 adenosine receptor gene in mice and its effect on stimulated inflammatory cells // J. Biol. Chem. 2000. V. 275(6). P. 4429–4434. https://doi.org/10.1074/jbc.275.6.4429
Sánchez de Miguel L., Arriero M.M., Farré J. et al. Nitric oxide production by neutrophils obtained from patients during acute coronary syndromes: expression of the nitric oxide synthase isoforms // J. Am. Coll. Cardiol. 2002. V. 39(5). P. 818–825. https://doi.org/10.1016/s0735-1097(01)01828-9
Santos-Argumedo L. CD38 Encyclopedia of Signaling Molecules, S. Choi, Editor. 2018, Springer International Publishing: Cham. P. 869–877. ISBN 978-3-319-67198-7.
Scanga C.A., Mohan V.P., Tanaka K. et al. The inducible nitric oxide synthase locus confers protection against aerogenic challenge of both clinical and laboratory strains of Mycobacterium tuberculosis in mice // Infect. Immun. 2001. V. 69(12). P. 7711–7717. https://doi.org/10.1128/IAI.69.12.7711-7717.2001
Shui W., Gilmore S.A., Sheu L. et al. Quantitative proteomic profiling of host – pathogen interactions: the macrophage response to Mycobacterium tuberculosis lipids // J. Proteome Res. 2009. V. 8(1). P. 282–289. https://doi.org/10.1021/pr800422e
Sitkovsky M.V., Ohta A. The ‘danger’sensors that STOP the immune response: the A2 adenosine receptors? // Trends Immunol. 2005. V. 26(6). P. 299–304. https://doi.org/10.1016/j.it.2005.04.004
Sturgill-Koszycki S., Schlesinger PH, Chakraborty P. et al. Lack of acidification in Mycobacterium phagosomes produced by exclusion of the vesicular proton-ATPase // Science. 1994. V. 263(5147). P. 678–681. https://doi.org/10.1126/science.8303277
Sun D., Samuelson L.C., Yang T. et al. Mediation of tubuloglomerular feedback by adenosine: evidence from mice lacking adenosine 1 receptors // Proc. Natl. Acad. Sci. USA. 2001. V. 98(17). P. 9983–9988. https://doi.org/10.1073/pnas.171317998
Ting L.-M., Kim A.C., Cattamanchi A., Ernst J.D. Mycobacterium tuberculosis inhibits IFN-γ transcriptional responses without inhibiting activation of STAT1 // J. Immunol. 1999. V. 163(7). P. 3898–3906. PMID: .10490990
Tsuda M., Tozaki-Saitoh H., Inoue K. Pain and purinergic signaling // Brain. Res. Rev. 2010. V. 63(1–2). P. 222–232. https://doi.org/10.1016/j.brainresrev.2009.11.003
Vandal O.H., Roberts J.A., Odaira T. et al. Acid-susceptible mutants of Mycobacterium tuberculosis share hypersusceptibility to cell wall and oxidative stress and to the host environment // J. Bacteriol. 2009. V. 191(2). P. 625–631. https://doi.org/10.1128/JB.00932-08
Wang J., Peng Y., Sun Y.W. et al. All-trans retinoic acid induces XAF1 expression through an interferon regulatory factor-1 element in colon cancer // Gastroenterology. 2006. V. 130(3). P. 747–758. https://doi.org/10.1053/j.gastro.2005.12.017
Wang X., Chen D. Purinergic regulation of neutrophil function // Front. Immunol., 2018. V. 9. P. 399. https://doi.org/10.3389/fimmu.2018.00399
Warburton D., Buckley S., Cosico L. P1 and P2 purinergic receptor signal transduction in rat type II pneumocytes // J. Appl. Physiol. 1989. V. 66(2). P. 901–905. https://doi.org/10.1152/jappl.1989.66.2.901
World-Health-Organization. https://www.who.int/news-room/fact-sheets/detail/tuberculosis. 2020.
Yamasaki M., Churchill G.C., Galione A. Calcium signalling by nicotinic acid adenine dinucleotide phosphate (NAADP) // FEBS J. 2005. V. 272(18). P. 4598–4606. https://doi.org/10.1111/j.1742-4658.2005.04860.x
Young D.B., Duncan K. Prospects for new interventions in the treatment and prevention of mycobacterial disease // Annu Rev. Microbiol. 1995. V. 49(1). P. 641–673. https://doi.org/10.1146/annurev.mi.49.100195.003233
Zaborina O., Misra N., Kostal J. et al. P2Z-independent and P2Z receptor-mediated macrophage killing by Pseudomonas aeruginosa isolated from cystic fibrosis patients // Infect. Immun. 1999. V. 67(10). P. 5231–5242. https://doi.org/10.1128/IAI.67.10.5231-5242.1999
Zaborina O., Li X., Cheng G. et al. Secretion of ATP-utilizing enzymes, nucleoside diphosphate kinase and ATPase, by Mycobacterium bovis BCG: sequestration of ATP from macrophage P2Z receptors? // Mol. Microbiol. 1999. V. 31(5). P. 1333–1343. https://doi.org/10.1046/j.1365-2958.1999.01240.x
Zarrinmayeh H., Territo P.R. Purinergic Receptors of the Central Nervous System: Biology, PET Ligands, and Their Applications // Mol. Imaging. 2020 V. 19. P. 1536012120927609. https://doi.org/10.1177/1536012120927609
Zavialov A.V., Engström Å. Human ADA2 belongs to a new family of growth factors with adenosine deaminase activity // Biochem. J. 2005. V. 391(Pt 1). P. 51–57. https://doi.org/10.1042/BJ20050683
Zavialov A.V., Gracia E., Glaichenhaus N. et al. Human adenosine deaminase 2 induces differentiation of monocytes into macrophages and stimulates proliferation of T helper cells and macrophages // J. Leukoc. Biol. 2010. V. 88(2). P. 279–290. https://doi.org/10.1189/jlb.1109764
Zimmermann H. Ectonucleotidases: some recent developments and a note on nomenclature // Drug. Dev. Res. 2001. V. 52(1–2). P. 44–56. https://doi.org/10.1002/ddr.1097
Zimmermann H. Braun N. Ecto-nucleotidases–molecular structures, catalytic properties, and functional roles in the nervous system. Prog. Brain Res. 1999, Elsevier. P. 371–385. https://doi.org/10.1016/S0079-6123(08)63570-0
Zubiaur M., Fernández O., Ferrero E. et al. CD38 is associated with lipid rafts and upon receptor stimulation leads to Akt/protein kinase B and Erk activation in the absence of the CD3-ζ immune receptor tyrosine-based activation motifs // J. Biol. Chem. 2002. V. 277(1). P. 13–22. https://doi.org/10.1074/jbc.M107474200
Zulauf K.E., Sullivan J.T., Braunstein M. The SecA2 pathway of Mycobacterium tuberculosis exports effectors that work in concert to arrest phagosome and autophagosome maturation // PLoS pathog. 2018. V. 14(4). e1007011. https://doi.org/10.1371/journal.ppat.1007011
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


