Успехи физиологических наук, 2022, T. 53, № 1, стр. 76-87
Принципы регуляции стационарно функционирующих систем метаболизма
Ф. И. Атауллаханов a, b, c, d, e, М. В. Мартынов a, С. В. Комарова f, В. М. Витвицкий a, *
a Центр теоретических проблем физико-химической фармакологии, РАН
109029 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
c Московский физико-технический институт
141701 Московская обл., г. Долгопрудный, Россия
d University of Pennsylvania (UPENN)
PA 19104 Philadelphia, USA
e Центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева
117997 Москва, Россия
f Faculty of Dentistry, McGill University
Montreal, Quebec, Canada
* E-mail: victor_vitvitsky@yahoo.com
Поступила в редакцию 30.09.2021
После доработки 04.10.2021
Принята к публикации 11.10.2021
- EDN: TWRQUQ
- DOI: 10.31857/S0301179822010039
Аннотация
В работе, на примере эритроцитов человека, обсуждаются механизмы метаболической регуляции, обеспечивающие гомеостаз в энергетическом метаболизме клетки. Показано, что скорость гликолиза определяется скоростью АТФ-потребляющих процессов. АТФ ингибирует, а АМФ активирует гликолиз, обеспечивая уменьшение скорости гликолиза с ростом [АТФ]. Важную роль в регуляции гликолиза в клетке играет аденилаткиназа, обеспечивающая сильный рост [АМФ] при уменьшении [АТФ]. Участие в регуляции гликолиза АТФ и АМФ, связанных аденилаткиназным равновесием, приводит к тому, что фактически скорость гликолиза зависит не от абсолютных концентраций АТФ и АМФ, а от относительной концентрации АТФ или от энергетического заряда клетки. Резкое снижение скорости гликолиза с ростом энергетического заряда клетки в области его физиологических значений обеспечивает стабилизацию энергетического заряда при активации потребления АТФ. Обсуждаются условия устойчивости стационарных состояний и возникновения бифуркаций в энергетическом метаболизме клетки.
ВВЕДЕНИЕ
В данной работе мы рассматриваем основные принципы и закономерности регуляции биологических систем, функционирующих в клетке стационарно. К таким системам относятся метаболические системы, обеспечивающие жизнеспособность клеток за счет снабжения их энергией, защиты от окислительного стресса, поддержания ионного баланса, целостности клеточной мембраны и т.п. Биологи давно пришли к пониманию того, что стационарно функционирующие системы не просто работают с постоянной скоростью, ни на что не обращая внимания. Такие системы пытаются противостоять любым изменениям, вызываемым внешними воздействиями, поддерживая неизменным свое собственное состояние.
Американский физиолог Уолтер Кэннон (Walter B. Cannon) предложил использовать термин “гомеостаз” для обозначения “координированных физиологических процессов, которые поддерживают наиболее стабильные (устойчивые) состояния организма” [20]. Впоследствии понятие гомеостаза стали применять и по отношению к отдельным органам и клеткам. Сейчас это универсальное понятие, широко используемое в биологии. Однако наши попытки найти более детальный анализ этого понятия, его “расшифровку”, применение этого понятия для выяснения механизмов работы метаболических систем не привели к успеху. Не много удалось найти в литературе информации, которая позволила бы использовать это расширенное, привлекательное, но очень расплывчатое понятие в качестве четкого инструмента для анализа метаболических систем.
Здесь мы постараемся это сделать. Для начала приведем хорошо всем известный пример гомеостаза. Это поддержание температуры тела у теплокровных животных. У человека температура поддерживается на уровне 36.6 ± 0.5°С. При температуре 37.2°С человек уже явно больной. Учитывая, что по абсолютной шкале температура тела человека составляет около 310 К разброс составляет всего 0.2%. И это гомеостаз. Наш организм делает все возможное, чтобы поддерживать эту температуру. И метаболически, и поведенчески все делается для того, чтобы температура тела изменялась как можно меньше. Можно привести целый ряд таких примеров, однако, в основном, когда мы смотрим на биологические системы, создается впечатление, что ситуация прямо противоположная. Практически все параметры биологических систем чрезвычайно широко варьируют. Это не случайный шум, или хаос. Это так называемая биологическая (индивидуальная) изменчивость. Если взять какой-либо один биологический вид, например, собаку, то мы обнаружим чрезвычайное разнообразие и по размеру, и по весу, и по цвету, и по другим признакам. Тем не менее, это один вид. Биологическая изменчивость создает большие трудности в нахождении закономерностей, присущих биологическим системам. Почему же некоторые характеристики биологических систем (организма), такие как температура тела, остаются строго постоянными, причем не только у одного представителя вида, но у всех без исключения представителей данного вида, в то время как множество других параметров сильно варьирует? Индивидуальная изменчивость проявляется в биологии на всех уровнях. Концентрация важных метаболитов (скажем, АТФ или глутатиона), скорость метаболических процессов и т.п. может варьировать от индивида к индивиду или от клетки к клетке более, чем в два раза [11, 25, 27, 32, 34].
Большая индивидуальная изменчивость не вызывает удивления у биологов. Предполагается, что высокая внутривидовая изменчивость обеспечивает популяциям стабильность при изменениях окружающей среды. Тем не менее, остается непонятным, как организмам удается сохранить такое индивидуальное разнообразие, сохранив, тем не менее, некоторые единые черты?
Здесь мы немного отошли от понятия гомеостаза, но суть проблемы остается та же самая. Огромное биологическое (индивидуальное) разнообразие на разных уровнях должно быть как-то совмещено с какими-то принципами организации биологических систем, с какими-то характеристиками систем, которые, наоборот, являются неизменными. Или, по крайней мере, природа пытается их сделать неизменными. Можем ли мы извлечь какие-то базовые, неизменные свойства (характеристики) биологических систем из того необъятного моря биологического (индивидуального) разнообразия, которое является непременным атрибутом биологических систем?
ЭНЕРГЕТИЧЕСКИЙ МЕТАБОЛИЗМ В ЭРИТРОЦИТАХ ЧЕЛОВЕКА
Рассмотрим этот вопрос на примере простейшей клетки человеческого организма – эритроцита. Этих клеток в организме очень много. Они составляют около 40% от объема циркулирующей крови. В них отсутствует ядро, митохондрии, рибосомы и другие органеллы. Следовательно, в эритроцитах нет окислительного фосфорилирования, и они не могут синтезировать белки. Тем не менее, эти клетки довольно стабильны. Время их жизни в организме составляет около 120 дней, что намного превышает время жизни многих других клеток [7, 8, 10, 26].
Мы довольно долго занимались изучением регуляции основных метаболических систем эритроцитов и будем проводить наше рассмотрение на основании нашего опыта в этой области.
Основной функцией эритроцита в организме является транспорт кислорода от легких к тканям. Эта функция обеспечивается за счет высокой концентрации кислород-транспортирующего белка гемоглобина в этих клетках (300 г/л) [22, 26] и высокой деформируемости эритроцитов – способности проходить по тканевым капиллярам, диаметр которых меньше, чем диаметр эритроцитов [5, 18, 29, 31].
Из-за высокой концентрации гемоглобина и метаболитов внутри эритроцита повышено осмотическое давление, которое клетка компенсирует за счет неравновесного распределения ионов Na и K между внешней средой и цитоплазмой (рис. 1 ) [6, 33]. Впрочем, это относится ко всем клеткам животных. Всем клеткам приходится бороться с проблемами, вызываемыми осмотическим давлением. Необходимое распределение ионов создается ионным насосом, Na/K-АТФазой, которая закачивает в клетку ионы K и выкачивает ион Na в соотношении 2 : 3 [6], уменьшая тем самым суммарное содержание одновалентных катионов в клетке по сравнению с окружающей средой. В результате осмотическое давление снаружи и внутри клетки выравнивается. Клетки животных не пытаются противостоять осмосу. Они выравнивают осмотическое давление по обе стороны клеточной мембраны, потому что мембрана не жесткая и не может противостоять осмосу. В результате, объем клетки становится динамической переменной. Он довольно легко может изменяться, если изменяется баланс ионов. Таким образом, ионный гомеостаз, это первый гомеостаз, который оказывается важен для клетки.
Рис. 1.
Схематическое изображение эритроцита с принципиальными компонентами этой клетки: гемоглобином, трансмембранной транспортной Na/K-АТФазой и системой гликолиза. Сплошные лиловые стрелки показывают активные потоки ионов, а пунктирные стрелки – пассивные потоки ионов через клеточную мембрану. Размер символов для ионов пропорционален их концентрации. Красные стрелки показывают активирующее влияние ионов Na и АТФ на транспортную Na/K-АТФазу. Зелеными стрелками показан круговорот АТФ и АДФ в клетке. Изображение молекулы гемоглобина взято из базы данных RCSB PDB (https://www.rcsb.org/structure/1GZX).

В свою очередь, насосы для своей работы нуждаются в энергии, то есть в АТФ. В эритроцитах АТФ производится в гликолизе (рис. 1). Это универсальная метаболическая система, существующая во всех клетках. В большинстве клеток гликолиз является частью АТФ-производящего метаболизма наряду с окислительным фосфорилированием, а в эритроците это единственная система производства АТФ. И мы начнем с рассмотрения того, как устроена регуляция производства АТФ в этой клетке. Схема гликолиза и взаимопревращений аденилатов в клетке показана на рис. 2 .
Рис. 2.
Схема гликолиза с учетом взаимопревращений аденилатов (АТФ, АДФ и АМФ). Г6Ф, Ф6Ф, ФДФ, ДАФ, ГАФ, 1,3ДФГ, 2,3ДФГ, 3ФГ, 2ФГ, ФЕП, пир и лак обозначают глюкозо-6-фосфат, фруктозо-6-фосфат, фруктозодифосфат, диоксиацетонфосфат, глицеральдегид-3-фосфат, 1,3-дифосфоглицерат, 2,3-дифосфоглицерат, 3-фосфоглицерат, 2‑фосфоглицерат, фосфоенолпируват, пируват и лактат соответственно. P обозначает неорганический фосфат. u1, u2, u3, u5, u6, u7, u8, u9, u10, u11 обозначают скорости реакций гексокиназной, фосфогексозоизомеразной, фосфофруктокиназной, альдолазной, триозофосфатизомеразной, глицеральдегидфосфатдегидрогеназной, фосфоглицераткиназной, фосфоглицератмутазной, енолазной, пируваткиназной и лактатдегидрогеназной реакций соответственно. u12 и u13 обозначают скорости реакций 2,3-дифосфоглицератного шунта: дифосфоглицератмутазной и дифосфоглицератфосфатазной соответственно. Триозофосфатизомеразная реакция считается равновесной и скорость ее равна скорости альдолазной реакции (u5). uC обозначает суммарную скорость потребления АТФ. uADK обозначает скорость аденилаткиназной реакции.
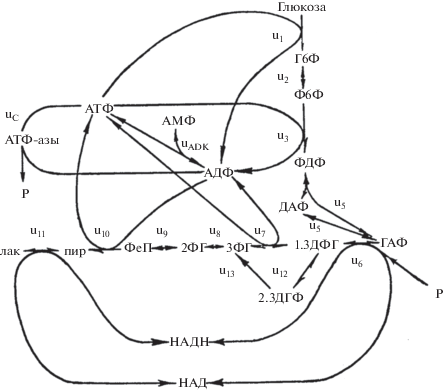
В стационарном состоянии в метаболической системе скорости всех реакций должны быть одинаковыми с учетом стехиометрических коэффициентов, и концентрации всех промежуточных метаболитов постоянны. Если пренебречь потоком через 2,3-дифосфоглицератный шунт (u12 и u13), который невелик, и предположить постоянство концентраций глюкозы пирувата и лактата (что вполне соответствует условиям in vivo), то для стационарного состояния в гликолизе можно записать следующее уравнение:
В гликолизе АТР потребляется в реакциях 1 и 3 и производится в реакциях 7 и 10 (рис. 2). Поэтому
Положительная производная концентрации АТФ по времени означает постоянный рост концентрации АТФ. Из этого уравнения вытекает, что в отсутствие потребления АТФ стационарное функционирование гликолиза в принципе невозможно. Если скорость потребления АТФ – uC = 0, то и стационарные скорости всех других реакций могут быть только нулевыми. Действительно, АТФ в гликолизе производится из АДФ. Но при отсутствии потребления АТФ концентрация АДФ и скорость реакций в так называемой “нижней” части гликолиза быстро снизятся. При этом скорости гексокиназной и фосфофруктокиназной реакций какое-то время будут протекать нормально, что приведет к накоплению фосфорилированных промежуточных метаболитов гликолиза и, в конце концов, к полному истощению ортофосфата, АТФ и к полной остановке гликолиза.
Итак, гликолиз может нормально функционировать только в том случае, если есть потребители АТФ, которые не являются частью гликолиза. Динамическое исследование гликолиза в принципе невозможно без дополнения его потребителями АТФ. Такими потребителями безусловно являются ионные насосы. Но кроме них АТФ может потребляться в других реакциях и процессах, которые очень разнообразны и не одинаковы в разных клетках. Таким образом, мы вынуждены перейти от четко определенной системы – гликолиза к уже не четко определенной системе, включающей гликолиз и потребителей АТФ, которые могут быть разными и не всегда полностью известными. Это одна из проблем, с которой сталкиваешься при исследовании закономерностей регуляции биологических систем – расплывчатость понятия системы. В данном случае мы расширили понятие системы гликолиза, введя неизвестное количество потребителей АТФ. Кроме того, если нам пришлось расширить систему один раз, где гарантия, что не придется расширять систему еще раз? Фактически, мы изучаем систему, которая нечетко определена.
РЕГУЛЯЦИЯ ЭНЕРГЕТИЧЕСКОГО МЕТАБОЛИЗМА
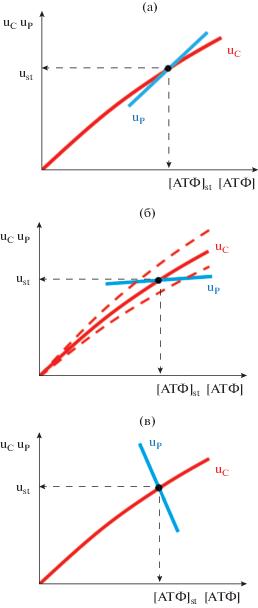
Предположим, что мы знаем всех потребителей АТФ и обозначим суммарную скорость потребления АТФ через uС. А через uP обозначим скорость, с которой АТФ производится в клетке. В стационарном состоянии скорость производства АТФ должна быть равна скорости потребления и это определяет скорости во всей системе. Если мы представим на графике зависимость скорости производства АТФ и скорости потребления АТФ от концентрации АТФ, то точка пересечения этих зависимостей (в которой скорости производства и потребления АТФ равны) и определит нам стационарное состояние метаболизма и стационарную скорость как производства, так и потребления АТФ (рис. 3 ).
Рис. 3.
Пересечение кривых зависимостей скорости производства АТФ (голубая линия) и скорости потребления АТФ (красная линия) от концентрации АТФ определяет стационарное состояние энергетического метаболизма. (а) – Неустойчивое стационарное состояние. (б) – Устойчивое стационарное состояние с отсутствием стабилизации уровня АТФ. Пунктирные линии показывают зависимость скорости потребления АТФ от [АТФ] при активации и ингибировании АТФ-потребляющих процессов. (в) – Устойчивое стационарное состояние со стабилизацией уровня АТФ. uP и uC обозначают скорости производства и потребления АТФ. ust и [АТФ]стац обозначают стационарные значения скорости и концентрации АТФ.
Здесь надо отметить, что скорость потребления АТФ в клетке связана обычно с выполнением каких-либо функций и задается в основном внешними условиями, такими как концентрация ионов, проницаемость мембраны, необходимость перемещения, необходимость какого-либо синтеза и т.п. При этом процесс производства АТФ не должен лимитировать его потребление. Иначе клетка просто не сможет выполнять необходимые функции. Скажем, при недостатке АТФ ионные насосы не смогут обеспечить скорость переноса ионов, необходимую для того, чтобы скомпенсировать пассивную утечку ионов через клеточную мембрану и сохранить осмотический баланс. Таким образом, именно потребление АТФ является в клетке определяющим фактором для стационарного состояния энергетического метаболизма.
Как же должна быть устроена зависимость скорости производства АТФ от [АТФ] для того, чтобы, с одной стороны, обеспечивать изменения скорости производства АТФ в соответствии с изменениями в скорости его потребления, и, с другой стороны, обеспечивать гомеостаз [АТФ], то есть обеспечивать стабилизацию уровня АТФ в клетке при изменениях скорости потребления АТФ?
Сразу отметим, что в ситуации, изображенной на рис. 3а, стационарное состояние, соответствующее пересечению двух кривых, является неустойчивым. При увеличении концентрации АТФ по сравнению со стационарным значением скорость производства АТФ начинает превышать скорость потребления, что приведет к росту уровня АТФ в клетке. При уменьшении концентрации АТФ скорость потребления АТФ начинает превышать скорость производства, что приведет к снижению уровня АТФ. В результате, любое случайное отклонение концентрации АТФ от стационарного значения приведет к потере стационарного состояния.
Для устойчивости необходимо, чтобы в точке пересечения наклон зависимости скорости производства АТФ от [АТФ] был меньше, чем наклон зависимости скорости потребления АТФ от [АТФ], как это изображено на рис. 3б. В этом случае при случайных отклонениях концентрации АТФ от стационарного значения система будет возвращаться в это стационарное значение. Однако, в ситуации, изображенной на рис. 3б небольшая активация или ингибирование АТФ-потребляющих процессов (пунктирные линии) вызывают значительные изменения уровня АТФ в клетке. Это плохо согласуется с идеями гомеостаза. Поэтому посмотрим, чем определяется стабильность уровня АТФ в клетке при изменении каких-то параметров метаболизма. Для этого удобно воспользоваться формализмом Теории Метаболического Контроля [21, 23, 24].
В окрестности стационарного состояния зависимости скоростей реакций от параметров системы можно считать линейными:
Тогда стационарная концентрация АТФ будет равна:
Для того, чтобы оценить степень стабилизации АТФ в клетке нужно вычислить контрольный коэффициент для влияния активности АТФ-потребляющих процессов на стационарный уровень АТФ ($C_{a}^{{\left[ {{\text{АТФ}}} \right]st}}$). Из Теории Метаболического Контроля следует, что этот коэффициент равен:
Теперь введем коэффициент стабилизации:
Чем меньше изменяется стационарная концентрация АТФ при изменении активности потребления АТФ, тем меньше соответствующий контрольный коэффициент и тем больше коэффициент стабилизации [АТФ]. Как видно, коэффициент стабилизации представляет собой простую функцию, которая определяется двумя параметрами. Параметр а, это активность АТФ-потребляющих процессов (наклон зависимости скорости потребления АТФ от [АТФ]), а параметр b, это наклон зависимости скорости производства АТФ от концентрации АТФ в области физиологических значений [АТФ]. Из последнего уравнения следует, что значение Q стремится к бесконечности если значение b стремится к минус-бесконечности. То есть с увеличением концентрации АТФ скорость производства АТФ должна уменьшаться, и чем сильнее она уменьшается, тем лучше стабилизируется [АТФ]. Такое устройство энергетического метаболизма обеспечивает изменение скорости производства АТФ в клетке в соответствии с изменениями скорости потребления АТФ и позволяет поддерживать гомеостаз (стабилизацию) в отношении внутриклеточной концентрации АТФ (рис. 3в). Физиологическое значение такого гомеостаза состоит в том, что при наличии в клетке большого количества АТФ-зависимых процессов, стабилизация уровня АТФ позволяет активировать или подавлять отдельные АТФ-зависимые процессы, не влияя на остальные.
Таким образом, простые динамические соображения приводят нас к простым фундаментальным принципам устройства биологических систем. В данном случае речь идет о системе производства и потребления АТФ, однако те же рассуждения можно применить к другим системам, например, к антиокислительному метаболизму глутатиона, к синтезу каких-то других важных метаболитов и т.п. Во всех случаях, когда требуется стабилизация каких-то метаболитов, картинка будет та же самая. Везде должен быть участок в системе производства этого вещества, на котором скорость производства будет уменьшаться с увеличением концентрации.
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ ПО РЕГУЛЯЦИИ ЭНЕРГЕТИЧЕСКОГО МЕТАБОЛИЗМА В ЭРИТРОЦИТАХ
Получив довольно парадоксальное предсказание о том, что скорость производства АТФ должна сильно уменьшаться с ростом концентрации АТР, мы решили посмотреть, как выглядит реальная (экспериментальная) зависимость скорости гликолиза от концентрации АТФ в эритроцитах человека и других млекопитающих [1, 2, 14].
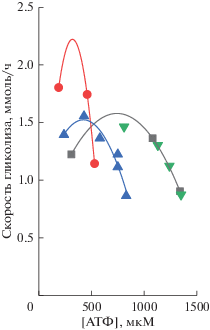
На рис. 4 приведена зависимость скорости гликолиза от [АТФ], полученная экспериментально в эритроцитах четырех разных доноров. Как видно из рисунка, в каждом случае, в соответствии с приведенными выше рассуждениями, скорость производства АТФ (скорость гликолиза) уменьшается с ростом [АТФ]. Но при этом у разных доноров падающий участок на кривых наблюдается при разных концентрациях АТФ. Получается, что гомеостаз (стабилизация [АТФ]) есть, но он индивидуальный и у каждого человека поддерживается своя собственная концентрация АТФ. Это привело нас к мысли, что, возможно, абсолютная концентрация АТФ не является той переменной, которая стабилизируется/гомеостазируется в клетке.
Рис. 4.
Зависимость скорости гликолиза (скорости потребления глюкозы) от [АТФ], полученная экспериментально в эритроцитах четырех разных доноров. Одинаковыми символами показаны данные, полученные на эритроцитах одного донора. Графики построены по данным из работы [14].
Предположение о том, какая энергетическая переменная (наряду с АТФ) может стабилизироваться в клетке, можно сделать на основании изучения регуляции ферментов гликолиза. Скорость гликолиза определяется двумя ферментами: гексокиназой (ГК) и фосфофруктокиназой (ФФК) (рис. 5 ). При этом АТФ ингибирует ФФК и это ингибирование передается на ГК за счет ингибирования ГК глюкозо-6-фосфатом (Г6Ф) (рис. 5а) [3, 9]. Таким образом, увеличение концентрации АТФ будет приводить к уменьшению скорости гликолиза в соответствие с вышеизложенными представлениями. Однако попытки количественно смоделировать зависимость скорости гликолиза в эритроцитах от [АТФ] используя кинетические параметры ферментов не позволяют получить необходимую крутизну падающего участка на зависимости скорости гликолиза от [АТФ] только за счет ингибирования ФФК концентрацией АТФ при разумных параметрах ингибирования.
Рис. 5.
Регуляция первых ферментов гликолиза, гексокиназы (ГК) и фосфофруктокиназы (ФФК), определяющих скорость всего гликолитического потока в эритроцитах человека. Фермент фосфогексоизомераза, находящийся между ГК и ФФК, катализирует обратимую реакцию, находящуюся в равновесии и не указан на рисунке. (а) – Регуляция скорости гликолиза за счет отрицательных обратных связей (показаны синими стрелками). (б) – Дополнительная регуляция скорости гликолиза за счет активирующего эффекта АМФ (красные стрелки). Г6Ф, Ф6Ф и ФДФ обозначают глюкозо-6-фосфат, фруктозо-6-фосфат и фруктозодифосфат соответственно. AK обозначает фермент аденилаткиназу.

РОЛЬ АДЕНИЛАТКИНАЗНОЙ РЕАКЦИИ В РЕГУЛЯЦИИ ЭНЕРГЕТИЧЕСКОГО МЕТАБОЛИЗМА. АМФ – СПЕЦИАЛЬНЫЙ УПРАВЛЯЮЩИЙ МЕТАБОЛИТ
Фермент ФФК имеет множество активаторов и ингибиторов. Одним из самых сильных активаторов является аденозинмонофосфат (АМФ) (рис. 5б) [3, 9, 19]. АМФ является промежуточным метаболитом в синтезе АТФ de novo и непосредственно не участвует в гликолитических реакциях. Однако во всех клетках есть фермент – аденилаткиназа, который катализирует взаимопревращения между АТФ, АДФ и АМФ в обратимой аденилаткиназной реакции:
Активность аденилаткиназы в клетках высока и обеспечивает поддержание равновесного соотношения между концентрациями АТФ, АДФ и АМФ [17, 30]. В результате, если в клетке возрастает АТФ, то одновременно снижается АМФ. Наличие такой сильной связи подсказывает, что нам необходимо еще одно расширение нашей энергетической системы за счет включения концентрации АМФ и аденилаткиназной реакции. При наличии равновесной аденилаткиназной реакции оба эффектора АТФ и АМФ будут действовать согласованно, поскольку их концентрации связаны между собой. При этом АМФ может вызывать гораздо более сильный эффект, поскольку в области физиологических концентраций при изменении уровня АТФ в клетке на 10–20% уровень АМФ изменяется в несколько раз (рис. 6 ). Сильные изменения концентрации АМФ при относительно небольших вариациях уровня АТФ вытекают из уравнений для аденилаткиназного равновесия и постоянства пула аденилатов (суммы концентраций АТФ, АДФ и АМФ):
Рис. 6.
Относительные изменения уровней АДФ (черная кривая) и АМФ (красная кривая) при уменьшении относительной концентрации АТФ в клетке. Расчеты сделаны при условии постоянства суммы концентраций аденилатов ([АТФ] + [АДФ] + [АМФ] = = А) и наличия аденилаткиназного равновесия ([АТФ] * [АМФ] = [АДФ]2).

В большинстве клеток в нормальных условиях концентрации аденилатов находятся в следующем соотношении [11, 25, 27, 34]:
И для концентрации АМФ получаем приближенную зависимость от [АТФ]:
Концентрация АМФ оказывается квадратичной функцией от концентрации АТФ. То есть небольшие изменения концентрации АТФ приводят к сильным изменениям концентрации АМФ. Таким образом, из приведенных выше уравнений вытекает, что при физиологических условиях АМФ является очень чувствительным индикатором, который резко реагирует на небольшие изменения концентрации АТФ и является одним из важнейших регуляторов энергетического метаболизма, в данном случае в эритроцитах.
Таким образом, раз небольшое увеличение концентрации АТФ будет вызывать сильное уменьшение концентрации АМФ, то это будет приводить к сильному уменьшению скорости ФФК реакции. В результате АМФ и АТФ совместно меняют скорость ФФК реакции, усиливая эффекты друг друга.
ЭНЕРГЕТИЧЕСКИЙ ЗАРЯД КЛЕТКИ
Из вышеприведенного рассмотрения следует, что гликолиз управляется двумя связанными между собой веществами (АТФ и АМФ). Исходя из этого вполне разумно предположить, что регулятором гликолиза (и стабилизируемой переменной) является какая-то относительная величина, например, относительная концентрация АТФ:
Первая функция (Ψ) более простая и более понятная. Она говорит, что эта система работает на относительных величинах. Она стабилизирует не абсолютную, а относительную концентрацию АТФ, потому что АМФ измеряет отклонения АТФ от полного пула аденилатов, а не абсолютное значение [АТФ]. Надо отметить, что при физиологических условиях ([АТФ] : [АДФ] : [АМФ] = 100 : 10 : 1) обе формулы дают практически одно и то же значение.
Дальше мы будем пользоваться формулой Аткинсона просто в знак уважения к этому великому человеку, который прозрел это много десятилетий тому назад.
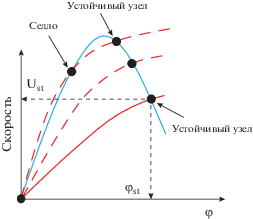
Если мы теперь нарисуем, как выглядит функция производства АТФ от энергетического заряда, то оказывается, что, введя регуляцию АМФ мы можем получить кривую с достаточно крутым падающим участком, на котором увеличение энергетического заряда приводит к резкому уменьшению скорости гликолиза (рис. 7 ). А восходящий участок на этой кривой, это “дань” биохимии. Поскольку гликолиз начинается с потребления АТФ в двух первых реакциях, неизбежно следует, что при нулевой концентрации АТФ или при нулевом энергетическом заряде скорость гликолиза тоже будет нулевая. Отсюда получается кривая с максимумом, на которой рабочим участком является только падающий участок.
Рис. 7.
Зависимость скорости гликолиза от энергетического заряда (φ) (голубая кривая), обеспечивающая стабилизацию энергетического заряда при активации потребления АТФ. Зависимость скорости потребления АТФ от энергетического заряда (фактически от концентрации АТФ) в норме (сплошная красная кривая) и при различной степени активации потребления АТФ (пунктирные красные кривые).
УСТОЙЧИВОСТЬ СТАЦИОНАРНОГО СОСТОЯНИЯ И СТАБИЛИЗАЦИЯ ЭНЕРГЕТИЧЕСКОГО ЗАРЯДА КЛЕТКИ
При нормальных физиологических условиях, согласно рис. 7, зависимости скорости производства и потребления АТФ от [АТФ] пересекаются в двух точках. При физиологической концентрации АТФ и при нулевой. Стационарное состояние системы при нулевой концентрации АТФ неустойчиво. Любое флуктуационное увеличение концентрации АТФ приведет к дальнейшему росту концентрации АТФ до тех пор, пока в системе не будет достигнуто физиологическое стационарное состояние. Если мы посмотрим, что будет происходить с этой системой при увеличении нагрузки (при активации потребления АТФ), то мы увидим, что энергетический заряд будет снижаться, но это снижение не очень большое. Это снижение будет продолжаться до тех пор, пока точка пересечения не достигнет максимума. Но еще до этого может сложиться ситуация, когда в системе появится три стационарных состояния (рис. 7). Такая ситуация возможна при гиперболической зависимости скорости потребления АТФ от [АТФ] (рис. 7). В этом случае появление третьего стационарного состояния происходит с одновременным изменением устойчивости нулевого стационарного состояния. В энергетической системе появляется два устойчивых стационарных состояния – физиологическое и нулевое, с неустойчивым состоянием между ними. Возможность сосуществования двух устойчивых стационарных состояний (бистабильность) является любопытной особенностью энергетической системы клетки. В каких-то ситуациях, например, патологических, когда такое состояние возможно, временный всплеск потребления АТФ может привести к переходу системы в состояние с нулевой концентрацией АТФ и к гибели клетки. В то же время, при отсутствии сильных возмущений, клетка могла бы оставаться в физиологически нормальном состоянии сколь угодно долго. Дальнейшая активация потребления АТФ приведет к тому, что скорость потребления АТФ будет превышать скорость производства АТФ при всех значениях энергетического заряда. В этой ситуации, естественно, в системе останется только одно, нулевое стационарное состояние.
Зависимость стационарного значения энергетического заряда от активности АТФ-потребляющих процессов в нашей системе приведена на рис. 8 . Как видно из рисунка, в “рабочем диапазоне” изменений активности АТФ-потребляющих процессов семикратное увеличение этой активности приводит к уменьшению энергетического заряда на 50%. Если бы не было никакой регуляции, и энергетическая система производила бы АТР с постоянной скоростью, не было бы никаких обратных связей, никакого АМФ, то энергетический заряд падал бы примерно по гиперболе, как показано на рис. 8 пунктирной линией.
Рис. 8.
Гомеостаз энергетического заряда в человеческих эритроцитах при изменении активности АТФ-потребляющих процессов (черная кривая). Пунктиром показана зависимость энергетического заряда клетки от активности АТФ-потребляющих процессов при постоянной скорости производства АТФ и линейной зависимости скорости потребления АТФ от [АТФ]. Красная стрелка показывает скачкообразное падение энергетического заряда в точке бифуркации.

И так получается, что, во-первых, в энергетике эритроцита есть гомеостаз уже на уровне одной метаболической системы – системы производства и потребления энергии. Во-вторых, этот гомеостаз может быть численно охарактеризован через коэффициент стабилизации (наклон участка, на котором энергетический заряд меняется мало), и через диапазон изменения активности АТФ-потребляющих процессов в котором осуществляется стабилизация (гомеостазирование) энергетического заряда. Невозможно гомеостазировать систему при бесконечно больших изменениях. В системе, естественно, существует ограничение активности потребления АТФ сверху и при превышении этого порога энергетический заряд (и концентрация АТФ) скачкообразно (катастрофически) падает. То есть происходит бифуркация. Система держится изо всех сил в стационарном состоянии, а потом не выдерживает, ломается, и “падает” практически в ноль. Любопытно, что на левой границе диапазона стабилизации тоже есть особая точка, в которой система теряет устойчивость (рис. 8). Что это такое? Система потребляет очень мало энергии, а метаболизм не может произвести столько энергии? Нет, может. А тем не менее система перестает работать. Это ситуация перепроизводства, когда система не может уменьшить скорость своей работы до нуля. Все эти регуляторы не способны полностью подавить работу ферментов. Отсюда возникает такая характерная картина, которая является довольно универсальной: есть диапазон стабилизации, с обеих сторон ограниченный катастрофическими изменениями состояния системы, и часто гибелью клетки. И это одна из интереснейших вещей, которую мы в свое время осознали и которая, по-видимому, является общим свойством всех (хотя мы все не проверяли, но полагаем, что всех) стационарно функционирующих метаболических систем клетки. Все метаболические системы, которые мы исследовали и которые обеспечивают гомеостаз каких-то параметров, они все ведут себя аналогичным образом. Можно считать, что это и есть некоторые принципиально общие правила, или принципы организации обеспечивающих гомеостаз систем. По крайней мере, на уровне метаболических систем.
ОБСУЖДЕНИЕ
Что мы увидели из нашего рассмотрения? Нам пришлось сделать несколько “расширений” исследуемой системы.
Мы начали с того, что энергию в эритроците, в простейшей клетке, производит гликолиз. Поскольку эта метаболическая система оказалась принципиально нестационарной, мы вынуждены были немедленно расширить систему, введя потребителей АТФ. Этого оказалось сильно недостаточно, и нам пришлось добавить АМФ и аденилаткиназу, которые обеспечили специальную регуляцию, управляющую потоком в гликолизе. После этого регуляция производства АТФ в модели стала гораздо более эффективной. При этом появилась некоторая свободная переменная. Оказалось, что система может работать как стабилизатор только по отношению к некоторой новой функции, которая не является биохимической функцией. Эта функция – энергетический заряд – комбинация концентраций разных аденилатов. И стабилизируется только эта комбинация, а вовсе не абсолютная концентрация АТФ.
Тем не менее концентрация АТФ является “привлекательной” биохимической характеристикой. Она важна для работы ионных насосов, потому что они-то используют именно АТФ и их скорость зависит от абсолютной концентрации АТФ. Оказывается, такой механизм, который природа создала для стабилизации энергетического заряда дает дополнительную возможность для регуляции [4, 12, 13, 28]. Клетка может менять абсолютную концентрацию АТФ, используя синтез и разрушение АМФ в реакциях совсем другой метаболической системы, не относящейся к гликолизу (к энергетическому метаболизму), и за счет этого управлять абсолютной концентрацией АТФ в клетке для каких-то своих нужд, сохраняя при этом постоянный энергетический заряд (рис. 9 ). Таким образом, мы получили дополнительную степень свободы.
Рис. 9.
Реакции синтеза и разрушения АМФ в эритроцитах (показаны зеленым цветом) могут влиять на суммарный уровень аденилатов в клетке ([АТФ] + [АДФ] + [АМФ]), что может обеспечивать дополнительную регуляцию метаболизма. ИМФ – инозинмонофосфат.

В ходе нашей работы мы постепенно начали понимать, что биологическая изменчивость или биоразнообразие, с которым мы сталкиваемся, закрывает от нас реальную картину устройства биологической системы. А биологические системы устроены, по-видимому, так, что в них есть переменные, которые определяют сущность функционирования (регуляции) данной системы, такие как энергетический заряд или температура тела. Этих переменных мало. Мало по необходимости, потому что биологические системы работают как надежно устроенные машины, а надежно устроенные машины, как мы полагаем, имеют мало степеней свободы.
Короче говоря, за этим гигантским биоразнообразием с неизбежностью стоит на много порядков меньшее (небольшое) разнообразие существенных переменных системы. Там нет никакого биологического разнообразия. В области существенных переменных все индивидуумы абсолютно одинаковы. Энергетический заряд фиксирован с точностью до процентов, и метаболические системы устроены так, что они сопротивляются изменениям изо всех сил, пока не сломаются.
Список литературы
Атауллаханов А.И., Атауллаханов Ф.И., Витвицкий В.М., Жаботинский А.М., Пичугин А.В. Исследование регуляторной характеристики гликолиза в эритроцитах барана // Биохимия. 1982. Т. 47. Вып. 8. С. 1293–1298.
Атауллаханов А.И., Атауллаханов Ф.И., Витвицкий В.М., Жаботинский А.М., Пичугин А.В. 2,3-Дифосфоглицератный шунт и стабилизация уровня АТФ в эритроцитах млекопитающих // Биохимия. 1985. Т. 50. Вып. 6. С. 1005–1011.
Атауллаханов Ф.И., Витвицкий В.М., Жаботинский А.М., Холоденко Б.И., Эрлих Л.И. Количественная модель гликолиза эритроцита человека. I. Зависимость стационарной скорости гликолиза от концентрации АТФ // Биофизика. 1977. Т. 22. Вып. 3. С. 483–488.
Атауллаханов Ф.И., Витвицкий В.М., Комарова С.В. Возможная роль метаболизма адениновых нуклеотидов в регуляции объема эритроцитов человека // Биологические мембраны. 1996. Т. 13. Вып. 2. С. 196–207.
Атауллаханов Ф.И., Витвицкий В.М., Лисовская И.Л., Тужилова Е.Г. Анализ геометрических параметров и механических свойств эритроцитов методом фильтрации через мембранные ядерные фильтры. I. Математическая модель // Биофизика. 1994. Т. 39. Вып. 4. С. 672–680.
Атауллаханов Ф.И., Корунова Н.О., Спиридонов И.С., Пивоваров И.О., Калягина Н.В., Мартынов М.В. Как регулируется объем эритроцита, или что могут и чего не могут математические модели в биологии // Биологические мембраны. 2009. Т. 26. Вып. 3. С. 163–179.
Бабский Е.Б., Зубков А.А., Косицкий Г.И., Ходоров Б.И. Физиология человека. Медицина, Москва. 1972. 656 с.
Кассирский И.А., Алексеев Г.А. Клиническая гематология (4-е изд.). Медицина, Москва. 1970. 799 с.
Ньюсхолм Э., Старт К. Регуляция метаболизма // Мир. Москва. 1977. 407 с.
Рапопорт С.М. Медицинская биохимия. Медицина, Москва. 1966. 892 с.
Angerås U., Hall-Angerås M., Wagner K.R., James H., Hasselgren P.O., Fischer J.E. Tissue metabolite levels in different types of skeletal muscle during sepsis // Metabolism: clinical and experimental. 1991. V. 40. № 11. P. 1147–51. https://doi.org/10.1016/0026-0495(91)90208-e
Ataullakhanov F.I., Komarova S.V., Martynov M.V., Vitvitsky V.M. A possible role of adenylate metabolism in human erythrocytes. 2. Adenylate metabolism is able to improve the erythrocyte volume stabilization // J. theoretical biology. 1996. V. 183. № 3. P. 307–16. https://doi.org/10.1006/jtbi.1996.0222
Ataullakhanov F.I., Komarova S.V., Vitvitsky V.M. A possible role of adenylate metabolism in human erythrocytes: simple mathematical model // J. theoretical biology. 1996. V. 179. № 1. P. 75–86. https://doi.org/10.1006/jtbi.1996.0050
Ataullakhanov F.I., Vitvitsky V.M., Zhabotinsky A.M., Pichugin A.V., Platonova O.V., Kholodenko B.N., Ehrlich L.I. The Regulation of Glycolysis in Human Erythrocytes // European J. Biochemistry. 1981. V. 115. № 2. P. 359–365. https://doi.org/10.1111/j.1432-1033.1981.tb05246.x
Atkinson D.E., Walton G.M. Adenosine triphosphate conservation in metabolic regulation. Rat liver citrate cleavage enzyme // The J. biological chemistry. 1967. V. 242. № 13. P. 3239–41.
Atkinson D.E. Cellular Energy Metabolism and its Regulation. Academic Press, New York. 1977. 293 p.
Beutler E., Carson D., Dannawi H., Forman L., Kuhl W., West C., Westwood B. Metabolic compensation for profound erythrocyte adenylate kinase deficiency. A hereditary enzyme defect without hemolytic anemia // The J. clinical investigation. 1983. V. 72. № 2. P. 648–55. https://doi.org/10.1172/JCI111014
Branemark P.I. Intravascular anatomy of blood cells in man // Karger, Basel. 1971. 90 p.
Brüser A., Kirchberger J., Kloos M., Sträter N., Schöneberg T. Functional linkage of adenine nucleotide binding sites in mammalian muscle 6-phosphofructokinase // The J. biological chemistry. 2012. V. 287. № 21. P. 17546–17553. https://doi.org/10.1074/jbc.M112.347153
Cannon W.B. The Wisdom of the Body. W. W. Norton., New York. 1932. 294 p.
Cornish-Bowden A. Fundamentals of Enzyme Kinetics (4 ed.). Wiley-Blackwell. 2012. 510 p.
Dominguez de Villota E.D., Ruiz Carmona M.T., Rubio J.J., De Andres S. Equality of the in vivo and in vitro oxygen-binding capacity of haemoglobin in patients with severe respiratory disease // British J. Anaesthesia. 1981. V. 53. № 12. P. 1325–8. https://doi.org/10.1093/bja/53.12.1325
Fell D.A. Metabolic control analysis: a survey of its theoretical and experimental development // The Biochemical journal. 1992. V. 286. № 2. P. 313–30. https://doi.org/10.1042/bj2860313
Heinrich R., Schuster S. The Regulation of Cellular Systems. Chapman and Hall, New York. 1996. 372 p.
Kaminsky Y.G., Kosenko E.A., Kondrashova M.N. Alteration of adenine nucleotide pool in old rat liver and its normalization with ammonium succinate // FEBS letters. 1983. V. 159. № 1–2. P. 259–61. https://doi.org/10.1016/0014-5793(83)80459-1
Lang F., Foller M. (Eds.) Erythrocytes: Physiology and pathophysiology. Imperial College Press, London. 2012. 452 p.
Mansell M.A., Allsop J., North M.E., Simmonds R.J., Harkness R.A., Watts R.W. Effect of renal failure on erythrocyte purine nucleotide, nucleoside and base concentrations and some related enzyme activities // Clinical science. 1981. V. 61. № 6. P. 757–64. https://doi.org/10.1042/cs0610757
Martinov M.V., Plotnikov A.G., Vitvitsky V.M., Ataullakhanov F.I. Deficiencies of glycolytic enzymes as a possible cause of hemolytic anemia // Biochimica et biophysica acta. 2000. V. 1474. № 1. P. 75–87. https://doi.org/10.1016/s0304-4165(99)00218-4
Mohandas N., Gallagher P. G. Red cell membrane: past, present, and future // Blood. 2008. V. 112. № 10. P. 3939–48. https://doi.org/10.1182/blood-2008-07-161166
Mohrenweiser H.W., Fielek S., Wurzinger K.H. Characteristics of enzymes of erythrocytes from newborn infants and adults: activity, thermostability, and electrophoretic profile as a function of cell age // American journal of hematology. 1981. V. 11. № 2. P. 125–36. https://doi.org/10.1002/ajh.2830110203
Reinhart W.H., Huang C., Vayo M., Norwich G., Chien S., Skalak R. Folding of red blood cells in capillaries and narrow pores // Biorheology. 1991. V. 28. № 6. P. 537–49. https://doi.org/10.3233/bir-1991-28605
Vitvitsky V., Dayal S., Stabler S., Zhou Y., Wang H., Lentz S. R., Banerjee R. Perturbations in homocysteine-linked redox homeostasis in a murine model for hyperhomocysteinemia // American journal of physiology. Regulatory, integrative and comparative physiology. 2004. V. 287. № 1. P. R39-46. https://doi.org/10.1152/ajpregu.00036.2004
Vitvitsky V.M., Frolova E.V., Martinov M.V., Komarova SV., Ataullakhanov F.I. Anion permeability and erythrocyte swelling // Bioelectrochemistry (Amsterdam, Netherlands). 2000. V. 52. № 2. P. 169–77. https://doi.org/10.1016/s0302-4598(00)00099-4
Vitvitsky V., Kumar R., Libiad M., Maebius A., Landry A.P., Banerjee R. The mitochondrial NADH pool is involved in hydrogen sulfide signaling and stimulation of aerobic glycolysis // J. Biological Chemistry. 2021. V. 296. P. 100736. https://doi.org/10.1016/j.jbc.2021.100736
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


