Успехи физиологических наук, 2022, T. 53, № 1, стр. 52-75
ГАМК Б торможение через обратные связи участвует в синхронизации интериктальных спайков в коре
В. Г. Марченко a, *, М. И. Зайченко a, **
a Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии РАН
117485 Москва, Россия
* E-mail: vgmarchenko3@gmail.com
** E-mail: mariya-zajchenko@yandex.ru
Поступила в редакцию 12.01.2021
После доработки 03.04.2021
Принята к публикации 18.05.2021
- EDN: XTIVUC
- DOI: 10.31857/S0301179822010064
Аннотация
Исследования, проведенные в последнее время, значительно расширили представления о функциях ГАМКергических интернейронов в нейронных сетях коры. Интернейроны определенного класса участвуют в генерации интериктальной активности в коре не только при некоторых формах патологии, но и в условиях, когда торможение осуществлялось преимущественно через ГАМК Б рецепторы. Интериктальная активность представляет собой спайки огромной амплитуды, когда за короткой возбудительной фазой следует длительная тормозная фаза, возникающая почти одновременное в разных участках коры. Спайк большой амплитуды отражает синхронное действие возбудительных нейронов в локальном участке, а синхронная активность в отдаленных участках определяется обратными связями между пирамидными клетками и интернейронами, когда активность большой массы нейронов происходит одновременно в течение узкого временного интервала. В процессе синхронизации интериктальных спайков принимают участие клетки Мартинотти, а также парвальбуминовые, нейроглиаформные и экспрессирующие вазоактивный интестинальный пептид интернейроны, которые, как показывают экспериментальные данные, осуществляют торможение и посредством ГАМК Б рецепторов. В настоящее время известно несколько механизмов синхронизации активности нейронов в нейронных сетях коры: посредством электрических связей, объемного проведения, синаптических обратных связей как между пирамидными нейронами и интернейронами, так и между самими интернейронами. Мы предполагаем, что механизм синхронизации интериктальных спайков в корковых нейронных сетях действует следующим образом. По-видимому, этот механизм одинаково работает в локальных нейронных сетях и на расстоянии. При возникновении возбуждения вслед за ним по обратной связи начинается торможение, которое ограничивает период возбуждения и таким образом создается временное окно интеграции, и это так же происходит в соседних нейронных сетях коры. На начальном этапе амплитуда интериктальных спайков невелика и не одновременна в разных участках коры. В дальнейшем все больше и больше пирамидных нейронов становятся активны в период действия временного окна, и таким образом увеличивается амплитуда интериктального спайка, а, следовательно, усиливается торможение. В конечном итоге усилившееся торможение за счет обратных связей начинает воздействовать на соседние нейронные сети и таким образом интериктальные спайки возникают почти одновременно в разных частях коры. При этом наблюдается значительное удлинение торможения после спайка, так как к собственному торможению в нейронной сети добавляется торможение от соседей по обратным тормозным связям.
ВВЕДЕНИЕ
На наш взгляд синхронизация электрической активности является отражением процессов интеграции в нейронных сетях коры, когда в короткий временной отрезок происходит суммация активности нейронов, как результат взаимодействия различных возбудительных и тормозных нейронных сетей. Именно взаимодействие между возбудительными и тормозными нейронными сетями является механизмом выполнения различных функций коры мозга. Главное в исследовании механизмов синхронизации – определить, как осуществляется взаимодействие между нейронными сетями, что заставляет элементы коры действовать одинаково во времени и пространстве. В экспериментах для этих целей широко используется активность интериктальных спайков. В литературе используются две формы – интериктальный (между эпилептическими приступами) спайк и интериктальный разряд.
МАТЕРИАЛЫ И МЕТОДЫ
Поиск соответствующих публикаций производился в электронных базах данных “PubMed”, “Springer”. Найденные на английском языке публикации представляли собой как экспериментальные исследования, так и литературные обзоры по данной тематике.
1. СВОЙСТВА ИНТЕРИКТАЛЬНЫХ СПАЙКОВ
Гибс с соавторами (Gibbs et al.) еще в 1935 г. определили интериктальные спайки как электрофизиологический маркер эпилепсии, который появляется значительно чаще, чем приступы [78].
Интериктальные спайки наблюдаются у больных различными формами эпилепсии при клинических исследованиях, при экспериментальной эпилепсии у животных. Существует несколько условий и методик, при которых возникают интериктальные спайки. Они появляются при использовании блокаторов ГАМК А-рецепторов в коре – пенициллина [28, 94, 121] и бикукулина [26, 66, 92]. Они обнаруживаются у пациентов c резистентной фокальной эпилепсией [102], с резистентной височной эпилепсией [97], в кортикальных срезах, полученных при хирургических операциях пациентов с фокальной корковой дисплазией [22]. Блокада ГАМК А-рецепторов габазином, 4-аминопиридином (4-AP, блокатор К+ каналов) приводит к появлению подобных интериктальных разрядов с частотой около 1 Гц [68], как и при использовании пикротоксина [11].
Результаты генерации интериктальных разрядов, полученные с применением 4-АР, были также воспроизведены in vitro во время применения искусственной спинномозговой жидкости (ACSF), не содержащей Mg2+. Существенно, что в указанных экспериментах эта процедура вызывала синхронизированные интериктальные спайки в изолированном срезе гиппокампа [8].
Специфическая фотостимуляция парвальбуминовых (PV) или соматостатиновых (SOM) интернейронов в присутствии проэпилептического соединения 4-AP также последовательно запускает интериктальные спайки [122].
1.1. Фазы интериктальных спайков
В ряде работ было показано, что интериктальные разряды обычно состоят из двух фаз. Первая фаза характеризуется короткой длительностью (<100 мс), большой амплитудой и состоит из одиночного пика (реже многофазного), вторая фаза обычно является более медленной волной [78].
Необходимо отметить, что в некоторых исследованиях интериктальные разряды наблюдались 2-х типов. Так, в экспериментах на модели височной эпилепсии интериктальные разряды были со спайком и последующей длительной волной, и со спайком без волны. Таким образом, спайки 1-го типа будут соответствовать активации больших популяций возбудительных и тормозных клеток, тогда как спайки 2-го типа будут возникать за счет активации возбуждающих клеток на более локальном уровне, поскольку как амплитуда, так и длительность пиков 2-го типа меньше, чем спайков 1-го типа. Существенно, что наличие только спайков 2-го типа позволяет предположить, что локальные нейронные сети могут быть активированы без включения тормозной обратной связи или, что локальные тормозные нейронные сети не активированы [16].
С нашей точки зрения, крайне важно для понимания механизмов синхронизации интериктальных спайков, что в разных экспериментах на разных объектах, включая грызунов и человека, было показано, что медленный компонент соответствует активности интернейронов.
Так, внутриклеточные записи нейронов показали, что наблюдается корреляция между фазами деполяризации и гиперполяризации и фазами интериктального спайка в ЭЭГ и полевого потенциала, и что короткие полевые интериктальные разряды были отражением деполяризациии мембран [89]. У пациентов, так же, как и в экспериментальных моделях, высокоамплитудные, короткие разряды на ЭЭГ первой фазы соответствуют активности пирамидных нейронов, а второй, медленной волны – активности интернейронов [25, 7 ]. Интериктальные спайки содержат тормозный компонент, то есть являются гиперполяризованными, что указывает на то, что торможение составляет важную часть этих событий [108]. В одной из недавних работ также было продемонстрировано, что медленный компонент интериктальных разрядов определялся синаптическим торможением [97]. Интериктальные разряды, индуцируемые 4-АР, состоят из первичной деполяризации и последующей гиперполяризации [59].
Нейронный разряд, связанный с одиночным интериктальным спайком, сопровождается глубоким и продолжительным рефрактерным периодом, поддерживаемым тормозными потенциалами. Постспайковая депрессия может отвечать за периодичность интериктальных спайков, обычно наблюдаемую как на животных моделях, так и на модели эпилепсии человека [24].
Характерной особенностью интериктальной активности, вызываемой нанесением пенициллина на моторную кору анестезированных крыс, является интериктальный разряд, за которым следовала абсолютная рефрактерная фаза продолжительностью 200–300 мс, при которой эпилептические явления не могли быть вызваны эпикортикальной стимуляцией. Далее следовал период относительной рефрактерности длительностью 750 мс от стимула. Показательно, что пики, вызванные в интервале между 300 и 900 мс, были меньше, чем пики с большими интервалами, и требовали стимуляции более высокой интенсивности [28]. Что было связано с активностью торможения.
Уже в течение 1960-х годов внутриклеточные исследования, проведенные в острых экспериментах in vivo, показали, что интериктальные спайки, регистрируемые в кортикальных нейронах, расположенных в эпилептических очагах, вызванные применением конвульсантов (таких, как пенициллин), выражались пароксизмальными деполяризующими сдвигами мембранного потенциала, приводящими к устойчивым разрядам потенциала действия с последующей сильной гиперполяризацией. Они обычно состоят из большой амплитуды короткого компонента (продолжительностью 50–100 мс), за которой обычно следует медленная волна (длительностью 200–500 мс) [6, 25, 94].
В результате стимуляции коллатералей Шаффера при аппликации пенициллина на срез гиппокампа у нейронов СА1 возникает пароксизмальный деполяризационный сдвиг с последующим сильным увеличением длительности торможения по сравнению с ответом без пенициллина. В этих условиях пароксизмальное возбуждение интернейронов преобразуется в значительное прямое и обратное торможение возбудительных нейронов [121].
В ранних работах было показано, что ранние (50 мс) и поздние (200 мс) фазы гиперполяризации отражают постсинаптическую активацию соответственно ГАМК А и ГАМК Б-рецепторов [82].
1.2. Синхронизация интериктальных спайков
Важным свойством интериктальных спайков является синхронизация, независимо от того, в каких условиях происходила их генерация. Как показывает анализ электроэнцефалограммы (ЭЭГ), интериктальные разряды при фокальной эпилепсии поддерживаются синхронной деполяризацией мембраны, генерируемой ансамблем гипервозбудимых нейронов. Генерация интериктального спайка, характерной особенностью которого является большая амплитуда, происходит в результате одновременной активности большого числа нейронов в локальной точке коры, то есть локальной синхронизации [99]. Высокосинхронный клеточный разряд, связанный с интериктальным спайком, генерируется множеством механизмов, включающих синаптическую и несинаптическую связь между нейронами [24].
Синхронизация интериктальных спайков является распространенным явлением как у пациентов, так и у экспериментальных животных. Было показано, что интериктальные спайки в значительной степени обусловлены кратковременными синхронными разрядами потенциалов действия, генерируемых пирамидными клетками. Кроме того, синхронные ГАМКергические потенциалы наблюдались во время генерации интериктальных спайков в срезах мозга, полученных из разных областей коры, и в изолированном препарате мозга морских свинок [25].
Синхронные интериктальные спайки продолжают возникать длительное время на протяжении всего эксперимента и остаются синхронными в энторинальной и гиппокампальной областях, распространяясь из гиппокампа (чаще всего СА3) на другие области [8].
Характерной особенностью интериктальной активности является почти одновременное появление разрядов (пространственная синхронизация) в разных областях коры. Подобное явление наблюдалось при аппликации 4-АР (блокатора К+ каналов) в переднюю поясную кору [89]. Какие механизмы лежат в основе такой активности, не вполне ясно. Наиболее вероятно, что синхронизацию интериктальных разрядов обеспечивает торможение, связанное с ГАМК Б рецепторами, которое создает в локальных структурах и на расстоянии временное окно интеграции с участием обратных связей в коре.
2. ГАМКЕРГИЧЕСКИЕ ИНТЕРНЕЙРОНЫ
ГАМКергические тормозные интернейроны играют важную роль в осуществлении различных корковых функций. В последнее десятилетие наблюдался существенный прогресс в понимании разнообразия кортикальных ГАМКергических интернейронов с точки зрения молекулярного состава, морфологического разнообразия и многогранных функций. В качестве важного сдвига парадигмы, тормозные интернейроны теперь больше не рассматриваются как “рабы к возбуждающим клеткам”, просто сохраняя адекватный баланс возбуждения–торможения. Весьма вероятно, что сами ГАМКергические интернейроны являются неотъемлемыми частями нейронных цепей для обработки сенсорных стимулов и делают результаты этой обработки доступными для моторных зон для целенаправленного поведения [32].
2.1. Классификация ннтернейронов
На основании молекулярной классификации терминологии Petilla [5], кортикальные интернейроны делятся на основе экспрессии специфических молекулярных маркеров. В частности, можно выделить несколько основных групп интернейронов: экспрессирующие парвальбумин (PV); экспрессирующие соматостатин (SOM), такие как клетки Мартинотти; экспрессирующие нейропептид Y (NPY), но не SOM; те, которые экспрессируют вазоактивный интерстинальный (кишечный) пептид (VIP); и те, которые экспрессируют холецистокинин (CCK), но не SOM или VIP [27].
Кроме этой существует классификация, в которой 100% ГАМКергических неокортикальных интернейронов разделены на 3 основных класса. На основании этой классификации 40% составляют интернейроны, экспрессирующие парвальбумин (PV), 30% экспрессируют соматостатин (SOM или аббревиатура SST, Sst), которые разделяются на несколько подклассов и большинство из которых составляют клетки Мартинотти (до 70%). Еще один класс, который составляет 30% от общего числа, который представлен клетками, экспрессирующими ионотропный серотониновый рецептор 5HT3a (5HT3aR). Он включает в себя группу интернейронов, которые экспрессируют вазоактивный интестинальный (кишечный) пептид (VIP), и нейроглиаформные клетки, которые являются уникальными среди других интернейронов, так как они устанавливают электрические синапсы не только друг с другом, но и с другими типами интернейронов, в отличие от всех других протестированных типов интернейронов, которые создают электрические контакты только с гомологичными нейронами. Кроме того, каждый класс включает в себя несколько мелких групп интернейронов [98].
В дальнейшем эта классификация была расширена добавлением связей интернейронов и их функций в коре. Почти все интернейроны в неокортексе экспрессируют один из трех основных неперекрывающихся маркеров: парвальбумин (PV), соматостатин (SOM) и ионотропный рецептор серотонина 5HT3a (5HT3aR). Дальнейшие подразделения внутри каждой молекулярной группы выявляются по морфологическим признакам, клеточного и субклеточного нацеливания, экспрессии других маркеров, а также некоторым известным анатомическим, электрофизиологическим и синаптическим свойствам [109].
Исследование торможения у пирамидных нейронов 5 слоя на срезах соматосенсорной коры крысы показали, что при стимуляции интернейронов генерировались как быстрые, так и медленные ТПСП, но они возникали по отдельности, и смешанные ответы никогда не наблюдались. Таким образом, два механистически различных типа ТПСП, которые возникают в результате взаимодействия ГАМК с ГАМК А и ГАМК Б-рецепторами на нейронах неокортекса, могут быть опосредованы различными классами тормозных нейронов [9].
2.2. Функции интернейронов
Результаты исследований последнего времени показывают, что торможение в коре чрезвычайно сложно, так как в нем участвуют различные подклассы инетернейронов, которые в свою очередь состоят из разнородных по морфологическим и фукциональным свойствам единиц [32]. За прошедшие годы накопились данные, свидетельствующие о том, что ГАМКергические интернейроны играют важную роль во многих корковых функциях, включая регулирование усиления и модуляцию динамического диапазона кортикальных цепей, селективность сенсорных характеристик, пластичность, времéнную точность разрядов пирамидальных клеток, регулирование числа разрядов пирамидальных клеток, синхронизацию и генерацию корковых ритмов, а также в поддержании возбуждающего и тормозного баланса, необходимого для передачи информации при одновременном предотвращении чрезмерного возбуждения [109].
Считается, что ГАМКергические интернейроны играют важную роль в контроле времени разрядов пирамидных клеток, синхронизации, сетевой активности и генерации корковых ритмов. По-видимому, они реагируют на динамические изменения возбуждения, увеличивая динамический диапазон корковых нейронных сетей, контролируя сенсорные рецептивные поля, пластичность, поддерживая баланс возбуждения и торможения, необходимый для передачи информации, в то же время предотвращая выход из-под контроля возбуждения [98].
Такое разнообразие функций интернейронов существенно для работы мозга – выключение одного типа интернейронов или рецепторов не приводит к исчезновению торможения и в этих условиях продолжает действовать торможение другого типа [1]. Поэтому очень упрощенным является подход, в котором возникновение эпилепсии, заболевания, признаком которого является гиперсинхронизация, рассматривается как дефицит торможения [46], что не соответствует реальным процессам, происходящим в неокортексе.
2.3. Торможение через ГАМК Б-рецепторы
Для нас наибольший интерес представляют типы интернейронов, осуществляющих торможение посредством ГАМК Б-рецепторов. Не только потому, что в последнее десятилетие получены данные о том, что уменьшение торможения, связанное с ГАМК Б-рецепторами, приводит к нарушению функций мозга [69], но и, главным образом, потому, что исследование механизмов синхронизации интериктальных спайков проводилось нами в ситуации, когда ГАМК А-рецепторы были заблокированы. При блокировании ГАМК А-рецепторов в коре возникают интериктальные спайки, которые в дальнейшем синхронизируются. Такая экспериментальная модель является очень удобной для исследования механизмов синхронизации [1].
К таким интернейронам относятся: клетки Мартинотти [113, 112 ], которые составляют более 70% клеток, экспрессирующих протеин соматостатин (SOM+), и которые тормозят дистальные дендриты пирамидных клеток [104] посредством ГАМК Б-рецепторов [118]; нейроглиаформные клетки [84, 107, 17 ], которые были описаны во всех слоях, но более распространены в супрагранулярных слоях и являются основным компонентом первого слоя неокортекса [109].
Существенно, что иммуногистохимические исследования локализовали рецепторы ГАМК Б как для пре-, так и для постсинаптических элементов как в возбуждающих, так и в ингибирующих синапсах [60]. В периформной коре обнаружено, что активация ГАМК Б-рецепторов имеет двойные эффекты in vivo – с одной стороны, подавляет спонтанную активность в пирамидных клетках, а с другой стороны, способствует периодической синхронной эпилептиформной активности в тех же клетках [39].
2.4. Соматостатиновые интернейроны (SOM+). Мартинотти клетки. Отличительные признаки
2.4.1. Соматостатиновые интернейроны (SOM+). Клетки SOM связны друг с другом в отличие от других интернейронов. Около 40% клеток SOM с низким порогом генерации спайков (LTS) создают тормозные связи друг с другом [33]. Один из основных подтипов ГАМКергических интернейронов – SOM-позитивные клетки, которые имеют низкий порог генерации спайков (LTS) и регулярную генерацию спайков (RS), как это было показано в этом исследовании, образуют обратные связи с 2-мя подтипами пирамидных клеток в слое 5 [77]. Существенно, что SOM-клетки имеют различные типы генерации разрядов, а также широкий спектр морфологических видов [55, 56, 70].
Проведенный недавно морфологический анализ продемонстрировал существование трех подтипов соматостатиновых интернейронов в 5-м слое с отчетливыми электрофизиологическими свойствами: Т-образные клетки Мартинотти, имеющие низкий порог генерации спайков, которые тормозят близлежащие пирамидные клетки через апикальные дендриты слоя 1; веерообразные клетки Мартинотти также тормозят близлежащие пирамидные клетки, но через апикальные дендриты слоев 2/3 и нижнюю половину слоя 1 и демонстрируют адаптирующиеся схемы разрядов. Клетки, не принадлежащие к подтипу Мартинотти, тормозят нейроны слоя 4, но, при этом, не тормозят пирамиды слоя 5 и демонстрируют квази-быстрый образец разрядов [83]. В других работах соматостатиновые интернейроны описываются как клетки, имеющие регулярные спайки (RS) только в одной трети SOM-клеток, а остальные SOM-клетки проявляли FS-свойства, сходные с PV-клетками, что позволяет предположить наличие по крайней мере двух классов SOM-клеток в пириформной коре головного мозга мышей [61].
2.4.2. Соматостатиновые интернейроны – ГАМК Б. В соматосенсорной коре мышей активность подавлялась посредством активации пресинаптических ГАМК Б-рецепторов, управляемых активностью соматостатин-экспрессирующих интернейронов, которые обеспечивали медленное торможение в коре длительностью более 100 мс после быстрой фазы торможения. При оптогенетическом подавлении активности соматостатиновых интернейронов происходило повышения амплитуды ВПСП и увеличение нейронной активности, эти эффекты были полностью обратимыми и устранялись антагонистами ГАМК Б-рецепторов [112].
2.4.3. Мартинотти клетки. Отличительные признаки. SOM интернейроны не являются однородным классом, но те, что присутствуют в слоях 2/3 и 5 и аксон которых заканчивается в слое 1 коры соответствуют по морфологическим критериям клеткам Мартинотти [119, 70 ]. Карло Мартинотти первый сделал сообщение о клетках в слое 5 коры в 1889 г. Позднее они получили название по его фамилии [119].
Клетки SOM включают группу нейронов, которые были идентифицированы, с использованием различных анатомических и электрофизиологических критериев, как клетки “Мартинотти”, bitufted-клетки (“с двумя пучками”), клетки с регулярным разрядами (RS) или не пирамидные клетки, или клетки с низким порогом генерации спайков (LTS) [30, 56, 119]. Интернейроны неокортекса соматостатин-позитивные клетки состоят из нескольких подтипов, из которых нейроны Мартинотти являются преобладающим типом [98]. Как в зрительной, так и в соматосенсорной коре LTS-интернейроны представляли собой соматостатин-позитивные клетки Martinotti, сконцентрированные в слое 5, с плотной аксональной иннервацией в слое 1 [41]. Необходимо отметить, что клетки Martinotti формируют ~70% SOM-экспрессирующих клеток в коре головного мозга [48].
Характерной особенностью клеток Мартинотти является то, что они имеют дендриты, умеренно покрытые шипиками, и аксоны, которые восходят к слою 1 и иннервируют дендриты пирамидных нейронов [57, 119].
2.4.4. Морфология Мартинотти клеток. Характерной чертой морфологической характеристики Мартинотти интернейронов является длинный восходящий аксон, который проецируется и горизонтально ветвится в 1 слое коры [53, 104, 50, 98 ] на расстояние до 1 миллиметра [119].
Клетки Мартинотти в основном присутствуют в слоях 2/3 и 5/6. Для них характерна локальная аксонная “беседка” и длинный восходящий аксон, который распространяется и значительно расширяется в слое 1, а также биполярные или многополярные дендриты [109].
Дендритное дерево значительно меньше аксонального, сома клеток яйцевидная или веретенообразная [53, 54, 119]. Хотя все они имеют некоторые общие анатомические, электрофизиологические и биохимические свойства. Но наблюдаются четкие различия морфологических признаков клеток Мартинотти специфичные для слоев 2/3–6 коры [119].
2.4.5. Расположение в коре и проекции. Связи. Электронно-микроскопическое исследование Мартинотти-клеток показало, что все синапсы были симметричными и большинство синапсов (71%) были сформированы на дендритах. Было обнаружено, что они контактируют с апикальными и базальными дендритами во многих неокортикальных слоях: Мартинотти-клетки из слоя 2/3 нацелены в основном на слой 1 и в меньшей степени на слой 2/3; из слоя 4 нацелены в основном на слой 4 и в меньшей степени на слой 1; из слоя 5 и 6 были нацелены в основном на слой 4 и слой 1 и в меньшей степени на слой, в котором располагались их сомы [119].
Пирамидные нейроны в локальной нейронной сети (в пределах 100 мк) 5-го слоя коры образуют с соседними пирамидными нейронами моносинаптические возбудительные связи и дисинаптические тормозные. Кроме этого, что крайне существенно, клетки Мартинотти образуют возвратное торможение с пирамидными нейронами 5 слоя через апикальные дендриты 1-го слоя (того же пирамидного нейрона, который инициирует эту активность). Эта схема предлагается в качестве центрального механизма регулирования корковой активности [104].
Клетки Мартинотти иннервируют дистальные дендриты пирамидных нейронов в слое 1. В отличие от большинства других типов нейронов слоев 2/3, SOM нейроны получают сильно облегчающий возбуждающий синаптический вход от близлежащих пирамидных нейронов. Активность SOM интернейронов в зоне бочонков в слоях 2/3 сенсомоторной коры бодрствующих мышей имеют отрицательную корреляцию со всеми другими соседними типами клеток. Это означает, что торможение дистальных дендритов, обеспечиваемое нейронами SOM снижается в то время, когда увеличиваются возбуждение и торможение других клеток [90].
Несмотря на то, что химических синапсов между нейронами SOM чрезвычайно мало, более половины проксимальных пар SOM-нейронов в неокортексе электрически связаны щелевыми контактами. Так, в зоне бочонков соматосенсорной коры мышей наблюдали синхронизацию спайковой активности экспрессирющих соматостатин пары интернейронов за счет взаимосвязи между ними посредством электрических синапсов [45].
Клетки, которые по морфологии, по-видимому, во многих случаях являются клетками Мартинотти, часто связаны с другими клетками Мартинотти в слое 2/3 соматосенсорной коры мышей. Эти супрагранулярные интернейроны образуют электрически связанную сеть, которая оказывает когерентное тормозное влияние в частотах 3–10 Гц на свои нейроны-мишени [30].
Используя методы оптогенетики, исследовали большой дальности входы от M1 до различных нейронных элементов в S1. Было обнаружено, что SOM-интернейроны получили самый слабый вклад от M1. В SOM-интернейроне фотостимуляция вызвала очень маленькие ВПСП, сопровождаемые выраженным тормозным постсинаптическим током [63].
Неокортикальные нейроны SOM, по-видимому, получают возбуждающий синаптический вход преимущественно из локальных и отдаленных кортикальных областей, а не из подкорковых областей [49, 48, 91 ].
2.4.6. Участие клеток Мартинотти в торможении.
2.4.6.1. Торможение пирамидных нейронов. В ряде работ были определены характеристики торможения между самими клетками Мартинотти (МК) и торможения пирамидных нейронов. Чрезвычайно важным свойством МК является торможение интернейронов других классов и, что не менее важно, торможение самих клеток Мартинотти по принципу обратных связей в нейронных сетях старой и новой коры. В связи с этим крайне интересным свойством МК является то, что в отличие от многих других корковых связей, синапс между пирамидной клеткой и клеткой Мартинотти является облегчающим. Высокочастотная стимуляция пирамидной клетки может вызывать спайковую активность клетки Мартинотти, что обеспечивает уровень торможения, зависящий от предыдущего уровня возбуждения в сети. Короткий высокочастотный разряд в нескольких пирамидных нейронах может служить затвором для дальнейшего возбуждения апикальных дендритов всей колонки. Это торможение способствует подпороговым корреляциям и синхронизации спайков в пирамидных клетках [10]. От себя заметим, что таким образом клетки Мартинотти создают временнόе окно интеграции в корковых нейронных сетях.
Клетки Мартинотти легко индуцируют дисинаптическое торможение между пучками дендритов пирамидных нейронов 5-го слоя [44, 104], что говорит о том, что они сильно иннервируются подтипами пирамидных клеток 5 слоя.
Кроме того, что клетки Мартинотти так же, как и нейроглиаформные интернейроны, действуют на дендриты пирамидных нейронов, они включаются при разных условиях и действуют по разным механизмам и, что особенно важно, осуществляют тормозный контроль в корковых сетях in vivo [87].
Одним из важных свойств соматостатиновых интернейронов является торможение посредством ГАМК Б рецепторов в пресинаптических синапсах. SOM-интернейроны (которые по своим характеристикам соответствовали клеткам Мартинотти) активирует пресинаптические рецепторы ГАМК Б в синапсах пирамидных клеток во 2-ом слое неокортекса, глубоко подавляя передачу и во многих случаях эффективно подавляя синапсы. Оптогенетическое подавление активности SOM-нейронов было достаточным для снижения частоты синаптических сбоев и увеличения средней амплитуды ВПСП. Этот эффект был полностью обратимым и перекрывался антагонистами ГАМК Б. Эти данные указывают на то, что SOM-интернейроны могут быстро и обратимо тормозить возбуждающие синапсы посредством регуляции пресинаптического высвобождения. Поскольку было показано, что активность SOM-интернейрона регулируется сенсорным и моторным входом, эти результаты предполагают механизм, с помощью которого функциональная связь и синаптическая пластичность могут регулироваться в зависимости от состояния. Текущая активность SOM-клеток также может модулировать возбуждающую передачу через ГАМКергическую активацию пресинаптических ГАМК Б-рецепторов [113].
2.4.6.2. Возвратные связи между пирамидными нейронами и клетками Мартинотти. Для понимания функций клеток Мартинотти в коре существенно, что их реализация происходит по обратным связям в неокортоксе. Так, одновременная стимуляция пирамидных клеток и клеток Мартинотти 5-го слоя показала, что синхронизация пирамидных нейронов в этом слое осуществляется по обратным связям между клетками Мартинотти и пирамидами [44]. Торможение через дендриты SOM интернейронов в возвратных нейронных сетях с возбуждающими нейронами является достаточным для генерации ритмов гамма-диапазона и создания когерентности между возбуждающими нейронами [116].
2.4.6.3. Торможение интернейронов. В коре интернейроны осуществляют торможение не только возбудительных нейронов, но в значительной степени друг друга, создавая таким образом облегчение. В локальных нейронных сетях неокортекса мышей между группами интернейронов VIP и PV были обнаружены взаимные тормозные связи. Также взаимосвязи были установлены между VIP и SOM интернейронами. Существенно, что VIP и SOM привлекают к участию своих членов популяции через четыре механизма: электрическая связь, полное отсутствие (SOM) или относительный дефицит (VIP) торможения в популяции, сильное VIP через высвобождение ACh. Пара интернейронов в популяции PV и SOM взаимно тормозят друг друга и получают локальное возбуждение с различной динамикой – если они получают возбуждение одновременно, то прямое взаимное торможение между ними не возникает. На основании полученных данных была предлoжена новая модель нейронных связей интернейронов в неокортексе, включающая взаимные тормозные популяции, а не последовательную иерархию популяций [52].
В обонятельной коре соматостатин-экспрессирующие интернейроны обычно описываются как регулярные спайки (RS) или низкопороговые спайки (LTS), то есть являются клетками Мартинотти. В неокортексе, было обнаружено, что SOM-клетки широко тормозят ряд не идентифицированных классов интернейронов, включая предположительно идентифицированные PV-клетки и, что удивительно, другие SOM-клетки. Кроме того SOM-клетки тормозят дендриты пирамидных нейронов и, таким образом, влияют на дендритную интеграцию афферентных и возвратных входов в интеринальную (пириформную) кору. В целом, эти результаты показывают, что интернейроны SOM играют важную роль в регуляции как возбуждения, так и торможения во время процесса обоняния. В отличие от предыдущих данных о том, что клетки SOM не ингибируют друг друга в неокортексе [91], было обнаружено, что клетки SOM ингибируют другие клетки SOM в периформной коре [61].
Наблюдаются существенные отличия клеток Мартинотти от интернейронов других классов. Тогда как у бодрствующих мышей медленные флуктуации мембранного потенциала большой амплитуды очень синхронны в PV, 5HT3aR и возбуждающих нейронах, то эти флуктуации сильно снижены и негативно связаны с нейронами SOM. Таким образом, нейроны SOM имеют другую динамику спонтанного мембранного потенциала по сравнению со всеми другими классами соседних нейронов. Нейроны SOM также уникальны тем, что они гиперполяризованы и тормозятся входным сигналом от вибрисс, тогда как PV, 5HT3aR и возбуждающие нейроны деполяризуются и возбуждаются сенсорной стимуляцией. Активность SOM интернейронов в зоне бочонков в слоях 2/3 сенсомоторной коры бодрствующих мышей имеют отрицательную корреляцию со всеми другими соседними типами клеток. Это означает, что торможение дистальных дендритов, обеспечиваемое SOM-клетками, снижается в то время, когда увеличиваются возбуждение и торможение других клеток [38].
2.4.6.4. Отсутствие связей между SOM интернейронами. В результате исследований была определена архитектура нейронных сетей, в которых клетки VIP тормозят клетки SOM, и наоборот. SOM-клетки тормозят все тормозные нейроны, кроме самих SOM-клеток, избегают друг друга [91].
Поскольку SOM-интернейроны не тормозят друг друга, но ингибируют нейроны PV, то в условиях, когда размер зрительного стимула увеличивается, величина ответа и количество SOM интернейронов, рекрутированных в поверхностных слоях зрительной коры мыши, продолжают увеличиваться. В это же время ответ пирамидных клеток и PV-интернейронов уменьшился из-за торможения, обеспечиваемого SOM-интернейронами [109]. Крайне важно, что в этих работах не выявлены связи друг с другом клеток Мартинотти, то есть они не тормозят активность одноименных клеток, в отличие от работ других авторов, в которых такая связь была выявлена.
2.4.6.5. Торможение нейронов в других областях коры. Используя методы оптогенетики, исследовали входы большой дальности от моторной коры (M1) до различных нейронных элементов в соматосенсорной коре (S1). Обнаружили, что пирамидные нейроны M1 активировали в S1 VIP-интернейроны (один из подтипов 5HT3aR-интернейронов в поверхностных слоях S1), которые в свою очередь тормозили клетки SOM, которые были нацелены на дистальные дендриты пирамидных клеток S1. Кроме того между этими классами интернейронов наблюдался определенный антагонизм. In vivo, во время движения вибрисс, VIP-нейроны были сильно и специфически активированы, тогда как активность SOM-интернейронов в этот момент была подавлена [63].
Были получены данные, которые также свидетельствовали о том, что взаимное торможение между PV и SOM интернейронами поддерживает совместную активность в обеих популяциях [51].
2.5. Нейроглиоформные интернейроны
Еще один класс интернейронов обычно обозначают как 5HT3аR (cеротонин, 5-гидрокситриптамин 3а), которые включают по крайней мере два разных подкласса ГАМКергических нейронов, один из которых является нейроглиаформными клетками [90]. 5HT3aR интернейроны составляют треть всех ГАМКергических интернейронов [62, 98]. Кроме того, что нейроглиаформные клетки экспрессируют 5HT3aR, они очень часто экспрессируют рилин и NPY (нейропептид Y) [62, 32 ].
2.5.1. Морфология. В разных работах строение нейроглиаформных клеток описывается по-разному. Так, в одних работах нейроглиаформные клетки имеют разветвление аксонов, похожее на паутину [21, 32], или с вытянутым древовидным ветвлением аксонов [48], или в виде плотного аксонального облака, образованного одной нейроглиаформной клеткой [84]. Нейроглиаформные клетки имеют горизонтально растягивающиеся аксональные коллатерали в слое 1 [47, 48], и их аксональные коллатерали простираются на несколько сотен микрон.
2.5.2. ГАМК Б-рецепторы. Нейроглиаформные клетки представляют большой интерес тем, что в отличие от других ГАМК-клеток, они вызывали комбинированные ГАМК А и ГАМК Б-опосредованные рецепторами ответы и были преимущественно нацелены на дендритные шипики пирамидных нейронов [107].
Нейроглиаформные клетки опосредуют бόльшую часть их тормозного действия на дендриты через рецепторы ГАМК Б. Влияние ГАМК Б-торможения осуществляемого нейроглиаформными клетками на пирамидальные нейроны является значительным [88].
Крайне важно, что нейроглиаформные клетки могут иметь в качестве мишени как постсинаптические ГАМК Б-рецепторы, так и пресинаптические ГАМК Б-рецепторы, расположенные на глутаматергических окончаниях [20].
Электрофизиологические данные свидетельствуют о том, что рецепторы ГАМК Б, экспрессируемые нейроглиаформными интернейронами, способствуют динамическому контролю возбуждающего входа в пирамидные нейроны CA1. Поэтому связь нейроглиаформных клеток с пирамидными нейронами CA1 обеспечивает уникальный и тонкий механизм формирования временной области интеграции для сигналов, поступающих через главный возбуждающий вход в пирамидные клетки CA1 [92, 93], кроме того, экспериментальные данные показали, что ГАМК Б-рецепторы присутствуют как на пресинаптических, так и постсинаптических мембранах в синапсах между нейроглиаформными интернейронами [92].
У крыс единичные потенциалы действия в нейроглиаформных клетках вызывали компонент, опосредованный рецептором ГАМК Б, у нейронов с регулярными спайками и быстро разряжающихся интернейронах (PV) после компонента, опосредованного рецептором ГАМК А, в постсинаптических реакциях [85].
Существенно, что нейроглиаформные клети осуществляют постсинаптические связи посредством ГАМК Б-рецепторов. Они вызывают медленные, длительные ТПСП в пирамидных нейронах и других интернейронах за счет комбинированной активации рецепторов ГАМК А и ГАМК Б и являются единственными интернейронами, которые, как было показано, вызывали унитарные ответы ГАМК Б в ответ на единый потенциал действия. Кроме того они имели высокую вероятность соединения со всеми соседними нейронами [84].
Было отмечено, что в дополнение к ГАМК А-опосредованному синаптическому медленному торможению, нейроглиаформные клетки также осуществляют медленное торможение посредством активации постсинаптических метаботропных ГАМК Б-рецепторов [32].
Было установлено, что неокортикальные нейроглиаформные клетки модулируют свои собственные аксонные терминалы через ГАМК Б-рецепторы, так же, как нейроглиаформные клетки гиппокампа [87].
2.5.3. Расположение в коре и проекции. Связи.
2.5.3.1. Расположение в коре. Около 30–40% интернейронов 1-го слоя являются нейроглиаформными клетками. Нейроглиаформные интернейроны 1-го слоя, так же, как и клетки Мартинотти, имеют проекции на апикальные дендриты корковых пирамидных нейронов 5 слоя. Исследование in vivo показало, что вероятнее всего их можно активировать стимуляцией через каллозальные волокна, которая, по-видимому, вовлекает именно эту специфическую субпопуляцию, но не другие интернейроны 1 слоя [88]
Нейроглиаформные клетки были описаны во всех слоях, но более всего распространены в надгранулярных слоях, и являются основным компонентом 1-го слоя [32, 48, 109]. Следует отметить, что они редко наблюдаются в 5-ом слое коры [84, 48 ].
2.5.3.2. Дендриты мишени нейроглиаформных клеток. Данные электронной микроскопии показали синаптические контакты с нейроглиаформными клетками на дендритах и шипах и очень мало на соме [109].
Нейроглиаформные клетки нацелены на базальные и проксимальные апикальные косые дендриты и вызывают там медленные ТПСП. Они располагают тормозные синапсы на апикальных дендритах пирамидальных клеток, расположенных как в основной колонке, так и в соседних, тем самым тормозят бόльшую популяцию этих нейронов [32].
2.5.3.3. Связи в коре. Нейроглиаформные клетки были электрически связаны с другими нейроглиаформными клетками, клетками корзины, клетками, имеющими регулярные спайки, с аксо-аксонными клетками и с различными неклассифицированными интернейронами, демонстрирующими различные паттерны спайковой активности и морфологию [105].
Нейроглиаформные клетки могут тормозить все близрасположенные возбуждающие и тормозные нейроны путем синаптического и несинаптического торможения, так как образуют с ними не только химические, но и электрические синапсы, и это позволяет предположить, что таким образом регулируют активность нейронных сетей в глобальном масштабе [92, 32 ].
2.5.4. Торможение и растормаживание.
2.5.4.1. Синаптическое торможение. Нейроглиаформные интернейроны слоев 2/3 обычно тормозят дистальные дендриты пирамидных нейронов коры слоев 2/3 и 5. Нейроглиаформные клетки тормозят пирамидные нейроны как внутри той же колонки, так и между колонками на расстоянии до 300 мк [64].
В экспериментальных исследованиях были получены доказательства того, что длительно действующие ТПСП сочетаются с электрической связью между нейроглиаформными клетками и несколькими типами интернейронов человека и крысы. Синаптические потенциалы распространяются через электрически связанные сети интернейронов. Объединенные в обширную сеть электрических синапсов, связывающих несколько классов интернейронов, нейроглиаформные клетки способны контролировать под- и надпороговую активность связанных нейронов и могут преобразовывать эту активность в длительную химическую передачу сигналов через метаботропные рецепторы ГАМК Б в нескольких популяциях нейронов [85, 84 ].
Нейроглиаформные клетки могут тормозить все близрасположенные возбуждающие и тормозные нейроны путем синаптического и несинаптического торможения, так как образуют с ними не только химические, но и электрические синапсы, и это позволяет предположить, что таким образом регулируют активность нейронных сетей в глобальном масштабе [32].
Одиночные потенциалы действия в пресинаптической нейроглиаформной клетке вызывали медленный ТПСП в пирамидной клетке, за которым следовал длительный ТПСП в другой нейроглиаформной клетке [107, 105 ].
С большой доли уверенности утверждалось, что нейроглиаформные клетки являются основным средством управления мощного торможения нейронных сетей, которое, действуя через ГАМК Б-рецепторы, могут дифференцированно вовлекаться дальними связями, чтобы выполнять роли столь же разнообразные, как сознательное восприятие и консолидация памяти [20].
2.5.3.4. Объемное торможение. Характерной особенностью нейроглиаформных интернейронов, которая принципиально отличает их от всех интернейронов коры, является наличие объемной передачи. В этом случае тормозный медиатор ГАМК выбрасывается аксонами в межклеточное пространство. Наличие объемной передачи делает их главными кандидатами на осуществление синхронизации в нейронных сетях коры. Показано, что отдельные нейроглиаформные клетки выделяют ГАМК в объеме, достаточном для передачи в аксональном облаке, и, таким образом, нейроглиаформные клетки не требуют синапсов для получения тормозных реакций в подавляющем большинстве нейронов, находящихся поблизости [17, 84, 87, 107].
Объемная передача предполагает очень высокую скорость функциональной связи между нейроглиаформными клетками и соседними нейронами [84, 87]. Кроме того, небольшое количество нейроглиаформных клеток обладает возможностью вызывать далеко распространяющееся торможение путем активации рецепторов ГАМК Б посредством, по-видимому, неизбирательной объемной передачи [20, 109], хотя получены экспериментальные данные [17], показывающие, что мишени нейроглиаформных клеток могут быть более специфичными для синапсов, чем предполагалось. Из всех интернейронов только нейроглиаформные клетки, по-видимому, демонстрируют этот уникальный способ связи с другими нейронами [17, 32, 107].
2.5.3.5. Растормаживание (торможение интернейронов). Нейроглиаформные интернейроны устанавливают тормозные синапсы на пучках апикальных дендритов пирамидальных клеток, расположенных как в основной колонке, так и в соседних, тем самым тормозя большую популяцию этих нейронов. Кроме того, нейроглиаформные клетки слоя 1 нацелены на 3 типа интернейронов слоев 2/3 (клетки Мартинотти, нейроглиаформные клетки и биполярные клетки с двойным пучком дендритов (bitufted cell)), тем самым растормаживая пирамидные клетки [16, 32, 47].
2.6. VIP интернейроны
В коре мозга существует подкласс интернейронов, экспрессирующих вазоактивный интестинальный пептид (VIP). VIP-клетки принадлежат к классу интернейронов, которые экспрессируют серотониновый рецептор 5HT3a (40%) [62, 98].
2.6.1. Морфология. Аксоны VIP-интернейронов имели тенденцию спускаться от мягкой мозговой оболочки и были несколько уже, чем аксоны SOM или PV клеток. Так, вертикальная длина и горизонтальная длина у VIP клеток составляла в среднем 440 и 233 мкм соответственно, а у SOM: 756 и 615 мкм и у PV 628 и 649 мкм [51].
Клетки VIP в основном представляют собой биполярные/двухохолковые клетки, обладающие характерными вертикально ориентированными дендритами и аксонами, которые проходят через многие кортикальные слои. VIP-интернейроны в слоях 2/3 являются крупнейшей субпопуляцией 5HT3aR, имеют плотный домен аксонов в слое 2/3 и дендриты в обоих слоях 2/3 и 1 [95].
2.6.2. Расположение в коре и проекции. Связи. В то время как VIP-нейроны сравнительно редки в слое 5, почти 60% VIP-нейронов находятся в слоях 2/3. Их аксоны спускаются в более глубокие слои и соединяются с пирамидными клетками и интернейронами в 5-ом слое [47].
2.6.3. Действие через ГАМК Б-рецепторы. Только небольшая часть VIP-иммунопозитивных интернейронов связана с классическим источником медленного ингибирования ГАМК Б-рецепторами. 25% субпопуляции ГАМК Б интернейронов в базолатеральной амигдале составляли VIP-нейроны [75].
2.6.4. Торможение и растормаживание VIP-интернейронами. В неокортикальном слое 2/3 активация VIP-интернейронов может блокировать латеральное дисинаптическое торможение между пирамидными нейронами в срезах. Одиночные VIP-интернейроны могут оказывать локальное тормозное воздействие на окружающую нейронную сеть. Существенно, что VIP-интернейроны имеют растормаживающую зону диаметром ~240 мкм в общей зоне торможения, опосредованной SOM-клеткам. Поскольку VIP-интернейроны в основном нацелены на SOM-интернейроны, которые опосредуют торможение близлежащих пирамидных нейронов, то возможно, что роль VIP-интернейронов заключается в том, чтобы сделать пространственно ограниченные зоны, в которых блокируется торможение. При использовании оптогенетических методов для активации VIP-интернейронов, обнаруживается, что VIP-интернейроны тормозят соматостатиновые и некоторые парвальбуминовые интернейроны, что, в свою очередь, ослабляет торможение этими нейронами пирамидных клеток. Следует отметить, что VIP-интернейроны в слое 2/3 эффективно нацелены на соматостатиновые интернейроны, тогда как торможение парвальбуминовых интернейронов и пирамидных клеток относительно слабое, как и было предсказано анатомическими данными [51].
В слоях 2/3 было показано, что VIP-клетки нацелены на другие интернейроны как часть выделенных растормаживающих цепей. VIP-клетки появились как специалисты по растормаживанию, которые могут освободить сети пирамидных нейронов от торможения путем избирательного подавления других интернейронов, особенно клеток SOM. Показано, что в 5-ом слое клетки PV и SOM иннервируются VIP-тормозящими синапсами [80].
Функция растормаживания, осуществляемая VIP-интернейронами, носит глобальный характер. В нескольких областях коры, включая зону баррелов, зрительную, слуховую и префронтальную кору, было показано, что они опосредуют растормаживание пирамидных клеток посредством торможения SOM+ и/или PV+ интернейронов [32].
Последние данные свидетельствуют о том, что синапсы VIP-клеток находятся в первую очередь на SOM-клетках, избегая при этом пирамидные клетки. Таким образом, во время спонтанной сетевой активности, такой как Up-состояние, VIP-клетки могут растормаживать пирамидные клетки, тормозя SOM-клетки [81].
2.7. Парвальбумин-экспрессирующие (PV)-интернейроны
В коре существует большой класс интернейронов, экспрессирующих парвальбумин. Они ассоциируются с быстро-разряжающимися интернейронами (FS) [5, 56].
2.7.1. Морфология PV-интернейронов. Существует два типа парвальбуминовых нейронов: корзинчатые клетки, синапсы которых располагаются на соме и проксимальном дендрите нейронов мишени и обычно имеют многополярную морфологию, и клетки-канделябры, которые нацелены на начальные сегменты аксонов пирамидальных клеток [5, 56].
2.7.2. Торможение через активацию ГАМК Б-рецепторов. В зрительной коре разряды FS-нейронов высвобождают ГАМК, которая может активировать как ГАМК А, так и ГАМК Б-рецепторы. В этом исследовании было показано, что обе субъединицы ГАМК Б-рецепторов – (R)1a/b и R2 экспрессируются в клеточных телах и дендритах в 92–100% парвальбумин-содержащих интернейронов [42].
В срезах гиппокампа CA1 в пресинаптическом торможении 40% аксонных окончаний PV-интернейронов содержат ГАМК Б-рецепторы. PV содержат пресинаптические ГАМК Б-рецепторы на своих аксонных терминалах, действуя как авторецепторы [13].
В недавней работе было показано, что передача сигналов в постсинаптических ГАМК Б-рецепторах возбудительных нейронах необходима для долгосрочной депрессии торможения в выходном синапсе PV-интернейрона [115].
2.7.3. Нейроны мишени PV-содержащих интернейронов. Опосредованное FS-интернейронами торможение через активацию ГАМК Б рецепторов позволяет регулировать активность пирамидных нейронов с высокой степенью специфичности [117].
В работе были получены данные, что тормозные постсинаптические потенциалы в синаптических контактах между FS-интернейронами в 4-ом слое и возбуждающими нейронами того же слоя были опосредованы исключительно рецепторами ГАМК А. ТПСП полностью блокировался 25 мкМ габазином, антагонистом рецепторов ГАМК А. При этом никакого вклада ГАМК Б-рецепторов в тормозный ответ не наблюдалось [58].
3. РЕЦИПРОКНЫЕ СВЯЗИ НЕЙРОНОВ КОРЫ
3.1. Анатомические реципрокные связи
Между различными областями неокортекса выявлены анатомические реципрокные связи. При использовании анатомических трассеров были найдены проекции как из первичной моторной коры (M1) к соматосенсорной коре (S1), а также из S1 к M1, что свидетельствует о том, что эти области коры взаимно связаны. Кроме того, S1 и S2 области взаимно связаны, как показала ретроградная маркировка у мышей [4].
Необходимо отметить, что реципрокные проекции из первичной моторной коры в первичную сенсомоторную кору мышей иннервируют главным образом из слоев 5/6 и 1. Эти связи выполняют функции моторного контроля, обеспечивая быстрый негативный возвратный сигнал для сенсомоторной интеграции [74].
При использовании различных методов определения морфологических связей были найдены проекции из представительства зоны вибрисс S1 в представительство вибрисс M1 коры мышей и обратно. Так кортико-кортикальные нейроны в слоях 2/3 и 5а первичной моторной коры образуют мощную дисинаптическую обратную петлю со слоями 2/3 и 5а первичной сенсомоторной коры, связывая, таким образом, сенсорную и моторную кору [73].
Реципрокные связи существуют между другими областями мозга. Выявлены прямые и обратные связи между S1 и S2 (вторичная соматосенсорная кора), S2 и M1, S1 и M1. Обычно наблюдается реципрокная кортико-кортикальная связь, что предполагает двунаправленный поток информации, связывающей эти кортикальные области [31].
Необходимо отметить, что наличие морфологических связей в коре является необходимым, но не достаточным условием функциональных связей. Если рельсы проложены, то вовсе не обязательно, что по ним могут ходить поезда.
3.2. Функциональные реципрокные связи
3.2.1. Реципрокные пространственные связи между областями коры. На самом деле поразительно, что несколько областей головного мозга связаны двунаправленно через ГАМКергические клетки проекциями большой дальности, которые заканчиваются преимущественно на тормозных клетках в целевой области. На основании этих результатов предполагается, что ГАМКергические клетки с проекциями (отростками) большой дальности осуществляют синхронную активность между отдаленными областями мозга через обратные связи [15, 76].
Небольшое подмножество (6–9%) клеток SOM, которые экспрессируют NPY, образуют особый морфологический класс, с проекциями аксонов на большие расстояния. Хотя их немного, они могут проецироваться на несколько областей мозга, как по горизонтали, так и по вертикали, что делает их хорошими кандидатами для синхронизации нейронной активности между несколькими корковыми и подкорковыми областями [123].
Были получены экспериментальные данные наличия прямых дальних тормозных связей между пирамидными нейронами из одной области лимбической коры и интернейронами (NPY+) другой. Но они также включают нейронную цепь между областями, которая взаимно (реципрокно) регулирует активность друг друга [100].
Исследования на срезах коры мышей связей между S1 и M1 областями показали, что эти области связаны прямыми проекциями в обоих направлениях. Ответы с большей величиной наблюдались в направлении прямой связи (S1–M1), тогда как ответы с обратной связью (M1–S1) возникали при более коротких задержках. Несмотря на расстояние около 3 мм между двумя областями, в них наблюдались коротколатентные, преимущественно моносинаптические, ответы после электрической стимуляции как S1, так и M1. Предполагается, что функции обратной связи от M1 до S1 могут служить для синхронизации активности клеток, реагирующих на стимуляцию вибрисс [96].
При исследовании функциональных связей между областями коры, находящимися на значительном удалении друг от друга, у трансгенных мышей электростимуляция в области S1 вызывала местные реакции кальция в местах, которые предположительно соответствуют ипсилатеральной области М1. Соответственно, картирование с помощью внутрикорковой микростимуляция области M1 мозга вызывало устойчивые локальные кальциевые реакции в ипсилатеральной области S1, а также в контралатеральных областях M1. Таким образом, было выявлено точное пространственное расположение обратных функциональных связей между областями M1, S1 и S2 [114].
Также на трансгенных мышах in vivo были исследованы функциональные реципрокные связи между удаленными первичными сенсорными и ассоциативными областями коры с использованием стимуляции Channelrhodopsin-2 и потенциал зависимых красителей. Было показано, что зоны представительства передней и задней лапы в S1 имеют реципрокные связи и были в состоянии возбуждать М1. Фотостимуляция зоны представительства баррелов в S1 вызывала возбуждение в М1 в зонах представительства передней и задней лапы [67].
3.2.2. Реципрокные связи пирамидных клеток и интернейронов (локальные). В локальных нейронных сетях коры пирамидные нейроны и интернейроны образуют обратные связи друг с другом. В основном такие взаимосвязи были установлены между SOM-интернейронами и пирамидными клетками [52].
В экспериментах было показано, что одновременная стимуляция пирамидных клеток и клеток Мартинотти 5-го слоя вызывала синхронизацию пирамидных нейронов в этом слое и что она осуществляется по обратным связям между клетками Мартинотти и пирамидами [44].
Низкопороговые интернейроны образовывали отдельные возвратные тормозные цепи с каждым из 2 подтипов пирамидных нейронов [77].
Между экспрессирующими соматостанин-интернейронами 3-го слоя и пирамидными нейронами также наблюдались реципрокные связи, причем, если активация интернейронов вызывает ТПСП в пирамидных нейронах, то активация пирамидных клеток вызывает потенциацию у интернейронов [30].
Клетки Мартинотти участвуют в торможении пирамидных нейронов в слое 5 путем дисинаптической обратной связи [14, 79, 103].
Обратные связи существуют не только между пирамидными нейронами и интернейронами, но интернейроны создают взаимные (реципрокные) синаптические связи друг с другом [46].
4. МЕХАНИЗМЫ СИНХРОНИЗАЦИИ В КОРЕ
В коре существует несколько механизмов взаимодействия между нейронными сетями, которое находит свое отражение в синхронизации электрической активности (табл. 1). Причем это взаимодействие осуществляется как в локальном пуле коры, так и между удаленными областями. Крайне важно, что торможение напрямую связано с синхронизацией нейронов, установлением скорости колебаний и поддержанием их когерентности в пространстве [46].
Таблица 1.
Механизмы синхронизации в коре
| Способы синхронизации | Локальные | Пространственные |
|---|---|---|
| Через электрические синапсы | + | |
| Посредством электрических полей | + | + |
| Объемной передачи | + | |
| Через общий вход | + | + |
| Посредством обратной связи между нейронами | + | + |
| Созданием временного окна интеграции | + | + |
4.1. Электрические связи между интернейронами как механизм синхронизации
4.1.1. Посредством электрических синапсов. Важное свойство интернейронов оказывается решающим для генерации синхронизированных колебаний. Интернейроны электрически связаны, что позволяет синхронизировать их большие популяции интернейронов с точностью до миллисекунды [46].
Точная синхронность может возникать между двумя интернейронами, электрически соединенными через щелевые соединения, химически, через быстрые тормозные синапсы, или через оба типа соединений [45]. Синхронизация посредством электрических синапсов наблюдается у различных типов интернейронов. Нейронная сеть из FS-интернейронов (PV) за счет связи посредством электрических синапсов может обеспечивать синхронную активность нейронов неокортекса [36]. Следует отметить, что такой механизм синхронизации работает даже при блокаде ГАМК А-рецепторов [40].
Синхронизация электрической активности может обеспечиваться еще одним типом интернейронов коры – соматостатин-экспрессирующими. Так, электрические синапсы между тормозными интернейронами с низким порогом генерации спайков (LTS) способны обеспечивать надежную синхронизацию спайковой активности [71]. У интернейронов, представленных клетками Мартинотти, наблюдали сильную синхронизацию активности за счет электрических синапсов. Отличительной особенностью соматостатин-экспрессирующих интернейронов (в основном это клетки Мартинотти), сомы которых находятся в 3-ем слое неокортекса мышей, является то, что они имеют сильные электрические связи между собой, но не с другими типами интернейронов [30]. В зоне баррелов соматосенсорной коры мышей наблюдали синхронизацию спайковой активности экспрессирующих-соматостатин пары интернейронов за счет взаимосвязи между ними посредством электрических синапсов [45].
Еще один тип интернейронов – нейроглиаформные клетки занимают уникальное положение среди кортикальных интернейронов, поскольку они устанавливают электрические синапсы не только друг с другом, но и с другими типами интернейронов в неокортексе и в области CA1 гиппокампа. Таким образом, нейроглиаформные клетки связывают множество сетей интернейронов и предположительно играют центральную роль в генерации и формировании синхронизированной активности нейронных сетей. В значительной степени этому способствует действие совместного ГАМК А и ГАМК Б-рецептор-опосредованного торможения на пирамидальные клетки [105].
4.1.2. Синхронизация посредством полевых потенциалов. Интериктальные спайки имеют большую амплитуду, составляющую несколько милливольт. Этот полевой потенциал распространяется на большие расстояния по коре и, что особенно существенно, практически мгновенно, в отличие от распространения активности по нейронам [3].
Активность популяции нейронных сетей и создаваемые ею эндогенные электрические поля формируют обратную связь: колебания активности вызывают изменения эндогенных электрических полей, которые действуют в свою очередь на потенциал мембраны нейронов, которые генерируют популяционную активность. Электрическая активность может, таким образом, представлять собой динамический механизм обратной связи, который модулирует и направляет активность нейронных цепей. В случае нейронных колебаний такой предлагаемый сигнал глобальной обратной связи может служить в качестве сигнала синхронизации в масштабах всей сети, который улучшает пространственно-временную структуру сетевой активности [35].
4.2. Синаптические связи интернейронов как механизм синхронизации
Существенно, что синхронизация электрической активности в коре определяется в первую очередь собственными корковыми механизмами [43]. Исследования механизмов гамма-осцилляций позволили предположить, что существуют два основных механизма, с помощью которых могут генерироваться колебания в локальной сети гиппокампа: вовлечение межнейронной сети, синхронизированной взаимными ГАМКергическими соединениями и/или щелевыми соединениями [72]. Главную роль здесь играют синаптические связи между различными типами нейронов в коре.
Торможение напрямую связано с синхронизацией участвующих нейронов, установлением скорости колебаний и поддержанием их когерентности в пространстве. Важным свойством интернейронов, оказывающимся решающим для генерации синхронизированных колебаний является то, что интернейроны создают взаимные реципрокные синаптические связи друг с другом [46].
Существенно, что синхронизация эпилептической активности в корковых нейронных сетях генерируется за счет взаимных синаптических связей между тремя нейронными сетями интернейронов, экспрессирующих парвальбумин (PV), соматостатин (SOM) и вазоактивный интестинальный пептид (VIP). Хотя вклад каждой группы интернейронов в синхронизацию различен [12].
В бочонке сенсомоторной коры мышей во время активации вибриссы и в покое наблюдалась синхронизация активности между пирамидными нейронами и экспрессирующими парвальбумин PV, нейроглиаформными интернейронами за счет синаптических связей. Высокая степень синхронизации наблюдалась и между интернейронами в условиях спокойного и активного бодрствования [37].
В экспериментальной работе были получены данные о том, что синхронизация спайков пирамидных нейронов происходит в значительной степени за счет обратных связей между парвальбуминовыми позитивными интернейронами и пирамидными нейронами [101].
Необходимо отметить, что фактически совместное существование химических и электрических синапсов в интернейронах зрелой коры важно для генерации синхронной активности [23].
4.3. Пространственная синхронизация через общий возбудительный вход
Пространственная синхронизация нейронов в разных областях коры может создаваться, когда на общий возбуждающий вход пирамидных нейронов одновременно подаются сигналы от сенсорных структур или других областей, в частности от таламуса через активацию ГАМК Б-рецепторов [17].
Синхронизация активности соседних возбудительных клеток и интернейронов может происходить в результате стимуляции общего входа. Действительно, стимуляция пирамидальных клеток слоя 2/3 индуцировала синхронные ВПСП с постоянной латентностью в обеих клетках в паре пирамида/интернейрон [86].
4.4. Реципрокные связи как механизм синхронизации
Были предложены механизмы синхронизации при генерации высокочастотных ритмов, которые заключаются в том, что в нейронных сетях существуют конвергенция и дивергенция связей между пирамидными нейронами и FS-интернейронами, которые приводят к синхронизации синаптических входов и разрядов потенциалов действия в соседних клетках. Конвергенция связей от пирамидных нейронов к FS-интернейронам по обратным связям может быть особенно важна для синхронизации клеток FS [101].
Используя оригинальный метод оптогенетической стимуляция тормозных клеток Мартинотти, стимул запускался активностью пирамидной клетки. Последовательность спайков соседних, не связанных между собой пирамидных нейронов 5-го слоя становится синхронной посредством торможения клетками Мартинотти. Синхронизация осуществляется благодаря обратным связям клеток Мартинотти через дендриты пирамидных нейронов 5-го слоя [44].
В экспериментах регистрировалась активность двух соседних пирамидных нейронов в срезе коры мышей. Активность одной из пирамидных клеток через систему приборов вызывала световой стимул, который в свою очередь вызывал активность SOM-интернейронов. В результате чего между пирамидными нейронами наблюдалась синхронизация активности. Эти эксперименты на животных показали, что в зрительной коре нейронная сеть, состоящая из обратных связей пирамидных нейронов и SOM-интернейронов через дендриты синхронизируют активность возбудительных нейронов. Задача этих экспериментов состояла в том, чтобы выявить участие нейронов SOM в гамма-колебаниях на больших расстояниях в первичной зрительной коре, и что они также могут играть ключевую роль в межобластной гамма-синхронизации. Это согласуется с тем фактом, что нейроны SOM в первичной зрительной коре, как было показано, входят в число мишеней для дальнодействующего нисходящего входа из областей более высокого кортикального слоя. Нейроны SOM могут также способствовать локальным гамма-колебаниям в других областях мозга [116].
Взаимодействия между ГАМКергическими интернейронами и глутаматергическими основными клетками являются взаимными: интернейроны тормозят пирамидные клетки и возбуждаются ими. На самом деле связь между этими двумя нейронными классами достаточно большая: отдельные интернейроны могут тормозить >50% пирамидных клеток, расположенных в пределах ~100 мкм, и получать возбуждающий сигнал от большой их части.
Торможение напрямую связано не только с генерацией быстрых колебаний (осцилляций), но также с синхронизацией нейронов, установлением скорости колебаний и поддержанием их когерентности в пространстве, которые основываются на реципрокных связях пирамидных нейронов и интернейронов. Тот факт, что отдельные корзинчатые клетки контактируют с очень большой частью соседних (то есть в пределах ~100 мкм) пирамидальных клеток и что отдельные пирамидальные клетки в свою очередь связываются со многими локальными тормозными нейронами, приводит к синхронному вовлечению больших популяций нейронов в колебание. Возможен и альтернативный механизм, основанный на взаимодействиях между тормозными нейронами, когда корзинчатые клетки взаимосвязаны через реципрокные тормозящие синапсы [46].
В 5-ом слое фронтальной коры крыс были исследованы связи между двумя типами пирамидных нейронов, FS и LTS интернейронов, которые представляют два наибольших подтипа ГАМКергических нейронов – парвальбуминовые (PV) и соматостатиновые (SOM) интернейроны соответственно. Было обнаружено, что оба подтипа интернейронов образуют обратные связи с пирамидными нейронами [77].
Как следует из наших неопубликованных данных, полученных в экспериментах, проведенных на модели интериктальной активности в коре, после блока ГАМК А-рецепторов в локальных участках коры (рис. 1а) возникают высокоамплитудные интериктальные спайки. Существенно, что в течение первоначального временного периода интериктальные спайки возникают в разные моменты времени в разных участках коры. Длительность тормозной фазы, следующей непосредственно после спайка в разных участках коры, были короткие. После того, как они начали возникать синхронно, длительность тормозной фазы интериктального спайка, возникающего первым, была длиннее, чем ранее до синхронизации и значительно длиннее чем у интериктального спайка, возникающего в соседнем участке коры с временной задержкой (рис. 1б, 1в).
Рис. 1.
Изменение длительности тормозной фазы интериктального спайка. (а). Верхняя панель – длительность фаз интериктального спайка в двух точках коры, расположенных на расстоянии 2 мм сразу после нанесения пенициллина. Синхронизация полностью отсутствует. Короткая длительность тормозных фаз. (б). Средняя панель – ситуация через 1250 с на (в). Максимальная степень синхронизации в данном эксперименте. Спайк сначала возникает на нижнем канале, и длительность тормозной фазы в два раза длиннее, чем на верхнем. (в). Нижняя панель – изменение длительностей тормозных фаз в течение эксперимента. Существенно, что чем больше степень синхронизации, тем длинней тормозная фаза после интериктального спайка Fig. 1. Change of duration of the inhibitory phase of interictal spike. (a) Upper panel – the duration of the phases of interictal spike in two points of the cortex, located at a distance of 2 mm immediately after application of penicillin. Synchronization is completely absent. Short duration of inhibitory phases. (б) Middle panel – situation in 1250 seconds on B. Maximum degree of synchronization in this experiment. The spike first occurs on the lower channel and the inhibitory phase is twice as long as on the upper channel. (в) Bottom panel – change of duration of the inhibitory phases during the experiment. It is important to note that the greater the degree of synchronization, the longer is the inhibitory phase after interictal spike.
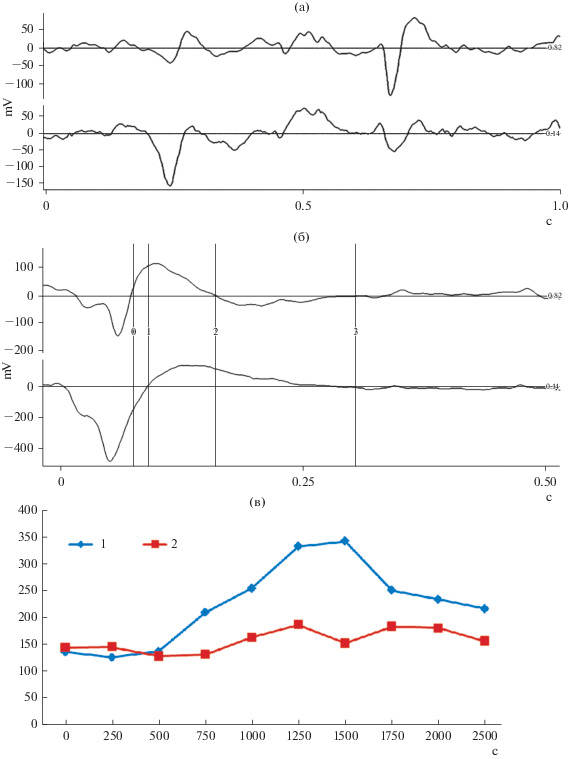
Большая амплитуда интериктальных спайков создается за счет одновременной активности нейронов в локальном участке коры в течение короткого временного окна. В самом начале одновременная активность нейронов может происходить, как показали наши данные, полученные на симуляционной модели в результате случайного совпадения активности группы нейронов в пуле, имеющих одинаковые временные параметры фаз возбуждения и торможения [2]. В данном случае наблюдается локальная синхронизация (рис. 1а). Мы предполагаем, что значительное удлинение тормозной фазы связано с действием обратного торможения, осуществляемого нейронными сетями находящихся на удалении друг от друга. Таким образом, создается временное окно интеграции, одновременно возникающее в коре, за счет обратных связей между пирамидными клетками и интернейронами и между интернейронами.
4.5. Временное окно как механизм интеграции, отражением которой является синхронизация электрической активности
Джон К. Экклс, писал: “Я всегда думаю, что торможение – это процесс создания скульптуры. Как бы то ни было, торможение высекает массу возбуждающего действия и придает более специфическую форму работе нейронов на каждом этапе синаптической ретрансляции” (Eccles, 1977). В данном высказывании содержится идея о создании торможением определенных рамок.
Временнόе окно в коре создается несколькими способами. Небольшое отставание между возбуждением и торможением создает короткое окно, в течение которого возможна интеграция синаптического возбуждения и последующего исчезновением спайков, что делает пирамидные клетки точными детекторами совпадений афферентного входа. Предполагалось, что наиболее вероятным механизмом синхронизации интериктальных спайков в нейронных сетях коры является создание с помощью торможения узкого временнόго окна, в течение которого возможна активность нейронов [78] и соответственно их интеграция, отражением которой является синхронизация.
Наличие мощного прямого торможения, предшествующего эпилептиформным потенциалам, было показано в работах, в которых большинству иктальных событий предшествовало торможение, регистрируемое внутриклеточно в клетках, расположенных на расстоянии 300 мкм друг от друга [110, 111]. После окончания торможения происходит взрыв активности в нейронном пуле, который определяется уже своими внутренними механизмами.
У пирамидных нейронов стимуляция током вызывала постсинаптические потенциалы периформной коры – короткую деполяризацию с последующей гиперполяризацией длительностью несколько сот миллисекунд, которая связана с ГАМК Б-рецепторами [39].
В сенсорных областях коры торможение укорачивает возбуждение, возникающее на сенсорную стимуляцию. Небольшое отставание между возбуждением и торможением создает короткое окно, дающее возможность для интеграции синаптического возбуждения и последующего выхода спайков и таким образом делает возбуждающие нейроны точными детекторами совпадений афферентного входа [46] и таким образом создает условия для одновременной активности нейронов в корковых нейронных сетях.
У нейронов слуховой коры крыс торможение на звуковую стимуляцию возникает после возбуждения с временнόй задержкой в несколько миллисекунд и таким образом может обострять нейронные ответы во времени, уменьшая степень случайности в функционировании коры, и кроме того создает короткое временнόе окно в течение которого возможна интеграция возбуждения нейронов [120].
Электрофизиологические данные свидетельствуют о том, что рецепторы ГАМК Б, экспрессируемые нейроглиаформными интернейронами, способствуют динамическому контролю возбуждающего входа в пирамидные нейроны CA1 гиппокампа. Поэтому связь нейроглиаформных клеток с пирамидными нейронами CA1 обеспечивает уникальный и тонкий механизм формирования временнόй области интеграции для сигналов, поступающих через главный возбуждающий вход в пирамидные клетки CA1. Нейроглиаформные клетки в гиппокампе с помощью прямого торможения участвуют в регуляции временнόго окна интеграции, подавляя освобождение ГАМК. Предполагается, что синхронное высвобождение ГАМК из нескольких интернейронов необходимо для активации рецепторов ГАМК в синапсах гиппокампа [93].
Следует отметить, что временны́е параметры интериктальных спайков – период возбуждения с последующей фазой молчания являются неким универсальным явлением, которые наблюдаются при других функциональных состояниях коры. Похожая динамика возбуждения и торможения существует при медленных осцилляциях и в состоянии UP и DOWN states в коре. Эти состояния характерны тем, что кратковременный период возбуждения сменяется периодом молчания. Ответственным за этот период является обратное торможение.
4.5.1. Торможение создает временные окна при медленных осцилляциях. В пионерской работе Стериада с соавторами были обнаружены медленные осцилляции в пирамидных нейронах коры меньше 1 Гц. Существенно, что следующие за периодами длительной деполяризации длительные периоды гиперполяризации у соседних нейронов были синхронизированы [106]. Также было показано, что во время медленных осцилляций в нейронах коры периоды деполяризации и длительной гиперполяризации отражаются в волнах в ЭЭГ [18].
Отметим, что в генерации медленной активности непосредственное участие принимали ГАМК Б рецепторы. Медленная кинетика рецепторов ГАМК Б аналогична медленным течениям состояний Up и Down, позволяя рецепторам ГАМК Б оказывать сильный синаптический эффект и таким образом контролировать частоту и синхронизацию медленных колебаний [60].
4.5.2. Временные окна при UP, DOWN states. У пирамидных нейронов в неокортексе крысы наблюдались флуктуации мембранного потенциала, когда гиперполяризованные периоды покоя чередуются с деполяризованными периодами с большими колебаниями напряжения и пиковой активностью. Такие деполяризованные и гиперполяризованные периоды были названы состояниями “вверх” и “вниз” (UP DOWN states) при первом их описании (Steriade). В данном случае период деполяризации рассматривался как временнόе окно интеграции [65].
Исследования роли соматостатин-экспрессирующих интернейронов показали, что в неокортексе может происходить разделение труда между ними и экспрессирующими парвальбумин (PV) FS-тормозными клетками, и они показали, что SOM-клетки могут способствовать прекращению UP-состояний, тогда как FS-клетки имеют меньше шансов сделать это. В пирамидных клетках возникает сильная гиперполяризация в ответ на активность SOM-интернейронов во время UP states. Кроме того, между этими нейронами существуют реципрокные связи [29].
В создании Up and Down states в энторинальной коре непосредственное участие принимают ГАМК Б-рецепторы и, в частности, в завершении Up states через обратные связи. Блокировка ГАМК Б-рецепторов удлиняет Up states [60]. Таким образом создается временно́е окно интеграции.
Во время медленной волны сна как спонтанное, так и вызванное прекращение UP state в срезах медиальной энторинальной коры крысы происходит с участием ГАМК Б-рецепторов. ГАМК Б-рецепторы, содержащие субъединицу ГАМК Б 1a, модулируют время прекращения спонтанного UP state, а рецепторы, содержащие субъединицу ГАМК Б 1b, необходимы для прекращения состояния UP state при электрической стимуляции в слое 1, то есть через афферентные входы [19].
4.5.3. Создание временного окна клетками Мартинотти, осуществляющие торможение посредством ГАМК Б-рецепторов. Одним из свойств нейронных сетей коры при синхронизации активности является создание временно́го окна интеграции с непосредственным участием торможения, создаваемого интернейронами связанными с ГАМК Б-рецепторами. Известный класс кортикальных тормозных интернейронов, которые экспрессируют соматостатин (SOM) – клетки Мартинотти имеют несколько характеристик, которые могут объяснить синхронную индукцию периодов выключения и связанных медленных волн в отсутствие соматического торможения. Так, у бодрствующих мышей было показано, что SOM+ экспрессирющие интернейроны (клетки Мартинотти) в коре разряжаются перед медленной волной, и при их оптогенетической стимуляцией во время ON периода в фазе медленного сна запускают длительный OFF период (гиперполяризации). Кроме того, клетки Мартинотти имеют уникально широкие и сложные аксональные образования [119], которые могут объяснить широкую синхронность медленных волн сна. Кроме этого, хемогенетическая активация клеток SOM+ способствует появлению медленных волн, которые электрофизиологически напоминают таковые в естественном сне NREM, что является признаком усиления нейронной синхронизации [34].
4.5.4. Обратные функциональные связи как механизм создания временно́го окна и синхронизации в локальных и пространственных нейронных сетях коры. При блокаде ГАМК А-рецепторов уменьшается соматическое торможение и появляется синхронизированная активность интериктальных спайков [1]. В основе появления данной активности, как было показано выше, лежит возвратное торможение посредством интернейронов Мартинотти, имеющих синапсы на апикальных дендритах пирамидных нейронов 1-го слоя коры [44, 104]. Ранее было показано сходство между механизмами возникновения интериктальных спайков и действием возвратного торможения в коре посредством клеток Мартинотти [124].
5. ЗАКЛЮЧЕНИЕ
На основании теоретических и экспериментальных данных разных авторов, представленных выше, можно предположить следующие схемы функциональных связей нейронов в коре, на основании которых может происходить интеграция в нейронных сетях, которая находит свое отражение в синхронизации интериктальных спайков в корковых структурах.
5.1. Первый тип функциональных связей (рис. 2а) представляет собой схема обратных связей между возбудительными клетками и тормозными интернейронами, и хотя эти связи непосредственно не связаны с синхронизацией активности, они являются важным элементом внутрикорковых связей. Основное их назначение заключается в создании периодической активности. Это осцилляции Up and Down states и интериктальные спайки, которые почти всегда синхронизированы.
5.2. Второй тип функциональных связей между нейронными сетями (рис. 2б) создает временно́е окно интеграции прямым дисинаптическим торможением в локальной нейронной сети в пределах 100 мк. В этом процессе создания как медленного, так и быстрого дисинаптического ТПСП участвуют преимущественно соматостатиновые и парвальбуминовые соответственно. Временно́е окно создается следующим образом. Активация пресинаптических пирамидных нейронов существенно увеличивает амплитуду и сокращает латентность начала медленного дисинаптического ТПСП в соседних пирамидных нейронах, что приводит к сужению временно́го окна для интеграции ВПСП. Обратное торможение может регулировать временно́е окно интеграции возбуждающих входов, обеспечивая, таким образом, механизм контроля по обратным связям времени генерирования спайков в пирамидных нейронах [124].
5.3. Третий тип функциональных связей (рис. 2в). Временно́е окно интеграции как в локальной нейронной сети, так и в различных областях может создаваться в результате внешнего воздействия на общий вход от сенсорных или других областей коры. В данном случае время одновременной активности определяется прямым и обратным торможением.
Рис. 2.
Схемы функциональных связей в коре между возбудительными (пирамиды) и тормозными нейронами (овалы), обеспечивающие синхронизацию интериктальных спайков, составленная на основании экспериментальных данных. Торможение осуществляется посредством ГАМК Б рецепторов (черные кружки) интернейронами экспрессирующие соматостатин (SOM), парвальбумин (PV), вазоактивный интестинальный пептид (VIP) и нейроглиаформными клетками (NGFC). (а) – Связи, обеспечивающие периодическую активность посредством обратных связей. (б) – Создание временного окна у соседних нейронов в локальной нейронной сети. (в) – Синхронизация через общий вход с созданием временного окна. (г) – Функциональные связи, которые обеспечивают синхронизацию интериктальных спайков между нейронными сетями расположенных на расстоянии с помощью создания временного окна и обратных связей. Каждый нейрон на схемах представляет нейронную популяцию. Все функциональные связи на (а), (б), (в) и (г) действуют одновременно и раздельно представлены для наглядности. Fig. 2. Schemes of functional connections in the cortex between excitatory (pyramids) and inhibitory neurons (ovals), providing synchronization of interictal spike made on the basis of experimental data. Inhibition is performed by GABA B receptors (black circles) by interneurons expressing somatostatin (SOM), parvalbumin (PV), vasoactive interstinal peptide (VIP) and neuroglioform cells (NGFC). (а) – connections that provide periodic activity through feedback. (б) – creation of time window for neighboring neurons in the local neural network. (в) – synchronization through the common input with creation of a time window. (г) – functional connections, which provide synchronization of interictal spike between neural networks located at a distance by creating a time window and feedback. Each neuron in the schemes represents a neural population. All functional connections on (а), (б), (в) and (г) operate simultaneously and are presented separately for illustration.
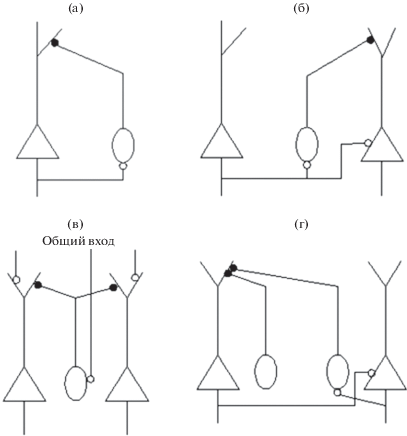
5.4. Четвертый тип функциональных связей. Удлинение торможения за счет обратного торможения от нейронов, расположенных на расстоянии (рис. 2г). При увеличении амплитуды интериктального спайка другие нейроны локальной нейронной сети могут быть активны только в момент, совпадающий по времени с активностью лидеров (временно́е окно), а активность остальных после временно́го окна тормозится с помощью обратного торможения, в результате чего происходит лавинное вовлечение соседних нейронов и увеличение амплитуды интерикальных спайков до максимума.
Отметим, что все эти функциональные связи работают одновременно, а раздельно представлены на рис. 2 для наглядности.
Список литературы
Марченко В.Г., Зайченко М.И. Динамика пространственной синхронизации эпилептиформных разрядов в неокортексе крыс // Журн. высш. нерв. деят. им. И.П. Павлова. 2015. Т. 65. № 1. С. 113.
Марченко В.Г., Салтыков К.А. Механизмы синхронизации в локальных нейронных сетях неокортекса. Модельные и экспериментальные исследования// Журн. высш. нерв. деят. им. И.П. Павлова. 2010. Т. 60. № 1. С. 80.
Марченко В.Г., Рысакова М.П., Зайченко М.И. Рраспространение внутренних электрических полей как возможный механизм синхронизации интериктальных спайков в неокортексе крыс // Журн. высш. нерв. деят. им. И.П. Павлова. 2018. Т. 68. № 2. С. 250.
Aronoff R., Matyas F., Mateo C. et al. Longrange connectivity of mouse primary somatosensory barrel cortex // Eur. J. Neurosci. 2010. V. 31. № 12. P. 2221.
Ascoli G.A., Alonso-Nanclares L., Anderson S.A., Barrionuevo G., Benavides-Piccione R., Burkhalter A., Buzsaki G. et al. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex // Nat Rev Neurosci. 2008. V. 9. № 7. P. 557.
Avoli M. Mechanisms of epileptiform synchronization in cortical neuronal networks// Curr Med Chem. 2014. V. 21. № 6. P. 653.
Avoli M., de Curtis M., Gnatkovsky V. et al. Specific imbalance of excitatory/inhibitory signaling establishes seizure onset pattern in temporal lobe epilepsy// J. Neurophysiol. 2016. V. 115. № 6. P. 3229–3237.
Barbarosie M., Avoli M. CA3-driven hippocampal-entorhinal loop controls rather than sustains in vitro limbic seizures // J. Neurosci. 1997. V. 17. № 23. P. 9308–9314.
Benardo L.S. Separate activation of fast and slow inhibitory postsynaptic potentials in rat neocortex in vitro // J. Physiol (Lond). 1994. V. 476. P. 203–215.
Berger T.K., Silberberg G., Perin R., Markram H. Brief bursts self-inhibit and correlate the pyramidal network // PLoS Biol. 2010. V. 8. № 9. e1000473.
Bink H., Sedigh-Sarvestani M., Fernandez-Lamo I. et al. Spatiotemporal Evolution of Focal Epileptiform Activity From Surface and Laminar Field Recordings in Cat Neocortex //J. Neurophysiol. 2018. V. 119. № 6. P. 2068–2081.
Bohannon A.S., Hablitz J.J. Optogenetic dissection of roles of specific cortical interneuron subtypes in GABAergic network synchronization // J. Physiol. 2018. V. 596. № 5. P. 901–919.
Booker S.A., Althof D., Degro C.E. et al. Differential surface density and modulatory effects of presynaptic GABAB receptors in hippocampal cholecystokinin and parvalbumin basket cells // Brain Struct. Funct. 2017. V. 222. № 8. P. 3677–3690.
Booker S.A., Loreth D., Gee A.L. et al. Postsynaptic GABABRs Inhibit L-Type Calcium Channels and Abolish Long-Term Potentiation in Hippocampal Somatostatin Interneurons // Cell Rep. 2018. V. 22. № 1. P. 36–43.
Caputi A., Melzer S., Michael M., Monyer H. The long and short of GABAergic neurons // Curr. Opin. Neurobiol. 2013. V. 23. № 2. P. 179–186.
Chauvière L., Doublet T., Ghestem A. et al. Changes in interictal spike features precede the onset of temporal lobe epilepsy // Ann. Neurol. 2012. V. 71. № 6. P. 805–814.
Chittajallu R., Pelkey K.A., McBain C.J. Neurogliaform cells dynamically regulate somatosensory integration via synapse-specific modulation // Nat. Neurosci. 2013. V. 16. № 1. P. 13–15.
Contreras D., Timofeev I., Steriade M. Mechanisms of long-lasting hyperpolarizations underlying slow sleep oscillations in cat corticothalamic networks // J. Physiol. 1996. V. 494 (Pt 1). P. 251–264.
Craig M.T., Mayne E.W., Bettler B., Paulsen O., McBain C.J. Distinct roles of GABAB1a- and GABAB1b-containing GABAB receptors in spontaneous and evoked termination of persistent cortical activity // J. Physiol. 2013. V. 591. № 4. P. 835–843.
Craig M.T., McBain C.J. The emerging role of GABAB receptors as regulators of network dynamics: fast actions from a 'slow' receptor // Curr. Opin. Neurobiol. 2014. V. № 26. P. 15–21.
Craig M.T., McBain C.J. Navigating the Circuitry of the Brain’s GPS System: Future Challenges for Neurophysiologists // Hippocampus. 2015. V. 25. № 6. P. 736–743. https://doi.org/10.1002/hipo.22456
D'Antuono M., Louvel J., Köhling R et al. GABAA receptor-dependent synchronization leads to ictogenesis in the human dysplastic cortex // Brain. 2004. V. 127 (Pt 7). P. 1626–1640.
Deans M.R., Gibson J.R., Sellitto C., Connors B.W., Paul D.L. Synchronous activity of inhibitory networks in neocortex requires electrical synapses containing connexin36 // Neuron. 2001. V. 31. № 3. P. 477–485.
de Curtis M., Avanzini G. Interictal spikes in focal epileptogenesis // Prog. Neurobiol. 2001. V. 63. № 5. P. 541–567.
de Curtis M., Avoli M. GABAergic networks jump-start focal seizures // Epilepsia. 2016. V. 57. № 5. P. 679–687.
de Curtis M., Radici C., Forti M. Cellular mechanisms underlying spontaneous interictal spikes in an acute model of focal cortical epileptogenesis // Neuroscience. 1999. V. 88. № 1. P. 107–117.
DeFelipe J., López-Cruz P.L., Benavides-Piccione R. et al. New insights into the classification and nomenclature of cortical GABAergic interneurons // Nat. Rev. Neurosci. 2013. V. 14. № 3. P. 202–216.
Dorn T., Witte O.W. Refractory periods following interictal spikes in acute experimentally induced epileptic foci // Electroencephalogr. Clin. Neurophysiol. 1995. V. 94. № 1. P. 80–85.
Fanselow E.E., Connors B.W. The roles of somatostatin-expressing (GIN) and fast-spiking inhibitory interneurons in UP-DOWN states of mouse neocortex // J. Neurophysiol. 2010. V. 104. № 2. P. 596–606.
Fanselow E.E., Richardson K.A., Connors B.W. Selective, state-dependent activation of somatostatin-expressing inhibitory interneurons in mouse neocortex // J. Neurophysiol. 2008. V. 100. № 5. P. 2640–2652.
Feldmeyer D., Brecht M., Helmchen F. et al. Barrel cortex function // Progress in Neurobiology. 2013. V. 103. P. 3–27.
Feldmeyer D., Qi G., Emmenegger V., Staiger J.F. Inhibitory interneurons and their circuit motifs in the many layers of the barrel cortex // Neuroscience. 2018. V. 368. P. 132–151.
Fino E., Yuste R. Dense inhibitory connectivity in neocortex // Neuron. 2011. V. 69. № 6. P. 1188–1203.
Funk C.M., Peelman K., Bellesi M. et al. Role of Somatostatin-Positive Cortical Interneurons in the Generation of Sleep Slow Waves // J. Neurosci. 2017. V. 37. № 38. P. 9132–9148.
Fröhlich F., McCormick D. Endogenous Electric Fields May Guide Neocortical Network Activity // Neuron. 2010. V. 67. № 1. P. 129–143.
Galarreta M., Hestrin S. Spike transmission and synchrony detection in networks of GABAergic interneurons // Science. 2001. V. 292. № 5525. P. 2295–2299.
Gentet L.J., Avermann M., Matyas F., Staiger J.F., Petersen C.C. Membrane potential dynamics of GABAergic neurons in the barrel cortex of behaving mice // Neuron. 2010. V. 65. № 3. P. 422–435.
Gentet L.J., Kremer Y., Taniguchi H. et al. Unique functional properties of somatostatin-expressing GABAergic neurons in mouse barrel cortex // Nat. Neurosci. 2012. V. 15. № 4. P. 607–612.
Gerrard L.B., Tantirigama M.L.S., Bekkers J.M. Pre- and Postsynaptic Activation of GABAB Receptors Modulates Principal Cell Excitation in the Piriform Cortex // Front. Cell Neurosci. 2018. V. 12. P. 28.
Gibson J.R., Beierlein M., Connors B.W. Functional properties of electrical synapses between inhibitory interneurons of neocortical layer 4 // J. Neurophysiol. 2005. V. 93. № 1. P. 467–480.
Goldberg J.H., Lacefield C.O., Yuste R. Global dendritic calcium spikes in mouse layer 5 low threshold spiking interneurones: implications for control of pyramidal cell bursting // J. Physiol. 2004. V. 558 (Pt 2). P. 465–478.
Gonchar Y., Pang L., Malitschek B., Bettler B., Burkhalter A. Subcellular localization of GABA(B) receptor subunits in rat visual cortex // J. Comp. Neurol. 2001. V. 431. № 2. P. 182–197.
Gray C.M., Singer W. Stimulus-specific neuronal oscillations in orientation columns of cat visual cortex // Proc. Natl. Acad. Sci. U S A. 1989.V. 86. № 5. P. 1698–1702.
Hilscher M.M., Leão R.N., Edwards S.J., Leão K.E., Kullander K. Chrna2-Martinotti Cells Synchronize Layer 5 Type A Pyramidal Cells via Rebound Excitation // PLoS Biol. 2017. V. 15. № 2. e2001392.
Hu H., Agmon A. Properties of precise firing synchrony between synaptically coupled cortical interneurons depend on their mode of coupling // J. Neurophysiol. 2015. V. 114. № 1. P. 624–637.
Isaacson J.S., Scanziani M. How inhibition shapes cortical activity // Neuron. 2011. V. 72. № 2. P. 231–243. https://doi.org/10.1016/j.neuron.2011.09.027
Jiang X., Wang G., Zhu J. The Organization of Two New Cortical Interneuronal // Circuits Nat. Neurosci. 2013. V. 16. № 2. P. 210–218.
Jiang X., Shen S., Cadwell C.R. et al. Principles of connectivity among morphologically defined cell types in adult neocortex // Science. 2015. V. 350. № 6264. aac9462.
Kapfer C., Glickfeld L.L, Atallah B.V., Scanziani M. Supralinear increase of recurrent inhibition during sparse activity in the somatosensory cortex // Nat. Neurosci. 2007. V. 10 P. 743–753.
Karagiannis A., Gallopin T., Dávid C. et al. Classification of NPY-expressing neocortical interneurons // J. Neurosci. 2009. V. 29. № 11. P. 3642–3659.
Karnani M.M., Jackson J., Ayzenshtat I. et al. Opening holes in the blanket of inhibition: localized lateral disinhibition by VIP interneurons // J. Neurosci. 2016, V. 36. P. 3471–3480.
Karnani M.M., Jackson J., Ayzenshtat I. et al. Cooperative Subnetworks of Molecularly Similar Interneurons in Mouse Neocortex // Neuron. 2016. V. 90. № 1. P. 86–100.
Karube F., Kubota Y., Kawaguchi Y. Axon branching and synaptic bouton phenotypes in GABAergic nonpyramidal cell subtypes // J. Neurosci. 2004. V. 24. № 12. P. 2853–2865.
Kawaguchi Y., Karube F. and Kubota Y. Dendritic branch typing and spine expression patterns in cortical nonpyramidal cells // Cerebral Cortex. 2006. V. 16. P. 696–711. https://doi.org/10.1093/cercor/bhj015
Kawaguchi Y., Kubota Y. Physiological and morphological identification of somatostatin- or vasoactive intestinal polypeptide-containing cells among GABAergic cell subtypes in rat frontal cortex // J. Neurosci. 1996. V. 16. № 8. P. 2701–2715.
Kawaguchi Y., Kubota Y. GABAergic cell subtypes and their synaptic connections in rat frontal cortex // Cereb. Cortex. 1997. V. 7. № 6. P. 476–486.
Kawaguchi Y., Shindou T. Noradrenergic excitation and inhibition of gabaergic cell types in rat frontal cortex // J. Neuroscience. 1998. V. 18. № 17. P. 6963–6976.
Koelbl1 C., Helmstaedter1 M., Lübke J., Feldmeyer D. A barrel-related interneuron in layer 4 of rat somatosensory cortex with a high intrabarrel connectivity // Cerebral Cortex 2015. V. 25. P. 713–725 https://doi.org/10.1093/cercor/bht263
Köhling R., D’Antuono M., Benini R., de Guzman P., Avoli M. Hypersynchronous ictal onset in the perirhinal cortex results from dynamic weakening in inhibition // Neurobiol. Dis. 2016. V. 87. P. 1–10.
Kohl M.M., Paulsen O. The roles of GABAB receptors in cortical network activity // Adv. Pharmacol. 2010. V. 58. P. 205–229.
Large A.M., Vogler N.W., Mielo S., Oswald A.M. Inhibition by Somatostatin Interneurons in Olfactory Cortex // Front. Neural Circuits. 2016. V. 10. P. 62.
Lee S.H., Hjerling-Leffler J., Zagha E., Fishell G., Rudy B. The largest group of superficial neocortical GABAergic interneurons expresses ionotropic serotonin receptors // J. Neurosci. 2010. V. 30. № 50. P. 16796–16808.
Lee S., Kruglikov I., Huang Z.J., Fishell G., Rudy B. A disinhibitory circuit mediates motor integration in the somatosensory cortex // Nat. Neurosci. 2013. V. 16. № 11. P. 1662–1670.
Lee A.J., Wang G., Jiang X. et al. Canonical Organization of Layer 1 Neuron-Led Cortical Inhibitory and Disinhibitory Interneuronal Circuits // Cereb. Cortex. 2015. V. 25. № 8. P. 2114–2126.
Le’ger J-F., Stern E.A., Aertsen Ad, Heck D. Synaptic integration in rat frontal cortex shaped by network activity // J. Neurophysiol. 2005. V. 93. P. 281–293.
Librizzi L., de Curtis M. Epileptiform ictal discharges are prevented by periodic interictal spiking in the olfactory cortex // Ann. Neurol. 2003. V. 53. № 3. P. 382–389.
Lim D.H., Mohajerani M.H., Ledue J. et al. In vivo Large-Scale Cortical Mapping Using Channelrhodopsin-2 Stimulation in Transgenic Mice Reveals Asymmetric and Reciprocal Relationships between Cortical Areas // Front. Neural Circuits. 2012. V. 6. P. 11.
Lillis K.P., Kramer M.A., Mertz J., Staley K.J., White J.A. Pyramidal cells accumulate chloride at seizure onset // Neurobiol. Dis. 2012. V. 47. № 3. P. 358–366.
Liu L., Ito W., Morozov A. GABAb Receptor Mediates Opposing Adaptations of GABA Release From Two Types of Prefrontal Interneurons After Observational Fear // Neuropsychopharmacology. 2017. V. 42. № 6. P. 1272–1283.
Ma Y., Hu H., Berrebi A.S., Mathers P.H., Agmon A. Distinct subtypes of somatostatin-containing neocortical interneurons revealed in transgenic mice // J. Neurosci. 2006. V. 26. № 19. P. 5069–5082.
Mancilla J.G., Lewis T.J., Pinto D.J., Rinzel J., Connors B.W. Synchronization of electrically coupled pairs of inhibitory interneurons in neocortex // J. Neurosci 2007. V. 27: P. 2058–2073.
Mann E.O., Radcliffe C.A., Paulsen O. Hippocampal gamma-frequency oscillations: from interneurones to pyramidal cells, and back // Physiol. 2005. V. 562 (Pt 1). P. 55–63.
Mao T., Kusefoglu D., Hooks B.M., Huber D., Petreanu L., Svoboda K. Longrange neuronal circuits underlying the interaction between sensory and motor cortex. Neuron. 2011. 72. № 1. P. 111–123.
Matyas F., Sreenivasan V., Marbach F. et al. Motor Control by Sensory Cortex // Science. 2010. V. 330. P. 1240.
McDonald A.J., Mascagni F., Muller J.F. Immunocytochemical localization of GABABR1 receptor subunits in the basolateral amygdala // Brain Res. 2004. V. 1018. P. 147–158. https://doi.org/10.1016/j.brainres.2004
Melzer S., Michael M., Caputi A., Eliava M., Fuchs E.C., Whittington M.A., Monyer H. Long-range-projecting GABAergic neurons modulate inhibition in hippocampus and entorhinal cortex // Science. 2012. V. 335. P. 1506–1510.
Morishima M., Kobayashi K., Kato S., Kobayashi K., Kawaguchi Y. Segregated Excitatory-Inhibitory Recurrent Subnetworks in Layer 5 of the Rat Frontal Cortex // Cereb. Cortex. 2017. V. 27. № 12. P. 5846–5857.
Muldoon S.F., Villette V., Tressard T.F. et al. GABAergic inhibition shapes interictal dynamics in awake epileptic mice // Brain. 2015. V. 138 (Pt 10). P. 2875–2890.
Murayama M., Pérez-Garci E., Nevian T., Bock T., Senn W., Larkum M.E. Dendritic encoding of sensory stimuli controlled by deep cortical interneurons // Nature. 2009. V. 457. № 7233. P. 1137–1141.
Naka A., Adesnik H. Inhibitory Circuits in Cortical Layer 5 // Front. Neural Circuits. 2016. V. 10. P. 35.
Neske G.T., Patrick S.L., Connors B.W. Contributions of diverse excitatory and inhibitory neurons to recurrent network activity in cerebral cortex // J. Neurosci. 2015. V. 35. № 3. P. 1089–1105.
Nicoll R.A., Malenka R.C., Kauer J.A. Functional comparison of neurotransmitter receptor subtypes in mammalian central nervous system // Physiol. Rev. 1990. V. 70. № 2. P. 513–565.
Nigro M.J., Hashikawa-Yamasaki Y.1., Rudy B. Diversity and Connectivity of Layer 5 Somatostatin-Expressing Interneurons in the Mouse Barrel Cortex // J. Neurosci. 2018. V. 38. № 7. P. 1622–1633.
Oláh S., Füle M., Komlósi G. et al. Regulation of cortical microcircuits by unitary GABAergic volume transmission // Nature. 2009. V. 461. № 7268. P. 1278–1281.
Oláh S., Komlósi G., Szabadics J., Varga C., T’oth E., Barzo P., Tamás G. Output of neurogliaform cells to various neuron types in the human and rat cerebral cortex // Front. Neural Circuits. 2007. V. 1. P. 4.
Otsuka T., Kawaguchi Y. Cortical inhibitory cell types differentially form intralaminar and interlaminar subnetworks with excitatory neurons // J. Neurosci. 2009. V. 29. № 34. P. 10533–10540.
Palmer L., Murayama M., Larkum M. Inhibitory Regulation of Dendritic Activity in vivo // Front. Neural Circuits. 2012. V. 6. P. 26.
Palmer L.M., Schulz J.M., Murphy S.C. et al. The cellular basis of GABA(B)-mediated interhemispheric inhibition // Science. 2012. V. 335. № 6071. P. 989–993.
Panuccio G., Curia G., Colosimo A., Cruccu G., Avoli M. Epileptiform onization in the cingulate cortex // Epilepsia. 2009. V. 50. № 3. P. 521–536.
Petersen C.C., Crochet S. Synaptic computation and sensory processing in neocortical layer 2/3 // Neuron. 2013. V. 78. № 1. P. 28–48.
Pfeffer C.K., Xue M., He M., Huang Z.J., Scanziani M. Inhibition of inhibition in visual cortex: the logic of connections between molecularly distinct interneurons // Nat. Neurosci. 2013. V. 16. № 8. P. 1068–1076.
Price C.J., Cauli B., Kovacs E.R. et al. Neurogliaform neurons form a novel inhibitory network in the hippocampal CA1 area // J. Neurosci. 2005. V. 25. № 29. P. 6775–6786.
Price C.J., Scott R., Rusakov D.A., Capogna M. GABA(B) receptor modulation of feedforward inhibition through hippocampal neurogliaform cells // J. Neurosci. 2008. V. 28. № 27. P. 6974–6982.
Prince D.A. Inhibition in “epileptic” neurons // Exp. Neurol. 1968 V. 21. № 3. P. 307–321.
Pronneke A., Scheuer B., Wagener R.J., Mock M., Witte M., Staiger J.F. Characterizing VIP Neurons in the Barrel Cortex of VIPcre/tdTomato Mice Reveals Layer-Specific Differences // Cereb. Cortex 2015. V. 25. № 12. P. 4854–4868.
Rocco-Donovan M., Ramos R.L., Giraldo S., Brumberg J.C. Characteristics of synaptic connections between rodent primary somatosensory and motor cortices // Somatosens. Mot. Res. 2011. V. 28. № 3–4. P. 63–72.
Roopun A.K., Simonotto J.D., Pierce M.L. et al. A nonsynaptic mechanism underlying interictal discharges in human epileptic neocortex // Proc. Natl. Acad. Sci. U S A. 2010. V. 107. № 1. P. 338–343.
Rudy B., Fishell G., Lee S., Hjerling-Leffler J. Three groups of interneurons account for nearly 100% of neocortical GABAergic neurons // Dev. Neurobiol. 2011. V. 71. № 1. P. 45–61.
Sabolek H.R., Swiercz W.B., Lillis K et al. A candidate mechanism underlying the variance of interictal spike propagation // J. Neurosci. 2012. V. 32. № 9. P. 3009–3021.
Saffari R., Teng Z., Zhang M. et al. NPY+-, but not PV+- GABAergic neurons mediated long-range inhibition from infra- to prelimbic cortex // Transl. Psychiatry. 2016. V. 6. :e736.
Salkoff D.B., Zagha E., Yüzgeç Ö., McCormick D.A. Synaptic Mechanisms of Tight Spike Synchrony at Gamma Frequency in Cerebral Cortex // J. Neurosci. 2015. V. 35. № 28. P. 10236–10251.
Schevon C.A., Ng S.K., Cappell J. et al. Microphysiology of epileptiform activity in human neocortex // J. Clin. Neurophysiol. 2008. V. 25. № 6. P. 321–330.
Scheyltjens I., Arckens L. The current status of somatostatin-interneurons in inhibitory control of brain function and plasticity // Neural. Plast. 2016. V. 2016. P. 8723623.
Silberberg G., Markram H. Disynaptic inhibition between neocortical pyramidal cells mediated by Martinotti cells // Neuron. 2007. V. 53. P. 735–746.
Simon A., Oláh S., Molnár G., Szabadics J., Tamás G. Gap-junctional coupling between neurogliaform cells and various interneuron types in the neocortex // J. Neurosci. 2005. V. 25. № 27. P. 6278–6285.
Steriade M., Nuñez A., Amzica F. A novel slow (<1 Hz) oscillation of neocortical neurons in vivo: depolarizing and hyperpolarizing components // J. Neurosci. 1993. V. 13. № 8. P. 3252–3265.
Tamás G., Lorincz A., Simon A., Szabadics J. Identified sources and targets of slow inhibition in the neocortex // Science. 2003. V. 299. № 5614. P. 1902–1905.
Timofeev I., Grenier F., Steriade M. The role of chloride-dependent inhibition and the activity of fast-spiking neurons during cortical spike^wave electrographic seizures // Neuroscience. 2002. V. 114. № 4. P. 1115–1132.
Tremblay R., Lee S., Rudy B. GABAergic Interneurons in the neocortex: from cellular properties to circuits // Neuron. 2016. V. 91. № 2. P. 260–292.
Trevelyan A.J., Sussillo D., Watson B.O., Yuste R. Modular propagation of epileptiform activity: evidence for an inhibitory veto in neocortex // J. Neurosci. 2006. V. 26. № 48. P. 12447–1255.
Trevelyan A.J.1, Sussillo D., Yuste R. Feedforward inhibition contributes to the control of epileptiform propagation speed // J. Neurosci. 2007. V. 27. № 13. P. 3383–3387.
Urban-Ciecko J., Barth A.L. Somatostatin-expressing neurons in cortical networks // Nat. Rev. Neurosci. 2016. V. 17. № 7. P. 401–409.
Urban-Ciecko J., Fanselow E.E., Barth A.L. Neocortical somatostatin neurons reversibly silence excitatory transmission via GABAb receptors // Curr. Biol. 2015. V. 25. № 6. P. 722–731.
Vanni M.P., Murphy T.H. Mesoscale transcranial spontaneous activity mapping in GCaMP3 transgenic mice reveals extensive reciprocal connections between areas of somatomotor cortex // J. Neurosci. 2014. V. 34. № 48. P. 15931–15946.
Vickers E.D., Clark C., Osypenko D. et al. Parvalbumin-Interneuron Output Synapses Show Spike-Timing-Dependent Plasticity that Contributes to Auditory Map Remodeling // Neuron. 2018. V. 99. № 4. P. 720–735.e6.
Veit J., Hakim R., Jadi M.P., Sejnowski T.J., Adesnik H. Cortical gamma band synchronization through somatostatin interneurons // Nat. Neurosci. 2017. V. 20. № 7. P. 951–959.
Wang L., Maffei A. Inhibitory plasticity dictates the sign of plasticity at excitatory synapses // J. Neurosci. 2014. V. 34. № 4. P. 1083–1093.
Wang Y., Neubauer F.B., Lüscher H.R., Thurley K. GABAB receptor-dependent modulation of network activity in the rat prefrontal cortex in vitro// Eur. J. Neurosci. 2010. V. 31. № 9. P. 1582–1594.
Wang Y., Toledo-Rodriguez M., Gupta A. et al. Anatomical, physiological and molecular properties of Martinotti cells in the somatosensory cortex of the juvenile rat // J. Physiol. 2004. V. 561. (Pt 1): P. 65–90.
Wehr M., Zador A.M. Balanced inhibition underlies tuning and sharpens spike timing in auditory cortex // Nature. 2003. V. 426. P. 442–446.
Witte O.W. Physiological basis of pathophysiological brain rhythms // Acta Neurobiol. Exp. (Wars). 2000. V. 60. № 2. P. 289–297.
Yekhlef L., Breschi G.L., Lagostena L., Russo G., Taverna S. Selective activation of parvalbumin- or somatostatin-expressing interneurons triggers epileptic seizurelike activity in mouse medial entorhinal cortex // J. Neurophysiol. 2015. V. 113. № 5. P. 1616–1630.
Yavorska I., Wehr M. Somatostatin-Expressing Inhibitory Interneurons in Cortical Circuits // Front. Neural Circuits. 2016. V. 10. P. 76.
Zhu J., Jiang M., Yang M., Hou H., Shu Y. Membrane Potential-Dependent Modulation of Recurrent Inhibition in Rat Neocortex // PLoS Biol. 2011. V. 9. № 3. e1001032.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


