Успехи физиологических наук, 2022, T. 53, № 2, стр. 83-97
Методические проблемы математического описания процессов всасывания питательных веществ в тонком кишечнике и определения “истинных” кинетических констант
С. И. Фокин *
Научно-практический центр “Психосоматическая нормализация” (НПЦ “ПСН”)
193079 Санкт-Петербург, Россия
* E-mail: fokin_s@mail.ru
Поступила в редакцию 20.01.2021
После доработки 03.03.2021
Принята к публикации 19.08.2021
- EDN: MRGYVR
- DOI: 10.31857/S0301179822020035
Аннотация
Для описания процесса всасывания питательных веществ в тонком кишечнике физиологи продолжают использовать понятие неподвижного поверхностного слоя, хотя его существование при турбулентном движении жидкости, которое неизбежно при интенсивном перистальтическом перемешивании химуса, экспериментально опровергнуто еще в тридцатых годах двадцатого века. В физиологии указанный слой называют “неподвижным водным слоем” – НВС, “автономным премембранным слоем” – АПС, или преэпителиальным слоем, размещая его прилегающим к внутреннему эпителию тонкой кишки. В настоящей статье проведен математический анализ методики определения “истинных” (скорректированных с учетом влияния преэпителиального слоя) кинетических констант активного транспорта глюкозы в изолированной петле тонкой кишки крыс в условиях хронического эксперимента. В результате проведенного анализа и расчетов выяснилось, что с математической точки зрения теория неподвижного поверхностного слоя также несостоятельна, т.к. не обеспечивает однозначности получаемых результатов. Это показано как теоретически, так и с использованием реальных экспериментальных данных, опубликованных ранее в Российском физиологическом журнале им. И.М. Сеченова. Предложен вариант вычисления кинетических констант всасывания глюкозы без использования НВС, обеспечивающий однозначность решения. Также показана принципиальная невозможность учета доказанной экспериментально нелинейной зависимости скорости всасывания глюкозы от ее концентрации при описании распределения последней вдоль исследуемого участка тонкой кишки с помощью одномерного линейного дифференциального уравнения с эквивалентным сопротивлением АПС в качестве постоянного коэффициента. Обозначены новые перспективные подходы по замене существующих интегральных математических моделей описания процессов всасывания питательных веществ в тонком кишечнике на дифференциальные, учитывающие распределение концентраций и скоростей всасывания на сколь угодно малых площадках эпителия.
ВВЕДЕНИЕ
Гипотеза о существовании неподвижного слоя жидкости малой толщины, непосредственно прилегающего к поверхности раздела фаз, сформулированная Нернстом еще в 1904 г. [17, 18], до сих пор активно используется современными исследователями при математическом моделировании процессов поверхностного пищеварения и всасывания питательных веществ в тонком кишечнике и определения соответствующих кинетических констант [1, 13–15, 20, 22]. Те же подходы применяются для вычисления кинетических параметров поглощения глюкозы поверхностью гельминтов – ленточных червей, паразитирующих в тонком кишечнике организма-хозяина, что не мудрено, ибо “тегумент у цестод как морфологически, так и функционально имеет определенную схожесть со щеточной каймой кишечника позвоночных” [7].
Хотя термин “неподвижный поверхностный слой” (“поверхностный слой Нернста”) в работах современных физиологов заменен на “неперемешиваемый водный слой” – “НВС”, “преэпителиальный слой” (the pre-epithelial layer) или прилегающий диффузный слой (adjacent diffusion layer) [1, 14], сути применяемого подхода это не меняет: предполагается, что нутриенты из полости тонкой кишки перемещаются в радиальном направлении к ее поверхности именно через этот слой только за счет простой диффузии в соответствии с первым законом Фика (одномерный случай, линейное распределение концентрации по толщине слоя).
Однако еще в 30-х годах двадцатого века с помощью прямых экспериментальных измерений было показано, что на расстоянии от твердой стенки порядка 10–5 см (меньше 1 мкм) наблюдается движение коллоидных частиц, взвешенных в жидкости [8], что опровергало теорию неподвижного поверхностного слоя Нернста. Если еще учесть интенсивное перистальтическое перемешивание содержимого тонкого кишечника в естественных условиях, то, разумеется, ни о каком “неперемешиваемом водном слое” вблизи эпителиальной поверхности кишки в этом случае не может быть и речи.
Признавая это обстоятельство [4, 21], современные исследователи все равно не отказываются от простой модели Нернста: толщина НВС рассматривается “не как некая физическая реальность, а лишь как удобное модельное представление” [4]. Кроме того, была выдвинута более правдоподобная гипотеза: “неперемешиваемый водный слой” заменили на неподвижный слой слизи в сети из нитей поверхностного гликокалиса микроворсинок [4, 11, 16, 19, 21]. Поменялось и название пристеночного слоя, позволившее использовать более широкую трактовку составляющей его среды: вместо “НВС” приэпителиальный слой тонкой кишки стали именовать “АПС” – “автономный премембранный слой” [2]. Но и здесь простота и удобство модели Нернста взяли верх над ее физической несостоятельностью: несмотря на то, что “представление о преимущественно водной природе преэпителиального слоя тонкой кишки не всегда является достаточно обоснованным”, все же, “его чрезвычайно широкое использование для оценки суммарной диффузионной проницаемости преэпителиального слоя представляется достаточно оправданным” в связи с удобством его применения при сопоставлении различных экспериментальных данных [4]. Поэтому-то простая, но опровергнутая с физической точки зрения, модель пограничного слоя Нернста начала 20-го века активно продолжает использоваться и в 21-м [1, 7, 13, 14].
Кроме физической неадекватности модели “НВС” методика определения “истинных” кинетических констант [1] имеет серьезную математическую уязвимость: не единственный экстремум минимизируемого функционала, из чего следует ненадежность получаемых результатов – их кратное изменение в зависимости от флуктуаций исходных данных в пределах погрешности эксперимента. Поэтому первая часть данного исследования посвящена математическому анализу однозначности определения “истинных” (скорректированных с учетом влияния преэпителиального слоя) кинетических констант гидролиза мальтозы (Km и Vmax) и активного транспорта глюкозы (Kt и Jmax) в изолированной петле тонкой кишки крыс в условиях хронического опыта по методике, изложенной в [1].
Во второй части предлагаемой работы наглядно, на примерах, будет показана принципиальная невозможность однозначного определения “истинных” кинетических констант в рамках модели НВС и существующего математического описания распределения нутриентов вдоль тонкой кишки, а также высказаны предложения по замене используемого математического подхода.
1. МЕТОДЫ ИССЛЕДОВАНИЯ
В предлагаемой работе проанализирована широко используемая в настоящее время [1, 13–15, 20, 22] методика определения “истинных” (скорректированных с учетом влияния преэпителиального слоя) кинетических констант активного транспорта глюкозы (Jmax и Kt) в изолированной петле тонкой кишки крыс в условиях хронического опыта на предмет однозначности получаемых результатов расчета. Для аппроксимации экспериментальных данных и вычисления соответствующих коэффициентов применялся метод наименьших квадратов, реализованный в программном пакете “Mathcad”. Для определения производных сложных функций в символьном виде также использовался “Mathcad”.
Полученные результаты могут быть также применены и к известной методике определения “истинных” кинетических констант гидролиза мальтозы (Vmax и Km), [1], т.к. указанные методики аналогичны.
Для гипотетического неподвижного поверхностного слоя, непосредственно прилегающего к эпителию тонкой кишки, физиологи вводят понятие “сопротивление преэпителиального слоя”: ${{R}_{{{\text{пэ\;}}}}} = {d \mathord{\left/ {\vphantom {d D}} \right. \kern-0em} D}$ = [мин/см] (см. ф-лу (5) в [1]). Затем в связи со сложностью точного определения площади внутренней поверхности тонкой кишки используют понятие “сопротвления преэпителиального слоя на сантиметр длины тонкой кишки” – RPL = [мин/см2] (начальное приближение см. ф-лу (3) в [1]), а вместо локальных концентраций используют среднелогарифмические по длине исследуемого участка тонкой кишки (см. ф-лы (1А, 2А) в [1]). Поэтому первый закон Фика в данных обозначениях принимает следующий вид (из ф-лы (2А) в [1] в обозначениях для глюкозы; индекс i соответствует каждой концентрации на входе в префузируемый участок кишки):
где Jaij – расчетная скорость всасывания глюкозы в расчете на 1 см длины кишки (средняя по длине петли), мкМоль/(мин см); индексы: i – номер эксперимента (отличаются концентрациями на входе Сin, см. ниже), j – номер варьируемого сопротивления преэпителиального слоя: от нуля до RPL' (см. ниже); $R{{~}_{{PLj}}}$ – сопротивление преэпителиального слоя на 1 см длины исследуемого участка кишки j-й вариации, мин/см2; $C{{~}_{{L\lg i}}}$ – среднелогарифмическая по длине перфузируемого участка концентрация глюкозы в полости кишки при i-й концентрации на входе, мкМоль/см3:(2)
${{C}_{{L\lg i}}} = \,\,~\frac{{{{C}_{{{\text{in}},i}}} - {{C}_{{{\text{out}},i}}}}}{{\ln ({{{{C}_{{{\text{in}},i}}}} \mathord{\left/ {\vphantom {{{{C}_{{{\text{in}},i}}}} {{{C}_{{{\text{out}},i}}}}}} \right. \kern-0em} {{{C}_{{{\text{out}},i}}}}})}}~,$(4)
${{J}_{{ali}}} = {{\left( {{{C}_{{{\text{in}},i}}}{{\vartheta }_{{{\text{in}}}}} - {{C}_{{{\text{out}},i}}}{{\vartheta }_{{{\text{out}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{C}_{{{\text{in}},i}}}{{\vartheta }_{{{\text{in}}}}} - {{C}_{{{\text{out}},i}}}{{\vartheta }_{{{\text{out}}}}}} \right)} L}} \right. \kern-0em} L},$Единицы измерения в формулах (1–4) соответствуют принятым в [1].
${{C}_{{L~\lg i}}}$ вычисляют по экспериментальным концентрациям глюкозы на входе и входе из перфузируемого участка тонкой кишки [1]. ${{C}_{{M~\lg }}}$ определяется методом “двойных обратных величин” при варьировании сопротивления преэпителиального слоя, RPL = [мин/см2], от нуля до его максимально возможного значения – Rэкв, равного суммарному диффузному сопротивлению [1, 4]:
(5)
${{R}_{{PL{\kern 1pt} '}}} = {{R}_{{PL\max }}} = \frac{L}{{\vartheta \ln \left( {{{{{C}_{{{\text{in}},i}}}} \mathord{\left/ {\vphantom {{{{C}_{{{\text{in}},i}}}} {{{C}_{{{\text{out}},i}}}}}} \right. \kern-0em} {{{C}_{{{\text{out}},i}}}}}} \right)}}~,$При этом критерием останова подбора является минимальное среднеквадратичное отклонение между вычисленной по экспериментальным данным скоростью всасывания нутриентов в петле тонкой кишки, ${{J}_{{ai}}}$, и расчетной скоростью всасывания, $~{{J}_{{arij}}}$, полученной по формуле Михаэлиса-Ментен [1]:
(6)
${{J}_{{arij}}} = \frac{{{{J}_{{\max }}}{{C}_{{M\lg ij}}}}}{{{{K}_{t}} + {{C}_{{M\lg ij}}}}} + {{k}_{d}}{{C}_{{M\lg ij}}}~,$В формулах (1–6) и далее с помощью индекса i идентифицируются концентрации на входе в перфузируемую петлю тонкой кишки, индексa j – номер варьируемого сопротивления преэпителиального слоя: от нуля до Rэквmin.
Для каждого зафиксированного RPLj минимизируемый функционал представляет собой следующее выражение:
2. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
2.1. Математический анализ уязвимостей методики вычисления “истинных” кинетических констант
2.1.1. Теоретический анализ. Условием минимизации среднеквадратичного отклонения (СКО) является равенство нулю частных производных от функционала F (ф-ла 7) по искомым коэффициентам Jmax и Kt, которые после дифференцирования и приравнивания к нулю могут быть выражены явно:
Подставляя Jmax в (7**), Kt в (7*), получим два уравнения, каждое с одним неизвестным, которые не могут быть выражены в явном виде, но дают однозначные решения при использовании современных математических программных продуктов, например, “Mathcad”. Однозначность решения системы уравнений (7*–7**) подтверждена нами при многократном изменении входных данных и начальных приближений Jmax и Kt.
Однако все меняется с вводом третьего параметра – сопротивления преэпителиального слоя, RPLj (см. ф-лу 3). В [1] его вводят неявно, вычисляя CM lgij для каждого итерационного значения RPLj ϵ [0, RPL'] по формуле (3) и далее уже из матрицы CM lgij получают соответствующий массив пар (Jmaxj, Ktj). Из полученных пар выбирают ту, при подстановке которой в формулу (6) получается минимальное среднеквадратичное отклонение расчетных от экспериментальных значений скорости всасывания глюкозы (условие 7). Таким образом пытаются “обойти” невозможность однозначной минимизации функционала (7) относительно трех параметров: Jmax, Kt и RPL. Действительно, подставив в (7) выражение для ${{J}_{{ari}}}$ из (6) с ${{C}_{{M\lg ij}}}$ из (3), получим нелинейное относительно искомого параметра RPL выражение:
(8)
$\begin{gathered} F\left( {{{J}_{{\max }}},{{K}_{t}},{{R}_{{PL}}}} \right) = \\ = \sum\limits_{i = 1}^n {\left( {{{J}_{{ai}}} - \frac{{{{J}_{{\max }}}\left( {{{C}_{{L{{~}_{{\lg i}}}}}} - ~{{J}_{{ai}}}{{R}_{{PL}}}} \right)}}{{{{K}_{t}} + {{C}_{{L{{~}_{{\lg i}}}}}} - ~{{J}_{{ai}}}{{R}_{{PL}}}}}} \right.} + \\ {{\left. {\frac{{^{{^{{}}}}}}{{_{{_{{}}}}}} + \,\,{{k}_{d}}\left( {{{C}_{{L{{~}_{{\lg i}}}}}} - ~{{J}_{{ai}}}{{R}_{{PL}}}} \right)} \right)}^{2}}~. \\ \end{gathered} $Частная производная от выражения (8) по параметру RPL, необходимая для поиска минимального среднеквадратического отклонения, так же будет нелинейным выражением, RPL будет там присутствовать во 2-й степени еще до приведения к общему знаменателю. Само выражение частной производной $\partial F{{\left( {{{J}_{{\max }}},{{K}_{t}},{{R}_{{PL}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{J}_{{\max }}},{{K}_{t}},{{R}_{{PL}}}} \right)} {\partial {{R}_{{PL}}}}}} \right. \kern-0em} {\partial {{R}_{{PL}}}}}$ приведено в Приложении А, т.к. оно слишком длинное (занимает почти страницу). Нам достаточно того, что при приравнивании к нулю этого выражения (условие минимума СКО) получается, как минимум, уравнение второй степени по RPL (см. Приложение). Соответствующий функционал не обязательно будет иметь единственный минимум: их может быть несколько или не быть вообще в зависимости от распределения экспериментальных данных и значений двух других искомых параметров оптимизации Jmax и Kt. Если с решениями квадратного или кубического уравнений мы можем легко справиться, отбросив отрицательные, как не входящее в область определения RPL, то единственное решение для нашей задачи критично, т.к. это RPL = 0, а значит, и толщина преэпителиального слоя тоже равна нулю, что противоречит изначальной теории Нернста. Таким образом, минимум среднеквадратичного отклонения оптимизируемого функционала не является единственным, более того, его может не быть вообще при определенном распределении экспериментальных данных. Т.е. сопротивление п/э слоя RPL и его толщина, определенные при минимизации указанного функционала, тоже могут быть не единственными или равными нулю и однозначный их выбор либо субъективен, либо случаен.
Однако приведенные выше теоретические выкладки носят общий характер и допускают призрачную возможность получения однозначного минимума СКО оптимизируемого функционала и, соответственно, единственных “истинных” кинетических констант хотя бы в области характерных значений экспериментальных данных, т.к. в связи со сложностью формул мы не можем определить явно зависимость динамики СКО от самих экспериментальных величин и их соотношения. Но мы можем попытаться показать неоднозначность определения “истинных” кинетических констант по методике [1] на примере реальных экспериментальных данных и найти критерий этой неоднозначности. Этим и займемся в следующем разделе.
2.1.2. Примеры расчетов, демонстрирующие теоретическую уязвимость методики. Начнем с арифметических ошибок и опечаток в [1]. Хотя ошибки эти никак не влияют на результаты нашего исследования, все же их надо указать, дабы они не вводили в заблуждение других читателей. На стр. 514 в [1] приведено среднее “диффузное сопротивление преэпителиального слоя (RPL), определенное для каждого животного по описанной выше методике” при всасывании глюкозы: 4.87 ± 1.00 (мин/см), и “рассчитанная по формуле (5) эффективная толщина неперемешиваемого водного слоя (d) – 23.4 ± 4.8 (мкм)”. Вышеупомянутая “формула (5)” представляет собой следующее выражение ([1], стр. 513): d = RD, где R – “сопротивление преэпителиального слоя в расчете на 1 см2 серозной поверхности кишки (мин/см); D – коэффициент диффузии данного вещества в воде (5.3 × 10–3 см2/мин … для глюкозы)”. В приведенных цитатах:
– во-первых, либо единицы измерения RPL указаны неверно – мин/см, а должно быть как изначально на стр. 512: мин/см2, т.к. RPL соответствует диффузному сопротивлению преэпителиального слоя в расчете на 1 см длины кишки; либо – если единицы измерения верны – вместо RPL должно стоять R (см. выше). В пользу того, что перепутаны единицы измерения, говорит следующее обстоятельство: при подстановке в формулу 5 (из [1], см. выше) значения R = 4.87 (мин/см) не получается указанной толщины НВС d = 23.4 мкм. Кроме того, по нашим расчетам с данными из [1] сопротивление преэпителиального слоя в расчете на 1 см длины кишки также получается порядка RPL ≈ 4.8 (мин/см2).
– во вторых, при указанных RPL = 4.87 (мин/см2) и Dгл = 5.3 × 10–3 см2/мин толщина преэпителиального слоя будет на порядок больше: d ~ 234 (мкм), т.к. RPL и R отличаются не более чем на 10% (см. ниже).
– в-третьих, коэффициент диффузии глюкозы в воде Dгл = 5.3 × 10–3 см2/мин, приведенный на стр. 513 в [1], завышен в 15–17 раз по сравнению с другими источниками [17, 19, 20], дающими: Dгл = = (5.2–6.8) × 10–6 (см2/с) ≈ (3.1–4.1) × 10–4 (см2/мин). Интересно, что в более поздней статье с участием тех же авторов и в развитие той же темы, но опубликованной в иностранном журнале [14], коэффициент диффузии глюкозы в воде указан верно: Dгл = 3.9 × 10–4 см2/мин ([14], tab. 2, p. 195; p. 196).
Чтобы перейти от “линейного” диффузного сопротивления преэпителиального слоя RPL к диффузному сопротивлению “в расчете на 1 см2 серозной поверхности кишки” – R, входящему в вышеприведенную “формулу (5)” (из [1], стр. 513), необходимо знать либо диаметр кишки по серозной оболочке, либо площадь серозной оболочки. Ни того, ни другого в [1], к сожалению, не приведено. Для восполнения данного пробела можем воспользоваться данными по морфологии тонкого кишечника крыс из других надежных источников, например, из [6]. В частности, у “белых беспородных крыс самцов” массой 250–280 г наружный диаметр тонкой кишки составлял: 2.6 ± 0.1 мм; массой 300–350 г – 3.2 ± ± 0.03 мм ([6], стр. 27). Для экспериментов в ([1], стр. 511) использовались крысы самцы породы Вистар “массой 150–180 г до операции и 250–300 г – во время проведения хронических опытов через 1.5–2 мес. после операции”. Таким образом, можем принять наружный диаметр (диаметр по серозной оболочке) тонкой кишки у крыс-участников хронических экспериментов в [1] равным 2.9 мм. Тогда, площадь серозной оболочки 1 см длины кишки будет равна: 3.14 × 0.29 см × 1 см = 0.91 см2. Т.е. количество всасываемой глюкозы в единицу времени в расчете на 1 см длины кишки, Jаl, будет таким же, как и в расчете на 0.91 см2 серозной оболочки кишки: Jаl = 0.91Jаs, где Jаs – скорость всасывания глюкозы в расчете на 1 см2 серозной оболочки. При этом Jаs также вычисляется по формуле (1), только вместо RPL в знаменателе будет стоять R, т.е. ∆C/RPL = 0.91(∆C/R), откуда R = = 0.91RPL (сопротивление большей площади меньше). Подставляя, получим: R = 0.91 × 4.87 = = 4.43 (мин/см) и в соответствии с формулой (5) из [1]: d = 0.0053 × 4.43 ≈ 0.02349 см = 234.9 мкм.
Т.е. вместо d = 23.4 мкм, приведенных на стр. 514 в [1], толщина НВС получается на порядок больше: d ≈ 235 мкм. Кстати, толщина НВС порядка 300–800 мкм была получена другими авторами “в условиях острых опытов in vivo” ([1], стр. 515), с чем лучше согласуется d ≈ 235 мкм, нежели d ≈ 23.4 мкм.
Если предположить, что в [1] опечатка в значении коэффициента диффузии глюкозы в воде (завышен в 15–17 раз по сравнению с другими источниками: [15, 17–19]), то при сохранении остальных данных получим величину НВС порядка 15 мкм ≈ 3.4 × 10–4 (см2/мин) × 4.43 (мин/см), что тоже не совпадает с рассчитанными авторами 23.4 мкм.
Скорее всего, в источнике [1] наложилось несколько досадных ошибок, разбираться с которыми предоставим самим авторам. Здесь же повторимся, что указанные опечатки и арифметические ошибки в расчетах толщины гипотетического преэпителиального слоя никак не повлияют на результаты нашего исследования, т.к. уязвимой является сама теория этих расчетов, причем как с физической, так и с математической точек зрения (см. выше). Далее мы покажем это наглядно с использованием полученных авторами [1] экспериментальных данных.
Рассмотрим экспериментальные данные по скорости всасывания глюкозы в петле тонкой кишке крысы в хроническом эксперименте, приведенные в [1]. К сожалению, данные там приведены только в графическом виде, поэтому у оппонентов могут возникнуть вполне резонные вопросы о величине неизбежной погрешности, возникающей при их переводе с журнального графика в табличные значения. Здесь подтверждением удовлетворительной погрешности восстановления данных могут служить результаты их аппроксимации по формуле (6) с вычислением “истинных” кинетических констант Jmax и Kt, а также сопротивления преэпитэлиального слоя RPL, представленные ниже (табл. 1 ), и близкие к результатам в первоисточнике [1] – в пределах обозначенной там же погрешности (см. ниже).
Таблица 1.
Варианты исходных данных для расчета
| Cin, мМ | 6.25 | 12.5 | 25 | 32.5 | 50 | 75 | 100 | Вычисленные константы |
| Jэ.с., мкМ/мин | 1.6 | 3.1 | 5.8 | 6.9 | 8.5 | 9.5 | 10.0 | Jmax = 0.743; Kt = 4.5; RPL = 4.7 |
| Jэ.в., мкМ/мин | 1.6 | 3.1 | 5.7 | 6.7 | 8.3 | 9.5 | 10.0 | Jmax = 0.75; Kt = 6.17; RPL = 2.2 |
| Jэ.н., мкМ/мин | 1.6 | 3.2 | 5.8 | 6.9 | 8.3 | 9.5 | 10.0 | Jmax = 0.737; Kt = 5.37; RPL = 0 |
Где Jэ.с. – экспериментальные данные из [1]; Jэ.в. – измененные в пределах декларируемой в [1] погрешности данные в столбцах 4–6 (концентрации 25, 32.5, 50 мМ соответственно); Jэ.н.– измененные в пределах декларируемой в [1] погрешности данные в столбцах 3 и 6 (концентрации 12.5 и 50 мМ соответственно).
Данные по концентрациям глюкозы на входе в перфузируемый участок кишки в [1] приведены явно и без изменений перенесены в табл. 1; данные по скорости всасывания глюкозы со всей длины исследуемого участка, снятые с графика из [1], приведены в той же табл. 1, в строке с названием Jэ.с.. При этом о достаточно точном переводе экспериментальных данных с графика в источнике [1] в табличные значения свидетельствуют полученные с их использованием результаты вычисления кинетических констант и сопротивления преэпителиального слоя: в [1] – Jmax = 0.73 ± 0.09 мкМоль/(мин см), Kt = 3.18 ± ± 0.6 мМоль и RPL = 4.87 ± 1.00 мин/см2; по данным Jэ.с. из табл. 1 – Jmax = 0.743 мкМоль/(мин см), Kt = 3.75 мМоль и RPL = 4.7 мин/см2, т.е. находятся в пределах заявленной в источнике погрешности.
Зная приведенные в [1] концентрации глюкозы на входе в перфузируемый участок тонкой кишки и скорости всасывания глюкозы на всей длине петли для этих концентраций (Cin и Jэ в табл. 1), из формулы (4) можем выразить концентрацию на выходе из перфузируемого участка:
Скорость всасывания глюкозы в расчете на 1 см длины исследуемого участка кишки, входящую в формулы (1–6) методики, получим делением Jэ на длину петли, которая приведена в [1]: L = 12.0 ± 0.7см: Jali = Ja/L или по формуле (4).
Таким образом, мы имеем все данные, необходимые для расчетов “истинных” (скорректированных с учетом влияния преэпителиального слоя) кинетических констант всасывания глюкозы в тонкой кишке (Jmax и Kt), сопротивления преэпителиального слоя, RPL, и его гипотетической толщины, d, по методике, приведенной в [1] и описанной выше. Расчеты проводились с использованием пакета “Mathcad”.
При попытке вычислить сразу все три искомых константы – Jmax, Kt и RPL – программа сообщала о невозможности найти решение, что подтверждает приведенные выше теоретические выводы о не единственности решения соответствующего оптимизационного уравнения. Если же, в соответствии с методикой [1], зафиксировать один из искомых параметров – RPL, то программа однозначно находит для него пару Jmax и Kt, по крайней мере в области определения RPL ϵ [0, Rэкв]. Причем среднеквадратичное отклонение экспериментальных значений Jэ от рассчитанных по формуле (6) получается различным для разных RPL. Тогда, выбрав минимальное СКО, объявленное в [1] критерием “истинности” сопутствующих ему кинетических параметров, получим искомую тройку – Jmax, Kt и RPL. Казалось бы, теоретическая проблема успешно разрешена с помощью “обходного” практического маневра.
На самом деле это не так: задача решена только для частного случая удачного (или удачно подогнанного?) набора экспериментальных данных (строка 2 в табл. 1: Jэ.с.). Учитывая широкий разброс экспериментальных данных даже для одной и той же петли тонкой кишки (академик Уголев А.М. в [10] честно приводит кратные различия), проблему можно будет считать снятой хотя бы при воспроизводимости вычисления констант, пропорциональной погрешности экспериментальных данных. На самом же деле оказывается, что даже незначительного изменения входных данных (не более 4% и не во всех точках, см. табл. 1) приводит к кратному изменению вычисляемых кинетических констант (см. табл. 1 и рис. 1 )!
Если с этим обстоятельством можно было бы еще бороться снижением экспериментальной погрешности, то никакими средствами, кроме субъективного выбора, нельзя убрать такие варианты экспериментальных данных, при которых минимума СКО вообще не получается (см. строку 4 в табл. 2 и рис. 1). Минимальное СКО в подобных вариантах наблюдается при RPL = 0, т.е. при толщине автономного премембранного слоя – АПС (или не перемешиваемого водного слоя – НВС), равной нулю. Но полное отсутствие этого гипотетического слоя рушит саму основу теории Нернста, т.к. исчезает канал и механизм передачи питательных веществ из полости кишки к мембранам энтероцитов (разумеется, исчезает только в теории АПС, реальные же способы передачи никуда не деваются).
Таблица 2.
Среднеквадратичные отклонения при разных параметрах расчета
| RPL, мин/см2 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|---|---|---|---|---|---|---|---|---|---|---|
| СКОэ (для Jэ.с.) | 0.0177 | 0.0166 | 0.0154 | 0.0144 | 0.0137 | 0.0136 | 0.0146 | 0.0170 | 0.0212 | 0.0278 |
| СКОв (для Jэ.в.) | 0.0116 | 0.0110 | 0.0107 | 0.0109 | 0.0118 | 0.0136 | 0.0163 | 0.0201 | 0.0253 | 0.0322 |
| СКОн (для Jэ.н.) | 0.0116 | 0.0117 | 0.0121 | 0.0134 | 0.0155 | 0.0186 | 0.0229 | 0.0285 | 0.0359 | 0.0457 |
Рис. 1.
Изменение динамики и значений среднеквадратичных отклонений расчетных от экспериментальных скоростей всасывания глюкозы (отложено по оси ординат) при вариации сопротивления преэпителиального слоя, СКО(RPL), мкмоль/(мин см), в зависимости от незначительного изменения (не более 4%) исходных экспериментальных данных в табл. 1: СКОэ – 2-я, СКОв – 3-я и СКОн – 4-я строки табл. 1. Показано, что изменение исходных данных в пределах погрешности эксперимента может привести к кратному изменению определяемого сопротивления: 2.2 и 4.7 мин/см2 или вообще его отсутствию (RPL = 0); так же при этом будет меняться и толщина преэпителиального слоя, т.к. она прямо пропорционально его сопротивлению. По оси абсцисс отложено сопротивление преэпителиального слоя, RPL, мин/см2.

В результате численного моделирования были определены причины, из-за которых сопротивление п/э слоя RPL ведет себя, казалось-бы, так непредсказуемо. Оказалось, что никакого отношения к динамике всасывания глюкозы эти причины не имеют и полностью определяются математическими соображениями, а именно, взаимным расположением исходных данных для расчета. Так, если большинство экспериментальных точек Jэi(CL lgi) находится ниже или на аппроксимирующей их по формуле (6) кривой Jarij(CM lgij) (при RPL= 0 → Jari(CL lgi)), то минимума на графике СКО(RPL) не будет вообще, а минимальное значение СКО будем наблюдать при RPL = 0 (см. рис. 1, кривая СКОн), т.е. при толщине АПС (или НВС) = 0, что не имеет смысла. Если же большинство экспериментальных точек Jэi(CL lgi) находится выше аппроксимирующей их по формуле (6) кривой Jarij(CM lgij) (при RPL = 0 → Jarij(CL lgij)), то на графике СКО(RPL) будет наблюдаться минимум, а его расположение вдоль оси RPL будет зависеть от значения первоначального отклонения экспериментальных точек от расчетных: чем выше экспериментальные точки над аппроксимирующей кривой – тем больше значение RPL, при котором кривая СКО(RPL) имеет минимум. На рис. 2, построенном по данным строки 2 табл. 1, видно, как это происходит (для наглядности на рис. 2 приведены только две центральные точки: 4-й и 5-й столбцы 2-й строки табл. 1).
Рис. 2.
Изменение расположения экспериментальных значений скоростей всасывания глюкозы Jэ (столбцы 4, 5 табл. 1; горизонтальные линии и точки на них), и аппроксимирующих их по формуле (6) расчетных кривых JR0, JR5 и JR9. При RPL = 0 экспериментальные точки лежат над аппроксимирующей их кривой JR0; при увеличении RPL СКО непрерывно уменьшается, достигая при RPL = 4.7 мин/см2 (кривая JR5) своего минимального значения (СКОmin = = 0.0136, 7-й столбец 2 строки табл. 2) – экспериментальные значения практически лежат на аппроксимирующей их кривой; при дальнейшем увеличении RPL СКО снова растет, а исходные точки опускаются все ниже и ниже под аппроксимирующую кривую (JR9 соответствует RPL = 9 мин/см2). Приведенным графикам соответствует кривая СКОэ на рис. 1. По оси абсцисс отложены среднелогарифмические по длине перфузируемого участка концентрации глюкозы, мМ; по оси ординат– скорости всасывания глюкозы, мкмоль/(мин см).
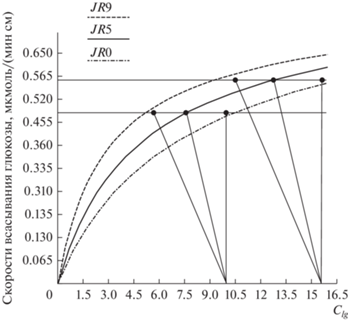
Начальное СКО зависит от взаимного расположения исходных точек, рассчитанных по экспериментальным значениям (табл. 1, ф-лы 1–4) и аппроксимирующей их кривой, рассчитанной по ф-ле (6) при RPL = 0. Дальнейшие итерационное увеличение RPL это не что иное, как изменение тангенса угла наклона линейной функции, определяемой формулой (3), к оси абсцисс, вдоль которой отложены CL lgi и CM lgij (см. рис. 2). Пересечением линии Jaэi с Jarij и определяются искомые значения CM lgij, по j-м наборам которых находятся соответствующие аппроксимирующие кривые. Из рис. 2 видно (см. также рис. 5.1 из [16]), что аппроксимирующие кривые не эквидистантны, а выгибаются влево и вверх, из-за чего и происходит вариация значений среднеквадратичного отклонения. Т.е., при условии расположения первоначальных экспериментальных точек CL lgi выше аппроксимирующей их кривой (рис. 2) в процессе итерационного увеличения RPL от нулевой величины находится такое его значение, при котором вычисленные по экспериментальным точкам CM lgij располагаются от нее на минимальном расстоянии (см. рис. 2, средняя кривая, RPL = = 4.7 мин/см2), обеспечивая, тем самым, минимальное СКО (см. рис. 1, кривые СКОэ и СКОв). Дальнейшее увеличение RPL приводит к увеличению СКО, т.к. аппроксимирующие кривые и рассчитанные по экспериментальным точки CM lgij начинают расходиться (см. рис. 2, верхняя кривая, RPL = 9 мин/см2; рис. 1, кривые СКОэ и СКОв после 4.7 и 2.2 соответственно).
Из рис. 2 видно, что чем ближе к первоначальной аппроксимирующей кривой находятся вычисленные по экспериментальным точки Jaэi(CL lgi), тем при меньшем RPL наступает минимум СКО (строки 3 в табл. 1 и 2 (на рис. 2 не приведено, чтобы сохранить наглядность); кривая СКОн приведена на рис. 1: координаты минимума СКО при RPL = 2.2 мин/см2).
Если же большинство вычисленных по экспериментальным точек Jaэi(CL lgi) находятся ниже или на аппроксимирующей кривой, то по вышеназванным причинам минимума СКО не будет вообще (см. строку 4 в табл. 1 и 2; кривая СКОн на рис. 1).
2.2. Противоречия между математическими описаниями распределения концентрации глюкозы по длине кишки и всасывания через ее внутреннюю поверхность
Общепризнано и доказано экспериментально, что кинетика всасывания питательных веществ в тонком кишечнике нелинейно зависит от их концентрации [1–4, 13–16, 19–22] и, скорее всего, происходит в соответствии с формулой Михаэлиса–Ментен (6). Тогда, зависимость Михаэлиса–Ментен должна проявляться не только при разных концентрациях на входе в исследуемый участок тонкой кишки, как это происходит в хронических экспериментах [1, 13, 14], но и при распределении концентрации вдоль этого участка, т.к. оно существенно. Например, при концентрации глюкозы на входе в 12 сантиметровую петлю кишки крысы в 50 мМ и расходе 0.26 мл/мин на выходе остается порядка 17.3 мМ; при 25 мМ на входе – на выходе получим порядка 2.7 Мм (вычислено по формуле (4*) и данным табл. 1). Выясним, учитывается ли это при математическом описании распределения концентрации глюкозы вдоль исследуемого участка кишки.
В методике определения “истинных” кинетических констант всасывания глюкозы [1], рассмотренной в предыдущем разделе, приведены формулы для вычисления среднелогарифмической по длине кишки концентрации (2) и эквивалентного (суммарного) сопротивления эпителиального и преэпителиального слоев (ф-ла 3 в [1]), обозначенного в [1] как RPL', хотя обычно оно обозначается как Rэкв [3]. Формулы эти взяты из решения дифференциального уравнения, описывающего распределение концентрации глюкозы вдоль тонкой кишки при условии отсутствия радиальных градиентов концентрации благодаря интенсивному перистальтическому перемешиванию содержимого ([3], стр. 93, приведено к стандартному виду [5]):
(9)
$\frac{{dC\left( x \right)}}{{dx}} + \frac{{C\left( x \right)}}{{\vartheta {{R}_{{{\text{экв}}}}}}} = 0,$Решение линейного дифференциального уравнения (9) приведено в [5]:
(10)
$C\left( x \right) = {{C}_{{{\text{in}}}}}\exp \left( { - \frac{x}{{\vartheta {{R}_{{{\text{экв}}}}}}}} \right)~.$Отсюда, для участка длиной L ([3], стр. 93):
(11)
${{R}_{{{\text{экв}}}}} = \frac{L}{{\vartheta \ln ({{{{C}_{{{\text{in}}}}}} \mathord{\left/ {\vphantom {{{{C}_{{{\text{in}}}}}} {{{C}_{{{\text{out}}}}}}}} \right. \kern-0em} {{{C}_{{{\text{out}}}}}}})}},$Здесь следует отметить, что Rэкв в формуле (11) относится к принятой единице длины исследуемого участка, в нашем случае к 1 см, т.е. априори предполагается, что эквивалентное сопротивление одинаково для любого единичного участка длины кишки. Однако такое допущение не корректно из-за нелинейной зависимости скорости всасывания от концентрации по механизму Михаэлиса–Ментен (в радиальном направлении через эпителий кишки) и существенной разницы концентраций на входе и выходе из исследуемой петли, как уже говорилось выше.
Вычислим и покажем графически к чему приводит указанное некорректное допущение на примере экспериментальных данных, уже использованных нами в предыдущем разделе. Для тестового расчета возьмем, например, данные с концентрацией глюкозы на входе Cin = 50 мМ и рассчитанной по экспериментальным данным средней скоростью всасывания глюкозы Jэс = 8.5 мкМ/мин (6-й столбец табл. 1). Концентрацию на выходе из исследуемого участка вычислим по формуле (4*): Cout = 17.3 мМ. Теперь можем вычислить Rэкв = 43.5 мин/см2. Далее восстановим распределение концентрации глюкозы.
В этом месте следует отметить еще одно подтверждение нелинейной зависимости скорости всасывания глюкозы от ее концентрации. Вычислив указанным выше способом значения Rэкв для всех входных концентраций, приведенных в табл. 1, увидим, что с повышением Сin растет и сопротивление: Rэкв = {11.1; 15.0; 20.7; 27.2: 43.5; 69.1; 95.1}. Т.к. эквивалентное сопротивление является суммой сопротивлений эпителиального и преэпителиального слоев [2–4], а толщина и свойства преэпителиального слоя (АПС, НВС) являются постоянными (одни и те же петля кишки и расход перфузата), соответственно, его сопротивление тоже не будет меняться. А значит, рост эквивалентного сопротивления при увеличении входной концентрации вызван исключительно повышением сопротивления эпителиального слоя, что как раз и описывается динамикой Михаэлиса–Ментен и происходит за счет насыщения активных транспортеров глюкозы [1, 3, 14] вдоль исследуемого участка кишки по формуле (10). Отметим, что можно вычислить С(x) сколь угодно подробно при условии, что х будет измеряться в сантиметрах. Однако произведенные нами вычисления с шагом 1 см и 1 мм (0.1 см в формуле 10) дали одинаковые результаты в совпадающих точках, поэтому, казалось бы, уменьшать шаг разбиения смысла нет. Но, с точки зрения дальнейших вычислений скорости всасывания глюкозы с каждого отрезка разбиения, корректнее было бы деление на участки минимальной длины, потому что тогда разница концентраций между входом и выходом участка будет минимальной, что позволит нам не учитывать нелинейность скорости всасывания от концентрации. Поэтому выполним расчеты и для 12 участков по 1 см, и для 120 участков по 0.1 см и сравним результаты.
Следующим шагом является вычисление массива среднелогарифмических значений концентраций на каждом из участков, Clgi (между значениями Сi и C(i+ 1)), по формуле (2). После этого можем определить значения скорости всасывания глюкозы в расчете на сантиметр длины, Jri, с каждого из участков по формуле (1), в которой вместо RPL будет присутствовать Rэкв, а вместо CM lgij будет ноль, т.к. эквивалентное сопротивление является суммой сопротивлений преэпителиального и эпителиального слоев и концентрация глюкозы внутри энтероцита обычно принимается равной нулю [3]:
(12)
${{J}_{{ri}}} = {{{{C}_{{{\text{lg}}i}}}} \mathord{\left/ {\vphantom {{{{C}_{{{\text{lg}}i}}}} {{{R}_{{{\text{экв}}}}}}}} \right. \kern-0em} {{{R}_{{{\text{экв}}}}}}}.$Теперь можем проверить правильность наших расчетов и влияние количества элементарных отрезков, на которые разбит исследуемый участок кишки, на их точность, сложив все Jri, предварительно умноженные на длину элементарного отрезка:
где j – номер количества разбиений; в настоящей работе было рассмотрено три варианта: при j = 1 петля не разбивалась на отрезки (dx1 = 12 см), при j = 2 петля разбивалась на 12 отрезков (dx2 = = 1 см); при j = 3 петля разбивалась на 120 отрезков (dx3 = 0.1 см); Nj – количество элементарных отрезков, на которые разбивался исследуемый участок, N1 = 1, N2 = 12, N3 = 120; Jri – скорость всасывания глюкозы на i-м отрезке разбиения, мкМ/(мин см).При правильных расчетах Jr∑j должны быть равными экспериментальной Jэс = 8.5 мкМ/мин (6-й столбец табл. 1). Хотя во всех трех случаях проверка прошла успешно, но, как уже было сказано выше, предпочтительным для дальнейших расчетов является более “мелкое” разбиение (N3 = 120).
Теперь мы можем вычислить среднелогарифмические концентрации глюкозы на прилегающей к эпителию стороне гипотетического преэпителиального слоя CMlgi для каждого i-го отрезка по формуле (3) из предыдущего раздела:
Как уже говорилось выше, расчеты выполним для разбиения с шагом 0.1 см, т.к. этот вариант обеспечивает минимальную разницу концентраций глюкозы между входами и выходами i-х элементарных отрезков, что позволит минимизировать влияние нелинейности скорости всасывания глюкозы от концентрации.
Полученные результаты распределения концентраций глюкозы вдоль исследуемого участка кишки с двух сторон преэпителиального слоя представлены на рис. 3 , а соответствующее им распределение скорости всасывания глюкозы – на рис. 4 . Следует отметить, что значения скоростей всасывания глюкозы, полученные по формулам (1, 4, 12) должны быть одинаковыми, что и подтвердилось расчетами.
Зная распределение концентраций глюкозы на границе преэпитэлиального и эпителиального слоев, Сm, можем вычислить гипотетическое распределение скоростей всасывания глюкозы в зависимости от Сm по формуле Михаэлиса–Ментен (6), подставив в нее значения “истинных” кинетических констант, полученных в [1]: Kt = 3.18 Мм, Jmax = = 0.73 мкМ/(мин см). Полученные распределения скоростей всасывания глюкозы в зависимости от концентрации для всех трех вариантов расчета представлены на рис. 5 и 6 (для двух других вариантов зависимости J(Cm) следуют из рис. 3 и 4). На рис. 5 и 6 приведены одни и те же данные, только на рис. 5 указаны все значения скоростей всасывания, рассчитанные с использованием эквивалентного сопротивления (J) и сопротивления преэпителиального слоя (JR), а на рис. 6 нижний и верхний пределы по оси ординат даны по значениям скорости всасывания, рассчитанной по формуле Михаэлиса–Ментен (6), чтобы наглядно показать характерную динамику последней зависимости – типичную кривую насыщения.
Рис. 3.
Пример расчетного распределения концентраций глюкозы вдоль исследуемого участка тонкой кишки по обе стороны от преэпителиального слоя (по оси ординат): С – концентрация со стороны полости кишки, Сm – на границе с эпителием, мМ. По оси абсцисс – расстояние от входа в экспериментальный участок, см. Кривые рассчитаны по экспериментально определенной скорости всасывания глюкозы на всем участке Jэ = 8.5 мкМ/мин.

Рис. 4.
Разница в распределении скоростей всасывания глюкозы (по оси ординат) вдоль исследуемого участка тонкой кишки в расчете на 1см длины, мкМ/(мин см) при одном и том же экспериментальном значении суммарной скорости всасывания Jэ = 8.5 (мкМ/мин): J – рассчитанные с использованием эквивалентного сопротивления Rэкв = 43.5 мин/см2 по ф-ле (12), JR – с использованием сопротивления преэпителиального слоя RPL = 4.87 мин/см2 по ф-ле (1), Jrk – по формуле Михаэлиса–Ментен (6) со значениями Сm с рис. 3. По оси абсцисс – расстояние от входа в экспериментальный участок, см.

Рис. 5.
Разница в распределении скоростей всасывания глюкозы в расчете на 1 см длины кишки (по оси ординат), мкМ/(мин см), при одном и том же экспериментальном значении суммарной скорости всасывания Jэ = = 8.5 (мкМ/мин), в зависимости от концентрации глюкозы на границе преэпитэлиального и эпителиального слоев Сmob = [мМ]: J – рассчитанные с использованием эквивалентного сопротивления Rэкв = 43.5 мин/см2 по ф-ле (12), JR – с использованием сопротивления преэпителиального слоя RPL = 4.87 мин/см2 по ф-ле (1), Jrk – по формуле Михаэлиса–Ментен (6) со значениями Сm с рис. 3.
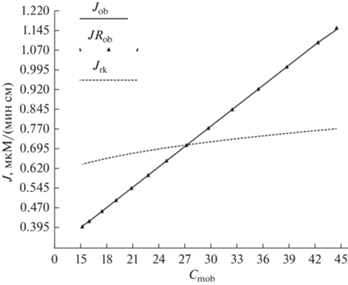
Рис. 6.
Графики с рисунка 5 в масштабе значений Jrkob. Линейные зависимости Job и JRob расчитаны по формулам (12) и (3*) и экспериментальным данным из [1]; Jrkob – по формуле Михаэлиса–Ментен с кинетическими константами из [1] и представляет собой типичную кривую насыщения.
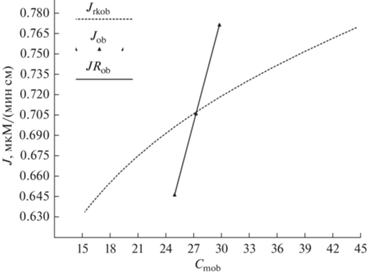
Из рис. 4, 5 и 6 очевидно, что распределения скоростей всасывания глюкозы вдоль исследуемого участка тонкой кишки, рассчитанные, с одной стороны, с использованием эквивалентного сопротивления (J) и сопротивления преэпителиального слоя (JR), а с другой – с использованием уравнения Михаэлиса–Ментен (6), имеют разную динамику, т.к. первые зависимости линейны, а вторая представляет собой типичную кривую насыщения. Поэтому попытки аппроксимировать линейное распределение скорости всасывания глюкозы, полученное из уравнений (9, 10), кривой насыщения Михаэлиса–Ментен изначально не верны, т.к. исходная и аппроксимирующая зависимости должны быть идентичны по форме. Возникает вопрос: от какой зависимости следует отказаться, как от неадекватной? Т.к. нелинейная зависимости скорости всасывания от концентрации нутриентов многократно подтверждена экспериментально [1–4, 7, 13, 14], а распределение концентраций по формулам (9, 10) экспериментально не подтверждено, то отказаться следует от последнего описания со всеми вытекающими из этого последствиями – среднелогарифмическим распределением концентраций вдоль исследуемого участка кишки (ф-ла 2), постоянным эквивалентным сопротивлением (ф-ла 11) и неизменным сопротивлением преэпителиального слоя (ф-лы 1, 3 и 3*). Предложения по преодолению указанных противоречий изложены в разделе Перспективы.
3. ВЫВОДЫ
1. Определенные по методике [1] сопротивление преэпителиального слоя и его толщина могут быть не единственными или нулевыми и однозначный их выбор либо субъективен, либо случаен, т.к. минимизируемый функционал (см. Приложение А) для их вычисления нелинеен. Данный вывод подтвержден тестовыми расчетами с использованием экспериментальных данных, приведенных в [1]. Изменение 2-х из 7-ми полученных экспериментально скоростей всасывания глюкозы не более чем на 4% (см. табл. 1) привело, в первом случае, к изменению сопротивления преэпителиального слоя (соответственно, и его толщины) более чем в два раза, а во втором случае, минимума среднеквадратичного отклонения вообще не было – минимальное значение СКО было при RPL = 0 (см. рис. 1), т.е. преэпителиальный слой отсутствовал, что противоречит изначальной теории.
2. Основываясь на результатах физических экспериментов [8], доказывающих отсутствие неперемешиваемого поверхностного слоя при турбулентном течении жидкости в трубах (турбулентность в тонкой кишке обеспечивается интенсивным перистальтическим перемешиванием) и нашего математического анализа методики определения “истинных” кинетических констант всасывания глюкозы [1], предлагается отказаться от понятия преэпителиального слоя (НВС, АПС) при вычислении кинетических констант (Jmax и Kt) по данным хронических экспериментов. При таком подходе допустимо будет считать, что интенсивное перистальтическое перемешивание обеспечивает одинаковую концентрацию нутриентов и в полости кишки, и на ее эпителиальной поверхности, т.е. при описании процессов всасывания в формулу Михаэлиса–Ментен (6) надо будет подставлять среднелогарифмические значения между входными и выходными концентрациями (ф-ла 2). Это позволит получать однозначные кинетические константы, по крайней мере, по данным одной экспериментальной серии, т.к. минимизируемые функционалы СКО (ф-лы 7*, 7**) имеют единственные решения. Полученные при таком подходе кинетические константы адекватно зависят от флуктуаций входных экспериментальных данных: разница при трех вариантах из табл. 1 не превышает 2% по Jmax и 14% по Kt (расчет по 2-строке табл. 1: Jmax = 0.76, Kt = 6.84; по 3-й строке: Jmax = 0.76, Kt = 7.04; по 4-й строке: Jmax = 0.75, Kt = 6.03). Кроме того, полученные параметры сравнимы с “истинными” кинетическими константами, скорректированными с учетом влияния преэпителиального слоя (например, в [1]: Jmax = 0.73 ± 0.09, Kt = 3.18 ± 0.6; в [13]: Jmax = 0.76 ± ± 0.08, Kt = 2.92 ± 0.48), поэтому не вызовут “потрясения основ”, но помогут прийти к более однозначным и сравнимым результатам. На существующем этапе развития математического моделирования процессов всасывания в тонком кишечнике предлагаемый подход будет оптимальным, хотя и не лишенным недостатков. Одним из существенных недостатков являются слишком большие перепады концентраций между входом в исследуемый участок тонкой кишки и выходом из нее, ведь в формуле Михаэлиса–Ментен, по определению, должны стоять локальные концентрации, мы же в данной методике оперируем интегральными – среднелогарифмическими между входом и выходом. Одно из возможных направлений более адекватного описания процессов всасывания нутриентов в тонком кишечнике предложено в следующем разделе.
3. Используемое в настоящее время математическое описание одномерного распределения концентраций между входом и выходом из исследуемого участка тонкой кишки (ф-лы 10–12) априори не может учитывать всасывание по механизму Михаэлиса–Ментен, т.к. скорость всасывания на единицу длины тонкой кишки в рассматриваемом описании линейно зависит от текущей концентрации, тогда как в формуле Михаэлиса–Ментен (6) указанная зависимость не линейна, а является типичной кривой насыщения (см. рис. 5, 6). Чтобы учесть многократно подтвержденную экспериментально [1–4, 7, 13, 14] нелинейность зависимости скорости всасывания от концентрации нутриентов, при математическом описании этих процессов необходимо перейти от интегральных характеристик (среднелогарифмические концентрации, эквивалентное сопротивление и проч.) к локальным: сопротивление элементарной площадки эпителия и локальной концентрации питательных веществ вблизи поверхности этой площадки. Один из возможных подходов к подобному описанию представлен в следующем разделе.
4. ПЕРСПЕКТИВЫ
Чтобы устранить противоречия в описании процессов всасывания нутриентов в тонком кишечнике, выявленные в настоящей статье, необходимо кардинально поменять математическую модель этих процессов, полумеры здесь не помогут. Во-первых, надо отказаться от несуществующего в природе [8] неперемешиваемого поверхностного слоя (АПС, слоя Нернста), каким бы “удобным и простым” не было описание процессов всасывания с его помощью. Во-вторых, необходимо отказаться только от одномерного по длине кишки распределения концентрации нутриентов, добавив радиальные градиенты. Понятно, что радиальные градиенты концентрации при интенсивном перистальтическом перемешивании будут иметь место только в непосредственной близости от поверхности всасывания, что все же их не отменяет.
Формальные дифференциальные уравнения для описания такого двумерного поля концентрации будут аналогичны уравнениям из научных областей гидродинамики и теплопроводности, решения которых известны и даже являются аналитическими для простых граничных условий. Однако, для реальных нелинейных граничных условий типа Михаэлиса–Ментен придется использовать численные методы, что так же не является проблемой при современном развитии компьютерной техники и математического программного обеспечения.
Понятно, что новый математический аппарат будет сложнее используемого в настоящее время, но, зато мы получим универсальные кинетические константы, применимые при разных скоростях течения перфузата, разных концентрациях градиентов и, самое главное, разных геометрических размерах тонкой кишки – от мыши до слона.
Надеюсь, следующая моя публикация будет посвящена двумерной математической модели всасывания питательных веществ в тонком кишечнике.
Список литературы
Громова Л.В., Груздков Ал.А., Груздков А.А. Кинетические параметры гидролиза мальтозы и всасывания глюкозы в тонкой кишке крыс в хронических опытах // Рос. физиол. журн. им. И.М. Сеченова. 2002. 88(4). С. 510.
Груздков A.A. Биофизические аспекты транспорта пищевых веществ в автономном премембранном слое. Мембранный гидролиз и транспорт: Новые данные и гипотезы / Под ред. А.М. Уголева. Л.: Наука, 1986. С. 167.
Груздков А.А. Пространственная организация пищеварения и всасывания в тонкой кишке. Дис. ... д. б. н., Ин-т физиологии им. И.П. Павлова РАН, СПб, 1998., 295с.
Груздков А.А. Современные представления о переносе веществ через преэпителиальный слой тонкой кишки // Рос. физиол. журн. им. И.М. Сеченова. 1993. 79 (6). С. 19.
Kамке E. Справочник по обыкновенным дифференциальным уравнениям / Пер. с нем. С.В. Фомина. 6-е изд., стер. СПб.: “Лань”, 2003., 576 с.
Кащенко С.А., Ткачева Е.Н. Морфометрические параметры лимфоидных образований тонкой кишки крыс в возрастном аспекте // Морфология. 2009. 3 (4). С. 25.
Куклина М.М., Куклин В.В. Экспериментальное исследование особенностей физиологии и питания ленточных червей Tetrabothrius minor (Cestoda; Tetrabothriidae) // Вестн. Кольского НЦ РАН. 2015. 2 (21). С. 49.
Левич В.Г. Физико-химическая гидродинамика. Изд. второе, дополн. и перер., М.: ГИ ФМЛ. 1959.
Справочник химика / Под ред. Б.П. Никольского и др., изд. второе, переработанное и дополненное, Т. 3., Л.: “Химия”, 1965. 1008 с.
Уголев А.М. Материалы по пристеночному пищеварению. Сообщение III. Сопоставление ферментативного гидролиза крахмала в кишке и in vitro // Бюлл. эксп. биологии и медицины. 1961. Т. 52. № 8. С. 8.
Уголев A.M. Мембранное пищеварение. Полисубстратные процессы, организация и регуляция. Л.: Наука, 1972.
Физические величины: Справочник / А.П. Бабичев, Н.А. Бабушкина, А.М. Братковский и др. / Под ред. И.С. Григорьева, Е.З. Мейлихова. М.: Энергоатомиздат, 1991. 1232 с.
Шептицкий В.А. Ca2+-зависимое всасывание глюкозы в тонкой кишке // Buletinul ASM. Stiintele vietii. 2018. V. 1 (334). С. 49.
Gruzdkov A.A., Gromova L.V., Grefner N.M., Komissarchik Y.Y. Kinetics and mechanisms of glucose absorption in the rat small intestine under physiological conditions // J. Bioph. Chemistry. 2012. V. 3. № 2: P. 191.
Levitt M.D., Fetzer C.A., Kneip J.M., Bond J.H., Levitt D.G. Quantitative assessment of luminal stirring in the perfused small intestine of the rat // Amer. J. Physiol. 1987. V. 252 (3). P. 325.
Lucas M.L. A contribution to analysis of three-compartmental models for intestinal weak electrolyte absorption // Amer. J. Physiol. 1984. V. 247 (5). P. 463.
Nernst W.H. Theorie der Reaktionsgeschwindigkeit in heterogenen Systemen // Zeitschrift für Physikalische Chemie. 1904. V. 47 (1). P. 52.
Nernst W.H., Merriam E.S. Zur Theorie des Reststroms // Zeitschrift für Physikalische Chemie. 1905. V. 53 (2). P. 235.
Schlichter L.C. Unstirred mucus layers: ion exchange properties and effect on ion regulation in luminaea stagnalis // J. Exp. Biol. 1982. V. 98. P. 363.
Strocchi A., Levitt M.D. A reappraisal of the magnitude and implications of the intestinal unstirred layer // Gastroenterol. 1991. V. 101. P. 843.
Westergaard H., Holtermuller K.H., Dietschy J.M. Measurement of resistance of barriers to solute transport in vivo in rat jejunum // Am. J. Physiol. 1986. V. 250. P. 727.
Wine D. Correction of the apparent Michaelis constant, biased by an unstirred layer, if a passive transport component is present // Biochim. Biophys. Acta. 1977. V. 464 (1). P. 118.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


