Успехи физиологических наук, 2022, T. 53, № 2, стр. 67-82
Молекулярные механизмы изменений системы гемостаза в третьем триместре беременности
А. А. Тараканова a, И. П. Тесаков b, Н. А. Подоплелова b, c, А. Н. Свешникова a, b, c, *, Е. М. Кольцова b, c
a Первый Московский государственный медицинский университет им. И.М. Сеченова
119991 г. Москва, Россия
b Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии
им. Дмитрия Рогачева
117198 Москва, Россия
c Центр теоретических проблем физико-химической фармакологии Российской академии наук
109029 Москва, Россия
* E-mail: agolomy@gmail.com
Поступила в редакцию 23.12.2021
После доработки 26.12.2021
Принята к публикации 28.12.2021
- EDN: USPFHI
- DOI: 10.31857/S0301179822020084
Аннотация
Беременность – это физиологический процесс, начинающийся с оплодотворения яйцеклетки и заканчивающийся рождением ребенка. При беременности в организме матери происходит целый ряд изменений, в том числе в системе гемостаза. Можно утверждать, что общий баланс системы свертывания при беременности сдвинут в сторону прокоагулянтного состояния: отмечается повышение концентрации в крови ряда факторов свертывания (VII, VIII, IX, XII, фактора фон Виллебранда), фибриногена, снижение концентрации и активности некоторых ингибиторов свертывания, например, протеина S. Физиологическая беременность нередко сопровождается тромбоцитопенией, которая, как правило, не приводит к серьезным кровотечениям в отсутствие каких-либо иных предпосылок. Предактивация тромбоцитов является одним из возможных механизмов предотвращения кровотечений при беременности. Во многом изменения системы гемостаза при физиологической беременности можно объяснить контактом крови матери с клетками плаценты (в первую очередь с трофобластом). Известен ряд молекулярных механизмов взаимодействия тромбоцитов с трофобластом, в частности происходит активация тромбоцитов через рецепторы-гликопротеины GPVI и GPIIb–IIIa (интегрин αIIbβ3), приводящая к секреции тромбоцитарных гранул, содержащих разнообразные хемокины и факторы роста. Эти механизмы обеспечивают как правильное формирование плаценты и адекватное кровоснабжения плода, так и предотвращение возможных тромботических и геморрагических осложнений. С другой стороны, они могут становиться ключевыми триггерами серьезных, иногда жизнеугрожающих, осложнений беременности. В настоящем обзоре описаны ключевые изменения системы гемостаза при физиологической и патологической беременности, а также известные на сегодняшний день молекулярные механизмы, лежащие в основе этих изменений.
ВВЕДЕНИЕ
Беременность является физиологическим состоянием женского организма. При этом во время нормально протекающей беременности в материнском организме наблюдаются существенные анатомические и биохимические изменения, направленные на создание оптимальных условий для роста и развития плода [7]. Физиологическая адаптация происходит практически во всех системах организма: в нервной, сердечно-сосудистой, дыхательной, эндокринной системах, в опорно-двигательном аппарате [7]. Поскольку плод является чужеродным по отношению к тканям матери, он может вызвать нежелательную реакцию иммунной системы женщины, поэтому нормальная беременность традиционно рассматривается как иммуносупрессивное состояние [65].
При физиологической беременности обычно наблюдаются изменения – в концентрациях и соотношении форменных элементов крови, при одновременном снижении гемоглобина (табл. 1) и гематокрита – появляется так называемая физиологическая анемия беременных [14]. Эти изменения принято ассоциировать с увеличением объема циркулирующей крови (ОЦК), которое происходит на протяжении всего периода беременности, достигая максимума на сроке 34 нед. (до 1.5 раз от исходного значения), при этом при многоплодной беременности ОЦК выше, чем при одноплодной [90]. Увеличение ОЦК происходит, в частности, за счет изменения активности транспорта натрия в почках и задержки его в организме, т.е. при этом увеличивается именно содержание воды в крови [99].
Таблица 1.
Некоторые параметры гемограммы и коагулограммы для группы женщин в III триместре беременности и группы здоровых контролей соответствующего возраста (из работы Della Rocca и др. [31], с изменениями). Сокращения: АЧТВ – активированное частичное тромбопластиновое время, МНО – международное нормализованное отношение
| Показатель | Беременные (III триместр) | Здоровые контроли | Уровень значимости различий |
|---|---|---|---|
| Гемоглобин (г/дл) | 11.8 ± 1.1 | 12.9 ± 1.1 | <0.001 |
| Тромбоциты (тыс./мкл) | 229 ± 52 | 266 ± 54 | <0.001 |
| Фибриноген (мг/дл) | 588 ± 80 | 347 ± 75 | <0.001 |
| МНО | 0.93 ± 0.04 | 1.01 ± 0.07 | <0.001 |
| АЧТВ | 0.99 ± 0.08 | 1.05 ± 0.08 | <0.001 |
Физиологическая беременность условно разделяется на два периода – эмбриональный (от момента оплодотворения до 8 нед. гестации) и фетальный (от 9 нед. гестации до родов) [11]. В течение эмбрионального периода происходит формирование первичных структур эмбриона и внедрение эмбриона в слой эндометрия [85]. В организме женщины в этот период начинается формирование плаценты – основного органа беременности, который должен обеспечивать адекватное кровоснабжение и питание плода [26]. Во время фетального периода в плаценте происходит увеличение размеров плода, развитие органов в рамках уже сформированных систем. Основные процессы, приводящие к изменениям иммунной системы и системы гемостаза при беременности, происходят в плаценте [36], в которой контактируют ткани матери и ребенка.
В то время как работа иммунной системы женщины подавляется [65] выделяемыми клетками плаценты соединениями (стероидными гормонами, главным образом – прогестероном [84], а также интерлейкином-10 [80]), система остановки кровотечений – система гемостаза – напротив, переходит в активированное состояние [8]. Тенденция к повышенной свертываемости крови (гиперкоагуляции) наблюдается начиная с ранних сроков беременности [44], когда только происходит внедрение эмбриона в слизистую оболочку матки (эндометрий) и формирование кровотока в системе мать–плацента–плод [85]. Эти изменения усиливаются по мере развития беременности [31]. Физиологический смысл гиперкоагуляции при беременности, как принято считать, заключается в своевременной остановке послеродовых кровотечений [46] – осложнений, наблюдаемых в 1.2% случаев [98] и на сегодняшний день остающихся ведущей причиной смертности при беременности с документированной летальностью около 3% во всем мире [97, 98]. В то же время, повышенная свертываемость крови при беременности становится фактором риска венозных тромбозов [70]. Этому дополнительно способствует стаз крови в венах нижних конечностей, который обусловлен расширением вен и замедлением кровотока в них. Не менее важную роль играют и особенности реологии крови, наблюдаемые в спиральных артериях матки и необходимые для адекватного кровоснабжения плода [25].
Основные изменения в системе гемостаза при беременности начинаются с тонких процессов, происходящих на уровне плаценты. Они неразрывно связаны с изменениями реологии крови и перестройкой иммунной системы. Понимание молекулярных основ этих процессов необходимо как для определения тактики ведения физиологической беременности, так и для предупреждения развития серьезных, порой жизнеугрожающих, осложнений.
ИЗМЕНЕНИЯ ГЕМОСТАЗА ПРИ БЕРЕМЕННОСТИ
Система остановки кровотечения – система гемостаза – традиционно разделяется на плазменное звено, состоящее из факторов и ингибиторов свертывания крови (рис. 1), и сосудисто-тромбоцитарное звено, состоящее в сужении просвета сосуда, а также адгезии и агрегации в месте повреждения клеток крови, в первую очередь тромбоцитов [3]. В активированном состоянии факторы свертывания крови являются сериновыми протеазами и образуют так называемый “каскад свертывания”, конечным результатом которого является превращение растворимого фибриногена в фибрин и последующая его полимеризация (рис. 1) [4].
Рис. 1.
Механизмы изменения системы свертывания крови на уровне плаценты. Взаимодействие основных компонентов плазменного звена гемостаза с клетками трофобласта и тромбоцитами. Сокращения: EGF – эпидермальный фактор роста, FDP – продукты деградации фибрина, GPIb – гликопротеин Ib, GPV – гликопротеин V, GPIX – гликопротеин IX, PAI-1 – ингибитор активатора плазминогена 1, PAI-2 – ингибитор активатора плазминогена 2, PCa – протеин C (активная форма), PDGF – тромбоцитарный фактор роста, PrS – протеин S, PS – фосфатидилсерин, Smad3a – активная форма белка Smad3, TAFI – тромбин-активируемый ингибитор фибринолиза, TF – тканевый фактор, TFPI – ингибитор пути тканевого фактора, tPA – тканевый активатор плазминогена, uPA – активатор плазминогена урокиназного типа, VEGF – фактор роста эндотелия сосудов, VWF – фактор фон Виллебранда.

Белки свертывания синтезируются в основном в печени и циркулируют в кровотоке, за исключением тканевого фактора (ТФ). Большинство факторов свертывания циркулируют как неактивные зимогены, которые могут подвергаться последовательной активации, приводящей к возникновению выраженной протеазной активности [5]. Основным путем запуска плазменного свертывания является образование комплекса ТФ с FVII и его последующая активация, а также комплексообразование с циркулирующими следовыми количествами активированного FVII (Рис. 1) [2].
Общий баланс системы свертывания при беременности сдвинут в сторону прокоагулянтного состояния [10], о чем можно судить по изменению в показателях свертываемости крови. Например, в третьем триместре наблюдается снижение международного нормализованного отношения (МНО), характеризующего время свертывания плазмы крови в ответ на добавление тканевого фактора. Хотя обычно МНО применяется для контроля антикоагулянтной терапии, т.е. показательным является именно повышение МНО [57], теоретически, показываемое им ускорение свертывания плазмы может свидетельствовать о повышении концентрации активного фактора VII [101], либо о снижении активности противосвертывающей системы, о которой речь пойдет ниже. В третьем триместре также наблюдается снижение времени свертывания плазмы в ответ на активацию по контактному пути показателя активированного частичного тромбопластинового времени (АЧТВ) (табл. 1) [31]. Аналогично МНО, АЧТВ более достоверен для измерения снижения активности системы свертывания, однако, есть данные о корреляции снижения АЧТВ и высокого риска тромбоза глубоких вен и сходных тромбофилий [57]. Возможно, наиболее достоверным показателем прокоагулянтного состояния системы гемостаза при физиологической беременности является значительное (в 3–13 раз) повышение уровня D-димера, наблюдаемое даже при беременности, протекающей без осложнений [42, 51]. D-димер – это фрагмент фибрина, образующийся при разрушении фибриновой сети, следовательно, повышение этого значения свидетельствует об идущем в организме беременной женщины процессе тромбообразования и тромболизиса [21]. Однако, повышение этого показателя также частично отражает повышение уровня фибриногена, о котором пойдет речь ниже.
Известно, что во время беременности и в течение 5–8 нед. после родоразрешения отмечается повышение концентрации факторов свертывания VII, VIII, IX, XII, фактора фон Виллебранда [22, 94] и значительное снижение концентрации фактора XIII [87]. Концентрация факторов II, X и V, как правило, остается в пределах нормальных значений [94]. Информация об изменении концентрации фактора XI крайне противоречива [29, 47, 94]. Важно также отметить значительное (более чем в полтора раза) повышение плазменной концентрации фибриногена, обычно наблюдаемое в третьем триместре беременности (табл. 1) [22, 31, 46, 47, 94].
Для предотвращения неконтролируемого свертывания в крови присутствует целый ряд ингибиторов (на сегодняшний день их известно больше десяти). Некоторые из них специфичны к определенным факторам свертывания, а другие могут подавлять активность практически любого фактора [102]. Основными считаются антитромбин, который может ингибировать практически все основные протеазы свертывания, и ингибитор пути тканевого фактора (TFPI), который специализируется на подавлении активности фактора VIIa [33] (рис. 1). Также существует система реакций пути протеина С, запускаемая тромбином и регулируемая кофакторами (протеином S, эндотелиальным рецептором протеина С и тромбомодулином), которая направлена на деградацию кофакторов Va и VIIIa [30]. Как правило, во время беременности наблюдается снижение концентрации большинства ингибиторов свертывания. Так, известно, что уровень антитромбина снижен во время всего периода беременности и в течение нескольких недель после родов [15, 94]. Концентрации протеина C и общего протеина S, как правило, при беременности значимо не меняются, однако отмечается снижение уровня свободного протеина S и его активности [28, 34, 94].
Система фибринолиза призвана разрушать фибриновый сгусток, образующийся в результате свертывания крови. При повреждении сосуда из тканей выходит тканевый активатор плазминогена (t-PA) – основной активатор процесса лизиса сгустка (рис. 1). Помимо него, в крови постоянно присутствует урокиназный активатор плазминогена (u-PA) – другой активатор лизиса [1]. Активаторы лизиса способны активировать плазминоген до плазмина напрямую, однако при связывании тканевого активатора плазминогена с фибрином скорость активации плазминогена возрастает на несколько порядков [78]. Связываясь с фибриновой сетью, плазмин начинает постепенно отрезать от нее кусочки, что приводит к растворению сгустка. Также существуют естественные ингибиторы плазмина (антиплазмин, альфа-2 макроглобулин), ингибиторы активаторов плазминогена (PAI-1, PAI-2), а также тромбин-активируемый ингибитор фибринолиза (TAFI), который модифицирует сайты связывания фибрина с t-PA и плазминогеном, снижая скорость активации плазмина и ухудшая растворение сгустка [12].
Влияние беременности на систему фибринолиза до конца не изучено. Так, ранее было показано, что плазменные концентрации плазминогена, тканевого активатора плазминогена (t-PA) и активатора плазминогена урокиназного типа (u-PA) увеличиваются на протяжении всей беременности [16, 47, 103], в то время как активность t-PA, напротив, заметно снижается [103]. Также происходит увеличение в несколько раз уровней обоих ингибиторов активаторов плазминогена (PAI-1 и PAI-2) [16, 47]. Уровни альфа-2 макроглобулина и TAFI во время беременности преимущественно не изменяются [67].
По сравнению с системой плазменного гемостаза, изменения в системе сосудисто-тромбоцитарного гемостаза при беременности изучены значительно хуже. Тромбоциты производятся в костном мозге из мегакариоцитов под действием вырабатываемого печенью тромбопоэтина, циркулируют в кровотоке около одной недели и в конце концов элиминируются макрофагами печени и селезенки. В ходе циркуляции тромбоциты могут активироваться при контакте с внесосудистыми или межклеточными тканями, содержащими коллагены, фибронектины и ламинины, а также в местах воспаления [6, 61]. При краткосрочном контакте тромбоциты переходят в так называемое предактивированное состояние, в котором их способность образовывать тромбы может быть как повышена, так и снижена; в любом случае, время жизни предактивированного тромбоцита резко сокращается [63].
Известно, что беременность нередко сопровождается умеренной тромбоцитопенией [73]. Тем не менее, гестационная тромбоцитопения не приводит к серьезным кровотечениям в отсутствие каких-либо иных предпосылок, и ее значение при беременности на сегодняшний день до конца не ясно [18]. Одним из механизмов предотвращения кровотечений может быть предактивация тромбоцитов, однако данные о функциональности тромбоцитов при беременности довольно противоречивы. В ряде работ было продемонстрировано снижение концентрации цАМФ в покоящихся тромбоцитах (в тромбоците циклические нуклеотиды выполняют роль ингибиторов активации [62]) и повышение мобилизации кальция в ответ на активацию тромбоцитов при беременности [23, 88], однако, в других исследованиях было показано, что эти показатели при беременности остаются нормальными или даже могут изменяться в обратную сторону [38, 96].
СТРОЕНИЕ ПЛАЦЕНТЫ И ЕЕ БИОЛОГИЧЕСКАЯ РОЛЬ
Основные процессы, приводящие к изменению системы гемостаза при беременности, происходят на уровне плаценты. Плацента – это высокоспециализированный орган, основными функциями которого являются защита плода от инфекционных агентов и иммунного ответа матери, питание плода (газообмен, транспорт различных соединений), а также секреция некоторых гормонов и других биологически активных веществ, участвующих в регуляции роста и развития плода, течения беременности и родов [39]. Зрелая плацента представляет собой диск, состоящий из хорионической пластинки, обращённой к плоду, и базальной пластинки, обращённой к эндометрию матки [27].
Плацента состоит из древовидных структур, называемых ворсинами (рис. 2). Свободные ворсины омываются циркулирующей материнской кровью и обеспечивают обмен газов и питательных веществ между матерью и плодом. Заякоренные ворсины также взаимодействуют с децидуальной оболочкой, обеспечивая этим прикрепление плаценты к стенке матки [39].
Рис. 2.
Механизм ремоделирования спиральных артерий. 1 – в первую стадию ремоделирования происходит набухание и дезорганизация гладкомышечных клеток мышечного слоя артериальной стенки, вакуолизация эндотелия. 2 – вторая стадия включает миграцию клеток вневорсинчатого трофобласта и постепенное превращение их в клетки эндоваскулярного трофобласта. 3 – в третью стадию происходит синтез фибриноида фибринового типа интрамуральными трофобластами. 4 – в четвертой стадии происходит реэндотелизация сосуда.

Наружная оболочка отдельных ворсин, контактирующих с материнской кровью, состоит из одного слоя многоядерного синцитиотрофобласта. Рост синцитиотрофобласта происходит за счет слияния мононуклеарных клеток-предшественников с дифференцированными клетками вследствие выхода их из клеточного цикла, формирования щелевых контактов и выставления на мембране фосфатидилсерина (ФС) [79, 100]. В результате образуется сильно поляризованный эпителий, плотно покрытый микроворсинками с апикальной стороны. В основании каждой микроворсинки находится ямка, покрытая изнутри клатрином и способная к инвагинации и образованию транспортных везикул [69]. Эти особенности строения обеспечивают ключевые функции синцитиотрофобласта: транспорт питательных веществ и предотвращение вертикальной передачи патогенов [39, 79].
Большая часть обменных процессов между организмом матери и плодом происходит в терминальных отделах заякоренных ворсин [39]. Они содержат клетки вневорсинчатого трофобласта, которые прикрепляют плаценту к стенке матки, ремоделируют маточные кровеносные сосуды, обеспечивая тем самым приток крови к плоду [52]. Эти клетки способны к миграции в децидуальную оболочку и миометрий, где они дифференцируются в интерстициальные или эндоваскулярные формы [74, 104]. Интерстициальные трофобласты внедряются в фибриноидный слой, способствуют дезорганизации стромальных и периваскулярных тканей и ремоделированию спиральных артерий [72]. В результате ремоделирования спиральные артерии превращаются в сосуды большего диаметра с низким гемодинамическим сопротивлением (рис. 2) [83].
Во время беременности ворсины хориона омываются материнской кровью, что обеспечивает трофику плаценты и плода. Так как ворсины являются достаточно хрупкими структурами, контакт их с кровью матери должен осуществляться при оптимальных скорости кровотока и давлении в спиральных артериях [24]. Увеличение диаметра спиральных артерий и связанное с ним снижение гемодинамического сопротивления (рис. 3) наряду со снижением вязкости крови за счет увеличения объема плазмы [90] являются необходимыми для адекватной перфузии плаценты [45].
Рис. 3.
Изменение параметров кровотока в спиральной артерии на различных участках сосуда в зависимости от радиуса. (а) Изменение давления между нерасширенным начальным и расширенным терминальным участками спиральной артерии. (б) Зависимость скорости потока крови на выходе из артерии (сплошные линии) от радиуса артерии, зависимость числа Рейнольдса (пунктирные линии) от радиуса артерии. Верхние кривые соответствуют вязкости 3 Мпа с, а нижние кривые – вязкости 6 Мпа с, что соответствует измерениям вязкости крови в конце беременности. Данные получены методом математического моделирования (из работы Burton et al. [24]).
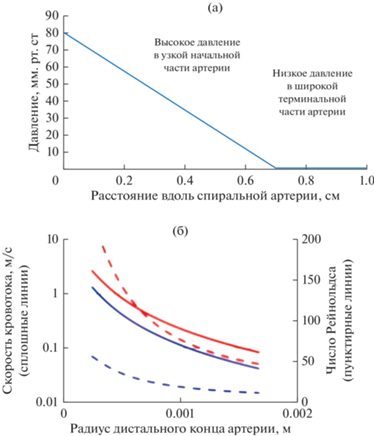
Расширение дистального сегмента спиральных артерий при физиологической беременности приводит к уменьшению скорости поступающей крови, а остаточный импульс переносит кровь в центральную полость дольки, откуда она равномерно распределяется по ворсинчатому дереву. Время прохождения крови до маточной вены оценивается примерно в 25–30 с, что обеспечивает достаточное время для обмена кислородом (рис. 4а) [24]. Описанный механизм позволяет поддерживать оптимальные реологические условия в плаценте и способствует адекватной перфузии плода при физиологической беременности.
Рис. 4.
Влияние перестройки спиральной артерии на приток материнской крови в межворсинчатое пространство и на архитектуру дольки, предсказанную с помощью компьютерного моделирования. (а) – Нормальное ремоделирование и адекватная перфузия плаценты при физиологической беременности. (б) – Нарушенное ремоделирование и недостаточная перфузия плаценты при преэклампсии (из работы Burton et al. [24]). Сокращения: ГМК – гладкомышечные клетки, ЦП – центральная полость, ЭКП – эхогенные кистозные поражения.

При некоторых патологиях беременности, в частности при преэклампсии, нередко наблюдается нарушение перестройки спиральных артерий [24]. В связи с этим материнская кровь поступает в межворсинчатое пространство с более высокой скоростью. Кроме того, высокое число Рейнольдса свидетельствует о наличии турбулентных потоков крови, которые могут разрывать закрепляющие ворсинки и вытеснять другие, образуя эхогенные кистозные поражения, выстланные тромботическими массами [77]. Время прохождения крови по межворсинчатому пространству сокращается, в результате чего нарушается кислородный обмен. Сохранение гладкомышечных клеток вокруг спиральной артерии дополнительно увеличивает риск сужения сосудов и ишемии плаценты (рис. 4б) [24]. Эти наблюдения подчеркивают важность физиологического ремоделирования сосудов для нормального протекания беременности.
МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ КЛЕТОК ТРОФОБЛАСТА С КОМПОНЕНТАМИ СИСТЕМЫ ГЕМОСТАЗА
Как было описано ранее, при беременности повышается концентрация большинства факторов свертывания и снижается концентрация ингибиторов, что, по-видимому, индуцируется эстрогенами и отчасти может быть связано с плацентой, особенно на поздних сроках [17]. Маккей [64] был первым исследователем, выдвинувшим гипотезу, согласно которой плацента при беременности оказывает на систему гемостаза воздействие, аналогичное феномену Казабаха–Мерритт. Этот феномен наблюдается при некоторых детских сосудистых опухолях и характеризуется низким количеством тромбоцитов, снижением концентраций факторов свертывания и фибриногена [50]. Людвиг [60] опубликовал снимки плаценты с помощью сканирующего электронного микроскопа, подтверждающие гипотезу Маккея. Согласно этой гипотезе, постоянное низкое потребление факторов свертывания стимулирует более интенсивный синтез факторов свертывания.
Существуют также данные о непосредственном влиянии трофобласта на систему свертывания. Децидуализированные стромальные клетки эндометрия человека способствуют предотвращению кровотечения во время инвазии трофобласта, поскольку экспрессируют на своей поверхности ТФ (рис. 1) [59]. Исследования in vivo и in vitro продемонстрировали, что экспрессия ТФ на таких клетках усиливается эстрадиолом (E2) во время децидуализации, индуцированной прогестинами [58]. Также плацента оказывает влияние на плазменное звено свертывания путем образования прокоагулянтных везикул. Было показано, что прокоагулянтные молекулы, такие как ТФ и ФС, присутствуют на поверхности микровезикул, образованных из клеток сцинтиотрофобласта, и могут вызывать системную гиперкоагуляцию [37].
Показано, что в ремоделировании спиральных артерий принимает участие не только вневорсинчатый трофобласт, но и клетки крови. Так, известно, что тромбоциты участвуют в синтезе фибриноида фибринового типа, локализующегося на поверхности ворсин хориона [66]. Перивиллярный фибриноид – важный компонент нормальной плаценты, который участвует в регуляции межворсинчатой гемодинамики, а также играет роль в правильном формировании ворсин (рис. 2) [13]. В литературе описано несколько механизмов образования перивиллярного фибриноида. Первый связан с нарушениями гемореологии, а именно появлением стаза и турбулентных потоков крови в артериях плаценты, активации тромбоцитов и формированием периворсинчатых агрегатов и фибриновых депозитов [41]. Второй механизм связан с дегенерацией синцитиотрофобласта, обнажением компонентов внеклеточного матрикса базальной мембраны и последующей активацией тромбоцитов и факторов свертывания [66].
Контакт тромбоцитов матери с клетками трофобласта во многом может объяснить особенности гемостаза при беременности. Известно, что клетки вневорсинчатного трофобласта продуцируют коллаген IV и фибронектин [52]. Ранее было показано, что при беременности тромбоциты в просвете спиральных артерий преимущественно локализуются вблизи именно этих клеток и могут активироваться продуцируемыми компонентами внеклеточного матрикса (рис. 5). Так, в плаценте зафиксировано наличие активированных (содержащих P-селектин – маркер секреции гранул) тромбоцитов, находящихся в прямом контакте с клетками трофобласта (рис. 6) [36]. Примечательно, что у небеременных женщин в секреторную фазу менструального цикла в спиральных артериях тромбоциты не обнаруживаются [82].
Рис. 5.
Взаимодействия между клетками трофобласта и тромбоцитами. Клетки трофобласта и тромбоциты находятся в тесной связи и оказывают взаимное воздействие друг на друга. Клетки трофобласта способны активировать тромбоциты путем секреции различных соединений, таких как коллаген, фибронектин и др. Тромбоциты, в свою очередь, оказывают влияние на клетки трофобласта, например, путем синтеза лигандов рецептора CCR1, приводящего к активации инфламмасом клеток трофобластов.
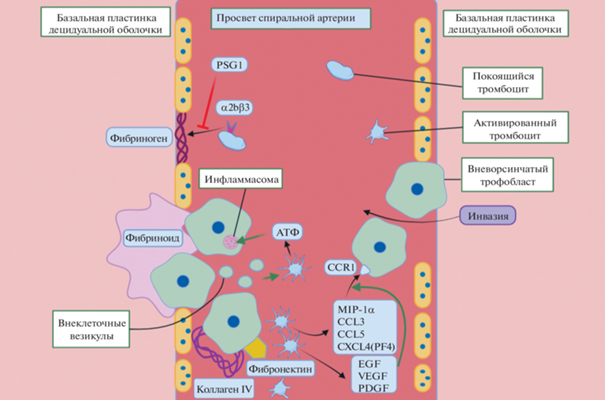
Рис. 6.
Взаимодействие материнских тромбоцитов с трофобластом в первом триместре беременности. (а) Схема прикрепления ворсинок в первом триместре, красным показано расположение материнских тромбоцитов. (б, в) Иммуногистохимический анализ расположения тромбоцитов (маркер CD42b, красный), скопление тромбоцитов в периворсинчатых отложениях фибрина (б) и между клетками вневорсинчатого трофобласта (в) показано открытой стрелкой. (г) Наличие тромбоцитов между клетками вневорсинчатого трофобласта было дополнительно подтверждено с помощью трансмиссионной электронной микроскопии (тромбоциты показаны черной стрелкой). Масштаб на панелях (б) и (в) составляет 50 мкм. Масштаб на панели (г) – 1 мкм. EVT: вневорсинчатый трофобласт; IVS: межворсинчатое пространство; CТ: цитотрофобласт; SCT: синцитиотрофобласт; SА: спиральная артерия. Воспроизведено из работы [36].

Активация тромбоцитов также может происходить под действием внеклеточных везикул, секретируемых клетками вневорсинчатого трофобласта. Так, было показано, что микровезикулы вневорсинчатого трофобласта провоцируют высвобождение содержимого гранул тромбоцитов, в частности АТФ (рис. 5) [53]. С одной стороны, это вызывает рекрутирование других тромбоцитов в место контакта с их последующей активацией, а с другой – активацию пуринергических сигнальных путей в клетках трофобласта и сборку в них сложных комплексов белков внутриклеточной сигнализации – инфламмасом, запускающих активацию клетки по провоспалительному пути. В мышиной модели было показано, что описанный механизм модуляции инфламмасом плацентарными тромбоцитами играет ключевую роль в развитии преэклампсии – частого осложнения беременности, которое характеризуется повышением артериального давления и протеинурией [53].
Известно, что тромбоциты, находящиеся в межворсинчатом пространстве, способны секретировать ряд соединений, влияющих на дифференцировку клеток трофобласта и развитие плаценты (рис. 5) [36, 40]. Показано, что при активации тромбоциты секретируют ряд хемокинов, в частности тромбоцитарный фактор 4 (PF4) и CC-хемокин 5 (ССL5), воспалительный белок макрофагов 1α (MIP-1α, или CCL5) [20]. Эти хемокины могут усиливать инвазию клеток трофобласта путем активации специфических хемокиновых рецепторов [81]. Особый интерес представляет тромбоцитарный фактор 4 (PF4). Кроме роли в качестве хемоаттрактанта, PF4 способен связываться и блокировать гепаран-сульфат на поверхности здорового эндотелия, тем самым ингибируя активность антитромбина и оказывая локальное прокоагулянтное действие [56]. В недавнем исследовании было показано, что повышение концентрации PF4 в плазме крови до и во время беременности ассоциировано с высоким риском осложнений в III триместре беременности, в частности преэклампсии [95].
Инвазия клеток трофобласта также может усиливаться и другими факторами, секретируемыми тромбоцитами при активации: эпидермальным фактором роста (EGF), фактором роста эндотелия сосудов (VEGF), тромбоцитарным фактором роста (PDGF) (рис. 5) [81]. Эти факторы тромбоцитарного происхождения приводят к активации Smad3 в клетках трофобласта и усилению продукции ими ингибитора активатора плазминогена 1 (PAI-1), ключевого ингибитора t-PA и u-PA (рис. 1) [35]. Кроме того, под действием факторов тромбоцитарного происхождения происходит снижение выработки клетками трофобласта β-субъединицы хорионического гонадотропина человека (β-ХГЧ) – одного из основных гормонов, отвечающих за поддержание беременности [35]. Снижение концентрации β-ХГЧ в крови отмечается в норме в III триместре, однако его низкий уровень на более ранних сроках может быть признаком серьезных нарушений беременности со стороны матери или плода [54].
Во время беременности в организме матери синтезируется ряд веществ, специфичных для данного состояния. В частности, к ним относится группа трофобластических гликопротеинов (PSGs), которые экспрессируются клетками цито- и синцитиотрофобласта и обладают иммуносупрессивными свойствами. Известно, что PSG повышают экспрессию гликопротеина цитотоксических Т-лимфоцитов 4 (CTLA-4), глюкокортикоид-индуцированного белка, связанного с рецептором фактора некроза опухолей (GITR) регуляторными Т-лимфоцитами и секрецию интерлейкина 10 (IL-10) моноцитами и макрофагами, тем самым участвуя в обеспечении иммунной толерантности при беременности [91]. Кроме того, было показано, что трофобластический гликопротеин 1 (PSG1), в отличие от остальных гликопротеинов этого семейства, имеет специфический KGD-мотив, обнаруженный ранее в барбурине – одном из компонентов змеиного яда, специфическом ингибиторе тромбоцитарного гликопротеина GPIIb/IIIa, и ингибирует связывание GPIIb/IIIa с фибриногеном in vitro [86]. Это свойство трофобластического гликопротеина 1 может играть определенную роль в регуляции агрегации тромбоцитов в протробротических условиях, наблюдаемых при беременности.
МЕХАНИЗМЫ НАРУШЕНИЯ СИСТЕМЫ ГЕМОСТАЗА ПРИ НЕКОТОРЫХ ОСЛОЖНЕНИЯХ БЕРЕМЕННОСТИ
Гестационная тромбоцитопения
Тромбоцитопения является часто наблюдаемым состоянием при беременности. Обычно она развивается в III триместре беременности. В одном из недавних исследований было показано, что концентрация тромбоцитов в крови при неосложненной беременности начинает снижаться еще в I триместре, в то время как к моменту родоразрешения у примерно 10% женщин она составляет менее 150 тыс./мкл [76].
Патогенез гестационной тромбоцитопении на сегодняшний день неясен, однако наиболее вероятным представляется иммуно-опосредованное разрушение тромбоцитов [106]. В отличие от классической идиопатической тромбоцитопенической пурпуры (ИТП), гестационная тромбоцитопения протекает значительно легче, чаще всего бессимптомно, и не требует какого-либо специфического лечения [18]. После рождения ребенка количество тромбоцитов восстанавливается довольно быстро, как правило, в течение первого месяца после родов. Важно подчеркнуть, что наличие гестационной тромбоцитопении у матери не связано с повышенным риском врожденной тромбоцитопении у ребенка [18].
Преэклампсия
Другим осложнением беременности является преэклампсия, которая наблюдается у 3–7% беременных в третьем триместре [18]. Преэклампсия включает классическую триаду: повышение систолического артериального давления ≥140 мм рт. ст. и/или диастолического артериального давления ≥90 мм рт. ст., наличие протеинурии и отеков [9, 75]. В ряде (15%) случаев преэклампсия сопровождается тромбоцитопенией. Важно отметить, что, как правило, все симптомы преэклампсии проходят после родоразрешения. Тем не менее, редко они могут сохраняться и после родов или даже манифестировать сразу после них. В случае персистенции симптомов после родоразрешения, особенно в случае тромбоцитопении, требуется дифференциальная диагностика между преэклампсией и тромботической тромбоцитопенической пурпурой (ТТП) и гемолитико-уремическим синдромом (ГУС), которая порой бывает весьма затруднительна [106].
Патогенез преэклампсии до конца неясен. Принято считать, что в ее основе лежат нарушение перестройки спиральных артерий (рис. 4б) и связанная с этим тканевая гипоксия [71]. Гипоксия оказывает важное влияние на дифференцировку клеток трофобласта и в норме наблюдается лишь на ранних этапах формирования плаценты [48]. На более поздних сроках гипоксия оказывает негативное воздействие на плаценту. В условиях гипоксии значительно снижается экспрессия генов-регуляторов клеточного цикла (например, p21), что приводит к снижению синтеза синдекана-1 [93], синцитина-2, хорионического гонадотропина и, в результате, нарушению слияния клеток и формирования синцитиотрофобласта [55].
Известно, что клетки трофобласта активно экспрессируют тромбомодулин и секретируют урокиназу, которые, как принято считать, играют ключевую роль в плазмин-опосредованной клеточной инвазии [105]. Показано, что при эклампсии способность клеток трофобласта секретировать урокиназу значительно снижена, вследствие чего нарушена их способность к инвазии и перестройке спиральных артерий, а также повышено внутриплацентарное тромбообразование [81]. Нарушение плацентарного кровотока вследствие этих причин может быть ключевым механизмом тканевой гипоксии и последующего развития преэклампсии.
Не последнюю роль в патогенезе преэклампсии играют и механизмы тромбовоспаления, которые связаны с повышенным образованием внеклеточных везикул клетками трофобласта, их секрецией и последующей активацией тромбоцитов. Высвобождение активированными тромбоцитами АТФ вызывает сборку инфламмасом в клетках трофобласта, запуск механизмов стерильного воспаления в плаценте и развитие преэклампсии в мышиной модели [53].
Синдром HELLP
Синдром HELLP (H – Hemolysis, EL – Elevated Liver enzymes, LP – Low Platelets) – редкое (0.5%) осложнение беременности, которое характеризуется гемолизом, повышением уровней печеночных трансаминаз и глубокой тромбоцитопенией. Исторически данный синдром классифицировался как осложнение или прогрессирование тяжелой преэклампсии. Однако на сегодняшний день принято считать, что данный синдром имеет свою собственную этиологию [43, 49]. В 15% случаев при HELLP-синдроме наблюдается клиника синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдрома).
Точный механизм HELLP-синдрома не известен. Тем не менее, его частая (до 20%) связь с преждевременной отслойкой нормально расположенной плаценты (ПОНРП) [32] позволяет предположить, что это состояние может быть одним из триггерных механизмов HELLP-синдрома [43]. При ПОНРП происходит отрыв плаценты от подлежащей децидуальной оболочки, приводящий к массивному высвобождению в системный кровоток тканевого фактора из поврежденных спиральных артерий, децидуальной ткани и трофобласта с последующей генерацией тромбина [68]. По мере прогрессирования отслойки увеличивается местное потребление факторов свертывания, особенно факторов VII, X, протромбина, фактора V и фибриногена, что в конечном счете приводит к микротромбозам, полиорганной недостаточности и развитию жизнеугрожающих кровотечений [19].
Тромбоцитопения является основным и самым ранним нарушением системы гемостаза при HELLP-синдроме, и, вероятнее всего, она вторична по отношению к активации системы плазменного свертывания и обусловлена сильной активацией тромбоцитов за счет образования тромбина [89].
Повреждение печени – один из отличительных признаков HELLP-синдрома. Механизмы повышения печеночных трансаминаз при беременности неизвестны, однако Strand и др. показали, что выделенный из ткани плаценты гликопротеин CD95 (APO-1, Fas) способен вызывать повреждение гепатоцитов и запускать их апоптоз [92]. Повреждение печени может приводить к снижению выработки фибриногена и факторов свертывания.
Патогенез гемолиза при HELLP-синдроме, вероятнее всего, обусловлен микроангиопатической гемолитической анемией, которая связана с разрушением эритроцитов при прохождении через частично закупоренные микрососуды [43]. Тем не менее, точные причины гемолиза при этом состоянии до конца не известны.
ЗАКЛЮЧЕНИЕ
В этой работе были подробно рассмотрены основные изменения, происходящие в системе гемостаза в различных периодах физиологической беременности и при некоторых ее осложнениях.
Беременность является прокоагулянтным состоянием, что подтверждается изменением показателей общепринятых тестов гемостаза. При этом при беременности наблюдается как повышение концентраций факторов свертывания, так и снижение концентрации и активности ингибиторов свертывания. Частично эти изменения можно объяснить наблюдаемым при беременности разбавлением плазмы крови, частично – гормональными изменениями и общей перестройкой организма женщины, однако, возможно, наибольшее влияние оказывает место взаимодействия тканей матери и плода – плацента.
Функциональная активность тромбоцитов при беременности изучена хуже, и данные о состоянии тромбоцитов у беременных противоречивы. Так, ряд авторов сообщает о существовании предактивации тромбоцитов, которая может рассматриваться как один из возможных механизмов предотвращения кровотечений, однако в других работах описано отсутствие значимых изменений функциональности тромбоцитов при беременности.
Механизмы изменений плазменного и тромбоцитарного гемостаза при беременности прежде всего связаны с тонкими взаимодействиями, происходящими на уровне плаценты. Так, предложено несколько возможных механизмов активации системы гемостаза: экспрессия ТФ клетками трофобласта и везикулами плацентарного происхождения, изменение реологии крови при перестройке спиральных артерий, обнажение компонентов внеклеточного матрикса при дегенерации клеток синцитиотрофобласта, продукция коллагена IV типа и фибронектина клетками вневорсинчатного трофобласта. В то же время, при беременности наблюдается и физиологическое подавление агрегации тромбоцитов белком PSG1, продуцируемым клетками трофобласта и являющегося ингибитором основного тромбоцитарного интегрина αIIbβ3.
С одной стороны, общие изменения системы гемостаза в сторону прокоагулянтного и, соответственно, протромботического состояния необходимы для предупреждения кровотечений при беременности и после родов, с другой – сами по себе они могут стать причиной серьезных осложнений. К сожалению, несмотря на успехи современной физиологии и медицины, ряд осложнений беременности со стороны системы гемостаза до сих пор сопровождается высокой смертностью. Необходимо более детальное изучение патогенетических механизмов этих состояний для разработки эффективных подходов к их предотвращению и определения оптимальной тактики лечения.
Список литературы
Жалялов А.С. и др. Современные представления о системе фибринолиза и методах диагностики ее нарушений // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2017. № 1(16). С. 69–82.
Коваленко Т.А., Пантелеев М.А., Свешникова А.Н. Механизмы и кинетика активации свертывания крови комплексом внешней теназы // Биофизика. 2017. № 2(62). С. 291–300.
Пантелеев М.А., Свешникова А.Н. Тромбоциты и гемостаз // Онкогематология. 2014. № 2. С. 65–73.
Пантелеев М., Атауллаханов Ф. Свертывание крови: биохимические основы // Клиническая онкогематология. 2008. № 1 (1). С. 50–62.
Подоплелова Н.А. и др. Регуляция мембранно-зависимых реакций свертывания крови // Успехи физиологических наук. 2015. № 4(46). С. 3–14.
Свешникова А.Н. и др. Роль трансмембранных гликопротеинов, интегринов и серпентинов в адгезии и активации тромбоцита // Биологические мембраны. 2018.
Abu-Raya B. et al. Maternal Immunological Adaptation During Normal Pregnancy // Frontiers in Immunology. 2020. № 11. C. 575197.
Agarwala R., Millar C.M., Campbell J.P. Haemostatic disorders in pregnancy // BJA Education. 2020. № 5(20). C. 150–157.
Amaral L.M. et al. Pathophysiology and Current Clinical Management of Preeclampsia // Current Hypertension Reports. 2017. № 8(19). C. 61.
Ataullakhanov F.I. et al. Classic and Global Hemostasis Testing in Pregnancy and during Pregnancy Complications // Seminars in Thrombosis and Hemostasis. 2016. № 7(42). C. 696–716.
Bainbridge D.R.J. The evolution of pregnancy // Early Human Development. 2014. № 11(90). C. 741–745.
Bajzar L., Manuel R., Nesheim M. E. Purification and Characterization of TAFI, a Thrombin-activable Fibrinolysis Inhibitor // J. Biological Chemistry. 1995. № 24(270). C. 14477–14484.
Bane A.L., Gillan J.E. Massive perivillous fibrinoid causing recurrent placental failure // BJOG: An International J. Obstetrics and Gynaecology. 2003. № 3(110). C. 292–295.
Beckert R.H. et al. Maternal anemia and pregnancy outcomes: a population-based study // J. Perinatology. 2019. № 7(39). C. 911–919.
Bellart J. et al. Endothelial Cell Markers and Fibrinopeptide A to D-Dimer Ratio as a Measure of Coagulation and Fibrinolysis Balance in Normal Pregnancy // Gynecologic and Obstetric Investigation. 1998. № 1(46). C. 17–21.
Bellart J. et al. Coagulation and Fibrinolysis Parameters in Normal Pregnancy and in Gestational Diabetes // American J. Perinatology. 1998. № 08(15). C. 479–486.
Beller F.K., Ebert C. The coagulation and fibrinolytic enzyme system in pregnancy and in the puerperium // European J. Obstetrics & Gynecology and Reproductive Biology. 1982. № 3(13). C. 177–197.
Bergmann F., Rath W. The Differential Diagnosis of Thrombocytopenia in Pregnancy // Dtsch Arztebl International. 2015. № 47(112). C. 795–802.
Bick R.L. Syndromes of disseminated intravascular coagulation in obstetrics, pregnancy, and gynecology. Objective criteria for diagnosis and management // Hematology/Oncology Clinics of North America. 2000. № 5(14). C. 999–1044.
Blaschitz A. et al. Adhering maternal platelets can contribute to the cytokine and chemokine cocktail released by human first trimester villous placenta // Placenta. 2015. № 11(36). C. 1333–1336.
Bravo M.C. et al. Hemostatic Activation and Glycocalyx Shedding during Pregnancy // Blood. 2018. № 132. C. 3794.
Brenner B. Haemostatic changes in pregnancy // Thrombosis Research. 2004. № 5–6(114). C. 409–414.
Burke N. et al. Platelet reactivity changes significantly throughout all trimesters of pregnancy compared with the nonpregnant state: a prospective study // BJOG: An International J. Obstetrics & Gynaecology. 2013. № 13(120). C. 1599–1604.
Burton G.J. et al. Rheological and Physiological Consequences of Conversion of the Maternal Spiral Arteries for Uteroplacental Blood Flow during Human Pregnancy // Placenta. 2009. № 6(30). C. 473–482.
Burton G.J. et al. Rheological and Physiological Consequences of Conversion of the Maternal Spiral Arteries for Uteroplacental Blood Flow during Human Pregnancy // Placenta. 2009. № 6(30). C. 473–482.
Burton G.J., Fowden A.L. The placenta: a multifaceted, transient organ // Philosophical Transactions of the Royal Society B: Biological Sciences. 2015. № 1663 (370). C. 20140066.
Bushway M. E. et al. Morphological and Phenotypic Analyses of the Human Placenta Using Whole Mount Immunofluorescence1 // Biology of Reproduction. 2014. № 5(90). C. 110, 1–10.
Clark P. Changes of Hemostasis Variables during Pregnancy // Seminars in Vascular Medicine. 2003. № 1(03). C. 013–024.
Condie R.G. A serial study of coagulation factors XII, XI and X in plasma in normal pregnancy and in pregnancy complicated by pre-eclampsia // BJOG: An International Journal of Obstetrics and Gynaecology. 1976. № 8(83). C. 636–639.
Dahlbäck B., Villoutreix B.O. Regulation of Blood Coagulation by the Protein C Anticoagulant Pathway: Novel Insights Into Structure-Function Relationships and Molecular Recognition // Arteriosclerosis, Thrombosis, and Vascular Biology. 2005. № 7(25). C. 1311–1320.
Della Rocca G. et al. Coagulation assessment in normal pregnancy: thrombelastography with citrated non activated samples // Minerva Anestesiol. 2012. № 12(78). C. 1357–1364.
Dibaba B. et al. Risk Factors of Antepartum Hemorrhage Among Mothers Who Gave Birth at Suhul General Hospital, 2016: A Case–Control Study // J. Multidisciplinary Healthcare. 2021. V. 14. C. 271–278.
Ersdal-Badju E. et al. Identification of the Antithrombin III Heparin Binding Site // J. Biological Chemistry. 1997. № 31(272). C. 19393–19400.
Faught W. et al. Changes in protein C and protein S levels in normal pregnancy // American J. Obstetrics and Gynecology. 1995. № 1(172). C. 147–150.
Forstner D. et al. Platelet-derived factors impair placental chorionic gonadotropin beta-subunit synthesis // J. Molecular Medicine. 2020. № 2(98). C. 193–207.
Forstner D., Guettler J., Gauster M. Changes in Maternal Platelet Physiology during Gestation and Their Interaction with Trophoblasts // International J. Molecular Sciences. 2021. № 19(22).
Gardiner C. et al. Syncytiotrophoblast Microvesicles Released from Pre-Eclampsia Placentae Exhibit Increased Tissue Factor Activity // PLoS ONE. 2011. № 10(6). C. e26313.
Gatti L.et al. Hemostatic parameters and platelet activation by flow-cytometry in normal pregnancy: a longitudinal study // International J. Clinical & Laboratory Research. 1994. № 4(24). C. 217–219.
Gude N.M. et al. Growth and function of the normal human placenta // Thrombosis Research. 2004. № 5–6(114). C. 397–407.
Guettler J. et al. Maternal platelets pass interstices of trophoblast columns and are not activated by HLA-G in early human pregnancy // J. Reproductive Immunology. 2021. (144). C. 103280.
Guettler J., Forstner D., Gauster M. Maternal platelets at the first trimester maternal-placental interface – Small players with great impact on placenta development // Placenta. 2021. C. 14–34.
Gutiérrez García I. et al. D-dimer during pregnancy: establishing trimester-specific reference intervals // Scandinavian Journal of Clinical and Laboratory Investigation. 2018. № 6(78). C. 439–442.
Haram K. et al. Disseminated intravascular coagulation in the HELLP syndrome: how much do we really know? // The J. Maternal-Fetal & Neonatal Medicine. 2017. № 7(30). C. 779–788.
Hayashi M. et al. The levels of five markers of hemostasis and endothelial status at different stages of normotensive pregnancy: The levels of five markers during normal pregnancy // Acta Obstetricia et Gynecologica Scandinavica. 2002. № 3(81). C. 208–213.
Heilmann L. 7 Blood rheology and pregnancy // Blood Rheology and Hyperviscosity Syndromes. 1987. № 3(1). C. 777–799.
Hellgren M. Hemostasis during Normal Pregnancy and Puerperium // Seminars in Thrombosis and Hemostasis. 2003. № 2 (29). C. 125–130.
J. C., S. P. Tissue plasminogen activator levels change with plasma fibrinogen concentrations during pregnancy // Annals of Hematology. 2002. № 11(81). C. 611–615.
Jauniaux E. et al. In-vivo measurement of intrauterine gases and acid–base values early in human pregnancy // Human Reproduction. 1999. № 11(14). C. 2901–2904.
Kappler S., Ronan-Bentle S., Graham A. Thrombotic Microangiopathies (TTP, HUS, HELLP) // Emergency Medicine Clinics of North America. 2014. № 3(32). C. 649–671.
Khachatryan L.A. et al. Kaposiform hemangioendothelioma/Kasabach–Merritt syndrome. Clinical and laboratory characteristics. Analysis of clinical cases // Pediatric Hematology/Oncology and Immunopathology. 2021. № 3(20). C. 74–91.
Kline J.A., Williams G.W., Hernandez-Nino J. D-Dimer Concentrations in Normal Pregnancy: New Diagnostic Thresholds Are Needed // Clinical Chemistry. 2005. № 5(51). C. 825–829.
Knöfler M. et al. Human placenta and trophoblast development: key molecular mechanisms and model systems // Cellular and Molecular Life Sciences. 2019. № 18(76). C. 3479–3496.
Kohli S. et al. Maternal extracellular vesicles and platelets promote preeclampsia via inflammasome activation in trophoblasts // Blood. 2016. № 17(128). C. 2153–2164.
Korevaar T.I.M. et al. Reference ranges and determinants of total hCG levels during pregnancy: the Generation R Study // European J. Epidemiology. 2015. № 9(30). C. 1057–1066.
Kreis N.-N. et al. Functional Analysis of p21Cip1/CDKN1A and Its Family Members in Trophoblastic Cells of the Placenta and Its Roles in Preeclampsia // Cells. 2021. № 9(10).
Lasagni L. et al. An Alternatively Spliced Variant of CXCR3 Mediates the Inhibition of Endothelial Cell Growth Induced by IP-10, Mig, and I-TAC, and Acts as Functional Receptor for Platelet Factor 4 // J. Experimental Medicine. 2003. № 11(197). C. 1537–1549.
Lipets E.N., Ataullakhanov F.I., Panteleev M.A. Integrated laboratory coagulation tests in hypercoagulation diagnosis and thrombosis risk assessment. Part II. The sensitivity of integral tests to hypercoagulable states // Oncohematology. 2015. № 3(10). C. 78.
Lockwood C.J. et al. Progestin-epidermal growth factor regulation of tissue factor expression during decidualization of human endometrial stromal cells // The J. Clinical Endocrinology and Metabolism. 2000. № 1(85). C. 297–301.
Lockwood C.J. et al. Decidualized Human Endometrial Stromal Cells Mediate Hemostasis, Angiogenesis, and Abnormal Uterine Bleeding // Reproductive Sciences. 2009. № 2(16). C. 162–170.
Ludwig H. Surface structure of the human term placenta and of the uterine wall post partum in the screen scan electron microscope // American J. Obstetrics and Gynecology. 1971. № 3(111). C. 328–344.
Martyanov A.A. et al. Физиологические и патофизиологические аспекты активации тромбоцитов крови через рецептор CLEC-2 // Онкогематология. 2018. № 3(13). С. 43–50.
Martyanov A.A. et al. Programmed Cell Death and Functional Activity of Platelets in Case of Oncohematologic Diseases // Biochemistry (Moscow). 2020. № 10(85). C. 1267–1276.
Martyanov A., Panteleev M. Platelet functional responses and signalling: the molecular relationship. Part 2: receptors // Systems Biology and Physiology Reports. 2021. № 3(1). C. 13–30.
McKay D.G. Chronic intravascular coagulation in normal pregnancy and preeclampsia // Contributions to Nephrology. 1981. (25). C. 108–119.
Mor G., Cardenas I. The Immune System in Pregnancy: A Unique Complexity // American J. Reproductive Immunology. 2010. № 6(63). C. 425–433.
Moser G. et al. Maternal Platelets—Friend or Foe of the Human Placenta? // International J. Molecular Sciences. 2019. № 22(20).
Mousa H. et al. Thrombin activatable fibrinolysis inhibitor and its fibrinolytic effect in normal pregnancy // Thrombosis and Haemostasis. 2004. № 11(92). C. 1025–1031.
Nilsen P.A. The Mechanism of Hypofibrinogenæmia in Premature Separation of the Normally Implanted Placenta // Acta Obstetricia et Gynecologica Scandinavica. 1963. № s2 (42). C. 11–96.
Ockleford C.D., Whyte A. Differeniated regions of human placental cell surface associated with exchange of materials between maternal and foetal blood: coated vesicles // J. Cell Science. 1977. № 1(25). C. 293–312.
Pabinger I., Grafenhofer H. Thrombosis during pregnancy: risk factors, diagnosis and treatment // Pathophysiology of Haemostasis and Thrombosis. 2002. № 5–6(32). C. 322–324.
Phipps E.A. et al. Pre-eclampsia: pathogenesis, novel diagnostics and therapies // Nature Reviews Nephrology. 2019. № 5(15). C. 275–289.
Pijnenborg R., Vercruysse L., Hanssens M. The Uterine Spiral Arteries In Human Pregnancy: Facts and Controversies // Placenta. 2006. № 9(27). C. 939–958.
Pishko A.M., Levine L.D., Cines D.B. Thrombocytopenia in pregnancy: Diagnosis and approach to management // Blood Reviews. 2020. (40). C. 100638.
Pollheimer J. et al. Regulation of Placental Extravillous Trophoblasts by the Maternal Uterine Environment // Frontiers in Immunology. 2018. (9). C. 2597.
Poon L.C. et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention // International J. Gynecology & Obstetrics. 2019. № S1(145). C. 1–33.
Reese J.A. et al. Platelet Counts during Pregnancy // New England J. Medicine. 2018. № 1(379). C. 32–43.
Reynolds S.R.M. Formation of fetal cotyledons in the hemochorial placenta: A theoretical consideration of the functional implications of such an arrangement // American J. Obstetrics and Gynecology. 1966. № 3(94). C. 425–439.
Rijken D.C., Hoylaerts M., Collen D. Fibrinolytic properties of one-chain and two-chain human extrinsic (tissue-type) plasminogen activator // J. Biological Chemistry. 1982. № 6(257). C. 2920–2925.
Robbins J.R. et al. Placental Syncytiotrophoblast Constitutes a Major Barrier to Vertical Transmission of Listeria monocytogenes // PLOS Pathogens. 2010. № 1(6). C. e1000732.
Roth I. et al. Human placental cytotrophoblasts produce the immunosuppressive cytokine interleukin 10 // J. Experimental Medicine. 1996. № 2(184). C. 539–548.
Sato Y. et al. Platelet-derived soluble factors induce human extravillous trophoblast migration and differentiation: platelets are a possible regulator of trophoblast infiltration into maternal spiral arteries // Blood. 2005. № 2(106). C. 428–435.
Sato Y. et al. Endovascular trophoblast and spiral artery remodeling // Molecular and cellular endocrinology. 2020. № 503. С. 110699.
Sato Y., Fujiwara H., Konishi I. Role of platelets in placentation // Medical Molecular Morphology. 2010. № 3(43). C. 129–133.
Shah N.M. et al. Progesterone-Related Immune Modulation of Pregnancy and Labor // Frontiers in Endocrinology. 2019. № 10. C. 198.
Shahbazi M.N. Mechanisms of human embryo development: from cell fate to tissue shape and back // Development. 2020. № 14(147). C. dev190629.
Shanley D.K. et al. Pregnancy-Specific Glycoproteins Bind Integrin αIIbβ3 and Inhibit the Platelet—Fibrinogen Interaction // PLoS One. 2013. № 2(8). C. e57491.
Sharief L.T. et al. Changes in factor XIII level during pregnancy // Haemophilia. 2014. № 2(20). C. e144–e148.
Sheu J.-R. et al. Mechanisms involved in the antiplatelet activity of magnesium in human platelets: Antiplatelet Activity of Magnesium // British J. Haematology. 2002. № 4(119). C. 1033–1041.
Sibai B.M. et al. Maternal-perinatal outcome associated with the syndrome of hemolysis, elevated liver enzymes, and low platelets in severe preeclampsia-eclampsia // American J. Obstetrics and Gynecology. 1986. № 3(155). C. 501–507.
Sifakis S., Pharmakides G. Anemia in Pregnancy // Annals of the New York Academy of Sciences. 2006. № 1(900). C. 125–136.
Snyder S.K. et al. Pregnancy-Specific Glycoproteins Function as Immunomodulators by Inducing Secretion of IL-10, IL-6 and TGF-beta1 by Human Monocytes // American J. Reproductive Immunology. 2001. № 4(45). C. 205–216.
Strand S. et al. Placenta-derived CD95 ligand causes liver damage in hemolysis, elevated liver enzymes, and low platelet count syndrome // Gastroenterology. 2004. № 3(126). C. 849–858.
Szabo S. et al. Changes of placental syndecan-1 expression in preeclampsia and HELLP syndrome // Virchows Archiv. 2013. № 3(463). C. 445–458.
Szecsi P. et al. Haemostatic reference intervals in pregnancy // Thrombosis and Haemostasis. 2010. № 04(103). C. 718–727.
Theilen L.H. et al. Platelet activation and placenta-mediated adverse pregnancy outcomes: an ancillary study to the Effects of Aspirin in Gestation and Reproduction trial // American J. Obstetrics and Gynecology. 2020. № 5(223). C. 741.e1–741.e12.
Valéra M.-C. et al. Platelet Adhesion and Thrombus Formation in Whole Blood at Arterial Shear Rate at the End of Pregnancy // American J. Reproductive Immunology. 2015. № 6(74). C. 533–541.
Vos T. et al. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015 // The Lancet. 2016. № 10053(388). C. 1545–1602.
Weeks A. The prevention and treatment of postpartum haemorrhage: what do we know, and where do we go to next? // BJOG: An International J. Obstetrics & Gynaecology. 2015. № 2(122). C. 202–210.
West C.A., Beck S.D., Masilamani S.M.E. Time course of renal sodium transport in the pregnant rat // Current Research in Physiology. 2021. (4). C. 229–234.
Whitley G.S.J., Cartwright J.E. Trophoblast-mediated spiral artery remodelling: a role for apoptosis // J. Anatomy. 2009. № 1(215). C. 21–26.
Whyte I.M. et al. Acetaminophen Causes an Increased International Normalized Ratio by Reducing Functional Factor VII // Therapeutic Drug Monitoring. 2000. № 6 (22). C. 742–748.
Wood J.P. et al. Tissue factor pathway inhibitor-alpha inhibits prothrombinase during the initiation of blood coagulation // Proceedings of the National Academy of Sciences. 2013. № 44(110). C. 17838–17843.
Wright J.G. et al. Fibrinolysis during normal human pregnancy: complex inter-relationships between plasma levels of tissue plasminogen activator and inhibitors and the euglobulin clot lysis time // British J. Haematology. 1988. № 2(69). C. 253–258.
Zhou Y. et al. Vascular Endothelial Growth Factor Ligands and Receptors That Regulate Human Cytotrophoblast Survival Are Dysregulated in Severe Preeclampsia and Hemolysis, Elevated Liver Enzymes, and Low Platelets Syndrome // The American J. Pathology. 2002. № 4(160). C. 1405–1423.
Zini J.-M. et al. Characterization of Urokinase Receptor Expression by Human Placental Trophoblasts // Blood. 1992. №79(11). P. 2917–2929.
Williams hematology / Ed. by K. Kaushansky, Ninth edition. New York: McGraw-Hill, 2016. 2500 p.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


