Успехи физиологических наук, 2022, T. 53, № 2, стр. 39-53
Роль саркомерного белка титина в насосной функции сердца
В. И. Капелько *
Институт экспериментальной кардиологии, Национальный медицинский исследовательский центр кардиологии МЗ
121552 Москва, Россия
* E-mail: valk69@yandex.ru
Поступила в редакцию 20.03.2021
После доработки 02.06.2021
Принята к публикации 14.09.2021
- EDN: CMTEAB
- DOI: 10.31857/S0301179822020059
Аннотация
В обзоре рассмотрена история открытия саркомерного белка титина (коннектина), его участие в пассивном напряжении миокарда, роль в сократительной функции нормального сердца, при адаптации и патологии.
ВВЕДЕНИЕ
Представления о механике мышц были заложены А. Хиллом еще в 1918 г. Он охарактеризовал механическую модель мышцы в виде трех компонентов – сократительного, последовательного эластического и параллельного эластического. Предполагалось, что сократительный элемент свободно растяжим, упругий последовательный эластический элемент растягивается при развитии силы сократительным элементом, а при расслаблении мышцы этот же элемент вытягивает сократительный элемент до прежней длины. Параллельный эластический элемент берет на себя нагрузку в покое и тем самым определяет длину сократительного элемента.
Эти представления были полностью подтверждены для сердечной мышцы [67] и позже дополнены введением вязкостного компонента, который позволяет мышце постепенно приспосабливаться к новой длине. Параллельный эластический компонент в структуре сердечной мышцы более упругий, чем в скелетной мышце, это защищает ее от перерастяжения саркомеров, теоретически возможного при избыточном притоке крови к сердцу. Первоначально думали, что роль эластических компонентов выполняют эластиновые и коллагеновые белки, составляющие каркас внеклеточного матрикса. Они оплетают кардиомиоциты, образуя своеобразные футляры, где клетки не могут сместиться друг относительно друга, и стабилизируют структуру миокарда. Однако эластиновые белки растягиваются только при действии достаточно большой силы, а коллагеновые белки практически нерастяжимы.
Следовательно, растяжение волокон миокарда в физиологичном диапазоне внешней нагрузки должно происходить за счет параллельного эластического компонента, расположенного непосредственно в кардиомиоцитах, в частности, в саркомерах миофибрилл. Также наличие вязких свойств, характерных для миокарда, указывает на участие в этом компоненте неких белковых структур. Но помимо актиновых и миозиновых нитей, взаимодействие которых в ходе сокращения было открыто британскими учеными A. Huxley, H. Huxley и J. Hanson и получило название “теории скользящих нитей” (1954–1957), не было известно наличие других белков, которые могли бы выполнять функции последовательного и параллельного эластических компонентов.
В 1976 г. группа японских биохимиков во главе c Maruyama [56] идентифицировала крупный белок, локализованный в саркомерах преимущественно в диске I между диском A и линией Z. Он был назван коннектином, поскольку соединяет концы миозиновых волокон с границей саркомера и тем самым удерживает миозиновые нити в постоянном положении. Его масса составляла 18% от всех белков миокарда [57] и была в 3 раза больше, чем в скелетных мышцах. Вскоре группа из Техаса [78], применив другой метод, также выделила данный белок, но без упоминания о работе Maruyama, и назвала его “титин” по аналогии с греческим “титан” (громадный), поскольку его масса (более 3 МДа) делает его наибольшим белком в организме млекопитающих. Японские авторы показали идентичность обоих белков [58], что подчеркивает их приоритет, но в силу большей цитируемости в США название “титин” упоминалось чаще и превалирует в наше время, хотя роли этого белка конечно лучше отвечает термин “коннектин”.
КОННЕКТИН/ТИТИН – СТРУКТУРА И СВОЙСТВА
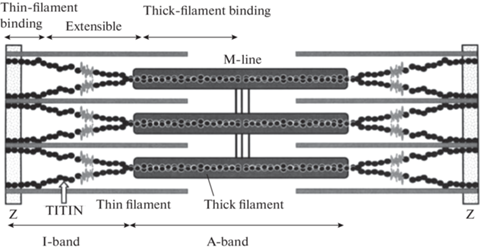
Коннектин/титин – это гигантский белок, самый большой из всех белков в теле млекопитающих. Его молекулярная масса в скелетных мышцах превышает 3 МДа, в сердечной мышце по разным данным его масса составляет от 2.5 МДа [30] до 3.5 МДа [51]. Основная часть этого белка локализована в диске I, т.е. в той структуре саркомера, которая подвергается удлинению при растяжении мышцы (рис. 1).
Рис. 1.
Место титина в структуре саркомера сердечной мышцы. И тонкие актиновые нити, и толстые миозиновые нити фиксированы к границам саркомера – линиям Z [26].
Структура титина была установлена в 1995 г. [47]. Белок разделен на 3 сегмента, причем два из них являются общими в скелетной и сердечной мышцах, но различаются по наличию третьего сегмента. Общие сегменты – это 1) последовательно соединенные иммуноглобулин-подобные домены (Ig сегменты) и 2) сегмент, состоящий из остатков пролина, глутамата, валина и лизина (PEVK). Третий сегмент в скелетной мышце N2A, а в сердечной мышце – оригинальный N2B и смешанный N2ВA сегменты. Примерная структура изоформ в миокарде показана на рис. 2 .
Рис. 2.
Структура и локализация изоформ титина в саркомерах сердечной мышцы [73]. Изоформа N2B cостоит из проксимального (слева) и дистального (справа) сегментов, собственно сегмента N2B и короткого PEVK сегмента. В структуре N2BA присутствуют те же элементы, только количество PEVK больше и, кроме того, добавлены изоформа N2A, аналогичная той, которая находится в скелетной мышце, и вставлен фрагмент Ig доменов с варьируемым (12–25) их количеством. Между изоформами показаны антитела, использованные для идентификации отдельных сегментов молекулы.

Сегмент N2A состоит из 4 Ig доменов и 106 остатков PEVK уникальной последовательности. В сердечной мышце сегмент N2B состоит из 3 Ig доменов и 572 остатков уникальной последовательности, а его растяжимый фрагмент включает также 37 Ig доменов и сегмент PEVK, содержащий 163 остатка уникальной последовательности. Комбинированная изоформа N2BA [15, 22] состоит из сегментов PEVK с 600–800 остатками и варьируемым количеством Ig доменов (12–25), которые разделяются на проксимальные (близкие к линии Z) и дистальные (близкие к диску А) участки [8]. Большое количество остатков PEVK а также Ig доменов повышает массу изоформы N2B приблизительно до 3.0 МДа, а для изоформы N2BА – до 3.3–3.5 МДа. Разница обусловлена наличием большего количества Ig доменов и сегментов PEVK [51]. В миокарде новорожденных присутствует и третья изоформа FST (10–12), она имеет наибольший размер – приблизительно 3.6–3.8 МДa, поскольку содержит еще большее количество Ig доменов и сегментов PEVK.
Все сегменты в миокарде удлиняются в физиологическом диапазоне длины саркомеров и поэтому могут рассматриваться как трехкомпонентная молекулярная пружина [53, 72], удлиняющаяся при растяжении и укорачивающаяся при устранении растяжения. Следовательно, чем более упругой является пружина, тем большее сопротивление она оказывает при растяжении и тем больше сжимается при снятии напряжения. A priori очевидно, что в сердечной мышце изоформы титина должны быть более упругие, поскольку нужно строго ограничивать степень растяжения саркомеров. Следовательно, изолированные кардиомиоциты должны сжиматься сильнее при снятии внешней нагрузки. Естественная их длина составляет около 1.85 мк, что составляет около 84% от длины, при которой достигается максимальная сила сокращений (2.2 мк). Упругость титина в миокарде более чем в 20 раз превышает таковую в скелетной мышце [30].
Упругость изоформы N2B, как было показано ранее, гораздо выше, чем упругость изоформы N2BА. Это различие обусловлено не только разными характеристиками собственно N2B и N2BА, но также различием сегментов Ig и PEVK. Изоформа N2BА содержит в несколько раз большее число Ig доменов, чем изоформа N2B; также в изоформе N2BA максимальная длина сегмента PEVK составляет около 200 нм, в то время как в изоформе N2B она составляет около 60 нм [29]. Соответственно, изоформа N2BА оказывает меньшее сопротивление при растяжении, что характеризует ее повышенную растяжимость.
Дальнейшее изучение структуры титина позволило установить характер связи миозиновых нитей с линией Z. Предлагается наличие двух компонентов молекулы в диске I. Один из них, длиной около 0.1 мк, “заякоривает” молекулу в линии Z, он располагается вдоль нитей актина, и его длина остается неизменной при растяжении саркомера [27]. Второй компонент связывает концы миозиновых нитей с первым компонентом, причем каждая миозиновая нить связывает 6 молекул титина [28]. Это позволяет удерживать концы миозиновых нитей на постоянном месте, ограничивая диск А.
Также в работе этой группы [74] с помощью специфических антител и иммуноэлектронной микроскопии было впервые установлено сосуществование двух изоформ в одном саркомере. При этом каждая из этих изоформ функционировала самостоятельно, вне связи с другой. Свойства данного саркомера зависели, таким образом, от соотношения изоформ. В бычьем миокарде преобладала изоформа N2BA, а в крысином миокарде – N2B.
Соотношение изоформ N2BA/N2B сильно варьирует среди сердец млекопитающих [15]. У крупных животных, а также у человека оно колеблется от 80 : 20 до 60 : 40, а у мелких (крыс, мышей) оно гораздо ниже (20 : 80). Это эволюционно обусловлено не только различными размерами сердец, но главным образом частотой их сокращений. У крупных животных основным компонентом минутного объема является ударный объем, который формируется на основе повышенного растяжения саркомеров в диастоле, поэтому превалирует менее упругая и более растяжимая изоформа N2BA. У мелких животных главным компонентом минутного объема является высокая частота сокращений, длительность диастолической паузы короткая, что требует быстрого завершения расслабления, в котором должна принимать участие упругая изоформа N2B.
ТИТИН И ПАССИВНОЕ НАПРЯЖЕНИЕ МИОКАРДА
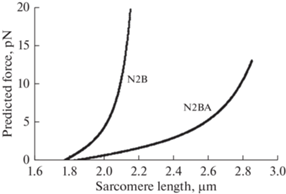
Очевидно, что более упругая изоформа N2B должна оказывать большее сопротивление при растяжении миокардиальных волокон, чем изоформа N2BА. Это демонстрирует рис. 3 [72]. Из рисунка видно, что именно изоформа N2B, имеющаяся только в сердечной мышце, создает гораздо большее сопротивление перерастяжению саркомеров, что крайне важно для сохранения сократительной функции миокарда.
Рис. 3.
Сопротивление изоформ титина из желудочка крысы (N2В) и предсердия быка (N2ВА) при растяжении саркомеров миокарда. Наличие изоформы N2B (крыса) гарантирует саркомеры миокарда от перерастяжения [72].
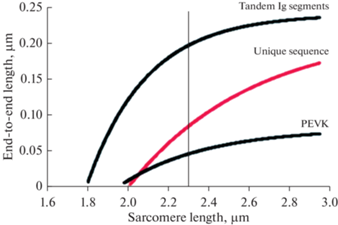
В самой изоформе N2B растяжимость сегментов сильно различается. Наиболее растяжимыми являются сегменты иммуноглобулиновых доменов, они начинают растягиваться уже при длине саркомеров 1.8 мк, а другие сегменты – N2B и PEVK – растягиваются, начиная с 2.0 мк (рис. 4 ). При максимальной физиологичной длине саркомера 2.2 мк длина Ig доменов в 4–5 раз больше, чем длина других сегментов. Следовательно, N2B и особенно PEVK являются наиболее упругими компонентами, сдерживающими перерастяжение саркомеров.
Рис. 4.
Растяжимость компонентов изоформы N2B. Наиболее растяжимыми являются сегменты иммуноглобулиновых доменов, а наименее растяжимыми – собственно сегмента N2B (unique sequence) и сегмента PEVK [73].
В свете данных о растяжимости изоформ N2В и N2ВА очевидно, что обе изоформы участвуют в создании пассивного напряжения миокарда при его растяжении, но в разной степени. Сердца животных, характеризующихся различным соотношением N2BА/N2B, обнаруживают различное пассивное напряжение. Сердца крупных животных, в которых преобладает изоформа N2BА, характеризуются меньшим напряжением при наполнении желудочка [24]. Более того, в сердцах собаки и свиньи отношение N2BA/N2B на 30% выше в субэндокардиальных слоях по сравнению с субэпикардиальными [24, 37]. Отмечено также повышение этого соотношения в процессе онтогенеза [51]. Можно также отметить, что в миокарде N2B представляет трехкомпонентную пружину, а в скелетной мышца изоформа N2А содержит только тандем иммуноглобулинов и сегмент PEVK, именно они являются растяжимыми элементами. Таким образом, изоформа N2А является двухкомпонентной пружиной [72].
Любопытное сравнение растяжимости компонентов изоформ N2B и N2BА было проведено на миокарде крысы с преобладанием N2B и миокарде предсердия быка с преобладанием N2BА [73]. Иммуноглобулиновые сегменты растягивались одинаково, но из-за меньшей длины в изоформе N2B относительное растяжение было больше, создавая таким образом более высокое сопротивление. Тот же феномен наблюдали при сравнении растяжимости сегментов PEVK. Растяжение сегментов N2B начиналось сразу после длины 1.8 мк. Эти данные объясняют, почему миокард животных, содержащих преимущественно изоформу N2BA, характеризуется пониженным пассивным напряжением [15].
Применение циклов “растяжение–снятие растяжения” показало, что пассивное напряжение включает вязкий компонент [28]. Это проявляется наличием петли гистерезиса, при которой возврат к исходной длине происходит таким образом, что при каждой повторной длине саркомера во время возврата к прежней длине его напряжение становится меньше, чем при растяжении. Другим проявлением вязкости является постепенное снижение пассивного напряжения после быстрого растяжения мышцы. Источник вязкости пока установить не удалось, возможно им могут быть связь титина с актином, связи сегментов N2B и PEVK c близлежащими молекулами или раскрытие Ig доменов [19].
Обнаружена зависимость пассивного напряжения миокарда от концентрации Са++ [23, 46]. Ее связывают со способностью доменов PEVK связываться с актином при повышенной концентрации Са++ и тем самым замедлять скольжение между титином и актином, повышая пассивное напряжение [45, 83]. Вместе с тем обнаружена разница в реагировании на Са++ между миокардом быка и крысы, значительно отличающимися по соотношению N2BA/N2B. В миокарде быка с повышенным содержанием N2BA ионы Са++ значительно повышали пассивное напряжение миокарда при его растяжении, а миокард крысы с повышенным содержанием N2B не реагировал на Са++ [23].
В поддержании пассивного напряжения, кроме титина, участвуют и структуры коллагена. В физиологическом диапазоне длины саркомеров (1.9–2.1 мк) основным компонентом оказывается титин, вклад промежуточных нитей невелик – около 10%, а при длине 2.2–2.3 мк основное сопротивление оказывают коллагены внеклеточного матрикса [30]. Хотя обе структуры реагируют одинаково на растяжение, вклад коллагена относительно “запаздывает” по сравнению со включением титина, т.е. он включается при большей длине саркомеров.
Существует некоторая разница между видами животных. Так, у крысы коллаген включается уже с длины саркомера 2.1 мк, а у свиньи – с 2.2 мк [28], что свидетельствует о более высокой упругости миокарда крысы. Более высокое пассивное напряжение присуще сердцам мелких животных с высокой частотой сокращений, что важно для обеспечения быстрого возврата саркомеров в прежнее положение и обеспечения быстрого наполнения желудочка [28].
Интересный метод был применен для оценки относительного вклада титина и коллагена на изолированных сердцах, перфузируемых через аорту. Для устранения влияния сокращений применяли искусственное разрушение сарколеммы мышечных волокон, и в этих условиях определяли соотношение “объем–давление” в полости левого желудочка [19]. При полной экстракции мышечных белков выяснилось, что титин ответственен за 80% всего пассивного напряжения в желудочке. Вклад внеклеточного матрикса сравнивается со вкладом титина только при достижении длины саркомеров более 2.2 мк. Таким образом, в физиологических условиях пассивное напряжение миокарда определяется почти исключительно титином.
УЧАСТИЕ ТИТИНА В СОКРАТИТЕЛЬНОЙ ФУНКЦИИ
Первоначальное мнение о титине как только пассивной структуре сейчас пересмотрено. В ряде экспериментов на разных объектах показано, что титин влияет на сократительную способность миокарда. Удаление титина из трабекул сердца крысы снижало силу активируемого ионами Са++ сокращения [25]. Скинированные (лишенные сарколеммы) миоциты сердца мыши выдерживали при длине саркомеров 2.0 и 2.3 мк и измеряли силу их сокращения в ответ на добавление максимальной концентрации Са++ к среде. При каждой длине сравнивали чувствительность миофибрилл к Са++ в условиях, когда пассивное напряжение было различно. Низкое напряжение наблюдали при длительном выдерживании миоцитов, а повышенное – сразу после растяжения до данной длины. При каждой длине величина рСа, характеризующая чувствительность миофибрилл, была ниже сразу после растяжения, при повышенном пассивном напряжении. Это означает повышение чувствительности миофибрилл к Са++ [16].
Другим фактором, облегчающим актомиозиновое взаимодействие, является обнаруженное в этих опытах уменьшение толщины миоцитов при повышенном растяжении, что предполагает более тесный контакт между миозиновыми и актиновыми нитями. Кроме того, в данной ситуации может включаться и третий фактор – наличие в структуре титина нитей, прикрепляющихся разными концами к актиновой и миозиновой нитям [28]. В ходе укорочения они естественно сжимаются, облегчая тем самым движение миозиновой нити вдоль актиновой.
Вероятно, эти факторы также участвуют в физиологическом эффекте увеличения силы сокращений сердца при увеличенном наполнении желудочка. Повышение диастолической упругости увеличивало способность миокарда развивать более высокое напряжение при увеличении объема изолированного сердца [50], т.е. повышается эффективность механизма Старлинга, что характерно для сердец крупных млекопитающих.
Другие экспериментальные данные согласуются с таким представлением. Изолированный фрагмент титина, находящийся в диске А, добавленный к миоцитам с гиперпроницаемой сарколеммой, не изменял чувствительность миофибрилл к Са++ в уже растянутых саркомерах, но повышал при ненагруженной длине [16]. Эти данные можно интерпретировать как блокирование актомиозинового взаимодействия в расслабленной нерастянутой мышце. То же наблюдалось в саркомерах, сокращенных до длины, меньшей, чем в свободно лежащей мышце [36]. Применительно к сердцу это означает, что титин может ингибировать актомиозиновое взаимодействие при сильном сокращении в условиях малого наполнения желудочка. Напротив, при растяжениии саркомеров зависимость силы сокращений от длины была тем больше, чем выше было пассивное напряжение миокарда [6]. Все эти данные позволили сделать вывод, что упругость титина — главный регулятор сократительной активности поперечнополосатых мышц [15, 24, 52].
Участие титина в процессе расслабления можно предполагать на основе его тесных связей с актиновыми и миозиновыми нитями. Основные данные получены на изолированных трабекулах, в которых можно измерять длину саркомеров. Недостатком этого метода является необходимость изучения работы мышцы в изометрическом режиме, который довольно далек от физиологичного. Процесс изометрического расслабления был проанализирован в работе [69]. Сокращение и расслабление изучали при быстрой смене раствора с высокой и низкой концентрацией Са++. Процесс развития напряжения происходил довольно медленно, в течение 1–1.5 с, в то время как процесс расслабления после очень кратковременной задержки происходил гораздо быстрее – примерно за 0.2–0.3 с. Авторы пришли к выводу, что кинетика изометрического расслабления определяется константой размыкания актомиозиновых связей.
С таким заключением согласуются результаты работы, в которой удаление изоформы N2B не повлияло на кинетику изометрического расслабления [21]. Впрочем, вопрос о роли данной изоформы в расслаблении отнюдь не столь ясен. Дело в том, что, как было показано в той же работе, после удаления этой изоформы нокаутным способом миокард успевает компенсировать ее отсутствие иным образом, в результате чего пассивное напряжение миокарда не только не снижается, как можно было ожидать, но напротив, повышается. Вероятно, ее устранение привело к значительному повышению упругости другой изоформы N2BА.
Наиболее весомым аргументом в пользу участия титина в процессе расслабления является феномен эластической отдачи (elastic recoil), наблюдавшейся в изолированных сердцах. Данный феномен был открыт давно, еще в 1930 г. Льюисом Катцем [42] на изолированном сердце черепахи. В начальном периоде диастолы он наблюдал увеличение объема желудочка в момент, когда давление в нем продолжало падать. Он впервые определил сердце как присасывающий насос. Гораздо позже это явление было установлено для сердца млекопитающих Brecher [12]. Прекращая доступ крови в ЛЖ, он наблюдал снижение давления в нем ниже нуля. Он указал, что во время сокращения запасается эластическая энергия вследствие растяжения одних эластических элементов и сжатия других. Он же ввел понятие о нулевом давлении в ЛЖ и считал, что присасывание происходит всегда, когда объем ЛЖ в конце систолы меньше уравновешенного объема, при котором не происходит ни растяжения, ни сжатия. В дальнейшем эти результаты были неоднократно подтверждены на разных объектах [60, 63, 70, 84].
Данный феномен наиболее естественно может быть объяснен наличием так называемой “восстанавливающей силы”, осуществляемой титином. Обработка миофибрилл трипсином, разрушающим титин, устраняла “восстанавливающую силу” [36]. Таким образом, подтверждается представление о титине как о двусторонней пружине, растягивающейся как при удлинении саркомера, так и при его укорочении меньше ненагруженной, “пассивной”, длины саркомера [27]. Эластический компонент титина полностью сжат при расслабленных саркомерах (slack длина = 1.85 мк), не испытывающих какого-либо напряжения. Молекула растягивается при увеличении длины до 2.2 мк или при ее уменьшении ниже slack длины. Относительно механизма такого преобразования была высказана гипотеза, ведущая роль в которой отводилась положению иммуноглобулиновых доменов [27]. В полностью расслабленных саркомерах данный компонент, связывающий молекулу титина с миозиновыми нитями, находится в сжатом состоянии, но при удлинении или чрезмерном укорочении саркомеров он распрямляется, создавая силу, направленную на возврат к ненагруженной длине саркомера (рис. 5 ).
Рис. 5.
Представления о структуре эластического компонента титина при изменении длины саркомеров. (а) “ненагруженная” (slack) длина; (б) изменения компонента при растяжении или чрезмерном сжатии саркомера; (в) сильное растяжение саркомера [27].

Слабым местом этой гипотезы является относительная низкая упругость данного сегмента, вряд ли способная обеспечить быстрое возвращение длины саркомеров к своему “нормальному” состоянию. В свете изложенных данных можно высказать альтернативную гипотезу. Основная роль в ней отводится упругим сегментам N2B и PEVK. Их “ненагруженное” состояние наблюдается при длине саркомера равной 2.0 мк (рис. 4). Следовательно, при удлинении саркомера они будут растягиваться, а при укорочении длины саркомеров меньше 2.0 мк сжиматься, создавая усилие, противодействующее дальнейшему укорочению саркомера. Когда же сокращение прекращается, данные сегменты N2B будут быстро отодвигать актиновые нити к линии Z, реализуя тем самым “восстанавливающую” силу.
В поддержку данной гипотезы можно привести данные, полученные на изолированных кардиомиоцитах, находившихся при своей естественной длине, т.е. полностью расслабленных [62]. Изучали миокард желудочков крысы и быка, а также предсердий быка. Известно, что содержание изоформы N2B наибольшее в миокарде крысы и наименьшее в миокарде предсердий быка. Выяснилось, что восстанавливающая сила была прямо пропорциональна пассивной упругости кардиомицитов, а она наибольшая в кардиомиоцитах миокарда крысы с повышенным уровнем изоформы N2B. Таким образом, подтверждается представление о N2B как самой упругой части титина, участвующей в реализации восстанавливающей силы. В одной из последних работ, выполненной на полностью расслабленных кардиомиоцитах из сердца человека было установлено, что расслабление происходило быстрее при повышенной упругости миофибрилл [17].
Изометрический режим, в котором изучали расслабление, не предполагает существенного изменения длины саркомеров. Более естественные условия создаются при работе изолированной мышцы в изотоническом режиме при малой нагрузке, когда укорочение максимально. В этих условиях скорость расслабления, т.е. возвращения мышцы к прежней длине после сокращения, всегда гораздо больше, чем скорость укорочения [1, 41]. Эта ситуация противоположна той, которая наблюдается при изометрическом сокращении, в котором скорость расслабления всегда меньше скорости сокращения.
Причина такого различия, по-видимому, состоит в различии исходной длины мышц. В изометрическом режиме опыты обычно выполняли при длине саркомеров близкой к максимальной, а в изотоническом режиме с малой нагрузкой длина саркомеров близка к ее естественной ненагруженной длине, и укорочение происходит в диапазоне, когда действует “восстанавливающая сила”. Согласно исследованиям японских авторов [71, 81] максимальное сокращение папиллярной мышцы крысы или левого желудочка мыши достигается при длине саркомеров 2.1 мк. Поскольку в изотоническом режиме с минимальной нагрузкой степень растяжения саркомеров вряд ли превышает 1.9 мк, можно полагать, что данный объект является удобным для исследования восстанавливающей силы.
Участие изоформы N2B в реализации восстанавливающей силы особенно важно для сердец мелких животных, таких как крысы и мыши. Высокая частота сокращений сердца (400–600/мин) сильно ограничивает длительность диастолической фазы, поэтому быстрое возвращение актиновых и миозиновых нитей в прежнее положение является критичным для выполнения насосной функции этих сердец. Не случайно поэтому они содержат повышенное количество изоформы N2B с высокой упругостью.
Изучение участия титина in vivo в фазе расслабления левого желудочка (ЛЖ) по естественным причинам весьма затруднено. Объектом изучения служит соотношение между объемом и давлением в нем. Дискуссионным и важным в настоящее время является вопрос – участвует ли “восстанавливающая” сила титина в каждом сокращении или только в тех, которые сопровождаются укорочением саркомеров ниже предела “ненагруженной длины”. Эта дискуссия [65, 85] возникла вначале из-за вопроса, какой момент считать состоянием, при котором на миофибриллы не действует никакая сила, а давление в левом предсердии и желудочке одинаково. Такой момент Brecher [12] определял как нулевое давление в ЛЖ. Но нулевой уровень давления наблюдается не всегда, чаще давление в течение всей диастолы остается на повышенном уровне. Nikolic et al. [60] развили это положение, уточнив его как значение объема, при котором проходит через 0 кривая, отражающая сумму силы отдачи и противоположно направленной пассивной силы, порождаемой растяжением стенок ЛЖ при его наполнении.
Это положение раскритиковали Shmuylovich et al. [65], они указали, что при нулевом уровне давления в ЛЖ сохраняются некие эластические силы и предложили альтернативный вариант – считать точкой диастаза некий “равновесный” объем ЛЖ, при котором нет эластических сил, т.е. саркомеры находятся близко к своей нерастянутой естественной длине. По понятным причинам такой момент гораздо сложнее определить, и в конечном итоге дискуссия свелась к вопросу – существует ли “восстанавливающая” сила в сокращениях, когда давление в диастоле ЛЖ не падает ниже нуля. Yellin and Nikolic возражают против этого, а Shmuylovich et al. считают, что давление в ЛЖ при этом не обязательно должно снижаться ниже 0, главное, чтобы оно было ниже давления в левом предсердии. Но такая ситуация естественна, в том числе и при дилатационной кардиомиопатии, иначе насосная функция сердца не могла бы осуществляться. При этом величина присасывания должна характеризовать состояние миокарда – при дилатации она гораздо меньше. Эту величину можно определять по эхокардиограмме [54].
При рассмотрении этого вопроса следует опираться на сведения об упругости компонентов титина. Согласно вышеприведенным данным [27], восстанавливающая сила, реализуемая укорочением Ig доменов, возникает только при длине саркомеров меньше естественной, и это соответствует взглядам Yellin and Nikolic. Аргументация Shmuylovich et al. гораздо слабее, но мнение об участии восстанавливающей силы или эластической отдачи практически в каждом сокращении выглядит привлекательным, потому что трудно допустить, чтобы эволюция, предусмотревшая участие титина в акте сокращения, не предусмотрела его участия в механизме расслабления.
В самом деле, если максимальное напряжение достигается при длине саркомеров 2.1–2.2 мк, то в нормальных условиях работа сердца происходит в диапазоне длины саркомеров 1.9–2.0 мк. При этом саркомеры в работающем сердце укорачиваются приблизительно на 10% [71], следовательно, вполне возможно укорочение саркомеров до 1.8 мк, т.е. меньше естественной ненагруженной длины, и можно ожидать включения восстанавливающей силы. Наши данные, полученные в опытах с кратковременным пережатием нижней полой вены [2], вполне согласуются с таким представлением. Закономерное уменьшение конечного диастолического объема при ограничении притока сопровождалось ускоренным расслаблением и более глубоким снижением минимального диастолического давления. Степень этих изменений была тем больше, чем меньше был конечный систолический объем.
Согласно расчетам [30, 36], в кардиомиоцитах крысы в пределах длины саркомеров 1.6–2.1 мк титин ответственен за 90% пассивной силы и по крайней мере за 60% восстанавливающей силы. По мере уменьшения содержания титина вследствие обработки трипсином восстанавливающая сила постепенно снижалась. Отсутствие титина (после обработки трипсином) снимает ограничения на чувствительность саркомеров к Са++ – укорочение при той же концентрации становится гораздо больше. Это означает, что возвращение саркомеров к прежней длине при расслаблении обеспечивается не только восстанавливающей силой [72], но и возникающей деактивацией миофибрилл. Результаты работы [68] показали, что удлинение саркомеров ненагруженной мышцы начинается, когда концентрация Са++ в миоплазме составляет около 30–50% от максимальной активирующей концентрации, т.е. когда уровень Са++ еще достаточно высок.
Согласно представлениям [35], титин играет центральную роль во взаимосвязи между концентрацией Са++ и длиной миокардиальных волокон в ходе всего цикла сокращения–расслабления, и сниженный уровень титина может служить одним из факторов, вызывающих диастолическую дисфункцию [35].
В целом можно заключить, что участие титина в каждом цикле расслабления является вероятным – ведь если структуры титина помогают развитию укорочения саркомеров, то почему не допустить, что они могут участвовать и в обратном процессе? Но требуются более конкретные данные. В этом плане весьма перспективной представляется недавно созданная методика опытов на изолированном кардиомиоците, позволяющая имитировать соотношения силы и длины, как это происходит на уровне целого сердца [35].
АДАПТАЦИЯ
В своих фундаментальных трудах Ф.З. Меерсон разделял адаптацию на кратковременную и долговременную. Кратковременная адаптация возникает при начале действия какого-либо фактора на работающую структуру, а долговременная – при длительном действии этого фактора. Наиболее естественным примером может служить физическая нагрузка, при которой сердцу нужно значительно увеличить интенсивность насосной функции. Это происходит за счет увеличения частоты сокращений и повышения растяжимости ЛЖ. Быстрая активация достигается за счет действия катехоламинов, которые через посредство адренорецепторов активируют усиленный вход Са++ в сократительный аппарат, что повышает и частоту, и силу сокращений. Кроме того, активируется сигнальный путь через протеинкиназу А, которая наряду с тропонином I фосфорилирует также молекулу титина, прежде всего – изоформу N2B [83], в результате чего снижается ее упругость, а значит – увеличивается растяжимость миокарда, способствуя лучшему наполнению камеры желудочка [28].
Сравнительная эффективность действия адреномиметиков на миокард животных зависит от соотношения N2BА /N2B. В работе на скинированных волокнах миокарда, полученных от желудочков крысы и быка, а также предсердия быка было обнаружено преимущественное снижение упругости в миокарде крысы с повышенным содержанием N2B и наименьшее – в предсердиях быка, в которых преобладает изоформа N2BА [24]. Вместе с тем в этой работе также было установлено, что адреномиметики снижают восстанавливаюшую силу, которая, как известно, также определяется изоформой N2B, что очевидно обусловлено снижением ее упругости.
Кроме протеинкиназы А несколько других протеинкиназ также фосфорилируют молекулы титина. Протеинкиназа G, зависимая от цГМФ, являющаяся вторичным мессенджером оксида азота и натрий-уретических пептидов, наряду с фосфорилированием саркомерных белков фосфорилирует также изоформу N2B титина [43], что сопровождается повышенной растяжимостью миокарда [13]. Вероятно, протеинкиназы А и G являются конкурентными, так как они фосфорилируют одинаковый сайт в структуре N2B. Кроме них, подобным действием обладает и протеинкиназа CaMKII [39]. Эта протеинкиназа фосфорилирует фосфоламбан и тем самым снимает его ингибирование с фермента SERCA2a, осуществляющего поглощение ионов Са++ в саркоплазматический ретикулум.
Как известно, при действии катехоламинов увеличивается не только сила сокращений, но также повышается их частота. Неудивительно поэтому, что расслабление изолированных кардиомиоцитов из сердца человека происходило быстрее при повышенной частоте сокращений [17]. Миоциты исходно были полностью расслаблены, и таким образом укорочение происходило в пределах меньше ненагруженной длины, т.е. при участии восстанавливающей силы.
Титин является также объектом фосфорилирования протеинкиназой С [37]. Но, в отличие от протеинкиназ А и G, фосфорилирование титина протеинкиназой С сопровождается повышением упругости миокарда. Она так же, как и протеинкиназа G, фосфорилирует саркомерные белки, но и на этом объекте ее эффект оказывается противоположным – она повышает чувствительность тропонина I к ионам Са++. Таким образом, система регуляции свойств титина имеет широкий диапазон, позволяющий успешно приспосабливать растяжимость миокарда к изменившимся условиям нагрузки на сердце.
Изоформа N2BА также чувствительна к действию протеинкиназы А, но растяжимость этой изоформы ограничивается благодаря противоположному действию ионов Са++, концентрация которых в миоплазме значительно возрастает при действии катехоламинов. На миокарде с различным соотношением N2BА/N2B (бык и крыса) было показано повышение упругости миокарда быка под влиянием повышения концентрации Са++, и отсутствие эффекта на миокард крысы. Следовательно, именно изоформа N2BА чувствительна к ионам Са++ [23]. Кроме того, поскольку связь сегмента PEVK изоформы N2B с актином является кальций-зависимой [46], эта изоформа также частично участвует в повышении пассивного напряжения [83].
Противоположное действие Са++ по сравнению с катехоламинами оправдано необходимостью предотвратить перерастяжение саркомеров, поскольку изоформа N2BА также чувствительна к действию протеинкиназы А. Результат этих противоположных влияний обусловлен наличием более короткого растяжимого сегмента в молекуле N2B, что и определяет преобладающее влияние на растяжимость молекулы титина в сердцах с повышенным содержанием изоформы N2B [28]. Данная ситуация представляет пример сбалансированного влияния на функционирующую структуру, предотвращая ее избыточную активацию.
Дефосфорилирование титина осуществляется протеинфосфатазами, например, серинтреониновая фосфатаза 5 (PP5) дефосфорилирует изоформу N2B в миокарде. Обычно PP5 аутоингибирована, но может активироваться под влиянием некоторых факторов, например, шаперона Hsp90 [44]. Этим объясняется, почему под влиянием увеличенного образования пероксида водорода в молекуле титина образуются дисульфидные связи, в результате упругость молекулы возрастает. Кроме того, дефосфорилирование титина может возникать вследствие недостаточной активности NO-синтазы. В результате дефосфорилирования титина растет диастолическое давление и затрудняется наполнение сердца.
Долговременная адаптация осуществляется посредством структурной перестройки в том же направлении, как и кратковременная, и зависит от вида нагрузки. Если эта нагрузка требует увеличенного ударного объема, соотношение изоформ N2BА/N2B сдвигается влево [55]. Если же нагрузка имеет преимущественно силовой характер, как например при стенозе аорты или гипертонии, соотношение сдвигается вправо [34].
Очевидно, что эти изменения происходят на основе перестройки генетического аппарата. Титин кодируется одним геном TTN, содержащим 368 эксонов. Многочисленные варианты сплайсинга создают изоформы с различной структурой пружин [8]. Но перестройка сплайсинга требует соответствущей сигнализации. Титин уже давно рассматривается как сенсор механического напряжения миокарда [26]. Его ключевая роль обусловлена наличием тесной связи не только с сократительными, но и с белками цитоскелета (филамин, интегрин), а также с линией Z через телетонин и альфа-актинин, связывающий титин с частью актиновой нити, контактирующей с линией Z [7]. Особенно важно участие белков линии Z. Изоформа N2B непосредственно контактирует с двумя белками FHL1 и FHL2, локализованными в ядре и действующими как коактиваторы транскрипции. Именно через них проходит сигнал активации гипертрофии [7].
ЗАБОЛЕВАНИЯ СЕРДЦА
Титин – громадный белок, и это делает мутации его молекулы весьма вероятными. В настоящее время мутации титина у человека активно изучают, найдено около 20 мутаций. Эти формы получили название титинопатий. Подавляющее большинство из них (около 90%) реализуются в виде дилатационной кардиомиопатии, а оставшаяся часть – в виде гипертрофической кардиомиопатии [31]. Причина такого различия пока неясна. Можно высказать предположение, что нарушение структуры титина скорее скажется на снижении пассивной упругости, поскольку основной функцией титина является создание сопротивления растяжению волокон миокарда.
Мутации обычно изменяют соотношение N2BA/N2B. При дилатационной кардиомиопатии это соотношение значительно повышено [55], но на ранней стадии недостаточности, при сохраненной фракции выброса оно оказалось почти вдвое меньше – 17/83 против 35/65 [76]. Это позволяет думать, что указанное соотношение меняется в ходе развития недостаточности. Убедительные данные в пользу такого представления получены при анализе ХСН, развивающейся у собак при длительной искусственно вызванной тахикардии [9, 79]. На первой стадии соотношение N2BA/N2B уменьшалось – в соответствии с кратковременной адаптацией сердца к высокой частоте сокращений, а затем повышалось в конечной стадии процесса при формировании дилатационной кардиомиопатии. Эти данные были впоследствии подтверждены [40].
Изменения титина возникают при разных заболеваниях сердца почти всегда. Отмечено повышение пассивной упругости миокарда в образцах, взятых у пациентов с диастолической дисфункцией [11]. Применение протеинкиназы А устраняло ее, что позволяет полагать снижение активности этой протеинкиназы in vivo. Повышение диастолической упругости в миокарде пациентов с ХСН, в том числе с диастолической дисфункцией [11], сочеталось с повышением активности протеинкиназы С, и ее ингибирование представляется одним из новых способов терапии ХСН [7]. Но в то же время соотношение N2BA/N2B у них не было снижено, как можно было ожидать, а, напротив, повышено, что позволяет предполагать повышенную растяжимость титина. Причина повышенного напряжения миокарда осталась невыясненной, удаление актина или прекращение актомиозинового взаимодействия не повлияли на упругость миокарда. Но применение протеинкиназ А или G нормализовало пассивное напряжение миокарда. Общее фосфорилирование титина не было изменено, но фосфорилирование N2B было меньше, чем N2BА, что вероятно и послужило причиной повышенного пассивного напряжения миокарда. Другая причина может быть связана с повышенным фосфорилирированием сегмента PEVK.
Наличие диабета обычно сочетается с повышенным пассивным напряжением миокарда у пациентов с ХСН, в том числе с диастолической дисфункцией [77]. При гипотиреоидизме, напротив, пассивное напряжение миокарда снижено, что сочеталось с повышенным содержанием изоформы N2BА [79].
В последнее время в структуре кардиологии выделяют отдельное направление – кардиоонкологию. Успехи в лечении опухолей, достигнутые главным образом применением антрациклиновых антибиотиков, в основном доксорубицина, осложнены нередким развитием кардиомиопатии и ХСН. Доксорубицин нарушает функцию митохондрий, вызывает окислительный стресс, при этом снижается сократимость миокарда. Наиболее естественным механизмом компенсации сниженной сократимости является мобилизация механизма Старлинга, основу которого составляет повышенная растяжимость миокарда. У крыс, получивших 4 инъекции доксорубицина в небольшой дозе, было установлено снижение диастолической упругости миокарда за счет повышенного фосфорилирования титина [3]. Соотношение N2BA/N2B повысилось почти вдвое – с 14/86 до 26/74. Эти изменения способствовали поддержанию фракции изгнания на нормальном уровне, т.е. предотвращали наступление систолической дисфункции.
При разных видах возникновения патологии сердца важным, а возможно и обязательным компонентом патогенеза является окислительный стресс. При этом в молекуле титина усиленно образуются дисульфидные связи, в результате пассивное напряжение миокарда повышается, а растяжимость снижается [32]. В недавних работах на сердцах крыс, получавших доксорубицин 2 или 4 нед., одновременно с доксорубицином вводили митохондриально-ориентированный антиоксидант пластомитин [66]. Он успешно предотвратил развитие систолической дисфункции после 4 инъекций доксорубицина [4] и развитие диастолической дисфункции после 2 инъекций доксорубицина [5]. Вместе с тем следует отметить, что применение данного антиоксиданта в качестве терапевтического средства при уже развившейся кардиомиопатии сомнительно, поскольку окислительный стресс возникает при остром действии какого-либо повреждающего фактора.
ЗАКЛЮЧЕНИЕ
Гигантский саркоплазматический белок коннектин был открыт в 1976 г. японскими биохимиками (Maruyama et al.). В 1979 г. другая группа биохимиков (Wang et al.) также выделила этот белок, но назвала его титином (от греческого “титан” – громадный). В силу более частой цитируемости в США данное название закрепилось, хотя термин “коннектин” больше соответствует роли этого белка, поскольку основное его местонахождение – в диске I саркомера, где он служит связующим звеном между концами миозиновых нитей и границей саркомера – линией Z.
Коннектин/титин обнаружен во всех мышцах. В скелетной мышце присутствует его изоформа N2А, а в сердечной N2В и N2BА. Основная роль титина состоит в поддержании пассивного напряжения миокарда, предотвращающего перерастяжение саркомеров. Для скелетной мышцы это не актуально, так как там перерастяжение невозможно из-за жестко закрепленных концов мышцы. В сердечной мышце таких ограничителей нет, и поэтому там присутствует более упругая изоформа N2В и смешанная N2ВА. Каждая изоформа имеет в своем составе различное количество иммуноглобулиновых доменов и сегментов PEVK. Иммуноглобулиновые домены представляют “первую линию обороны” – они удлиняются уже при любом растяжении саркомеров. Более упругие пептиды – собственно N2В единицы и сегменты PEVK растягиваются уже при приближении длины саркомеров к максимально эффективной.
Соотношение изоформ варьирует в сердцах разных животных. Миокард мелких млекопитающих характеризуется низким отношением N2ВА/N2В, а миокард крупных животных и человека – высоким отношением. Это различие связано главным образом с различной частотой сокращений – у крыс и мышей она в несколько раз выше. Очень короткая диастолическая пауза требует быстрого завершения расслабления, что достигается в том числе благодаря более упругой структуре титина. Преобладание изоформы N2ВА в миокарде крупных животных обеспечивает повышенную растяжимость миокарда, что особенно важно для увеличения ударного объема.
Роль титина не ограничивается только поддержанием пассивного напряжения. Он участвует в акте сокращения благодаря наличию своих нитей, приближающих актиновые нити к миозиновым, и модулирует чувствительность миофибрилл к ионам Са++ – снижает чувствительность при малой длине саркомеров и повышает при большой. Роль титина в расслаблении бесспорна – он является “двигателем” эластической отдачи желудочка при низком конечносистолическом объеме, обеспечивая присасывание крови из предсердия. При обычном конечносистолическом объеме роль титина не столь очевидна, но весьма вероятна. Во всяком случае сердца с более упругой структурой титина характеризуются более высокой скоростью удлинения волокон при расслаблении.
Титин участвует и в кратковременной, и в долговременной адаптации сердца к различным нагрузкам. При необходимости увеличить минутный объем протеинкиназы А и G фосфорилируют изоформу N2В, повышая растяжимость миокарда, а при необходимости развивать повышенное давление протеинкиназа С фосфорилирует изоформу N2ВА, повышая упругость миокарда. Долговременная адаптация в первом случае сопровождается повышением соотношения N2ВА/N2В, а во втором – снижением этого соотношения. Многочисленные генетические мутации титина обычно сопровождаются развитием дилатационной кардиомиопатии. Показаны закономерные изменения свойств титина при различных болезнях сердца.
Обзор выполнен при финансовой поддержке гранта РФФИ № 18-015-00271.
Автор благодарен доктору биологических наук Елене Владимировне Лукошковой за ценные замечания при обсуждении материалов обзора.
Список литературы
Капелько В.И., Горина М.С. Кальциевая регуляция сокращения и расслабления миокарда. В кн: Регуляция сократительной функции и метаболизма миокарда. М. Наука, 1987. С. 79.
Капелько В.И., Абрамов А.А., Лакомкин В.Л., Лукошкова Е.В. Компенсаторные изменения диастолы при уменьшении притока к сердцу. Бюллетень экспериментальной биологии и медицины // 2020. принята к печати 18.10
Лакомкин В.Л., Абрамов А.А., Студнева И.М., Уланова А.Д., Вихлянцев И.М., Просвирнин А.В., Лукошкова Е.В., Капелько В.И. Ранние изменения энергетического метаболизма и изоформного состава и уровня фосфорилирования титина при диастолической дисфункции // Кардиология. 2020. Т. 60. № 2. С. 4.
Лакомкин В.Л., Студнева И.М., Абрамов А.А., Просвирнин А.В., Веселова О.М., Писаренко О.И., Капелько В.И. Митохондриальный антиоксидант пластомитин изменяет энергетический статус и улучшает сократимость миокарда при доксорубициновой кардиомиопатии // Кардиологический вестник. 2020. № 2. С. 24.
Лакомкин В.Л., Абрамов А.А., Лукошкова Е.В., Просвирнин А.В., Капелько В.И. Митохондриальный антиоксидант пластомитин в предотвращении диастолической дисфункции, вызываемой доксорубицином // Кардиология. 2020. 60 (7). С. 40
Ait-Mou Y., Hsu K., Farman G.P., Kumar M., Greaser M.L., Irving T.C., de Tombe P.P. Titin strain contributes to the Frank-Starling law of the heart by structural rearrangements of both thin- and thick-filament proteins // Proc. Natl Acad. Sci. USA. 2016. V. 113 (8). C. 2306. https://doi.org/10.1073/pnas.1516732113
Anderson B.R., Granzier H.L. Titin-based tension in the cardiac sarcomere: molecular origin and physiological adaptations // Prog. Biophys. Mol. Biol. 2012. V. 110 (2–3). C. 204. https://doi.org/10.1016/j.pbiomolbio.2012.08.003
Bang M.L., Centner T., Fornoff F., Geach A.J, Gotthardt M., McNabb M., Witt C.C., Labeit D., Gregorio C.C., Granzier H., Labeit S. The complete gene sequence of titin, expression of an unusual approximately 700-kDa titin isoform, and its interaction with obscurin identify a novel Z-line to I-band linking system // Circ. Res. 2001. V. 89. P. 1065. [PubMed: 11717165]
Bell S.P., Nyland L., Tischler M.D., McNabb M., Granzier H., LeWinter M.M. Alterations in the determinants of diastolic suction during pacing tachycardia // Circ. Res. 2000. V. 87. P. 235. [PubMed: 10926875]
Borbely A., Falcao-Pires I., van Heerebeek L., Hamdani N., Edes I., Gavina C., Leite-Moreira A.F., Bronzwaer J.G., Papp Z., van der Velden J., Stienen G.J., Paulus W.J. Hypophosphorylation of the Stiff N2B titin isoform raises cardiomyocyte resting tension in failing human myocardium // Circ. Res. 2009. V. 104. P. 780. [PubMed: 19179657]
Borbely A., van der Velden J., Papp Z., Bronzwaer J.G., Edes I., Stienen G.J., Paulus W.J. Cardiomyocyte stiffness in diastolic heart failure // Circulation. 2005. V. 111. P. 774. [PubMed: 15699264]
Brecher G.A. Experimental evidence of ventricular diastolic suction // Circ. Res. 1956. V. 4. P. 513
Burley D.S., Ferdinandy P., Baxter G.F. Cyclic GMP and protein kinase-G in myocardial ischaemia-reperfusion: opportunities and obstacles for survival signaling // Br. J. Pharmacol. 2007. V. 152. P. 855 [PubMed: 17700722]
Cazorla O., Wu Y., Irving T.C., Granzier H. Titin-based modulation of calcium sensitivity of active tension in mouse skinned cardiac myocytes // Circ. Res. 2001. V. 88. P. 1028. [PubMed: 11375272]
Cazorla O., Freiburg A., Helmes M., Centner T., McNabb M., Wu Y., Trombitás K., Labeit S., Granzier H. Differential expression of cardiac titin isoforms and modulation of cellular stiffness // Circ. Res. 2000. V. 86(1). P. 59.
Cazorla O., Wu Y., Irving T.C., Granzier H. Titin-based modulation of calcium sensitivity of active tension in mouse skinned cardiac myocytes // Circ. Res. 2001. V. 88. P. 1028
Chen Mei-Pian, Salome A., Kiduko, Nancy S., Saad., Benjamin D., Canan A.K., Mohler P.J., Janssen P.M.L. Stretching single titin molecules from failing human hearts reveals titin’s role in blunting cardiac kinetic reserve // Cardiovasc Res. 2020. V. 116. P. 127. https://doi.org/10.1093/cvr/cvz043
Chung C.S., Bogomolovas J., Gasch A., Hidalgo C.G., Labeit S., Granzier H.L. Titin-actin interaction: PEVK-actin-based viscosity in a large animal // J. Biomed. Biotechnol. 2011. P. 310791. https://doi.org/10.1155/2011/310791
Chung C.S., Granzier H.L. Contribution of titin and extracellular matrix to passive pressure and measurement of sarcomere length in the mouse left ventricle // J. Mol. Cell Cardiol. 2011. V. 50(4). P. 731. https://doi.org/10.1016/j.yjmcc.2011.01.005
Chung C.S., Granzier H.L. Contribution of titin and extracellular matrix to passive pressure and measurement of sarcomere length in the mouse left ventricle // J. Mol. Cell Cardiol. 2011. V. 50. P. 731.
Elhamine F., Radke M.H., Pfitzer G., Granzier H., Gotthardt M., Stehle R. Deletion of the titin N2B region accelerates myofibrillar force development but does not alter relaxation kinetics // J. Cell Sci. 2014. V. 127 (Pt 17). P. 3666. https://doi.org/10.1242/jcs.141796
Freiburg A., Trombitas K., Hell W., Cazorla O., Fougerousse F., Centner T., Kolmerer B., Witt C., Beckmann J.S., Gregorio C.C., Granzier H., Labeit S. Series of Exon-Skipping Events in the Elastic Spring Region of Titin as the Structural Basis for Myofibrillar Elastic Diversity // Circ. Res. 2000. V. 86. P. 1114.
Fujita H., Labeit D., Gerull B., Labeit S., Granzier H.L. Titin isoform-dependent effect of calcium on passive myocardial tension // Am. J. Physiol. Heart Circ. Physiol. 2004. V. 287(6). P. H2528.
Fukuda N., Wu Y., Nair P., Granzier H.L. Phosphorylation of titin modulates passive stiffness of cardiac muscle in a titin isoform dependent manner // J. Gen. Physiol. 2005.V. 125. P. 257. PMID: 15738048
Fukuda N., Sasaki D., Ishiwata S., Kurihara S. Length dependence of tension generation in rat skinned cardiac muscle: role of titin in the Frank-Starling mechanism of the heart // Circulation. 2001. V. 104. P. 1639.
Granzier H., Labeit S. Cardiac titin: an adjustable multi-functional spring // J. Physiol. 2002. V. 541(Pt 2). P. 335.
Granzier H., Helmes M., Trombitas K. Nonuniform Elasticity of Titin in Cardiac Myocytes: A Study Using Immunoelectron Microscopy and Cellular Mechanics // Biophysical. J. 1996. V. 70. P. 430.
Granzier H.L., Labeit S. The giant protein titin: a major player in myocardial mechanics, signaling, and disease // Circ. Res. 2004. V. 94 (3). P. 284.
Granzier H., Helmes M., Cazorla O., McNabb M., Labeit D., Wu Y., Yamasaki R., Redkar A., Kellermayer M., Labeit S., Trombitás K. Mechanical Properties of Titin Isoforms // Adv. Exp. Med. Biol. 2000. V. 481. P. 283 https://doi.org/10.1007/978-1-4615-4267-4_17
Granzier H.L., Irving T.C. Passive Tension in Cardiac Muscle: Contribution of Collagen, Titin, Microtubules, and Intermediate Filaments // Biophysical J. 1995. V. 68. P. 1027.
Greaser M.L. Stressing the giant: a new approach to understanding dilated cardiomyopathy // J. Mol. Cell Cardiol. 2009. V. 47. P. 347. [PubMed: 19555694]
Grutzner A., Garcia-Manyes S., Kotter S., Badilla C.L., Fernandez J.M., Linke W.A. Modulation of titin-based stiffness by disulfide bonding in the cardiac titin N2-B unique sequence // Biophys J. 2009. V. 97. P. 825. [PubMed: 19651040]
Hamdani N., Herwig M., Linke W.A. Tampering with springs: phosphorylation of titin affecting the mechanical function of cardiomyocytes // Biophys. Rev. 2017. V. 9 (3). P. 225. https://doi.org/10.1007/s12551-017-0263-9
Hamdani N., Bishu K.G., von Frieling-Salewsky M., Redfield M.M., Linke W.A. Deranged myofilament phosphorylation and function in experimental heart failure with preserved ejection fraction // Cardiovasc Res. 2013. V. 97 (3). P. 464.
Helmes M., Najafi A., Palmer B.M., Breel E., Rijnveld N., Iannuzzi D., van der Velden J. Mimicking the Cardiac Cycle in Intact Cardiomyocytes Using Diastolic and Systolic Force Clamps; Measuring Power Output // Cardiovasc. Res. 2016. V. 111 (1). P. 66. https://doi.org/10.1093/cvr/cvw072
Helmes M, Trombitas K, Granzier H. Titin develops restoring force in rat cardiac myocytes // Circ. Res. 1996. V. 79. P. 619.
Hidalgo C., Hudson B., Bogomolovas J., Zhu Y., Anderson B., Greaser M., Labeit S., Granzier H. PKC phosphorylation of titin’s PEVK element: a novel and conserved pathway for modulating myocardial stiffness // Circ. Res. 2009. V. 105. P. 631. [PubMed: 19679839]
Hidalgo C. Granzier H. Tuning the molecular giant titin through phosphorylation-role in health and disease // Trends Cardiovasc Med. 2013. V. 23 (5). P. 165. https://doi.org/10.1016/j.tcm.2012.10.005
Hoch B., Meyer R, Hetzer R., Krause E.G., Karczewski P. Identification and expression of δ-isoforms of the multifunctional Ca2+/calmodulin-dependent protein kinase in failing and nonfailing human myocardium // Circ. Res. 1999. V. 84. P. 713. PMID: 10189359
Jaber W.A., Maniu C., Krysiak J., Shapiro B.P., Meyer D.M., Linke W.A., Redfield M.M. Titin isoforms, extracellular matrix, and global chamber remodeling in experimental dilated cardiomyopathy: functional implications and mechanistic insight // Circ. Heart. Fail. 2008. V. 1. P. 192. [PubMed: 19808289]
Kapelko V.I., Gorina M.S. Calcium regulation of myocardial contraction and relaxation // In: Sov. Med. Rev. A. Cardiol. V. 2. Harwood Academic Publ. London. 1989. P. 163.
Katz L.N. The role played by the ventricular relaxation process in filling the ventricle // Am. J. Physiol. 1930. V. 95. P. 542.
Kruger M., Kotter S., Grutzner A., Lang P., Andresen C., Redfield M.M., Butt E., dos Remedios C.G., Linke W.A. Protein kinase G modulates human myocardial passive stiffness by phosphorylation of the titin springs // Circ. Res. 2009. V. 104. P. 87. [PubMed: 19023132]
Krysiak J., Unger A., Beckendorf L., Hamdani N., von Frieling-Salewsky M., Redfield M.M, Dos Remedios C.G., Sheikh F., Gergs U., Boknik P., Linke W.A. Protein phosphatase 5 regulates titin phosphorylation and function at a sarcomere-associated mechanosensor complex in cardiomyocytes // Nat. Commun. 2018. V. 9 (1). P. 262. https://doi.org/10.1038/s41467-017-02483-3
Kulke M., Fujita-Becker S., Rostkova E., Neagoe C., Labeit D., Manstein D.J., Gautel M., Linke W.A. Interaction between PEVK-titin and actin filaments: origin of a viscous force component in cardiac myofibrils // Circ. Res. 2001. V. 89. P. 874. [PubMed: 11701614]
Labeit D., Watanabe K., Witt C., Fujita H., Wu Y., Lahmers S., Funck T., Labeit S., Granzier H. Calcium-dependent molecular spring elements in the giant protein titin // Proc. Natl Acad. Sci. U S A 2003. V. 100. P. 13716. [PubMed: 14593205]
Labeit S., Kolmerer B. Titins: Giant Proteins in Charge of Muscle Ultrastructure and Elasticity // Science. 1995. V. 270. Iss. 5234. P. 293. https://doi.org/10.1126/science.270.5234.293
Labeit D., Watanabe K., Witt C., Fujita H., Wu Y., Lahmers S., Funck T., Labeit S., Granzier H. Calcium-dependent molecular spring elements in the giant protein titin // Proc. Natl Acad. Sci. U S A. 2003. V. 100. P. 13716. [PubMed: 14593205]
Lahmers S., Wu Y., Call D.R., Labeit S, Granzier H. Developmental control of titin isoform expression and passive stiffness in fetal and neonatal myocardium // Circ. Res. 2004. V. 94. P. 505. [PubMed:14707027]
Lee E.J., Peng J., Radke M., Gotthardt M., Granzier H.L. Calcium sensitivity and the Frank-Starling mechanism of the heart are increased in titin N2B region-deficient mice // J. Mol. Cell Cardiol. 2010. V. 49 (3). P. 449. https://doi.org/10.1016/j.yjmcc.2010.05.006
LeWinter M.M., Granzier H. Cardiac titin: a multifunctional giant // Circulation. 2010. V. 121(19). P. 2137. https://doi.org/10.1161/CIRCULATIONAHA.109.860171
Linke W.A. Titin Gene and Protein Functions in Passive and Active Muscle // Annu Rev. Physiol. 2018. V. 80. P. 389. https://doi.org/10.1146/annurev-physiol-021317-121234
Linke W.A., Rudy D.E., Centner T., Gautel M., Witt C., Labeit S., Gregorio C.C. I-band titin in cardiac muscle is a three-element molecular spring and is critical for maintaining thin filament structure // J. Cell Biol. 1999. V. 146 (3). P. 631. https://doi.org/10.1083/jcb.146.3.631
Little W.C., Oh J.K. Echocardiographic evaluation of diastolic function can be used to guide clinical care // Circulation. 2009. V. 120. P. 802.
Makarenko I., Opitz C.A., Leake M.C., Neagoe C., Kulke M. Gwathmey J.K., del Monte F., Hajjar R.J., Linke W.A. Passive stiffness changes caused by upregulation of compliant titin isoforms in human dilated cardiomyopathy hearts // Circ. Res. 2004. V. 95 (7). P. 708. https://doi.org/10.1161/01.RES.0000143901.37063.2f
Maruyama K., Natori R., Nonomura Y. New Elastic Protein From Muscle // Nature. 1976. V. 262 (5563). P. 58. https://doi.org/10.1038/262058a0
Maruyama K. Connectin/titin, giant elastic protein of muscle // FASEB J. 1997. V. 11. P. 341
Maruyama K., Kimura S., Ohashi K., Kuwano Y. Connectin, an Elastic Protein of Muscle. Identification of “Titin” with Connectin // J Biochem. 1981. V. 89. P. 701.
Neagoe C., Opitz C.A., Makarenko I., Linke W.A. Gigantic variety: expression patterns of titin isoforms in striated muscle and consequences for myofibrillar passive stiffness // J. Muscle Res. Cell Motil. 2003. V. 24 (2–3). P. 175.
Nikolic S., Yellin E.L., Tamura K., Vetter H., Tamura T., Meisner J.S., Frater R.W. Passive properties of canine left ventricle: diastolic stiffness and restoring forces // Circ. Res. 1988. V. 62. P. 1210.
Nikolic S., Yellin E.L. Point:Counterpoint: Left ventricular volume during diastasis is/is not the physiological in vivo equilibrium volume and is/is not related to diastolic suction // J. Appl. Physiol. 2010. V. 109. P. 608.
Preetha N., Yiming W., Helmes M., Norio F., Siegfried L., Granzier H. Restoring force development by titin/connectin and assessment of Ig domain unfolding // J. Muscle. Res. Cell. Motil. 2005. V. 26. P. 307. [PubMed: 16470334]
Robinson T.F., Factor S.M., Sonnenblick E.H. The heart as a suction pump // Sci. Am. 1986. V. 254. P. 84.
Schmiel F.K., Lorenzen N., Fischer G., Harding P., Kramer H.-H. Diastolic Left Ventricular Function Experimental Study of the Early Filling Period Using the Voigt Model // Basic Res. Cardiol. 2005. V. 100 (1). P. 64. https://doi.org/10.1007/s00395-004-0487-2
Shmuylovich L., Chung C.S., Kovács S.J. Point: left ventricular volume during diastasis is The physiological in vivo equilibrium volume and Is related to diastolic suction // J. Appl. Physiol. 2010. V. 109. P. 606.
Skulachev V.P., Anisimov V.N., Antonenko Yu.N., Bakeeva L.E., Chernyak B.V., Erichev V.P., Filenko O.F., Kalinina N.I., Kapelko V.I., Kolosova N.G., Kopnin B.P., Korshunova G.A., Lichinitser M.R., Obukhova L.A., Pasyukova E.G. et al. An attempt to prevent senescence: A mitochondrial approach // Biochimica et Biophysica Acta. 2009. V. 1787(5). P. 437. https://doi.org/10.1016/j.bbabio.2008.12.008
Sonnenblick E.H. Implications of muscle mechanics in the heart // Fed. Proc. 1962. V. 21. P. 975. PMID: 13978235
Spurgeon H.A., duBell W.H., Stern M.D., Sollott S.J., Ziman B.D., Silverman H.S., Capogrossi M.C., Talo A., Lakatta E.G. Cytosolic Calcium and Myofilaments in Single Rat Cardiac Myocytes Achieve a Dynamic Equilibrium During Twitch Relaxation // J. Physiol. 1992. V. 447. P. 83. https://doi.org/10.1113/jphysiol.1992.sp018992
Stehle R., Solzin J., Iorga B., Gomez D., Blaudeck N., Pfitzer G. Mechanical properties of sarcomeres during cardiac myofibrillar relaxation: stretch-induced cross-bridge detachment contributes to early diastolic filling // J. Muscle. Res. Cell Motil. 2006. V. 27 (5–7). P. 423. https://doi.org/10.1007/s10974-006-9072-7
Suga H., Goto Y., Igarashi Y., Yamada O., Nozava T., Yasamura Y. Ventricular suction under zero source pressure for filling // Am. J. Physiol. Heart. Circ. Physiol. 1986. V. 251. P. H47.
Toh R., Shinohara M., Takaya T., Yamashita T., Masuda S., Kawashima S., Yokoyama M., Yagi N. An X-Ray diffraction study on mouse cardiac cross-bridge function in vivo: effects of adrenergic {beta}-stimulation // Biophys. J. 2006. V. 90. P. 1723. [PubMed: 16339874]
Trombitas K., Freiburg A., Centner T., Labeit S, Granzier H. Molecular Dissection of N2B Cardiac Titin’s Extensibility // Biophysical. J. 1999. V. 77. P. 3189.
Trombitás K., Freiburg A., Greaser M., Labeit S., Granzier H. From connecting filaments to co-expression of titin isoforms // Adv. Exp. Med. Biol. 2000. V. 481. P. 405.
Trombitás K., Wu Y., Labeit D., Labeit S., Granzier H. Cardiac titin isoforms are coexpressed in the half-sarcomere and extend independently // Am. J. Physiol. Heart Circ. Physiol. 2001. V. 281 (4). p. H1793.
Trombitás K., Granzier H. Actin removal from cardiac myocytes shows that near Z line titin attaches to actin while under tension // Am. J. Physiol. 1997. V. 273. (2 Pt 1) P. C662. PMID: https://doi.org/10.1152/ajpcell.1997.273.2.C6629277364
van Heerebeek L., Hamdani N., Handoko M.L., Falcao-Pires I., Musters R.J., Kupreishvili K., Ijsselmuiden A.J., Schalkwijk C.G., Bronzwaer J.G., Diamant M., Borbely A., van der Velden J., Stienen G.J., Laarman G.J., Niessen H.W., Paulus W.J. Diastolic stiffness of the failing diabetic heart: importance of fibrosis, advanced glycation end products, and myocyte resting tension // Circulation. 2008. V. 117. P. 43. [PubMed: 18071071]
van Heerebeek L., Borbely A., Niessen H.W., Bronzwaer J.G., van der Velden J, Stienen G.J., Linke W.A., Laarman G.J., Paulus W.J. Myocardial structure and function differ in systolic and diastolic heart failure // Circulation. 2006. V. 113. P. 1966. [PubMed: 16618817]
Wang K., Mcclure J., Tu A. Titin: Major myofibrillar components of striated muscle // Proc. Natl. Acad. Sci. USA. 1979. V. 76(8). P. 3698.
Wu Y., Peng J., Campbell K.B., Labeit S., Granzier H. Hypothyroidism leads to increased collagen-based stiffness and re-expression of large cardiac titin isoforms with high compliance // J. Mol. Cell Cardiol. 2007. V. 42. P.186. [PubMed: 17069849]
Wu Y., Bell S.P., Trombitas K., Witt C.C., Labeit S., LeWinter M.M., Granzier H. Changes in titin isoform expression in pacing-induced cardiac failure give rise to increased passive muscle stiffness // Circulation. 2002. V. 106. P. 1384. [PubMed: 12221057]
Yagi N., Okuyama H., Toyota H., Araki J., Shimizu J., Iribe G., Nakamura K., Mohri S., Tsujioka K., Suga H., Kajiya F. Sarcomere-length dependence of lattice volume and radial mass transfer of myosin cross-bridges in rat papillary muscle // Pflugers. Arch. 2004. V. 445. P. 238.
Yakupova E.I., Vikhlyantsev I.M., Lobanov M.Y., Galzitskaya O.V., Bobylev A.G. Amyloid properties of titin // Biochemistry (Moscow). 2017. V. 82 (13). P. 1675. https://doi.org/10.1134/S0006297917130077
Yamasaki R., Berri M., Wu Y., Trombitas K., McNabb M., Kellermayer M.S., Witt C., Labeit D., Labeit S., Greaser M., Granzier H. Titin-actin interaction in mouse myocardium: passive tension modulation and its regulation by calcium/S100A1 // Biophys. J. 2001. V. 81. P. 2297. [PubMed: 11566799]
Yamasaki R., Wu Y., McNabb M., Greaser M., Labeit S., Granzier H. Protein kinase A phosphorylates titin’s cardiac-specific N2B domain and reduces passive tension in rat cardiac myocytes // Circ. Res. 2002. V. 90. P. 1181. [PubMed: 12065321]
Yellin E.L., Hori M., Yoran C., Sonnenblick E.H., Gabbay S., Frater R.W.M. Left ventricular relaxation in the filling and non–filling intact canine heart // Am. J. Physiol. Heart. Circ. Physiol. 1986. V. 250. P. H620.
Yellin E., Nikolic S.D. Counterpoint: left ventricular volume during Diastasis is not the physiological in vivo Equilibrium volume and is not related to Diastolic suction // J. Appl. Physiol. 2010. V. 109. P. 606.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


