Успехи физиологических наук, 2022, T. 53, № 2, стр. 15-38
Лимфатическая система в норме и при патологии
Г. И. Лобов *
ФГБУН Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
* E-mail: LobovGI@infran.ru
Поступила в редакцию 27.11.2021
После доработки 01.12.2021
Принята к публикации 21.12.2021
- EDN: YEWDXY
- DOI: 10.31857/S0301179822020060
Аннотация
Лимфатическая система представляет собой сеть лимфатических сосудов, начинающуюся в тканях и заканчивающуюся лимфатическими протоками, впадающими в крупные вены шеи. В состав лимфатической системы входят также лимфоидные органы. Лимфатические сосуды выполняют важнейшую функцию по поддержанию гомеостаза внеклеточной жидкости посредством удаления из тканей продуктов метаболизма, клеток и клеточного детрита. Лимфатическая система обеспечивает абсорбцию липидов и их доставку в кровь. Она также является структурной основой иммунной системы и имеет важное значения для развития и поддержания иммунных реакций. В этом обзоре представлены данные о строении и функциях лимфатической сосудистой сети, сформировавшиеся за последнее столетие, а также результаты исследований последних лет, существенно дополнивших и изменивших наши представления о функциях лимфатической системы в физиологических условиях и при некоторых патологических состояниях.
ВВЕДЕНИЕ
Млекопитающие имеют две специализированные сосудистые системы: кровеносную и лимфатическую. В отличие от кровеносной системы, лимфатическая сосудистая сеть представляет собой однонаправленный канал, по которому отфильтрованная интерстициальная жидкость, тканевые метаболиты и некоторые клетки возвращаются в кровоток. Сердечно-сосудистая систем для непрерывной циркуляции крови использует централизованный насос – сердце, создающий постоянный градиент давления для движения крови по сосудам. В лимфатической системе подобного насоса нет и движение лимфы по сети лимфатических сосудов (ЛС) опосредуется несколькими силами: 1) силами лимфообразования, 2) механизмами внутреннего насоса (собственная сократительная активность ЛС, продвигающая лимфу от корней лимфатической системы до места впадения лимфатических протоков в вены шеи и 3) колебаниями тканевого давления в органах, подвергающихся периодической компрессии. Не менее важно отметить, что, в отличие от крови, лимфа не циркулирует сама по себе, а представляет собой фильтрат плазмы, образовавшийся в тканях и перемещаемый в центральный кровоток. Движение лимфы по сосудам довольно медленное, у человека не превышает 10 л в сутки, половина из которых возвращается в системный кровоток в лимфатических узлах (ЛУ), а другая половина поступает через грудной и правый лимфатический протоки в крупные вены шеи [66, 83]. Лимфа является, с одной стороны, дополнительным резервуаром жидкости, а с другой, образцом отфильтрованной плазмы и интерстициальной жидкости, доступным для наблюдения иммунной системой в локальных дренирующих ЛУ, распределенных по всей системе.
ЛС имеются практически в каждой ткани. Плотность лимфатической сосудистой сети особенно высока в коже, дыхательной и пищеварительной системах, что свидетельствует о важности лимфатической системы для иммунного наблюдения за чужеродными антигенами и микроорганизмами, поступающими из внешней среды. Некоторые ткани (костный мозг, хрящ, роговица и центральная нервная система) до недавнего времени традиционно считали не имеющими ЛС. Однако в последнее время в этих тканях были обнаружены доказательства существования лимфодренажа в нормальных условиях или лимфангиогенеза при патологических состояниях. Было доказано наличие ЛС в длинных костях [100], выявлен рост ЛС в роговице при травме или инфекции [67]. Но наиболее значимым открытием является обнаружение глимфатической системы, обеспечивающей дренаж ткани мозга и отведение части цереброспинальной жидкости в ЛС твердой мозговой оболочки [9, 88, 95].
Традиционно ЛС считались пассивными коллекторами, обеспечивающими отток избытка интерстициальной жидкости из тканей, транспорт иммунных клеток и абсорбцию продуктов переваривания жиров в желудочно-кишечном тракте [103]. Также складывалось мнение, в т.ч. и среди практикующих врачей, что нарушения лимфотока встречаются нечасто и обычно проявляются в виде лимфедемы [109]. Однако к настоящему времени показано, что структурные или функциональные дефекты лимфатической сосудистой сети лежат или в основе развития некоторых заболеваний, или способствуют их прогрессированию. Состояния, в которые вовлечены ЛС, включают ожирение, болезнь Крона, атеросклероз, инфаркт миокарда, глаукому и ряд неврологических заболеваний (болезнь Альцгеймера, болезнь Паркинсона, инсульты, рассеянный склероз, а также возрастное снижение когнитивных функций) [28, 120]. Таким образом, в последние 10–15 лет выявлено множество новых функциональных ролей лимфатической сосудистой сети в здоровом организме и при развитии болезней, и есть все основания полагать, что подобные открытия продолжатся и в будущем [99].
СТРОЕНИЕ И ФУНКЦИИ ЛИМФАТИЧЕСКОЙ СОСУДИСТОЙ СЕТИ
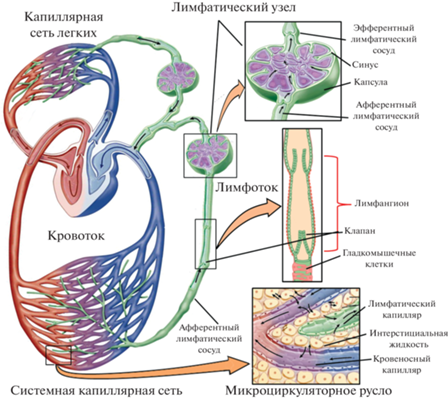
Гомеостаз интерстициальной жидкости у позвоночных в значительной степени определяется лимфатической системой, образующей сложную иерархическую сеть лимфатических капилляров (ЛК) и ЛС, элиминирующих из межклеточного пространства жидкость, макромолекулы и клетки (рис. 1).
Рис. 1.
Схема лимфатической системы. Жидкость из кровеносных капилляров поступает в интерстициальное пространство и в дальнейшем переходит под действием градиента гидростатического давления в лимфатические капилляры. Затем жидкость (лимфа) транспортируется лимфатическими сосудами в лимфатические узлы и в последующем поступает в лимфатические протоки, которые впадают в крупные вены шеи и таким образом возвращается в системный кровоток.
ОБРАЗОВАНИЕ И СОСТАВ ЛИМФЫ
В сосудах микроциркуляторного русла (МЦР) (в основном, в кровеносных капиллярах и посткапиллярных венулах) постоянно происходит утечка жидкости за пределы сосудистого русла. Объем плазмы, профильтрованной через стенку сосудов МЦР, определяется проницаемостью стенки капилляров и посткапиллярных венул и соотношением гидростатического и осмотического давлений, известном как уравнение Старлинга. Несмотря на то, что с течением времени уравнение Старлинга было несколько изменено и в него внесено много уточняющих дополнений, общие принципы закона остались неизменными: основной механизм образования интерстициальной жидкости – это преобладание фильтрации плазмы над реабсорбцией в сосудах МЦР [90].
ЛК располагаются в непосредственной близости от кровеносных капилляров и постоянная утечка плазмы из кровеносных сосудов МЦР создает градиент давления для формирования потока интерстициальной жидкости от кровеносных капилляров и венул к ЛК [18]. В органах, подвергающихся периодической компрессии (сердце, легкие, органы брюшной полости) функционирует дополнительный механизм лимфообразования – колебания гидростатического давления обеспечивают движение интерстициальной жидкости от кровеносных капилляров к лимфатическим [114]. Учитывая специфическое строение стенки ЛК, интерстициальная жидкость беспрепятственно поступает через открытые первичные лимфатические клапаны в просвет ЛК. Перемещение жидкости из интерстиция в ЛК по градиенту гидростатического давления, по-видимому, является основным механизмом образования лимфы. В дополнение к этому параклеточному пути поступления жидкости, в ЛЭК ЛК выражена экспрессия водного канала aquaporin-1, указывая на то, что трансцеллюлярный транспорт воды через стенку ЛК также может вносить вклад в образование лимфы [42]. Определенный вклад в лимфообразование вносит активный транспорт жидкости и веществ через ЛЭК, осуществляемый транспортными везикулами, переносящими различные вещества. В наибольшей степени этот механизм представлен в млечных сосудах микроворсинок тонкой кишки, где в ЛС поступает большое количество хиломикронов [38]. Физиологический резерв ЛК и ЛС для удаления выходящей в интерстиций плазмы в 10 раз превышает обычное количество плазмы, поступающей из сосудов МЦР, тем самым обеспечивая защиту тканей от развития отека даже в случаях, когда проницаемость микрососудов существенно повышена (например, при воспалении) [46].
Концентрация ионов в лимфе практически не отличается от таковой в плазме крови и интерстициальной жидкости. Аминокислоты, глюкоза и другие небольшие молекулы в лимфе также имеют концентрации, близкие к концентрации в плазме [22, 111]. В ЛУ концентрация белка в лимфе увеличивается, поскольку значительное количество воды из лимфы реабсорбируется в вены с высоким эндотелием [15]. Протеомический анализ лимфы показал, что состав белков в лимфе отличается от состава белков в плазме, в лимфе выявляются белки и пептиды, которых нет в плазме крови (белки, высвобождаемые клетками тканей в процессе их апоптоза или некроза, в т.ч. и продукты катаболизма органелл, а также белки экстраклеточного матрикса). Лимфатический протеом обеспечивает таким образом богатый источник пептидов для презентации аутоантигенов в дренирующих ЛУ и формирования аутотолерантности. В наибольшей степени протеом лимфы изменяется при патологических состояниях. Так, при моделировании септического перитонита у крыс в лимфе брыжеечных ЛС было обнаружено более 150 специфических белков и пептидов, которых не было у контрольных животных [113]. В лимфе, оттекающей от тонкого кишечника, содержится значительное количество липопротеинов, образованных из абсорбированных длинноцепочечных жирных кислот и холестерола. Большая часть липидов находится в виде хиломикронов и ЛПОНП (до 90%), а остальная часть – во фракциях ЛПВП и ЛПНП [117].
Афферентная лимфа содержит Т-лимфоциты (в основном CD4+), некоторое количество В-лимфоцитов и антигенпрезентирующие дендритные клетки (ДК). Основной популяцией клеточных элементов периферической лимфы являются лимфоциты – до 80–90% общего числа клеток. В лимфе, прошедшей через ЛУ, число лимфоцитов возрастает в сотни раз. При исследовании клеточного состава афферентной и эфферентной лимфы у овец было установлено, что с афферентной лимфой в ЛУ поступало 2–5 × × 105 кл./ч, при этом 85% из них составляли Т-лимфоциты, 5% – В-лимфоциты и 10% – ДК. Число клеток в эфферентной лимфе возрастало и составляло 2–5 × 107 кл./ч, из них Т-лимфоциты составляли 75%, а В-лимфоциты – 25%. При стимуляции ЛУ липополисахаридом количество лимфоцитов в лимфе увеличивалось в 10 раз [5, 85].
ДК – это важнейший группа клеток лимфы, они представляют собой гетерогенную популяцию клеток врожденного иммунитета, состоящую из клеток Лангерганса, видоизмененных моноцитов и плазмоцитоидных ДК. ДК участвуют как в поддержании толерантности к комменсальной микробиоте и компонентам пищи, так и в генерации защитных иммунных ответов против патогенов. ДК в значительных количествах присутствуют в тканях, в которых осуществляется контакт с большим количеством антигенов (кожа и слизистые оболочки). Все ДК способны захватывать, обрабатывать и представлять антигены наивным Т-лимфоцитам. После активации на периферии ДК мобилизуются и по ЛС поступают в дренирующие ЛУ. Внутри ЛУ ДК, несущие антигены, приобретенные на периферии, занимают стратегическое положение в стромальной сети ЛУ для сканирования наивными Т-клетками [13, 61]. ДК не только представляют антигены, но и передают важные сигналы компонентам стромы, которые необходимы для инициирования ремоделирования ЛУ в начале иммунного ответа, что приводит к значительному увеличению размеров ЛУ [6]. ДК не выходят из ЛУ с эфферентной лимфой, они накапливаются и погибают в паренхиме ЛУ [49].
ЛИМФАТИЧЕСКИЕ КАПИЛЛЯРЫ
Начинается лимфатическая сосудистая сеть с дистально расположенных многочисленных ЛК, имеющих большую площадь и служащих местом образования лимфы. В большинстве органов и тканей ЛК имеют общие черты: они представляют собой сосуды диаметром 10–200 мкм с закрытыми с одной стороны концами. ЛК обычно не имеют базальной мембраны и состоят из одного слоя черепицеобразно расположенных ЛЭК, имеющих форму “дубовых листьев” (рис. 2). ЛЭК в ЛК перекрывают друг друга, перекрывающиеся части клеток соединены только в отдельных местах специализированными структурами, называемыми “кнопками”. Между кнопками имеются неприкрепленные участки мембраны ЛЭК, важность которых заключается в том, что они способствуют одностороннему движению жидкости и клеток, т.е. являются первичными лимфатическими клапанами, через которые жидкость по градиенту давления поступает из интерстициального пространства в просвет ЛК [12]. Через эти же структуры осуществляется трансмиграция иммунных клеток из интерстиция в просвет ЛК [55, 59]. Аблюминальная сторона ЛЭК фиксирована к экстраклеточному матриксу закрепляющими нитями (якорными филаментами) [44]. Якорные филаменты не позволяют ЛК спадаться и таким образом обеспечивают свободный поток жидкости через первичные клапаны, а при повышенном интерстициальном давлении (отек ткани) они растягивают ЛК и увеличивают просвет первичных клапанов [44, 123]. Когда гидростатическое давление жидкости внутри ЛК превышает давление межклеточной жидкости, фрагменты мембран ЛЭК в области первичных клапанов плотно прижимаются друг к другу, герметизируя первичные клапаны и лимфа не может выйти обратно в интерстиций [40, 41].
Рис. 2.
Лимфатический капилляр. Образован одним слоем ЛЭК, черепицеобразно перекрывающих друг друга. Определенные фрагменты мембран соседних ЛЭК не прикреплены друг к другу и под действием градиента гидростатического давления отклоняются в просвет ЛК (первичный лимфатический клапан) и пропускают интерстициальную жидкость в ЛК (б, внизу). При повышении давления в ЛК клапан закрывается и не пропускает лимфу обратно (б, вверху). ЛЭК прикреплены к экстраклеточному матриксу якорными филаментами, что не позволяет ЛК спадаться при значительном повышении интерстициального давления (например, при отеке).

ЛИМФАТИЧЕСКИЕ ПОСТКАПИЛЛЯРЫ
Ряд авторов выделяет в лимфатической сосудистой сети группу сосудов, следующих за ЛК. Их называют лимфатическими посткапиллярами или преколлекторами [112]. Лимфатические посткапилляры так же, как и ЛК, имеют стенку, состоящую из одного слоя эндотелиальных клеток, но при этом они имеют вторичные лимфатические клапаны для предотвращения обратного оттока лимфы в ЛК. ЛЭК посткапилляров имеют более ромбическую форму, подобную эндотелиальным клеткам классических ЛС [132]. Поскольку в стенке лимфатических посткапилляров нет ГМК, движение лимфы по посткапиллярам сильно зависит от давлений в ЛК и первом лимфангионе [12].
ЛИМФАТИЧЕСКИЕ СОСУДЫ
Лимфатические посткапилляры переходят в ЛС, стенка которых, в отличие от посткапилляров, более толстая, имеет явно выраженный соединительнотканный каркас и гладкомышечные клети (ГМК). В мелких ЛС небольшое количество ГМК, которые расположены неупорядоченно. По мере увеличения просвета ЛС ГМК становится больше. Стенка ЛС состоит из трех оболочек: внутренней (интима), средней (медиа) и внешней (адвентиция) [30]. Интима представляет собой слой плотно уложенных эндотелиальных клеток, поддерживаемых субэндотелиальной соединительной тканью шириной до 5 мкм, переходящей в среднюю оболочку. Коллагеновые волокна базальной мембраны расположены продольно и переходят в субэндотелиальную пластинку и медию. Продольное расположение коллагеновых волокон позволяет ЛС значительно увеличивать свой диаметр даже при небольшом повышении давления в его просвете.
Медиа – это слой ГМК толщиной 25–70 мкм. Клетки сильно различаются по диаметру (от 1 до 10 мкм), и длине (от 40 до 200 мкм). ГМК плотно контактируют друг с другом, образуя нексусы (участки слияния мембран, через которые потенциалы действия распространяются с клетки на клетку). В клетках много митохондрий, разбросанных по всей цитоплазме. Коллагеновые волокна в медии также расположены преимущественно продольно. В мелких ЛС нет разделения ГМК на продольные и циркулярные пучки. В более крупных брыжеечных ЛС быка четко выражены три слоя ГМК: наружный и внутренний – преимущественно с продольной ориентацией ГМК и средний – с круговым расположением пучков ГМК [75, 96].
Главный компонент адвентиции – коллагеновые волокна, по большей части они расположены продольно, но некоторые идут наклонно и по окружности. Имеются также эластические волокна, ориентированные в разных направлениях. Соединительнотканные волокна адвентиции переходят, с одной стороны – в среднюю оболочку, с другой – в окружающую соединительную ткань. В стенке ЛС проходят многочисленные немиелинизированные нервные волокна, диаметр которых варьирует от 30 нм до 1 мкм.
Важными производными стенки ЛС являются вторичные клапаны, которые разделяют сосуд на отдельные структурно-функциональные единицы – лимфангионы (рис. 3) [23]. Клапаны чаще всего бывают двустворчатые, створки клапанов довольно толстые и способны выдержать давление в десятки см Н2О. Соединительнотканные волокна стенки ЛС переходят в створки клапанов, формируя выраженное основание створки, обладающее довольно высокой жесткостью, что исключает развитие клапанной недостаточности даже при высоких градиентах давления [76, 77]. Положение створок клапанов определяется градиентом давления и потоком жидкости по ЛС. Если давление на входе лимфангиона выше, то створки клапана открываются для обеспечения прямого потока, если давление на выходе выше, чем на входе, клапан закрывается, чтобы предотвратить обратный поток лимфы. Клапаны выполняют ряд важных функций: сводят к минимуму обратный отток лимфы, помогают уменьшить гравитационное влияние на давление в ЛС, разрывая гидростатический столб лимфы на множество маленьких отсеков (при отсутствии клапанов в ЛС стопы человека было бы очень высокое гидростатическое давление (более 120 см Н2О), и позволяют последовательно наращивать (лимфангион за лимфангионом) давление лимфы с целью преодоления любых возможных противоположных градиентов давления [77].
Рис. 3.
Схематическое строение лимфатического сосуда. Показаны основные элементы стенки лимфатического сосуда (в т.ч. и его структурно-функциональная единица – лимфангион с мышечной манжеткой и клапанами).

По мере слияния ЛС увеличиваются в диаметре и в дальнейшем впадают в региональные ЛУ. В узел обычно впадает несколько (до 12) пренодальных ЛС. Из узла выходят один–два крупных постнодальных ЛС, которые впадают в крупные лимфатические коллекторы или в следующие ЛУ. Лимфатические стволы и протоки имеют такую же структуру, как и пренодальные ЛС. Их стенка более толстая, в медии хорошо выражены три слоя ГМК, в среднем слое ГМК ориентированы циркулярно, а во внутреннем и наружном – продольно или по пологой спирали [61]. Лимфа от большей части тела по лимфатическим стволам поступает в грудной проток, лимфа из правой половины грудной клетки, правой руки, правой стороны головы и шеи – в правый лимфатический проток. Оба протока впадают в подключичные вены [2]. Таким образом, лимфа, образовавшаяся из интерстициальной жидкости (которая представляет собой фильтрат плазмы крови), возвращается в систему кровообращения (рис. 1).
ЛИМФАТИЧЕСКИЕ УЗЛЫ
ЛУ, будучи элементами лимфатической сосудистой системы и принимая участие в транспорте лимфы, одновременно являются важнейшими органами иммунной системы, ключевой функцией которых является формирование особого комплекса клеток, способного стимулировать взаимодействие между ДК и В- и Т-лимфоцитами и управлять гуморальными и клеточными иммунными ответами. ЛУ представляет собой своеобразный перекресток, созданный эволюцией для встречи ДК и антигенов, доставляемых лимфой, с лимфоцитами, рекрутированными в ЛУ из крови [97]. У человека насчитывается от 450 до 600 ЛУ, стратегически расположенных в определенных местах по всему телу [1, 2]. ЛУ представляют собой сложно организованные инкапсулированные органы, состоящие из стромы и паренхимы. Снаружи ЛУ покрыт капсулой, основу которой составляет соединительнотканный каркас с пучками ГМК, ориентированными в разных направлениях. Ультраструктура ГМК капсулы ЛУ принципиально не отличается от ультраструктуры миоцитов в ЛС: вытянутая клетка с центрально расположенным ядром, многочисленные митохондрии (подтверждающие способность клеток к высокой активности) располагаются в цитоплазме вблизи полюсов ядра. Между соседними клетками часто выявляются плотные контакты (нексусы), позволяющие быстро передавать возбуждение с клетки на клетку, что создает условия для функционирования ГМК капсулы ЛУ как единого целого [97].
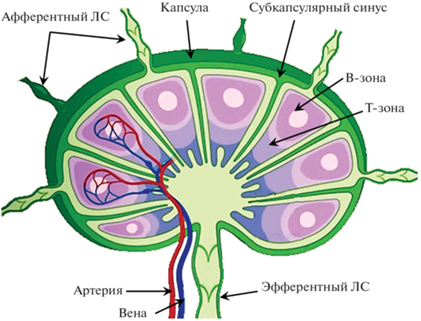
От капсулы внутрь ЛУ отходят трабекулы, к которым прикреплены стромальные клетки, формирующие трехмерную сеть, создающую каркас для размещения фолликулов и организации транспорта лимфы внутри ЛУ и путей миграции лимфоцитов. В строме принято выделять субкапсулярный синус (СС), синусы в глубокой коре, трабекулярные и медуллярные синусы (рис. 4). Губчатый каркас паренхимы узла состоит из коллагеновых и эластических волокон, к которым прикреплены ретикулярные клетки. Анатомически и функционально ЛУ включает 3 различные области (кору, паракортикальную зону и мозговое вещество), каждая из которых выполняет определенные функции в процессе инициации и развития иммунного ответа.
Синусы ЛУ заполнены эндотелиальными клетками (ЛЭК), образующими сложную трехмерную сеть. К ЛЭК на дне СС прикреплены многочисленные макрофаги (CD169+), которые настолько важны для развития иммунных реакций, что получили специальное название – макрофаги субкапсулярного синуса. С помощью технологий интравитальной визуализации и секвенирования установлено, что CC содержит разнообразные клетки врожденной и адаптивной памяти [83]. Макрофаги СС, ЛЭК и ретикулярные клетки создают на “дне” СС клеточно-молекулярный слой, который действует как барьер для проникновение патогена. Здесь же расположены врожденные эффекторные клетки и клетки памяти. Макрофаги СС предотвращают системное распространение патогена с лимфой, инициируя воспалительный иммунный ответ в субкапсулярном регионе ЛУ для привлечения и активации клеток врожденного и адаптивного иммунитета. Макрофаги СС CD169+ имеют множество выступов и отростков и стратегически расположены так, что их “головы” выступают в СС с целью контакта с антигеном в лимфе. Другие отростки макрофага проникают в фолликулы с В-лимфоцитами. Такая особенность позволяет им эффективно захватывать и переносить антиген через “дно” СС. Макрофаги СС представляют антигены наивным В-лимфоцитам, CD8+-Т-лимфоцитам и естественным Т-клеткам-киллерам для развития первичного ответа [19]. Макрофаги CC также продуцируют несколько цитокинов, в т.ч. различные виды интерферонов [68, 94].
Рядом с синусами проходят венулы c высоким эндотелием, через которые циркулирующие в крови лимфоциты попадают в паренхиму ЛУ. Высокий эндотелий венул экспрессирует большое количество аквапоринов-1, участвующих в абсорбции воды из лимфы в кровь. Поступающая в узел лимфа протекает по синусам ЛУ, а также может проникать в кору ЛУ через щели между эндотелиальными клетками на дне СС и в дальнейшем через фолликулы, контактируя с большим количеством лимфоцитов [68]. ЛЭК синусов ЛУ способны управлять органогенезом ЛУ. При развитии адаптивных иммунных реакций под влиянием ряда сигнальных молекул, продуцируемых ЛЭК ЛУ, происходит быстрое и обширное увеличение ЛУ. Объем и количество клеток в воспаленных ЛУ могут возрасти в 20 раз. При этом сохраняется сложная внутренняя структура органов, что свидетельствует о существовании механизмов, способных сбалансировать целостность ЛУ со структурной гибкостью [68].
МЕХАНИЗМЫ ТРАНСПОРТА ЛИМФЫ ПО ЛИМФАТИЧЕСКИМ СОСУДАМ И УЗЛАМ
Механизмы транспорта лимфы по ЛС принципиально отличаются от такового в сердечно-сосудистой системе. В лимфатической системе нет централизованного насоса, и продвижение лимфы от мест образования до места впадения лимфатических протоков в крупные вены шеи осуществляется сегментами ЛС – лимфангионами. Благодаря наличию клапанов ЛС разделены на множество отсеков и, как уже было описано выше, все ЛС представляют собой цепочки лимфангионов – структурно-функциональных единиц ЛС (рис. 1 и 3) [23, 133]. Подобное строение ЛС приводит к тому, что у стоящего человека в физиологических условиях в ЛС столб жидкости и, соответственно, создаваемое им давление, разделены клапанами на множество частей. Каждый из многих тысяч лимфангионов выполняет работу по перекачиванию лимфы только в следующий лимфангион. Экспериментальные данные in vitro показали, что для эффективного перемещения лимфы из одного лимфангиона в другой достаточно градиента давления в 0.5–1.5 см Н2О [77, 96, 133]. Позднее примерно такие же результаты были получены in vivo при исследовании лимфотока у крыс с помощью неинвазивной визуализации в ближнем инфракрасном диапазоне [108].
В зависимости от ткани, лимфангионы могут использовать для транспорта лимфы как внешние силы, так и внутреннюю. В органах, подвергающихся периодической компрессии (органы брюшной и грудной полостей, скелетные мышцы) поток лимфы по ЛС может обеспечиваться внешними силами. Периодическое повышение интерстициального давления сопровождается сдавлением лимфангиона, гидростатическое давление в нем повышается, что приводит к закрытию дистального клапана и открытию проксимального. В результате часть лимфы перемещается в следующий по ходу ЛС лимфангион. Этот механизм транспорта лимфы достаточно эффективен и обеспечивает значительный лимфоток, но имеет один серьезный недостаток – отсутствуют механизмы регуляции лимфотока, что при повышенном лимфообразовании на пике активности органа может приводить к замедлению оттока лимфы и накоплению интерстициальной жидкости в тканях.
Второй (важнейший) механизм лимфотока реализуется за счет внутренних сил – быстрых фазных сокращений лимфатических гладких мышц – собственный лимфатический насос [71]. Сужение лимфангиона, создаваемое синхронным сокращением ГМК, повышает внутрилимфатическое давление, что приводит к закрыванию дистального и открыванию проксимальнго клапанов лимфангиона и обеспечивает пульсирующее перемещение значительного объема лимфы (до 70% от конечнодиастолического объема лимфангиона) в проксимальный лимфангион. Таким образом реализуется основная функция ЛС – эффективно удалять из интерстициального пространства избыточное количество межклеточной жидкости, экстравазированные белков и липиды с целью поддержания гомеостаза ткани [71].
ГМК ЛС отличаются как от ГМК висцеральных органов, так и от ГМК артерий и вен. Они представляют собой уникальный фенотип, который является промежуточным между фенотипами сосудистых ГМК и сердечной мышцы. Скорость укорочения лимфатических ГМК находится в промежутке между скоростями укорочения сосудистых ГМК и кардиомиоцитов. Подобно сердечной мышце, ГМК ЛС экспрессируют сердечные изоформы актина и тропонина C, а также α-тропомиозин, характерный для поперечно-полосатых мышц [129]. Сократительные филаменты лимфатических ГМК высоко организованы, хотя и не имеют отчетливой поперечной исчерченности, характерной для кардиомиоцитов. Все вышеуказанные особенности ГМК ЛС имеют решающее значение для обеспечения относительно высокой скорости укорочения, что позволяет всем ГМК лимфангиона синхронно сокращаться, обеспечивая эффективное прокачивание лимфы и высокую фракцию выброса. При этом лимфатические ГМК демонстрируют также определенную схожесть с сосудистыми ГМК. В частности, реакция на растяжение ЛС сходна с реакциями артерий и вен. Общим является также механизм эндотелийзависимой релаксации [127]. Кроме того, ЛС, так же, как и кровеносные, способны изменять и поддерживать тонус. Механизмы, контролирующие тонус ЛС, имеют сходство с гладкой мускулатурой кровеносных сосудов, такие как активация киназы легкой цепи миозина путем повышения уровня цитоплазматического [Ca2+] в интервалах между фазными сокращениями.
Ритмические сокращения сегментов ЛС вызываются потенциалами действия (ПД), имеющими сложную конфигурацию и не менее сложную ионную природу [70]. Величина мембранного потенциала (МП) ГМК ЛС была измерена лишь в нескольких работах, полученные данные сильно отличаются (от –65 до –40 мВ) [125]. Практически во всех исследованных ЛС МП не был стабильным, в фазу расслабления наблюдалось медленное уменьшение МП (медленная диастолическая деполяризация (МДД) [14, 75]. При низком трансмуральном давлении, приближающемся к нулю, мембрана ГМК не растянута, МП ГМК максимален и держится постоянным. Небольшое увеличение давления в просвете лимфангиона (которое растягивает мембрану ГМК) приводит к появлению медленного деполяризующего тока. В условиях, максимально приближенным к физиологическим, так же, как в клетках синоатриального сердца, МП ГМК ЛС медленно уменьшается). МДД практически не зависит от активности нервных волокон и наличия эндотелия в стенке ЛС, т.е. этот процесс имеет миогенное происхождение [75, 128]. МДД уменьшает МП до критического уровня, в результате генерируется ПД сложной формы, напоминающий ПД кардиомиоцитов с хорошо выраженными фазами МДД, быстрой деполяризации, плато и быстрой реполяризации (рис. 5б) [70]. Механизм МДД недостаточно изучен. Полагают, что одной из причин является медленное высвобождение Ca2+ из внутриклеточных хранилищ с последующей активацией Ca2+-каналов мембраны ГМК и генерацией ПД [125]. Также имеются данные, свидетельствующие об участии в МДД Са2+-активируемого Cl–-тока [14]. Однако изменение скорости МДД при растяжении сегментов ЛС позволяет предположить наличие в мембране ГМК ЛС механочувствительных ионных каналов, активируемых растяжением. Доказательствами участия механочувствительных ионных каналов в формировании МДД является также факт прекращения спонтанной активности и стабилизация МП на максимальном уровне при снижении трансмурального давления до величин, близких к 0 (рис. 5а), а также возрастание скорости МДД при увеличении растяжения стенки ЛС (рис. 5б и 5в) [76].
Рис. 5.
Потенциалы действия (нижние кривые и фазные сокращения (верхние кривые)) ГМК брыжеечного ЛС быка. Синяя пунктирная линия – максимальный уровень мембранного потенциала при отсутствии растяжения препарата, коричневая пунктирная линия – уровень тонуса препарата при отсутствии растяжения. (а) – МП ГМК и тонус при отсутствии растяжения, (б) – ПД и фазное сокращение при растяжении, соответствующем трансмуральному давлению 4 см Н2О, (в) – ПД и фазное сокращение при растяжении, соответствующем трансмуральному давлению 10 см Н2О.
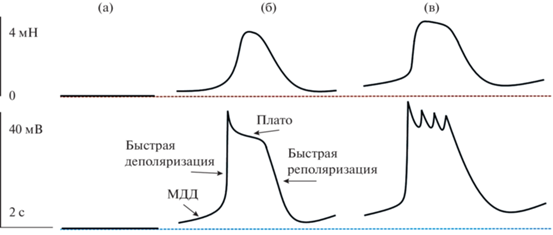
Важнейшей составляющей ПД ГМК ЛС является фаза плато, представляющая собой наиболее вариабельную часть ПД. При низком трансмуральном давлении плато имеет небольшую продолжительность, соответственно, фазное сокращение имеет низкую амплитуду и небольшую продолжительность. При повышении давления и увеличении растяжения ГМК длительность фазы плато ПД возрастает, при этом увеличиваются амплитуда и продолжительность фазного сокращения (рис. 5б и 5в). Более того, при значительном трансмуральном давлении на плато генерируются дополнительные пиковые потенциалы, появление которых также приводит к увеличению амплитуды и продолжительности фазных сокращений. В экспериментах с применением блокаторов Са2+- и К+-каналов было доказано, что фаза плато создается выходящим К+-током, при этом также имеет место входящий Са2+-ток. Установлено также, что пиковые потенциалы имеют Са2+-природу [70].
Вопрос о специализированных ГМК, выполняющих в лимфангионе функцию пейсмекеров, до конца не изучен. Результаты специально проведенной серии экспериментов на брыжеечных ЛС быка показали, что функцию пейсмекеров потенциально способны выполнять все ГМК лимфангиона. В стандартных условиях при исследовании целого лимфангиона была зарегистрирована максимальная частота фазных сокращений. При удалении клапанного участка в аналогичных экспериментальных условиях оставшаяся часть лимфангиона спонтанно сокращалась с меньшей частотой. При исследовании проксимальной части лимфангиона спонтанные сокращения имели наименьшую частоту. Подобный градиент автоматии (максимальная частота спонтанных сокращений в дистальной части лимфангиона и минимальная – в проксимальной) обусловлен различным строением стенки лимфангиона. В области клапанного синуса стенка тонкая, в ее составе больше эластина и меньше коллагена. Как следствие, эта часть лимфангиона при заполнении лимфой растягивается сильнее остальных. Растяжение ГМК активирует механочувствительные ионные каналы в мембране ГМК, что ведет к деполяризации и генерации ПД. Возникнув в этой области, ПД быстро распространяется по мио-миоцитарным контактам по всей мышечной массе лимфангиона и вызывает синхронное сокращение ГМК. ГМК других частей лимфангиона потенциально способны генерировать ПД, однако в естественных условиях они генерируют ПД с ритмом, навязанным ГМК клапанного синуса. Удаление клапанного синуса приводит к растормаживанию клеток, расположенных проксимальнее, и они начинают генерировать ПД в своем, более медленном ритме [76].
Лимфа, транспортируемая афферентными ЛС, поступает в ЛУ. В некоторых органах лимфа по пути следования к месту впадения грудного лимфатического протока в крупные вены шеи проходит через несколько ЛУ. Сложная организация ЛУ (синусы узлов имеют значительную протяженность и узкие просветы (20–60 мкм), они пронизаны многочисленными, проходящими в разных направлениях отростками эндотелиальных клеток), является причиной их высокого гидродинамического сопротивления. В работах лаборатории Ю.И. Бородина было показано, что кратковременное повышение давления в афферентном ЛС (близкое по величине и продолжительности к естественному увеличению давления при сокращении ЛС) в непосредственной близости от ЛУ не приводит к увеличению лимфотока в эфферентном ЛС [1]. Из этих данных был сделан вывод о том, что перемещение лимфы по синусам ЛУ от места впадения в ЛУ афферентных ЛС до эфферентного ЛС осуществляется за счет каких-то дополнительных сил. В нескольких работах были описаны вызванные и спонтанные сокращения ЛУ [53, 121], а в последующем они были изучены более детально [78, 79]. Было установлено, что капсула ЛУ обладает высокой растяжимостью, что значительно облегчает приток лимфы в ЛУ по афферентным ЛС. Расчеты показали, что последние лимфангионы афферентных ЛС, развивающие в процессе фазных сокращений достаточно высокоамплитудные колебания трансмурального давления, способны эффективно закачивать лимфу в ЛУ [83]. Дальнейшее медленное перемещение лимфы по синусам ЛУ осуществляется за счет фазных сокращений ГМК капсулы ЛУ. Фазные сокращения капсулы ЛУ приводят к волнообразному повышению трансмурального давления в ЛУ (до 5–7 см Н2О). Волны повышенного давления в ЛУ имеют большую продолжительность (до 70 с), что, несмотря на относительно невысокие подъемы внутриузлового давления, обеспечивает эффективное перемещение лимфы по синусам ЛУ от афферентных ЛС к воротам ЛУ (рис. 6) [83].
РЕГУЛЯЦИЯ АКТИВНОЙ ТРАНСПОРТНОЙ ФУНКЦИИ ЛИМФАТИЧЕСКИХ СОСУДОВ И УЗЛОВ
Количество лимфы, оттекающей от органов и тканей, определяется интенсивностью метаболизма и может существенно изменяться. Так, в физиологических условиях при возрастании скорости метаболизма в тканях увеличивается кровоток, соответственно повышается количество профильтрованной в интерстициальное пространство плазмы и увеличивается количество образующейся лимфы. При воспалении проницаемость кровеносных сосудов МЦР значительно повышается, что приводит к увеличению количества профильтрованной плазмы и, соответственно, к значительному увеличению объема лимфы. Чтобы поддерживать жидкостный гомеостаз ткани и обеспечивать отток необходимого количества лимфы, ЛС должны одновременно выполнять по меньшей мере две функции: функцию коллекторов и функцию активных насосов. Данные, полученные в разных лабораториях, показывают, что ЛС способны контролировать как тонус (медленные, длительные сокращения), которые изменяют сопротивление потоку, так и быстрые фазные сокращения, способствующие продвижению лимфы в центрипетальном направлении. В процессе эволюции сформировалось несколько регуляторных механизмов, позволяющих поддерживать оптимальную гидратацию тканей посредством изменения лимфооттока от них.
Основным механизмом регуляции лимфотока является миогенный (ауторегуляция). При исследовании насосной функции ЛС было показано, что по мере заполнения сосудов жидкостью увеличивается их диаметр и возрастает амплитуда сокращений, приводя к возрастанию систолического объема лимфангиона [76, 128]. Одновременно возрастает и частота фазных сокращений. В результате существенно увеличивается минутный объем лимфангиона, являющийся показателем его эффективности как микронасоса. При исследовании брыжеечных ЛС быка диаметром 1.5 мм было показано, что фазная сократительная активность начинает проявляться при трансмуральном давлении 0.6 см Н2О, при этом частота сокращений низкая и минутный объем лимфангиона минимален. По мере повышения давления минутный объем лимфангиона возрастает как за счет увеличения систолического объема, так и частоты фазных сокращений, максимальная производительность лимфангиона наблюдается при трансмуральном давлении 8–10 см Н2О (что в 5–6 раз превышает давление в физиологических условиях – резерв лимфооттока). Дальнейшее повышение давления сопровождается снижением минутного объема лимфангиона в основном за счет уменьшения систолического объема, частота фазных сокращений при этом остается высокой [76, 77]. Подобные изменения параметров фазных сокращений ГМК лимфангиона наблюдаются также в деэндотелизированных ЛС (исключалась эндотелийзависимая регуляция) и на фоне применения тетродотоксина (блокировалось проведение возбуждения по нервным волокнам), что свидетельствует о миогенном характере регуляции, т.е. ПД ЛС не только запускают фазные сокращения ГМК, но и управляют их параметрами – амплитудой и длительностью (рис. 3) [83]. По мере увеличения растяжения стенки лимфангиона (и входящих в ее состав ГМК) возрастает длительность фазы плато ПД. Поскольку фаза плато ПД обусловлена входом в ГМК Са2+, длительное плато способствует повышению концентрации цитозольного Са2+ и дополнительной активации сократительного аппарата ГМК, что приводит к увеличению амплитуды и длительности фазных сокращений, возрастанию систолического давления и систолического объема лимфангиона. С учетом повышения частоты фазных сокращений под действием растяжения значительно возрастает минутный объем лимфангиона [71, 76].
Не менее важной представляется и эндотелийзависимая регуляция сокращений ЛС. Параметры фазных сокращений и тонус гладких мышц ЛС изменяются под действием веществ, продуцируемых ЛЭК при действии механических стимулов (растяжение, увеличение линейной скорости лимфотока), а также химических факторов, образующихся в ткани или приносимых в ткань с кровью (агонисты α-адренергических рецепторов, простаноиды, натрийуретический фактор, брадикинин, гистамин, вещество P и др.) [39, 62, 81]. Эндотелиальные клетки ЛС продуцируют разнообразные химические вещества, в т.ч. и важнейший регуляторный фактор – оксид азота (NO). Его роль в регуляции частоты и амплитуды фазных сокращений ЛС быка показана во многих работах [39, 78]. Ингибирование эндотелиальной NO-синтазы сопровождается повышением тонуса и гидродинамического сопротивления ЛС, а также увеличением частоты фазных сокращений. Роль NO в регуляции сократительной функции ЛС показана также при исследовании брыжеечных ЛС морской свинки [63]. Было установлено, что введенный в омывающий раствор ацетилхолин приводит к выделению эндотелиоцитами NO, который замедляет МДД мембраны ГМК и вызывает урежение ПД и ритма сокращений. Такие же данные были получены и в других исследованиях [16]. Механизм действия NO на ГМК ЛС идентичен таковому в артериях: NO стимулирует растворимую гуанилатциклазу в ГМК, что приводит к образованию цГМФ, открыванию АТФ-чувствительных К+-каналов, гиперполяризации мембраны ГМК и их расслаблению.
Вторая группа веществ, продуцируемых эндотелиальными клетками при химической стимуляции и при воспалении – простаноиды. В ряде случаев это простагландины, обладающие констрикторным эффектом на ГМК, но чаще – вазодилатирующие [62]. В последние годы показано, что при некоторых воздействиях эндотелиоциты ЛС продуцируют вещества, обладающие способностью гиперполяризовать ГМК ЛС, что приводит к их расслаблению [74]. Имеются данные, что одним из таких веществ может быть сероводород (H2S) [73].
Другие виды регуляции сократительной функции ЛС. Сократительная функция ГМК ЛС, лежащая в основе их транспортной функции, подвержена многоконтурной регуляции. Помимо описанных выше миогенной и эндотелийзависимой регуляции, на ЛС также оказывают выраженное влияние биологические субстанции, образующиеся в физиологических условиях в окружающих ЛС тканях (в особенности – в тучных клетках: гистамин, гепарин, серотонин) [81], а также, синтезируемые различными клетками при воспалении (интерфероны, интерлейкины и др. цитокины) [124]. Модулирующий эффект на сократительную функцию ЛС оказывают и некоторые гормоны, доставляемые кровью из других тканей, в частности – глюкокотикоиды [82].
Определенное влияние на лимфоток оказывает и нервная система. В стенке ЛС ноги человека обнаружены многочисленные нервные волокна, большая часть которых является катехоламинергическими, а в некоторых нервных окончаниях был идентифицирован нейропептид Y [31]. На мембране ГМК ЛС мыши и человека были обнаружены α1- и α2-адренорецепторы, избирательная стимуляция которых вызывала разнонаправленные эффекты [10, 80, 119]. В стенке ЛС человека и морской свинки были обнаружены также холинергические волокна [10, 31]. Было установлено, что дилатация ЛС при действии АХ зависит от эндотелия и опосредовано продукцией эндотелиальными клетками NO [26]. Анализ данных исследований по иннервации ЛС и эффектов при стимуляции нервных волокон и окончаний свидетельствует, что функциональный вклад всех вышеуказанных видов иннервации в регуляцию лимфотока, по-видимому, относительно невелик по сравнению с внутренними миогенным и эндотелийзависимым механизмами, контролирующими лимфоток [26, 83].
Как уже указывалось выше, ЛУ с их редкими, но длительными и высокоамплитудными сокращениями капсулы, обеспечивают продвижение лимфы по многочисленным синусам ЛУ в сторону ворот. Было установлено, что активный транспорт лимфы по ЛУ модулируется несколькими механизмами. Основным видом регуляции в ЛУ так же, как и в ЛС, является миогенная регуляция (ауторегуляция), реализуемая за счет высокой механочувствительности ГМК капсулы ЛУ: чем больше растяжение ГМК (до определенных пределов), тем большая сила развивается ими в процессе сокращения [79]. При этом также возрастает и продолжительность фазных сокращений. Подобный механизм ауторегуляции позволяет изменять параметры активной транспортной функцию ЛУ в соответствии с объемом лимфы, поступающей по афферентным ЛС [83]. Частота, амплитуда и длительность фазных сокращений ГМК капсулы ЛУ модулируется также химическими веществами, продуцируемыми многочисленными эндотелиальными клетками субкапсулярного синуса ЛУ (NO, простагландины, эндотелиальный гиперполяризующий фактор) [72, 83]. Установлено также, что важным модулятором сократительной функции ГМК капсулы ЛУ является H2S, образующийся в эндотелиоцитах и ГМК как в физиологических условиях [72], так и при воспалении [3]. Важную роль в модуляции сократительной функции ГМК капсулы ЛУ играют также местные факторы. Продуцируемые клетками окружающих тканей (и в частности многочисленными тучными клетками, окружающими ЛУ) физиологически активные вещества (гепарин, гистамин, брадикинин) изменяют параметры сократительной функции ГМК капсулы ЛУ [81]. При воспалении в модуляции активной транспортной функции ЛУ принимают различные цитокины, как приносимые с поступающей лимфой, так и образующиеся непосредственно в тканях ЛУ [82].
В ЛУ найдены нервные волокна, которые, по мнению ряда исследователей, являются норадренергическими. Некоторые волокна демонстрируют тесную связь с фолликулами В-клеток и группами дендритных клеток, что доказывает тесную связь вегетативной нервной системы с иммунной системой [52]. Нервные волокна, входящие в капсулу ЛУ, модулируют сократительную функцию ГМК капсулы. Химическая природа медиаторов, выделяемых в нервных окончаниях, до настоящего времени недостаточно изучена. Доказано наличие на мембране ГМК капсулы ЛУ α-адренорецепторов [53, 80]. Имеющиеся данные позволяют предположить, что нервные волокна в капсуле ЛУ выполняют преимущественно трофическую функцию, оказывая при этом слабое и кратковременное влияние на сократительную функцию ГМК капсулы.
ФУНКЦИИ ЛИМФАТИЧЕСКОЙ СОСУДИСТОЙ СЕТИ ПРИ НЕКОТОРЫХ ВИДАХ ПАТОЛОГИИ
Традиционно многие годы превалировало мнение, что ЛС являются пассивными коллекторами для транспорта жидкости и иммунных клеток, абсорбции продуктов переваривания жиров в желудочно-кишечном тракте и служат каналами для метастазирования опухолей [64, 98]. В последние годы эти традиционные представления о ЛС были существенно дополнены. Было установлено, что нарушения функций лимфатической сосудистой системы наблюдаются при многих заболеваниях. Ниже в сжатом виде представлена информация о традиционных видах патологии ЛС и о новых, недавно выявленных нарушениях функции ЛС при некоторых широко распространенных заболеваниях человека.
ТРАДИЦИОННЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ С УЧАСТИЕМ ЛИМФАТИЧЕСКИХ СОСУДОВ И УЗЛОВ
Лимфедема
Лимфедема представляет собой хронический прогрессирующий отек ткани, возникающий в результате нарушения оттока лимфы и задержки жидкости в интерстициальном пространстве. В мире зарегистрировано более 200 млн пациентов с лимфедемой. В зависимости от этиологии выделяют первичную и вторичную лимфедему.
Первичная лимфедема
Первичная лимфедема встречается относительно редко, ее распространенность составляет 1 случай на 100 000 человек, обычно развивается в детстве, но также может проявиться в любом возрасте [45]. Первичная лимфедема имеет генетическое происхождение, хотя некоторые авторы более осторожны и предлагают говорить о генетической предрасположенности к развитию лимфедемы. Одна разновидность первичной лимфедемы проявляется в виде аномально увеличенных ЛС, активная транспортная функция которых существенно нарушена (болезнь Мейнджа), вторая – характеризуется гипоплазией ЛС (болезнь Милроя). В обоих случаях транспорт лимфы нарушен, наблюдается лимфостаз, приводящий к отеку тканей и последующему фиброзу с накоплением подкожного жира. Сдавление кровеносных сосудов приводит к гипоперфузии и гипоксии тканей, что провоцирует развитие хронического воспаления и дальнейший реактивный фиброз тканей. В далеко зашедшей стадии этих заболеваний органы и конечности существенно деформируются, нарушается заживление ран и возрастает восприимчивость к инфекционным повреждениям тканей [45, 47]. К настоящему времени выявлено более двух десятков генов, дефекты которых лежат в основе развития первичной лимфедемы.
Вторичная лимфедема
Вторичная лимфедема встречается в 100 раз чаще первичной и возникает в результате повреждения лимфатической сосудистой сети вследствие различных патологических процессов (рецидивирующая инфекция, травма, хирургическое вмешательство, последствия злокачественных новообразований) [47]. В развитых странах среди пациентов с вторичной лимфедемой преобладают пациенты со злокачественными опухолями и пациенты, которым было проведено хирургическое лечение новообразований с лимфаденоэктомией [35]. Вторичная лимфедема поражает до 20% женщин, проходивших лечения рака груди, в т.ч. и методом лучевой терапии [126]. Причиной вторичной лимфедемы может быть также венозная гипертензия различной этиологии. В тропических странах причиной вторичной лимфедемы чаще всего является филяриатоз. Это заболевание вызывается нематодами, переносимыми комарами. Попав на кожу, личинки нематод проникают в ЛС, размножаются и блокируют лимфоток. Рецидивирующий целлюлит и рожа также могут приводить к повреждению ЛС кожи и вызывать одностороннюю лимфедему.
Радикальных методов лечения лимфедемы до настоящего времени не разработано. Как первичная, так и вторичная лимфедема являются хроническими, прогрессирующими заболеваниями, требующими пожизненного лечения. Однако некоторые доклинические исследования вселяют определенный оптимизм. Применение пролимфангиогенных факторов, таких как VEGF-C может быть положено в ближайшем будущем в основу альтернативного лечения вторичной лимфедемы [34].
Лимфатическая сосудистая сеть в иммунитете
Важнейшей функцией лимфатической системы является ее критическая роль в адаптивных иммунных ответах и обеспечении удаления из тканей чужеродных веществ и антигенов, способных повреждать ткань. В последние годы иммунологи рассматривают ЛС, в первую очередь, как информационную магистраль, постоянно доставляющую “отчет о состоянии ткани” к конкретным дренирующим ЛУ [21]. Хотя система ЛС длительное время считалась лишь проводящей системой, ответственной за поддержание баланса тканевой жидкости, в 70-х гг. ХХ века была признана ее иммунологическая функция. С тех пор понимание значимости лимфатического транспорта в доставке антигенов из периферических тканей, цитокинов и хемокинов, иммуномодулирующих частиц и иммунных клеток, способных модулировать иммунологическое микроокружение дренирующих ЛУ и влиять на адаптивный иммунный ответ множеством способов, значительно улучшилось. Новые данные показывают, что лимфатическая система может контролировать окончательный иммунный ответ несколькими способами, которые включают: 1) управление входом антигена и ДК в ЛК на периферии; 2) перемещение антигена и ДК по афферентным ЛС посредством их активной насосной функции; 3) обеспечение презентации антигена в ЛУ через сеть ЛЭК и стромальных клеток ЛУ и, 4) регулирования выхода лимфоцитов из ЛУ.
Доказано, что в организме важнейшим постоянным процессом является лимфодренаж аутоантигенов к ЛУ, что обеспечивает поддержание аутотолерантности. При отсутствии патогена прямое взаимодействие ЛЭК ЛК, ЛЭК ЛС и T-лимфоцитов и перенос антигена в ДК приводят к усилению апоптоза CD4+ T-лимфоцитов и нарушению активации CD8+ Т-лимфоцитов, что способствует толерантности. Эти механизмы подчеркивают способность ЛЭК действовать как негативный регулятор иммунного ответа посредством модуляции ДК. При воспалении транспорт экзоантигенов, ДК, цитокинов и хемокинов из поврежденной ткани управляет ремоделированием дренирующих ЛУ [110]. Во время воспаления ЛЭК продуцируют NO и некоторые другие факторы, которые регулируют пролиферацию Т-клеток. ЛЭК также активируют молекулы адгезии и молекулы главного комплекса гистосовместимости (MHC) [115]. Недавно также установлено, что после разрешения воспаления ЛЭК могут удерживать антигены в течение длительного времени (архивирование антигенов) и передавать их ДК, тем самым способствуя поддержанию иммунологической памяти [86].
Дальнейшие процессы, направленные на защиту от чужеродных антигенов, происходят в ЛУ, встроенных во все основные лимфатические пути. В эмбриогенезе в качестве основы многочисленных синусов ЛУ выступают ЛЭК ЛС, вокруг которых создается каркас из ретикулярных клеток, фибробластов и ГМК [24]. В ЛУ ЛЭК тесно взаимодействуют со стромальными клетками мезенхимального или эндотелиального происхождения. Именно стромальные клетки, а конкретно ретикулярные клетки Т-клеточной зоны (TРК), представляющие собой сократительные миофибробласты, формируют границы зоны Т-клеток и физически поддерживают миграцию лимфоцитов. ТРК также продуцируют множество хемокинов, регулирующих миграцию лимфоцитов в эту зону, а также их выживание и позиционирование в ЛУ [36]. ТРК выполняют также важнейшую функцию ремоделирования ЛУ при воспалении.
ЛЭК ЛУ осуществляют ряд важнейших функций, модулирующих иммунный ответ. В процессе созревания ЛЭК ЛУ проходят этапы специализации, в результате которой в ЛУ формируются до 6 фенотипов ЛЭК, играющих различную функциональную роль в разных регионах ЛУ [118]. В итоге ЛЭК в ЛУ служат не только выстилкой для каналов, по которым протекает лимфа, но скорее отвечают за модуляцию адаптивных иммунных ответов посредством захвата, презентации и архивирования антигена, а также за поддержание толерантности [86]. Антигенный груз, доставляемый лимфой в ЛУ, эффективно сортируется различными ЛЭК, расположенными на “полу” СС и субкапсулярными макрофагами и в последующем направляется в соответствии с градиентами хемокинов в разные локусы ЛУ в места наивысшей концентрации иммунных клеток [29]. ЛЭК, продуцируя определенные хемокины, привлекают в ЛУ нейтрофилы из крови, протекающей по венулам с высоким эндотелием. Нейтрофилы, накапливающиеся в реактивных ЛУ, играют важную роль в способности ЛУ сдерживать и инактивировать инфекционные агенты [118].
Ремоделирование ЛУ обычно происходит в несколько последовательных фаз. Оно инициируется увеличением афферентного потока лимфы с активированными ДК и поступлением медиаторов воспаления, таких как провоспалительные цитокины. Через активированные венулы с высоким эндотелием в паренхиму ЛУ входит большое количество лимфоцитов, что приводит к растяжению ретикулярной сети, а в последующем – к расширению стромальных отсеков и релаксации-растяжению капсулы ЛУ. Растяжение и пролиферация стромальных клеток индуцируются и поддерживаются различными цитокинами и хемокинами из очага воспаления и продуцируемыми ДК в ЛУ. Этот процесс длится на протяжении первой недели воспаления и особенно выражен в T- и B-клеточных областях [29].
Наивные лимфоциты попадают в ЛУ через венулы с высоким эндотелием. Другие иммунные клетки (ДК, Т-клетки памяти и эффекторные Т-клетки) проникают в ЛУ через афферентные ЛС. Рекрутирование лимфоцитов в ЛУ создает идеальную возможность их контактирования с ДК. Лимфоциты при входе в ткань ЛУ теряют с поверхности клетки рецептор S1P1, в результате чего они не могут выйти из ЛУ и длительно взаимодействуют с ДК. Через определенное время (иногда это продолжается до 96 часов) лимфоциты, поступающие в воротный синус, восстанавливают экспрессию S1P1 и могут покидать ЛУ в составе эфферентной лимфы. Затем они поступают в кровоток, рециркулируют и накапливаются предпочтительно в том органе, от которого оттекает лимфа, вызвавшая реакцию ЛУ. В отличие от Т-лимфоцитов, большинство ДК не могут покинуть ЛУ [60]. Это крайне важно – максимально удерживать в ЛУ клетки, которые сначала фагоцитировали или заразились инфекционным агентом в периферических тканях хозяина. Их быстрый выход из ЛУ мог бы способствовать распространению инфекции по всему организму. ДК, несущие антигены, также активируют молекулы, которые инициируют свертывание крови в окружающих капиллярах, предупреждая таким образом возможное распространение инфекции гематогенным путем [48].
Регресс стромального компартмента ЛУ совпадает по времени с разрешением периферического воспаления. Устранение патогенов на периферии и заживление поврежденных тканей уменьшают приток продуктов деградации микробов и медиаторов воспаления в дренирующие ЛУ, в результате чего резко возрастает апоптоз стромальных клеток. Количество мигрирующих ДК возвращается к гомеостатическому уровню. Поскольку ДК продуцируют критические медиаторы, необходимые для роста стромальных клеток, это способствует прекращению роста ЛУ и индукции инволюции. В это время резко снижается рекрутирование лимфоцитов, их число в ЛУ значительно уменьшается, что также приводит к апоптозу стромальных клеток. Процессу апоптоза стромальных клеток способствуют и резидентные макрофаги Т-зоны ЛУ. Эти макрофаги Т-зоны действуют как профессиональные мусорщики этого отсека, они очищают апоптотический мусор, образующийся в паренхиме LN, которого особенно много бывает после иммунного ответа [17].
Лимфатические сосуды и узлы при раке
Длительное время предполагалось, что ЛС играют только пассивную роль в метастазировании опухолей, выступая в роли каналов для перемещения опухолевых клеток. Однако за последние 20 лет в области биологии ЛС был достигнут значительный прогресс. Были получены данные, которые привели к признанию важной роли лимфатической сосудистой сети в способствовании метастазированию рака и к новым концепциям опухолевого лимфангиогенеза и лимфангиогенеза в ЛУ. Установлено, что метастазирование регулируется на нескольких уровнях от проникновения раковых клеток в ЛС до внедрения в дренирующие ЛУ [104]. Сóлидные опухоли обычно вызывают расширение окружающей лимфатической сети, при этом ЛС располагаются по краям опухоли. Поскольку внутри опухоли отсутствуют ЛС, давление интерстициальной жидкости в ней повышается, что ускоряет ее поток к ЛК, окружающим опухоль и усиливает лимфообразование. В составе интерстициальной жидкости в лимфу поступают различные химические вещества, образующиеся в опухоли. Повышенное интерстициальное давление внутри опухоли способствует механическому проникновению раковых клеток в ЛС на краю опухоли. Помимо пассивного перемещения, опосредованного интерстициальным потоком, раковые клетки также могут активно двигаться к ЛС и внедряться в них, используя градиенты некоторых хемокинов, продуцируемых ЛЭК [102]. Усиленное лимфообразование способствует повышению лимфотока от ткани с опухолью к дренирующим ЛУ. Кроме этого, полученные из опухоли VEGF-C и VEGF-D усиливают сокращения ЛС и потенциально увеличивают лимфоток [131].
Длительное время было непонятно, как раковые клетки могут заселить орган, наполненный иммунными клетками, и избежать разрушения. Лишь после открытия и изучения лимфангиогенных факторов стало понятно, что усиленный лимфангиогенез и расширение лимфатических синусов в дренирующих ЛУ происходят задолго до метастазирования опухоли [116]. Фундаментальные открытия последнего десятилетия показали, что опухоли вызывают образование специфической микросреды в отдаленных органах, которая способствует выживанию и росту опухолевых клеток до их прибытия в эти органы. Эту микросреду принято называть “дометастатической нишей”. Растворимые молекулы, секретируемые опухолью, играют решающую роль в подготовке отдаленных органов для образования дометастатических ниш de novo, тем самым подготавливая почву для метастазов. Эти первичные молекулярные компоненты опухоли включают секретируемые факторы опухоли и внеклеточные везикулы: экзосомы (диаметром 30–100 нм), микровезикулы (диаметром 100–1000 нм) и “большие онкосомы” (диаметром 1–10 мкм). Экзосомы содержат белки, мРНК, микроРНК, малые РНК и/или фрагменты ДНК и способствуют образованию дометастатической ниши, опосредуя связь между опухолевыми клетками и окружающими клеточными компонентами ЛУ [92]. Цитокины и хемокины, воспалительные факторы, продуцируемые опухолевыми клетками, также играют значимую роль в формировании дометастатической ниши. Комплекс тканевых структур, называемый дометастатической нишей, обеспечивает колонизацию опухолевых клеток, способствует метастазированию и характеризуется следующими признаками: воспаление, ангиогенез, сосудистая проницаемость, лимфангиогенез, органотропизм и перепрограммирование [65].
Среди компонентов, участвующих в образовании дометастатической ниши, в последние годы в клинике все большее внимание уделяется экзосомам. Преимуществами экзосом является их повсеместное присутствие, их особый профиль ДНК//РНК/белок и их наиболее эффективный перенос в клетки-мишени. Идентификация геномных профилей экзосом имеет большой потенциал для применения в качестве биомаркеров для раннего обнаружения опухоли. Выяснение точного биологического состава экзосом будет иметь решающее значение для определения их роли в развитии рака и, вероятно, поможет в разработке методов лечения. Потенциальное применение экзосом в качестве носителей лекарств для эффективной терапии рака, является перспективным направлением в биологии и медицине. Исследование молекулярного груза экзосом позволит также контролировать эффект противоопухолевой терапии.
НОВЫЕ ФУНКЦИИ ЛИМФАТИЧЕСКОЙ СОСУДИСТОЙ СЕТИ
Исследования последних десятилетий изменили наши общепринятые взгляды на роль ЛС в физиологических условиях и при патологии, позволили выявить важную роль лимфатической сосудистой сети в некоторых нормальных и патологических процессах, о чем не было известно ранее. Состояния, в которые вовлечены ЛС, включают ожирение, болезнь Крона, сердечно-сосудистые и неврологические заболевания. Эти новые данные свидетельствуют о том, что при широком спектре заболеваний человека неожиданно выявляются морфологические или функциональные дефекты лимфатической сосудистой сети и новые знания в этой области будут способствовать развитию новых методов диагностики и терапии.
Ожирение
В настоящее время считается, что развитию ожирения способствуют не только чрезмерное потребления пищи и (или) низкая физическая активность, но и ряд других факторов. Ожирение само по себе не представляет особой опасности, но является ключевым фактором риска метаболических и сердечно-сосудистых заболеваний, включая диабет 2 типа, гипертоническую болезнь, ишемическую болезнь сердца и инсульт [8].
В отличие от большинства питательных веществ, всасываемых кровеносными сосудами, всасывание жиров и жирорастворимых витаминов осуществляется особыми лимфатическими капиллярами тонкой кишки (млечными сосудами). У млекопитающих триглицериды и жирорастворимые витамины упаковываются в энтероцитах в хиломикроны, которые поступают в млечные сосуды. Последние транспортируют их к собирающим ЛС стенки тонкой кишки. В дальнейшем лимфа с продуктами всасывания пищевых жиров поступает по брыжеечным ЛС к ЛУ и далее в грудной проток [28].
Совсем недавно появились доказательства, указывающие на то, что между ЛС и жировой тканью возникает перекрестное взаимодействие и что лимфатическая функция связана с метаболическими заболеваниями и ожирением. Первоначальные данные, подтверждающие существование взаимосвязи между дефектными ЛС и ожирением, были предоставлены на моделях мышей с лимфатическими дефектами. У взрослых мышей, гетерозиготных по Prox1 (Prox1+/–) и характеризующихся чрезмерным накоплением жира, выявлены дефектные ЛС, через стенку которых из ЛС лимфа просачивается в окружающие ткани, при этом в максимальной степени протекание выявляется в брыжеечных ЛС. Эта модель и ряд других привели к предположению, что аномальная утечка лимфы из ЛС способствует гипертрофии адипоцитов и/или адипогенезу в окружающих тканях. Представляется интересным отметить, что лимфа этих мышей способствовала адипогенезу in vitro, а выявленный адипогенный фактор в лимфе был идентифицирован как липид [37]. Эти исследования предоставили убедительные экспериментальные результаты, которые показали связь нарушений функции ЛС с ожирением. Одновременно было показано, что у мышей с ожирением лимфатическая дисфункция характеризуется не только протеканием лимфы из ЛС, но и пониженной насосной способностью ЛС. Установлено, что одних диетических изменений недостаточно, чтобы вызвать лимфатическую дисфункцию, и что эта лимфатическая дисфункция в основном вызвана воспалением, спровоцированным ожирением [43].
Было установлено также, что жировая ткань людей с ожирением содержит больше насыщенных жирных кислот, которые могут не только способствовать воспалению, но и отвечать за дефекты ЛС, приводящие к утечке лимфы и ожирению [37]. Полученные экспериментальные данные о том, что лимфа может вызывать адипогенез, согласуется с клиническими исследованиями, которые демонстрируют, что вторичная лимфедема вызывает локальное накопление жира в пораженной ткани [27].
Таким образом, растущее количество данных свидетельствует о том, что утечка свободных жирных кислот из протекающих ЛС может вызвать дифференциацию адипоцитов и ожирение и представляет собой новый фактор риска ожирения. Это также означает, что ожирение может регулироваться локальным накоплением факторов, высвобождаемых лимфатической сосудистой сетью. Эти данные могут способствовать разработке эффективных терапевтических средств, направленных на обеспечение целостности лимфатического эндотелия и предотвращение высвобождения адипогенных факторов из ЛС как профилактику ожирения.
БОЛЕЗНЬ КРОНА
Болезнь Крона (БК) – воспалительное заболевание кишечника, которое обычно поражает терминальную часть тонкой кишки. Хотя патофизиология БК остается неизвестной, изменения в ЛС кишечника являются общепризнанным признаком БК [106]. Усиленный лимфангиогенез, лимфангиэктазия и застой лимфоцитов в ЛС являются важнейшими признаками БК. Недавно было высказано предположение, что жирные кислоты, высвобождаемые из адипоцитов и из протекающих ЛС у пациентов с БК, непосредственно изменяют метаболическое состояние мышечных клеток в наружной мышечной оболочке кишечника, что приводит к пролиферации и фиброзу мышц в стенке кишки, вызывая тем самым стриктуры [107]. Лимфатические дефекты и утечка жира в брыжейку связаны с воспалительной реакцией и приводят к накоплению жира, ожирению и прогрессированию патологических изменений кишечника. Полагают, что такие дефекты связаны с нарушением плотности соединений ЛЭК в брыжеечных ЛС [50].
В физиологических условиях млечные сосуды реагируют на высокие уровни VEGF-A уплотнением соединений ЛЭК, что не позволяет хиломикронам выходить за пределы ЛС. При БК складывается ситуация, когда утечка жира в брыжейку стимулирует воспаление, а воспаление, в свою очередь активирует лимфангиогенез. При этом, несмотря на возрастание плотности ЛС у пациентов с БК, эти ЛС оказываются дефектными, так что они не могут способствовать эффективному дренированию и разрешению воспаления. Учитывая адипогенные свойства лимфы и роль воспаления в разрастании жировой ткани, можно предположить, что именно хроническая утечка лимфы при БК способствует образованию так называемого “ползучего жира”. Механизмы развития БК похожи на механизмы развития ожирения, однако в последнем случае соединения ЛЭК в млечных сосудах остаются нормальными и воспалительный процесс проявляется слабее.
Накопление в настоящее время новых данных о роли лимфатической сосудистой сети как фактора, способствующего развитию БК, приведет к более детальной характеристике этих сосудов у пациентов с БК, что, возможно, позволит в будущем рекомендовать стимулирование роста ЛС у этих пациентов на ранних стадиях развития болезни.
СЕРДЕЧНО-СОСУДИСТЫЕ ЗАБОЛЕВАНИЯ
В последние 15 лет были открыты основные гены, ответственные за развитие и фукнционирование ЛС, разработаны методы визуализации функции ЛС и ее количественной оценки и установлена важность лимфатической сосудистой сети в патогенезе сердечно-сосудистых заболеваний, включая гипертоническую болезнь, атеросклероз и инфаркт миокарда.
Атеросклероз
Атеросклероз характеризуется появлением бляшек, содержащих жир, холестерин и иммунные клетки внутри стенки артерий. Развитие бляшек приводит к сужению просвета артерий и жесткости их стенки, ограничивая таким образом кровоток. Атеросклероз часто приводит к развитию инфаркта миокарда и инсульту – основным причинам смертности во всем мире. Установлено, что в атеросклеротических участках адвентициального слоя артерий имеются ЛС, расположенные рядом с кровеносными (vasa vasorum) [25]. В одной из недавних работ на мышиных моделях показано, что ЛС являются основным путем транспортировки холестерина из стенки артерий в кровоток (обратный транспорт холестерина) [93]. В этих моделях было установлено, что нарушение функций ЛС серьезно ослабляет обратный транспорт холестерина, в то время как стимуляция лимфангиогенеза снижает содержание холестерина в стенке артерий [91]. Было показано также, что плотность ЛС в стенке артерий человека и мыши с атеросклеротическими поражениями, увеличивается по мере прогрессирования бляшек. Кроме того, блокирование при атеросклерозе лимфатического дренажа или ингибирование VEGFR-3-зависимого лимфангиогенеза усугубляет образование атеросклеротических бляшек и увеличивает толщину интимы артерий. Эти результаты доказывают, что периадвентициальные ЛС играют важную роль в ограничении накопления холестерина и воспалительных изменений бляшек при атеросклерозе [105]. Дальнейшие исследования покажут, возможно ли терапевтически стимулировать лимфангиогенез в стенках артерий и замедлить отложение холестерина и воспалительный процесс, обеспечивая тем самым защиту людей от атеросклероза
Инфаркт миокарда
Инфаркт миокарда (ИМ) – наиболее частое повреждение сердца, представляет собой опасное для жизни состояние, которое возникает при резком ограничении кровотока в сердце, обычно в результате закупорки коронарных артерий. Результатом гипоперфузии миокарда является гибель большого количества кардиомиоцитов, некроз с последующим образованием фиброзной ткани и ремоделированием, что в конечном итоге приводит к развитию сердечной недостаточности. ИМ обычно сопровождается отеком. Многие сердечно-сосудистые заболевания, в т.ч. и ИМ со временем сопровождаются изменениями функций лимфатической системы [25]. Недавние исследования показали, что ослабление лимфотока в сердце способствуют отеку миокарда и что ИМ является пусковым механизмом для образования новых сердечных ЛС [57]. Также установлено, что усиление лимфангиогенеза сопровождается улучшением систолической функции сердца после ИМ, способствуя разрешению отека миокарда и воспаления.
На моделях ИМ грызунов и при введении микросфер установлено, что применение белка VEGFC-C156S (активатор лимфангиогенеза) улучшало баланс жидкости в миокарде, уменьшало воспаление и в определенной степени восстанавливало функцию миокарда. Во время ИМ ранний неолимфангиогенез важен для рекрутирования в область инфаркта лейкоцитов и макрофагов, а также для удаления избытка интерстициальной жидкости, погибших клеток и клеточного детрита, что облегчает процесс заживления и ремоделирования. Устойчивый лимфангиогенез после инфаркта миокарда наблюдается также и у людей. Новообразованные ЛК и ЛС можно обнаружить в зоне инфаркта уже на второй неделе [69].
Сообщается, что наряду с VEGF-C и другие сигнальные факторы и пути также улучшают сердечную функцию после ИМ посредством лимфангиогенеза. Например, сверхэкспрессия гена, кодирующего у мышей синтез адреномедуллина, о котором ранее сообщалось, что он необходим для правильного развития сердечно-сосудистой и лимфатической систем, увеличивает плотность и калибр ЛС в сердце после ИМ, улучшает сердечную функцию и уменьшает отек миокарда [122]. В некоторых работах задокументировано, что стимуляция лимфангиогенеза после ИМ приводила к значительному возрастанию притока моноцитов и активированных макрофагов, которые проявляли высокую фагоцитарную активность в области инфаркта, способствовали разрушению и удалению погибших клеток сердца и высвобождали хемокины, необходимые для ремоделирования сердца [51].
Таким образом, результаты этих исследований показывают, что стимуляция лимфангиогенеза при ИМ может быть ценным терапевтическим подходом для улучшения сердечной функции и предотвращения неблагоприятного ремоделирования сердца. Некоторые аспекты эффектов VEGF-C-индуцированного лимфангионеогеза еще предстоит изучить, но его положительные терапевтические эффекты, включающие улучшение клиренса жидкости и уменьшение отека, а также облегчение трансмиграции иммунных клеток через эндотелий дают основания надеяться на применение в будущем этого подхода в клинической практике.
НЕВРОЛОГИЧЕСКИЕ РАССТРОЙСТВА
Мозг – орган с высоким уровнем метаболизма, и продукты его жизнедеятельности необходимо быстро удалять. В отличие от других органов, мозг окружен несколькими оболочками, покрывающими его со всех сторон, и цереброспинальной жидкостью (ЦСЖ), которая заполняет желудочки мозга и пространства на его внешних поверхностях. ЦСЖ выполняет несколько функций, включая защиту от механических повреждений, амортизацию колебаний объема крови в черепе во время сердечного цикла и путь для удаления из мозга высокомолекулярных метаболитов. Количество ЦСЖ, производимой ежедневно у людей, составляет от 400 до 500 мл, но в любой момент времени только 150 мл ЦСЖ заполняют субарахноидальное пространство черепа и позвоночника, включая желудочки. ЦСЖ быстро реабсорбируется и заменяется у людей от 4 до 5 раз в сутки, при этом механизмы реабсорбции ЦСЖ недостаточно изучены и дискуссия по этому вопросу продолжается до настоящего времени [58].
В 2013 г. Iliff J.J. и Nedergaard M. выдвинули новую гипотезу о перемещении жидкостей в мозге. Эта гипотеза не представляет собой открытие ранее неизвестной анатомической структуры, а скорее демонстрирует новую функцию периваскулярных пространств Вирхова–Робина в мозге для обмена ЦСЖ и интерстициальной жидкости, которая обеспечивает эффективное удаление растворенных веществ и метаболитов из мозга. Суть гипотезы заключается в том, что периваскулярные пространства в головном мозге представляют собой систему, эквивалентную лимфатической системе. Авторы назвали эти структуры глимфатической системой, подчеркивая факт объединения в мозге глиальной и лимфатической систем [95]. Их гипотеза сводится к следующему: 1) ЦСЖ вырабатывается эпителиальными клетками сосудистого сплетения желудочков мозга и циркулирует в субарахноидальном пространстве; 2) ЦСЖ по периартериальным пространствам Вирхова–Робина паренхиматозных артерий стекает в паренхиму мозга, при этом движущей силой является пульсация артерий; 3) ЦСЖ попадает в интерстиций ткани мозга через водные каналы аквапорина-4 (AQP4) в отростках астроцитов, которые составляют внешнюю стенку периваскулярного пространства; 4) ЦСЖ, смешанная с интерстициальной жидкостью, захватывает метаболиты, белковые агрегаты и другие продукты жизнедеятельности клеток мозга и посредством конвективного механизма перемещается к мозговым венам и далее поступает в перивенозное пространство; 5) жидкость, поступившая в перивенозное пространство затем выводится в ЦСЖ, при этом часть этой жидкости попадает в менингеальные ЛС твердой мозговой оболочки и далее в глубокие шейные ЛС.
Данная гипотеза подтверждена многочисленными экспериментальными данными. В частности, с помощью двухфотонной микроскопии показано, что крупномолекулярные индикаторы, вводимые в паренхиму мозга, через час обнаруживаются в периартериальном пространстве, а через 3 ч – в перивенозном [89]. В некоторых работах эта гипотеза отвергается, но, несмотря на противоречия, концепция глимфатической системы помогает исследователям лучше понять динамику жидкостей и транспорт метаболитов в мозге.
Болезнь Альцгеймера
Болезнь Альцгеймера (БА) – это тяжелое повреждение ЦНС, нейропатологически характеризующееся внеклеточным накоплением амилоида-β в форме бляшек и внутриклеточным накоплением гиперфосфорилированного тау белка [87]. Амилоид-β формирует амилоидные бляшки между клетками и нарушает таким образом движение интерстициальной жидкости в мозге. На модели мышей с нокаутом AQP4 показано, что клиренс введенного в мозг амилоида-β значительно замедляется. Это указывает на то, что глимфатическая система, включая водный канал AQP4, участвует в клиренсе амилоида-β. Накопление амилоида-β вызывает дисфункцию глимфатической системы, что приводит к дальнейшему его накоплению. Этот порочный круг способствует прогрессированию заболевания.
Несмотря на то, что имеется множество доказательств важнейшей роли глимфатической системы в паренхиматозном клиренсе амилоида-β и тау белка [54], сообщений о попытках оценки и стимуляции функции глимфатической системы у пациентов с БА немного. Требуются дополнительные исследования и получение доказательств безопасности предлагаемых методов. В то же время с целью профилактики БА у людей с семейным анамнезом раннего начала развития этого заболевания рекомендуется лечение с помощью VEGF-C для стимуляции развития ЛС с целью усиления лимфатического дренажа [32].
Болезнь Паркинсона
Болезнь Паркинсона (БП) характеризуется отчетливым набором клинических симптомов, включая как моторные, так и немоторные нарушения. Моторные нарушения проявляются в виде брадикинезии в сочетании с тремором покоя, мышечной ригидностью и постуральной неустойчивостью [56], в то время как немоторные симптомы обычно включают когнитивную дисфункцию и нарушения сна [11]. Основной причиной развития БП служит накопление в межклеточном пространстве α-синуклеина, при этом структуры мозга с высокими концентрациями дофаминергических синапсов, включая черную субстанцию, демонстрируют повышенную уязвимость к накоплению α-синуклеина [7].
В различных исследованиях показано, что сон выполняет защитную функцию в мозге, особенно в отношении крупных белков, обладающих токсическими свойствами. Глимфатическая система работает естественным образом во время сна, в это время интерстициальное пространство в мозге расширяется, и возросшие потоки ЦСЖ и интерстициальной жидкости через паренхиму головного мозга очищают мозг от естественно накопившихся отходов (в т.ч. и от α-синуклеина) путем вымывания в ЦСЖ и ЛС [26, 54]. Существует мнение, что нарушение сна приводит к ослаблению транспортной функции глимфатической системы, что сопровождается накоплением α-синуклеина, а последнее в еще большей степени ингибирует потоки жидкости в паренхиме мозга.
Менингеальные ЛС также играют определенную роль в развитии БП, что подтверждается в экспериментах, когда у мышей лигировали менингеальные ЛС и это значительно ухудшало потоки жидкости в паренхиме мозга [32]. Эти данные позволяют рассматривать менингеальные ЛС в качестве терапевтической мишени при лечении неврологических расстройств, связанных с накоплением/агрегацией α-синуклеина и других белков. Исследователи сходятся во мнении, что следует развивать неинвазивные методы визуализации мозга у людей с БП, поскольку идентификация in vivo биомаркеров функционировании глимфатической системы может улучшить клиническую диагностику и лечение этого тяжелого заболевания.
ЗАКЛЮЧЕНИЕ
Открытия последних лет значительно улучшают наши представления о физиологии и патологии лимфатической системы. Недавние достижения в области исследований лимфатической системы показали, что даже небольшие и малозаметные изменения функций лимфатической сосудистой сети могут запускать патологические процессы, приводящие к тяжелым сердечно-сосудистым и неврологическим заболеваниям. С другой стороны, установлена роль ЛС в восстановлении миокарда после инфаркта, а также в ограничении формирования атеросклеротических бляшек в артериях. Есть основания надеяться, что темпы исследований лимфатической системы в ближайшем будущем не ослабнут, а наоборот, будут нарастать. Новые методы, используемые при изучении лимфатической системы (генетически модифицированные мыши, новые молекулярные инструменты и др.) позволяют более детально раскрывать роль ЛС в обеспечении гомеостаза тканей в физиологических условиях и их функции при разного рода патологии.
Детальное изучение тонких механизмов транспорта лимфы, включая насосную функцию лимфангионов, функции клапанов, роль местных сигналов в стимуляции или ингибировании лимфотока остается и должно оставаться в будущем приоритетом в исследованиях лимфатической системы специалистами разного профиля (физиологами, иммунологами, молекулярными биологами, микробиологами и др.). Успехи недавних лет позволяют надеяться на разработку в ближайшее время новых стратегий и новых фармакологических препаратов для лечения патологических изменений ЛС. Перспективными направлениями являются использование экзосом при лечении рака, применение наночастиц, разработка методов доставки диагностических средств и лекарств непосредственно в ЛС, что позволит облегчить диагностику и улучшить способы лечения ряда патологий человека.
Список литературы
Бородин Ю.И., Григорьев В.Н. Лимфатический узел при циркуляторных нарушениях. Москва. Наука, 1986. 332 с.
Жданов Д.А. Общая анатомия и физиология лимфатической системы. Москва. Медгиз, 1952. 336 с.
Лобов Г.И. Роль сероводорода в релаксации капсулы лимфатических узлов при ЛПС-индуцированном воспалении // Росс. Физиол. Журн. им. И.М. Сеченова. 2021. Т. 107. № 11. С. 1372.
Лобов Г.И., Панькова М.Н. Транспорт лимфы по лимфатическим узлам: механизмы регуляции // Росс. физиол. Журн. им. И.М. Сеченова. 2012. Т. 98. № 11. С. 1350.
Цыб А.Ф., Е.Г. Кузьмина Е.Г. Дорошенко Л.Н. Сравнительный анализ некоторых показателей венозной крови и периферической лимфы у здоровых людей // Вестн. АМН СССР. 1989. № 12. С. 82.
Acton S.E., Reis e Sousa C. Dendritic cells in remodeling of lymph nodes during immune responses // Immunol. Rev. 2016. V. 271. № 1. 221. https://doi.org/10.1111/imr.12414.
Alberico S.L., Cassell M.D., Narayanan N.S. The vulnerable ventral tegmental area in Parkinson’s disease. Basal Ganglia // 2015. V. 5. P. 51. https://doi.org/10.1016/j.baga.2015.06.001.
Antoniak K., Hansdorfer-Korzon R., Mrugacz M., Zorena K. Adipose Tissue and Biological Factors. Possible Link between Lymphatic System Dysfunction and Obesity // Metabolites. 2021. V. 11. № 9. 617. https://doi.org/10.3390/metabo11090617.
Aspelund A., Antila S., Proulx S.T., Karlsen T.V., Karaman S., Detmar M., Wiig H., Alitalo K. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules // J. Exp. Med. 2015. V. 212. P. 991. https://doi.org/10.1084/jem.20142290
Bachmann S.B., Gsponer D., Montoya-Zegarra J.A., Schneider M., Scholkmann F., Tacconi C., Noerrelykke S.F., Proulx S.T., Detmar M.A. Distinct Role of the Autonomic Nervous System in Modulating the Function of Lymphatic Vessels under Physiological and Tumor-Draining Conditions // Cell Rep. 2019. V. 11. № 27. P. 3305. e13. https://doi.org/10.1016/j.celrep.2019.05.050
Balestrino R., Schapira A.H.V. Parkinson disease // Eur. J. Neurol. 2020. V. 27. № 1. P. 27. https://doi.org/10.1111/ene.14108.
Baluk P., Fuxe J., Hashizume H., Romano T., Lashnits E., Butz S., Vestweber D., Corada M., Molendini C., Dejana E., McDonald D.M. Functionally specialized junctions between endothelial cells of lymphatic vessels // J. Exp. Med. 2007. V. 204. P. 2349. https://doi.org/10.1084/jem.20062596.
Banchereau J., Steinman R.M. Dendritic cells and the control of immunity // Nature. 1998. V. 392. № 6673. P. 245. https://doi.org/10.1038/32588.
Beckett E.A.H., Hollywood M.A., Thornbury K.D., McHale N.G. Spontaneous electrical activity in sheep mesenteric lymphatics // Lymphat. Res. Biol. 2007. V. 5. № 1. P. 29. https://doi.org/10.1089/lrb.2007.5104.
Beh K.J., Watson D.L., Lascelles A.K. Concentrations of immunoglobulins and albumin in lymph collected from various regions of the body of the sheep // Aust. J. Exp. Biol. Med. Sci. 1974. V. 52. № 1. P. 81. https://doi.org/10.1038/icb.1974.6.
Behringer E.J., Scallan J.P., Jafarnejad M., Castorena-Gonzalez J.A., Zawieja S.D., Moore J.E. Jr., Davis M.J., Segal S.S. Calcium and electrical dynamics in lymphatic endothelium // J. Physiol. 2017. V. 595. № 24. P. 7347. https://doi.org/10.1113/JP274842.
Bellomo A., Gentek R., Bajénoff M., Baratin M. Lymph node macrophages: Scavengers, immune sentinels and trophic effectors // Cell Immunol. 2018. V. 330. P. 168. https://doi.org/10.1016/j.cellimm.2018.01.010.
Bert J.L., Reed R.K. Flow conductivity of rat dermis is determined by hydration // Biorheology. 1995. V. 32. № 1. P. 17. https://doi.org/10.3233/bir-1995-32102.
Boehm T., Hess I., Swann J.B. Evolution of lymphoid tissues // Trends Immunol. 2012. V. 33. № 6. P. 315. https://doi.org/10.1016/j.it.2012.02.005.
Boggon R.P., Palfrey A.J. The microscopic anatomy of human lymphatic trunks // J. Anat. 1973. V. 114. Pt. 3. P. 389.
Bogoslowski A., Kubes P. Lymph Nodes: The Unrecognized Barrier against Pathogens // ACS Infect. Dis. 2018. V. 4. № 8. P. 1158. https://doi.org/10.1021/acsinfecdis.8b00111.
Bohlen H.G., Unthank J.L. Rat intestinal lymph osmolarity during glucose and oleic acid absorption // Am. J. Physiol. 1989. V. 257. № 3. Pt. 1. P. G438. https://doi.org/10.1152/ajpgi.1989.257.3.G438.
Borisov A.V. Functional anatomy of lymphangion // Morfologiia. 2005. V. 128. № 6. P. 18. (in Russian).
Bovay E., Sabine A., Prat-Luri B., Kim S., Son K., Willrodt A.H., Olsson C., Halin C., Kiefer F., Betsholtz C., Jeon N.L., Luther S.A., Petrova T.V. Multiple roles of lymphatic vessels in peripheral lymph node development // J. Exp. Med. 2018. V. 215. № 11. P. 2760. https://doi.org/10.1084/jem.20180217.
Brakenhielm E., Alitalo K. Cardiac lymphatics in health and disease // Nat. Rev. Cardiol. 2019. V. 16. P. 56. https://doi.org/10.1038/s41569-018-0087-8.
Breslin J.W., Yang Y., Scallan J.P., Sweat R.S., Adderley S.P., Murfee W.L. Lymphatic Vessel Network Structure and Physiology // Compr. Physiol. 2018. V. 9 (1). P. 207–299.https://doi.org/10.1002/cphy.c180015.
Brorson H. Liposuction in Lymphedema Treatment // J. Reconstr. Microsurg. 2016. V. 32. P. 56. https://doi.org/10.1055/s-0035-1549158.
Cifarelli V., Eichmann A. The Intestinal Lymphatic System: Functions and Metabolic Implications // Cell Mol. Gastroenterol. Hepatol. 2019. V. 7. № 3. P. 503. https://doi.org/10.1016/j.jcmgh.2018.12.002.
Czepielewski R.S., Randolph G.J. Lymph nodes go with the flow // J. Exp. Med. 2018. V. 215. № 11. P. 2699. https://doi.org/10.1084/jem.20181898.
D'Andrea V., Bianchi E., Taurone S., Mignini F., Cavallotti C., Artico M. Cholinergic innervation of human mesenteric lymphatic vessels // Folia Morphol. (Warsz). 2013. V. 72. № 4. P. 322. https://doi.org/10.5603/fm.2013.0054.
D’Andrea V., Panarese A., Taurone S., Coppola L., Cavallotti C., Artico M. Human lymphatic mesenteric vessels: morphology and possible function of aminergic and NPY-ergic nerve fibers // Lymphat. Res. Biol. 2015. V. 13. № 3. P. 170. https://doi.org/10.1089/lrb.2015.0018.
Da Mesquita S., Louveau A., Vaccari A., Smirnov I., Cornelison R.C., Kingsmore K.M., Contarino C., Onengut-Gumuscu S., Farber E., Raper D. Functional aspects of meningeal lymphatics in ageing and Alzheimer’s disease // Nature. 2018. V. 560. P. 185. https://doi.org/10.1038/s41586-018-0368-8.
Dasoveanu D.C., Shipman W.D, Chia J.J., Chyou S., Lu T.T. Regulation of Lymph Node Vascular-Stromal Compartment by Dendritic Cells // Trends Immunol. 2016. V. 37. № 11. P. 764. https://doi.org/10.1016/j.it.2016.08.013.
Dayan J.H., Ly C.L., Kataru R.P., Mehrara B.J. Lymphedema: Pathogenesis and Novel Therapies // Annu. Rev. Med. 2018. V. 69. P. 263. https://doi.org/10.1146/annurev-med-060116-022900.
Dessources K., Aviki E., Leitao M.M. Jr. Lower extremity lymphedema in patients with gynecologic malignancies // Int. J. Gynecol. Cancer. 2020. V. 30. № 2. P. 252. https://doi.org/10.1136/ijgc-2019-001032.
Eckert N., Permanyer M., Yu K., Werth K., Förster R. Chemokines and other mediators in the development and functional organization of lymph nodes // Immunol. Rev. 2019. V. 289. № 1. P. 62. https://doi.org/10.1111/imr.12746.
Escobedo N., Oliver G. The Lymphatic Vasculature: Its Role in Adipose Metabolism and Obesity // Cell Metab. 2017. V. 26. P. 598. https://doi.org/10.1016/j.cmet.2017.07.020.
Dixon J.B., Raghunathan S., Swartz M.A. A tissue-engineered model of the intestinal lacteal for evaluating lipid transport by lymphatics // Biotechnol. Bioeng. 2009. V. 103. № 6. P. 1224. https://doi.org/10.1002/bit.22337.
Ferguson M.K., De Filippi V.J. Nitric oxide and endothelium-dependent relaxation in tracheobronchial lymph vessels // Microvasc. Res. 1994. V. 47. № 3. P. 308. https://doi.org/10.1006/mvre.1994.1024.
Fischer M., Franzeck U.K., Herrig I., CostanzoU., Wen S., Schiesser M., Hoffmann U., Bollinger A. Flow velocity of single lymphatic capillaries in human skin // Am. J. Physiol. 1996. V. 270. № 1. Pt. 2. P. H358. https://doi.org/10.1152/ajpheart.1996.270.1.H358.
Galie P., Spilker R.L. A two-dimensional computational model of lymph transport across primary lymphatic valves // J. Biomech. Eng. 2009. V. 131:111004. https://doi.org/10.1115/1.3212108.
Gannon B.J., Carati C.J. Endothelial distribution of the membrane water channel molecule aquaporin-1: implications for tissue and lymph fluid physiology? // Lymphat. Res. Biol. 2003. V. 1. № 1. P. 55. https://doi.org/10.1089/15396850360495709.
Garcia Nores G.D., Cuzzone D.A., Albano N.J., Hespe G.E., Kataru R.P., Torrisi J.S., Gardenier J.C., Savetsky I.L., Aschen S.Z., Nitti M.D. Obesity but not high-fat diet impairs lymphatic function // Int. J. Obes. (Lond.). 2016. V. 40. P. 1582. https://doi.org/10.1038/ijo.2016.96.
Gerli R., Solito R., Weber E., Agliano M. Specific adhesion molecules bind anchoring filaments and endothelial cells in human skin initial lymphatics // Lymphology. 2000. V. 33. P. 148.
Grada A.A., Phillips T.J. Lymphedema: Pathophysiology and clinical manifestations // J. Am. Acad. Dermatol. 2017. V. 77. № 6. P. 1009. https://doi.org/10.1016/j.jaad.2017.03.022.
Granger H.J. Role of the interstitial matrix and lymphatic pump in regulation of transcapillary fluid balance // Microvasc. Res. 1979. V. 18. P. 209. https://doi.org/10.1016/0026-2862(79)90029-3.
Greene A.K., Slavin S.A., Brorson H., Håkan B. Lymphedema: Presentation, Diagnosis, and Treatment. Cham. Switzerland: Springer. 2015. 353 p. https://doi.org/10.1007/978-3-319-14493-1.
Grover S.P., Mackman N. Tissue Factor: An Essential Mediator of Hemostasis and Trigger of Thrombosis // Arterioscler. Thromb. Vasc. Biol. 2018. V. 38. P. 709. https://doi.org/10.1161/ATVBAHA.117.309846.
Haig D.M., Hopkins J., Miller H.R. Local immune responses in afferent and efferent lymph // Immunology. 1999. V. 96. № 2. P. 155. https://doi.org/10.1046/j.1365-2567.1999.00681.x.
Harvey N.L., Srinivasan R.S., Dillard M.E., Johnson N.C., Witte M.H., Boyd K., Sleeman M.W., Oliver G. Lymphatic vascular defects promoted by Prox1 haploinsufficiency cause adult-onset obesity // Nat. Genet. 2005. V. 37. P. 1072. https://doi.org/10.1038/ng1642.
Henri O., Pouehe C., Houssari M., Galas L., Nicol L., Edwards-Lévy F., Henry J.P., Dumesnil A., Boukhalfa I., Banquet S., Schapman D., Thuillez C., Richard V., Mulder P., Brakenhielm E. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction // Circulation. 2016. V. 133. № 15. P. 1484. https://doi.org/10.1161/CIRCULATIONAHA.115.020143.
Hu D., Nicholls P.K., Claus M., Wu Y., Shi Z., Greene W.K., Ma B. Immunofluorescence characterization of innervation and nerve-immune cell interactions in mouse lymph nodes // Eur. J. Histochem. 2019. V. 63. № 4. P. 3059. https://doi.org/10.4081/ejh.2019.3059.
Hughes G.A., Allen J.M. Neural modulation of bovine mesenteric lymph node contraction // Exp. Physiol. 1993. V. 78. № 5. P. 663. https://doi.org/10.1113/expphysiol.1993.sp003714.
Iliff J.J., Wang M., Liao Y., Plogg B.A., Peng W., Gundersen G.A., Benveniste H., Vates G.E., Deane R., Goldman S.A., Nagelhus E.A., Nedergaard M. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β // Sci. Transl. Med. 2012. V. 4. 147ra111. https://doi.org/10.1126/scitranslmed.3003748.
Jackson D.G. Leucocyte trafficking via the lymphatic vasculature- mechanisms and consequences // Front. Immunol. 2019. V. 10. P. 471. https://doi.org/10.3389/fimmu.2019.00471.
Jankovic J. Parkinson’s disease: Clinical features and diagnosis // J. Neurol. Neurosurg. Psychiatry. 2008. V. 79. P. 368. https://doi.org/10.1136/jnnp.2007.131045.
Ji R.C. The role of lymphangiogenesis in cardiovascular diseases and heart transplantation // Heart Fail. Rev. 2021. https://doi.org/10.1007/s10741-021-10188-5.
Johanson C.E., Duncan J.A. 3rd, Klinge P.M., Brinker T., Stopa E.G., Silverberg G.D. Multiplicity of cerebrospinal fluid functions: new challenges in health and disease // Cerebrospinal Fluid Res. 2008. V. 5.10. https://doi.org/10.1186/1743-8454-5-10.
Johnson L.A., Banerji S., Lawrance W., Gileadi U., Prota G., Holder K.A. Dendritic cells enter lymph vessels by hyaluronan-mediated docking to the endothelial receptor LYVE-1 // Nat. Immunol. 2017. V. 18. P. 762. https://doi.org/10.1038/ni.3750.
Johnson L.A., Jackson D.G. Hyaluronan and Its Receptors: Key Mediators of Immune Cell Entry and Trafficking in the Lymphatic System // Cells. 2021. V. 10. № 8. P. 2061. https://doi.org/10.3390/cells10082061.
Katakai T., Hara T., Lee J-H., Gonda H., Sugai M., Shimizu A. A novel reticular stromal structure in lymph node cortex: an immuno-platform for interactions among dendritic cells, T cells and B cells // Int. Immunol. 2004. V. 16. P. 1133. https://doi.org/10.1093/intimm/dxh113.
Koller A., Mizuno R., Kaley G. Flow reduces the amplitude and increases the frequency of lymphatic vasomotion: role of endothelial prostanoids // Am. J. Physiol. 1999. V. 277. № 6. P. R1683. https://doi.org/10.1152/ajpregu.1999.277.6.R1683.
Leak L.V., Cadet J.L., Griffin C.P., Richardson K. Nitric oxide production by lymphatic endothelial cells in vitro // Biochem. Biophys. Res. Commun. 1995. V. 217. № 1. P. 96. https://doi.org/10.1006/bbrc.1995.2750.
Leclers D., Durand K., Dutour A., Barrière G., Monteil J., Rigaud M., Sturtz F. Lymphatic vessels and cancer // Med. Sci. (Paris). 2005. V. 21. № 10. P. 839. https://doi.org/10.1051/medsci/20052110839.
Lee W., Ko S.Y., Mohamed M.S., Kenny H.A., Lengyel E., Naora H. Neutrophils facilitate ovarian cancer premetastatic niche formation in the omentum // J. Exp. Med. 2019. V. 216. P. 176. https://doi.org/10.1084/jem.20181170.
Levick J.R., Michel C.C. Microvascular fluid exchange and the revised Starling principle // Cardiovasc. Res. 2010. V. 87. P. 198. https://doi.org/10.1093/cvr/cvq062.
Ling S., Lin H., Liang L., Xu J., Xu C., Zhao W., Liu Z. Development of new lymphatic vessels in alkali-burned corneas // Acta Ophthalmol. 2009. V. 87. P. 315. https://doi.org/10.1111/j.1755-3768.2008.01349.x
Liu Y., Xia Y., Qiu C.H. Functions of CD169 positive macrophages in human diseases (Review) // Biomed. Rep. 2021. V. 14. № 2. P. 26. https://doi.org/10.3892/br.2020.1402.
Liu X., De la Cruz E., Gu X., Balint L., Oxendine-Burns M., Terrones T., Ma W., Kuo H.H., Lantz C., Bansal T., Thorp E., Burridge P., Jakus Z., Herz J., Cleaver O., Torres M., Oliver G. Lymphoangiocrine signals promote cardiac growth and repair // Nature. 2020. V. 588. № 7839. P. 705. https://doi.org/10.1038/s41586-020-2998-x
Lobov G.I. Electrophysiological properties of the smooth muscle cell membrane in lymphatic vessels // Doklady Biol. Sciences. 1984. T. 277. № 1–6. C. 499.
Lobov G.I. The Rheological Properties of the Large Lymphatic Vessels // Fiziol. Zh. SSSR Im. I. M. Sechenova. 1990. V. 76. № 3. P. 371. (in Russian].
Lobov G.I. Relaxing Effect of Hydrogen Sulfide on Isolated Bovine Mesenteric Lymph Nodes // Bull Exp. Biol Med. 2020. V. 169. № 2. P. 192. https://doi.org/10.1007/s10517-020-04848-z
Lobov G.I. The Role of Hydrogen Sulfide in the Dilatation of Mesenteric Lymphatic Vessels in Bulls // Bull. Exp. Biol. Med. 2020. V. 169. № 3. P. 302. https://doi.org/10.1007/s10517-020-04874-x
Lobov G.I., Dvoretskii D.P. Endothelium-dependent hyperpolarization-mediated relaxation pathway in bovine mesenteric lymph nodes // Dokl. Biol. Sci. 2019. V. 484. № 1. P. 10. https://doi.org/10.1134/S001249661901006X.
Lobov G.I., Orlov R.S. Electrical and contractile activity of the lymphangions of the mesenteric lymphatic vessels // Fiziol. Zh. SSSR Im. I.M. Sechenova. 1983. V. 69. 12. P. 1614. (in Russian).
Lobov G.I., Orlov R.S. Self-regulation of the pump function of the lymphangion // Fiziol. Zh. SSSR Im. I.M. Sechenova. 1988. V. 74. № 7. P. 977. (in Russian).
Lobov G.I., Orlov R.S., Kostikova M.A. Active and passive mechanical properties of the wall of the lymphangion // Fiziol. Zh. SSSR Im. I.M. Sechenova. 1989. V. 75. № 2. P. 218. (in Russian).
Lobov G.I., Pan’kova M.N. NO-dependent Modulation of Contractile Function in Capsule of Lymph Nodes // Ross. Fiziol. Zh. Im. I. M. Sechenova. 2010. V. 96. № 5. P. 489 (in Russian).
Lobov G.I., Pan’kova M.N., Dvoretsky D.P., Sergeev I.V. Characteristic of the active and passive mechanical properties of the lymph node capsule // Dokl. Biol. Sci. 2010. V. 434. P. 310. https://doi.org/10.1134/S0012496610050054.
Lobov G.I., Pan’kova M.N. Effects of stimulation of nervous fibres upon contractile activity of the tracheobronchial lymphatic node capsules' smooth muscles // Ross. Fiziol. Zh. Im. I. M. Sechenova. 2011. V. 97. № 11. P. 1215. (in Russian).
Lobov G.I., Pan’kova M.N. Effect of histamine on contractile activity of smooth muscles in bovine mesenteric lymph nodes // Bull. Exp. Biol. Med. 2012. V. 152. № 4. P. 406. https://doi.org/10.1007/s10517-012-1539-5.
Lobov G.I., Unt D.V. Protective effect of dexamethasone on lipopolysaccharide-induced inhibition of contractile function of isolated lymphatic vessels and nodes // Bull. Exp. Biol. Med. 2018. V. 165. № 5. P. 602. https://doi.org/10.1007/s10517-018-4222-7.
Lobov G.I., Nepiyushchikh Z.V. Structure and physiology of the lymphatic vasculature // Regional blood circulation and microcirculation. 2020. V. 19. № 3. P. 5–18. (in Russian.) https://doi.org/10.24884/1682-6655-2020-19-3-5-18
Louie D.A.P., Liao S. Lymph Node Subcapsular Sinus Macrophages as the Frontline of Lymphatic Immune Defense // Front. Immunol. 2019. V. 10. 347. https://doi.org/10.3389/fimmu.2019.00347.
Mackay C.R., Kimpton W.G., Brandon M.R., Cahill R.N. Lymphocyte subsets show marked differences in their distribution between blood and the afferent and efferent lymph of peripheral lymph nodes // J. Exp. Med. 1988. V. 167. № 6. P. 1755. https://doi.org/10.1084/jem.167.6.1755.
Maisel K., Sasso M.S., Potin L., Swartz M.A. Exploiting lymphatic vessels for immunomodulation: Rationale, opportunities, and challenges // Adv. Drug Deliv. Rev. 2017. V. 114. P. 43. https://doi.org/10.1016/j.addr.2017.07.005.
Matsuda H., Shigemoto Y., Sato N. Neuroimaging of Alzheimer’s disease: focus on amyloid and tau PET // Jpn. J. Radiol. 2019. V. 37. P. 735. https://doi.org/10.1007/s11604-019-00867-7.
Mestre H., Mori Y., Nedergaard M. The Brain’s Glymphatic System: Current Controversies // Trends Neurosci. 2020. V. 43. № 7. P. 458. https://doi.org/10.1016/j.tins.2020.04.003.
Mestre H., Hablitz L. M., Xavier A. L., Feng W., Zou W., Pu T. Aquaporin-4-dependent glymphatic solute transport in the rodent brain // eLife. 2018. 7. e40070. https://doi.org/10.7554/eLife.40070.
Michel C.C. Starling: the formulation of his hypothesis of microvascular fluid exchange and its significance after 100 years // Exp. Physiol. 1997. V. 82. P. 1. https://doi.org/10.1113/expphysiol.1997.sp004000.
Milasan A., Smaani A., Martel C. Early rescue of lymphatic function limits atherosclerosis progression in Ldlr(−/−) mice // Atherosclerosis. 2019. V. 283. P. 106. https://doi.org/10.1016/j.atherosclerosis.2019.01.031.
Minciacchi V.R., Freeman M.R., Di Vizio D. Extracellular vesicles in cancer: exosomes, microvesicles and the emerging role of large oncosomes // Semin. Cell. Dev. Biol. 2015. V. 40. P. 41. https://doi.org/10.1016/j.semcdb.2015.02.010.
Miyazaki T., Miyazaki A. Hypercholesterolemia and Lymphatic Defects: The Chicken or the Egg? // Front. Cardiovasc. Med. 2021. V. 23. № 8. 701229. https://doi.org/10.3389/fcvm.2021.701229.
Moran I., Grootveld A.K., Nguyen A., Phan T.G. Subcapsular Sinus Macrophages: The Seat of Innate and Adaptive Memory in Murine Lymph Nodes // Trends Immunol. 2019. V. 40. № 1. P. 35. https://doi.org/10.1016/j.it.2018.11.004.
Nedergaard M., Goldman S.A. Brain drain // Sci. Am. 2016. V. 314. № 3. P. 44. https://doi.org/10.1038/scientificamerican0316-44.
Ohhashi T., Azuma T., Sakaguchi M. Active and passive mechanical characteristics of bovine mesenteric lymphatics // Am. J. Physiol. 1980. V. 239. № 1. P. H88. https://doi.org/10.1152/ajpheart.1980.239.1.H88.
Ohtani O., Ohtani Y. Structure and function of rat lymph nodes // Arch. Histol. Cytol. 2008. V. 71. № 2. P. 69–76. https://doi.org/10.1679/aohc.71.69.
Oliver G., Alitalo K. The lymphatic vasculature: recent progress and paradigms // Annu. Rev. Cell. Dev. Biol. 2005. V. 21. P. 457–83. https://doi.org/10.1146/annurev.cellbio.21.012704.132338.
Oliver G., Kipnis J., Randolph G.J., Harvey N.L. The Lymphatic Vasculature in the 21(st) Century: Novel Functional Roles in Homeostasis and Disease // Cell. 2020. V. 182. № 2. P. 270. https://doi.org/10.1016/j.cell.2020.06.039.
Olszewski W.L., Sawicki Z. Radiological evidence of lymphatic drainage of bone marrow cavity in long bones // Lymphology. 1977. V. 10. P. 1.
Pan'kova M.N., Lobov G.I. Effect of Heparin on Contractile Activity of Lymph Node Capsule // Bull. Exp. Biol. Med. 2015. V. 159. № 5. P. 632. https://doi.org/10.1007/s10517-015-3033-3.
Paudyal R., LoCastro E., Reyngold M., Do R.K., Konar A.S., Oh J.H., Dave A., Yu K., Goodman K.A., Shukla-Dave A. Longitudinal Monitoring of Simulated Interstitial Fluid Pressure for Pancreatic Ductal Adenocarcinoma Patients Treated with Stereotactic Body Radiotherapy // Cancers (Basel). 2021. V. 13. № 17. 4319. https://doi.org/10.3390/cancers13174319.
Petrova T.V., Koh G.Y. Biological functions of lymphatic vessels // Science. 2020. V. 10. 369(6500):eaax4063. https://doi.org/10.1126/science.aax4063.
Podgrabinska S., Skobe M. Role of lymphatic vasculature in regional and distant metastases // Microvasc. Res. 2014. V. 95. P. 46. https://doi.org/10.1016/j.mvr.2014.07.004.
Rademakers T., van der Vorst E.P., Daissormont I.T., Otten J.J., Theodorou K., Theelen T.L., Gijbels M., Anisimov A., Nurmi H., Lindeman J.H. Adventitial lymphatic capillary expansion impacts on plaque T cell accumulation in atherosclerosis // Sci. Rep. 2017. V. 7. 45263. https://doi.org/10.1038/srep45263.
Rahier J.F., Dubuquoy L., Colombel J.F., Jouret-Mourin A., Delos M., Ferrante M., Sokol H., Hertogh G.D., Salleron J., Geboes K. Decreased lymphatic vessel density is associated with postoperative endoscopic recurrence in Crohn’s disease // Inflamm. Bowel. Dis. 2013. V. 19. P. 2084. https://doi.org/10.1097/MIB.0b013e3182971cec.
Randolph G.J., Bala S., Rahier J.F., Johnson M.W., Wang P.L., Nalbantoglu I., Dubuquoy L., Chau A., Pariente B., Kartheuser A. Lymphoid Aggregates Remodel Lymphatic Collecting Vessels that Serve Mesenteric Lymph Nodes in Crohn Disease // Am. J. Pathol. 2016. V. 186. P. 3066. https://doi.org/10.1016/j.ajpath.2016.07.026.
Razavi M.S., Nelson T.S., Nepiyushchikh Z., Gleason R.L., Dixon J.B. The relationship between lymphangion chain length and maximum pressure generation established through in vivo imaging and computational modeling // Am. J. Physiol. Heart Circ. Physiol. 2017. V. 313. № 6. P. H1249. https://doi.org/10.1152/ajpheart.00003.2017.
Rockson S.G. Lymphedema // Am. J. Med. 2001. V. 110. P. 288. https://doi.org/10.1016/s0002-9343(00)00727-0.
Rohner N.A., McClain J., Tuell S.L., Warner A., Smith B., Yun Y., Mohan A., Sushnitha M., Thomas S.N. Lymph node biophysical remodeling is associated with melanoma lymphatic drainage // FASEB J. 2015. V. 11. P. 4512. https://doi.org/10.1096/fj.15-274761.
Rutili G., Arfors K.E. Protein concentration in interstitial and lymphatic fluids from the subcutaneous tissue // Acta Physiol. Scand. 1977. V. 99. № 1. P. 1. https://doi.org/10.1111/j.1748-1716.1977.tb10345.x.
Sacchi G., Weber E., Aglianò M., Cavina N., Comparini L. Lymphatic vessels of the human heart: precollectors and collecting vessels. A morpho-structural study // J. Submicrosc. Cytol. Pathol. 1999. V. 31. № 4. P. 515.
Santambrogio L. The Lymphatic Fluid // Int. Rev. Cell Mol. Biol. 2018. V. 337. P. 111. https://doi.org/10.1016/bs.ircmb.2017.12.002.
Schmid-Schonbein G.W. Microlymphatics and lymph flow // Physiol. Rev. 1990. V. 70. № 4. P. 987. https://doi.org/10.1152/physrev.1990.70.4.987.
Sibler E., He Y., Ducoli L., Keller N., Fujimoto N., Dieterich L.C., Detmar M. Single-Cell Transcriptional Heterogeneity of Lymphatic Endothelial Cells in Normal and Inflamed Murine Lymph Nodes // Cells. 2021. V. 10. № 6. 1371. https://doi.org/10.3390/cells10061371.
Sleeman J.P. The lymph node pre-metastatic niche // J. Mol. Med. (Berl.). 2015. V. 93. P. 1173. https://doi.org/10.1007/s00109-015-1351-6.
Sloop C.H., Dory L., Roheim P.S. Interstitial fluid lipoproteins // J. Lipid Res. 1987. V. 28. № 3. P. 225.
Takeda A., Hollmen M., Dermadi D., Pan J., Brulois K.F., Kaukonen R., Lonnberg T., Bostrom P., Koskivuo I., Irjala H., Miyasaka M., Salmi M., Butcher E.C., Jalkanen S. Single-Cell Survey of Human Lymphatics Unveils Marked Endothelial Cell Heterogeneity and Mechanisms of Homing for Neutrophils // Immunity. 2019. V. 51. P. 561. e565. https://doi.org/10.1016/j.immuni.2019.06.027.
Telinius N., Baandrup U., Rumessen J., Pilegaard H., Hjortdal V., Aalkjaer C., Boedtkjer D.B. The human thoracic duct is functionally innervated by adrenergic nerves // Am. J. Physiol. Heart Circ. Physiol. 2014. V. 306. P. H206. https://doi.org/10.1152/ajpheart.00517.2013.
Thomas J.L., Jacob L., Boisserand L. Lymphatic system in central nervous system // Med. Sci (Paris). 2019. V. 35. № 1. P. 55. https://doi.org/10.1051/medsci/2018309.
Thornbury K.D., McHale N.G., Allen J.M., Hughes G. Nerve-mediated contractions of sheep mesenteric lymph node capsules // J. Physiol. 1990. V. 422. P. 513. https://doi.org/10.1113/jphysiol.1990.sp017998.
Trincot C.E., Xu W., Zhang H., Kulikauskas M.R., Caranasos T.G., Jensen B.C., Sabine A., Petrova T.V. Caron K.M. Adrenomedullin Induces Cardiac Lymphangiogenesis After Myocardial Infarction and Regulates Cardiac Edema Via Connexin 43 // Circ. Res. 2019. V. 124. P. 101. https://doi.org/10.1161/CIRCRESAHA.118.313835.
Trzewik J, Mallipattu S.K, Artmann G.M., Delano F.A., Schmid-Schönbein G. W. Evidence for a second valve system in lymphatics: endothelial microvalves // The FASEB J. 2001. V. 15. P. 1711. https://doi.org/10.1096/fj.01-0067com.
Unt D.V., Lobov G.I. Inhibitory effect of interferons on contractive activity of bovine mesenteric lymphatic vessels and nodes // Bull. Exp. Biol. Med. 2017. V. 164. № 2. P. 123. https://doi.org/10.1007/s10517-017-3939-z.
Van Helden D.F. Pacemaker potentials in lymphatic smooth muscle of the guinea-pig mesentery // J. Physiol. 1993. V. 471. P. 465. https://doi.org/10.1113/jphysiol.1993.sp019910
Vignes S. Lymphedema: From diagnosis to treatment // Rev. Med. Interne. 2017. V. 38. № 2. P. 97. https://doi.org/10.1016/j.revmed.2016.07.005.
von der Weid P.Y., Crowe M.J., Van Helden D.F. Endothelium-dependent modulation of pacemaking in lymphatic vessels of the guinea-pig mesentery // J. Physiol. 1996. V. 493. Pt 2. P. 563. https://doi.org/10.1113/jphysiol.1996.sp021404.
von der Weid P.Y., Zhao J., Van Helden D.F. Nitric oxide decreases pacemaker activity in lymphatic vessels of guinea pig mesentery // Am. J. Physiol. Heart Circ. Physiol. 2001. V. 280. № 6. P. H2707. https://doi.org/10.1152/ajpheart.2001.280.6.H2707.
von der Weid P.Y., Muthuchamy M. Regulatory mechanisms in lymphatic vessel contraction under normal and inflammatory conditions // Pathophysiology. 2010. V. 17. № 4. P. 263. https://doi.org/10.1016/j.pathophys.2009.10.005
Wong B.W., Zecchin A., García-Caballero M., Carmeliet P. Emerging Concepts in Organ-Specific Lymphatic Vessels and Metabolic Regulation of Lymphatic Development // Dev. Cell. 2018. V. 45. № 3. P. 289. https://doi.org/10.1016/j.devcel.2018.03.021.
Zhou H., Lei P.J., Padera T.P. Progression of Metastasis through Lymphatic System // Cells. 2021. V. 10. № 3. 627. https://doi.org/10.3390/cells10030627.
Zoltzer H. Morphology and Physiology of Lymphatic Endothelial Cells. In: Microvasculature Research: Biology and Pathology. Ed. by Shepro D., and D’Amore P.A. San Diego: Elsevier Academic Press. 2006. P. 535–544.
Zweifach B.W., Prather J.W. Micromanipulation of pressure in terminal lymphatics in the mesentery // Am. J. Physiol. 1975. V. 228. № 5. P. 1326. https://doi.org/10.1152/ajplegacy.1975.228.5.1326.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук