Успехи физиологических наук, 2023, T. 54, № 1, стр. 26-54
Витамины группы B: от гомеостаза к патогенезу и лечению рассеянного склероза
И. Н. Абдурасулова a, *, А. В. Дмитриев a, **
a ФГБНУ “Институт экспериментальной медицины”
197022 Санкт-Петербург, Россия
* E-mail: i_abdurasulova@mail.ru
** E-mail: admitriev10@yandex.ru
Поступила в редакцию 13.09.2022
После доработки 25.09.2022
Принята к публикации 27.09.2022
- EDN: GXFYBA
- DOI: 10.31857/S0301179823010034
Аннотация
Хорошо известно, что витамины являются необходимыми микронутриентами для нормального функционирования всех систем организма и должны поступать в достаточном количестве с пищей. Роль витаминов, продуцирумых кишечной микробиотой, для здоровья хозяина практически не определена. В обзоре рассматриваются свойства восьми водорастворимых витаминов группы B, их комплексные эффекты на функционирование нервной системы. Уделяется внимание малоизученному вопросу – синтезу витаминов группы В кишечной микробиотой и ее роли в дефиците витаминов в организме. Предполагается, что взаимосвязанные факторы – “западная диета”, измененный состав (дисбиоз) кишечной микробиоты и дефицит витаминов группы В вовлечены в патогенез рассеянного склероза, тяжелого аутоиммунного демиелинизирующего заболевания, поражающего людей трудоспособного возраста. Приводятся имеющиеся исследования по оценке уровня витаминов группы B у пациентов с рассеянным склерозом и применению высоких доз этих витаминов для лечения прогрессирующих форм рассеянного склероза. Кроме того, высказывается идея о возможности использования пробиотических бактерий-продуцентов витаминов группы B в терапии рассеянного склероза.
ВВЕДЕНИЕ
Витамины группы B – B1 (тиамин), B2 (рибофлавин), B3 (ниацин, никотинамид), B5 (пантотеновая кислота), B6 (пиридоксин), B7 (биотин), B9 (фолиевая кислота), B12 (кобаламин) представляют собой химически разнородную группу из восьми водорастворимых веществ, выполняющих в организме разнообразные функции. Они являются универсальными незаменимыми коферментами, используемыми во многих метаболических путях, включая жировой, углеводный, энергетический обмен, репарацию ДНК, а также участвуют в реакциях, важных для экспрессии генов (например, процессов метилирования), участвуют в обеспечении развития и функционирования нервной системы, иммунных функций [118].
Одной из особенностей витаминов группы В является взаимозависимость их коферментных функций, нередко несколько витаминов являются коферментами одних и тех же ферментных комплексов, либо обеспечивают ключевыми соединениями (аминокислоты, жирные кислоты, пиримидины) пересекающиеся метаболические пути, либо участвуют в биосинтезе и метаболизме друг друга. Например, для биосинтеза ниацина из триптофана, необходимы пиридоксаль, рибофлавин (кофакторы для специфических ферментов) и тиамин, при дефиците которых скорость реакции существенно замедляется [23, 213]. Витамин В2 участвует в метаболизме витаминов В9, B12, B6 и пр. [234]. В форме флавинадениндинуклеотида (FAD), витамин В2 является кофактором для метилентетрагидрофолат редуктазы (MTHFR), что свидетельствует о взаимодействиях между статусом рибофлавина и статусом фолиевой кислоты, которая участвует в процессах синтеза, репарации, метилирования ДНК [201].
Активные формы тиамина, рибофлавина, ниацина и пантотеновой кислоты являются важными коферментами в митохондриальном аэробном дыхании, цепи переноса электронов и в цикле Кребса, в результате чего образуется аденозинтрифосфат (АТP) [60, 61, 103]. При этом каждый из витаминов группы В выполняет различные нейроспецифические функции. Наиболее важной функцией тиамина является обеспечение нервных клеток энергией [222], рибофлавин защищает от окислительного стресса, особенно от перекисного окисления липидов, способствуя превращению глутатиона в восстановленную форму [17], ниацин участвует в окислительно-восстановительных реакциях и обеспечивает развитие и выживание нейронов [75], пантотеновая кислота выполняет метаболическую функцию, действуя в разнообразных ферментативных путях (окисление жирных кислот, катаболизм аминокислот, синтез нейромедиаторов, холестерина, стероидных гормонов и пр.) [118].
Регуляция обмена веществ и энергии, а также транспорт кислорода, осуществляемые витаминами группы В, особенно важны для деятельности мозга. Более 20% общих затрат энергии организма приходится на мозг, это – наиболее метаболически активный орган [182]. О важности витаминов группы В для функции мозга свидетельствует наличие специальных переносчиков для активного транспорта витаминов через гематоэнцефалический барьер и/или сосудистое сплетение, а также механизмов клеточного поглощения. Уровни витаминов группы В в мозге регулируются несколькими гомеостатическими механизмами, что гарантирует поддержание их сравнительно высоких концентраций [221]. Например, концентрация метилтетрагидрофолата (основной циркулирующей формы фолиевой кислоты) в головном мозге в четыре раза выше, чем в плазме [221], а биотина и пантотеновой кислоты – в 50 раз [221, 236].
При возникновении дефицита витаминов группы В появляются неврологические симптомы в виде “синдрома хронической усталости” (повышенная утомляемость, усталость, слабость, головокружение, раздражительность, бессонница), невропатий (онемение и покалывание в руках и ногах, нарушение походки, мышечная слабость), когнитивной дисфункции, снижении памяти, может развиться депрессия [13, 90, 155, 156].
За исключением витамина B3, человек, как и другие млекопитающие, не может синтезировать витамины группы B de novo, поэтому зависит от их экзогенного поступления. Хотя большинство витаминов синтезируется растениями, растительная пища не является единственным источником этих витаминов. В продуктах животного происхождения, включая мясо, молочные продукты и яйца также содержатся витамины группы В, причем иногда в формах, которые уже претерпели трансформацию до биологически активных форм. Как видно из табл. 1, различные витамины группы В содержатся в одних и тех же источниках пищи, таких как цельные зерна, листовые зеленые овощи, яйца, мясо и молоко.
Таблица 1.
Продукты, богатые витаминами группы B и бактерии, продуцирующие витамины группы B Table 1. B-vitamin-rich foods and B-vitamin-producing bacteria
| Витамин/ активная форма (ы) | Химическая и структурная формула | РСН для взрослых в России [7]/ВОЗ [249] | Продукты, богатые витамином | Обеспечение микро-биотой от РСН ВОЗ [140] | Основная функция | Транспортеры витаминов в толстой кишке/ кодирующий ген [237] | Связь витаминов группы B и кишечных бактерий | Примеры микробов-продуцентов* |
|---|---|---|---|---|---|---|---|---|
| Vitamin/active form(s) | Chemical and structural formula | RDA for adult in Russia [7]/ WHO [249] | Vitamin rich foods | Provision of microbiota from RDA WHO [140] | Main function | Colon vitamin transporters/coding gene [237] | Relationship between B vitamins and gut bacteria | Examples of producer microbes& |
| B1 – тиамин/ тиаминпирофосфат (TPP) | С12H17N4OS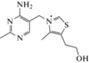 |
1.5 мг/ 1.1–1.2 мг | Свинина, говядина, печень, желтки яиц, тунец, скумбрия, сыры, зерна овса, гречи, ржи, риса, пшеницы, пивные дрожжи, орехи (особенно кедровые), бобовые растения, ржаной и пшеничный хлеб грубого помола | 2.3% | Кофактор для ферментов, участвующих в углеводном обмене: • транскетолаза; • пируватдегидрогеназа; • альфа-кетоглутарат-дегидрогеназа обеспечение энергией |
THTR1/SLC19A2 THTR2/SLC19A3 |
• тиазольный фрагмент витамина B1 бактерии синтезируют из глицина или тирозина и 1-дезокси-D-ксилулозо-5-фосфата,
пиримидиновый фрагмент – из 5-аминоимидазолрибонуклеотида, промежуточного звена пуринового
пути; • биосинтетические пути тиамина широко представлены в энтеротипе Prevotella; • необходим для роста Bаcteroides thetaiotaomicron in vitro |
Bacteroides fragilis, Prevotella copri, Lactobacillus casei, L. curvatus, L. fermenti, L. plantarum, L. helveticus, Ruminococcus lactaris, Bifidobacterium infantis, B. bifidum, B. longum, Streptococcus thermophilus, Fusobacterium varium, Clostridium difficile |
| B2 – рибофлавин/флавинмоно-нуклеотид (FMN), флавинаденин-динуклеотид (FAD) | C17H20N4O6 |
1.8 мг/ 1.0–1.3 мг | Яйца, печень, почки, молочные продукты, мясо, рыба, хлеб (из муки грубого помола), семена злаков, свежие зеленые овощи, бобовые, дрожжи, грибы |
2.8% | FAD и FMN – коферменыты во многих окислительно-восстановительных реакциях, действуют
как переносчики водорода, антиоксидантная активность |
RFVT3/SLC52A3 | • Синтезируется бактериями из гуанозинтрифосфата и D-рибулозо-5-фосфата; • добавление диетического рибофлавина увеличивает количество Faecalibacrium prausnitzii и Roseburia spp., уменьшает – Escherichia coli |
Bacteroides fragilis, Prevotella copri, Lactobacillus plantarum, L. fermentum, Lactococcus lactis, Ruminococcus lactaris, Roseburia intestinalis, Escherichia coli, Propionibacterium freudenreichii, Clostridium difficile, Citrobacter spp., Klebsiella spp., Bacillus subtilis |
| B3 – ниацин/ никотинамид-адениндинуклеотид (NAD), никотинамид- адениндинуклеотидфосфат (NADP) |
C6H5NO2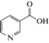 |
20 мг/ 11–12 мг | Красное мясо, печень, курица, рыба, молоко, зерновые, рисовые и пшеничные отруби, бобовые, орехи, дрожжи, грибы, кофе | 27% | NAD и NADP – коферменты в окислительно-восстановительных реакциях выработка АТФ, антиоксидантная защита совместно с витамином С или Е |
SMCT1/SLC5A8 GPR109A/HCAR2 |
• Может синтезироваться в организме из триптофана; • бактериями синтезируется de novo двумя путями или из триптофана; • при низком потреблении ниацина снижено количество Bacteroidetes; • добавление высоких доз (900 to 3000 mg) ниацина увеличивает популяцию Bacteroidetes |
Bacteroides fragilis, Prevotella copri, Ruminococcus lactaris, Clostridium difficile, Bifidobacterium infantis, B. longum, B. bifidum, Helicobacter pylori, Fusobacterium varium |
| B5 – пантотеновая кислота/ кофермент А (CoA) | C9H17NO5 |
5.0 мг/5.0 мг | Печень, мозг, почки, сердце, курица, яйца, молоко бобовые, авокадо и ферментированная соя, бобовые, цельно зерновые крупы, брокколи |
0.078% | Предшественник CoA и фосфопантетеина, участвующих в реакциях переноса ацильных групп при синтезе и окислении жирных кислот | SMVT / SLC5A6 | • Синтезируется бактериями из 2-дигидропантоата и β-аланина путем синтеза de novo; • высокое потребление витамина В5 связано с увеличенной численностью Actinobacteria; • необходим для роста in vitroLactobacillus spp., Enterococcus spp.,Streptococcus spp. |
Bacteroides fragilis, Prevotella copri, Ruminococcus lactaris, Roseburia intestinalis, Clostridium difficile, Helicobacter pylori, Fusobacterium varium |
| B6 – пиридоксин/пиридоксин, пиридоксаль, пиридоксамин | C8H11NO3 |
2.0 мг/ 1.3–1.7 мг | Говядина, свинина, птица, рыба, печень, нут, орехи, бобовые, злаки, хлеб, тофу, батат, картофель, авокадо, бананы, морковь, шпинат |
86% | Предшественник коферментов пиридоксаль-фосфата (PLP) и пиридоксамин-фосфата (PMP),
участвующих в метаболизме аминокислот, липидов и углеводов, кофактор в фолатном цикле |
н/о | • Синтезируется бактериями в виде PLP из дезоксиксилулозо-5-фосфата и 4-фосфогидрокси-L-треонина
или из глицеральдегид-3-фосфата и D-рибулозо-5-фосфата; • численность Blautia, Coprococcus и Roseburia отрицательно коррелирует с генами, связанными с метаболизмом витамина B6; • кишечная миробиота худощавых людей более интенсивно синтезирует витамин B6 |
Bacteroides fragilis, Prevotella copri, Lactobacillus helveticus, Bifidobacterium longum, B. adolescentis, B. bifidum, Roseburia intestinalis, Streptococcus thermophilus, Collinsella aerofaciens, Helicobacter pylor, Citrobacter spp., Klebsiella spp. |
| B7 – биотин/ биотин | C10H16N2O3S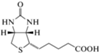 |
50 мкг/ 30 мкг | Сырой яичный желток, печень, почки, свинина, молоко, дрожжи, томаты, арахис, соевые бобы, миндаль, грецкие орехи, листовые овощи |
4.5% | Кофермент для пяти карбоксилаз, участвующих в цикле трикарбоновых кислот: • пируваткарбоксилазы, • пропионил-КоА-карбоксилазы, • метилкротонил-КоА-карбоксилазы (МСС), • ацетил-КоА-карбоксилаз 1 и 2 |
SMVT/SLC5A6 | • Синтезируется кишечными бактериями из малонил-КоА или пимелата через пимелоил-КоА
тремя путями; • Bacteroidetes и Firmicutes синтезируют биотин разными путями, Proteobacteria используют тот же путь, что и Bacteroidetes; • пути биосинтеза биотина широко представлены в энтеротипе Bacteroides; • необходим для роста Lactobacillus murinus |
Bacteroides fragilis, Lactobacillus helveticus, Escherichia coli, Fusobacterium varium, Campylobacter coli, Citrobacter spp. Klebsiella spp. |
| B9 – фолиевая кислота, фолаты/5-метил-тетрагидрофолат (THF) | C19N19N7O6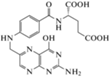 |
400 мкг/ 400 мкг | Говяжья печень, молоко, мясо, птица, морепродукты, яйца зеленые листовые овощи, спаржа, шпинат, брюссельская капуста, бобовые, злаки, дрожжи, цитрусовые, орехи |
37% | Кофермент в метаболизме одноуглеродных (С1) фрагментов, в метаболизме нуклеиновых
кислот и аминокислот необходим для реакций метилирования |
hPCFT/SLC46A1 Rfc1/SLC19A1 |
• Бактерии синтезируют ТHF из GTP, эритрозо-4-фосфата и фосфоенолпирувата; • обилие Bifidobacterium и Lactobacillus коррелирует с фолатным статусом; • общее количество аэробных бактерий коррелирует уровнем фолиевой кислоты в кишечнике; • большинство лактобацилл не способно синтезировать фоливую кислоту в отсутствие pABA; • микробиомы детей до шести месяцев обогащены генами, участвующими в биосинтезе фолиевой кислоты |
Bacteroides fragilis, Prevotella copri, Lactobacillus plantarum, L. delbrueckii ssp. bulgaricus, L. reuteri, Streptococcus thermophiles, Bifidobacterium adolescentis, B. bifidum, B. longum, Fusobacterium varium, Clostridium difficile, Salmonella enterica, Citrobacter spp., Klebsiella spp. |
| B12 – кобаламин, цианкобаламин/метилко-баламин, аденозилкобаламин | C63H88CoN14O14P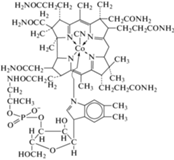 |
3.0 мкг/ 2.4 мкг | Мясо, печень, почки, сердце, рыба, птица, яйца, молочные продукты | 31% | Кофермент для: • метионинсинтетазы; • мутазы L-метилмало-нилкоэнзима катализирует синтез метионина, необходим для синтеза ДНК |
н/о | • Синтезируется бактериями аэробным и анаэробным путями, кишечные бактерии обычно
используют анаэробный путь; • в синтез витамина В12 de novo вовлекается около 30 бактериальных генов; • только половина Bacteroidetes имеет необходимые гены для синтеза витамина В12 de novo; • необходим для метаболизма бактерий и регуляции экспрессии бактериальных генов; • большая часть кишечных бактерий конкурирует с хозяином за диетический витамин B12; • большинство бактерий содержит, по крайней мере, один кобаламин-зависимый фермент • необходим для роста Bacteroides. thetaiotaomicronin vitro• |
Bacteroides fragilis, Parabacteroides spp., Prevotella copri, Lactobacillus reuteri, Faecalibacterium prausnitzii, Roseburia inulinivorans, Propionibacterium freudenreichii, Streptococcus sanguinis, Klebsiella spp., Citrobacter freundii, Salmonella enterica, S. typhimurium, Listeria innocua, Pseudomonas denitrificans, Bacillus megaterium |
Примечания: РСН – рекомендованная суточная норма; н/о – не обнаружен; * – для анаэробных бактерий приводятся данные in silico анализа [38].
Также использованы материалы из публикаций [14, 29, 46, 54, 70, 71, 118, 136, 169, 252].
В последние годы стала также рассматриваться роль кишечной микробиоты в обеспечении организма хозяина витаминами [136]. Однако вклад бактериального синтеза в уровни витаминов группы В в организме у людей не определен количественно. Использование пробиотических микроорганизмов-продуцентов витаминов также может быть источником этих микронутриентов. Кроме того, это может представлять собой более естественную альтернативу восполнения дефицита витаминов, чем применение химически синтезированных витаминов.
КИШЕЧНАЯ МИКРОБИОТА КАК ИСТОЧНИК ВИТАМИНОВ
Кишечная микробиота – совокупность населяющих кишечник бактерий, вирусов, архей, простейших, грибов – играет ключевую роль как в поддержании здоровья человека, так и в патогенезе широкого спектра заболеваний, включая заболевания ЦНС [188].
Бактерии, колонизирующие кишечный тракт человека, демонстрируют высокое филогенетическое разнообразие. Миробиота кишечника насчитывает свыше 1000 различных видов, большая часть (~90%) которых – представители двух доминирующих филумов Firmicutes и Bacteroidetes, остальную часть составляют виды из филумов Actinobacteria, Proteobacteria и Verrucomicrobia [65]. Микробные клетки превосходят количество клеток человека в десять раз, проявляют разнообразие как между участками тела, так и между людьми и содержат на два порядка больше генов, чем геном человека [181]. Более 70% всех микробов в организме человека обитает в толстой кишке [65, 188].
В ходе эволюции, с большинством микроорганизмов установились взаимовыгодные симбиотические (полезные виды) или комменсальные (безвредные виды) отношения [137]. Хозяин предоставляет микробиоте нишу для обитания и питательные вещества (все компоненты пищи, которые не перевариваются в тонкой кишке, являются потенциальными пищевыми субстратами для бактерий в толстой кишке), а микробиота обеспечивает хозяину колонизационую резистентность, целостность барьеров, иммунный гомеостаз, выполняет метаболическую и синтетическую функцию (ферментирует сложные полисахариды, белки и жиры; обеспечивает поглощение кальция, магния, железа и других веществ; модифицирует желчные кислоты; синтезирует витамины, аминокислоты, нейротрансмиттеры, короткоцепочечные жирные кислоты; утилизирует ксенобиотики, изменяет метаболизм и биодоступность лекарств) [92]. Бактериальная конверсия пищевых веществ и лекарств приводит к образованию большого количества соединений, которые могут оказывать благотворное или неблагоприятное воздействие на здоровье человека [34]. Кишечная микробиота метаболически и иммунологически интегрирована с хозяином, поэтому ее часто рассматривают как функциональный орган, состоящий из прокариотических клеток [38].
Использование безмикробных (germ-free – GF) животных убедительно продемонстрировало огромную роль микробиоты кишечника в физиологии хозяина: в развитии и нормальном функционировании желудочно-кишечного тракта (ЖКТ), иммунной и нервной систем; в поддержании целостности кишечного и гематоэнцефалического барьера (ГЭБ), в процессе миелинизации и пр. [37, 82, 100, 147, 196]. Влияние кишечной микробиоты на деятельность ЦНС и поведение отразилось в концепции оси микробиота–кишечник–мозг с двунаправленным влиянием [62].
Важность кишечных бактерий, как источника витаминов, была продемонстрирована наблюдением, что безмикробным животным требуются диетические источники различных витаминов, которые не нужны обычным животным [250]. Бактерии играют важную роль в биосинтезе de novo и биодоступности витаминов группы В и могут быть фактором, определяющим баланс витаминов [89]. Хотя бактерии не могут целиком обеспечить хозяина витаминами (табл. 1), бактериальный пул витаминов может служить дополнительным источником этих незаменимых веществ и может позволить снизить потребность в пищевых и синтетических витаминах. Кроме того, бактерии могут синтезировать хорошо усваиваемые биодоступные формы витаминов.
Вопросы о биодоступности витаминов B и их производных в дистальном отделе кишечника не выяснены, однако выявленная экспрессия транспортеров многих витаминов группы В в толстой кишке свидетельствует о том, что витамины могут абсорбироваться и в этом отделе кишечника [237]. Имеются данные об участии продуцируемых кишечной микробиотой витаминов группы В в толстой кишке в поддержании гомеостаза колоноцитов, барьерной функции кишечника, регуляции активности иммунных клеток в ЖКТ, супрессии колонизации патогенными бактериями [29].
Существует также точка зрения, что витамины, синтезируемые обитающей в толстой кишке микробиотой, являются пулом, который преимущественно потребляется самими микроорганизмами, а хозяином используются витамины, поступающие с пищей, которые в основном всасываются в тонкой кишке. Избытки витаминов группы В, которые не абсорбировась в тонкой кишке, поступают в дистальный отдел кишечника, где могут использоваться бактериями.
Вклад кишечных микроорганизмов в биосинтез и биодоступность витаминов в основном изучен на аэробных представителях кишечной микробиоты, а также пробиотических штаммах [85, 89]. Это связано с тем, что большинство бактерий идентифицировано с помощью методов секвенирования гена 16S рРНК и их функции изучаются с помощью аналитических биоинформационных подходов, так как нет возможности их культивировать и получить жизнеспособные культуры.
Анализ in silico показал, что 20–30% кишечных бактерий не имеют всех необходимых генов для синтеза витаминов группы В и, следовательно, не способны их продуцировать [140]. Эти микроорганизмы являются ауксотрофами и для обеспечения своей жизнедеятельности должны получать один или несколько витаминов группы В из окружающей среды, в результате чего происходит конкуренция, как между бактериями, так и между хозяином и бактериями за пищевые, а также синтезированные бактериями-прототрофами (продуцентами) витамины. Причем одни и те же бактериальные виды могут быть ауксотрофами по одним витаминам и продуцентами – других витаминов [140].
Изменения в составе микробиоты кишечника при элиминации видов-продуцентов или при увеличении ауксотрофных видов могут серьезно повлиять на потребности хозяина в витаминах группы В. Однако влияние бактериальных микронутриентов на организм хозяина практически не изучено.
Оценка способности кишечных бактерий к биосинтезу витаминов на основе геномного анализа выявила три особенности: 1) различную распространенность и распределение генов биосинтеза и транспортеров в геномах кишечных комменсалов; 2) отсутствие полных путей в геноме у некоторых видов; 3) комплементарные пары видов с паттернами наличия и отсутствия генов, кодирующих ферменты биосинтеза конкретного витамина [140, 208].
Разнообразие кишечного бактериального сообщества является необходимым условием для его нормального функционирования, чтобы обеспечивать поддержание гомеостатического состояния организма. В свою очередь, разнообразие и богатство кишечной микробиоты регулируются рядом внешних факторов, из которых немаловажная роль принадлежит диете. Считается, что диетические привычки в современном обществе привели к обеднению разнообразия кишечной микробиоты, поскольку изолированные племена, например, американские индейцы яномами, ведущие образ жизни охотников-собирателей, имеют большее микробное разнообразие в кишечнике, чем другие человеческие популяции [47].
С другой стороны, с заменой богатой микронутриентами “досельскохозяйственной” диеты, которая состояла из овощей, фруктов и орехов растительного происхождения, с рыбой и мясом, когда они были доступны, на современную, высокоэнергетическую, легкоусвояемую диету, обедненную микронутриентами, связывают наблюдаемый у населения развитых промышленных стран дефицит витаминов [49]. Причем, соблюдение “средиземноморской диеты” (высокое потребление фруктов, овощей, бобовых, сложных углеводов, оливкового масла, красного вина, а также умеренное потребление рыбы и белого мяса) обеспечивает повышенное содержание всех витаминов и минералов, напротив, приверженность “западной диете” (высокое потребление переработанного мяса, красного мяса, сливочного масла, молочных продуктов с высоким содержанием жира, яиц, рафинированного зерна и сахара) приводит к снижению содержания витаминов и минералов [45, 209].
Хотя витамины группы В содержатся во многих пищевых продуктах (табл. 1), большинство из них чувствительно к повышению температуры и легко разрушается в процессе приготовления пищи, что также является причиной встречающегося дефицита витаминов группы В.
Недостаток одного или нескольких водорастворимых витаминов, который может возникать на системном, тканевом или клеточном уровнях, приводит к широкому спектру специфических и неспецифических симптомов и способствует развитию различных “болезней образа жизни”, таких как ожирение, сердечно-сосудистые заболевания, заболевания нервной системы. Среди последних – рассеянный склероз представляет заболевание, при котором предполагается патогенетическая роль взаимосвязанных факторов – диеты, кишечной микробиоты и витаминов группы В.
ДЕФИЦИТ ВИТАМИНОВ ГРУППЫ В КАК ВОЗМОЖНЫЙ ФАКТОР ПАТОГЕНЕЗА РАССЕЯННОГО СКЛЕРОЗА
Рассеянный склероз (РС) представляет медико-социальную проблему, поражая людей трудоспособного возраста и детей, приводя к инвалидизации заболевших. Это – аутоиммунное заболевание центральной нервной системы (ЦНС), характеризующееся хроническим нейровоспалением, демиелинизацией и нейродегенерацией [134]. Активированные макрофаги, аутореактивные CD4+ Т-клетки (Th1, Th17), CD8+ T-клетки, цитокины, антитела против белков миелиновой оболочки (основной белок миелина, протеолипидный протеин, миелин-олигодендроцитарный белок), дефицит и дисфункция регуляторных Т‑клеток (Treg) играют роль в патогенезе РС [219]. Процессы демиелинизации и нейродегенерации при РС являются следствием комплексного повреждающего действия аутоиммунных реакций, нейровоспаления, эксайтотоксичности и окислительного стресса [1, 2, 42, 135].
Наиболее часто очаги демиелинизации возникают на перекресте зрительных нервов, в стволе мозга, мозжечке, а также в верхнем отделе спинного мозга, в результате развиваются зрительные и сенсорные нарушения, проблемы с подвижностью и координацией, спастичность, моторно-сенсорный дефицит, расстройства психоэмоциональной сферы, нарушения функций желудочно-кишечного тракта (ЖКТ). Наличие тех или иных симптомов определяется локализацией и выраженностью воспаления и демиелинизации [78].
Хотя этиопатогенез РС до конца не ясен, признается роль генетических факторов, преимущественно генов, вовлекаемых в иммунный ответ (HLA-DRB1, HLA-DPB1, HLA-A, TNF) [105] и факторов окружающей среды таких, как дефицит витамина D, инфекции (вирус Эпштейна–Барра, вирусы герпеса человека, ретровирусы и пр.), “западная диета” с высоким содержанием насыщенных жиров, углеводов и соли, курение, ожирение и кишечная микробиота [15, 16, 25, 97, 148, 153].
В последнее время возрос интерес к влиянию диеты и кишечной микробиоты, как продуцента необходимых человеку нутриентов, а также возможного терапевтического агента на распространенность и прогрессирование заболевания [169, 187]. Показано, что “средиземноморская диета” поддерживает микробиоту с полезным метаболическим профилем (Bacteroides, Lactobacillus, Bifidobacterium, Faecalibacterium, Oscillospira, Roseburia, Ruminococcus, Clostridium кластер XIVa) и рекомендуется при рассеянном склерозе [151, 204].
Как уже упоминалось, дефицит витаминов группы В приводит к развитию неврологических симптомов, которые также являются характерными симптомами рассеянного склероза [169], при этом важно, что эти симптомы поддаются регрессу при восполнении дефицита витаминов [118]. О наличии дефицита витаминов группы B у пациентов с РС сообщалось еще в 1950–1970-е гг., и описывались случаи применения очень высоких доз никотинамида, тиамина, пиридоксина, кобаламина пациентами с РС с восстановлением поврежденных нервных клеток и регрессом симптомов РС [123]. Позже было подтверждено, что дефицит витаминов группы B влияет на развитие и прогрессирование рассеянного склероза [170]. Однако нет единого мнения о роли дефицита витаминов группы В в патогенезе РС.
Причинами дефицита витаминов группы В могут быть генетические дефекты, недостаточное поступление с пищей, нарушение всасывания в кишечнике, использование определенных лекарств, включая антибиотики, иммуносупрессирующие препараты (метотрексат). В последнее время предполагается также их недостаточная продукция кишечной микробиотой [226] вследствие изменения ее таксономического состава.
Действительно, при РС наблюдаются изменения состава кишечной микробиоты (дисбиоз), связанные с увеличением Bifidobacterium, Akkermansia, Methanobrevibacter, Streptococcus, Acinetobacter, а также уменьшением Bacteroides, Prevotella, Collinsella, Faecalibacterium, Roseburia и других бутират-продуцирующих бактерий [4]. Как будет показано далее, эти бактериальные таксоны в разной степени способны продуцировать витамины группы В.
Является кишечный дисбиоз причиной или следствием заболевания не известно. Однако сейчас уже очевидно, что коррекция состава кишечной микробиоты оказывает позитивный эффект не только на функции ЖКТ, но и на иммунную систему, ЦНС, метаболические процессы, в том числе на системный статус витаминов группы В.
Основными эффекторами иммуномодуляции, продуцируемыми микробиотой, считаются короткоцепочечные жирные кислоты (SCFAs), которые регулируют кишечные Treg клетки и макрофаги [59], однако витамины группы В, в частности ниацин, фолаты также стимулируют образование Treg клеток [216], т.е. могут оказывать иммуномодулирующее действие.
В связи с этим, а также с признанием вклада кишечной микробиоты в развитие РС, вопрос о значении дефицита витаминов группы B в патогенезе этого заболевания приобретает все большую актуальность и создает основу для нового направления лечения РС с применением пробиотических видов-продуцентов витаминов для иммунокоррекции и нейропротекции.
Можно выделить несколько основных путей воздействия витаминов группы В на организм, которые потенциально могут быть связаны с патогенезом РС:
• на нервную систему (процесс миелинизации/ремиелинизации, нейропротекция и нейротропная поддержка);
• на иммунную систему (регуляция активности иммунных клеток, продукция цитокинов, противовоспалительное действие);
• на желудочно-кишечный тракт и микробиоту (поддержание целостности барьера, ассоциированная с кишечником лимфоидная ткань, колоноциты);
• на метаболизм (углеводов, жиров, белков, энергетический метаболизм, антиоксидантное действие);
• на эпигенетическую регуляцию (процессы метилирования, биотинилирования и пр.).
Широкий спектр биологической активности витаминов группы В демонстрирует важность поддержания их нормального уровня в организме и делает их перспективными средствами для лечения РС, комплексно влияющими на различные патогенетические мишени, при этом важно учитывать состав кишечной микробиоты, поскольку определенные виды могут конкурировать за доступность витаминов с хозяином и способствовать возникновению у последнего гиповитаминоза, как показано при воспалительных заболеваниях кишечника [102, 104].
ВИТАМИН B1 (ТИАМИН)
Витамин В1 – важнейший витамин в энергетическом обмене, метаболизме углеводов, жиров, белков. В клетках-мишенях тиамин подвергается фосфорилированию при участии тиаминпирофосфокиназы, с образованием тиаминмонофосфата (TMP), тиаминпирофосфата (TPP) и тиаминтрифосфата (TTP). Основной коферментной формой витамина В1 является TPP.
Тиамин действует как кофермент пируватдегидрогеназного и α-кетоглутаратдегидрогеназного комплексов, участвующих в метаболизме углеводов (цикл трикарбоновых кислот), а также транскетолазы, которая функционирует в пентозофосфатном пути окисления углеводов и участвует в синтезе жирных кислот. В комплексе с пируватдегидрогеназой (PDH) тиамин вовлекается также в другие метаболические пути, такие как синтез нейротрансмиттеров (ацетилхолина, серотонина) [12, 107], нуклеиновых кислот, липидов [66] и стероидов [149].
Считается, что абсорбция тиамина происходит с помощью активной транспортной системы в тощей и подвздошной кишке, однако высокоаффинные переносчики тиамина THTR1 и THTR2 были идентифицированы в слизистой оболочке толстой кишки человека [194], что свидетельствует о возможности всасывания витамина В1 в толстой кишке. Однако нет данных о значении поступления тиамина в дистальный отдел кишечника, а также об использовании хозяином витамина В1 бактериального происхождения. По расчетам, продуцируемый микробиотой тиамин обеспечивает всего 2.3% суточной потребности человека в этом витамине [140].
In silico анализ показал, что 56% бактерий, составляющих кишечную микробиоту человека, обладают генами, участвующими в синтезе тиамина. Интересно, что наиболее активными продуцентами TMP являются представители филумов Bacteroidetes и Fusobacteria, тогда как среди Firmicutes немного видов, способных синтезировать витамин В1 [140]. Пути биосинтеза тиамина широко представлены в энтеротипе 2, обогащенном Prevotella (p_Bacteroidetes) [14]. Численность рода Prevotella, как и филума Bacteroidetes в целом, сокращается у пациентов с РС [4]. Учитывая, что Bacteroidetes является доминантным филумом, уменьшение численности этих микроорганизмов может существенно сказаться на бактериальном пуле тиамина у пациентов с РС.
Биосинтез тиамина и его транспортная система необходимы для роста in vitro Bacteroides thetaiotaomicron – кишечной бактерии, обладающей мощным метаболическим потенциалом и снабжающей других членов микробного сообщества пищевыми субстратами [51]. Это свидетельствует о том, что уровень тиамина в толстой кишке важен для поддержания структуры кишечного микробиома, и его дефицит может приводить к кишечному дисбиозу в результате элиминации важных представителей кишечного микробиома, ауксотрофных по тиамину.
При длительном дефиците тиамина отмечается стойкое поражение многих систем организма, включая мышечную [125], пищеварительную [72] и нервную системы [168], которые поражаются при РС. К дефициту витамина В1 высоко чувствителен мозг, вероятно, из-за его зависимости от энергетического метаболизма и биосинтеза нейротрансмиттеров, опосредованного тиамин-зависимыми ферментами [242]. Кроме того, в повреждении ЦНС, обусловленном дефицитом тиамина, играют роль воспаление, эксайтотоксичность, митохондриальная дисфункция и окислительный стресс, ослабление нейрогенеза, нарушение ГЭБ и миелиногенеза. Недостаточное поступление в организм витамина B1 с пищей влияет на функционирование иммунной системы, нарушая дифференцировку и пролиферацию иммунных клеток [8, 22, 40, 96].
Приведенные выше факты демонстрируют, что дефицит витамина В1 может играть патогенетическую роль при РС, однако опубликовано всего несколько исследований тиамина при рассеянном склерозе и его общепринятой модели – экспериментальном аутоиммунном энцефаломиелите (ЭАЭ).
Так, у пациентов с РС при употреблении диеты с низким содержанием тиамина отмечалось наличие депрессии [57]. Имеется также сообщение о пилотном исследовании с участием 15 пациентов с ремиттирующе-рецидивирующим течением РС (РР-РС), получавших высокие дозы тиамина (10–23 мг/кг/день) дополнительно к основной терапии. Проведенное лечение привело к регрессу симптома усталости, который присутствовал у пациентов до лечения [50]. Хотя в этом исследовании не изучались другие показатели, потенциально тиамин может влиять на процесс демиелинизации, как это показано при митохондриальной энцефалопатии (МЭ), заболевании, при котором также повреждается миелиновая оболочка вследствие сниженной активности PDH. Фармакологическая стимуляция активности PDH у пациентов с МЭ приводила к уменьшению повреждения миелиновых оболочек и улучшению неврологического статуса пациентов [120].
На модели индуцированного ЭАЭ, у животных с дефицитом витамина В1 усугублялась тяжесть заболевания, что сопровождалось повышенной экспрессией СС-хемокинового лиганда 2 (CCL2) в спинном мозге, пролиферацией Т-клеток, усиленной инфильтрацией ЦНС субпопуляциями Th1 и Th17 клеток, активацией микроглии [108].
Эти исследования показывают, что дефицит тиамина может влиять на течение РС, однако на их основании невозможно сделать вывод о перспективах его применения для лечения РС. Учитывая, что бактерии-продуценты из филума Bacteroidetes существенно уменьшаются при РС, добавление диетического тиамина и пробиотических бактерий-продуцентов тиамина может оказаться полезным для восполнения дефицита тиамина.
ВИТАМИН B2 (РИБОФЛАВИН)
Рибофлавин – один из основных антиоксидантов в организме благодаря его участию в цикле восстановления глутатиона. Важнейшие биологически активные формы рибофлавина – флавинмононуклеотид (FMN) и флавинадениндинуклеотид (FAD) являются коферментами большого числа ферментов, участвующих в окислительно-восстановительных реакциях. Известно также, что рибофлавин влияет на выработку и усвояемость других витаминов группы B – В3, В6 и В9, а также железа.
Всасывание рибофлавина происходит в эпителиальных клетках тонкой кишки за счет активного переноса транспортерами RFVT1-3. Максимальное количество рибофлавина, которое может быть абсорбировано при однократной дозе, составляет 27 мг [253], что почти в 20 раз превышает рекомендуемую суточную дозу (табл. 1). Ограниченное всасывание в кишечнике обеспечивает защиту при потреблении высоких доз витамина [27]. При этом 10–15% населения страдают от наследственной мальабсорбции, что приводит к гиповитаминозу [11].
Экспрессия мРНК гена SLC52A1, кодирующего RFVT1, обнаружена также в плаценте, а гена SLC52A2, кодирующего RFVT2, – повсеместно, особенно в мозге и слюнных железах [251], что свидетельствует о важности этого витамина в процессе внутриутробного развития и для деятельности мозга.
Не абсорбировавшийся в тонкой кишке диетический рибофлавин, а также рибофлавин, продуцируемый комменсальными бактериями, составляют пул рибофлавина, присутствующий в дистальном отделе кишечника, где также обнаружен транспортер рибофлавина RFVT3 [229, 230].
В дополнение к молочнокислым бактериям, известным продуцентам рибофлавина в кишечнике, геномный анализ 256 видов кишечных микробов человека показал, что более половины (56%) из них имеют группу генов для биосинтеза рибофлавина de novo [140, 233]. Рибофлавин, синтезированный кишечной микробиотой, был способен быстро компенсировать дефицит рибофлавина в рационе у Caenorhabditis elegans и мышей [29, 180].
Было высказано предположение, что рибофлавин влияет на рост анаэробных бактерий [119, 225], таких как Faecalibacterium prausnitzii, Roseburia spp., не способных синтезировать этот витамин ввиду отсутствия соответствующих генов [99]. В совокупности рибофлавин, продуцируемый кишечной микробиотой, выступает как модулятор приспособленности бактерий в кишечном сообществе и к иммунной системе хозяина.
Исследование на небольшой группе взрослых добровольцев показало, что добавление рибофлавина в пищу в течение 14 дней увеличивало количество F. prausnitzii и одновременно снижало количество Escherichia coli [225]. F. prausnitzii является одним из ключевых видов-продуцентов короткоцепочечной жирной кислоты бутирата, необходимой для колоноцитов. Количество этих бактерий уменьшается при многих заболеваниях ЖКТ, а также при РС [160].
Как уже отмечалось, окислительный стресс является одной из причин повреждения нейронов и аксонов, а также миелин-продуцирующих олигодендроцитов. В активных очагах демиелинизации также наблюдается окислительное повреждение астроцитов и нагруженных миелином макрофагов, которое может быть устранено эндогенными антиоксидантами [240]. Диетический рибофлавин, видимо, также способен влиять на интенсивность окислительного стресса за счет своих антиоксидантных свойств.
Дефицит рибофлавина у животных приводит к аномальной миелинизации как в периферической, так и в центральной нервной системе [111]. Совместное применение рибофлавина с IFNβ-1a в течение 2-х нед. у мышей с индуцированным ЭАЭ ослабляло двигательные нарушения и повышало уровни мРНК нейротрофического фактора головного мозга (BDNF) в ЦНС, по сравнению с контрольной группой или группой мышей, получавшей только IFNβ-1a [165]. Однако в рандомизированном двойном слепом контролируемом исследовании, в котором 29 пациентов с РС получали рибофлавин (10 мг/день) в течение 6 мес., не было отмечено каких-либо улучшений по сравнению с группой плацебо [166]. Причиной этого может быть то, что рибофлавин не накапливается в организме и период его полувыведения из плазмы крови составляет около 2-х часов, а наибольшее количество рибофлавина после внутривенной инфузии оказывается в миокарде, печени и почках.
В более раннем исследовании (тип случай-контроль) с участием 197 пациентов с РС была показана обратная связь между более высоким индексом массы тела и заболеваемостью РС, а также отмечен защитный эффект употребления растительного белка, тиамина, рибофлавина, кальция и калия [77]. Авторы делают вывод о связи факторов питания, в том числе рибофлавина, с риском/этиологией РС.
Таким образом, рибофлавин оказывает протективное действие на модели ЭАЭ, однако необходимы дальнейшие исследования, чтобы выяснить его роль при РС и отработать эффективные схемы и дозы введения, возможность модуляции биодоступности рибофлавина индигенными и пробиотическими микроорганизмами.
ВИТАМИН B3 (НИАЦИН, НИКОТИНАМИД)
Ниацин (никотиновая кислота) участвует во многих биологических реакциях, включая выработку АТФ, антиоксидантную защиту совместно с витаминами С или Е, а также в синтезе жирных кислот и стероидов, метаболизме липидов, репарации ДНК, дифференцировке клеток [118].
Ниацин и никотинамид являются предшественниками никотинамидадениндинуклеотида (NAD) и фосфорилированной формы – никотинамидадениндинуклеотидфосфата (NADP), которые служат коферментами в более, чем 200 окислительно-восстановительных реакциях [177]. Никотинамид проникает через гематоэнцефалический барьер (ГЭБ) [91] и превращается в NAD в головном мозге всего за 20 мин [220]. Поддержание высоких уровней NAD, как предполагается, может быть полезной стратегией нейропротекции [177].
Ниацин активирует рецептор гидроксикарбоновой кислоты (HCA2), снижает активность транскрипционного фактора NFκB и хемотаксические сигналы в макрофагах и моноцитах, что приводит к уменьшению нейровоспаления [173]. Кроме того, ниацин оказывает иммуномодулирующее действие, увеличивая количество Treg клеток, как и бутират, активируя рецептор Gpr109a, тем самым защищая от воспаления толстой кишки [33, 216]. Хотя ниацин не считается основным лигандом этого рецептора, в эпителии толстой кишки, где рецептор экспрессируется, он вполне может использоваться для осуществления ниацином своих эффектов [174, 252]. В кишечнике ниацин модулирует барьерную функцию и оказывает противовоспалительное действие [113, 117, 256]. Одним из проявлений дефицита ниацина может быть диарея на фоне кишечного воспаления [98, 206].
Никотинамид и никотиновая кислота всасываются в тонком кишечнике, два транспортера (GPR109A, SMCT1) обнаружены также в толстой кишке [130].
Ниацин – единственный витамин, который может синтезироваться в организме из триптофана по кинурениновому пути. Причем диета, обогащенная ненасыщенными жирными кислотами, увеличивает биосинтез ниацина, богатая белком диета снижает, ограничение калорий резко подавляет, насыщенные жирные кислоты не влияют на биосинтез ниацина из триптофана [23, 211, 212, 214]. Кишечные бактерии могут быть дополнительным источником этого витамина [75]. Гены для синтеза ниацина присутствуют в большинстве геномов бактерий, населяющих ЖКТ. Филумы Actinobacteria и Firmicutes содержат более низкие количества продуцентов de novo, чем Bacteroidetes, Proteobacteria и Fusobacteria. Кроме того, Actinobacteria и Firmicutes содержат гены путей метаболизма ниацина, которых нет в геномах Fusobacteria и Bacteroidetes. В общей сложности 63% всех исследованных геномов содержали также пути биосинтеза активной формы витамина В3 – NAD [140].
При использовании ниациана необходимо учитывать как бактериальный синтез, так и продукцию витамина из триптофана, поскольку в высоких дозах (>1000 мг/сутки) никотиновая кислота может вызывать желудочно-кишечные расстройства, оказывать токсическое воздействие на печень и повышать уровень мочевой кислоты [76, 131]. У здоровых людей употребление микрокапсул, содержащих ниацин, которые высвобождают свое содержимое в подвздошной кишке, дозозависимо увеличивало концентрацию ниацина в сыворотке крови [70].
Исследований, имеющих отношение к витамину В3, при РС/ЭАЭ немного. Единственное исследование применения ниацина пациентами с прогрессирующим РС, относится к 1940 году, в котором M.T. Moor описал 5 клинических случаев [162]. Он использовал следующую схему лечения: попеременные внутримышечные (60–140 мг) и внутривенные (60–160 мг) инъекции ниацина 5 дней в неделю с последующими регулярными (2–3 раза в неделю) внутримышечными инъекциями раствора, содержащего ниацин (120 мг) и тиамин хлорид (33.2 мг). Как видно, в данной схеме используется сочетанное применение витаминов В3 и В1 и 5 случаев недостаточно, чтобы делать выводы об эффективности проведенного лечения.
Исследование на животных показало, что никотинамид предотвращает дегенерацию демиелинизированных аксонов и ослабляет двигательные нарушения при ЭАЭ. Ежедневные инъекции никотинамида (500 мг/кг) мышам с индуцированным ЭАЭ, после того, как у них появились клинические симптомы, снижали тяжесть заболевания, а области воспаления, демиелинизации и потери аксонов были уменьшены по сравнению с контрольной группой [115]. Аналогичные результаты были получены при применении меньшей дозы (100 мг/кг) ниаспана – пролонгированной формы ниацина [254]. На фоне сниженной тяжести заболевания у животных авторы наблюдали стимуляцию олигодендрогенеза и регенерации аксонов. Интересно, что более высокие дозы – 200 и 400 мг/кг не оказывали протективного действия. Стимуляция ремиелинизации ниацином отмечалась также в модели демиелинизации, индуцированной лизолецитином [184]. В этом исследовании примечательно то, что ниацин стимулировал ремиелинизацию у старых мышей, в возрасте, когда процесс ремиелинизации ухудшается.
Ниацин также оказывает влияние на микробиоту кишечника. Показано, что добавление ниацина или триптофана, из которого может образовываться ниацин, восстанавливало состав кишечной микробиоты у мутантных Ace2 мышей [94]. Кроме того, прием микрокапсулы с отсроченным высвобождением ниацина (900–3000 мг), но не никотинамида (30–300 мг) способствовал значительному увеличению популяции Bacteroidetes [70]. Такая специфичность по отношению к ниацину объясняется отсутствием ферментов никотинамидазы и никотинамидфосфорибозилтрансферазы у Bacteroidetes, поэтому они не способны метаболизировать никотинамид [76]. Это подтверждает, что ниацин, но не никотинамид в дистальном отделе кишечника поддерживает рост видов Bacteroidetes. Можно предположить, что наблюдаемое уменьшение численности этого бактериального таксона у части пациентов с РС может быть связано с недостаточным содержанием ниацина в нижних отделах ЖКТ, и что нициан можно использовать для восстановления популяции Bacteroidetes. Наличие дефицита ниацина отмечено в единственном опубликованном исследовании у монгольского пациента с РС [127].
Важно отметить, что никотиновая кислота может повышать уровень гомоцистеина и снижать уровни витаминов В6 и В12, как показано на модели атеросклероза у крыс [26], что предполагает необходимость контроля уровня гомоцистеина и его коррекции, например, введением витаминов В6 и В12.
В совокупности представленные исследования свидетельствуют о том, что ниацин может оказывать нейропротективное действие, стимулировать ремиелинизацию и модулировать микробный состав в кишечнике. Это предполагает перспективность использования ниацина и ниацин-продуцирующих пробиотических бактерий при рассеянном склерозе, однако необходимы дополнительные исследования.
ВИТАМИН B5 (ПАНТОТЕНОВАЯ КИСЛОТА)
Пантотеновая кислота существует в основном в виде производных кофермента А (CоА), ацетил-СоА, ацил-СоА, белка АСР (acyl-carrier protein) и 4-фосфопантетеина. Пантотеновая кислота необходима для метаболизма жиров, углеводов, аминокислот, синтеза жирных кислот, фосфолипидов, холестерина, гистамина, ацетилхолина, гемоглобина, стимулирует образование глюкокортикоидов, формирование антител, способствует усвоению других витаминов.
Всасывание пантотеновой кислоты происходит через кишечную петлю натрий-зависимыми переносчиками поливитаминов (SMVT, SLC5A6) в тонкой кишке, в толстой кишке также обнаружен транспортер SMVT, однако прямых доказательств всасывания пантотеновой кислоты в толстой кишке нет [79, 247]. Вопросы о том, может ли пантотеновая кислота в дистальном отделе кишечника быть питательным веществом для хозяина, и влияет ли ее доступность на состав кишечной микробиоты и функцию клеток-хозяев остаются открытыми.
Геномный анализ 256 репрезентативных организмов микробиоты кишечника человека показал, что почти все Bacteroidetes и Proteobacteria содержат гены полного пути синтеза пантотената de novo, эти гены имеются лишь у отдельных представителей Actinobacteria и Firmicutes [140]. Предполагается, что повышенное потребление пантотеновой кислоты связано с увеличением относительной численности Actinobacteria [43, 140]. Интересно, что род Bifidobacterium, относящийся к Actinobacteria, чрезмерно увеличивается у пациентов с РС, особенно при большей тяжести по расширенной шкале оценки степени инвалидизации – EDSS (Expanded Disability Status Scale) и при обострении [3]. Требуются дальнейшие исследования, чтобы уточнить влияние дефицита и добавок пантотеновой кислоты на состав кишечной микробиоты в целом и на отдельные бактериальные виды с различной ролью при РС, а также выяснить, как это сказывается на течении заболевания.
Этот витамин широко распространен, поэтому дефицит пантотеновой кислоты встречается редко. Обычно он наблюдается при синдроме мальабсорбции, при недостаточном содержании в рационе белков и жиров, при длительном применении антибиотиков. Сообщается, что у мышей, получавших антибиотики, проявляются признаки дефицита пантотеновой кислоты [224].
Многие симптомы, наблюдаемые при недостатке витамина B5 (покалывание и онемение пальцев ног, нарушение координации, усталость, утомляемость, депрессия, диспепсические расстройства и пр.), характерны также для РС.
Циркулирующая форма витамина B5 – 4'-фосфопантотенат участвует в регуляции уровня железа, необходимого для транспорта кислорода в головном мозге, переноса электронов, синтеза нейротрансмиттеров, образования и регенерации миелина [227]. Высокий уровень железа может приводить к образованию свободных радикалов и нейротоксичности, что наблюдается в головном мозге, как при РС, так и при других нейродегенеративных заболеваниях (болезнь Паркинсона, болезнь Альцгеймера) [223].
Приведенные данные демонстрируют, что как дефицит, так и избыток витамина В5 может негативно влиять на течение РС. Более определенный вывод невозможно сделать, так как мы не обнаружили исследований на эту тему ни на модели ЭАЭ, ни при РС.
ВИТАМИН B6 (ПИРИДОКСИН, ПИРИДОКСАМИН, ПИРИДОКСАЛЬ)
Витамин В6 – групповое название трех производных пиримидина: пиридоксина, пиридоксаля и пиридоксамина. Активной формой витамина В6 является пиридоксаль-5-фосфат, который выступает в роли кофермента более, чем в 140 ферментативных реакциях, связанных с метаболизмом аминокислот, сахаров, липидов, холина и незаменимых ненасыщенных жирных кислот, а также с синтезом нейротрансмиттеров, действует как кофермент кинуренинового пути метаболизма триптофана, кофермент в синтезе сфинголипидов, кофермент в образовании одноуглеродных фрагментов и метаболизме гомоцистеина, важен для поддержания иммунной системы [176]. Маркеры системного воспаления отрицательно коррелируют с уровнями пиридоксина [63].
Пиридоксаль-5'-фосфат (PLP) – распространенная коферментная форма витамина B6 может синтезироваться бактериями de novo двумя путями [140]. Большинство Actinobacteria, Bacteroidetes и Proteobacteria (примерно 50% из исследованных 256 геномов кишечной микробиоты человека) способны продуцировать витамин В6 de novo, по крайней мере одним из этих путей. Бактериальное происхождение витамина В6 в толстой кишке мышей продемонстрировано в эксперименте Miki T. et al. [154]. Истощение микробиоты кишечника у мышей коктейлем антибитиотиков в течение недели приводило к снижению (с 0.4–0.5 мг/100 г до 0.1–0.2 мг/100 г) концентрации витамина B6 в содержимом толстой кишки, причем количество витамина B6 частично восстанавливалось введением Bacteroides acidifaciens [154]. Большинство Firmicutes не имеют всех необходимых генов для синтеза витамина В6 [140], что согласуется с данными об отрицательной корреляции относительной численности представителей филума Firmicutes – Blautia, Coprococcus и Roseburia с количеством генов, связанных с метаболизмом витамина B6 [210].
Поддержание оптимального уровня витамина B6 в клетках необходимо для адекватного иммунного ответа в норме и при заболеваниях [93, 152, 183], и кишечная микробиота играет в этом немаловажную роль. По расчетам [140], бактерии способны обеспечить до 86% суточной потребности хозяина в этом витамине, что является самым большим количеством из всех 8 витаминов группы В (табл. 1).
Дефицит пиридоксина наблюдается редко, обычно генетически обусловлен, возникает в результате нарушения всасывания или вызывается длительным применением лекарств, влияющих на метаболизм пиридоксина, таких как леводопа-карбидопа, изониазид или гидралазин гидрохлорид, гидразины и пеницилламины [158]. При дефиците пиридоксина отмечаются нарушения психоэмоциональной сферы, кожные проявления, может развиться полинейропатия.
Опубликовано несколько противоречивых исследований о содержании витамина B6 при РС – сообщается как о нормальных или превышающих нормальные уровни витамина B6, так и о сниженных уровнях B6 в сыворотке крови пациентов с РС по сравнению с контрольной группой [172, 195].
Витамин B6 совместно с витаминами B9 и B12 является кофактором в превращении гомоцистеина, который оказывает нейротоксическое и нейровоспалительное действие [172]. Однако не наблюдалось значимой корреляции между уровнями витамина B6 и гомоцистеина в сыворотке крови пациентов с РС [159].
Поглощение гомоцистеина B6-зависимым путем приводит к образованию цистеина, участвующего в образовании миелина. Кроме того, витамин B6 играет важную роль в синтезе сфингомиелинов, также являющихся важным компонентом миелиновой оболочки [36]. Это предполагает его роль в процессах миелинизации/ремиелинизации. Действительно, при дефиците пиридоксина в пище у экспериментальных животных развивается демиелинизация [228].
Дефицит пиридоксина ассоциирован с повышенным уровнем воспаления, а добавление витамина В6 подавляет экспрессию генов цитокинов, ингибируя NF-kB зависимый путь, опосредованный TLRs, а также инфламмосому NLRP3 в макрофагах, стимулированных ЛПС [197, 231]. В высоких дозах витамин В6 способен ослаблять воспаление в эпителиальной кишечной ткани, как показано на модели воспалительного заболевания кишечника у мышей с делецией гена IL-10 [207]. Дефицит витамина В6 обнаруживается примерно у 30% пациентов с воспалительными заболеваниями кишечника (ВЗК) [239]. Так как существует высокая коморбидность ВЗК с РС, и кишечник считается местом инициации патологических процессов при РС, подавление воспаления в кишечнике может быть стратегией лечения РС. Эффективен ли витамин В6 для этого, на данный момент не известно. Но витамин B6 (20 мг/кг) может оказывать противовоспалительное действие за счет снижения уровней провоспалительных цитокинов IL-1β, TNF-α и IL-6, как показано при ревматоидном артрите [101] и на модели ЭАЭ у мышей C57BL/6 [64], что способствует ослаблению тяжести заболевания [64].
Исследований по использованию витамина В6 при РС мы не обнаружили. Возможно, это связано с тем, что длительное (несколько лет) употребление витамина В6 или его употребление в высоких дозах (>50 мг/сут) может приводить к развитию полинейропатии с демиелинизацией [44, 164]. Примечательно, что все препараты, вызвавшие побочные эффекты у людей, содержали пиридоксин (неактивная форма), который конкурирует с пиридоксальфосфатом (активная форма), в результате чего ингибируются зависимые от витамина В6 ферменты, что приводит к ситуации, аналогичной дефициту витамина В6 [245]. Одним из путей с участием пиридоксальфосфата является кинурениновый путь, в котором триптофан метаболизируется до никотинамида, а промежуточными продуктами являются хинолиновая кислота, кинуренин, 3-гидроксикинуренин (3-ГК) и 3-гидроксиантраниловая кислота [238]. 3-ГК – нейротоксичное соединение, связанное с заболеваниями ЦНС [203]. Vrolijka M.F. et al предлагают заменить пиридоксин на пиридоксаль или пиридоксальфосфат в фармакологических препаратах витамина В6, чтобы избежать нейротоксических эффектов [245]. Возможно, что применение активных форм витамина В6 или бактерий, которые продуцируют эти формы витамина В6, найдет применение при РС в будущем.
ВИТАМИН B7 (БИОТИН)
Биотин является важным кофактором пяти карбоксилаз, участвующих в синтезе жирных кислот и выработке энергии, участвующих в метаболизме углеводов, жирных кислот и аминокислот (лейцина), процессе глюконеогенеза, синтеза пуринов, миелинизации.
Дефицит биотина встречается редко, но может наблюдаться у пациентов, употребляющих большое количество сырых яичных белков, или при некоторых редких генетических вариантах. Дефицит биотина вызывает дерматит, энцефалопатию, миалгии и невропатию.
Всасывание биотина как в тонком, так и в толстом кишечнике опосредуется переносчиком SMVT, кодируемым геном SLC5A6 [194]. На процесс абсорбции биотина в толстой кишке влияют липополисахариды [132]. Это показывает, что уровень грамотрицательных бактерий в составе кишечной микробиоты может влиять на всасывание и доступность биотина для хозяина.
Геномный анализ 256 репрезентативных организмов микробиоты кишечника человека показал, что 40% из них способны к синтезу витамина B7 de novo. [140]. Исследования показали, что филумы Bacteroidetes, Fusobacteria и Proteobacteria содержат гены, ответственные за синтез биотина [140, 258]. Так, у людей с энтеротипом Bacteroides в микробиоме отмечается повышенная экспрессия четырех ферментов пути биосинтеза биотина [14]. Выявлено, что в геноме Actinobacteria отсутствует важный ген биосинтеза биотина, при этом 83% представителей Actinobacteria в геноме содержат переносчик биотина, что указывает на их потребность в этом витамине [140]. Предполагается возможность контролирования заболевания при высоком содержании Actinobacteria, путем регулирования доступности биотина в кишечнике [80]. Lactobacillus murinus также поглощает биотин, тем самым снижая его доступность в кишечнике. Таким образом, существует конкуренция за использование биотина между хозяином и бактериями [95].
Мы обнаружили единственное исследование, в котором оценивался уровень биотина в спинномозговой жидкости при РС. В исследовании приняли участие 170 пациентов с различными неврологическими расстройствами, из которых 33 пациента были с РС. Сниженный уровень биотина в спинномозговой жидкости по сравнению с контрольной группой (136 + 75 мг/л; p = 0.001) отмечался у пациентов с РС (79 + 28 мг/л) или с эпилепсией (82 + 21 мг/л) [10].
Опубликовно около 15 работ по использованию высоких доз (100–600 мг/сут) биотина для лечения прогрессирующих форм РС. Предполагалось, что высокие дозы биотина будут оказывать терапевтический эффект у пациентов с прогрессирующим рассеянным склерозом посредством двух различных и дополняющих друг друга механизмов: стимулирование ремиелинизации аксонов за счет увеличения продукции миелина и уменьшение гипоксии аксонов за счет увеличения выработки энергии.
Первые пилотные исследования действительно показали хороший эффект проводимого лечения, более чем у 90% пациентов наблюдалось клиническое улучшение в течение 9.2 мес. при применении биотина в дозах от 100 до 300 мг/сут [205]. После этого исследования в 12-месячном многоцентровом рандомизированном клиническом исследовании сравнивали прием 100 мг биотина 3 раза в день с плацебо у 154 пациентов с прогрессирующим рассеянным склерозом; двигательные показатели умеренно улучшились среди участников, принимавших биотин (12.6%), по сравнению с теми, кто получал плацебо (0%) [235]. Позитивный эффект высокодозного биотина отмечен также Guillevin et al., (2019) у 19 пациентов с РС [86].
Однако в большинстве опубликованных работ не отмечалось эффекта лечения биотином [48, 52, 53, 69, 146] или даже у части пациентов отмечалось некоторое ухудшение в виде увеличения числа обострений и МРТ активности [30, 58]. Описан также случай развития транзиторной миопатии у пациентки на фоне лечения высокой дозой биотина, который компенсировался после отмены биотина [141]. Рядом авторов отмечалось также влияние терапии биотином на лабораторные анализы крови, в частности, при определении тиреотропного гормона, витамина D, креатинкиназы, тропонина и специфического антигена простаты [215]. В этих исследованиях не оценивался уровень биотина, поэтому нельзя исключить, что у пациентов, не отвечавших на терапию или имевших нежелательные явления, не наблюдалось дефицита биотина, в том числе из-за достаточного микробного синтеза. Например, при ВЗК, как показано в исследовании Das et al., распространены виды, потенциально синтезирующие биотин, а виды-ауксотрофы (имеющие гены переносчиков биотина) были значительно менее распространены у субъектов с ВЗК по сравнению со здоровым контролем [54].
Проведенные исследования показывают, что биотин может играть роль при РС, однако необходимы дальнейшие исследования для определения роли дефицита биотина в РС и механизма действия добавок биотина в высоких дозах у пациентов с РС, для выявления целевой группы пациентов, кому будет полезна данная терапия.
ВИТАМИН B9 (ФОЛАТЫ)
Витамин В9, или фолаты (фолиевая кислота), представляют собой ряд биомолекул, характеризующихся наличием комплекса субъединиц птерина, парааминобензойной кислоты (рABA) и глутамата [35], основной биологически доступной формой является тетрагидрофолат (THF) [190]. Фолаты необходимы для нескольких метаболических процессов, включая одноуглеродный перенос, метаболизм метилирования посредством синтеза S-аденозилметионина (SAM) и синтез тимидилатов, пуринов и некоторых аминокислот, участвующих в синтезе и репликации нуклеотидов, репарации и метилировании ДНК [24, 39]. Дефицит фолатов связан с нестабильностью ДНК и разрушением фосфолипидных мембран и, таким образом, может повлиять на целостность миелина [24, 39], а также на функции Treg клеток [112, 163]. Дефициту фолиевой кислоты способствует ряд заболеваний (мальабсорбция, шунтирование желудка, дисфункция поджелудочной железы, воспалительные заболевания кишечника, целиакия, хроническая гемолитическая анемия, алкоголизм), веганская или вегетарианская диеты, прием определенных лекарств (метформин, метотрексат, сульфасалазин, триметоприм, пириметамин, дифенилгидантоин, фенобарбитал, фенитоин, вальпроевая кислота и карбамазепин) [186]. Одним из проявлений дефицита фолиевой кислоты является нарушение целостности кишечника и персистирующая диарея [21].
Диетический фолат существует преимущественно в виде полиглутамата и гидролизуется в кишечнике до моноглутамата, который всасывается в тощей кишке за счет активного и пассивного транспорта. В крови циркулирует в основном 5-метилтетрагидрофолат, который переносится в клетки транспортерами.
Дополнительным источником витамина В9, обеспечивающим ~37% суточной потребности организма, является синтезированный кишечной микробиотой пул [140]. Биосинтез фолиевой кислоты представляет сложный процесс, состоящий из 16 ферментативных реакций [114]. Геномный анализ 256 репрезентативных организмов микробиоты кишечника человека показал, что 43% бактериальных геномов имеют гены пути синтеза фолиевой кислоты de novo. Путь биосинтеза фолиевой кислоты присутствует почти во всех геномах Bacteroidetes, а также в большинстве Fusobacteria и Proteobacteria, но редко встречается в геномах Actinobacteria и Firmicutes, в основном из-за отсутствия пути биосинтеза pABA [140]. Bacteroidetes (рода Prevotella, Bacteroides, Porphyromonas) синтезируют фолат de novo из фосфоенолпирувата и гуанозинтрифосфата (GTP) [109, 179]. В другом исследовании, анализировавшем 512 референсных геномов из кишечного микробиома человека, обнаружено, что бактерии, относящиеся к филумам Proteobacteria, Firmicutes, Actinobacteria и Verrucomicrobia способны синтезировать THF, из них 77% бактериальных геномов содержат гены, способные синтезировать THF в присутствии pABA, 57% бактериальных геномов содержат гены, участвующие в синтезе THF из pABA и дигидроптеринфосфата и только 68 геномов (филумы Firmicutes и Proteobacteria) способны для синтеза фолатов de novo использовать хоризмат [68]. Эти данные свидетельствуют о том, что большинство кишечных бактерий должно получать предшественники в виде пищевых питательных веществ или микробного перекрестного питания, чтобы продуцировать фолаты. Таким образом, различия в составе комменсальных кишечных микробов, продуцирующих глутамилированные производные фолиевой кислоты, могут влиять на биодоступность фолиевой кислоты в кишечнике [68] и в циркуляции [190]. Основным депо фолиевой кислоты является толстая кишка [126], но этот пул не влияет на уровень фолиевой кислоты в плазме [243].
Крысы, которых кормили пробиотическими бифидобактериями, продуцирующими фолиевую кислоту, демонстрировали повышенный уровень фолиевой кислоты в плазме, что подтверждает выработку и усвоение витамина in vivo. Та же добавка при введении людям повышала концентрацию фолиевой кислоты в фекалиях [190].
Фолаты, продуцируемые бактериями, могут поглощаться переносчиками фолиевой кислоты в толстой кишке крысы, свиньи и человека [18, 19, 133, 189].
В отличие от пищевых витаминов, которые в основном всасываются в тонком кишечнике, микробные метаболиты фолиевой кислоты в основном всасываются в толстой кишке, где они вырабатываются и ассимилируются в тканях хозяина [194]. Люминальный фолат или метаболиты, полученные из фолиевой кислоты участвуют в регуляции иммунной функции [122, 252]. Предполагается, что он влияет на метилом Т-клеток, но механизм этого не ясен [139].
В лонгитюдном исследовании с участием 101 пациента с РС был определен статус питания и его связь с утомляемостью. Показано, что ежедневное употребление фолиевой кислоты, а также витамина D, кальция и магния у всех пациентов было значительно ниже, чем рекомендуемая суточная доза, и диета с низким содержанием фолиевой кислоты коррелировала с высокой утомляемостью у пациентов с РС [31].
Исследований по оценке уровня фолиевой кислоты достаточно много, но только в когорте из 21 пациента (Дания) с РС в сыворотке крови уровень фолиевой кислоты был ниже, чем в контрольной группе [106]. Низкий или пониженный уровень фолиевой кислоты, обнаруживаемый у пациентов с РС, может быть связан с предыдущим лечением кортикостероидами [73]. Добавление фолиевой кислоты (200–300 мкг/день) пациентам с РС улучшало неврологический статус пациентов, способствовало регенерации миелина и улучшению общего состояния [116, 241]. В другом исследовании сравнивались эффекты короткого курса иммуносупрессии (циклофосфамид 400–500 мг) у 22 пациентов с РС и сочетанной терапии циклофосфамида с фолиевой кислотой (1 мг 5 раз в неделю в течение 2 нед.) у 20 пациентов. Обе схемы лечения показали одинаковое прогрессирование заболевания [138].
На модели фокального ЭАЭ у крыс оценивалось противовоспалительное действие комплекса фолат-аминоптерин (EC2319). EC2319 хорошо переносился крысами, ослаблял воспаление, уменьшал размеры очагов демиелинизации, снижал экспрессию рецептора фолата FR-β, который у пациентов с РС экспрессируется в хронических активных очагах [67]. Эффекты препарата проявлялись в хроническую прогрессирующую фазу ЭАЭ, но не в острую фазу заболевания 67].
Несомненно, фолиевая кислота является важной регуляторной молекулой, которая может предотвратить связанные с метилированием изменения, способствующие демиелинизации. Недостаточное количество данных о связи между фолиевой кислотой и РС требует дополнительных экспериментальных и клинических исследований роли фолиевой кислоты при нейродегенеративных заболеваниях, таких как РС и возможности ее использования в лечении пациентов. Учитывая, что витамин В9 и витамин В12 являются биологически взаимосвязанными витаминами, функциональная недостаточность фолиевой кислоты может быть связана с дефицитом витамина B12 и необходимо изучать совместные эффекты этих двух витаминов.
ВИТАМИН B12 (КОБАЛАМИН)
Название “витамин В12” (кобаламин) относится ко всем формам группы химически родственных кобальт-содержащих витамерных соединений [178]. Метил-В12 форма витамина является коферментом цитоплазматической метионинсинтетазы (EC 2.1.1.13), поэтому, как и витамин В9, является важным кофактором в реакциях метилирования, необходима для синтеза и репарации ДНК. 5'-дезоксиаденозил-B12 форма витамина является коферментом митохондриальной метилмалонил-КоА-мутазы (EC 5.4.99.2), которая играет роль в катаболизме жирных кислот с нечетной цепью, аминокислот с разветвленной цепью и холестерина [178]. Показано участие витамина В12 в нормальном функционировании нервной системы [248], в формировании миелиновой оболочки [157] и в модуляции активности иммунной системы [202].
Витамин B12 требуется в наименьшем количестве из всех витаминов, его катаболизм очень медленный, а абсорбция ограничена, около 1 мкг всасывается из разовой дозы витамина, следующая доза может быть абсорбирована с той же эффективностью только через 4–6 ч [194]. Витамин В12 транспортируется в клетки белками-переносчиками (гаптокоррином, внутренним фактором, транскобаламином), причем основная часть (80%) витамина В12 транспортируется в неактивной форме [192–194].
Хотя дефицит витамина B12 обычно связан с макроцитарной анемией, неврологические осложнения (миелопатия, периферическая невропатия, когнитивные и аффективные симптомы) часто возникают при отсутствии гематологических проявлений [218]. Дефицит витамина B12 встречается у пациентов с мальабсорбцией, в том числе у тех, кто перенес шунтирование желудка, у пациентов с недостаточностью поджелудочной железы, у пациентов с пернициозной анемией, у лиц, придерживающихся веганской или вегетарианской диеты, или у людей, длительно принимающих определенные лекарства, такие как метформин или антациды. До 20% людей старше 60 лет имеют нарушенный статус B12 [83].
Витамин содержится исключительно в пище животного происхождения. Биосинтез основной структуры витамина В12 осуществляется только бактериями, которые обычно производят гидроксикобаламин. Путь биосинтеза кобаламина присутствует в 42% из 256 референсных геномов HGM, все необходимые гены обнаружены в филуме Fusobacteria, у половины геномов Bacteroidetes, и у отдельных представителей Actinobacteria и Proteobacteria [140]. Среди наиболее активных продуцентов витамина B12 – представители Pseudomonas spp. и Klebsiella spp., продуцирующие активную форму витамина В12, тогда как Clostridia, Veillonella и Fusobacteria преимущественно синтезировали аналоги витамина B12 [9]. В двух других исследованиях показано, что около 80% бактерий содержат гены, кодирующие кобаламин-зависимые ферменты, то есть эти бактерии потребляют кобаламин, при этом большинство из них не имеет генов, необходимых для его синтеза [55, 255]. Это доказывает, что кобаламин такими бактериями поглощается из окружающей среды.
Помимо кобаламина, кишечные бактерии могут продуцировать различные производные корриноидов [87, 128, 150], как минимум, 27 различных семейств [55, 56]. Усвоение этих корриноидов бактериями осуществляется с помощью транспортеров и рецепторов для поглощения корриноидов [55, 56]. Примечательно, что ряд бактерий, в частности некоторые Bacteroidetes получили гены, кодирующие эти транспортеры, путем горизонтального переноса генов из других бактерий [74]. Вероятно, конкуренция и обмен кобаламином, а также его аналогами потенциально могут определять как состав и приспособленность кишечного микробиома, так и статус витамина В12 у человека [56, 81].
Имеется большое количество публикаций по изучению уровня кобаламина при РС, в которых демонстрируется наличие его дефицита (см. ниже). Некоторые пациенты с рассеянным склерозом также страдают мегалобластной анемией или макроцитозом – известными признаками дефицита витамина B12 [185]. Дефицит кобаломина приводит к нарушению синтеза миелина и включению в него аномальных жирных кислот [84].
Всплеск интереса к витамину B12 при рассеянном склерозе отмечался в 1950–1960-е гг. В тот период было опубликовано свыше 15 статей, в которых исследовался уровень витамина B12, однако данные были противоречивыми. В последнее время интерес к витамину В12 возобновился.
У 35 пациентов с РС во время обострения были отмечены более низкие уровни витамина B12 в сыворотке по сравнению с 30 здоровыми людьми из контрольной группы [124]. Аналогично, у 75 пациентов с ремиттирующим РС уровни витамина B12 в сыворотке крови были значительно ниже, чем у здоровых людей [161], при этом выявлена корреляция сниженного уровня витамина В12 с РС [185]. Однако в японской когорте из 24 пациентов с РС не было различий в уровнях витамина B12 в сыворотке крови по сравнению с контрольной группой [121], как и в стадии ремиссии у 60 пациентов с РС [167].
В двух исследованиях сообщалось о снижении уровня витамина B12 в спинномозговой жидкости пациентов с РС [170, 200].
Таким образом, дефицит кобаламина, как и фолиевой кислоты является одним из наиболее часто наблюдаемых дефицитов витаминов группы В у пациентов, страдающих РС. Эти витамины являются важными кофакторами в превращении токсичного гомоцистеина в метионин [186], поэтому не удивительно, что на фоне дефицита кобаламина и фолатов отмечается повышенный уровень гомоцистеина [28, 161, 244]. Мета-анализ 8 исследований подтвердил связь низких уровней витаминов B12 и В9 в сыворотке крови и повышенного уровня гомоцистеина с патогенезом РС [257].
Высокий уровень гомоцистеина приводит к активации иммунной системы, нейровоспалению и усилению окислительного стресса, что является токсичным для клеток ЦНС и способствует нейродегенерации [20, 88, 118, 129, 171, 217]. Высокий уровень гомоцистеина у пациентов с РС связан с клиническим прогрессированием заболевания [191, 232], а более низкие уровни B12 в сыворотке связаны с более ранним возрастом начала рассеянного склероза [198].
Дефицит витамина B12 может нарушать ремиелинизацию при РС, поскольку он играет ключевую роль в синтезе фосфолипидов. Ремиелинизация in vivo после введения высоких доз метилкобаламина (1 мг/кг/день) без каких-либо побочных эффектов отмечалась у крыс с повреждением нерва [175].
Существенно меньше работ по лечению пациентов с РС кобаламином.
Сообщалось, что применение высоких доз метилкобаламина (60 мг/день в течение 6 месяцев) снижало у пациентов с прогрессирующим РС риск рецидива, улучшало показатели по шкале EDSS, а также зрительные и стволовые слуховые вызванные потенциалы [121, 199].
В рандомизированном плацебо-контролируемом двойном слепом исследовании с участием 138 пациентов с РС, витамин B12 в дозе 1 мг, вводимый внутримышечно в течение 24 нед., снизил тяжесть заболевания по шкале неврологической инвалидности (GNDS) на 2 балла, что, согласно шкале, является значительным улучшением [246].
Протективное действие отмечалось также при использовании витамина В12 в комплексной терапии. Так, добавление витамина В12 к иммуномодулирующей терапии (IFN-β) на модели ЭАЭ практически полностью нормализовало двигательную функцию у животных, при этом интенсивность демиелинизации и астроцитоза была ослаблена [144]. Добавление B12 вместе с паклитакселом также существенно уменьшило клинические признаки ЭАЭ у мышей, что сопровождалось подавлением инфильтрации Т-клеток в ЦНС, снижением астроцитоза и уменьшением уровня IFN-γ [145].
Приведенные данные демонстрируют потенциальную пользу терапии метилкобаламином для оптимизации лечения РС, однако для выяснения эффектов регулярного использования витамина B12 требуются дополнительные исследования.
ИСПОЛЬЗОВАНИЕ КОМПЛЕКСОВ ВИТАМИНОВ ГРУППЫ В ПРИ РС
Комбинация витаминов В1, В6 и В12 традиционно используется в неврологической практике. Клинические исследования доказали, что использование такой комбинации витаминов более эффективно, чем монотерапия каким-либо из этих витаминов. Видимо поэтому позитивные результаты при монотерапии витаминами наблюдаются лишь у отдельных пациентов.
Системно-биологический анализ в рамках протеома человека выявил многочисленные потенцирующие взаимодействия витаминов В1, В6, В12 на молекулярном уровне, включающие метаболизм аминокислот, углеводов, липидов, формирование структур нейронов, кроветворение, синтез АТФ и другие. Синергичное действие этих трех витаминов способствует поддержанию миелиновой оболочки, регуляции процессов воспаления посредством нейтрализации токсического действия гомоцистеина [6]. Calderon-Ospina C.A. & Nava-Mesa M.O. [41] также придерживаются точки зрения синергизма действия этих витаминов, предполагая, что витамин B1 обеспечивает нервные клетки энергией и защищает от окислительного стресса как антиоксидант, витамин B6 в первую очередь задействован в нейропротекции, а витамин B12 – в регенерации миелина. Фактически, эти три витамина обладают свойствами, которые могут быть полезными при РС.
В недавнем исследовании Mallone et al., (2020), пациенты с РС со стойким нарушением зрения, связанным с рассеянным склерозом, получали перорально комбинацию высоких доз трех витаминов В (B1 – 300 мг, B6 – 450 мг, B12 – 1500 мкг) в качестве дополнительного лечения к основной терапии препаратами, изменяющими течение РС. Повторное обследование пациентов после проведенного в течение 90 дней лечения показало улучшение параметров зрительной функции [142].
Имеется несколько исследований применения витаминов группы В в различных сочетаниях, в том числе, с другими витаминами.
Одним из таких сообщений было исследование Klenner F., проведенное более 40 лет назад, в котором он назначал пациентам с прогрессирующим РС большие дозы никотинамида (100 мг, за 30 мин до еды и сна) и тиамина (300–500 мг, за 30 мин до еды и сна). Такая схема лечения способствовала регрессу симптомов РС и восстанавливала поврежденные нервные клетки [123].
Еще в 2000 г. Johnson S., высказал гипотезу этиологии РС, связанную с дисбалансом определенных микронутриентов: постепенным накоплением меди, кадмия и железа наряду с усиливающимся дефицитом цинка, магния и витаминов B6 и D и предложил использовать добавку комплекса этих микронутриентов в подростковом возрасте, когда в силу физиологических особенностей организма может возникать их дефицит [110].
Сообщалось о многоцентровом рандомизированном исследовании 94 пациентов с ремитирующим РС и вторично-прогрессирующим РС в стадии обострения, получавших либо базовую терапию (трентал и витамины группы В в виде препарата “Пентовит”), либо эту же терапию вместе с цитофлавином (комбинация никотинамида, рибофлавина, янтарной кислоты и инозина). У всех получавших цитофлавин пациентов отмечен позитивный клинический эффект терапии (более значимый регресс неврологической симптоматики по шкале EDSS по сравнению с группой, не получавшей цитофлавин, снижалась потребность в кортикостероидах для купирования обострения) [5].
В тройном слепом, рандомизированном, плацебо-контролируемом клиническом исследовании оценивалась эффективность витаминно-минерального комплеса (1 капсула содержала: 350 мкг витамина А, 7.5 мг витамина D, 75 мг витамина C, 1.1 мг витамина B1, 1.5 мг витамина B6, 400 мкг витамина B9, 2.4 мкг витамина В12, 250 мг кальция, 160 мг магния, 27 мкг селена, 200 мг Q10 и 100 мг L-карнитина). Через 3 мес. лечения (2 капсулы/день) у пациентов уменьшились признаки воспаления и симптомы усталости [32].
На модели ЭАЭ у крыс Dark Agouti был апробирован комплекс 6-ти витаминов группы В (1 ампула: В1 – 40 мг, В2 – 4 мг, В3 – 100 мг, B5 – 10 мг, B6 – 8 мг, B12 – 4 мкг, Бевиплекс® (Galenika, Сербия)). Ежедневные внутрибрюшинные инъекции в дозе 1.85 мл/кг снизили тяжесть заболевания у крыс и сократили его длительность, при этом проведенное лечение модулировало состав кишечного микробиома [143].
Приведенные исследования показывают, что терапия комплексами витаминов, в том числе с добавками других микронутриентов может представлять перспективную стратегию лечения РС. В этом отношении в качестве биодоступных форм витаминов могут выступать сбалансированные комбинации пробиотических микроорганизмов, которые кроме витаминов будут обеспечивать хозяина и другими необходимыми полезными биологически активными веществами.
ЗАКЛЮЧЕНИЕ
Позитивное действие витаминов группы B на нервную систему установлено давно, и они традиционно используются в неврологии. Многие клинические симптомы, возникающие при дефиците витаминов группы В, характерны также для рассеянного склероза. В ряде случаев, предпринимавшиеся попытки применять высокие дозы тиамина, ниацина, биотина, рибофлавина для лечения РС были успешными. Действительно, эти витамины способны подавлять воспаление, оказывать нейропротективное действие и способствовать ремиелинизации и, могут рассматриваться как потенциальное средство для лечения РС. В свете установленной роли кишечной микробиоты как в патогенезе РС, так и в синтезе витаминов группы В, мы делаем два предположения. Первое – изменение состава кишечной микробиоты, наблюдаемое при РС, может приводить к дефициту витаминов группы В из-за увеличения количества ауксотрофных видов, особенно на фоне обедненной витаминами группы В диете и при применении ряда иммуномодулирующих средств. Второе – восполнение дефицита витаминов группы с помощью сбалансированной диеты, синтетических препаратов или пробиотических штаммов, синтезирующих эти витамины, может оказаться перспективной стратегией лечения РС.
Несмотря на разработку улучшенных вариантов лечения ремиттирующего РС, прогрессирование заболевания все еще представляет нерешенную проблему. Применяемая иммуномодулирующая терапия не способствует восстановлению нейронов и не ускоряет процесс ремиелинизации, поэтому поиск веществ, воздействующих на эти мишени, является актуальной задачей. Витамины группы В являются естестественными веществами, вовлекаемыми в эти процессы. Сочетанное применение нейропротективных витаминов группы В с основной иммуномодулирующей терапии может влиять на разные патогенетические мишени, а также – помочь снизить нежелательные явления последней и повысить качество жизни пациентов. Выявленные ранее негативные последствия применения витаминов группы В могут быть связаны с тем, что как недостаток, так и избыток витаминов может оказывать неблагоприятное воздействие. В связи с этим необходим персонализированный подход к назначению конкретных витаминов и используемых доз, а также контроль эндогенного уровня витаминов. Кроме того, необходимо понять относительный вклад кишечного микробиома в общий гомеостаз витаминов группы В в организме и, как изменение состава микробиома при РС влияет на статус этих витаминов. Микробный пул витаминов необходимо учитывать при назначении витаминов, так как он может влиять на эффективность лечения.
Работа поддержана грантом РНФ и Санкт-Петербургского Научного Фонда № 22-25-20191.
Список литературы
Абдурасулова И.Н., Клименко В.М. Гетерогенность механизмов повреждения нервных клеток при демиелинизирующих аутоиммунных заболеваниях ЦНС // Росс. Физиол. Журн. им. И.М. Сеченова. 2010. Т. 96. № 1. С. 50.
Абдурасулова И.Н., Клименко В.М. Роль иммунных и глиальных клеток в процессах нейродегенерации // Медицинский академический журн. 2011. Т. 1. № 1. С. 12. https://doi.org/10.17816/MAJ11112-29
Абдурасулова И.Н., Тарасова Е.А., Мацулевич А.В. и др. Влияние бифидобактерий в составе кишечной микробиоты на течение рассеянного склероза // Проблемы медицинской микологии. 2022. Т. 24. № 2. С. 38.
Абдурасулова И.Н. Роль микробиоты кишечника в патогенезе рассеянного склероза. Часть 1. Клинические и экспериментальные доказательства вовлечения микробиоты кишечника в развитие рассеянного склероза // Медицинский академический журн. 2022. Т. 22. № 2. С. 9. https://doi.org/10.17816/MAJ108241
Бисага Г.Н., Одинак М.М., Бойко А.Н., Мельник Ю.Б., Попова Н.Ф. Возможности лечения обострений рассеянного склероза без применения кортикостероидов: роль метаболической и антиоксидантной терапии // Журн. Неврологии и Психиатрии им. С.С. Корсакова. 2011. Т. 111. № 2. С. 44.
Громова О.А., Торшин И.Ю., Прокопович О.А. Синергидные нейропротекторные эффекты тиамина, пиридоксина и цианокобаламина в рамках протеома человека // Consilium Medicum. Неврология и Ревматология (Прил.). 2016. Т. 2. С. 76.
Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека) // Методические рекомендации (МР 2.3.1.0253-21) от 22.07.2021 г.
Abdou E., Hazell A.S. Thiamine deficiency: An update of pathophysiologic mechanisms and future therapeutic considerations // Neurochem. Res. 2015. V. 40. № 2. P. 353. https://doi.org/10.1007/s11064-014-1430-z
Albert M.J., Mathan V.I., Baker S.J. Vitamin B12 synthesis by human small intestinal bacteria // Nature. 1980. V. 283. № 5749. P. 781. https://doi.org/10.1038/283781a0
Anagnostouli M., Livaniou E., Nyalala J.O. et al. Cerebrospinal fluid levels of biotin in various neurological disorders // Acta Neurol. Scand. 1999. V. 99. № 6. P. 387. https://doi.org/10.1111/j.1600-0404.1999.tb07369.x
Anderson B.B., Scattoni M., Perry G.M. et al. Is the flavin-deficient red blood cell common in Maremma, Italy, an important defense against malaria in this area? // Am. J. Hum. Genet. 1994. V. 55. № 5. P. 975.
Anzalone S., Vetreno R.P., Ramos R.L., Savage L.M. Cortical cholinergic abnormalities contribute to the amnesic state induced by pyrithiamine-induced thiamine deficiency in the rat // Eur. J. Neurosci. 2010. V. 32. № 5. P. 847. https://doi.org/10.1111/j.1460-9568.2010.07358.x
Aring C.D., Spies T.D. Vitamin B deficiency and nervous disease // J. Neurol. Psychiatry. 1939. V. 2. № 4. P. 335. https://doi.org/10.1001/jama.1960.73020300005019c
Arumugam M., Raes J., Pelletier E. et al. Enterotypes of the human gut microbiome // Nature. 2011. V. 473. P. 174. https://doi.org/10.1038/nature09944
Ascherio A., Munger K. L., White R. et al. Vitamin D as an early predictor of multiple sclerosis activity and progression // JAMA Neurol. 2014. V. 71. № 3. P. 306. https://doi.org/10.1001/jamaneurol.2013.5993
Ascherio A., Munch M. Epstein–Barr virus and multiple sclerosis // Epidemiology. 2000. V. 11. № 2. P. 220. https://doi.org/10.1097/00001648-2000030000-00023
Ashoori M., Saedisomeolia A. Riboflavin (vitamin B2) and oxidative stress: a review // Br. J. Nutr. 2014. V. 111. № 11. P. 1985. https://doi.org/10.1017/S0007114514000178
Asrar F.M., O’Connor D.L. Bacterially synthesized folate and supplemental folic acid are absorbed across the large intestine of piglets // J. Nutr. Biochem. 2005. V. 16. № 10. P. 587. https://doi.org/10.1016/j.jnutbio.2005.02.006
Aufreiter S., Gregory J.F.3rd, Pfeiffer C.M. et al. Folate is absorbed across the colon of adults: evidence from cecal infusion of (13)C-labeled [6S]-5-formyltetrahydrofolic acid // Am. J. Clin. Nutr. 2009. V. 90. № 1. P. 116. https://doi.org/10.3945/ajcn.2008.27345
Au-Yeung K.K.W., Yip J.C.W., Siow Y.L., Karmin O. Folic acid inhibits homocysteine-induced superoxide anion production and nuclear factor kappa B activation in macrophages // Can. J. Physiol. Pharmacol. 2006. V. 84. № 1. P. 141. https://doi.org/10.1139/Y05-136
Awuchi C.G., Igwe V.S., Amagwula I.O. Nutritional diseases and nutrient toxicities: a systematic review of the diets and nutrition for prevention and treatment // Int. J. Adv. Acad. Res. 2020. V. 6. № 1. P. 1.
Bâ A. Metabolic and structural role of thiamine in nervous tissues // Cell. Mol. Neurobiol. 2008. V. 28. № 7. P. 923. https://doi.org/10.1007/s10571-008-9297-7
Badawy A.A. Kynurenine Pathway of Tryptophan Metabolism: Regulatory and Functional Aspects // Int. J. Tryptophan Res. 2017. V. 10. P. 1178646917691938. https://doi.org/10.1177/1178646917691938
Baggott J.E., Tamura T. Folate-dependent purine nucleotide biosynthesis in humans // Adv. Nutr. 2015. V. 6. № 5. P. 564. https://doi.org/10.3945/an.115.008300
Bagur M.J., Murcia M.A., Jiménez-Monreal A.M. et al. Influence of diet in multiple sclerosis: A systematic review // Adv. Nutr. 2017. V. 8. № 3. P. 463. https://doi.org/10.3945/an.116.014191
Basu T.K., Mann S. Vitamin B-6 normalizes the altered sulfur amino acid status of rats fed diets containing pharmacological levels of niacin without reducing niacin’s hypolipidemic effects // J. Nutr. 1997. V. 127. № 1. P. 117. https://doi.org/10.1093/jn/127.1.117
Bates C. Riboflavin // Int. J. Vitam. Nutr. Res. 1993. V. 63. № 4. P. 274.
Besler H.T., Comoğlu S. Lipoprotein oxidation, plasma total antioxidant capacity and homocysteine level in patients with multiple sclerosis // Nutr. Neurosci. 2003. V. 6. № 3. P. 189. https://doi.org/10.1080/1028415031000115945
Biesalski H.K. Nutrition meets the microbiome: micronutrients and the microbiota // Ann. N.Y. Acad. Sci. 2016. V. 1372. № 1. P. 53. https://doi.org/10.1111/nyas.13145
Birnbaum G., Stulc J. High Dose Biotin As Treatment for Progressive Multiple Sclerosis // Mult. Scler. Relat. Disord. 2017. V. 18. P. 141. https://doi.org/10.1016/j.msard.2017.09.030
Bitarafan S., Harirchian M.-H., Nafissi S. et al. Dietary intake of nutrients and its correlation with fatigue in multiple sclerosis patients // Iran. J. Neurol. 2014. V. 13. № 1. P. 28.
Bitarafan S., Karimi E., Moghadasi A.N. et al. Impact of supplementation with “multivitamin-mineral” specially formulated to improve fatigue and inflammatory state in patients with multiple sclerosis: A triple-blind, randomized, placebo-controlled trial // Curr. J. Neurol. 2020. V. 19. № 4. P. 180. https://doi.org/10.18502/cjn.v19i4.5545
Blad C.C., Tang C., Offermanns S. G protein-coupled receptors for energy metabolites as new therapeutic targets // Nat. Rev. Drug Discov. 2012. V. 11. № 8. P. 603. https://doi.org/10.1038/nrd3777
Blaut M., Clavel T. Metabolic diversity of the intestinal microbiota: Implication for health and disease // J. Nutr. 2007. V. 137. P. 751. https://doi.org/10.1093/jn/137.3.751S
Blom H.J., Shaw G.M., den Heijer M., Finnell R.H. Neural tube defects and folate: case far from closed // Nat. Rev. Neurosci. 2006. V. 7. № 9. P. 724. https://doi.org/10.1038/nrn1986
Bourquin F., Capitani G., Grütter M.G. PLP-dependent enzymes as entry and exit gates of sphingolipid metabolism // Protein Sci. 2011. V. 20. № 9. P. 1492. https://doi.org/10.1002/pro.679
Braniste V., Al-Asmakh M., Kowal C. et al. The gut microbiota influences blood brain barrier permeability in mice // Sci. Transl. Med. 2014. V. 6. № 263. P. 263ra158. https://doi.org/10.1126/scitranslmed.3009759
Brestoff J.R., Artis D. Commensal bacteria at the interface of host metabolism and the immune system // Nat. Immunol. 2013. V. 14. № 7. P. 676. https://doi.org/10.1038/ni.2640
Brosnan M.E., MacMillan L., Stevens J.R., Brosnan J.T. Division of labour: how does folate metabolism partition between one-carbon metabolism and amino acid oxidation? // Biochem. J. 2015. V. 472. № 2. P. 135. https://doi.org/10.1042/BJ20150837
Butterworth R.F. Thiamin deficiency and brain disorders // Nutr. Res. Rev. 2003. V. 16. № 2. P. 277. https://doi.org/10.1079/NRR200367
Calderón-Ospina C.A., Nava-Mesa M.O. B Vitamins in the nervous system: Current knowledge of the biochemical modes of action and synergies of thiamine, pyridoxine, and cobalamin // CNS Neurosci. Ther. 2020. V. 26. P. 5. https://doi.org/10.1111/cns.13207
Campbell G., Mahad D.J. Mitochondrial dysfunction and axon degeneration in progressive multiple sclerosis // FEBS Lett. 2018. V. 592. P. 113. https://doi.org/10.1002/1873-3468.13013
Carrothers J.M., York M.A., Brooker S.L. et al. Fecal Microbial Community Structure Is Stable over Time and Related to Variation in Macronutrient and Micronutrient Intakes in Lactating Women // J. Nutr. 2015. V. 145. № 10. P. 2379. https://doi.org/10.3945/jn.115.211110
Castagnet S., Blasco H., Vourc’h P., Andres C.R., Praline J. Chronic demyelinating polyneuropathy and B6 hypervitaminosis // Rev. Med. Interne. 2010. V. 31. № 12. e1. https://doi.org/10.1016/j.revmed.2010.03.457
Castro-Quezada I., Román-Viñas B., Serra-Majem L. The mediterranean diet and nutritional adequacy: A review // Nutrients. 2014. V. 6. № 1. P. 231. https://doi.org/10.3390/nu6010231
Celis A.I., Relman D.A. Competitors versus Collaborators: Micronutrient Processing by Pathogenic and Commensal Human-Associated Gut Bacteria // Mol. Cell. 2020. V. 78. № 4. P. 570. https://doi.org/10.1016/j.molcel.2020.03.032
Clemente J.C., Pehrsson E.C., Blaser M.J. et al. The microbiome of uncontacted Amerindians // Sci. Adv. 2015. V. 1. № 3. e1500183. https://doi.org/10.1126/sciadv.1500183
Collongues N., Kuhle J., Tsagkas C. et al. Biomarkers of treatment response in patients with progressive multiple sclerosis treated with high-dose pharmaceutical-grade biotin (MD1003) // Brain Behav. 2021. V. 11. № 2. e01998. https://doi.org/10.1002/brb3.1998
Cordain L., Eaton S.B., Sebastian A. et al. Origins and evolution of the western diet: Health implications for the 21st century // Am. J. Clin. Nutr. 2005. V. 81. № 2. P. 341. https://doi.org/10.1093/ajcn.81.2.341
Costantini A., Nappo A., Pala M.I., Zappone A. High dose thiamine improves fatigue in multiple sclerosis // BMJ Case Rep. 2013. bcr2013009144. https://doi.org/10.1136/bcr-2013-009144
Costliow Z.A., Degnan P.H. Thiamine Acquisition Strategies Impact Metabolism and Competition in the Gut Microbe Bacteroides thetaiotaomicron // mSystems. 2017. V. 2. № 5. e00116-17. https://doi.org/10.1128/mSystems.00116-17
Couloume L., Barbin L., Leray E. et al. High-dose biotin in progressive multiple sclerosis: A prospective study of 178 patients in routine clinical practice // Mult. Scler. 2020. V.26. № 14. P. 1898. https://doi.org/10.1177/1352458519894713
Cree B.A.C., Cutter G., Wolinsky J.S. et al. SPI2 investigative teams. Safety and efficacy of MD1003 (high-dose biotin) in patients with progressive multiple sclerosis (SPI2): a randomised, double-blind, placebo-controlled, phase 3 trial // Lancet Neurol. 2020. V. 19. № 12. P. 988. https://doi.org/10.1016/S1474-4422(20)30347-1
Das P., Babaei P., Nielsen J. Metagenomic analysis of microbe-mediated vitamin metabolism in the human gut microbiome // BMC Genomics. 2019. V. 20. № 1. P. 208. https://doi.org/10.1186/s12864-019-5591-7
Degnan P.H., Barry N.A., Mok K.C., Taga M.E., Goodman A.L. Human gut microbes use multiple transporters to distinguish vitamin B12 analogs and compete in the gut // Cell Host Microbe. 2014. V. 15. № 1. P. 47. https://doi.org/10.1016/j.chom.2013.12.007
Degnan P.H., Taga M.E., Goodman A.L. Vitamin B12 as a modulator of gut microbial ecology // Cell Metabolism. 2014. V. 20. № 5. P. 769. https://doi.org/10.1016/j.cmet.2014.10.002
de la Rubia Ortí J.E., Cuerda-Ballester M., Drehmer E. et al. Vitamin B1 Intake in Multiple Sclerosis Patients and its Impact on Depression Presence: A Pilot Study // Nutrients. 2020. V. 12. № 9. P. 2655. https://doi.org/10.3390/nu12092655
Demas A., Cochin J.-P., Hardy C. et al. Tardive reactivation of progressive multiple sclerosis during treatment with biotin // Neurol. Ther. 2020. V. 9. № 1. P. 181. https://doi.org/10.1007/s40120-019-00175-2
den Besten G., van Eunen K., Groen A.K. et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism // J. Lipid Res. 2013. V. 54. № 9. P. 2325. https://doi.org/10.1194/jlr.R036012
Depeint F., Bruce W.R., Shangari N., Mehta R., O’Brien P.J. Mitochondrial function and toxicity: Role of the B vitamin family on mitochondrial energy metabolism // Chem. Biol. Interact. 2006. V. 163. № 1–2. P. 94. https://doi.org/10.1016/j.cbi.2006.04.014
Depeint F., Bruce W.R., Shangari N., Mehta R., O’Brien P.J. Mitochondrial function and toxicity: Role of B vitamins on the one-carbon transfer pathways // Chem. Biol. Interact. 2006. V. 163. № 1–2. P. 113. https://doi.org/10.1016/j.cbi.2006.05.010
Dinan T.G., Cryan J.F. The microbiome-gut-brain axis in health and disease // Gastroenterol. Clin. North. Am. 2017. V. 46. № 1. P. 77. https://doi.org/10.1016/j.gtc.2016.09.007
di Salvo M.L., Contestabile R., Safo M.K. Vitamin B6 salvage enzymes: mechanism, structure and regulation // Biochim. Biophys. Acta. 2011. V. 1814. № 11. P. 1597. https://doi.org/10.1016/j.bbapap.2010.12.006
Du X., Yang Y., Zhan X. et al. Vitamin B6 prevents excessive inflammation by reducing accumulation of sphingosine-1-phosphate in a sphingosine-1-phosphate lyase–dependent manner // J. Cell. Mol. Med. 2020. V. 24. № 22. P. 13129. https://doi.org/10.1111/jcmm.15917
Eckburg P.B., Bik E.M., Bernstein C.N. et al. Diversity of the human intestinal microbial flora // Science. 2005. V. 308. № 5728. P. 1635. https://doi.org/10.1126/science.1110591
el-Hindi H.M., Amer H.A. Effect of thiamine, magnesium, and sulfate salts on growth, thiamine levels, and serum lipid constituents in rats // J. Nutr. Sci. Vitaminol (Tokyo). 1989. V. 35. № 5. P. 505. https://doi.org/10.3177/jnsv.35.505
Elo P., Li X.-G., Liljenbäck H. et al. Efficacy and tolerability of folate aminopterin therapy in a rat focal model of multiple sclerosis // J. Neuroinflammation. 2021. V. 18. № 1. P. 30. https://doi.org/10.1186/s12974-021-02073-7
Engevik M.A., Morra C.N., Röth D. et al. Microbial metabolic capacity for intestinal folate production and modulation of host folate receptors // Front. Microbiol. 2019. V. 10. P. 2305. https://doi.org/10.3389/fmicb.2019.02305
Espiritu A.I., Remalante–Rayco P.P.M. High-dose biotin for multiple sclerosis: A systematic review and meta-analyses of randomized controlled trials // Mult. Scler. Rel. Disord. 2021. V. 55. P. 103159. https://doi.org/10.1016/ j.msard.2021.103159
Fangmann D., Theismann E.-M., Türk K. et al. Targeted Microbiome Intervention by Microencapsulated Delayed-Release Niacin Beneficially Affects Insulin Sensitivity in Humans // Diabetes Care. 2018. V. 41. № 3. P. 398. https://doi.org/10.2337/dc17-1967
Frame L.A., Costa E., Jackson S.A. Current explorations of nutrition and the gut microbiome: a comprehensive evaluation of the review literature // Nutr. Rev. 2020. V. 78. № 10. P. 798. https://doi.org/10.1093/nutrit/nuz106
Francini-Pesenti F., Brocadello F., Famengo S., Nardi M., Caregaro L. Wernicke’s encephalopathy during parenteral nutrition // JPEN J. Parenter. Enteral. Nutr. 2007. V. 31. № 1. P. 69. https://doi.org/10.1177/014860710703100169
Frequin S.T., Wevers R.A., Braam M., Barkhof F., Hommes O.R. Decreased vitamin B12 and folate levels in cerebrospinal fluid and serum of multiple sclerosis patients after high-dose intravenous methylprednisolone // J. Neurol. 1993. V. 240. № 5. P. 305. https://doi.org/10.1007/BF00838168
Frye K.A., Piamthai V., Hsiao A., Degnan P.H. Mobilization of vitamin B12 transporters alters competitive dynamics in a human gut microbe // Cell Rep. 2021. V. 37. № 13. P. 110164. https://doi.org/10.1016/j.celrep.2021.110164
Gasperi V., Sibilano M., Savini I., Catani M.V. Niacin in the central nervous system: an update of biological aspects and clinical applications // Int. J. Mol. Sci. 2019. V. 20. № 4. P. 974. https://doi.org/10.3390/ijms20040974
Gazzaniga F., Stebbins R., Chang S.Z., McPeek M.A., Brenner C. Microbial NAD metabolism: lessons from comparative genomics // Microbiol. Mol. Biol. Rev. 2009. V. 73. P. 529. https://doi.org/10.1128/MMBR.00042-08
Ghadirian P., Jain M., Ducic S., Shatenstein B., Morisset R. Nutritional factors in the aetiology of multiple sclerosis: a case-control study in Montreal, Canada // Int. J. Epidemiol. 1998. V. 27. № 5. P. 845.https://doi.org/10.1093/ije/27.5.845
Ghasemi N., Razavi S., Nikzad E. Multiple sclerosis: Pathogenesis, symptoms, diagnoses and cell-based therapy // Cell J. 2017. V. 19. № 1. P. 1. https://doi.org/10.22074/cellj.2016.4867
Ghosal A., Lambrecht N., Subramanya S.B., Kapadia R., Said H.M. Conditional knockout of the Slc5a6 gene in mouse intestine impairs biotin absorption // Am. J. Physiol. Gastrointest. Liver Physiol. 2013. V. 304. № 1. P. 64. https://doi.org/10.1152/ajpgi.00379.2012
Gibiino G., Lopetuso L.R., Scaldaferri F. et al. Exploring Bacteroidetes: Metabolic key points and immunological tricks of our gut commensals // Dig. Liver Dis. 2018. V. 50. 7. P. 635. https://doi.org/10.1016/j.dld.2018.03.016
Goodman A.L., McNulty N.P., Zhao Y. et al. Identifying genetic determinants needed to establish a human gut symbiont in its habitat // Cell Host Microbe. 2009. V. 6. № 3. P. 279. https://doi.org/10.1016/j.chom.2009.08.003
Gordon H.A., Pesti L. The gnotobiotic animal as a tool in the study of host microbial relationship // Bacteriological. Rev. 1971. V. 35. № 4. P. 390. https://doi.org/10.1128/br.35.4.390-429.1971
Green R., Allen L.H., Bjørke-Monsen A.L. et al. Vitamin B12 deficiency // Nat. Rev. Dis. Primers. 2017. V. 3. P. 17040. https://doi.org/10.1038/nrdp.2017.40
Gröber U., Kisters K., Schmidt J. Neuroenhancement with vitamin B12-underestimated neurological significance // Nutrients. 2013. V. 5. № 12. P. 5031. https://doi.org/10.3390/nu5125031
Gu Q., Li P. Biosynthesis of Vitamins by Probiotic Bacteria // Probiotics and Prebiotics in Human Nutrition and Health. 2016. Ch 6. P. 135. https://doi.org/10.5772/63117
Guillevin C., Agius P., Naudin M. et al. 1H-31P magnetic resonance spectroscopy: effect of biotin in multiple sclerosis // Ann. Clin. Transl. Neurol. 2019. V. 6. № 7. P. 1332. https://doi.org/10.1002/acn3.50825
Guimarães D.H., Weber A., Klaiber I., Vogler B., Renz P. Guanylcobamide and hypoxanthylcobamide-Corrinoids formed by Desulfovibrio vulgaris // Arch. Microbiol. 1994. V. 162. P. 272. https://doi.org/10.1007/BF00301850
Haan M.N., Miller J.W., Aiello A.E. et al. Homocysteine, B vitamins, and the incidence of dementia and cognitive impairment: results from the Sacramento area Latino study on aging // Am. J. Clin. Nutr. 2007. V. 85. № 2. P. 511. https://doi.org/10.1093/ajcn/85.2.511
Hadadi N., Berweiler V., Wang H., Trajkovski M. Intestinal microbiota as a route for micronutrient bioavailability // Curr. Opin. Endocr. Metab. Res. 2021. V. 20. P. 100 285. https://doi.org/10.1016/j.coemr.2021.100285
Hakim M., Kurniani N., Pinzon R.T. et al. Management of peripheral neuropathy symptoms with a fixed dose combination of high-dose vitamin B1, B6 and B12: a 12-week prospective non-interventional study in Indonesia // Asian J. Med. Sci. 2018. V. 9. № 1. P. 32. https://doi.org/10.3126/ajms.v9i1.18510
Hankes L.V., Coenen H.H., Rota E. et al. Effect of Huntington’s and Alzheimer’s diseases on the transport of nicotinic acid or nicotinamide across the human blood brain barrier // Adv. Exp. Med. Biol. 1991. V. 294. P. 675. https://doi.org/10.1007/978-1-4684-5952-4_91
Hansen N.W., Sams A. The Microbiotic Highway to Health–New Perspective on Food Structure, Gut Microbiota, and Host Inflammation // Nutrients. 2018. V. 10. № 11. P. 1590. https://doi.org/10.3390/nu10111590
Harbige L.S. Nutrition and immunity with emphasis on infection and autoimmune disease // Nutr. Health. 1996. V. 10. № 4. P. 285. https://doi.org/10.1177/026010609601000401
Hashimoto T., Perlot T., Rehman A. et al. ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation // Nature. 2012. V. 487. P. 477. https://doi.org/10.1038/nature11228
Hayashi A., Mikami Y., Miyamoto K. et al. Intestinal Dysbiosis and Biotin Deprivation Induce Alopecia through Overgrowth of Lactobacillus murinus in Mice // Cell Rep. 2017. V. 20. № 7. P. 1513. https://doi.org/10.1016/j.celrep.2017.07.057
Hazell A.S., Butterworth R.F. Update of cell damage mechanisms in thiamine deficiency: focus on oxidative stress, excitotoxicity and inflammation // Alcohol Alcohol. 2009. V. 44. № 2. P. 141. https://doi.org/10.1093/alcalc/agn120
Hedström A.K., Alfredsson L., Olsson T. Environmental factors and their interactions with risk genotypes in MS susceptibility // Curr. Opin. Neurol. 2016. V. 29. № 3. P. 293. https://doi.org/10.1097/WCO.0000000000000329
Hegyi J., Schwartz R.A., Hegyi V. Pellagra: dermatitis, dementia, and diarrhea // Int. J. Dermatol. 2004. V. 43. № 1. P. 1. https://doi.org/10.1111/j.1365-4632.2004.01959.x
Heinken A., Khan M.T., Paglia G. et al. Functional metabolic map of Faecalibacterium prausnitzii, a beneficial human gut microbe // J. Bacteriol. 2014. V. 196. № 18. P. 3289. https://doi.org/10.1128/JB.01780-14
Hoban A.E., Stilling R.M., Ryan F.J. et al. Regulation of prefrontal cortex myelination by the microbiota // Transl. Psychiatry. 2016. V. 6. № 4. e774. https://doi.org/10.1038/tp.2016.42
Huang S.-C., Wei J.C.-C., Wu D.J., Huang Y.-C. Vitamin B(6) supplementation improves pro-inflammatory responses in patients with rheumatoid arthritis // Eur. J. Clin. Nutr. 2010. V. 64. № 9. P. 1007. https://doi.org/10.1038 / ejcn.2010.107
Huang S., Ma J., Zhu M., Ran Z.V. Status of serum vitamin B12 and folate in patients with inflammatory bowel disease in China // Intest. Res. 2017. V. 15. № 1. P. 103. https://doi.org/10.5217/ir.2017.15.1.103
Huskisson E., Maggini S., Ruf M. The role of vitamins and minerals in energy metabolism and well-being // J. Int. Med. Res. 2007. V. 35. № 35. P. 277. https://doi.org/10.1177/147323000703500301
Hwang C., Ross V., Mahadevan U. Micronutrient deficiencies in inflammatory bowel disease: from a to zinc // Inflamm. Bowel Dis. 2012. V. 18. № 10. P. 1961. https://doi.org/10.1002/ibd.22906
International Multiple Sclerosis Genetics Consortium; Wellcome Trust Case Control Consortium 2; Sawcer S., Hellenthal G., Pirinen M. et al. Genetic risk and a primary role for cell-mediated immune mechanisms in multiple sclerosis // Nature. 2011. V. 476. № 7359. P. 214. https://doi.org/10.1038/nature10251
Isager H. Serum folate in patients with multiple sclerosis // Acta Neurol. Scand. 1970. V. 46. № 2. P. 238. https://doi.org/10.1111/j.1600-0404.1970.tb05619.x
Jankowska–Kulawy A., Bielarczyk H., Pawełczyk T., Wróblewska M., Szutowicz A. Acetyl-CoA deficit in brain mitochondria in experimental thiamine deficiency encephalopathy // Neurochem. Int. 2010. V. 57. № 7. P. 851. https://doi.org/10.1016/j.neuint.2010.09.003
Ji Z., Fan Z., Zhang Y. et al. Thiamine deficiency promotes T cell infiltration in experimental autoimmune encephalomyelitis: the involvement of CCL2 // J. Immunol. 2014. V. 193. № 5. P. 2157. https://doi.org/10.4049/jimmunol.1302702
Johnson E.L., Heaver S.L., Walters W.A. Ley R.E. Microbiome and metabolic disease: revisiting the bacterial phylum Bacteroidetes // J. Mol. Med. (Berl). 2017. V. 95. № 1. P. 1. https://doi.org/10.1007/s00109-016-1492-2
Johnson S. The possible role of gradual accumulation of copper, cadmium, lead and iron and gradual depletion of zinc, magnesium, selenium, vitamins B2, B6, D, and E and essential fatty acids in multiple sclerosis // Med. Hypotheses. 2000. V. 55. № 3. P. 239. https://doi.org/10.1054/mehy.2000.1051
Johnson W.D., Storts R.W. Peripheral neuropathy associated with dietary riboflavin deficiency in the chicken, I: light microscopic study // Vet. Pathol. 1988. V. 25. № 1. P. 9. https://doi.org/10.1177/030098588802500102
Kalekar L.A., Schmiel S.E., Nandiwada S.L. et al. CD4+ T cell anergy prevents autoimmunity and generates regulatory T cell precursors // Nat. Immunol. 2016. V. 17. № 3. P. 304. https://doi.org/10.1038 / ni.3331
Kamanna V.S., Kashyap M.L. Mechanism of action of niacin // Am. J. Cardiol. 2008. V. 101. P. 20B. https://doi.org/10.1016/j.amjcard.2008.02.029
Kanehisa M., Goto S. // KEGG: kyoto encyclopedia of genes and genomes // Nucleic. Acids. Res. 2000. V. 28. № 1. P. 27. https://doi.org https://doi.org/10.1093/nar/28.1.27
Kaneko S., Wang J., Kaneko M. et al. Protecting axonal degeneration by increasing nicotinamide adenine dinucleotide levels in experimental autoimmune encephalomyelitis models // J. Neurosci. 2006. V. 26. № 38. P. 9794. https://doi.org/10.1523/JNEUROSCI.2116-06.2006
Kanevskaia S.A., Kravets A.S., Slesarenko E.V., Shevchenko V.I., Tkachenko N.V. Folic acid in the combined treatment of patients with disseminated sclerosis and chronic gastritis // Vrach. Delo. 1990. V. 4. P. 96. (In Russ).
Karpe F., Frayn K.N. The nicotinic acid receptor–a new mechanism for an old drug // Lancet. 2004. V. 363. P. 1892. https://doi.org/10.1016/S0140-6736(04)16359-9
Kennedy D.O. B Vitamins and the Brain: Mechanisms, Dose and Efficacy–A Review // Nutrients. 2016. V. 8. № 2. P. 68. https://doi.org/10.3390/nu8020068
Khan M.T., Duncan S.H., Stams A.J.M. et al. The gut anaerobe Faecalibacterium prausnitzii uses an extracellular electron shuttle to grow at oxic-anoxic interphases // ISME J. 2012. V. 6. № 8. P. 1578. https://doi.org/10.1038/ismej.2012.5
Kimura S., Ohtuki N., Nezu A., Tanaka M., Takeshita S. Clinical and radiologic improvements in mitochondrial encephalomyelopathy following sodium dichloroacetate therapy // Brain Dev. 1997. V. 19. № 8. P. 535. https://doi.org/10.1016/s0387-7604(97)00074-0
Kira J., Tobimatsu S., Goto I. Vitamin B12 metabolism and massive-dose methyl vitamin B12 therapy in Japanese patients with multiple sclerosis // Intern. Med. 1994. V. 33. № 2. P. 82. https://doi.org/10.2169/internalmedicine.33.82
Kjer-Nielsen L., Patel O., Corbett A.J. et al. MR1 presents microbial vitamin B metabolites to MAIT cells // Nature. 2012. V. 491. № 7426. P. 717. https://doi.org/10.1038/nature11605
Klenner F.B. Response of Peripheral and Central Nerve Pathology to Mega-Doses of the Vitamin B-Complex and Other Metabolites // J. Appl. Nutr. 1973. https://www.tldp.com/issue/11_00/klenner.htm
Kocer B., Engur S., Ak F., Yılmaz M. Serum vitamin B12, folate, and homocysteine levels and their association with clinical and electrophysiological parameters in multiple sclerosis // J. Clin. Neurosci. 2009. V. 16. № 3. P. 399. https://doi.org/10.1016/j.jocn.2008.05.015
Koike H., Watanabe H., Inukai A. et al. Myopathy in thiamine deficiency: Analysis of a case // J. Neurol. Sci. 2006. V. 249. № 2. P. 175. https://doi.org/10.1016/j.jns.2006.06.016
Kok D.E., Steegenga W.T., McKay J.A. Folate and epigenetics: why we should not forget bacterial biosynthesis // Epigenomics. 2018. V. 10. № 9. P. 1147. https://doi.org/10.2217/epi-2018-0117
Komatsu F., Kagawa Y., Kawabata T. et al. Influence of essential trace minerals and micronutrient insufficiencies on harmful metal overload in a Mongolian patient with multiple sclerosis // Curr. Aging Sci. 2012. V. 5. № 2. P. 112. https://doi.org/10.2174/1874609811205020112
Kräutler B., Fieber W., Ostermann S. et al. The cofactor of tetrachloroethene reductive dehalogenase of Dehalospirillum multivorans is norpseudo-B12, a new type of a natural corrinoid // Helv. Chim. Acta. 2003. V. 86. № 11. P. 3698. https://doi.org/10.1002/hlca.200390313
Kruman I.I., Culmsee C., Chan S.L. et al. Homocysteine elicits a DNA damage response in neurons that promotes apoptosis and hypersensitivity to excitotoxicity // J. Neurosci. 2000. V. 20. № 18. P. 6920. https://doi.org/10.1523/JNEUROSCI.20-18-06920.2000
Kumar J.S., Subramanian V.S., Kapadia R., Kashyap M.L., Said H.M. Mammalian colonocytes possess a carrier-mediated mechanism for uptake of vitamin B3 (niacin): studies utilizing human and mouse colonic preparations // Am. J. Physiol. Gastrointest. Liver Physiol. 2013. V. 305. № 3. P G207. https://doi.org/10.1152/ajpgi.00148.2013
Kurnasov O., Goral V., Colabroy K. et al. NAD biosynthesis: identification of the tryptophan to quinolinate pathway in bacteria // Chem. Biol. 2003. V. 10. № 12. P. 1195. https://doi.org/10.1016/j.chembiol.2003.11.011
Lakhan R., Said H.M. Lipopolysaccharide inhibits colonic biotin uptake via interference with membrane expression of its transporter: a role for a casein kinase 2-mediated pathway // Am. J. Physiol. Cell Physiol. 2017. V. 312. № 4. P. C376. https://doi.org/10.1152/ajpcell.00300.2016
Lakoff A., Fazili Z., Aufreiter S. et al. Folate is absorbed across the human colon: evidence by using enteric-coated caplets containing 13C-labeled [6S]-5-formyltetrahydrofolate // Am. J. Clin. Nutr. 2014. V. 100. № 5. P. 1278. https://doi.org/10.3945/ajcn.114.091785
Lassmann H., Brück W., Lucchinetti C. The immunopathology of multiple sclerosis: an overview // Brain Pathol. 2007. V. 17. № 2. P. 210. https://doi.org/10.1111/j.1750-3639.2007.00064.x
Lassmann H. Multiple sclerosis: Lessons from molecular neuropathology // Exp. Neurol. 2014. V. 262. P. 2. https://doi.org/10.1016/j.expneurol.2013.12.003
LeBlanc J.G., Milani C., de Giori G.S. et al. Bacteria as vitamin suppliers to their host: a gut microbiota perspective // Curr. Opin. Biotechnol. 2013. V. 24. № 2. P.160. https://doi.org/10.1016/j.copbio.2012.08.005
Ley R.E., Peterson D.A., Gordon J.I. Ecological and evolutionary forces shaping microbial diversity in the human intestine // Cell. 2006. V. 124. № 4. P. 837. https://doi.org/10.1016/j.cell.2006.02.017
Likosky W.H., Fireman B., Elmore R. et al. Intense immunosuppression in chronic progressive multiple sclerosis: the Kaiser study // J. Neurol. Neurosurg. Psychiatry. 1991. V. 54. № 12. P. 1055. https://doi.org/10.1136/jnnp.54.12.1055
Luo A., Leach S.T., Barres R. et al. The microbiota and epigenetic regulation of T Helper 17/regulatory T cells: in search of a balanced immune system // Front. Immunol. 2017. V. 8. P. 417. https://doi.org/10.3389/fimmu.2017.00417
Magnúsdóttir S., Ravcheev D., de Crécy-Lagard V., Thiele I. Systematic genome assessment of B-vitamin biosynthesis suggests co-operation among gut microbes // Front. Genet. 2015. V. 6. P. 148. https://doi.org/10.3389/fgene.2015.00148
Maillart E., Mochel F., Acquaviva C., Maisonobe T., Stankoff B. Severe transient myopathy in a progressive multiple sclerosis patient with high-dose biotin // Neurol. 2019. V. 92. № 22. P. 1060. https://doi.org/10.1212/WNL.0000000000007576
Mallone F., Lucchino L., Franzone F. et al. High-dose vitamin B supplementation for persistent visual deficit in multiple sclerosis: a pilot study // Drug Discov. Ther. 2020. V. 14. № 3. P. 122. https://doi.org/10.5582/ddt.2020.03031
Mandić M., Mitić K., Nedeljković P. et al. Vitamin B Complex and Experimental Autoimmune Encephalomyelitis-Attenuation of the Clinical Signs and Gut Microbiota Dysbiosis // Nutrients. 2022. V. 14. № 6. P. 1273. https://doi.org/10.3390/nu14061273
Mastronardi F.G., Min W., Wang H. et al. Attenuation of experimental autoimmune encephalomyelitis and nonimmune demyelination by IFN-beta plus vitamin B12: treatment to modify notch-1/sonic hedgehog balance // J. Immunol. 2004. V. 172. № 10. P. 6418. https://doi.org/10.4049/jimmunol.172.10.6418
Mastronardi F.G., Tsui H., Winer S. et al. Synergy between paclitaxel plus an exogenous methyl donor in the suppression of murine demyelinating diseases // Mult. Scler. 2007. V. 13. № 5. P. 596. https://doi.org/10.1177/1352458506072167
Mathais S., Moisset X., Pereira B. et al. Relapses in Patients Treated with High-Dose Biotin for Progressive Multiple Sclerosis // Neurotherapeutics. 2021. V. 18. № 1. P. 378. https://doi.org/10.1007/s13311-020-00926-2
Mazmanian S.K., Liu C.H., Tzianabos A.O., Kasper D.L. An immunoregulatory molecule of symbiotic bacteria directs maturation of the host immune system // Cell. 2005. V. 122. № 1. P. 107. https://doi.org/10.1016/j.cell.2005.05.007
McKay K.A., Jahanfar S., Duggan T., Tkachuk S., Tremlett H. Factors associated with onset, relapses or progression in multiple sclerosis: a systematic review // Neurotoxicology. 2017. V. 61. P. 189. https://doi.org/10.1016/j.neuro.2016.03.020
Meikle A.W., Wittek P.J., Klain G.J. An aberration of glucose metabolism and steroidogenesis in adrenals of thiamin-deficient rats // Endocrinology. 1972. V. 91. № 5. P. 1206. https://doi.org/10.1210/endo-91-5-1206
Men Y., Seth E.C., Yi S. et al. Identification of specific corrinoids reveals corrinoid modification in dechlorinating microbial communities // Environ. Microbiol. 2015. V. 17. № 12. P. 4873. https://doi.org/10.1111/1462-2920.12500
Merra G., Noce A., Marrone G. et al. Influence of Mediterranean Diet on Human Gut Microbiota // Nutrients. 2021. V. 13. № 1. P. 7. https://doi.org/10.3390/nu13010007
Meydani S.N., Ribaya-Mercado J.D., Russell R.M. et al. Vitamin B-6 deficiency impairs interleukin 2 production and lymphocyte proliferation in elderly adults // Am. J. Clin. Nutr. 1991. V. 53. № 5. P. 1275. https://doi.org/10.1093/ajcn/53.5.1275
Mielcarz D.W., Kasper L.H. The Gut Microbiome in Multiple Sclerosis // Curr. Treat. Options Neurol. 2015. V. 17. № 4. P. 344. https://doi.org/10.1007/s11940-015-0344-7
Miki T., Goto R., Fujimoto M. et al. The Bactericidal Lectin RegIIIβ Prolongs Gut Colonization and Enteropathy in the Streptomycin Mouse Model for Salmonella Diarrhea // Cell Host Microbe. 2017. V. 21. P. 195. https://doi.org/10.1016/j.chom.2016.12.008
Mikkelsen K., Stojanovska L., Tangalakis K., Bosevski M., Apostolopoulos V. Cognitive decline: a vitamin B perspective // Maturitas. 2016. V. 93. P. 108. https://doi.org/10.1016/j.maturitas.2016.08.001
Mikkelsen K., Stojanovska L., Prakash M., Apostolopoulos V. The effects of vitamin B on the immune/cytokine network and their involvement in depression // Maturitas. 2017. V. 96. P. 58. https://doi.org/10.1016/j.maturitas.2016.11.012
Miller A., Korem M., Almog R., Galboiz Y. Vitamin B12, demyelination, remyelination and repair in multiple sclerosis // J. Neurol. Sci. 2005. V. 233. № 1–2. P. 93. https://doi.org/10.1016/j.jns.2005.03.009
Miller K.L., Trifan G., Testai F.D. Neurology of Nutritional Deficiencies // Curr. Neurol. Neurosci. Rep. 2019. V. 19. № 12. P. 101. https://doi.org/10.1007/s11910-019-1011-2
Miller J.W., Ribaya-Mercado J.D., Russell R.M. et al. Effect of vitamin B-6 deficiency on fasting plasma homocysteine concentrations // Am. J. Clin. Nutr. 1992. V. 55. № 6. P. 1154. https://doi.org/10.1093/ajcn/55.6.1154
Miyake S., Kim S., Suda W. et al. Dysbiosis in the gut microbiota of patients with multiple sclerosis, with a striking depletion of species belonging to Clostridia XIVa and IV clusters // PLoS One. 2015. V. 10. № 9. e0137429. https://doi.org/10.1371/journal.pone.0137429
Moghaddasi M., Mamarabadi M., Mohebi N., Razjouyan H., Aghaei M. Homocysteine, vitamin B12 and folate levels in Iranian patients with Multiple Sclerosis: a case control study // Clin. Neurol. Neurosurg. 2013. V. 115. № 9. P. 1802. https://doi.org/10.1016/j.clineuro.2013.05.007
Moore M.T. Treatment of multiple sclerosis with nicotinic acid and vitamin B1 // Arch. Intern. Med. (Chic). 1940. V. 65. № 1. P. 1. https://doi.org/10.1001/archinte.1940.00190070011001
Morales M.S., Mueller D. Anergy into T regulatory cells: an integration of metabolic cues and epigenetic changes at the Foxp3 conserved non-coding sequence 2 // F1000Res. 2018. V. 7. P. 1938. https://doi.org/10.12688/f1000research.16551.1
Morra M., Philipszoon H.D., D’Andrea G. et al. Sensory and motor neuropathy caused by excessive ingestion of vitamin B6: a case report // Funct. Neurol. 1993. V. 8. № 6. P. 429.
Naghashpour M., Amani R., Sarkaki A. et al. Brain-derived neurotrophic and immunologic factors: beneficial effects of riboflavin on motor disability in murine model of multiple sclerosis // Iran J. Basic Med. Sci. 2016. V. 19. № 4. P. 439.
Naghashpour M., Majdinasab N., Shakerinejad G. et al. Riboflavin supplementation to patients with multiple sclerosis does not improve disability status nor is riboflavin supplementation correlated to homocysteine // Int. J. Vitam. Nutr. Res. 2013. V. 83. № 5. P. 281. https://doi.org/10.1024/0300-9831/a000170
Najafi M.R., Shaygannajad V., Mirpourian M., Gholamrezaei A. Vitamin B(12) Deficiency and Multiple Sclerosis; Is there Any Association? // Int. J. Prev. Med. 2012. V. 3. № 4. P. 286.
Nardone R., Höller Y., Storti M. et al. Thiamine deficiency induced neurochemical, neuroanatomical, and neuropsychological alterations: A reappraisal // Sci. World J. 2013. V. 2013. P. 309143. https://doi.org/10.1155/2013/309143
Nemazannikova N., Mikkleson K., Stojanovska L., Blatch G.L, Apostolopoulos V. Is there a link between vitamin B and multiple sclerosis? // Med. Chem. 2018. V. 14. № 2. P. 170. https://doi.org/10.2174/1573406413666170906123857
Nijst T.Q., Wevers R.A., Schoonderwaldt H.C., Hommes O.R., de Haan A.F. Vitamin B12 and folate concentrations in serum and cerebrospinal fluid of neurological patients with special reference to multiple sclerosis and dementia // J. Neurol. Neurosurg. Psychiatry. 1990. V. 53. № 11. P. 951. https://doi.org/10.1136/jnnp.53.11.951
Nilsson K., Gustafson L., Hultberg B. Elevated plasma homocysteine level in vascular dementia reflects the vascular disease process // Dement. Geriatr. Cogn. Dis. Extra. 2013. V. 3. № 1. P. 16. https://doi.org/10.1159/000345981
Obeid R., McCaddon A., Herrmann W. The role of hyperhomocysteinemia and B-vitamin deficiency in neurological and psychiatric diseases // Clin. Chem. Lab. Med. 2007. V. 45. № 12. P. 1590. https://doi.org/10.1515/CCLM.2007.356
Offermanns S., Schwaninger M. Nutritional or pharmacological activation of HCA(2) ameliorates neuroinflammation // Trends Mol. Med. 2015. V. 21. № 4. P. 245. https://doi.org/10.1016/j.molmed.2015.02.002
Offermanns S. Hydroxy-Carboxylic Acid Receptor Actions in Metabolism // Trends Endocrinol. Metab. 2017. V. 28. № 3. P. 227. https://doi.org/10.1016/j.tem.2016.11.007
Okada K., Tanaka H., Temporin K. et al. Methylcobalamin increases Erk1/2 and Akt activities through the methylation cycle and promotes nerve regeneration in a rat sciatic nerve injury model // Exp. Neurol. 2010. V. 222. № 2. P. 191. https://doi.org/10.1016/j.expneurol.2009.12.017
Parra M., Stahl S., Hellmann H. Vitamin B6 and Its Role in Cell Metabolism // Cells. 2018. V. 7. № 7. P. 84. https://doi.org/10.3390/cells7070084
Penberthy W.T., Tsunoda I. The Importance of NAD in Multiple Sclerosis // Curr. Pharm. Des. 2009. V. 15. № 1. P. 64. https://doi.org/10.2174/138161209787185751
Pratt J.M., Thorp R.G. The Chemistry of Vitamin B12. Part. V. The Class (b) Character of the Cobaltic Ion Inorganic Chemistry of Vitamin B12 // J. Chem. Soc. A. 1966. P. 187. https://doi.org/10.1039/J19660000187
Putnam E.E., Goodman A.L. B vitamin acquisition by gut commensal bacteria // PLoS Pathog. 2020. V. 16. № 1. P. e1008208. https://doi.org/10.1371/ journal.ppat.1008208
Qi B., Kniazeva M., Han M. A vitamin-B2-sensing mechanism that regulates gut protease activity to impact animal’s food behavior and growth // Elife. 2017. V. 6. e26243. https://doi.org/10.7554/eLife.26243
Qin J., Li R., Raes J. et al. A human gut microbial gene catalogue established by metagenomic sequencing // Nature. 2010. V. 464. № 7285. P. 59. https://doi.org/10.1038/nature08821
Raichle M.E. Two views of brain function // Trends Cogn. Sci. 2010. V. 14. № 4. P. 180. https://doi.org/10.1016/j.tics.2010.01.008
Rall L.C., Meydani S.N. Vitamin B6 and immune competence // Nutr. Rev. 1993. V. 51. № 8. P. 217. https://doi.org/10.1111/j.1753-4887.1993.tb03109.x
Rawji K.S., Young A.M.H., Ghosh T. et al. Niacin-mediated rejuvenation of macrophage/microglia enhances remyelination of the aging central nervous system // Acta Neuropathol. 2020. V. 139. № 5. P. 893. https://doi.org/10.1007/s00401-020-02129-7
Reynolds E.H., Linnell J.C., Faludy J.E. Multiple sclerosis associated with vitamin B12 deficiency // Arch. Neurol. 1991. V. 48. № 8. P. 808. https://doi.org/10.1001/archneur.1991.00530200044017
Reynolds E. Vitamin B12, folic acid, and the nervous system // Lancet Neurol. 2006. V. 5. № 11. P. 949. https://doi.org/10.1016/S1474-4422(06)70598-1
Riccio P. The molecular basis of nutritional intervention in multiple sclerosis: a narrative review // Complement Ther. Med. 2011. V. 19. № 4. P. 228. https://doi.org/10.1016/j.ctim.2011.06.006
Rojo D., Méndez-García C., Raczkowska B.A. et al. Exploring the human microbiome from multiple perspectives: factors altering its composition and function // FEMS Microbiol. Rev. 2017. V. 41. № 4. P. 453–478. https://doi.org/10.1093/femsre/fuw046
Rong N., Selhub J., Goldin B.R., Rosenberg I.H. Bacterially synthesized folate in rat large intestine is incorporated into host tissue folyl polyglutamates // J. Nutr. 1991. V. 121. № 12. P. 1955. https://doi.org/10.1093/jn/121.12
Rossi M., Amaretti A., Raimondi S. Folate production by probiotic bacteria // Nutrients. 2011. V. 3. № 1. P. 118. https://doi.org/10.3390/nu3010118
Russo C., Morabito F., Luise F. et al. Hyperhomocysteinemia is associated with cognitive impairment in multiple sclerosis // J. Neurol. 2008. V. 255. № 1. P. 64. https://doi.org/10.1007/s00415-007-0668-7
Said H.M., Kumar C. Intestinal absorption of vitamins // Curr. Opin. Gastroenterol. 1999. V. 15. № 2. P. 172. https://doi.org/10.1097/00001574-199903000-00015
Said H.M., Mohammed Z.M. Intestinal absorption of water-soluble vitamins: an update // Curr. Opin. Gastroenterol. 2006. V. 22. № 2. P. 140. https://doi.org/10.1097/01.mog.0000203870.22706.52
Said H.M., Nexo E. Gastrointestinal Handling of Water-Soluble Vitamins // Compr. Physiol. 2018. V. 8. № 4. P. 1291. https://doi.org/10.1002/cphy.c170054
Salemi G., Gueli M.C., Vitale F. et al. Blood lipids, homocysteine, stress factors, and vitamins in clinically stable multiple sclerosis patients // Lipids Health Dis. 2010. V. 9. № 19. P. 19. https://doi.org/10.1186/1476-511X-9-19
Sampson T.R., Mazmanian S.K. Control of Brain Development, Function, and Behavior by the Microbiome // Cell Host Microbe. 2015. V. 17. № 5. P. 565. https://doi.org/10.1016/j.chom.2015.04.011
Sanada Y., Kumoto T., Suehiro H. et al. RASSF6 expression in adipocytes is down-regulated by interaction with macrophages // PLoS One. 2013. V. 8. № 4. e61931. https://doi.org/10.1371/journal.pone.0061931
Sandyk R., Awerbuch G.I. Vitamin B12 and its relationship to age of onset of multiple sclerosis // Int. J. Neurosci. 1993. V. 71. № 1–4. P. 93. https://doi.org/10.3109/00207459309000596
Scalabrino G., Buccellato F.R., Veber D., Mutti E. New basis of the neurotrophic action of vitamin B12 // Clin. Chem. Lab. Med. 2003. V. 41. № 11. P. 1435. https://doi.org/10.1515/CCLM.2003.220
Scalabrino G., Veber D., De Giuseppe R., Roncaroli F. Low levels of cobalamin, epidermal growth factor, and normal prions in multiple sclerosis spinal cord // Neuroscience. 2015. V. 298. P. 293. https://doi.org/10.1016/j.neuroscience.2015.04.020
Schlenz M.A., Schlenz M.B., Wöstmann B. et al. Riboflavin Is an Important Determinant of Vitamin B-6 Status in Healthy Adults // J. Nutr. 2020. V. 150. № 10. P. 2699. https://doi.org/10.1093/jn/nxaa225
Schroecksnadel K., Frick B., Wirleitner B. et al. Moderate hyperhomocysteinemia and immune activation // Curr. Pharm. Biotechnol. 2004. V. 5. № 1. P. 107. https://doi.org/10.2174/1389201043489657
Schwarz M.J., Guillemin G.J., Teipel S.J., Buerger K., Hampel H. Increased 3-hydroxykynurenine serum concentrations differentiate Alzheimer’s disease patients from controls // Eur. Arch. Psychiatry Clin. Neurosci. 2013. V. 263. № 4. P. 345. https://doi.org/10.1007/s00406-012-0384-x
Sedaghat F., Jessri M., Behrooz M., Mirghotbi M., Rashidkhani B. Mediterranean diet adherence and risk of multiple sclerosis: a case-control study // Asia Pac. J. Clin. Nutr. 2016. V. 25. № 2. P. 377. https://doi.org/10.6133/apjcn.2016.25.2.12
Sedel F., Papeix C., Bellanger A. et al. High doses of biotin in chronic progressive multiple sclerosis: a pilot study // Mult. Scler. Relat. Disord. 2015. V. 4. № 2. P. 159. https://doi.org/10.1016/j.msard.2015.01.005
Segal I., Tim L.O., Demetriou A. et al. Rectal manifestations of pellagra // Int. J. Colorectal Dis. 1986. V. 1. № 4. P. 238. https://doi.org/10.1007/BF01648345
Selhub J., Byun A., Liu Z. et al. Dietary vitamin B6 intake modulates colonic inflammation in the IL10–/– model of inflammatory bowel disease // J. Nutr. Biochem. 2013. V. 24. №12. P. 2138. https://doi.org/10.1016/j.jnutbio.2013.08.005
Serbus L.R., Rodriguez B.G., Sharmin Z., Momtaz A.J.M.Z., Christensen S. Predictive Genomic Analyses Inform the Basis for Vitamin Metabolism and Provisioning in Bacteria-Arthropod Endosymbioses // G3 (Bethesda). 2017. V. 7. № 6. P.1887. https://doi.org/10.1534/g3.117.042184
Serra-Majem L., Bes-Rastrollo M., Román-Viñas B. et al. Dietary patterns and nutritional adequacy in a mediterranean country // Br. J. Nutr. 2009. V. 101 (Suppl. 2). P. S21. https://doi.org/10.1017/S0007114509990559
Shen Y., Xu J., Li Z. et al. Analysis of gut microbiota diversity and auxiliary diagnosis as a biomarker in patients with schizophrenia: A cross-sectional study // Schizophr. Res. 2018. V. 197. P. 470. https://doi.org/10.1016/j.schres.2018.01.002
Shibata K., Onodera M. Comparison of Tryptophan-Niacin Conversion in Rats Fed with a Nicotinic Acid-Free Diet Containing Egg White, Egg White Proteolysate, or Mixtures of Amino Acid // Agric. Biol. Chem. 1991. V. 55. № 5. P. 1291. https://doi.org/10.1080/00021369.1991.10870775
Shibata K., Nakata C., Fukuwatari T. Moderate Food Restriction Suppresses the Conversion of L-tryptophan to Nicotinamide in Weaning Rats // Biosci. Biotechnol. Biochem. 2014. V. 78. P. 478. https://doi.org/10.1080/09168451.2014.890025
Shibata K., Kobayashi R., Fukuwatari T. Vitamin B1 Deficiency Inhibits the Increased Conversion of Tryptophan to Nicotinamide in Severe Food-Restricted Rats // Biosci. Biotechnol. Biochem. 2015. V. 79. № 1. P. 103. https://doi.org/10.1080/09168451.2014.962473
Shibata K. Organ Co-Relationship in Tryptophan Metabolism and Factors That Govern the Biosynthesis of Nicotinamide from Tryptophan // J. Nutr. Sci. Vitaminol. 2018. V. 64. № 2. P. 90. https://doi.org/10.3177/jnsv.64.90
Siddiqui U., Egnor E., Sloane J.A. Biotin supplementation in MS clinically valuable but can alter multiple blood test results // Mult. Scler. 2017. V. 23. № 4. P. 619. https://doi.org/10.1177/1352458516680751
Singh N., Gurav A., Sivaprakasam S. et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis // Immunity. 2014. V. 40. № 1. P. 128. https://doi.org/10.1016/j.immuni.2013.12.007
Sly L.M., Lopez M., Nauseef W.M., Reiner N.E. 1alpha,25-Dihydroxyvitamin D3-induced monocyte antimycobacterial activity is regulated by phosphatidylinositol 3-kinase and mediated by the NADPH-dependent phagocyte oxidase // J. Biol. Chem. 2001. V. 276. № 38. P. 35482. https://doi.org/10.1074/jbc.M102876200
Solomon L.R. Cobalamin-responsive disorders in the ambulatory care setting: unreliability of cobalamin, methylmalonic acid, and homocysteine testing // Blood. 2005. V. 105. № 3. P. 978. https://doi.org/10.1182/blood-2004-04-1641
Sospedra M., Martin R. Immunology of multiple sclerosis // Annu. Rev. Immunol. 2005. V. 23. P. 683. https://doi.org/10.1146/annurev.immunol.23.021704.115707
Spector R. Niacin and niacinamide transport in the central nervous system. In vivo studies // J. Neurochem. 1979. V. 33. № 4. P. 895. https://doi.org/10.1111/j.1471-4159.1979.tb09919.x
Spector R. Vitamin transport diseases of brain: Focus on folates, thiamine and riboflavin // Brain Disord. Ther. 2014. V. 3. № 2. P. 1.
Sriram K., Manzanares W., Joseph K. Thiamine in nutrition therapy // Nutr. Clin. Pract. 2012. V. 27. № 1. P. 41. https://doi.org/10.1177/0884533611426149
Stankiewicz J., Panter S.S., Neema M. et al. Iron in Chronic Brain Disorders: Imaging and Neurotherapeutic Implications // Neurotherapeutics. 2007. V. 4. № 3. P. 371. https://doi.org/10.1016/j.nurt.2007.05.006
Stein E.D., Diamond J.M. Do dietary levels of pantothenic acid regulate its intestinal uptake in mice? // J. Nutr. 1989. V. 119. № 12. P. 1973. https://doi.org/10.1093/jn/119.12.1973
Steinert R.E., Sadabad M.S., Harmsen H.J.M., Weber P. The prebiotic concept and human health: a changing landscape with riboflavin as a novel prebiotic candidate? // Eur. J. Clin. Nutr. 2016. V. 70. № 12. P. 1348. https://doi.org/10.1038/ejcn.2016.119
Steinert R.E., Lee Y.-K., Sybesma W. Vitamins for the Gut Microbiome // Trends Mol. Med. 2019. V. 26. № 2. P. 137. https://doi.org/10.1016/j.molmed.2019.11.005
Stephenson E., Nathoo N., Mahjoub Y., Dunn J., Yong V.W. Iron in multiple sclerosis: roles in neurodegeneration and repair // Nat. Rev. Neurol. 2014. V. 10. № 8. P. 459. https://doi.org/10.1038 / nrneurol.2014.118
Street H.R., Cowgill G.R., Zimmerman H.M. Some Observations of Vitamin B6 Deficiency in the Dog: Three Figures // J. Nutrition. 1941. V. 21. № 3. P. 275. https://doi.org/10.1093/jn/21.3.275
Subramanian V.S., Subramanya S.B., Ghosal A., Said H.M. Chronic alcohol feeding inhibits physiological and molecular parameters of intestinal and renal riboflavin transport // Am. J. Physiol. Cell Physiol. 2013. V. 305. № 5. P. C539. https://doi.org/10.1152/ajpcell.00089.2013
Subramanian V.S., Lambrecht N., Lytle C., Said H.M. Conditional (intestinal-specific) knockout of the riboflavin transporter-3 (RFVT-3) impairs riboflavin absorption // Am. J. Physiol. Gastrointest. Liver Physiol. 2016. V. 310. № 4. P. G285. https://doi.org/10.1152/ajpgi.00340.2015
Swanson K.V., Deng M., Ting J.P.-Y. The NLRP3 inflammasome: molecular activation and regulation to therapeutics // Nat. Rev. Immunol. 2019. V. 19. № 8. P. 477. https://doi.org/10.1038/s41577-019-0165-0
Teunissen C.E., Killestein J., Kragt J.J. et al. Serum homocysteine levels in relation to clinical progression in multiple sclerosis // J. Neurol. Neurosurg. Psychiatry. 2008. V. 79. № 12. P. 1349. https://doi.org/10.1136/jnnp.2008.151555
Thakur K., Tomar S.K., De S. Lactic acid bacteria as a cell factory for riboflavin production // Microb. Biotechnol. 2016. V. 9. № 4. P. 441. https://doi.org/10.1111/1751-7915.12335
Thakur K., Tomar S.K., Singh A.K., Mandal S., Arora S. Riboflavin and health: A review of recent human research // Crit. Rev. Food Sci. Nutr. 2017. V. 57. № 17. P. 3650. https://doi.org/10.1080/10408398.2016.1145104
Tourbah A., Lebrun-Frenay C., Edan G. el al. MD1003 (high-dose biotin) for the treatment of progressive multiple sclerosis: a randomised, double-blind, placebo-controlled study // Mult. Scler. 2016. V. 22. № 13. P. 1719. https://doi.org/10.1177/1352458516667568
Uchida Y., Ito K., Ohtsuki S. et al. Major involvement of Na+-dependent multivitamin transporter (SLC5A6/SMVT) in uptake of biotin and pantothenic acid by human brain capillary endothelial cells // J. Neurochem. 2015. V. 134. № 1. P. 97. https://doi.org/10.1111/jnc.13092
Uebanso T., Yoshimoto A., Aizawa S. et al. Glycolate is a Novel Marker of Vitamin B 2 Deficiency Involved in Gut Microbe Metabolism in Mice // Nutrients. 2020. V. 12. № 3. P. 736. https://doi.org/10.3390/nu12030736
Ueland P.M., Ulvik A., Rios-Avila L., Midttun Ø., Gregory J.F. Direct and functional biomarkers of vitamin B6 status // Annu. Rev. Nutr. 2015. V. 35. P. 33. https://doi.org/10.1146/annurev-nutr-071714-034330
Vagianos K., Bector S., McConnell J., Bernstein C.N. Nutrition assessment of patients with inflammatory bowel disease // JPEN J. Parenter. Enteral. Nutr. 2007. V. 31. № 4. P. 311. https://doi.org/10.1177/0148607107031004311
van Horssen J., Schreibelt G., Drexhage J. et al. Severe oxidative damage in multiple sclerosis lesions coincides with enhanced antioxidant enzyme expression // Free Radic. Biol. Med. 2008. V. 45. № 12. P. 1729. https://doi.org/10.1016/j.freeradbiomed.2008.09.023
van Rensburg S.J., Kotze M.J., Hon D. et al. Iron and the folate-vitamin B12-methylation pathway in multiple sclerosis // Metab. Brain Dis. 2006. V. 21. № 2–3. P. 121. https://doi.org/10.1007/s11011-006-9019-0
Vernau K., Napoli E., Wong S. et al. Thiamine Deficiency-Mediated Brain Mitochondrial Pathology in A laskan H uskies with Mutation in SLC19A3. 1 // Brain Pathol. 2015. V. 25. № 4. P. 441. https://doi.org/10.1111/bpa.12188
Virk B., Jia J., Maynard C.A. et al. Folate Acts in E. coli to Accelerate C. elegans Aging Independently of Bacterial Biosynthesis // Cell Rep. 2016. V. 14. № 7. P. 1611. https://doi.org/10.1016/j.celrep.2016.01.051
Vrethem M., Mattsson E., Hebelka H. et al. Increased plasma homocysteine levels without signs of vitamin B12 deficiency in patients with multiple sclerosis assessed by blood and cerebrospinal fluid homocysteine and methylmalonic acid // Mult. Scler. 2003. V. 9. № 3. P. 239. https://doi.org/10.1191/1352458503ms918oa
Vrolijk M.F., Opperhuizen A., Jansen E.H.J.M. et al. The vitamin B6 paradox: Supplementation with high concentrations of pyridoxine leads to decreased vitamin B6 function // Toxicol. in Vitro. 2017. V. 44. P. 206. https://doi.org/10.1016/j.tiv.2017.07.009
Wade D.T., Young C.A., Chaudhuri K.R., Davidson D.L.W. A randomised placebo controlled exploratory study of vitamin B-12, lofepramine, and L-phenylalanine (the “Cari Loder regime”) in the treatment of multiple sclerosis // J. Neurol. Neurosurg. Psychiatry. 2002. V. 73. № 3. P. 246. https://doi.org/10.1136/jnnp.73.3.246
Wang X., Wang J., Rao B., Deng L. Gut flora profiling and fecal metabolite composition of colorectal cancer patients and healthy individual // Exp. Ther. Med. 2022. V. 23. № 4. P. 250. https://doi.org/10.3892/etm.2022.11175
Weinstein S.J., Hartman T.J., Stolzenberg-Solomon R. et al. Null association between prostate cancer and serum folate, vitamin B(6), vitamin B(12), and homocysteine // Cancer Epidemiol. Biomarkers Prev. 2003. V. 12. P. 1271. https://pubmed.ncbi.nlm.nih.gov/14652294/
WHO/FAO. Vitamin and Mineral Requirements in Human Nutrition. 2nd ed. Report of a joint WHO/FAO Expert Consultation, Bangkok, Thailand 1998. Geneva: World Health Organization/Rome: Food and Agriculture Organization of the United Nations (2004). https://www.fao.org/3/y2809e/y2809e.pdf
Wostmann B.S. The germfree animal in nutritional studies // Ann. Rev. Nutr. 1981. V. 1. P. 257. https://doi.org/10.1146/annurev.nu.01.070181.001353
Yao Y., Yonezawa A., Yoshimatsu H. et al. Identification and comparative functional characterization of a new human riboflavin transporter hRFT3 expressed in the brain // J. Nutr. 2010. V. 140. № 7. P. 1220. https://doi.org/10.3945/jn.110.122911
Yoshii K., Hosomi K., Sawane K., Kunisawa J. Metabolism of Dietary and Microbial Vitamin B Family in the Regulation of Host Immunity // Front. Nutr. 2019. V. 6. P. 48. https://doi.org/10.3389/fnut.2019.00048
Zempleni J., Galloway J.R., McCormick D.B. The metabolism of riboflavin in female patients with liver cirrhosis // Am. J. Clin. Nutr. 1996. V. 63. № 3. P. 54.
Zhang J., Chen J., Li Y. et al. Niaspan treatment improves neurological functional recovery in experimental autoimmune encephalomyelitis mice // Neurobiol. Dis. 2008. V. 32. № 2. P. 273. https://doi.org/10.1016/j.nbd.2008.07.01
Zhang Y., Rodionov D.A., Gelfand M.S., Gladyshev V.N. Comparative genomic analyses of nickel, cobalt and vitamin B12 utilization // BMC Genomics. 2009. V. 10. P. 78. https://doi.org/10.1186/1471-2164-10-78
Zhong W., Li Q., Zhang W. et al. Modulation of Intestinal Barrier and Bacterial Endotoxin Production Contributes to the Beneficial Effect of Nicotinic Acid on Alcohol-Induced Endotoxemia and Hepatic Inflammation in Rats // Biomolecules. 2015. V. 5. № 4. P. 2643. https://doi.org/10.3390/biom5042643
Zhu Y., He Z.-Y., Liu H.-N. Meta-analysis of the relationship between homocysteine, vitamin B12, folate, and multiple sclerosis // J. Clin. Neurosci. 2011. V. 18. № 7. P. 933. https://doi.org/10.1016 / j.jocn.2010.12.022
Zoetendal E.G., Raes J., van den Bogert B. et al. The human small intestinal microbiota is driven by rapid uptake and conversion of simple carbohydrates // ISME J. 2012. V. 6. № 7. P. 1415. https://doi.org/10.1038/ismej.2011.212
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


