Вестник РАН, 2022, T. 92, № 7, стр. 647-653
ЭПИДЕМИОЛОГИЯ И ДИАГНОСТИКА COVID-19. МОНИТОРИНГ ЭВОЛЮЦИОННЫХ ИЗМЕНЕНИЙ ВИРУСА SARS-COV-2
В. Г. Акимкин *
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Москва, Россия
* E-mail: vgakimkin@yandex.ru
Поступила в редакцию 29.12.2021
После доработки 10.01.2022
Принята к публикации 28.02.2022
- EDN: NRFRLG
- DOI: 10.31857/S0869587322070027
Аннотация
В статье представлены результаты научных исследований эпидемиологических особенностей новой коронавирусной инфекции (COVID-19) и молекулярно-генетических характеристик геновариантов вируса SARS-CoV-2, основанные на опыте работы Центрального научно-исследовательского института эпидемиологии Федеральной службы по надзору в сфере защиты прав потребителей и защиты прав человека (Роспотребнадзор).
С декабря 2019 г. по настоящее время в мире развивается пандемия новой коронавирусной инфекции COVID-19, вызванная оболочечным одноцепочечным РНК-вирусом SARS-CoV-2, относящимся к семейству Sarbecovirus рода Betacoronavirus [1–4]. Данные об этом вирусе содержат базы геномов GISAID (https://www.gisaid.org), GenBank (https://www.ncbi.nlm.nih.gov). В России соответствующая база данных VGARuS (https://genome.crie.ru/app/index) создана в ЦНИИ эпидемиологии Роспотребнадзора. Филогенетический анализ проводится с помощью классификаторов Nexstrain (https://nextstrain.org) и Pangolin (https://cov-lineages.org/resources/pangolin.html).
Основной механизм передачи SARS-CoV-2 – аэрогенный. Микрочастицы аэрозоля размерностью от 1 до 10 мкм способны проникать в глубокие отделы дыхательных путей, их эпидемиологическое значение в распространении COVID-19 наиболее значимо. Второй по значимости механизм передачи – контактный [5, 6]. В связи с этим возникла необходимость ограничить социальные контакты инфицированных, усилить врачебный контроль за их состоянием.
11 марта 2020 г. Всемирная организация здравоохранения признала, что распространение новой коронавирусной инфекции приобрело характер пандемии. По данным на 13 декабря 2021 г. по общему количеству выявленных случаев среди регионов мира первое место занимал американский (97 679 255), здесь же зафиксировано наибольшее количество летальных исходов (2 360 315). Самый высокий прирост выявленных случаев за неделю с 5 по 12 декабря 2021 г. зафиксирован в Европе (2 687 257) и в американском регионе (935 062). Максимальный прирост летальных исходов за ту же неделю зарегистрирован в Европе и американском регионе (28 990 и 12 987 соответственно).
В мире, по имеющимся на 13 декабря 2021 г. данным, зафиксировано свыше 270 млн подтверждённых случаев заболевания COVID-19, из них летальных исходов – порядка 5.3 млн. Российская Федерация по общему числу зарегистрированных случаев занимает 5 место в мире, хотя по общему уровню заболеваемости на 100 тыс. населения стоит на 77 месте, по абсолютному числу летальных исходов РФ занимает 5-е, по уровню летальности – 37-е, а по уровню смертности на 100 000 населения – 36 место.
По данным статистики на 13.12.2021 г. в Российской Федерации зарегистрировано 10 046 454 заболевших, выздоровели 8 769 916 человек, летальных исходов 290 604, проведено более 232.1 млн тестов, привито полностью 61 074 945 человек (сделано прививок 135 478 571).
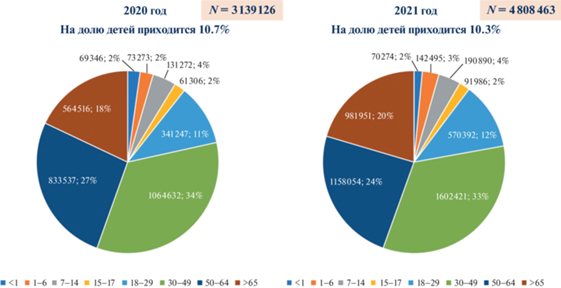
Анализ проявлений эпидемического процесса COVID-19 на территории РФ за 2020–2021 гг. позволил выделить четыре подъёма уровня заболеваемости (рис. 1). В возрастной структуре заболевших суммарно преобладали лица трёх возрастов: среднего (30–49 лет) – 33–34%, старшего (от 50 до 64 лет) – 24.5–26.5%, пожилого (старше 65 лет) – 18–21%. Частично это объясняется тем, что молодые и дети болеют легче, среди них выше доля бессимптомных больных, которые не прибегают к тестированию, не обращаются за медицинской помощью, не попадают в статистику, но при этом могут оставаться заразными для других. Доля заболевших в возрасте до 17 лет составила 19–20% (рис. 211).
Рис. 1.
Динамика изменения абсолютного числа ежедневно регистрируемых случаев и количества летальных случаев в Российской Федерации

Лабораторная диагностика новой коронавирусной инфекции осуществляется в соответствии с требованиями Санитарно-эпидемиологических правил СП 1-П. Биологическим материалом служит мазок, взятый из носоглотки. При определении группы патогенности в основном используется метод амплификации нуклеиновых кислот, а конкретно – полимеразная цепная реакция (ПЦР) с обратной транскрипцией (преобразование молекул РНК в молекулы ДНК) в реальном времени (ОТ-ПЦР в реальном времени). ПЦР – “золотой стандарт” в диагностике, но в последнее время наряду с ней активно внедряются методы изотермической амплификации нуклеиновых кислот.
Пандемия COVID-19 вызвала острейшую потребность в доступном массовом тестировании, которая количественно на порядки превышает возможности существующей медицинской и лабораторной инфраструктуры, использующей традиционные методы диагностики. Для выявления заболевания на ранней стадии очень важна и скорость проведения анализов. Тесты, основанные на ОТ-ПЦР, требуют минимум 3–4.5 ч., а время от момента поступления материала в лабораторию до оформления официального результата может составлять 8–12 ч. В связи с этим встаёт вопрос внедрения новых методов экспресс-диагностики.
По объёму тестирования Россия, по данным на 01.12.2021 г., занимает 4 место в мире после Великобритании, Индии, США, при этом при пересчёте на 1000 жителей мы находимся на 5 месте.
В 2020–2021 гг. сотрудниками ЦНИИЭ проведено 3.5 млн исследований методом ПЦР, по сравнению с предыдущими годами их объём возрос в 50 раз (!). Для определения антител к COVID-19 выполнено более 1 млн исследований методом иммуноферментного анализа (ИФА). Проведено более 20 тыс. исследований по секвенированию геномов SARS-CoV-2.
ЦНИИ эпидемиологии одним из первых в нашей стране зарегистрировал тест-систему АмплиСенс® Cov-Bat-FL на основе ПЦР для выявления РНК SARS-CoV-2, которая обладает достаточно высокими показателями чувствительности (0.1 TCID50/мл22 – 1000 копий РНК/мл) и специфичности. С её помощью мы можем проводить диагностику не только SARS-CoV-2, но и SARS, MERS.
Упоминавшиеся выше методы амплификации нуклеиновых кислот – самые чувствительные и специфичные из доступных в настоящее время средств выявления РНК SARS-CoV-2 [7–9]. В апреле 2021 г. зарегистрирована тест-система АмплиСенс® COVID-19-FL на основе метода амплификации нуклеиновых кислот для количественного определения РНК вируса с помощью ОТ-ПЦР. По уровню чувствительности она одна из лучших в мире, её чувствительность составляет 5 × 10 ГЭ33 (копий)/мл с достаточно широким диапазоном измерения: 5 × 10 – 3 × 10 ГЭ (копий)/мл, специфичность практически 100%. Она позволяет детектировать наличие вируса, отслеживать его изменения, а также определять вирусную нагрузку, что важно для прогноза течения заболевания госпитализированных пациентов. Автоматическая экстракция РНК сокращает время исследования в 4–5 раз. Так, при использовании амплификатора CFX96 оно составляет 93 мин, Rotor-Gene – 99 мин, ДТ-96 – 101 мин. Определение вирусной нагрузки позволяет оценить вероятность передачи возбудителя при контакте с инфицированным, эпидемиологическая опасность снижается по мере уменьшения количества РНК в образце.
В числе новых методов экспресс-диагностики наиболее популярна и эффективна петлевая изотермическая амплификация нуклеиновых кислот (Loop-mediated Isothermal Amplification – LAMP). Сотрудниками ЦНИИЭ разработана тест-система АмплиСенс® SARS-CoV-2-ГГ на основе LAMP, которая обладает несколькими достоинствами: позволяет сократить время исследования в 3–4 раза без снижения чувствительности и специфичности классической ОТ-ПЦР (100%). Амплификация проходит в течение 20 мин, а суммарное время тестирования вместе с этапом выделения РНК вируса составляет около 1 ч, что гораздо быстрее, чем при классическом ПЦР-тестировании. Кроме того, есть возможность использования более простого оборудования (термостата), а не только дорогих амплификаторов. Хотелось бы подчеркнуть, что набор разработан на основе собственной ферментной базы ЦНИИ эпидемиологии, что позволяет не зависеть от поставок реагентов из-за рубежа и сохранять цены на невысоком уровне.
Специалистами Роспотребнадзора и других ведомств ведутся масштабные работы по секвенированию и биоинформатическому анализу генома SARS-CoV-2, выявлению как известных, так и потенциально новых геновариантов. При этом полногеномное секвенирование позволяет выявлять все возможные мутации в геноме. Фрагментное же секвенирование, как правило, ориентируется на ключевые изменения в геноме, которые ответственны за более удачные с точки зрения вируса свойства патогена.
Учёными нашего института в июле 2021 г. разработана NGS-панель АмплиСенс® SARS-CoV-2-N501Y-IT для выявления самых значимых мутаций в гене S-белка. Это достаточно быстрый, эффективный и дешёвый способ секвенирования: праймеры были положены так, чтобы они “залипали” на консервативных областях, а прочитанные участки захватывали все значимые изменения. На тот момент были известны геноварианты Alpha, Британский (B.1.1.7), Beta, Южноафриканский (B.1.351), Бразильский (P.1). Нашей панелью выявляются и другие эпидемиологически значимые штаммы вируса N501Y, в том числе Delta/Kappa, Индийский (B.1.617.1/B/1/617.2), который сейчас распространён повсеместно. Панель позволяет исследовать большое количество образцов и определять принадлежность изолятов к конкретным геновариантам.
Понятно, что SARS-CoV-2 будет мутировать и дальше, а новые изменения могут и не попасть в прочитываемые участки, для чего мы разработали вторую версию панели. Ген S-белка, включающий около 4000 последовательностей, она охватывает полностью, что позволяет обнаружить любые изменения в нём. Становится возможным определение всех штаммов, при этом себестоимость остаётся достаточно низкой (3 тыс. руб. за образец). Панель позволяет также увеличить скорость секвенирования по сравнению с другими коммерчески доступными продуктами. Порядка суток занимает подготовка, менее 6 ч собственно секвенирование, в итоге прочтение гена S-белка занимает менее трёх суток.
Чтобы снизить вероятность ложноотрицательных результатов, связанных с новыми штаммами, специалисты ЦНИИЭ разработали новую тест-систему, которая менее чувствительна к изменениям в SARS-CoV-2 за счёт одновременного использования сразу двух мишеней в геноме вируса. Так как в тесте применяется неспецифическая детекция продуктов амплификации, одновременное использование двух мишеней незначительно сказывается на себестоимости теста, но при этом может существенно снижать число ложноотрицательных результатов. Сам тест основан на технологии петлевой изотермической амплификации, позволяющей проводить тестирование существенно быстрее и проще, чем на базе традиционной ПЦР. Параллельно в институте ведётся регулярный анализ геномных последовательностей нового коронавируса, получаемых в ходе секвенирования институтами Роспотребнадзора и других ведомств, с тем чтобы не пропустить момент таких мутаций в таргетируемых областях генома, частоты которых начнут расти в общей вирусной популяции. Использование двух мишеней в тесте позволит выиграть время – хотя бы один регион остаётся неизменённым, у разработчиков появляется время исправить праймеры в мутировавшем локусе. Использование нескольких таргетных областей в быстрых тестах никогда ранее не применялось в России, а за рубежом известно лишь в виде научных публикаций.
За период пандемии (2020–2021) ЦНИИ эпидемиологии Роспотребнадзора выполнил 7 распоряжений Правительства РФ, в рамках которых полностью обеспечено производство и поставка диагностических тест-систем, в том числе более 27 млн для проведения исследований на выявление РНК SARS-CoV-2, более 28 млн для проведения экстракции нуклеиновых кислот, более 21 млн для получения комплементарной ДНК на матрице ДНК. Всего выполнено более 76 млн исследований. Практически каждая третья тест-система в России для диагностики SARS-CoV-2 произведена в ЦНИИ эпидемиологии. Следует отметить, что в рамках международного сотрудничества наш институт поставляет диагностические тест-системы в 40 стран мира.
Мониторинг изменений свойств возбудителя – важнейшее направление эпидемиологического надзора за COVID-19 (Постановление Правительства РФ № 448 от 23.03.2021 г.). Специалистами Роспотребнадзора развёрнуты масштабные исследования (секвенирование и биоинформатический анализ) геномов коронавируса SARS-CoV-2, в ходе которых выявляются известные и потенциально новые варианты патогена.
На базе ЦНИИ эпидемиологии развёрнута российская платформа VGARuS для анализа генома вируса SARS-CoV-2 [10]. Эпидемиологический анализ распространения его геновариантов на территории РФ проводится на основе базы данных VGARus и сведений из организаций Роспотребнадзора, осуществляющих секвенирование. Для загрузки и анализа данных, отображения результатов секвенирования создана веб-платформа, а для выявления мутаций и отображения их принадлежности к эпидемиологически значимым штаммам разработаны биоинформатические средства анализа данных. Продолжается депонирование данных секвенирования, включая метаданные. На 13 декабря 2021 г. в базу загружено более 46 тыс. последовательностей патогена, в том числе 22 908 последовательностей полного генома, 23 841 последовательность фрагмента генома. 10 872 последовательности (10 576 – полного генома, 296 – фрагмента генома) загружено в GISAID44 российской локализации. Выявлено более 30 тыс. образцов, относящихся к геновариантам, отличным от уханьского. Создан научный консорциум, включающий 28 организаций, проводящих секвенирование и осуществляющих загрузку данных на платформу.
Специалистами ЦНИИ эпидемиологии неоднократно была модифицирована NGS-панель для выявления значимых мутаций в гене S-белка [11], включающая в себя все известные значимые мутации в гене S-белка, в том числе присущие штамму “Омикрон”. Особая модификация праймеров устраняет необходимость этапа лигирования, существенно снижая стоимость и длительность подготовки проб, позволяет добавлять в панель новые фрагменты генома. NGS-панель для секвенирования полного гена S-белка охватывает ~4000 нуклеотидных последовательностей, позволяет обнаруживать любые возможные мутации в гене, определять все геноварианты SARS-CoV-2, она пригодна для массового скрининга образцов.
В конце сентября 2021 г. на пресс-конференции Всемирной организации здравоохранения было сообщено, что вариант Delta окончательно вытеснил все другие геноварианты по всему миру. Список геновариантов был сокращён, начиная с 6 декабря 2021 г. ВОЗ выделяет следующие:
• VOC – Variants of Concern: содержат опасные мутации, вызвали масштабные вспышки;
• VUI/VOI – Variants of Interest: содержат опасные мутации, вызвали/могут вызвать локальные вспышки или множественные кластеры во многих странах;
• VUM – Variants Under Monitoring: содержат опасные или предположительно опасные мутации, их свойства и способность к распространению пока неясны [10].
Приведём список геновариантов ВОЗ, актуальный на 3 декабря 2021 г.
Первая категория (VOC) – варианты, вызывающие беспокойство: Alpha (Британский, B.1.1.7), Beta (Южноафриканский B.1.351), Gamma (Бразильский, P.1), Delta (Индийский-2, B.1.617.2 + AY.*), Omicron (B.1.1.529).
Вторая категория (VOI) – варианты, вызывающие интерес: Lambda (C.37), Mu (B.1.621).
Третья категория (VUM) – варианты, находящиеся под мониторингом: AZ.5, C.1.2, Kappa (B.1.617.1), Iota (B.1.526), Eta (B.1.525), B.1.630, B.1.640.
26 ноября 2021 г. ВОЗ внесла в первую категорию (VOC) вариант Omicron. На 06.12.2021 в базе данных GISAID опубликовано 582 генома штамма омикрон (B.1.1.529), более 45 мутаций во всём геноме и более 30 мутаций в гене S-белка.
Обратимся теперь к расположению на филогенетическом древе последовательностей для категорий VOC и VOI и выявляемости геновариантов на территории Российской Федерации: геновариант Alpha (Британский, B.1.1.7) был распространён на территории страны зимой 2021 г.; геновариант Delta (Индийский-2, B.1.617.2 + AY. *) распространился на территории страны во второй половине апреля 2021 г. и доминировал по состоянию на 14.12.2021 г., геновариант Beta (Южноафриканский, B.1.351) встречался зимой 2021 г. одновременно с Alpha, распространения не получил; геновариант Gamma (Бразильский, P.1) встречался в начале 2021 г., не получил заметного распространения; геновариант Lambda (C.37) и геновариант Mu (B.1.621) на сегодня не имеют эпидемического значения на территории Российской Федерации; геновариант Omicron (B.1.1.529) обнаружен на территории нашей страны у прибывающих из-за границы граждан. Вариант SARS-CoV-2 BA.1 был практически одновременно выявлен в ЮАР, Ботсване и Гонконге (по данным GISAID). Первые геномы датируются 9 и 11 ноября 2021 г. (из ЮАР), 11 ноября (из Ботсваны), 13 ноября (из Гонконга). Позднее Omicron был обнаружен в Израиле – 20 ноября, Канаде – 23 ноября, Бельгии – 24 ноября, Австралии – 28 ноября (указаны по дате забора биоматериала). На 27.12.2021, по данным GISAID, всего в мире было известно 53 737 последовательностей геномов штамма Omicron.
По данным национальной базы геномных данных VGARus, среди последовательностей SARS-CoV-2, классифицированных программой Pangolin (версия 3.1.17) как Omicron (BA.1), на 27.12.21 обнаружено 89 последовательностей.
По данным мониторинга за циркуляцией генотипов SARS-CoV-2, на территории РФ доминирует генетическая линия Delta (B.1.617.2+AY.*), с апреля 2021 г. относимая к группе VOС. На начало декабря 2021 г. доля Delta в структуре выявленных геновариантов SARS-CoV-2 сохранялась на уровне 89% (рис. 3). Эта генетическая линия доминировала на территории всех федеральных округов и субъектов РФ. По нашим уточнённым данным, её доля в структуре субвариантов Delta колебалась: 82.7–88.5% в сентябре, 82–93.5% в октябре, 91.2% в первой неделе ноября, 85.7% во второй неделе ноября. На территории РФ вариант Delta стал доминирующим в апреле–мае 2021 г. В структуре субвариантов линии Delta (B.1.617.2 + AY.*), выделенных в Российской Федерации, преобладает субвариант AY.122 (81%) (рис. 4).
Рис. 3.
Структура геновариантов SARS-CoV-2, выявленных на территории Российской Федерации (на 03.12.2021 г.)
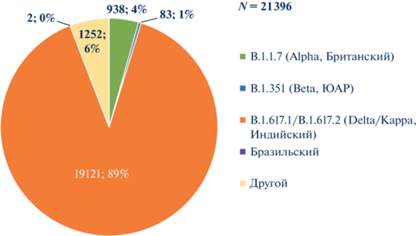
Рис. 4.
Структура субвариантов линии Delta (B.1.617.2 + AY.*), выделенных в Российской Федерации
Примечание: забор биоматериала с 5 октября по 6 декабря 2021 г., по данным базы VGARus, N = 4 066
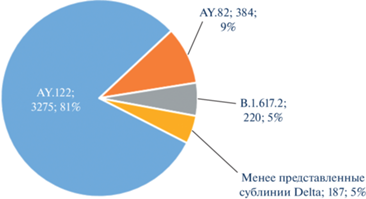
По состоянию на начало декабря 2021 г. помимо AY.122 на территории РФ преобладали такие сублинии, как AY.82, B.1.617.2. Следует отметить, что в России зарегистрировано более 30 сублиний геновариантов Delta, и мы продолжаем постоянный мониторинг за геновариантами.
В рамках Постановления Правительства РФ № 452 от 27.03.2021 г., Распоряжения Правительства РФ от 16.03.2020 г. № 635-р (ред. от 10.12.2021 г.) на базе ЦНИИЭ создана интеграционная платформа “SOLAR” для быстрой передачи результатов ПЦР-исследований всем заинтересованным гражданам РФ, с момента загрузки информации в базу данных это занимает менее 60 мин. С 01.11.2020 г. по 13.12.2021 г. регионами на платформу передано 56 740 613 результатов исследований. К платформе подключено более 1000 лабораторий (в том числе сетевых), 85 регионов передают данные в автоматическом режиме. Более 427 000 результатов исследований передаётся на Единый портал государственных услуг РФ ежедневно. Также создано приложение “Путешествую без COVID-19”, к нему подключены 3200 точек забора биоматериала, 6 тыс. результатов загружается ежемесячно.
٭ ٭ ٭
Подводя итоги, отметим следующее.
По состоянию на середину декабря 2021 г. продолжался активный процесс эволюции возбудителя COVID-19. Генетический вариант Delta (B.1.617.2 + AY.*) доминировал на территории Российской Федерации, его доля среди всех выявленных вариантов составляла более 95%, при этом отмечалась его диссоциация. На протяжении всех месяцев наблюдения с момента начала регистрации геноварианта Delta доминировал вариант, которому с 26 ноября 2021 г. классификатор Pangolin присвоил название AY.122. Доля AY.122 в структуре субвариантов Delta в России составляла 85–95%. Помимо AY.122 наиболее часто встречались такие субварианты Delta, как “материнский” B.1.617.2 (доля с октября по декабрь 2021 г. – 5%, AY.82 (4%), AY.99 (2%). Прочие субварианты (их 30) представлены единичными образцами и составляли суммарно около 1% всех последовательностей Delta.
Динамичное изменение доли данных субвариантов в общей структуре в последние месяцы не оказывало влияния на интенсивность проявлений эпидемического процесса и тяжесть клинического течения заболевания.
Геноварианты, требующие особого внимания, в частности Lambda (С. 37) и Mu (B.1.621), на территории Российской Федерации практически отсутствовали и не образовывали эпидемических очагов. В связи с ростом числа выявленных в разных странах мира случаев заболевания, вызванных вариантом Omicron, целесообразно продолжать мониторинг этого геноварианта среди лиц, въезжающих на территорию Российской Федерации из эпидемиологически неблагополучных стран.
Молекулярно-генетический мониторинг за циркулирующими геновариантами должен оставаться основой эпидемиологического надзора за COVID-19, его результаты обязательно нужно учитывать при создании вакцинных препаратов.
Список литературы
Severe acute respiratory syndrome coronavirus 2. Taxonomy browser. NCBI. 2021.
Fehr A.P., Perlman S. Coronaviruses: An Overview of Their Replication and Pathogenesis // Methods in molecular biology (Clifton, N.J.). 2015. V. 1282. P. 1–23.
Randhawa G.S. et al. Machine learning using intrinsic genomic signatures for rapid classification of novel pathogens: COVID-19 case study // PLOS One. 2020. V. 15. № 4. P. e0232391.
Щелканов М.Ю., Попова А.Ю., Дедков В.Г. и др. История изучения и современная классификация коронавирусов (Nidovirales: Coronaviridae) // Инфекция и иммунитет. 2020. № 2. С. 221–246.
Stadnytskyi V., Bax C.E. et al. The airborne lifetime of small speech droplets and their potential importance in SARS-CoV-2 transmission // PNAS. 2020. V. 117(22). P. 11875–11877. https://doi.org/10.1073/pnas.2006874117
Asadi S., Wexler A.S., Cappa C.D et al. Effect of voicing and articulation manner on aerosol particle emission during human speech // PLOS One. 2020. V. 15. № 1. P. e0227699.
Geddes L. Puzzle over viral load // New Sci. 2020. V. 245(3276). P. 8.
Joynt G.M., Wu W.K. Understanding COVID-19: what does viral RNA load really mean? // Lancet Infect Dis. 2020. V. 20. P. 635–636.
La Scola B., Le Bideau M., Andreani J. et al. Viral RNA load as determined by cell culture as a management tool for discharge of SARS-CoV-2 patients from infectious disease wards // Eur. J. Clin. Microbiol. Infect. Dis. 2020. V. 39. P. 1059–1061.
https://www.genome.crie.ru/app/index (дата обращения 13.12.2021).
Borisova N.I., Kotov I.A., Kolesnikov A.A. et al. Monitoring the spread of the SARS-CoV-2 (Coronaviridae; Coronavirinae; Betacoronavirus; Sarbecovirus) variants in the Moscow region using targeted high-throughput sequencing // Vopr. Virusol. 2021. № 4. P. 269–278.
Дополнительные материалы отсутствуют.