Вестник РАН, 2022, T. 92, № 7, стр. 654-660
КОРОНАВИРУСНАЯ БОЛЕЗНЬ 2019 (COVID-19) И АУТОИММУНИТЕТ
Е. Л. Насонов a, b, *, М. Ю. Самсонов b, **, А. М. Лила a, c, ***
a Научно-исследовательский институт ревматологии им. В.А. Насоновой
Москва, Россия
b Первый Московский государственный медицинский университет им. И.М. Сеченова
Москва, Россия
c Российская медицинская академия непрерывного профессионального образования
Москва, Россия
* E-mail: nasonov@irramn.ru
** E-mail: samsonov_m_yu@staff.sechenov.ru
*** E-mail: director@irramn.ru
Поступила в редакцию 09.03.2022
После доработки 11.03.2022
Принята к публикации 12.03.2022
- EDN: WMHAIK
- DOI: 10.31857/S086958732207012X
Аннотация
Пандемия коронавирусной болезни 2019, этиологически связанной с вирусом SARS-CoV-2, привлекла внимание медицинского сообщества к новым клиническим и фундаментальным проблемам иммунопатологии заболеваний человека. В процессе детального анализа клинических проявлений и иммунопатологических нарушений при COVID-19 стало очевидным, что инфекция SARS-CoV-2 сопровождается развитием широкого спектра экстрапульмональных клинических и лабораторных нарушений, некоторые из которых характерны для иммуновоспалительных ревматических заболеваний и других аутоиммунных и аутовоспалительных болезней человека. Всё это вместе взятое послужило теоретическим обоснованием для репозиционирования при COVID-19 противовоспалительных препаратов, ранее специально разработанных для лечения иммуновоспалительных ревматических заболеваний. В статье обсуждаются перспективы изучения аутоиммунных механизмов COVID-19 и возможности противовоспалительной терапии.
Пандемия коронавирусной болезни 2019 (coronavirus disease, COVID-19), этиологически связанной с вирусом SARS-CoV-2 (severe acute respiratory syndrome coronavirus-2), привлекла внимание медицинского сообщества к новым клиническим и фундаментальным проблемам иммунопатологии заболеваний человека [1]. В течение двух лет, прошедших с начала пандемии, в мире проведено беспрецедентное число клинических и фундаментальных исследований, посвящённых проблемам эпидемиологии, вирусологии, иммунологии, молекулярной биологии, клинического полиморфизма, диагностики и фармакотерапии COVID-19, объединивших учёных и врачей всех биологических и медицинских специальностей. Эти усилия увенчались созданием нескольких типов вакцин против новой инфекции, противовирусных препаратов, моноклональных антител, нейтрализующих SARS-CoV-2, и в целом разработкой более рациональных подходов к ведению пациентов с COVID-19 [2].
Существенный вклад в борьбу с пандемией COVID-19 внесла ревматология [1, 3]. Уже в начале 2020 г. в первых публикациях, касающихся ревматологических проблем COVID-19, было сформулировано положение о том, что “опыт, накопленный в ревматологии за последние 70 лет в процессе изучения патогенетических механизмов и фармакотерапии иммуновоспалительных ревматических заболеваний, как наиболее частых и тяжёлых форм аутоиммунной и аутовоспалительной патологии человека, будет востребован для расшифровки природы патологических процессов, лежащих в основе COVID-19, и разработки подходов к эффективной фармакотерапии” [1].
Обращаясь к истории науки, напомним, что в 1950 г. Т. Рейхштейн (Швейцария), Э. Кендалл и Ф. Хенч (США) были удостоены Нобелевской премии по физиологии и медицине за “открытия, касающиеся гормонов коры надпочечников, их структуры и биологических эффектов” [4]. Годом ранее в американской клинике Мейо глюкокортикоидный гормон кортизон впервые c успехом был использован для лечения пациентов с ревматоидным артритом. Спустя 70 лет после прорыва в лечении воспалительных заболеваний применение синтетических глюкокортикоидов (ГК) у пациентов с тяжёлым COVID-19 не только позволило спасти жизнь десяткам тысяч пациентов, но и способствовало формированию концепции о фундаментальной роли вирус-индуцированного воспаления в патогенезе этого заболевания. Следующим важным этапом в борьбе с тяжёлыми последствиями COVID-19 стало репозиционирование генно-инженерных биологических препаратов, представляющих собой моноклональные антитела, блокирующие активность провоспалительных цитокинов (или их клеточных рецепторов), а также таргетных противовоспалительных препаратов, модулирующих внутриклеточную сигнализацию цитокинов, специально разрабатывавшихся для лечения иммуновоспалительных ревматических заболеваний, в первую очередь ревматоидного артрита [5].
Хотя инфекция SARS-CoV-2 обычно характеризуется лёгким/умеренно тяжёлым течением и заканчивается выздоровлением, у некоторых пациентов развивается тяжёлая пневмония, реже – острый респираторный дистресс-синдром, коагулопатия и потенциально летальная мультиорганная недостаточность (1–2%). В основе патогенеза COVID-19 лежит своеобразная вирус-индуцированная дисрегуляция (асинхронизация) врождённого и приобретённого иммунитета, приводящая к гиперпродукции широкого спектра провоспалительных, антивоспалительных и иммунорегуляторных цитокинов, других медиаторов воспаления [6]. Течение и исход заболевания определяются как уникальными свойствами самого вируса SARS-CoV-2, так и синергическими (и амплифицирующими) влияниями возрастных, гендерных (мужской пол) и генетических факторов, коморбидной патологии и присоединением вторичной бактериальной инфекции (рис. 1). Активацию транскрипции генов медиаторов воспаления и увеличение концентрации цитокинов в крови, включая интерлейкины ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-17, ИЛ-18, гранулоцитарно-макрофагальный колониестимулирующий фактор и хемокины CXCL10, CCL2, рассматривают как “иммунологический автограф” патологической активации иммунитета, выраженность которого в определённой степени коррелирует с тяжестью COVID-19 и неблагоприятным прогнозом. Кульминацией иммунопатологического процесса становится синдром “цитокинового шторма” – гетерогенный клинико-лабораторный симптомокомплекс, включающий в себя несколько патологических состояний: гемофагоцитарный лимфогистиоцитоз, синдром активации макрофагов и синдром высвобождения цитокинов, индуцированный CAR-T-клеточной терапией (сhimeric аntigen receptor T-Cell) [7]. Полагают, что при COVID-19 специфика ассоциированного с ним субтипа синдрома “цитокинового шторма” проявляется в сочетании иммуносупрессии, приводящей к ослаблению антивирусного иммунного ответа и замедлению элиминации SARS-COV-2 (вирусный сепсис), и гипервоспаления, интенсивность которого может быть выражена в меньшей степени, чем при других формах “цитокинового шторма” [8, 9].
Рис. 1.
Гипотетическая модель развития гипервоспаления и иммуновоспалительных заболеваний на фоне инфицирования вирусом SARS-CoV-2
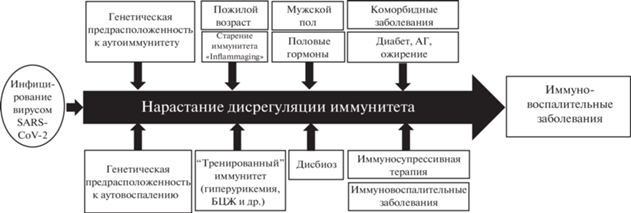
В процессе детального анализа спектра клинических проявлений и иммунопатологических нарушений при COVID-19 стало очевидным, что инфекция SARS-CoV-2 приводит к развитию широкого спектра экстрапульмональных клинических и лабораторных нарушений, некоторые из которых характерны для иммуновоспалительных ревматических и других аутоиммунных и аутовоспалительных заболеваний человека [10]. К ним относятся лихорадка, усталось, артралгии и артрит, миалгии, кожная “васкулитная” сыпь, алопеция, тромбоз, клинические и лабораторные проявления гипервоспаления, цитопения. Кроме того, на фоне инфицирования вирусом SARS-CoV-2 зарегистрировано развитие заболеваний, классифицируемых как аутоиммунные и/или аутовоспалительные (ревматоидный артрит, реактивный артрит, системная красная волчанка, системные васкулиты, воспалительные миопатии, синдром Гийена–Барре, IgA-нефропатия, болезнь Стилла, аутоиммунные цитопении и др.), а в сыворотке пациентов с COVID-19 обнаруживаются более 50 типов органоспецифических и органонеспецифических аутоантител, характерных для этих заболеваний [11, 12]. Всё это вместе взятое позволило обсуждать патогенетическое значение инфекции SARS-CoV-2 как триггерного фактора аутоиммунной патологии человека [13–15].
При рассмотрении общих (частично перекрещивающихся) механизмов COVID-19 и аутоиммунных заболеваний обращает на себя внимание существование тесной патогенетической взаимосвязи между воспалением, активацией системы комплемента и гиперкоагуляцией, которая составляет основу патологического процесса, получившего название “тромбовоспаление” (иммунотромбоз) и рассматривающегося в качестве универсального механизма патогенеза как при COVID-19 (так называемая СOVID-19-ассоциированная коагулопатия), так и при иммуновоспалительных ревматических заболеванях [16–18]. Определённую специфику тромбовоспалению при COVID-19 придаёт механизм инфицирования вирусом SARS-СoV-2, который, используя в качестве рецептора ангиотензин-превращающий фермент 2, индуцирует дисрегуляцию системы ренин-ангиотензин-альдостерон, характеризующуюся избыточным образованием ангиотензина II, обладающего провоспалительными, вазоконстрикторными и профибротическими эффектами [19].
Важным доказательством развития аутоиммунной патологии при COVID-19 служит гиперпродукция аутоантител – диагностических маркеров аутоиммунных заболеваний, одновременно играющих существенную роль в развитии аутоиммунного воспаления. Среди них наибольшее значение придают антителам к фосфолипидсвязывающим белкам, антителам к компонентам ядра и цитоплазмы, цитокинам и внеклеточным и секретируемым белкам.
В спектре аутоиммунных проявлений COVID-19 особое внимание привлечено к антифосфолипидному синдрому (АФС) – симптомокомплексу, проявляющемуся в рецидивирующих тромбозах (артериальных и/или венозных), акушерской патологии и присутствии антифосфолипидных антител [20]. В рамках антифосфолипидного синдрома выделяют так называемый катастрофический АФС – редкую потенциально летальную форму, характеризующуюся распространённым внутрисосудистым микротромбозом, напоминающим COVID-19-коагулопатию [18]. При COVID-19 антифосфолипидные антитела выявляются примерно у половины пациентов, они ассоциируются с тяжёлым течением заболевания, тромбозом сосудов головного мозга, могут персистировать в крови после выздоровления. Примечательно, что антифосфолипидные антитела, выделенные из сыворотки пациентов с COVID-19, системной красной волчанкой и антифосфолипидным синдромом, in vitro вызывают активацию эндотелиальных клеток, проявляющуюся гиперэкспрессией молекул адгезии на их мембранах [21].
Недавно у пациентов с COVID-19 был обнаружен новый тип липид-связывающих антител, которые, реагируя с комплексом, состоящим из лизобифосфатидиловой кислоты и рецептора белка С, индуцируют протромботическую и провоспалительную активацию моноцитов, эндотелиальных клеток и образование тромбов, а их обнаружение ассоциируется с критическим течением заболевания и неблагоприятным прогнозом [22]. Представляют интерес данные об обнаружении в сыворотке пациентов с тяжёлым течением COVID-19 и антифосфолипидным синдромом антител к фосфолипид-связывающему белку аннексину А2 [23, 24].
Ещё одной аутоантигенной мишенью при COVID-19 и антифосфолипидном синдроме служат аутоантитела к ADAMTS-13 (металлопротеиназа, принадлежащая к семейству пептидазных белков “Adams”), которые при COVID-19 ассоциируются с тяжестью заболевания и летальностью, а у пациентов с антифосфолипидным синдромом – с увеличением риска развития тромбозов [25]. Важный аутоиммунный механизм их возникновения при COVID-19 связан с синтезом антител, индуцирующих антителозависимую активацию, апоптоз и прокоагулянтную активность тромбоцитов [26] и антител к тромбоцитарному фактору 4 (ТФ4) [27]. Полагают, что тромботическая тромбоцитопения, развивающаяся при COVID-19 или после вакцинации против SARS-CoV-2, может быть связана с индукцией синтеза антител к ТФ4 [28].
Общий механизм тромбовоспаления как при COVID-19, так и при иммуновоспалительных ревматических заболеваниях может быть обусловлен образованием нейтрофильных внеклеточных ловушек, обнаружение компонентов которых (свободная ДНК, комплекс ДНК-миелопероксидаза, цитруллинированный гистон H3) в сыворотке пациентов с COVID-19 коррелирует с тяжестью заболевания и развитием тромботических нарушений [29]. Все данные позволяют обсуждать патогенетическое значение различных типов аутоантител к фосфолипид-связывающим белкам в развитии коагулопатии и существование так называемого COVID-19-индуцированного АФС-подобного синдрома. Выделение аутоиммунного субтипа COVID-19 – ассоциированной коагулопатии – может иметь важное клиническое значение с точки зрения персонификации антикоагулянтной и противовоспалительной терапии [18].
Другой тип аутоантител, выявляемых в сыворотке пациентов с COVID-19, – характерные для иммуновоспалительных ревматических заболеваний антиядерные антитела, которые, как и антифосфолипидные антитела, ассоциируются с тяжёлым течением COVID-19, активностью воспаления и риском тромбозов. О патогенетическом значении этих аутоантител свидетельствует “перекрёст” клинических, серологических, рентгенологических и морфологических проявлений СOVID-19 – пневмонии и интерстициального заболевания лёгких при иммуновоспалительных ревматических заболеваниях, для которых характерно присутствие широкого спектра антиядерных антител [30]. Интересный пример схожести COVID-19 и иммуновоспалительных ревматических заболеваний – субтип воспалительной миопатии, так называемый анти-MDA-5 синдром. Его характерным лабораторным биомаркером являются антитела к белку MDA-5, выполняющему функцию внутриклеточного сенсора вирусной РНК (в том числе коронавирусов). Клинически анти-MDA5 синдром проявляется быстро прогрессирующим интерстициальным заболеванием лёгких, рентгенологически сходным с COVID-19-пневмонией, мышечной слабостью, типичной кожной сыпью, лихорадкой, тромботическими нарушениями и другими системными проявлениями. У пациентов с COVID-19 обнаружение и титры антител к MDA5 достоверно коррелируют с тяжестью заболевания и летальностью [31].
Учитывая фундаментальную роль ангионтензипревращающего фермента-2 (АПФ2) как рецептора для SARS-CoV-2, привлекает внимание обнаружение у пациентов с COVID-19 и иммуновоспалительным ревматическим заболеванием антител к АПФ2 [32]. Предполагается, что они представляют собой анти-идиотипические антитела к S-белку SARS-CoV-2 [33]. Это соответствует “сетевой” концепции иммунитета, сформулированной лауреатом Нобелевской премии по физиологии и медицине 1984 г. Н. Ерне и впоследствии развитой П. Плотцем, согласно которой аутоантитела фактически представляют собой антиидиотипические антитела против антивирусных антител, а их синтез служит одним из важных механизмов вирусиндуцированного аутоиммунитета.
С использованием аутоантигенного анализа в сыворотке пациентов с COVID-19 обнаружены аутоантитела к широкому спектру белков, ранее не выявлявшиеся при аутоиммунных заболеваниях человека. Авторы работы [34], использовав метод REAP (rapid extracellular antigen profiling), позволяющий одномоментно определять аутоантитела к 2770 внеклеточным и секретируемым белкам, обнаружили в сыворотке пациентов с COVID-19 аутоантитела, взаимодействующие с разнообразными белковыми молекулами, обладающими иммуномодулирующей активностью (цитокины, хемокины, компоненты комплемента), и мембранными белками различных клеток. Эти антитела обладают способностью нарушать функцию клеток иммунной системы, ослаблять контроль вирусной инфекции за счёт ингибирования иммунорецепторной сигнализации и нарушения композиции периферических иммунных клеток. Авторы работы [35] с использованием специально разработанных белковых микрочипов исследовали ингибицию аутоантител к цитокинам и антител к SARS-CoV-2 в сыворотке пациентов с тяжёлым течением COVID-19. Антиядерные антитела были обнаружены у более половины пациентов, их гиперпродукция коррелировала с высокими титрами антител к структурным (S1, S2, N) белкам SARS-CoV-2. Эти данные позволяют привлечь внимание к роли феномена “молекулярной мимикрии” в развитии аутоиммунных нарушений при COVID-19, связанной с перекрёстной реактивностью, наблюдающейся между антителами к вирусным эпитопам SARS-CoV-2 и белками собственных тканей.
В отношении расшифровки механизмов связи между инфекцией SARS-CoV-2 и развитием аутоиммунной патологии особый интерес представляют данные, свидетельствующие о нарушении регуляции синтеза интерферона типа I у пациентов с COVID-19 [36] и системной красной волчанкой. При COVID-19 наблюдается ослабление синтеза интерферона типа I, ассоциирующееся с тяжёлым течением заболевания, замедлением клиренса SARS-CoV-2 и гиперпродукцией провоспалительных цитокинов, связанной с аутосомально-рецессивными дефектами генов с потерей функции участвующих в TLR3/7-зависимой сигнализации интерферонов типа I. Кроме того, в сыворотке пациентов с тяжёлым течением COVID-19 выявляются нейтрализующие антитела к интерферонам α2 и w. Примечательно, что выявление этих антител у пациентов с системной красной волчанкой, впоследствии заболевших COVID-19, ассоциируется с тяжёлым его течением.
Важные результаты, в определённой степени раскрывающие механизмы взаимосвязи между SARS-COV-2 и аутоиммунной патологией, получены в процессе углублённого иммунофенотипирования В-клеток [37]. Установлено, что у пациентов с тяжёлым COVID-19 наблюдается активация экстрафолликулярного пути В-клеточного иммунного ответа, который характерен для пациентов с тяжёлым течением системной красной волчанки. Остаётся неясным, является ли экстрафолликулярный путь В-клеточного иммунного ответа причиной или следствием тяжёлого течения COVID-19 и системной красной волчанки и каково его участие в гиперпродукции провоспалительных медиаторов и аутоантител.
В настоящее время, несмотря на огромное число открытых и рандомизированных контролируемых исследований, тактика ведения пациентов с COVID-19 носит эмпирический характер и нуждается в совершенствовании. Очевидно, что основное направление фармакотерапии COVID-19, как и других вирусных инфекций, связано с реализацией превентивной стратегии (вакцинация) и применением противовирусных препаратов с доказанной эффективностью, а у пациентов с COVID-19-ассоциированным гипервоспалительным синдромом – рациональной противовоспалительной терапии. Можно предположить, что при COVID-19 противовоспалительная терапия наиболее эффективна в короткий промежуток времени между завершением фазы вирусемии, когда цитопатическое действие вируса определяет формирование раннего (защитного, но не всегда эффективного) противовирусного иммунного ответа, и началом трансформации у некоторых пациентов иммунного ответа в гипериммунную фазу, прогрессирующую в направлении COVID-19-ассоциированного гипервоспалительного синдрома (“цитокиновый шторм”). При этом оптимальными для лечения тех пациентов, у которых есть риск развития гипервоспаления, могут быть препараты, обладающие как противовирусным, так и иммуномодулирующим действием. В контексте совершенствования иммуномодулирующей персонифицированной терапии, основанной на концепции таксономии цитокин-зависимых заболеваний [38], продолжаются интенсивные исследования, направленные на поиск ведущих молекулярных и терапевтических мишеней при COVID-19.
Первыми препаратами, официально рекомендованными для лечения тяжёлого/критического COVID-19, стали глюкокортикоиды [2]. В ревматологии накоплен огромный опыт их применения, в том числе и для лечения осложнений иммуновоспалительных ревматических заболеваний, угрожающих жизни. Однако многие теоретические и практические проблемы терапии глюкокортикоидами у пациентов с COVID-19 требуют дальнейшего изучения. В спектре цитокинов, участвующих в патогенезе иммуновоспалительных ревматических заболеваний и COVID-19, большое значение придаётся интерлейкину-6 [39]. Ингибиция ИЛ-6 с использованием моноклональных антител к ИЛ-6-рецепторам (тоцилизумаб, сарилумаб, российский препарат левилимаб) или к ИЛ-6 (российский препарат олокизумаб) рассматривается как одно из важнейших направлений фармакотерапии COVID-19-ассоциированного гипервоспалительного синдрома. В качестве перспективной мишени рассматривается ИЛ-1β – ключевой медиатор аутовоспалительных заболеваний человека [40]. Определённые надежды связывают с применением ингибиторов янус-киназ (барицитиниб и тофацитиниб) [41], которые подавляют сигнализацию широкого спектра провоспалительных цитокинов (ИЛ-6, ИЛ-10, гранулоцитарно-макрофагальный колониестимулирующий фактор и др.), участвующих в развитии гипервоспалительного синдрома при COVID-19.
В заключение необходимо подчеркнуть, что пандемия COVID-19 привлекла внимание к проблемам вирус-индуцированного аутоиммунитета и за короткое время аккумулировала в себе многие направления научных и клинических исследований, касающихся изучения механизмов иммунопатогенеза и лечения аутоиммунных и аутовоспалительных заболеваний человека. Гипотетическая модель развития аутоимунной патологии у пациентов с COVID-19, обобщающая доказанные (или предполагаемые) факторы и механизмы гипервоспаления при COVID-19 и ИВРЗ, представлена на рисунке 1.
Можно надеяться, что усилия учёных и врачей всего мира позволят не только улучшить прогноз при COVID-19 и получить новые знания для успешной борьбы с эпидемиями вирусных инфекций, с которыми человечество может столкнуться в будущем, но и будут способствовать совершенствованию фармакотерапии широко распространённых аутоиммунных и аутовоспалительных заболеваний человека.
Список литературы
Насонов Е.Л. Коронавирусная болезнь 2019 (COVID-19): размышления ревматолога // Научно-практическая ревматология. 2020. Т. 58. № 2. С. 123–132. https://doi.org/10.14412/1995-4484-2020-123-132
van de Veerdonk F.L., Giamarellos-Bourboulis E., Pickkers P. et al. A guide to immunotherapy for COVID-19 // Nat. Med. 2022. V. 28 (1). P. 39–50.
Schett G., Manger B., Simon D., Caporali R. COVID-19 revisiting inflammatory pathways of arthritis // Nat. Rev. Rheumatol. 2020. V. 16 (8). P. 465–470.
Raju T.N. The Nobel chronicles. 1950: Edward Calvin Kendall (1886–1972); Philip Showalter Hench (1896–1965); and Tadeus Reichstein (1897–1996) // Lancet. 1999. V. 353 (9161). P. 1370.
Nissen C.B., Sciascia S., de Andrade D. et al. The role of antirheumatics in patients with COVID-19 // Lancet Rheumatol. 2021. V. 3 (6). P. e447–e459.
Wang Y., Perlman S. COVID-19: Inflammatory Profile // Annu. Rev. Med. 2022. V. 73. P. 65–80.
Fajgenbaum D.C., June C.H. Cytokine Stor // N. Engl. J. Med. 2020. V. 383. P. 2255–2273.
Leisman D.E., Ronner L., Pinotti R. et al. Cytokine elevation in severe and critical COVID-19: a rapid systematic review, meta-analysis, and comparison with other inflammatory syndromes // Lancet Respir. Med. 2020. V. 8 (12). P. 1233–1244.
Weatherhead J.E., Clark E., Vogel T.P. et al. Inflammatory syndromes associated with SARS-CoV-2 infection: dysregulation of the immune response across the age spectrum // J. Clin. Invest. 2020. V. 130 (12). P. 6194–6197.
Ramos-Casals M., Brito-Zerón P., Mariette X. Systemic and organ-specific immune-related manifestations of COVID-19 // Nat. Rev. Rheumatol. 2021. V. 17 (6). P. 315–332.
Gracia-Ramos A.E., Martin-Nares E., Hernández-Molina G. New Onset of Autoimmune Diseases Following COVID-19 Diagnosis // Cells. 2021. V. 10 (12). P. 3592.
Damoiseaux J., Dotan A., Fritzler M.J. et al. Autoantibodies and SARS-CoV2 infection: The spectrum from association to clinical implication. Report of the 15th Dresden Symposium on Autoantibodies // Autoimmun. Rev. 2021. V. 21 (3). P. 103012.
Liu Y., Sawalha A.H., Lu Q. COVID-19 and autoimmune diseases // Curr. Opin. Rheumatol. 2021. V. 33 (2). P. 155–162.
Knight J.S., Caricchio R., Casanova J.L. et al. The intersection of COVID-19 and autoimmunity // J. Clin. Invest. 2021. V. 131 (24). P. e154886.
Halpert G., Shoenfeld Y. SARS-CoV-2, the autoimmune virus // Autoimmun. Rev. 2020. V. 19 (12). P. 102695.
Bonaventura A., Vecchié A., Dagna L. et al. Endothelial dysfunction and immunothrombosis as key pathogenic mechanisms in COVID-19 // Nat. Rev. Immunol. 2021. V. 21 (5). P. 319–329.
Merrill J.T., Erkan D., Winakur J., James J.A. Emerging evidence of a COVID-19 thrombotic syndrome has treatment implications // Nat. Rev. Rheumatol. 2020. V. 16 (10). P. 581–589.
Насонов Е.Л., Бекетова Т.В., Решетняк Т.М. и др. Коронавирусная болезнь 2019 (COVID-19) и иммуновоспалительные ревматические заболевания: на перекрёстке проблем тромбовоспаления и аутоиммунитета // Научно-практическая ревматология. 2020. Т. 58. № 4. С. 353–367. https://doi.org/10.47360/1995-4484-2020-353-367
Henry B.M., Vikse J., Benoit S. et al. Hyperinflammation and derangement of renin-angiotensin-aldosterone system in COVID-19: A novel hypothesis for clinically suspected hypercoagulopathy and microvascular immunothrombosis // Clin. Chim. Acta. 2020. V. 507. P. 167–173.
Антифосфолипидный синдром / Под ред. Е.Л. Насонова. М.: Литтерра, 2004.
Shi H., Zuo Y., Navaz S. et al. Endothelial cell-activating antibodies in COVID-19 // Arthritis Rheumatol. 2022. Feb. 17.
Hollerbach A., Müller-Calleja N., Pedrosa D. et al. Pathogenic lipid-binding antiphospholipid antibodies are associated with severity of COVID-19 // J. Thromb Haemost. 2021. V. 19 (9). P. 2335–2347.
Zuniga M., Gomes C., Carsons S.E. et al. Autoimmunity to annexin A2 predicts mortality among hospitalised COVID-19 patients // Eur. Respir. J. 2021. V. 58 (4). P. 2100918.
Cañas F., Simonin L., Couturaud F. et al. Annexin A2 autoantibodies in thrombosis and autoimmune diseases // Thromb. Res. 2015. V. 135 (2). P. 226–230.
Doevelaar A.A.N., Bachmann M., Hölzer B. et al. Generation of Inhibitory Autoantibodies to ADAMTS13 in Coronavirus Disease 2019 // medRxiv. 2021.03.18.21253869. https://doi.org/10.1101/2021.03.18.21253869
Althaus K., Marini I., Zlamal J. et al. Antibody-induced procoagulant platelets in severe COVID-19 infection // Blood. 2021. V. 137 (8). P. 1061–1071.
Brodard J., Kremer Hovinga J.A., Fontana P. et al. COVID-19 patients often show high-titer non-platelet-activating anti-PF4/heparin IgG antibodies // J. Thromb. Haemost. 2021. V. 19 (5). P. 1294–1298.
Greinacher A., Thiele T., Warkentin T.E. et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination // N. Engl. J. Med. 2021. V. 384 (22). P. 2092–2101.
Zuo Y., Zuo M., Yalavarthi S. et al. Neutrophil extracellular traps and thrombosis in COVID-19 // J. Thromb. Thrombolysis. 2021. V. 51 (2). P. 446–453.
Gagiannis D., Steinestel J., Hackenbroch C. et al. Clinical, Serological, and Histopathological Similarities Between Severe COVID-19 and Acute Exacerbation of Connective Tissue Disease-Associated Interstitial Lung Disease (CTD-ILD) // Front. Immunol. 2020. V. 11. P. 587517.
Wang G., Wang Q., Wang Y. et al. Presence of Anti-MDA5 Antibody and Its Value for the Clinical Assessment in Patients With COVID-19: A Retrospective Cohort Study // Front. Immunol. 2021. V. 12. P. 791348.
Arthur J.M., Forrest J.C., Boehme K.W. et al. Development of ACE2 autoantibodies after SARS-CoV-2 infection // PLoS One. 2021. V. 16 (9). P. e0257016.
Murphy W.J., Longo D.L. A Possible Role for Anti-idiotype Antibodies in SARS-CoV-2 Infection and Vaccination // N. Engl. J. Med. 2022. V. 386 (4). P. 394–396.
Wang E.Y., Mao T., Klein J. et al. Diverse functional autoantibodies in patients with COVID-19 // Nature. 2021. V. 595 (7866). P. 283–288.
Chang S.E., Feng A., Meng W. et al. New-Onset IgG Autoantibodies in Hospitalized Patients with COVID-19 // Natura Com. 2021. V. 12. P. 5417.
Bastard P., Zhang Q., Zhang S.Y. et al. Type I interferons and SARS-CoV-2: from cells to organisms // Curr. Opin. Immunol. 2022. V. 74. P. 172–182.
Woodruff M.C., Ramonell R.P., Nguyen D.C. et al. Extrafollicular B cell responses correlate with neutralizing antibodies and morbidity in COVID-19 // Nat. Immunol. 2020. V. 21 (12). P. 1506–1516.
Schett G., McInnes I.B., Neurath M.F. Reframing Immune-Mediated Inflammatory Diseases through Signature Cytokine Hubs // N. Engl. J. Med. 2021. V. 385 (7). P. 628–639.
Nasonov E., Samsonov M. The role of Interleukin 6 inhibitors in therapy of severe COVID-19 // Biomed. Pharmacother. 2020. V. 131. P. 110698.
Wang Y., Zhu K., Dai R. et al. Specific Interleukin-1 Inhibitors, Specific Interleukin-6 Inhibitors, and GM-CSF Blockades for COVID-19 (at the Edge of Sepsis): A Systematic Review // Front. Pharmacol. 2022. V. 12. P. 804250.
Gajjela B.K., Zhou M.M. Calming the cytokine storm of COVID-19 through inhibition of JAK2/STAT3 signaling // Drug. Discov. Today. 2022. V. 27 (2). P. 390–400.
Дополнительные материалы отсутствуют.


