Вестник РАН, 2022, T. 92, № 8, стр. 722-730
ОНКОЛОГИЯ В ПЕРИОД ПАНДЕМИИ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
А. Д. Каприн a, *, Н. С. Сергеева a, **, П. В. Шегай a, ***, Б. Я. Алексеев a, ****
a Национальный медицинский исследовательский центр радиологии Минздрава России
Обнинск, Россия
* E-mail: kaprin@mail.ru
** E-mail: prognoz.01@mail.ru
*** E-mail: dr.shegai@mail.ru
**** E-mail: byalekseev@nmirc.ru
Поступила в редакцию 12.03.2022
После доработки 21.04.2022
Принята к публикации 26.04.2022
- EDN: IHLRJW
- DOI: 10.31857/S0869587322080060
Аннотация
Пандемия COVID-19 послужила катализатором целого пласта научных исследований, в том числе в России, где с 2020 г. проводятся международные многоцентровые исследования по изучению влияния коронавирусной инфекции на течение онкологических заболеваний, а также на разработку и применение новых клинических методов в онкологии. В 2020–2022 гг. стали активно развиваться новые методы ядерной медицины, основанные на таргетном воздействии ионизирующего излучения радиофармпрепаратов, в частности, разработка новых отечественных радиофармпрепаратов для диагностики и терапии, методы внутриартериальной радиоэмболизации разработанными препаратами с 90Y и 188Re первичных и метастатических опухолей различной локализации. Внедрены в клиническую практику новые методы лучевой терапии, в том числе дистанционная лучевая терапия “быстрыми” нейтронами, позволяющая преодолеть резистентность опухоли к лучевому и лекарственному лечению. Кроме того, продолжается поиск и внедрение в клиническую практику новых подходов в области генной терапии и использовании онколитических вирусов. Находят своё применение в России платформы комплексного фармакогеномного анализа на основе мировых знаний и глубокого машинного обучения, позволяющие прецизионно подбирать наиболее эффективную терапию. Разрабатываются новые мультидисциплинарные технологии.
Начавшаяся в 2019 г. пандемия новой коронавирусной инфекции COVID-19 существенно повлияла на работу органов здравоохранения во всех странах без исключения, в частности в России. Правительства и профильные министерства были вынуждены срочно перестраивать работу медицинских организаций, исходя из стремительно меняющейся эпидемической обстановки. Потери населения от COVID-19 в мире по состоянию на 14.12.2021 г. оцениваются в среднем в 8–9 тыс. человек в день [1]. Изменение системы и порядка оказания медицинской помощи в той или иной мере коснулось всех отраслей медицины, в том числе онкологии.
Одновременно неуклонно растёт бремя онкологических заболеваний, приводя к огромным физическим, эмоциональным и финансовым последствиям для населения и систем здравоохранения во всём мире. По данным ВОЗ, ежедневно в мире от злокачественных новообразований умирают около 26 тыс. человек. Именно поэтому работа онкологической службы и научные исследования в области разработки и внедрения современных методов диагностики и лечения онкологических заболеваний не должны останавливаться даже в такое сложное время.
Если обратиться к российским статистическим данным, то с ростом возможностей ранней диагностики, расширением скрининговых программ и программ диспансеризации за 2016–2019 гг. количество выявленных случаев злокачественных новообразований только увеличивалось [2]. Однако в 2020 г. данная тенденция не сохранилась – в настоящий момент зафиксировано снижение числа выявленных онкологических заболеваний. Показатель заболеваемости злокачественными новообразованиями в 2020 г. в России снизился на 13.2% по сравнению с 2019 г. Подобная тенденция наблюдается, например, и в Республике Беларусь, где заболеваемость в 2020 г. снизилась на 20.18% по отношению к 2019 г. Очевидно, что этот тренд связан с пандемией новой коронавирусной инфекции, которая вызвала вынужденную приостановку программ скрининга, ранней диагностики и диспансеризации населения и, соответственно, привела к снижению выявляемости злокачественных новообразований.
Уже появились исследования, подтверждающие нецелесообразность приостановки программ раннего выявления онкологичексих заболеваний в период пандемии COVID-19. Так, известный британский онколог профессор К. Сикора полагает, что их задержка на каждые полгода из-за пандемии приведёт в последующие годы к увеличению доли запущенных форм рака и, как следствие, дополнительному росту смертности примерно на 50 тыс. больных в год [3]. Откладывание профилактических и скрининговых мероприятий, например, по раку молочной железы, раку шейки матки и опухолям желудочно-кишечного тракта всего лишь на неделю может приводить к снижению выявляемости 400 случаев этих заболеваний на ранних стадиях, когда высока вероятность проведения эффективного радикального лечения. Таким образом, онкологическое сообщество должно быть готово к увеличению доли распространённых (метастатических), а также устойчивых к традиционным терапевтическим подходам формам рака уже в ближайшие несколько лет. Кроме того, новая коронавирусная инфекция непосредственно влияет на здоровье и качество жизни онкологических пациентов. По данным исследований коллег из КНР, опубликованных в журнале “Lancet”, у онкологических пациентов наблюдался более высокий риск тяжёлых осложнений по сравнению с пациентами без этой патологии [4].
В условиях пандемии новой короновирусной инфекции, начиная с 2020 г., перед онкологической службой встала проблема дефицита медицинских и научных кадров. Отток кадров из научно-исследовательских онкологических институтов и вузов, в том числе аспирантов и ординаторов, в практическое здравоохранение в связи с лучшими условиями оплаты труда (особенно в инфекционных отделениях) не всегда возможно остановить путём мотивации профессиональным и научным ростом. Проблемы научного менеджмента в условиях COVID-инфекции связаны и со сложностью формирования хорошо охарактеризованных и прослеженных выборок и баз данных онкологических больных из-за перерывов в курсах специализированного лечения в ходе научных исследований, а также с трудностями при оценке итогов научных исследований, обусловленными дополнительным влиянием коронавирусной инфекции на результаты лечения основного заболевания и качество жизни онкобольных и сокращением финансирования научных проектов, не связанных с изучением инфекции.
Пандемия COVID-19 стимулировала исследования в онкологии такого биологического явления, как системное воспаление. Известно, что неблагоприятное течение коронавирусной инфекции приводит к развитию системного воспалительного ответа (СВО), что выражается в массированном выбросе в кровоток цитокинов (“цитокиновый шторм”) и белков острой фазы [5]. Сходные явления, выраженные в разной степени, могут наблюдаться и на этапах развития опухолевого заболевания. В онкологии активация СВО исходно регистрируется примерно у трети больных с операбельными опухолями и у половины больных с неоперабельными опухолями [6, 7]. Повышенный уровень СВО у онкологических больных до начала лечения коррелирует с распространённостью опухолевого процесса, более коротким периодом общей и безрецидивной выживаемости после хирургического, лекарственного и комбинированного лечения, со слабым ответом опухоли на химиотерапию [8–12].
Биологическими маркерами системного воспалительного ответа у онкологических больных чаще всего служат: уровень в плазме крови С-реактивного белка (СРБ), синтез которого в печени индуцируется провоспалительными цитокинами, поступающими в системный кровоток; индекс Glasgow Prognostic Score (GPS), учитывающий соотношение уровня СРБ и содержание альбумина в плазме крови; отношение нейтрофилов или тромбоцитов к лимфоцитам (NLR и PLR соответственно), что косвенно отражает соотношение воспалительных реакций и реакций специфического иммунитета; уровни в периферической крови провоспалительных медиаторов – интерлейкина (ИЛ)-6, ИЛ-8, ИЛ-1β, ИЛ-12, ИЛ-17, фактора некроза опухолей (ФНО) [13].
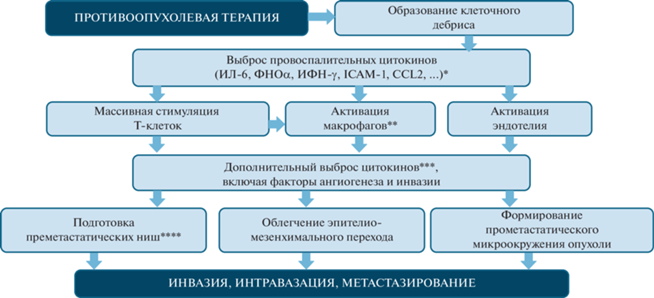
Системный выброс провоспалительных цитокинов и активация СВО наблюдаются при различных видах противоопухолевой терапии, включая таргетную и иммунотерапию [14–16]. Предполагается, что это может быть связано с образованием продуктов деградации опухолевых клеток, перепрограммированием опухоль-ассоциированных макрофагов и фибробластов, непосредственной индукцией синтеза цитокинов в клетках опухоли под действием цитостатиков [17–20]. В экспериментальных исследованиях установлено, что последствия подобных реакций могут провоцировать метастазирование опухолей, и механизмы такого парадоксального эффекта противоопухолевого лекарственного лечения активно изучаются [18–20]. На основе данных экспериментальных исследований сформирована цепь событий, которая может связывать выброс цитокинов при противоопухолевой терапии с индукцией метастазирования (рис. 1).
Рис. 1.
Предполагаемый механизм парадоксального стимулирующего влияния противоопухолевого лекарственного лечения на опухолевую прогрессию (на основе данных экспериментальных исследований) [18, 20]
* Цитокины как молекулы межклеточной коммуникации; ** инфильтрация опухоли макрофагами; *** “цитокиновый шторм”; **** циркулирующие цитокины
В настоящее время в Московском научно-исследовательском онкологическом институте им. П.А. Герцена (МНИОИ им. П.А. Герцена – филиал Национального медицинского исследовательского центра радиологии Минздрава России) проводится исследование СВО у больных, получающих лекарственную противоопухолевую терапию, алгоритмов его оценки и клинической значимости. В перспективе будут предложены схемы купирования системного воспалительного ответа для улучшения результатов лечения.
В Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова Минздрава России проводится пострегистрационное неинтервенционное когортное исследование эффективности и безопасности вакцинопрофилактики коронавирусной инфекции COVID-19 препаратом Спутник V у пациентов с метастатическими солидными опухолями на фоне системного лекарственного лечения. Важно сравнение уровня вируснейтрализующих антител IgA, IgM, IgG к SARS-CoV-2 антигенам (N-белок, RBD и S1) у онкологических больных относительно здоровых лиц (медицинский персонал) в соответствии с гипотезой, что эффективность вакцины при применении на онкологических пациентах не ниже, чем в случае здоровых людей (разница частот составляет менее 20%). Кроме того, становится актуальным изучение нежелательных последствий вакцинации в когортах пациентов и в сравнении с данными регистрационных исследований при проведении различных режимов лекарственной терапии. Предполагается, что нежелательные явления не нарастают после второго введения вакцины по сравнению с первой вакцинацией. Однако уровень вируснейтрализующих антител IgG может оказаться на 30% ниже у пациентов на химиотерапии c высоким риском развития гематологической токсичности, что потребует третьего введения вакцины. Кроме того, неизученными остаются сроки ревакцинации при снижении защитного титра вируснейтрализующих антител IgG к RBD домену спайкового белка (S) SARS-CoV-2 ниже референтных значений.
На первом этапе в исследование были включены здоровые лица (n = 22), у которых изучали фагоцитарную активность нейтрофилов и моноцитов, субпопуляционный состав и функциональную активность иммунокомпетентных клеток периферической крови (Т-лимфоциты, Т-хелперы, цитотоксические Т-лимфоциты, T-регуляторные клетки, B-лимфоциты, NK- и NKT-клетки), уровень специфических антител к белкам вируса SARS-CoV-2: белок нуклеокапсида (N), рецептор-связывающий домен (RBD), субъединица S1 спайкового белка. Уровень антител определяли с использованием программного обеспечения BD FACSDiva v8.0.1 по соотношению медианы интенсивности флуоресценции MFI (Median fluorescence intensity) антигена в сравнении с контролем.
Субпопуляционный состав лимфоцитов и активность фагоцитирующих клеток во всех исследованных образцах находились в переделах референтных значений. При анализе уровня антител были выделены четыре когорты. В первую когорту включены вакцинированные после перенесённой коронавирусной инфекции COVID-19 (n = 7); вторая состояла из невакцинированных, но перенёсших коронавирусную инфекцию (n = 2); третья – из вакцинированных, не болевших COVID-19 (n = 4); четвёртая – из невакцинированных и неболевших (n = 9) (рис. 2, 3).
Рис. 2.
Уровень вируснейтрализующих антител IgG к SARS-CoV-2 антигенам (S1, N-белок, RBD) относительно контрольных значений (Guava® SARS-CoV-2 Multi-Antigen Antibody Kit, Luminex (США), проточный цитофлюориметр BD FACS Canto™ II, BD Biosciences)
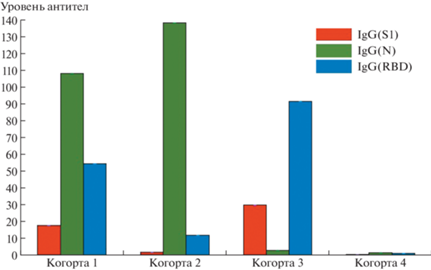
Рис. 3.
Интенсивность флуоресценции (MFI) IgG к SARS-CoV-2 антигенам (S1, N-белок, RBD) относительно контрольных значений (Guava® SARS-CoV-2 Multi-Antigen Antibody Kit, Luminex (США), проточный цитофлюориметр BD FACS Canto™ II, BD Biosciences)
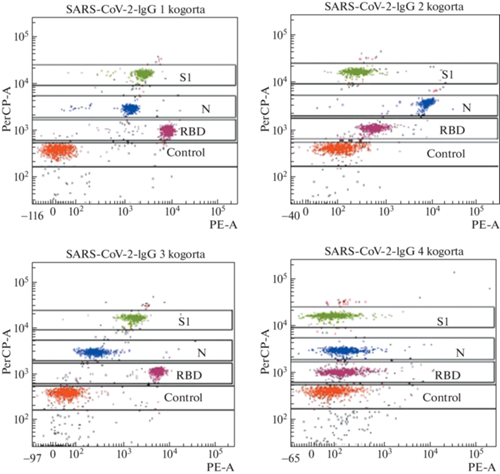
Сравнительный анализ уровня вируснейтрализующих антител IgG к SARS-CoV-2 антигенам (S1, N-белок, RBD) в изучаемых когортах здоровых лиц показал, что у переболевших независимо от вакцинации определяются IgG к белку нуклеокапсида N (когорты 1 и 2), в отличие от вакцинированных, но не перенёсших COVID-19 (когорта 3). У вакцинированных через три месяца выявлено высокое содержание IgG к SARS-CoV-2 антигенам RBD и S1 (когорты 1 и 3). У невакцинированных и неболевших уровень изучаемых антител IgG к SARS-CoV-2 не достигал контрольных значений (когорта 4). Показатели IgA и IgM к SARS-CoV-2 во всех когортах достоверно не отличались. Таким образом, вакцинопрофилактика коронавирусной инфекции COVID-19 препаратом Спутник V приводит к формированию высокого уровня вируснейтрализующих антител IgG к SARS-CoV-2 антигенам (RBD и S1) у здоровых лиц с референтными значениями иммунологических показателей.
В НМИЦ онкологии Минздрава России проведено исследование, целью которого стало изучение показателей свёртывающей системы крови пациенток, больных раком молочной железы (РМЖ) и перенёсших COVID-19 различной степени тяжести. Больные РМЖ (50 человек) были разделены на группы: основная – 30 пациенток, перенёсших новую коронавирусную инфекцию; контрольная группа 1 – 20 больных без подтверждённой инфекции; а также контрольная группа 2 – 20 женщин без онкопатологии с COVID-19 в анамнезе. Онкологические больные получали курсы химиотерапии сообразно стадии процесса. Изучались следующие показатели: активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ), международное нормализованное отношение (МНО), протромбиновый индекс (ПТИ), фибриноген, растворимые фибрин-мономерные комплексы (РФМК), тромбиновое время (ТВ), антитромбин III, D-димер и плазминоген, продукты деградации фибрина. Кровь на исследование брали через 4–6 недель после перенесённой инфекции и получения двух отрицательных ПЦР тестов на COVID-19.
У больных основной группы после лечения получены различия показателей МНО в группе с бессимптомным течением (Ме = 1.24) и в группе с лёгким течением (Ме = 0.97): U = 10, Z = 2.766, p = 0.0057; в группе бессимптомного течения (Ме = 1.24) и в группе со средне-тяжёлым течением (Ме = 0.98): U = 26.5, Z = 2.199, p = 0.027; в показателях ТВ в группе бессимптомного течения (Ме = 14.5) и в группе со средне-тяжёлым течением (Ме = 16.5): U = 18.5, Z = –2.725, p = 0.0064. При сравнении групп больных, перенёсших COVID-19 до (Ме = 0.83) и после лечения (Ме = = 0.4), получены различия в показателе D-димера у больных со средне-тяжёлым течением: U = 6.5, Z = –2.2861, р = 0.022 в сторону уменьшения последнего после химиотерапии. Получены различия показателей АЧТВ в основной группе (Ме = = 30.65) и контрольной группе 1 (Ме = 27.85): U = = 119, Z = 3.574, p = 0.00035; показателей анти-тромбина в основной группе (Ме = 94) и контрольной группе 1 (Ме = 106): U = 112, Z = 3.713, p = 0.00021; показателей РФМК в основной группе (Ме = 17) и контрольной группе 1 (Ме = 8): U = = 180.5, Z = 2.356, p = 0.018.
Авторы приходят к выводу, что определение уровня плазминогена может стать независимым фактором выявления тромботического риска у онкологических больных, переболевших COVID-19. Целесообразно при наличии перенесённой коронавирусной инфекции в анамнезе больного злокачественными новообразованиями учитывать её как дополнительный фактор риска венозных тромбоэмболических осложнений для данных пациентов.
В последние годы в России наблюдается активное развитие технологий ядерной медицины, и 2021 г. не стал исключением. Увеличилось число как новых разработок, так и клинических исследований отечественных радиофармпрепаратов (РФП) для диагностики и терапии [21, 22].. ПСМА-направленная радиолигандная терапия (ПСМА-РЛТ) у больных с метастатическим каст-рат-резистентным раком предстательной железы (мКРРПЖ) в мире ещё не зарегистрирована, но проходит клинические исследования 2 и 3 фазы в странах Европы, США и Канаде, в рамках которых успешно пролечено уже более 2 тыс. пациентов [23, 24]. В НМИЦ радиологии Минздрава России разработано три оригинальных отечественных таргетных радиофармпрепарата (РФЛП) для диагностики и терапии метастатического каст-рационно-резистентного рака предстательной железы: 99mTc-HYNIC-ПСМА, 177Lu-ДОТА-ПСМА и 225Ас-ДОТА-ПСМА, мишенями для которых выступает простат-специфичный мембранный антиген (рис. 4).
Рис. 4.
Динамика изменения среднего объёма опухоли после однократного внутривенного введения РФЛП 177Lu-ДОТА-ПСМА (мыши линии BALB/c nu/nu с перевитым РПЖ)
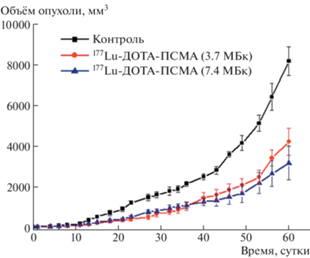
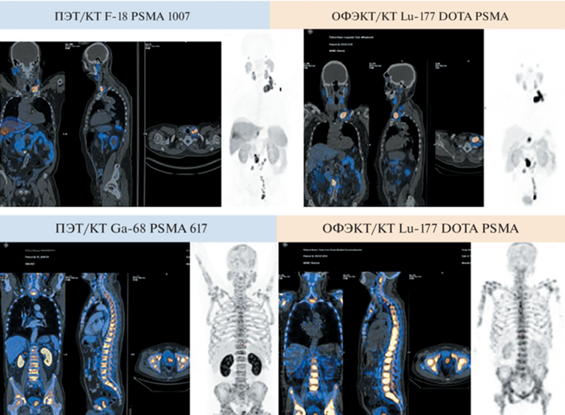
РФЛП 177Lu-ДОТА-ПСМА прошёл доклинические и вступил в клинические исследования для его последующей регистрации. Кроме того, в НМИЦ радиологии Минздрава России проведена первая в России лечебная процедура РФЛП 177Lu-ДОТА-ПСМА больным мКРРПЖ, и сейчас они лечатся в центре рутинно в рамках Приказов Минздрава России № 1218н от 12.11.2020 г. и № 780н от 31.07.2020 г. Радиофармпрепаратом 177Lu-ДОТА-ПСМА уже пролечено 29 пациентов. Его распределение в организме хорошо согласовалось с распределением диагностических препаратов с 18F и 68Ga на ПЭТ этих пациентов. Наблюдалась стабилизация или снижение уровня ПСА у всех пациентов после проведения радиолигандной терапии, а также уменьшение размеров метастатических очагов [25] (рис. 5).
Рис. 5.
Идентичность фармакокинетики диагностических РФЛП 18F-PSMA-1007 / РФЛП 68Ga-ПСМА-617 и терапевтического РФЛП 177Lu-DOTA-PSMA
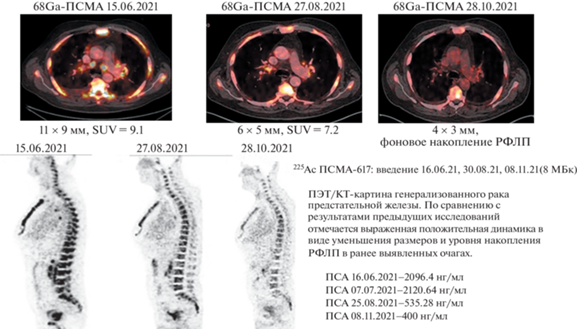
В Российском научном центре радиологии и хирургических технологий им. ак. А.М. Гранова Минздрава России (РНЦРХТ им. ак. А.М. Гранова Минздрава России) в 2020–2021 гг. была разработана технология синтеза радиофармпрепарата 225Ас-ПСМА для лечения пациентов с мКРРПЖ, резистентных к радиолигандной ПСМА-терапии радиофармпрепаратом с 177Lu. В июне–ноябре 2021 г. в центре в рамках Приказа Минздрава России № 1218н от 12.11.2020 г. радиофармпрепаратом 225Ас-ПСМА было пролечено три пациента: одному был проведён один курс радиотерапии, двум другим – три курса радиотерапии с интервалом в два месяца. Активность вводимого РФЛП составляла 8 МБк [26] (рис. 6).
Радионуклид 225Ас (период полураспада 9.92 дня; энергия альфа-частиц 5.94 МэВ) является альфа-излучающим изотопом, физико-химические характеристики которого идеально подходят для целей ядерной медицины, а единственный его недостаток – редкость. В мире 225Ас получают в небольших количествах лишь в трёх центрах: АО “ГНЦ НРФ – ФЭИ” (Обнинск, Россия), OakRidge National Laboratory (Штат Теннесси, США), Institute for Transuranium Elements (Карлсруе, Германия). В РНЦРХТ им. ак. А.М. Гранова Минздрава России, как и в НМИЦ радиологии Минздрава России, проводили исследования с отечественным 225Ас. Введение в печёночную артерию радиоактивных микросфер – эндоваскулярная радиоэмболизация печени (SIRT, РЭ) – один из самых эффективных методов лечения нерезектабельного рака печени [27, 28]. В мире для РЭ разрешены к клиническому применению микросферы с радионуклидом 90Y (Theraspheres, MDS Nordion, Канада; SIR-spheres, Sirtex Medical, Австралия) и микросферы с 166Но (QuiremSpheres, Quirem Medical BV, Deventer, the Netherlands) [27–30]. В НМИЦ радиологии Минздрава России проводятся клинические испытания оригинального отечественного РФЛП гепаторен-МРНЦ на основе микросфер альбумина крови человека диаметром 20–40 мкм, меченных 188Re, для лечения нерезектабельного рака печени.
* * *
Учитывая описанные выше факты, в настоящее время онкологическая наука фокусирует своё внимание на поиске и развитии технологий раннего выявления онкологических заболеваний и эффективного лечения запущенных (метастатических) форм рака. В 2019–2021 гг. активное развитие получили:
• методы ядерной медицины, основанные на таргетном воздействии ионизирующего излучения радиофармпрепаратов, в том числе разработка новых отечественных диагностических и лечебных радиофармпрепаратов;
• методы рентгенэндоваскулярной радиоэмболизации первичных и метастатических опухолей различной локализации;
• разработка и внедрение новых видов лучевой терапии, в том числе “быстрыми” нейтронами, позволяющими преодолеть резистентность к лучевому и лекарственному лечению;
• разработка и внедрение новых подходов (генная терапия, использование онкологических вирусов);
• разработка и внедрение платформ комплексного фармакогеномного анализа на основе мировых знаний и глубокого машинного обучения, позволяющих прецизионно подбирать наиболее эффективную терапию;
• разработка новых мультидисциплинарных хирургических техник;
• изучение фундаментальных механизмов возможного канцерогенного потенциала COVID 19.
Пандемия COVID-19 послужила катализатором целого ряда научных изысканий, в том числе в российских центрах, где проводятся международные многоцентровые исследования COVID-инфекции в онкологии. Кроме того, необходимость поиска новых решений в области диагностики и лечения COVID-19 привела учёных к более тесному междисциплинарному сотрудничеству и применению технологий off-label, а также гибкому маневрированию режимами лучевого, комбинированного и комплексного лечения.
Список литературы
https://yandex.ru/covid19/stat?utm_source=main_graph&utm_source=main_notif&geoId=225
Состояние онкологической помощи населению России в 2020 году / Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена, 2021.
https://:hmong.ru/wiki/Karol_Sikora
Liang W., Guan W., Chen R. et al. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China // Lancet Oncol. 2020. V. 21 (3). P. 335–337.
Jiang Y., Rubin L., Peng T. et al. Cytokine storm in COVID-19: from viral infection to immune responses, diagnosis and therapy // Int. J. Biol. Sci. 2022. V. 18 (2). P. 459–472.
Dolan R.D., Lim J., McSorley S.T. et al. The role of the systemic inflammatory response in predicting outcomes in patients with operable cancer: Systematic review and meta-analysis // Sci. Rep. 2017a. V. 7 (1). P. 16717.
Dolan R.D., McSorley S.T., Horgan P.G. et al. The role of the systemic inflammatory response in predicting outcomes in patients with advanced inoperable cancer: Systematic review and meta-analysis // Crit. Rev. Oncol. Hematol. 2017b. V. 116. P. 134–146.
Lin S., Gan Z., Han K. et al. Interleukin-6 as a prognostic marker for breast cancer: a meta-analysis // Tumori. 2015. V. 101 (5). P. 535–541.
Dolan R.D., Laird B.J.A., Horgan P.G., McMillan D.C. The prognostic value of the systemic inflammatory response in randomised clinical trials in cancer: A systematic review // Crit. Rev. Oncol. Hematol. 2018. V. 132. P. 130–137.
Guo W., Lu X., Liu Q. et al. Prognostic value of neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio for breast cancer patients: An updated meta-ana-lysis of 17079 individuals // Cancer Med. 2019. V. 8 (9). P. 4135–4148.
Sanghera C., Teh J.J., Pinato D.J. The systemic inflammatory response as a source of biomarkers and therapeutic targets in hepatocellular carcinoma // Liver Int. 2019. V. 39 (11). P. 2008–2023.
Yuk H.D., Ku J.H. Role of systemic inflammatory response markers in urothelial carcinoma // Front. Oncol. 2020. V. 10. P. 1473.
Guner A., Kim H.I. Biomarkers for evaluating the inflammation status in patients with cancer // J. Gastric Cancer. 2019. V. 19 (3). P. 254–277.
Shimabukuro-Vornhagen A., Gödel P., Subklewe M. et al. Cytokine release syndrome // J. Immunother. Cancer. 2018. V. 6 (1). P. 56.
Findakly D., Luther R.D. 3rd, Wang J. Tumor lysis syndrome in solid tumors: A comprehensive literature review, new insights, and novel strategies to improve outcomes // Cureus. 2020. V. 12 (5). P. e8355.
Ceschi A., Noseda R., Palin K., Verhamme K. Immune checkpoint inhibitor-related cytokine release syndrome: Analysis of WHO Global Pharmacovigilance Database // Front. Pharmacol. 2020. V. 11. P. 557.
Ran S. The role of TLR4 in chemotherapy-driven metastasis // Cancer Res. 2015. V. 75 (12). P. 2405–2410.
Middleton J.D., Stover D.G., Hai T. Chemotherapy-exacerbated breast cancer metastasis: A paradox explainable by dysregulated adaptive-response // Int. J. Mol. Sci. 2018. V. 19 (11). P. 3333.
Gartung A., Yang J., Sukhatme V.P. et al. Suppression of chemotherapy-induced cytokine/lipid mediator surge and ovarian cancer by a dual COX-2/sEH inhibitor // Proc. Natl. Acad. Sci. USA. 2019. V. 116 (5). P. 1698–1703.
Karagiannis G.S., Condeelis J.S., Oktay M.H. Chemotherapy-induced metastasis: Molecular mechanisms, clinical manifestations, therapeutic interventions // Cancer Res. 2019. V. 79 (18). P. 4567–4576.
Информация с сайта ГК “Росатом”. https://rg.ru/ 2021/04/11/rost-rossijskogo-rynka-iadernoj-mediciny-udvoitsia-k-koncu-goda.html
Постановление Правительства РФ от 22.10.2021 г. № 1779 «О создании инновационного научно-технологического центра “Парк атомных и медицинских технологий”».
Kratochwil C., Fendler W.P., Eiber M. et al. EANM procedure guidelines for radionuclide therapy with 177Lu-labelled PSMA-ligands (177Lu-PSMA-RLT) // Eur. J. Nuc. Med. Mol. Im. 2019. V. 46. P. 2536–2544.
Ларенков А.А., Кодина Г.Е. Радионуклидная диагностика рака предстательной железы: позитронно-эмиссионная томография с 68Ga-PSMA-ингибиторами и их фармразработка // Медицинская радиология и радиационная безопасность. 2017. № 6. С. 58–74.
Крылов В.В., Петриев В.М., Кочетова Т.Ю. и др. Первый в России опыт применения отечественного препарата 177Lu-ДОТА-ПСМА при метастатическом кастрационно-резистентном раке предстательной железы // Материалы V Международной научно-практической конференции “Радиофарма-2021”. 2021. С. 50–51.
Антуганов Д.О., Антуганова Ю.О., Надпорожский М.А., Снигирёва Н.А. Особенности контроля качества 68Ga/177Lu/225Ac-ПСМА // Материалы V Международной научно-практической конференции “Радиофарма-2021”. 2021. С. 39.
Каприн А.Д., Иванов С.А., Кучеров В.В. и др. Радиоэмболизация печени: новая глава в отечественной онкологии // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019. № 5. С. 7–12.
Kima S.P., Cohalanb C., Kopekc N. et al. A guide to 90Y radioembolization and its dosimetry // Physica Medica. 2019. V. 68. P. 132–145.
Alsultan A.A., Braat A.J.A.T., Smits M.L.J. et al. Status and Future Direction of Hepatic Radioembolisation // Clinical Oncology. 2021. V. 33. P. 106–116.
Reinders M.T.M., Smits M.L.J., van Roekel C. et al. Holmium-166 Microsphere Radioembolization of Hepatic Malignancies // Semin. Nucl. Med. 2019. V. 49. P. 237–243.
Дополнительные материалы отсутствуют.