Вестник РАН, 2023, T. 93, № 3, стр. 275-282
ПЕРСОНИФИЦИРОВАННЫЙ ПОДХОД К МОНИТОРИНГУ И ТЕРАПИИ КРИТИЧЕСКИХ СОСТОЯНИЙ
М. Ю. Киров a, *, В. В. Кузьков a, **, Е. В. Фот a, ***, А. А. Смёткин a, ****
a Северный государственный медицинский университет Минздрава России
Архангельск, Россия
* E-mail: mikhail_kirov@hotmail.com
** E-mail: v_kuzkov@mail.ru
*** E-mail: ev_fot@mail.ru
**** E-mail: anesth_sm@mail.ru
Поступила в редакцию 13.01.2023
После доработки 23.01.2023
Принята к публикации 30.01.2023
- EDN: QEHTBT
- DOI: 10.31857/S0869587323030040
Аннотация
В статье изложены ключевые аспекты диагностики и терапии критических состояний. Особое внимание уделено инвазивному мониторингу гемодинамики при сепсисе и септическом шоке. Авторы рассматривают стратегию инфузионной терапии и респираторной поддержки как у пациентов реанимационного профиля, так и в периоперационном периоде обширных хирургических вмешательств. Результаты клинических исследований легли в основу персонифицированного подхода к мониторингу и терапии критических состояний. Такой подход, представляя собой одно из перспективных направлений современной медицины, изменяет диагностическую и лечебную тактику, позволяет достоверно улучшить клинические исходы, снижает нагрузку на систему здравоохранения и длительность госпитализации, уменьшает количество осложнений и летальных исходов.
Коррекция гемодинамических нарушений и органной дисфункции у пациентов, находящихся в критическом состоянии, – одна из ключевых задач современной интенсивной терапии. Это особенно актуально при шоке, который регистрируется приблизительно у трети пациентов отделения интенсивной терапии и характеризуется смертностью порядка 50% [1]. Несвоевременная коррекция объёма циркулирующей крови и общего содержания воды в организме у пациентов с шоком сопровождается ухудшением органной функции и ростом летальности. В связи с этим пациентам с шоком необходимо внутривенное ведение жидкости – инфузионная терапия11. Ещё один важнейший метод лечения при шоке – инотропная и вазопрессорная поддержка, при которой используются препараты, усиливающие способность сердца сокращаться (инотропные свойства) и поддерживающие тонус сосудов организма (вазопрессорный эффект), что необходимо для поддержания артериального давления и эффективного кровоснабжения органов. Быстрое принятие решений об оптимальном объёме и составе инфузионной терапии, характере инотропной и вазопрессорной поддержки и параметрах искусственной вентиляции лёгких – одна из основных целей врача-реаниматолога на протяжении всего периода пребывания пациента в отделении интенсивной терапии [2, 3].
Инфузионная терапия играет важную роль на начальном этапе стабилизации состояния пациентов с сепсисом, травмой, кровопотерей, шоком различного генеза [4, 5]. Важной предпосылкой её успеха выступает возможность увеличения сердечного выброса (количество крови, выбрасываемое правым или левым желудочком в единицу времени) и доставки кислорода. В то же время факторами, ограничивающими эффективность инфузионной терапии и нарушающими транспорт кислорода, становятся гемодилюция22, ухудшение оксигенации и тканевой отёк на фоне дистрибутивного шока33 и синдрома системного воспаления, когда инфузионные среды быстро покидают сосудистое русло и попадают в интерстициальное (межклеточное) пространство, приводя к острому респираторному дистресс-синдрому (ОРДС)44 и другим осложнениям. В тех случаях, когда утечка жидкости принимает угрожающий жизни характер, говорят о синдроме глобального усиления проницаемости [6]. Примечательно, что спустя лишь сутки после госпитализации в отделение интенсивной терапии чувствительность к инфузии сохраняется менее чем у 50% пациентов [7]. Как следствие, у половины больных активное проведение дальнейшей инфузионной терапии становится нецелесообразным и даже опасным. В связи с этим крайне важен именно персонифицированный подход к мониторингу и терапии критических состояний.
Подобный подход в настоящее время служит центральным звеном ведения пациентов реанимационного профиля. В рамках его изучения авторы исследовали и внедрили в рутинную клиническую практику комплекс диагностических инструментов, а также ряд лечебных стратегий. В частности, детально рассмотрены вопросы мониторинга систем дыхания, кровообращения и метаболизма на фоне различных критических состояний, фазовой инфузионной терапии у пациентов с сепсисом и септическим шоком, оптимизации респираторной поддержки как у пациентов после оперативных вмешательств высокого риска, так и у больных с ОРДС. На основе полученных данных были разработаны и валидированы в клинической практике алгоритмы персонализированной коррекции нарушений гемодинамики, газообмена, транспорта кислорода и органной функции.
Большое внимание уделялось изучению метода транспульмональной термодилюции55 и оценке внесосудистой воды лёгких на фоне искусственной вентиляции лёгких. Несмотря на то, что искусственная вентиляция лёгких – самый распространённый метод протезирования внешнего дыхания, она не заменяет функцию лёгких, а лишь обеспечивает более оптимальные условия для обмена газами между организмом и окружающей средой. Более того, у некоторых категорий пациентов использование искусственной вентиляции лёгких может приводить к повреждению лёгочной ткани (механическое перерастяжение, полное спадение участков лёгких) и развитию вторичного отёка лёгких (вентилятор-индуцированный отёк). Это особенно актуально при операциях, сопровождающихся удалением поражённой заболеванием части лёгочной ткани. Авторы продемонстрировали, что метод изолированной транспульмональной термодилюции позволяет с высокой точностью измерить индекс внесосудистой воды лёгких на фоне вентилятор-индуцированного отёка единственного лёгкого [8]. Кроме того, у умерших пациентов с сепсис-индуцированным ОРДС и шоком наблюдается достоверное повышение индекса внесосудистой воды лёгких, тогда как у выживших содержание жидкости в лёгких снижается [9, 10].
Полученные данные легли в основу протоколов целенаправленной инфузионной терапии и дегидратации для различных категорий пациентов. Показано, что после хирургических вмешательств по поводу комбинированных пороков сердца алгоритм целенаправленной терапии, основанный на транспульмональной термодилюции, обеспечивает более стабильные показатели гемодинамики и транспорта кислорода и на 36% уменьшает продолжительность послеоперационной искусственной вентиляции лёгких по сравнению с коррекцией гемодинамики, проводимой по показателям термодилюции, которая осуществлялась с помощью катетеризации лёгочной артерии [11].
Исследуемые показатели также гармонично согласовываются с фазовым подходом к инфузионной терапии. Процесс фазового ведения пациентов в отделении интенсивной терапии требует надёжных диагностических критериев, позволяющих своевременно диагностировать переход от одной стадии к другой. При подборе инфузионной терапии в стадии ресусцитации (проявление признаков жизни без восстановления сознания) можно опираться на достаточно простые клинические параметры и показатели гемодинамики, тогда как с каждой последующей стадией процесс принятия решения становится всё более сложным и требует использования большего количества различных диагностических инструментов. В качестве критериев для начала дересусцитации/дегидратации можно использовать положительный кумулятивный гидробаланс в комбинации со снижением показателя артериальной оксигенации РаО2/FiO2 <200 мм рт. ст., повышением капиллярной утечки (индекс проницаемости лёгочных сосудов >2.5 и индекс внесосудистой воды лёгких (ИВСВЛ) >12 мл/кг предсказанной массы тела), увеличением внутрибрюшного давления >15 мм рт. ст. и снижением пульсового давления <40 мм рт. ст. [12].
Важным фактором для выбора оптимального гидробаланса, отражающим гидратацию интерстиция малого круга кровообращения, служит ИВСВЛ [13]. Примечательно, что этот индекс взаимосвязан с внутричерепным и внутрибрюшным давлением, а также с функцией других органов и исходом. Так, в одном из исследований авторы продемонстрировали, что проведение целенаправленной дегидратационной терапии под контролем волюметрических показателей, в частности, внесосудистой воды лёгких, у пациентов с сепсисом и ОРДС сопровождается стабилизацией показателей гемодинамики и повышением артериальной оксигенации (показателя PaO2/FiO2), pH крови и актуального бикарбоната параллельно с уменьшением дефицита оснований [14]. Деэскалационная терапия сепсиса и острого респираторного дистресс-синдрома приводит к существенному снижению тяжести органной дисфункции по шкале последовательной оценки органной функции (SOFA), при этом количество пациентов, получающих вазопрессоры, уменьшается в 2 раза. Более того, деэскалационная терапия при ОРДС на фоне сепсиса под контролем внесосудистой воды лёгких более эффективно способствует разрешению артериальной гипоксемии, отёка лёгких, синдрома капиллярной утечки66 и острого повреждения почек, чем дегидратация с использованием в качестве основного ориентира глобального конечно-диастолического объёма [14].
Целесообразность оценки внесосудистой воды лёгких была доказана и в другом исследовании авторов, показавшем, что протокол дересусцитации под контролем ИВСВЛ ускоряет восстановление диуреза и сократительной функции миокарда у пациентов с острым повреждением почек и ОРДС. Более активное восстановление диуреза при проведении непрерывной вено-венозной гемодиафильтрации под контролем ИВСВЛ может объясняться ускорением разрешения отёка паренхимы почек или, напротив, предупреждением нецелесообразной дегидратации при подборе ультрафильтрации с учётом этого показателя. Значительное снижение объёма суточной ультрафильтрации может ассоциироваться с постепенным восстановлением суточного диуреза и уменьшением общего гидробаланса при статистически несущественных различиях в инфузионной нагрузке и общих потерях жидкости в период исследования [15].
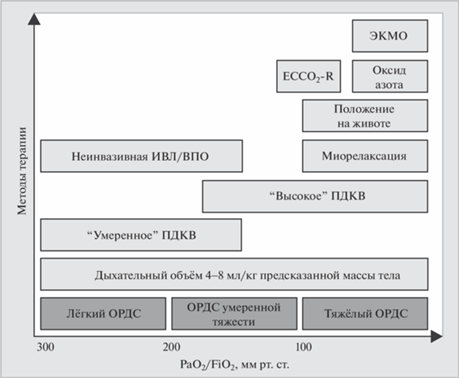
Мониторинг внесосудистой воды лёгких не только лёг в основу алгоритмов инфузионной и дегидратационной терапии, но и позволил оценить целесообразность проведения манёвра рекрутмента альвеол77 с кратковременным повышением давления в дыхательных путях на фоне искусственной вентиляции лёгких у пациентов с острым респираторным дистресс-синдромом. Проведение данного манёвра сопровождалось увеличением показателя PaO2/FiO2 у пациентов без отёка лёгких (ИВСВЛ <10 мл/кг) и не приводило к улучшению оксигенации у пациентов с отёком лёгочной ткани [16, 17]. Таким образом, пациенты с ОРДС требуют персонализированного подхода в зависимости от степени выраженности гипоксемии. Это нашло отражение в современном алгоритме респираторной поддержки больных с ОРДС (рис. 1). Так, при наличии острого респираторного дистресс-синдрома лёгкой и умеренной степени тяжести можно ограничиться применением неинвазивной вентиляции лёгких или высокопоточной оксигенации, в то время как тяжёлый ОРДС практически всегда требует проведения инвазивной респираторной поддержки, в том числе с альвеолярным рекрутментом по показаниям.
Рис. 1.
Подбор опций респираторной поддержки в зависимости от тяжести ОРДС
ПДКВ – положительное давление в конце выдоха; ОРДС – острый респираторный дистресс-синдром; ПМТ – предсказанная масса тела; ВПО – высокопоточная оксигенация; ЭКМО – экстракорпоральная мембранная оксигенация
Следующим этапом работы стало внедрение малоинвазивных методов мониторинга гемодинамики. В современной анестезиологии и интенсивной терапии именно снижение инвазивности мониторного контроля без потери качества получаемой информации стало основным трендом последних десятилетий. Идеальная система гемодинамического мониторинга должна быть точной, обеспечивать воспроизводимые измерения, представлять интерпретируемые данные, быть лёгкой в использовании и независимой от оператора, иметь быстрый отклик на изменяющиеся гемодинамические условия, не оказывать негативного влияния на пациента, иметь приемлемую стоимость и достаточную информативность для проведения терапии [18]. На практике при выборе мониторной системы клиницист ориентируется на такие факторы, как инвазивность, наличие технических ограничений, точность, воспроизводимость данных, наличие дополнительных гемодинамических параметров и личный опыт.
Сердечный выброс – один из наиболее важных параметров гемодинамики в хирургии высокого риска. Традиционно он определяется с использованием методов препульмональной и транспульмональной термодилюции. Оба метода продемонстрировали достаточную точность и воспроизводимость и были неоднократно использованы в разных протоколах целенаправленной терапии [19]. В то же время термодилюционные методы инвазивны, не являются полностью независимыми от оператора и требуют повторного введения индикатора. Более того, при использовании термодилюции в ряде ситуаций риск осложнений может превышать пользу метода мониторинга [20].
В связи с этим были разработаны альтернативные, минимально инвазивные методы гемодинамического мониторинга, позволяющие непрерывно измерять ударный объём88 с последующим вычислением сердечного выброса. Кроме того, стало возможным измерение динамических показателей преднагрузки, которые используются в качестве ориентира при принятии решения о необходимости инфузионной нагрузки в алгоритмах целенаправленной терапии в периоперационном периоде99. В частности, в клиническую практику был введён новый метод мониторинга сердечного выброса ProAQT (Professional Arterial Flow Trending), основанный на анализе формы пульсовой волны без предварительной внешней калибровки термодилюцией. С помощью данной технологии можно определить не только сердечный индекс, но и ударный объём, индекс системного сосудистого сопротивления, вариабельность ударного объёма и пульсового давления. Авторы продемонстрировали, что при аортокоронарном шунтировании на работающем сердце сердечный индекс, определяемый по форме пульсовой волны, коррелирует со значениями сердечного индекса, измеряемого с помощью транспульмональной термодилюции (rho = 0.836, p < 0.001), с небольшой средней разницей (–0.14 л/мин/м2) и приемлемым процентом ошибки (31%) [21]. При этом применение алгоритма целенаправленной оптимизации гемодинамики, основанного на анализе формы пульсовой волны, при обширных абдоминальных вмешательствах снижает общую частоту осложнений на 27%, а частоту инфекционных осложнений вдвое [22].
Большое внимание уделялось изучению различных динамических показателей и тестов, необходимых для выявления пациентов, чувствительных к инфузионной терапии. В настоящее время, согласно рекомендациям рабочей группы экспертов Европейского общества интенсивной терапии, для оценки чувствительности к инфузионной нагрузке у пациентов с шоком было предложено использовать динамический (или функциональный) подход к гемодинамическому мониторингу. Он позволяет выявить группы пациентов, реагирующих (респондеры) и не реагирующих (нереспондеры) на инфузионную терапию [23, 24]. Большинство авторов считает, что пациенты находятся в группе респондеров, если после пробной инфузии или на фоне функциональной пробы происходит повышение сердечного выброса или ударного объёма на величину ≥10–15% от исходных значений [25].
Для оценки кардиореспираторных взаимодействий в клинической практике могут применяться такие показатели как вариабельность систолического давления, ударного объёма, пульсового давления, индекс динамической артериальной эластичности, индекс растяжимости нижней полой или ярёмной вен, индекс коллабирования верхней полой вены, окклюзионный тест в конце выдоха, тесты с повышением положительного давления в конце выдоха и дыхательного объёма [26]. При этом существуют как необратимые тесты со стандартной или минимальной инфузионной нагрузкой, так и обратимые – тест с пассивным подъёмом ног пациента или вре́менным повышением положительного давления в конце выдоха [25–27]. Тем не менее эти тесты требуют валидации у различных категорий больных.
Тесты с пассивным подъёмом ног пациента и повышением положительного давления в конце выдоха при искусственной вентиляции лёгких на фоне септического шока позволяют прогнозировать последующее увеличение сердечного выброса на инфузионную нагрузку, что даёт возможность идентифицировать группу больных, восприимчивых к инфузионной терапии [28]. При исследовании динамических тестов у пациентов кардиохирургического профиля в раннем послеоперационном периоде было доказано, что снижение среднего артериального давления в ходе теста с положительным давлением в конце выдоха более чем на 5 мм рт. ст. помогает выявить чувствительных к инфузионной нагрузке пациентов (AUC 0.73, p = 0.03). В ходе теста с минимальной инфузионной нагрузкой в качестве ориентира восприимчивости к инфузии можно использовать снижение вариабельности ударного объёма и пульсового давления более чем на 2% (AUC 0.75 и 0.77, р < 0.05). При стандартном тесте с инфузионной нагрузкой выявить чувствительность к инфузионной терапии позволяли изолированная оценка вариабельности ударного объёма (AUC 0.77), пульсового давления (AUC 0.84) и применение неинвазивного показателя сердечно-лёгочных взаимодействий (AUC 0.77, р < 0.05) [29].
На следующем этапе рассматривалось влияние различных вариантов манёвра рекрутмента альвеол на длительность послеоперационной искусственной вентиляции лёгких у пациентов после реваскуляризации миокарда на работающем сердце. Проведение манёвра после аортокоронарного шунтирования на работающем сердце сопровождается улучшением показателей оксигенации и механики дыхания. Более того, оптимизация функции дыхания путём использования варианта рекрутмента альвеол с подъёмом положительного давления в конце выдоха до 15 см вод. ст. на протяжении 5 мин позволяет уменьшить длительность послеоперационной искусственной вентиляции лёгких на 34% [30, 31].
Следует отметить протоколизированный подход к прекращению респираторной поддержки. Процесс прекращения респираторной поддержки после оперативных вмешательств может занимать длительное время и требует повышенного внимания со стороны медицинского персонала. В настоящее время существует ряд стратегий по сокращению длительности респираторной поддержки и самого процесса отлучения от искусственной вентиляции лёгких. Одно из таких направлений – использование протоколов отлучения от искусственной вентиляции лёгких. Однако разработка протокола – весьма трудоёмкий процесс. Кроме того, могут возникать трудности с внедрением и воспроизведением протокола в конкретном учреждении, а также с его соблюдением всеми сотрудниками отделения [32]. Для решения этих проблем в практику всё активнее внедряются компьютеризированные протоколы, позволяющие облегчить процесс прекращения респираторной поддержки как у взрослых, так и у детей [33]. Аналогом подобных компьютеризированных протоколов выступают автоматизированные режимы отлучения от искусственной вентиляции лёгких.
В рамках проведённых исследований доказано, что применение протокол-ориентированных алгоритмов отлучения от вентиляции в послеоперационном периоде позволяет сократить её продолжительность в сравнении с подходом прекращения респираторной поддержки, основанным на опыте врача-реаниматолога. Использование методики автоматизированного отлучения от искусственной вентиляции лёгких у пациентов после коронарного шунтирования на работающем сердце повышает безопасность вентиляции, значительно снижает нагрузку на медицинский персонал и не увеличивает длительность респираторной поддержки в послеоперационном периоде [34].
Автоматизированное отлучение стало возможным благодаря режиму искусственной вентиляции лёгких, в основе которого лежит принцип минимальной работы дыхания Отиса. Режим позволяет обеспечить необходимую минутную вентиляцию лёгких с учётом установленного целевого значения углексилого газа в выдыхаемом воздухе, а также подобрать необходимый уровень положительного давления в конце выдоха и фракцию вдыхаемого кислорода на основе целевого уровня насыщения кислородом артериальной крови. В ходе искусственной вентиляции лёгких выполняется непрерывная автоматическая коррекция параметров вентиляции от вдоха к вдоху для поддержания оптимального респираторного паттерна. Кроме того, режим обладает функцией быстрого отлучения, представляющей, по сути, готовый протокол прекращения респираторной поддержки. Авторы впервые в России доказали эффективность и безопасность этого режима, а также одними из первых в мире продемонстрировали возможность его применения у пациентов кардиохирургического профиля.
В ходе изучения различных лабораторных показателей установлено, что при хирургической коррекции комплексной патологии клапанов сердца повышение вено-артериального градиента по парциальному давлению углекислого газа более 6 мм рт. ст. взаимосвязано с изменениями венозной сатурации и указывает на тканевую гипоперфузию, что требует комплексной оценки метаболизма и транспорта кислорода и своевременной коррекции выявленных нарушений [35]. При оценке ещё одного лабораторного метода – внутрисосудистого микродиализа – выявлено, что данная инновационная технология позволяет с приемлемой точностью непрерывно мониторировать концентрацию лактата и глюкозы в центральной вене при комплексных кардиохирургических вмешательствах высокого риска и своевременно диагностировать изменения этих показателей в периоперационном периоде [36].
Большое внимание уделено системе эндотелиального гликокаликса, представляющего собой важную часть сосудистого барьера. Гликокаликс – гелеобразная структура, расположенная между потоком крови и эндотелиальными клетками сосудистой стенки. Сепсис и септический шок ассоциируются с тяжёлым повреждением эндотелиальной системы и деградацией эндотелиального гликокаликса, что приводит к нарушениям регуляции гомеостаза и проницаемости сосудистой стенки, вызывая повреждение микроциркуляторного русла. При сепсисе повреждённый слой эндотелиального гликокаликса истончается, что влечёт за собой выход белков (альбумина) и жидкости через сосудистую стенку в интерстициальное пространство. В дальнейшем это приводит к снижению объёма циркулирующей крови (гиповолемия), уменьшению концентрации альбумина и ряда других белков в плазме крови (гипоальбуминемия) и отёку тканей. Повреждение эндотелиального гликокаликса при септическом шоке, искусственном кровообращении и в других критических состояниях вызывает капиллярную утечку и взаимосвязано с целым рядом гемодинамических и метаболических нарушений. Известно, что агрессивная инфузионная терапия может усиливать деградацию гликокаликса. При этом некоторые маркеры деградации гликокаликса, такие как концентрация в плазме крови синдекана-1 или гепарансульфата, могут использоваться в качестве индикаторов эндотелиальной дисфункции и определять текущую тактику инфузионной терапии, особенно при сепсисе и септическом шоке [37].
Представленные результаты многочисленных клинических исследований легли в основу персонифицированного подхода к мониторингу и терапии критических состояний, который нашёл отражение в современных рекомендациях и руководствах [2, 38–43]. Как нам представляется, в качестве основных задач здесь следует определить дальнейшее усовершенствование диагностических инструментов и терапевтических подходов, обучение врачей-анестезиологов-реаниматологов инновационным стратегиям, а также целенаправленное внедрение последних в рутинную клиническую практику. В настоящее время имеющиеся данные указывают на необходимость подбора темпа и объёма волемической терапии, а также типа инотропной и вазопрессорной поддержки с учётом преморбидного фона1010 и исходной тяжести состояния пациента. Более того, следует учитывать фазу течения критического состояния, а также индивидуальные клинико-лабораторные характеристики пациента, в том числе показатели волюметрического мониторинга, динамические тесты и современные маркеры органной дисфункции и тканевой гипоперфузии.
Таким образом, персонифицированный подход к ведению критических состояний и периоперационного периода изменяет диагностическую и лечебную тактику, позволяет достоверно улучшить клинические исходы, сокращая время искусственной вентиляции лёгких, госпитализации в отделении интенсивной терапии и стационаре, количество осложнений и летальных исходов, и является одним из перспективных направлений современной медицины.
Список литературы
Evans L., Rhodes A., Alhazzani W. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021 // Intensive Care Med. 2021. V. 47 (11). P. 1181–1247.
Ерёменко А.А. Особенности интенсивной терапии в кардиохирургии. Интенсивная терапия (национальное руководство). Т. 1 / Под ред. И.Б. Заболотских, Д.Н. Проценко. М.: ГЭОТАР-Медиа, 2020. С. 1113–1130.
Bellani G., Laffey J.G., Pham T. et al. Epidemiology, Patterns of Care, and Mortality for Patients with Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries // JAMA. 2016. V. 315 (8). P. 788–800.
Багненко С.Ф., Ермолов А.С., Стожаров В.В. и др. Основные принципы диагностики и лечения тяжёлой сочетанной травмы // Скорая медицинская помощь. 2008. № 3. С. 3–10.
Cinel I., Kasapoglu U.S., Gul F. et al. The initial resuscitation of septic shock // J. Crit. Care. 2020. V. 57. P. 108–117.
Malbrain M.L., Marik P.E., Witters I. et al. Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice // Anaesthesiol. Intensive Ther. 2014. V. 46 (5). P. 361–380.
Marik P.E., Monnet X., Teboul J.L. Hemodynamic parameters to guide fluid therapy // Ann. Intensive Care. 2011. V. 1 (1). P. 1–9.
Кузьков В.В., Суборов Е.В., Куклин В.Н. и др. Динамика внесосудистой воды лёгких после пневмонэктомии по данным транспульмональной термодилюции // Общая реаниматология. 2006. № 4. С. 34–41.
Суборов Е.В., Кузьков В.В., Смёткин А.А. и др. Гемодинамика у больных с септическим шоком и острым повреждением лёгких // Анестезиология и реаниматология. 2006. № 6. С. 15–20.
Gavelli F., Shi R., Teboul J.L. et al. Extravascular lung water levels are associated with mortality: a systematic review and meta-analysis // Crit. Care. 2022. V. 26 (1). Article number 202. P. 1–11.
Lenkin A.I., Kirov M.Y., Kuzkov V.V. et al. Comparison of goal-directed hemodynamic optimization using pulmonary artery catheter and transpulmonary thermodilution in combined valve repair: a randomized clinical trial // Crit. Care Res. Pract. 2012. № 2012.
Malbrain M.L., Roberts D.J., Surgue M. et al. The polycompartment syndrome: a concise state-of-the-art review // Anaesthesiol. Intensive Ther. 2014. V. 46 (5). P. 433–450.
Кузьков В.В., Киров М.Ю. Инвазивный мониторинг гемодинамики в интенсивной терапии и анестезиологии. Архангельск: СГМУ, 2015.
Хромачёва Н.О., Фот Е.В., Кузьков В.В. и др. Целенаправленная дегидратационная терапия при сепсисе и остром респираторном дистресс-синдроме под контролем волюметрического мониторинга гемодинамики // Вестник анестезиологии и реаниматологии. 2019. № 16. С. 6–15.
Низовцев Н.В., Кузьков В.В., Плотникова Е.В. и др. Целенаправленная непрерывная веновенозная гемофильтрация при системном воспалительном ответе и остром повреждении почек // Вестник анестезиологии и реаниматологии. 2012. № 1. С. 40–47.
Кузьков В.В., Смёткин А.А., Суборов Е.В. и др. Внесосудистая вода лёгких и рекрутмент альвеол у пациентов с острым респираторным дистресс-синдромом // Вестник анестезиологии и реаниматологии. 2012. № 2. С. 15–21.
Smetkin A.A., Kuzkov V.V., Suborov E.V. et al. Increased extravascular lung water reduces the efficacy of alveolar recruitment maneuver in acute respiratory distress syndrome // Critical Care Research and Practice. 2012. № 2012.
Vincent J.L., Rhodes A., Perel A. et al. Clinical review: Update on hemodynamic monitoring – a consensus of 16 // Crit. Care. 2011. V. 15 (4). P. 229.
Alhashemi J.A., Cecconi M., della Rocca G. et al. Minimally invasive monitoring of cardiac output in the cardiac surgery intensive care unit // Curr. Heart Fail. Rep. 2010. V. 7 (3). P. 116–124.
Stewart R.M., Park P.K., Hunt J.P. et al. Less is more: improved outcomes in surgical patients with conservative fluid administration and central venous catheter monitoring // J. Am. Coll. Surg. 2009. V. 208 (5). P. 725–735.
Smetkin A., Hussain A., Kuzkov V. et al. Validation of cardiac output monitoring based on uncalibrated pulse contour analysis vs transpulmonary thermodilution during off-pump coronary artery bypass grafting // Br. J. Anaesth. 2014. V. 112 (6). P. 1024–1031.
Salzwedel C., Puig J., Carstens A. et al. Perioperative goal-directed hemodynamic therapy based on radial arterial pulse pressure variation and continuous cardiac index trending reduces postoperative complications after major abdominal surgery: a multi-center, prospective, randomized study // Critical Care. 2013. № 5. R191.
Cavallaro F., Sandroni C., Antonelli M. Functional hemodynamic monitoring and dynamic indices of fluid responsiveness // Minerva Anesthesiol. 2008. V. 74. P. 123–135.
Monnet X., Teboul J.-L. Assessment of volume responsiveness during mechanical ventilation: recent advances // Crit. Care. 2013. V. 17 (2). P. 217.
Donati A., Carsetti A., Damiani E. et al. Fluid responsiveness in critically ill patients // Indian J. Crit. Care Med. 2015. V. 19. P. 375–376.
Rhodes A., Laura E., Evans L.E. et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016 // Intensive Care Med. 2017. V. 43 (3). P. 304–377.
Carsetti A., Cecconi M., Rhodes A. Fluid bolus therapy: monitoring and predicting fluid responsiveness // Curr. Opin. Crit. Care. 2015. V. 21 (5). P. 388–394.
Ильина Я.Ю., Кузьков В.В., Фот Е.В. и др. Прогнозирование ответа на инфузионную нагрузку: современные подходы и перспективы // Вестник анестезиологии и реаниматологии. 2017. Т. 14 (3). С. 25–34.
Fot E.V., Izotova N.N., Smetkin A.A. et al. Invasive and Non-invasive Dynamic Parameters to Predict Fluid Responsiveness After Off-pump Coronary Surgery // Turk. J. Anaesthesiol. Reanim. 2022. V. 50 (1). P. 59–64.
Fot E.V., Kuzkov V.V., Gaidukov K.M. et al. Efficacy and safety of three alveolar recruitment maneuvers after off-pump coronary artery bypass grafting // Jacobs Journal of Anesthesiology and Research. 2014. V. 1 (1). P. 005.
Фот Е.В., Кузьков В.В., Гайдуков К.М. и др. Эффективность и безопасность различных вариантов манёвра рекрутмента альвеол после аортокоронарного шунтирования на работающем сердце // Клиническая анестезиология и интенсивная терапия 2016. Т. 1 (7). С. 4–16.
Ely E.W., Bennett P.A., Bowton D.L. et al. Large scale implementation of a respiratory therapist-driven protocol for ventilator weaning // Am. J. Respir. Crit. Care Med. 1999. V. 159. P. 439–446.
Burns K.E., Lellouche F., Nisenbaum R. et al. Automa-ted weaning and SBT systems versus non-automated weaning strategies for weaning time in invasively ventilated critically ill adults // Cochrane Database Syst. Rev. 2014. V. 9. CD008638.
Fot E.V., Izotova N.N., Yudina A.S. et al. Automated Weaning from Mechanical Ventilation after Off-Pump Coronary Artery Bypass Grafting // Front Med. (Lausanne). 2017. V. 4. Article 00031.
Гайдуков К.М., Лёнькин А.И., Кузьков В.В. и др. Насыщение кислородом гемоглобина центральной венозной крови и венозно-артериальный градиент PCO2 после комбинированных операций на клапанах сердца // Анестезиология и реаниматология. 2011. № 3. С. 19–21.
Lenkin P.I., Smetkin A.A., Hussain A. et al. Continuous monitoring of lactate using intravascular microdialysis in high-risk cardiac surgery: a prospective observational study // J. Cardiothorac. Vasc. Anesth. 2017. V. 31. P. 37–44.
Ilyina Y., Fot E., Kuzkov V. et al. The Glycocalyx Shedding Influences Hemodynamic and Metabolic Response to Fluid Load in Septic Shock // Turk. J. Anaesthesiol. Reanim. 2022. V. 50 (2). P. 94–100.
Киров М.Ю., Кузьков В.В. Интенсивная терапия сепсиса и септического шока. Интенсивная терапия (национальное руководство). Т. 2 / Под ред. И.Б. Заболотских, Д.Н. Проценко. М.: ГЭОТАР-Медиа, 2020. С. 393–408.
Заболотских И.Б., Киров М.Ю., Лебединский К.М. и др. Анестезиолого-реанимационное обеспечение пациентов с новой коронавирусной инфекцией COVID-19. Методические рекомендации Общероссийской общественной организации “Федерация анестезиологов и реаниматологов” // Вестник интенсивной терапии им. А.И. Салтанова. 2021. S2. С. 9–145.
Ярошецкий А.И., Власенко А.В., Грицан А.И. и др. Применение неинвазивной вентиляции лёгких (второй пересмотр). Клинические рекомендации Общероссийской общественной организации “Федерация анестезиологов и реаниматологов” // Анестезиология и реаниматология. 2019. № 6. С. 5–19.
Ярошецкий А.И., Грицан А.И., Авдеев С.Н. и др. Диагностика и интенсивная терапия острого респираторного дистресс-синдрома. Клинические рекомендации Общероссийской общественной организации “Федерация анестезиологов и реаниматологов” // Анестезиология и реаниматология. 2020. № 2. С. 5–39.
Авдеев С.Н., Адамян Л.В., Алексеева Е.И. и др. Временные методические рекомендации Министерства здравоохранения РФ “Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)”. Версия 11 от 07.05.2021 г.
Advanced Hemodynamic Monitoring: Basics and New Horizons / Ed. by M. Kirov, V. Kuzkov, B. Saugel. Springer, Cham, 2021.
Дополнительные материалы отсутствуют.


