Высокомолекулярные соединения (серия А), 2019, T. 61, № 2, стр. 180-192
Полимероподобные червеобразные мицеллы ионогенных поверхностно-активных веществ: Структура и реологические свойства
А. Л. Квятковский a, *, В. С. Молчанов a, О. Е. Филиппова a
a Московский государственный университет имени М.В. Ломоносова. Физический факультет
119991 Москва, Ленинские горы, Россия
* E-mail: kvyatkovskij@physics.msu.ru
Поступила в редакцию 03.10.2018
После доработки 30.10.2018
Принята к публикации 05.11.2018
Аннотация
В настоящем обзоре изложены современные представления о червеобразных мицеллах поверхностно-активных веществ как полимероподобных объектах, обратимо разрывающихся и рекомбинирующих в растворе. Описаны вязкоупругие свойства полуразбавленных растворов червеобразных мицелл поверхностно-активных веществ и способы их анализа, в том числе в случае образования разветвленных мицелл. Представлены основные закономерности эволюции структуры червеобразных мицелл ионогенных поверхностно-активных веществ в присутствии неорганических и органических (гидротропных) солей, при этом особое внимание уделено роли заряда ионов соли. Обсуждены перспективы практического применения и развития фундаментальных исследований полимероподобных червеобразных мицелл поверхностно-активных веществ.
ВВЕДЕНИЕ
Самоорганизация амфифильных молекул поверхностно-активных веществ в водной среде приводит к образованию агрегатов различной формы с размерами от нескольких нанометров до десятков микрон. Наиболее часто встречающиеся формы агрегатов – сферические мицеллы, цилиндрические (стержнеобразные) мицеллы, везикулы, бислои [1–7]. Среди мицеллярных агрегатов особенно следует отметить длинные цилиндрические мицеллы ПАВ – червеобразные мицеллы, по своему поведению во многом напоминающие полимеры и благодаря этому получившие название “живущие” полимеры или “равновесные полимеры” [8–12].
Как и полимерные цепи, червеобразные мицеллы могут переплетаться с образованием трехмерной сетки топологических зацеплений, что придает растворам вязкоупругие свойства: при больших временах механического воздействия (деформации) система течет как высоковязкая неньютоновская жидкость, а при малых временах воздействия раствор ведет себя как упругий гель.
В то же время в отличие от полимерных цепей в червеобразных мицеллах ПАВ молекулы связаны относительно слабыми нековалентными взаимодействиями, следовательно, длина и форма мицелл могут изменяться в ответ на изменение состава раствора или внешнее воздействие [13]. Это происходит за счет процессов разрыва и рекомбинации мицелл и обмена молекул ПАВ в мицелле со свободными молекулами ПАВ, находящимися в растворе. Интерес к растворам червеобразных мицелл вызван также восприимчивостью их вязкоупругих свойств к изменению внешних условий: концентрации соли [2–4, 14–19], температуры [20–23], добавке гидрофобных веществ [20, 24–29], полимеров [14, 30–38], наночастиц [39–43]. Благодаря этому растворы червеобразных мицелл ПАВ стали широко применять в качестве загустителей вместо растворов полимеров или вместе с ними во многих областях промышленности: нефтедобывающей, косметической, производстве красок. Помимо высокой восприимчивости ко внешним воздействиям технологическим преимуществом растворов червеобразных мицелл ПАВ является тот факт, что они полностью восстанавливают исходные вязкоупругие свойства после воздействия высоких деформаций или давлений за счет обратимости процесса самоорганизации (в отличие от необратимого разрыва ковалентных связей полимерных молекул).
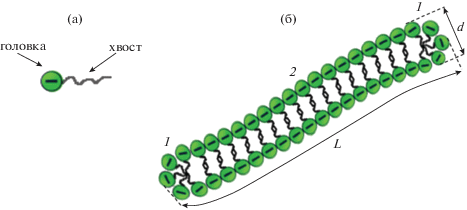
Для получения червеобразных мицелл обычно используют ионогенные ПАВ (рис. 1а) в присутствии низкомолекулярной соли [1–4, 14, 17, 44–46], причем соль играет ключевую роль как в создании мицелл, так и в определении основных реологических характеристик их растворов. На сегодняшний день в литературе насчитывается более двухсот работ, посвященных теме влияния различных солей на свойства червеобразных мицелл ионогенных ПАВ. Цель настоящего обзора – обобщение и структурирование полученных в этих работах теоретических и экспериментальных результатов.
ТЕОРЕТИЧЕСКОЕ ОПИСАНИЕ ХАРАКТЕРИСТИК ЧЕРВЕОБРАЗНЫХ МИЦЕЛЛ
Форма мицелл определяется балансом между силами гидрофобного и электростатического взаимодействия, зависящими от строения гидрофобной и гидрофильной частей молекулы ПАВ и состава растворителя. Форма мицелл может быть оценена при помощи параметра молекулярной упаковки P, введенного J.N. Israelachvili [6]:
где ν и lс – объем и длина гидрофобного хвоста молекулы ПАВ соответственно, определяющиеся ее химическим строением; а0 – эффективная площадь, приходящаяся на гидрофильную головку молекулы ПАВ в короне мицеллы и зависящая от ее взаимодействия с соседними молекулами. Так, например, для простейших агрегатов ПАВ (сферических мицелл) P находится в диапазоне от 0 до 1/3, а при увеличении P от 1/3 до 1/2 становится выгодным образование цилиндрических мицелл, которые при определенных условиях могут вырасти в полимероподобные червеобразные мицеллы.Как следует из выражения (1), для данного ПАВ переход от сферических мицелл к цилиндрическим происходит при уменьшении эффективной площади а0, приходящейся на одну гидрофильную группу на поверхности мицеллы, т.е. при увеличении плотности упаковки молекул ПАВ. Величина а0 уменьшается, например, в результате экранирования отталкивания одноименно заряженных головок ионогенного ПАВ, что приводит к росту P и образованию более плотно упакованных мицелл цилиндрической формы.
Червеобразные мицеллы ПАВ представляют собой полимероподобные агрегаты, которые условно состоят из трех частей: двух торцевых полусферических частей и центральной длинной цилиндрической части (рис. 1б). Молекулы ПАВ в центральной части мицеллы упакованы более плотно по сравнению с торцевыми полусферическими частями. Диаметр цилиндрической части d близок по величине удвоенной длине гидрофобного хвоста молекулы ПАВ и составляет обычно 4–6 нм [14, 15, 26, 28, 33, 34, 47]. Персистентная длина червеобразных мицелл lp ионогенных ПАВ в условиях слабой экранировки составляет 40–150 нм [17, 23, 48–50], но при сильном экранировании отталкивания заряженных групп на поверхности мицеллы становятся более гибкими, их персистентная длина lp обычно 15–30 нм и по порядку величины не сильно превышает их диаметр, поэтому такие червеобразные мицеллы ионогенных ПАВ могут рассматриваться как полугибкие цепи [51]. Средняя контурная длина $\bar {L}$ таких цепей может достигать несколько десятков микрометров [3, 4, 14, 16, 26, 32].
Согласно теории среднего поля, червеобразные мицеллы ПАВ обладают широким распределением по длине N(L), задаваемым соотношением [2, 44, 52, 53]
($\bar {L}$ – средняя контурная длина червеобразных мицелл).В силу того, что молекулы ПАВ в червеобразных мицеллах связаны посредством относительно слабых взаимодействий, они обратимо разрываются и рекомбинируют через характерные временные интервалы, называемые временем жизни мицелл τbr. Разрыв червеобразных мицелл является равновероятным по всей длине, поэтому время жизни τbr и средняя контурная длина мицелл $\bar {L}$ связаны следующим образом:
где k – константа разрыва, зависящая от типа ПАВ и температуры. Физический смысл k – вероятность разрыва, приходящаяся на единицу длины червеобразной мицеллы, в единицу времени.Еще один результат применения теории среднего поля к червеобразным мицеллам ПАВ – выражение для средней контурной длины мицелл $\bar {L}$ в разбавленных растворах, в которых концентрация ПАВ С меньше концентрации перекрывания мицелл С* [2, 52, 53]:
(4)
$\bar {L}\sim {{C}^{{0.5}}}\exp ({{{{E}_{{sc}}}} \mathord{\left/ {\vphantom {{{{E}_{{sc}}}} {2{{k}_{B}}T}}} \right. \kern-0em} {2{{k}_{B}}T}})$Здесь Esc – энергия разрыва мицелл, необходимая для разрыва червеобразной мицеллы с образованием двух торцевых полусферических частей, kB – постоянная Больцмана, Т – абсолютная температура.
Из выражения (4) следует, что повышение концентрации ПАВ С приводит к увеличению средней длины мицелл. Рост длины мицелл происходит за счет уменьшения количества торцевых полусферических частей и перехода молекул ПАВ из них в более плотно упакованную центральную цилиндрическую часть, что приводит к уменьшению эффективной площади a0 и росту параметра молекулярной упаковки P.
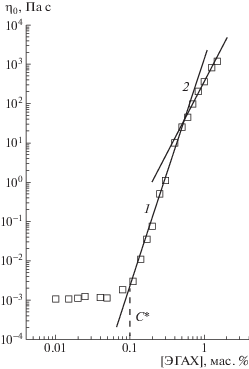
При С > C* червеобразные мицеллы ПАВ начинают переплетаться, образуя физическую сетку зацеплений [3, 14, 26, 34, 39, 54, 55], при этом раствор переходит в полуразбавленный режим. В указанной области концентраций раствор приобретает вязкоупругие свойства. Стоит отметить, что благодаря длине в несколько десятков микрон и относительно высокой персистентной длине переход к полуразбавленным растворам происходит уже при концентрациях около 0.1 мас. % или 3–5 ммоль/л (рис. 2).
Рис. 2.
Зависимость вязкости при нулевой скорости сдвига от концентрации эруцил-бис-(гидроксиэтил)метиламмоний хлорида в растворе. Наклон 5.6 (1) и 3.6 (2). Штриховая линия указывает на концентрацию С*, при которой начинается перекрывание мицелл. Растворитель 3%-ный раствор KCl. Публикуется с согласия Shashkina J.A., Philippova O.E., Zaroslov Y.D., Khokhlov A.R., Pryakhina T.A., Blagodatskikh I.V. // Langmuir. 2005. V. 21. № 4. P. 1524. © 2005 American Chemical Society.
РЕОЛОГИЧЕСКИЕ СВОЙСТВА ПОЛУРАЗБАВЛЕННЫХ РАСТВОРОВ ЧЕРВЕОБРАЗНЫХ МИЦЕЛЛ
Время жизни и время рептации мицелл
В сетке топологических зацеплений червеобразные мицеллы ПАВ переплетены между собой и двигаются за счет рептации подобно полимерным цепям в полуразбавленных растворах или расплавах. Процесс рептации заключается в проскальзывании мицеллярной цепи в эффективной трубке, образованной соседними с ней переплетенными цепями. Изображение физической сетки зацеплений в растворе ПАВ, полученное методом крио-просвечивающей электронной микроскопии (крио-ПЭМ), представлено на рис. 3. Вязкость растворов переплетенных червеобразных мицелл на несколько порядков превосходит вязкость воды [3, 5, 15, 22, 28, 46, 56–58].
Рис. 3.
Изображение сетки из переплетенных червеобразных мицелл в водном растворе 0.047 М олеата калия в присутствии 0.8 М соли хлорида калия, полученное методом крио-ПЭМ. Публикуется с согласия Kwiatkowski A.L., Sharma H., Molchanov V.S., Orekhov A.S., Vasiliev A.L., Dormidontova E.E., Philippova O.E. // Macromolecules. 2017. V. 50. № 18. P. 7299. © 2017 American Chemical Society.

Сетка зацеплений придает водным растворам червеобразных мицелл вязкоупругие свойства [3, 4, 18, 21, 30, 34, 59, 60]. Суть свойства вязкоупругости состоит в зависимости характера отклика образца от длительности приложенного напряжения. Вязкоупругие растворы ПАВ при малых временах воздействия на них демонстрируют упругий отклик, а при больших временах – вязкий отклик.
Вязкоупругие свойства растворов червеобразных мицелл ПАВ были теоретически описаны M.E. Cates [10]. Теория M.E. Cates основывается на предположении о том, что релаксация напряжения в растворе переплетенных червеобразных мицелл происходит за счет процессов рептации, как и в случае полимерных цепей, но с учетом процессов разрыва и рекомбинации, характерных для червеобразных мицелл.
Процесс рептации определяется временем рептации τrep, т.е. временем обновления трубки, в которой двигается червеобразная мицелла [61, 62]. Время рептации τrep связано со средней контурной длиной мицелл $\bar {L}$ соотношением [52]:
Процесс обратимого разрыва и рекомбинации мицелл характеризуется их временем жизни τbr, которое, согласно формуле (3), обратно пропорционально средней длине мицелл $\bar {L}$.
M.E. Cates с соавторами [52, 53, 63, 64] было показано, что в зависимости от соотношения между временами жизни τbr и рептации τrep цепи червеобразных мицелл могут находиться в одном из двух режимов релаксации напряжения. Первый режим – режим “неразрывных” мицеллярных цепей (режим 1 на рис. 2). В нем время жизни τbr значительно превосходит время рептации: τbr ≫ τrep, т.е. процесс рептации протекает значительно быстрее процесса разрыва–рекомбинации, поэтому мицеллы можно считать “неразрывными” (за время рептации). Таким образом, в данном режиме червеобразные мицеллы движутся в сетке зацеплений, как полимерные цепи. Поскольку релаксация приложенного напряжения в таких условиях происходит только за счет рептации, время релаксации τR системы “неразрывных” цепей равно времени рептации τrep. Ввиду широкого распределения червеобразных мицелл по длине [2, 52, 53], из формулы (5) следует, что в системе “неразрывных” цепей наблюдается спектр времен релаксации. Экспериментально режим “неразрывных” червеобразных мицелл был обнаружен в растворах катионного [30] и анионного ПАВ [46] в присутствии простых неорганических солей. Показано, что в обоих случаях режим реализуется в сетке относительно коротких мицелл при концентрациях, ненамного превышающих концентрацию перехода в полуразбавленный режим. Для этого режима теоретически предсказана степенная зависимость вязкости от концентрации ПАВ с показателем степени 5.25 (область 1 на рис. 2).
Второй режим – режим “живых” цепей (режим 2 на рис. 2). В этом режиме время жизни червеобразных мицелл, наоборот, намного меньше времени рептации: τbr ≪ τrep. В результате за время рептации мицеллы многократно разрываются и рекомбинируют, что приводит к усреднению времен и появлению в системе “живых” цепей одного времени релаксации τR, равного среднему геометрическому времени жизни τbr и времени рептации τrep:
Согласно теоретическим предсказаниям M.E. Cates, для этого режима характерна степенная зависимость вязкости от концентрации ПАВ с показателем степени, близким к 3.5 (область 2 на рис. 2). Именно режим “живых” цепей экспериментально встречается чаще всего. Как следует из формул (3) и (5), режим “живых” цепей реализуется для длинных мицелл. Он обычно наблюдается при концентрациях ПАВ, в несколько раз превышающих С* [8–12].
Связь вязкоупругих свойств и длины червеобразных мицелл
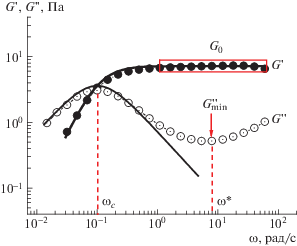
Замечательным свойством червеобразных мицелл ПАВ является то, что вязкоупругие свойства растворов “живых” цепей хорошо описываются простой моделью Максвелла вязкоупругой жидкости с одним временем релаксации τR [3–5, 30, 65–68]. Использование этой модели позволяет связать время воздействия на образец с величинами, характеризующими отклик среды [69]. Зависимости модуля накоплений G ', отвечающего за упругий отклик, и модуля потерь G '', характеризующего вязкий отклик, от частоты приложенного напряжения ω для модели Максвелла имеют следующий вид:
(7)
$G'(\omega ) = \frac{{{{G}_{0}}{{{(\omega {{\tau }_{R}})}}^{2}}}}{{1 + {{{(\omega {{\tau }_{R}})}}^{2}}}},$Рис. 4.
Частотные зависимости модуля накоплений G ' и модуля потерь G '' раствора олеата калия концентрации 0.047 М. Растворитель 0.8 М водный раствор KCl, pH 11. Прямоугольником выделена область, отвечающая значению модуля накоплений на плато G0; стрелкой указана точка, соответствующая минимуму кривой G ''(ω); пунктирными линиями отмечена частота ωс в точке пересечения кривых G '(ω) и G ''(ω) и частота ω*, соответствующая минимуму модуля потерь $G_{{\min }}^{{''}}$; сплошные линии показывают аппроксимацию зависимостей моделью Максвелла. Публикуется с согласия Kwiatkowski A.L., Sharma H., Molchanov V.S., Orekhov A.S., Vasiliev A.L., Dormidontova E.E., Philippova O.E. // Macromolecules. 2017. V. 50. № 18. P. 7299. © 2017 American Chemical Society.
Подобное отклонение более наглядно видно на диаграмме Коула–Коула, представляющей собой зависимость величины модуля потерь G '' от величины модуля накоплений G ', нормированной на величину максимума модуля потерь $G_{{\max }}^{{''}}$ [15, 26, 28, 30, 46, 67, 70–72]. Как следует из выражений (7) и (8), диаграмма Коула–Коула идеальной максвелловской системы имеет вид полуокружности единичного радиуса (рис. 5а).
Рис. 5.
Рассчитанные диаграммы Коула–Коула для вязкоупругой жидкости, описываемой моделью Максвелла (а) и для вязкоупругих растворов червеобразных мицелл ПАВ с разным соотношением ζ времен жизни τbr и рептации τrep (ζ = 0.01, 0.1 и 1.0) (б). Публикуется с согласия Fischer P., Rehage H. // Langmuir. 1997. V. 13. № 26. P. 7012. © 1997 American Chemical Society.
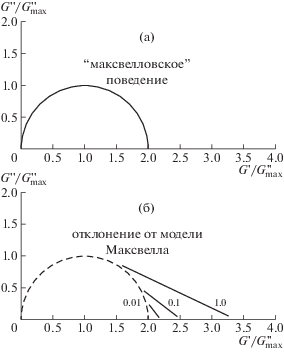
Моделью Максвелла описываются вязкоупругие растворы “живых” червеобразных мицелл, для которых отношение τbr и τrep ζ = τbr/τrep ≪ 1. При увеличении отношения ζ наблюдается отклонение диаграмм Коула–Коула от идеальной максвелловской полуокружности (рис. 5б). Согласно выражениям (3) и (5), соотношение ζ ≪ 1 выполняется для длинных червеобразных мицелл. Чем больше средняя контурная длина червеобразных мицелл $\bar {L}$, тем ближе к идеальной максвелловской полуокружности лежит диаграмма Коула–Коула. Поэтому диаграммы Коула–Коула в литературе часто используются для анализа изменения контурной длины мицелл в различных системах [15, 25, 26, 32, 73].
На рис. 4 на частотной зависимости модуля потерь G ''(ω) в области высоких частот наблюдается минимум $G_{{\min }}^{{''}}$. Частота напряжения сдвига ω*, соответствующая минимуму $G_{{\min }}^{{''}}$, зависит от времени жизни червеобразных мицелл τbr как [74]
(9)
${{\tau }_{{br}}} \propto {1 \mathord{\left/ {\vphantom {1 {\omega {\text{*}}}}} \right. \kern-0em} {\omega {\text{*}}}}$R. Granek и M.E. Cates [9] было показано, что величина минимума модуля потерь $G_{{\min }}^{{''}}$ также связана с контурной длиной участка мицеллы между зацеплениями в сетке le соотношением
где G0 – величина модуля накоплений на плато, $\bar {L}$– средняя контурная длина мицелл. Величина модуля накоплений на плато G0 зависит от контурной длины участка мицеллы между зацеплениями le и персистентной длины мицеллы lp [3, 17, 26, 33]:(11)
${{G}_{0}} \approx \frac{{{{k}_{B}}T}}{{{{{(l_{e}^{{{3 \mathord{\left/ {\vphantom {3 5}} \right. \kern-0em} 5}}}l_{p}^{{{2 \mathord{\left/ {\vphantom {2 5}} \right. \kern-0em} 5}}})}}^{3}}}}$Следовательно, зная величины G0 и $G_{{\min }}^{{''}}$, можно вычислить среднюю контурную длину червеобразных мицелл $\bar {L}$. Описанный метод оценки контурной длины мицелл широко применяется в литературе [15, 20, 26, 32, 70]. Из реологических данных, используя выражения (3) и (9)–(11), также может быть получено значение константы разрыва мицелл k.
Настоящий обзор посвящен описанию линейных вязкоупругих свойств растворов червеобразных мицелл ПАВ. Вместе с этим существует большое количество нелинейных эффектов, таких как образование неустойчивости в системе при приложении сдвигового напряжения и образование полос сдвига. Тема нелинейных эффектов широко рассмотрена в обзорах J.-F. Berret [75, 76].
ВЛИЯНИЕ СОЛЕЙ НА СТРУКТУРУ ЧЕРВЕОБРАЗНЫХ МИЦЕЛЛ ПАВ
Одним из наиболее распространенных способов получения длинных червеобразных мицелл ионогенного ПАВ является добавление соли в водный раствор ПАВ [2, 7, 15, 17, 18, 20, 23, 34, 36, 55, 60, 61, 77, 78]. При диссоциации молекул соли в воде образуется два типа ионов: противоионы – ионы, противоположно заряженные по отношению к заряду головок ПАВ, и ко-ионы – ионы, одноименно заряженные с головками ПАВ. Противоионы и ко-ионы соли по-разному влияют на червеобразные мицеллы. Противоионы частично экранируют отталкивание заряженных головок ПАВ в короне мицелл. Ко-ионы, наоборот, могут повышать заряд мицелл.
Влияние ионов соли, противоположно заряженных по отношению к ионам ПАВ
M.E. Cates было показано, средняя контурная длина мицелл $\bar {L}$ в полуразбавленных растворах ионогенного ПАВ в присутствии соли задается выражением [77, 79]
(12)
$\bar {L}\sim {{C}^{{0,6}}}\exp ({{{{E}_{{sc}}}} \mathord{\left/ {\vphantom {{{{E}_{{sc}}}} {2{{k}_{B}}T}}} \right. \kern-0em} {2{{k}_{B}}T}}),$Рост экранирования отталкивания головок ПАВ приводит к увеличению средней контурной длины мицелл $\bar {L}$ и, следовательно, к резкому росту вязкости системы (рис. 6а). При некоторой контурной длине мицеллы начинают переплетаться, образуя физическую сетку зацеплений, растворы червеобразных мицелл переходят в полуразбавленный режим. При этом в системе наблюдается рост модуля накоплений на плато G0 и времени релаксации τR (рис. 6б) [15, 17, 78]. Диаграмма Коула–Коула системы с ростом $\bar {L}$ приближается к идеальной максвелловской полуокружности [12, 15, 19, 45, 67].
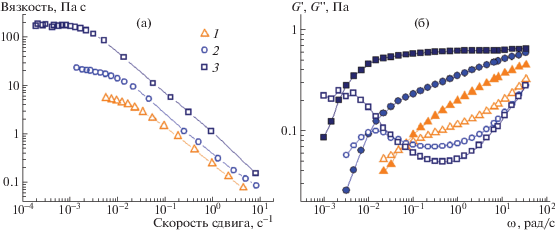
Рис. 6.
Кривые течения (а) и частотные зависимости модуля накоплений G ' (темные точки) и модуля потерь G '' (светлые точки) (б) 0.6%-ных растворов ПАВ эруцил-бис-(гидроксиэтил)метиламмоний хлорида для добавленной соли СаCl2 концентрации 0.05 (1), 0.08 (2) и 0.10 моль/л (3). Публикуется с согласия Kwiatkowski A.L., Molchanov V.S., Orekhov A.S., Vasiliev A.L., Philippova O.E. // J. Phys. Chem. B. 2016. V. 120. № 49. P. 12547. © 2016 American Chemical Society.
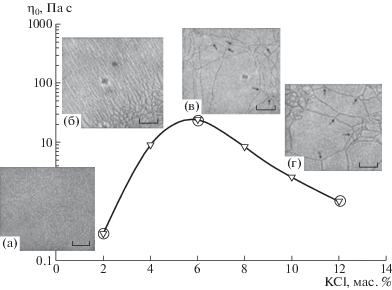
Вязкость растворов червеобразных мицелл в зависимости от концентрации соли проходит через максимум (рис. 7). В максимуме вязкости линейные червеобразные мицеллы имеют наибольшую длину (рис. 7б). Наблюдаемое после достижения максимума уменьшение η0 сопровождается уменьшением времени релаксации τR [17, 78], а величина модуля накоплений на плато G0 [17, 67, 73, 78] практически не меняется. Такое поведение реологических характеристик системы объясняется переходом линейных червеобразных мицелл в разветвленные (рис. 7в, 7г) [3, 14, 34, 44, 67].
Рис. 7.
Зависимость вязкости η0 1.5%-ных растворов эруцил-бис-(гидроксиэтил)метиламмоний хлорида от концентрации добавленной соли KCl при 40°С. Изображения крио-ПЭМ показывают последовательный переход сферических мицелл (а) в сетку линейных червеобразных мицелл (б), а затем в сетку разветвленных червеобразных мицелл (в, г). Публикуется с согласия Dreiss C.A. // Soft Matter. 2007. V. 3. № 8. P. 956. © 2007 Royal Society of Chemistry.
Предположение об образовании разветвленных мицелл впервые было высказано G. Porte в 1986 г. [80]. Затем F. Lequeux в 1992 г. предложил механизм релаксации разветвленных мицелл, приводящий к уменьшению вязкости системы [81]. Согласно F. Lequeux, релаксация механических напряжений в растворе разветвленных червеобразных мицелл происходит за счет скольжения точек ветвления вдоль основной цепи [3, 4, 81, 82]. Этот процесс требует значительно меньших затрат энергии, чем процесс рептации линейных мицелл. Все приведенные в разделе “Реологические свойства полуразбавленных растворов червеобразных мицелл” выражения для линейных мицелл могут быть также использованы и для разветвленных, однако в случае разветвленных мицелл средняя контурная длина $\bar {L}$ в них должна быть заменена на Lc – контурную длину фантомной линейной мицеллы, имеющей такой же коэффициент диффузии, как ставящаяся ей в соответствие разветвленная мицелла [81]. Величина Lc вычисляется по следующей формуле [67, 70, 83]:
где lp – персистентная длина мицеллы, n1 – количество торцевых полусферических частей, n2 – количество линейных участков, n3 – количество тройных точек ветвления. Важно отметить, что при замене $\bar {L}$ на Lc в выражении (3) величины τbr и k не имеют физического смысла, так как являются временем жизни и вероятностью разрыва фантомной мицеллы [67].Разветвленные червеобразные мицеллы формируются из линейных при высоком содержании соли в системе, обеспечивающем сильное экранирование отталкивания одноименно заряженных головок ПАВ противоионами. При этом головки ПАВ могут ближе подойти друг к другу, образуя тройную точку ветвления. Образование точек ветвления термодинамически выгодно, поскольку приводит к уменьшению количества неплотно упакованных торцевых частей. С увеличением количества точек ветвления длина линейных сегментов разветвленных мицелл уменьшается. Средняя контурная длина $\bar {L}$ (Lc для разветвленных мицелл) падает при переходе от линейных мицелл к разветвленным [15].
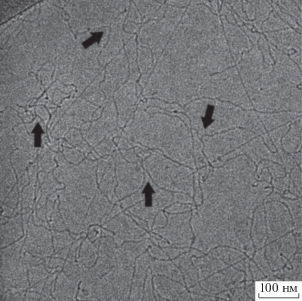
Развитие метода крио-ПЭМ позволило получить прямое экспериментальное доказательство существования разветвленных мицелл. Первые крио-ПЭМ изображения разветвленных мицелл были получены D. Danino с соавторами в 1995 г. [84]. Крио-ПЭМ изображения разветвленных червеобразных мицелл ионогенного ПАВ представлены на рис. 8.
Рис. 8.
Изображение сетки из переплетенных червеобразных мицелл в водном растворе эруцил-бис-(гидроксиэтил)метиламмоний хлорида в присутствии 0.2 М соли KCl, полученное методом крио-ПЭМ. Стрелками отмечены точки ветвления разветвленных мицелл. Публикуется с согласия Kwiatkowski A.L., Molchanov V.S., Orekhov A.S., Vasiliev A.L., Philippova O.E. // J. Phys. Chem. B. 2016. V. 120. № 49. P. 12547. © 2017 American Chemical Society.
То, насколько эффективно противоионы инициируют увеличение длины линейных мицелл и переход линейных мицелл в разветвленные, определяется типом соли. Наиболее эффективными являются органические (гидротропные) соли, такие как салицилат натрия [16, 71, 85, 86], 3-гидрокси-нафталин-2-карбоксилат [87], п-толуолсульфонат натрия [88] и т.д. в случае катионных ПАВ и п-толуидин гидрохлорид [89], бензилметиламмоний бромид [90, 91], хлорид холина [92] и т.д. для анионных ПАВ. Ионы указанных солей имеют амфифильное строение, напоминающее строение ионов ПАВ. Однако гидрофобные группы ионов гидротропных солей довольно малы и поэтому не могут самостоятельно образовывать мицеллы [93], но могут встраиваться между заряженными головками существующих мицелл ПАВ [86, 94, 95]:
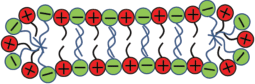
Встраивание ионов гидротропных солей между противоположно заряженными головками ПАВ в мицеллах значительно понижает эффективный заряд поверхности мицелл, тем самым инициируя их рост при значительно меньших концентрациях соли по сравнению с непроникающими неорганическими солями (например, NaCl, KCl), которые экранируют отталкивание головок ПАВ лишь на расстоянии [18]. На сегодняшний день в литературе существует большое количество работ посвященных исследованию влияния непроникающих солей на червеобразные мицеллы ПАВ [1–4, 14, 17, 44–46].
Тип непроникающей соли может также значительно влиять на степень экранировки отталкивания в червеобразных мицеллах и вязкоупругие свойства растворов ПАВ. В экспериментальной работе C. Oelschlaeger с соавторами [17] показано, что последовательное добавление в раствор катионного ПАВ цетилтриметиламмоний бромида трех неорганических солей (KBr, NaNO3 и NaClO3) приводит к уменьшению величины максимума вязкости и времени релаксации, что объяснили сокращением длины червеобразных мицелл цетилтриметиламмоний бромида. Оно было вызвано увеличением размеров сольватной оболочки противоионов соли [17], препятствующей их сближению с поверхностью мицеллы и, следовательно, экранированию отталкивания головок ПАВ [96].
Таким образом, описанные в данном разделе ионогенные ПАВ с относительно длинной гидрофобной группой, содержащей от 16 до 22 атомов углерода, в присутствии неорганических солей образуют червеобразные мицеллы микронной длины. Использование гидротропной соли, встраивающейся в структуру мицелл, позволяет образовывать такие длинные червеобразные мицеллы более эффективно при меньших концентрациях ПАВ.
Влияние ионов соли, одноименно заряженных по отношению к ионам ПАВ
Вопрос влияния ко-ионов соли на свойства растворов червеобразных мицелл ионогенных ПАВ пока слабо изучен. В литературе насчитывается всего три экспериментальные работы, посвященные этой теме [15, 97, 98]. В работе [97] на примере нескольких солей аммония (NH4Cl, NH4Br, NH4I, NH4NO3, NH4SCN) методом капиллярной вискозиметрии было показано, что тип ко-иона соли может влиять на величину вязкости растворов червеобразных мицелл анионного ПАВ додецилсульфата натрия как до, так и после максимума на зависимости вязкости от концентрации соли. Характерный вид подобной зависимости представлен на рис. 7. Раствор, содержащий NH4SCN, имел наибольшую вязкость, раствор с NH4Cl – наименьшую. Различие в величинах вязкости объясняли влиянием гидрофобных взаимодействий между ко-ионами соли и молекулами воды на размер мицелл [97]. Во второй работе [98] методом статического рассеяния видимого света было также показано, что ко-ионы (F–, Cl–, Br–, I–, SCN–) влияют на размер червеобразных мицелл додецилсульфата натрия. Однако мицеллы в растворе с NaSCN были намного короче, чем в растворе с NaCl, что противоречило результатам, полученным в работе [97].
В 2014 г. в теоретической работе С.В. Королевой и А.И. Викторова [99] было показано, что эффект ко-ионов на вязкоупругие свойства растворов червеобразных мицелл должен наблюдаться при высоких концентрациях соли, когда их отталкивание от одноименно заряженной поверхности мицеллы сильно экранировано противоионами. При таких условиях ко-ионы под действием дисперсионного взаимодействия способны ближе подойти к мицелле, тем самым увеличивая ее эффективный заряд, что ограничивает рост вязкости системы и препятствует возникновению разветвлений. При слабом экранировании, наблюдаемом при низких концентрациях соли, эффект ко-ионов является незначительным [99].
Экспериментальное подтверждение этих теоретических результатов было получено в работе А.Л. Квятковского с соавторами [15] на примере червеобразных мицелл катионного ПАВ эруцил-бис-(гидроксиэтил)метиламмоний хлорида и трех неорганических солей KCl, CaCl2 и LaCl3. Использованные соли различались количеством противоионов Cl– в молекуле и зарядом ко-иона (+1, +2 и +3). На рис. 9 представлены полученные графики зависимостей вязкости растворов мицелл от концентрации противоионов соли при постоянном содержании ПАВ. Видно, что восходящие ветви кривых (область I) совпадают для всех исследованных солей, что свидетельствует о незначительном влиянии ко-иона при низких концентрациях соли (слабом экранировании). В таких условиях рост длины линейных червеобразных мицелл определется концентрацией противоионов. В областях максимума и падения вязкости (область II на рис. 8) значения вязкости в случае мультивалентных солей CaCl2 и LaCl3 значительно превышают значения вязкости для моновалентной соли KCl. Таким образом, в области II при сильном экранировании отталкивания ПАВ противоионами Cl– наблюдается эффект ко-ионов соли. Полученный результат объяснили на основании молекулярно-кинетической теории С.В. Королевой и А.И. Викторова [99], согласно которой моновалентные ко-ионы способны ближе подойти к поверхности мицеллы, чем мультвалентные. Это увеличивает эффективный заряд мицелл в растворе с KCl и ограничивает рост вязкости.
Рис. 9.
Зависимость вязкости 0.6%-ных растворов эруцил-бис-(гидроксиэтил)метиламмоний хлорида от концентрации противоионов Cl- добавленных солей KCl (1), CaCl2 (2) и LaCl3 (3). Публикуется с согласия Kwiatkowski A.L., Molchanov V.S., Orekhov A.S., Vasiliev A.L., Philippova O.E. // J. Phys. Chem. B. 2016. V. 120. № 49. P. 12547. © 2017 American Chemical Society.
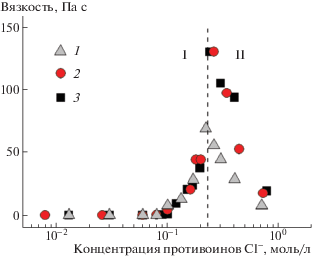
Таким образом, комплексный теоретико-экспериментальный подход в изложенных выше работах позволил определить диапазон концентраций неорганических солей, при которых влияние на длину и форму червеобразных мицелл ионогенного ПАВ помимо противоионов оказывают также ко-ионы соли.
ЗАКЛЮЧЕНИЕ
Аналогия червеобразных мицелл ПАВ с полимерными цепями успешно использована в литературе для создания теоретической модели и для анализа и обработки экспериментальных результатов. Образование сетки топологических зацеплений червеобразных мицелл придает растворам ПАВ оригинальные вязкоупругие свойства. Развитие метода криогенной просвечивающей электронной микроскопии внесло весомый вклад в понимание структуры червеобразных мицелл и образуемой ими сетки, а также позволило визуализировать разветвленные червеобразные мицеллы. Были установлены прямые связи между структурой и вязкоупругими свойствами. Обнаружено, что характеристики внутренней структуры раствора можно напрямую получить, анализируя реологические характеристики системы. Свойства системы определяются степенью разветвленности, длиной и количеством червеобразных мицелл и также соотношением между временем рептации и временем жизни мицелл, описывающим процессы их обратимого разрыва и рекомбинации. Полуразбавленные растворы, содержащие относительно короткие мицеллы, ведут себя как полимерные системы с широким распределением по длине, такие мицеллы называют “неразрывными”. При относительно большой длине цепей происходит усреднение релаксационных процессов и эффективной длины мицелл, и вязкоупругие свойства описываются простой моделью Максвелла с одним временем релаксации. Такие мицеллы ведут себя как “живые” или “равновесные полимеры”.
Анализ экспериментальных данных показывает, что ионогенные ПАВ с относительно длинной гидрофобной группой, содержащей от 16 до 22 атомов углерода, в присутствии неорганической соли формируют червеобразные мицеллы микронной длины. Обнаружено влияние структуры и заряда ионов солей на рост и разветвление червеобразных мицелл ионогенных ПАВ. Использование гидротропной соли, встраивающейся в структуру мицелл, позволяет образовывать такие длинные червеобразные мицеллы более эффективно при меньших концентрациях ПАВ.
В ряде областей, например в нефтедобыче, червеобразные мицеллы ПАВ стали применять вместо полимеров или вместе с ними. Практически важными оказались восприимчивость вязкоупругих свойств растворов червеобразных мицелл к углеводородам (нефти) и способоность полностью восстанавливать структуру и свойства из-за обратимости процессов самоорганизации, что позволяет использовать системы в условиях воздействия высоких деформаций и давлений.
Ближайшие перспективы развития червеобразных мицелл ПАВ в первую очередь связаны с созданием гибридных систем с полимерами [32, 33] и наночастицами [39] для модификации реологических свойств и придания системам функциональности.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 18-33-00885).
Список литературы
Zana R. // Dynamics of Surfactant Self-Assemblies: Micelles, Microemulsions, Vesicles and Lyotropic Phases. Boca Raton: Taylor and Francis Group, 2005.
Zana R., Kaler E.W. // Giant Micelles: Properties and Applications. Boca Raton: CRC Press, 2007.
Dreiss C.A. // Soft Matter. 2007. V. 3. № 8. P. 956.
Magid L.J. // J. Phys. Chem. B. 1998. V. 102. № 21. P. 4064.
Dreiss C.A., Feng Y. // Wormlike Micelles: Advances in Systems, Characterisation and Applications. London: The Royal Society of Chemistry, 2017.
Israelachvili J.N., Mitchell D.J., Ninham B.W. // J. Chem. Soc., Faraday Trans. 1976. V. 72. P. 1525.
Kaatze U. // J. Phys. Chem. B. 2011. V. 115. № 35. P. 10470.
Massiera G., Ramos L., Ligoure C. // Europhys. Lett. 2002. V. 57. № 1. P. 127.
Granek R., Cates M.E. // J. Chem. Phys. 1992. V. 96. № 6. P. 4758.
Cates M.E. // Macromolecules. 1987. V. 20. № 9. P. 2289.
Khatory A., Kern F., Lequeux F., Appell J., Porte G., Morie N., Ott A., Urbach W. // Langmuir. 1993. V. 9. № 4. P. 933.
Parker A., Fieber W. // Soft Matter. 2013. V. 9. № 4. P. 1203.
Русанов А.И., Щёкин А.К. // Мицеллообразование в растворах поверхностно-активных веществ. СПб.: Лань, 2016.
Croce V., Cosgrove T., Maitland G., Hughes T. // Langmuir. 2003. V. 19. № 10. P. 8536.
Kwiatkowski A.L., Molchanov V.S., Orekhov A.S., Vasiliev A.L., Philippova O.E. // J. Phys. Chem. B. 2016. V. 120. № 49. P. 12547.
Shikata T., Hirata H., Kotaka T. // Langmuir. 1988. V. 4. № 2. P. 354.
Oelschlaeger C., Suwita P., Willenbacher N. // Langmuir. 2010. V. 26. № 10. P. 7045.
Oelschlaeger C., Waton G., Candau S.J. // Langmuir. 2003. V. 19. № 25. P. 10495.
Haward S.J., McKinley G.H. // Phys. Rev. E – Stat. Nonlinear, Soft Matter Phys. 2012. V. 85. № 3. P. 031502.
Siriwatwechakul W., LaFleur T., Prud’homme R.K., Sullivan P. // Langmuir. 2004. V. 20. № 21. P. 8970.
Feng Y., Chu Z., Dreiss C.A. // Smart Wormlike Micelles: Design, Characteristics and Applications. Berlin; Heidelberg: Springer-Verlag, 2015.
Chu Z., Dreiss C.A., Feng Y. // Chem. Soc. Rev. 2013. V. 42. № 17. P. 7174.
Molchanov V.S., Philippova O.E. // J. Colloid Interface Sci. 2013. V. 394. № 1. P. 353.
Pope T.L., Olsen T., Powers B., Wilson A. // Oilfield Rev. 2004. V. 16. P. 10.
Shibaev A.V., Molchanov V.S., Philippova O.E. // J. Phys. Chem. B. 2015. V. 119. № 52. P. 15938.
Shibaev A.V., Tamm M.V., Molchanov V.S., Rogachev A.V., Kuklin A.I., Dormidontova E.E., Philippova O.E. // Langmuir. 2014. V. 30. № 13. P. 3705.
Philippova O.E., Molchanov V.S. // Macromol. Symp. 2010. V. 291–292. № 1. P. 137.
Molchanov V.S., Philippova O.E., Khokhlov A.R., Kovalev Y.A., Kuklin A.I. // Langmuir. 2007. V. 23. № 1. P. 105.
Afifi H., Karlsson G., Heenan R.K., Dreiss C.A. // Langmuir. 2011. V. 27. № 12. P. 7480.
Shashkina J.A., Philippova O.E., Zaroslov Y.D., Khokhlov A.R., Pryakhina T.A., Blagodatskikh I. V. // Langmuir. 2005. V. 21. № 4. P. 1524.
Shibaev A. V., Abrashitova K.A., Kuklin A.I., Orekhov A.S., Vasiliev A.L., Iliopoulos I., Philippova O.E. // Macromolecules. 2017. V. 50. № 1. P. 339.
Kwiatkowski A.L., Molchanov V.S., Sharma H., Kuklin A.I., Dormidontova E.E., Philippova O.E. // Soft Matter. 2018. V. 14. P. 4792.
Kwiatkowski A.L., Sharma H., Molchanov V.S., Orekhov A.S., Vasiliev A.L., Dormidontova E.E., Philippova O.E. // Macromolecules. 2017. V. 50. № 18. P. 7299.
Flood C., Dreiss C.A., Croce V., Cosgrove T., Karlsson G. // Langmuir. 2005. V. 21. № 17. P. 7646.
Nakamura K., Shikata T. // J. Phys. Chem. B. 2006. V. 110. № 49. P. 24802.
Kuntz D.M., Walker L.M. // J. Phys. Chem. B. 2007. V. 111. № 23. P. 6417.
Nakamura K., Shikata T., Takahashi N., Kanaya T. // J. Am. Chem. Soc. 2005. V. 127. № 13. P. 4570.
Massiera G., Ramos L., Ligoure C. // Langmuir. 2002. V. 18. № 15. P. 5687.
Pletneva V.A., Molchanov V.S., Philippova O.E. // Langmuir. 2015. V. 31. № 1. P. 110.
Nettesheim F., Liberatore M.W., Hodgdon T.K., Wagner N.J., Kaler E.W., Vethamuthu M. // Langmuir. 2008. V. 24. № 15. P. 7718.
Bandyopadhyay R., Sood A.K. // J. Colloid Interface Sci. 2005. V. 283. № 2. P. 585.
Helgeson M.E., Hodgdon T.K., Kaler E.W., Wagner N.J., Vethamuthu M., Ananthapadmanabhan K.P. // Langmuir. 2010. V. 26. № 11. P. 8049.
Cong T., Wani S.N., Paynter P.A., Sureshkumar R. // Appl. Phys. Lett. 2011. V. 99. № 4. P. 2011.
Candau S.J., Khatory A., Lequeux F., Kern F. // J. Phys. IV Colloq. 1993. V. 3. P. 197.
Cao Q., Yu L., Zheng L.Q., Li G.Z., Ding Y.H., Xiao J.H. // Colloids Surfaces A. 2008. V. 312. № 1. P. 32.
Molchanov V.S., Shashkina Y.A., Philippova O.E., Khokhlov A.R. // Colloid J. 2005. V. 67. № 5. P. 606.
Croce V., Cosgrove T., Dreiss C.A., King S., Maitland G., Hughes T. // Langmuir. 2005. V. 21. № 15. P. 6762.
Padding J.T., Boek E.S., Briels W.J. // J. Chem. Phys. 2008. V. 7. № 129. 074903.
Magid L.J., Li Z., Butler P.D. // Langmuir. 2000. V. 16. № 26. P. 10028.
Magid L.J., Han Z., Li Z., Butler P.D. // J. Phys. Chem. B. 2000. V. 104. № 29. P. 6717.
Хохлов А.Р., Кучанов С.И. // Лекции по физической химии полимеров. Москва: Мир, 2000.
Cates M.E., Candau S.J. // J. Phys., Condens. Matter. 1990. V. 2. P. 6869.
Cates M.E. // J. Phys. Condens. Matter. 1996. V. 8. № 47. P. 9167.
Valeeva F.G., Kuryashov D.A., Zakharov S. V., Vagapova G.I., Vasilieva E.A., Bashkirtseva N.Y., Zakharova L.Y., Konovalov A.I. // Russ. Chem. Bull. 2013. V. 62. № 4. P. 989.
Valeeva F.G., Vasilieva E.A., Gaynanova G.A., Kashapov R.R., Zakharov S. V., Kuryashov D.A., Lukashenko S.S., Bashkirtseva N.Y., Zakharova L.Y. // J. Mol. Liq. 2015. V. 203. P. 104.
Vasserman A.M., Motyakin M.V., Yasina L.L., Vasil’ev V.G., Rogovina L.Z. // Colloid J. 2011. V. 73. № 4. P. 453.
Vasilieva E.A., Zakharov S.V., Kuryashov D.A., Valeeva F.G., Ibragimova A.R., Bashkirtseva N.Y., Zakharova L.Y. // Russ. Chem. Bull. 2015. V. 64. № 8. P. 1901.
Schubert B.A., Kaler E.W., Wagner N.J. // Langmuir. 2003. V. 19. № 10. P. 4079.
Shibaev A.V., Makarov A.V., Kuklin A.I., Iliopoulos I., Philippova O.E. // Macromolecules. 2018. V. 51. № 1. P. 213.
Berret J.F., Appell J., Porte G. // Langmuir. 1993. V. 9. № 11. P. 2851.
Doi M., Edwards S. // The Theory of Polymer Dynamics. Oxford: Clarendon Press, 1986.
De Gennes P.G. // Scaling Concepts in Polymer Physics. Ithaka: Ithaka Univ. Press, 1979.
Turner M.S., Marques C., Cates M.E. // Langmuir. 1993. V. 9. № 3. P. 695.
Turner M.S., Cates M.E. // Langmuir. 1991. V. 7. № 8. P. 1590.
Nagarajan R. // Langmuir. 2002. V. 18. № 1. P. 31.
Raghavan S.R., Fritz G., Kaler E.W. // Langmuir. 2002. V. 18. № 10. P. 3797.
Khatory A., Lequeux F., Kern F., Candau S.J. // Langmuir. 1993. V. 9. № 2. P. 1456.
Parker A., Fieber W. // Soft Matter. 2013. V. 9. № 4. P. 1203.
Малкин А.Я., Исаев А.И. // Реология: концепции, методы, приложения. СПб.: Профессия, 2007.
Candau S.J., Oda R. // Colloids Surfaces A . 2001. V. 183–185. P. 5.
Cardiel J.J., Dohnalkova A.C., Dubash N., Zhao Y., Cheung P., Shen A.Q. // Proc. Natl. Acad. Sci. 2013. V. 110. № 18. P. E1653.
Fischer P., Rehage H. // Langmuir. 1997. V. 13. № 26. P. 7012.
Yesilata B., Clasen C., McKinley G.H. // J. Non-Newton. Fluid Mech. 2006. V. 133. № 2–3. P. 73.
Rogers S.A., Calabrese M.A., Wagner N.J. // Curr. Opin. Colloid Interface Sci. 2014. V. 19. № 6. P. 530.
Berret J.-F. // Molecular Gels / Ed.by R.G. Weiss, P. Terech. Dordrecht: Springer, 2006. P. 667.
Lerouge S., Berret J.-F. // Adv. Polym. Sci. 2010. V. 230. P. 1.
Couillet I., Hughes T., Maitland G., Candau F., Candau S.J. // Langmuir. 2004. V. 20. № 22. P. 9541.
Oelschlaeger C., Schopferer M., Scheffold F., Willenbacher N. // Langmuir. 2009. V. 25. № 8. P. 716.
Candau S.J., Hirsch E., Zana R., Delsanti M. // Langmuir. 1989. V. 5. № 5. P. 1225.
Porte G., Gomati R., Haitdmy E., Appell J., Marignan J. // J. Phys. Chem. 1986. V. 1. № 5. P. 5746.
Lequeux F. // Europhys. Lett. 1992. V. 19. № 8. P. 675.
Lin Z. // Langmuir. 1996. V. 12. № 7. P. 1729.
Kern F., Lequeux F., Zana R., Candau S.J. // Langmuir. 1994. V. 10. № 6. P. 1714.
Danino D., Talmon Y., Levy H., Beinert G., Zana R. // Science. 1995. V. 269. № 5229. P. 1420.
Rehage H., Hoffmann H. // J. Phys. Chem. 1988. № 92. P. 4712.
Nakamura K., Shikata T. // ChemPhysChem. 2007. V. 8. № 18. P. 2568.
Mendes E., Oda R., Manohar C., Narayanan J. // J. Phys. Chem. B. 1998. V. 102. № 2. P. 338.
Soltero J.F.A., Puig J.E., Manero O., Schulz P.C. // Langmuir. 1995. V. 11. № 9. P. 3337.
Hassan P.A., Raghavan S.R., Kaler E.W. // Langmuir. 2002. V. 18. № 7. P. 2543.
Han Y.Y., Feng Y., Sun H., Li Z., Han Y.Y., Wang H. // J. Phys. Chem. B. 2011. V. 115. № 21. P. 6893.
Huang J., Zhang S., Feng Y., Li J., Yan H., He F., Wang G., Liu Y., Wang L. // Colloids Surfaces A. 2016. V. 500. P. 222.
Han Y., Chu Z., Sun H., Li Z., Feng Y. // RSC Adv. 2012. V. 2. № 8. P. 3396.
Subbarao C.V., Chakravarthy I.P.K., Sai Bharadwaj A.V.S.L., Prasad K.M.M. // Chem. Eng. Technol. 2012. V. 35. № 2. P. 225.
Ulmius J., Lindman B., Lindblom G., Drakenberg T. // J. Colloid Interface Sci. 1978. V. 65. № 1. P. 1978.
Raghavan S.R., Edlund H., Kaler E.W. // Langmuir. 2002. V. 18. № 4. P. 1056.
Jiang N., Li P., Wang Y., Wang J., Yan H., Thomas R.K. // J. Colloid Interface Sci. 2005. V. 286. № 2. P. 755.
Kabir-ud-Din, David S.L., Kumar S. // J. Chem. Eng. Data. 1997. V. 42. № 6. P. 1224.
Ikeda S., Hayashi S., Imae T. // J. Phys. Chem. 1981. V. 85. № 6. P. 106.
Koroleva S.V., Victorov A.I. // Phys. Chem. Chem. Phys. 2014. V. 16. № 33. P. 17422.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)