Высокомолекулярные соединения (серия А), 2019, T. 61, № 3, стр. 195-202
ОБ УСТОЙЧИВОСТИ ВОДНЫХ НАНОДИСПЕРСИЙ ПОЛИЭЛЕКТРОЛИТНЫХ КОМПЛЕКСОВ НА ОСНОВЕ ХИТОЗАНА И N-СУКЦИНИЛХИТОЗАНА
С. В. Колесов a, М. С. Гурина a, Р. Х. Мударисова a, *
a фимский институт химии Уфимского федерального исследовательского центра Российской академии наук
450054 Уфа, пр. Октября, 71, Россия
* E-mail: mudarisova@anrb.ru
Поступила в редакцию 13.09.2018
После доработки 24.12.2018
Принята к публикации 09.01.2019
Аннотация
Получены и охарактеризованы с точки зрения агрегативной устойчивости водные дисперсии частиц полиэлектролитных комплексов на основе гидрохлорида хитозана и натриевой соли N-сукцинил-хитозана. Показано, что во всем рассмотренном диапазоне экспериментальных условий эти полиэлектролиты образуют агрегативно неустойчивые дисперсные системы. Вместе с тем относительная агрегативная устойчивость систем (время до образования осадка полиэлектролитного комплекса) растет при увеличении разницы в молекулярных массах полимеров, с ростом мольного соотношения компонентов, концентрации полимеров в растворе и достигает 30 дней. Средний размер частиц в области относительной агрегативной устойчивости дисперсных систем составляет 100–380 нм, что перспективно для их использования в качестве лизируемых носителей лекарственных средств для их целенаправленного транспорта в организме.
В современных технологиях фармацевтических препаратов большое внимание уделяется разработке безопасных систем целевой доставки лекарственных соединений. Существенные улучшения в пассивной целевой доставке лекарственных средств на фармакологические цели, например, опухолевые клетки и ткани, эффективно достигаются за счет использования полимерных наночастиц. Целями разработки и применения нано- и микрочастиц в биомедицинском приложении являются преодоление тканевых барьеров, уменьшение побочных эффектов лекарственных соединений (токсичности, аллергенности), повышение эффективности за счет пролонгирования действия и, главное, достижение их целенаправленной доставки в клетки и ткани организма. Так, наночастицы с размерами порядка 10–400 нм имеют тенденцию накапливаться в опухолях из-за увеличения кровообращения и уменьшения лимфатического дренирования опухолевых тканей. Среди множества видов наночастиц в качестве носителей для пассивной доставки лекарственных соединений несомненные преимущества имеют полимерные частицы на основе природных полисахаридов. Это связано с биосовместимостью, биоразлагаемостью, разнообразной собственной биологической активностью и нетоксичностью самих полисахаридов, широкими возможностями их химической модификации и наличием сравнительно простых методов получения наночастиц на их основе [1–5]. Наночастицы на основе хитозана и его производных отмечают среди наиболее перспективных носителей в связи с широким спектром его биологической активности.
Описано [5–22] много способов получения наночастиц на основе хитозана
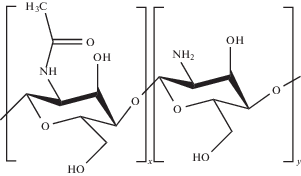 ,
,
например ионотропное гелеобразование [8, 10–12], послойное нанесение полимеров на предварительно сформированные полимерные или неорганические наночастицы [9, 13, 14] и т.д. Вместе с тем не ослабевает интерес к самоорганизующимся наноматериалам на основе хитозана (микрочастицам, гелям, пленкам и т.д.) [11–13, 16–18, 20, 22]. Их преимущества связаны с более простой реализацией, отсутствием необходимости использования предварительно полученных наночастиц или дополнительных физических воздействий, в частности при ультразвуковом диспергировании. К самоорганизующимся нанообъектам относятся и полиэлектролитные комплексы (ПЭК) хитозана с противоположно заряженными полиионами, образующиеся в совместном растворе по механизму электростатического взаимодействия противоположно заряженных ионогенных групп с образованием солевых ПЭК. Здесь исследованы влияние природы полиэлектролитов, их молекулярных характеристик, мольного соотношения полимеров в общем растворе, влияние среды на фазовое поведение систем, и определены условия, в которых ПЭК образуется как дисперсная система нано- и микрочастиц [2, 23].
В ряду исследованных хитозановых ПЭК с полисахаридами описаны комплексы с такими полианионами, как альгинат Na, гиалуроновая кислота, полиглютаминовая кислота, каррагенаны, функциональные производные самого хитозана, например сульфатированный хитозан. С этой точки зрения, несомненно, интересен в качестве компонента ПЭК доступный и практически значимый продукт – Na-соль N-сукцинил-хитозана
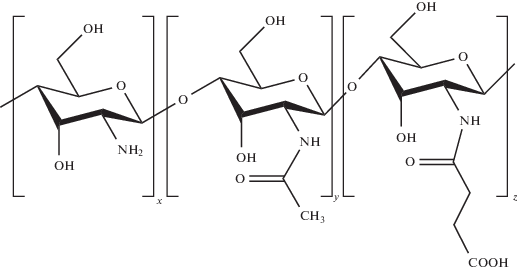
Биологическая активность N-сукцинил-хитозана и возможности его использования для иммобилизации лекарственных соединений исследуются достаточно широко. Показано [24, 25], что N-сукцинил-хитозан безопасен при внутривенном введении, чем положительно отличается от хитозана, который вызывает гемолиз [26]. Установлено, что он нетоксичен [27, 28], более устойчив к биодеградации [29], обладает антикоагулянтной и антиагрегантной и антиоксидантной активностью [30]. N-сукцинил-хитозан исследовался в разработке систем доставки противоопухолевых препаратов – митомицина С [27, 31, 32], таксанов [33].
Как правило, в работах, посвященных исследованию дисперсных систем нано- и микрочастиц, приводятся их размерные характеристики, чаще средние размеры и диапазон размеров частиц, реже кривые распределения частиц по размерам. Вместе с тем для дисперсных систем ПЭК не менее актуален вопрос о динамике изменения размерных характеристик частиц во времени. Это важно с точки зрения допустимых сроков хранения и использования систем в случае их практического применения.
Цель настоящего исследования заключалась в получении нано- и микродисперсных интерполимерных комплексов хитозана и N-сукцинил-хитозана и оценке агрегативной устойчивости систем в зависимости от молекулярных характеристик полиэлектролитов.
В задачи исследования входила оценка фазового поведения смесей полиэлектролитов в водном растворе во времени, определение средних размеров частиц комплексов, изменения размеров частиц в зависимости от соотношений молекулярных масс, молярных концентраций компонентов в смеси и массовой концентрации полимеров, а также агрегативной устойчивости систем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали образцы хитозана и натриевой соли N-сукцинил-хитозана (М = 207 × 103) производства Закрытого акционерного общества “Биопрогресс” (Щелково, Россия), ТУ 9289-067-00473124-03 и ТУ 9284-027-11734126 соответственно. Образец N-сукцинил-хитозана с молекулярной массой 26 × 103 получали методом окислительного расщепления высокомолекулярного полимера с массой 207 × 103 перекисью водорода в водном растворе, как описано в работе [34]. Полагали, что содержание ацетамидных, амино- и N-сукцинильных групп при окислительном расщеплении макроцепей по закону случая не изменялось. Степень замещения N-сукцинил-хитозана определяли нингидринным анализом [35].
Степень деацетилирования β хитозана оценивали кислотно-основным титрованием с потенциометрическим определением точек эквивалентности на кулонометрическом титраторе ТК100-В по формуле [36]
Гидрохлорид хитозана получали в виде пленки из солянокислого раствора хитозана (2 г хитозана в 50 мл 1%-ного раствора соляной кислоты) путем высушивания на воздухе и далее под вакуумом до постоянной массы. Мольное соотношение соляная кислота : хитозан составляет 1.07.
Молекулярную массу исследуемых полимеров определяли методом вискозиметрии с помощью вискозиметра Уббелоде при 25 ± 0.1°С в ацетатном буфере (рН 4.5). Средневязкостную молекулярную массу рассчитывали по уравнению Марка–Куна–Хаувинка [η] = 1.38 × 10–4М0.85 [37]. Молекулярную массу полимеров также находили методом седиментационного равновесия и рассчитывали следующим образом:
Здесь R = 8.3 Дж/моль К; Т – абсолютная температура; угловая скорость вращения ротора ультрацентрифуги ω = 2πn рад/с (n – число оборотов ротора в минуту); tgα – угол наклона зависимости Z/X от концентрации раствора с, где X – расстояние от оси вращения ротора до точки кривой на снимке, Z = dс/dX – высота градиентной кривой (градиент концентрации) в данной точке; ($1 - v{{\rho }_{0}}$) – архимедов множитель ($v$ – удельный парциальный объем полимера, ρ0 – плотность растворителя). Характеристики использованных образцов приведены в табл. 1.
Таблица 1.
Физико-химические характеристики полиэлектролитов
| Полимер | [η], дл/г | М × 10–3 | Количество звеньев, мол. % | ||
|---|---|---|---|---|---|
| R–NH2 | R–NHСОСН3 | R–СООН | |||
| Х-1 | 0.7 | 30* | 75 | 25 | – |
| Х-2 | 3.5 | 100** | 87 | 13 | – |
| СХ-1 | 0.6 | 26* | 20 | 18 | 62 |
| СХ-2 | 3.6 | 207* | 20 | 18 | 62 |
Водные дисперсии ПЭК получали путем добавления к водным растворам N-сукцинил-хитозана по каплям водный раствор гидрохлорида хитозана при интенсивном перемешивании (500 об/мин) и температуре 25°С с интервалом между введением порций 5 мин. Состав реакционной смеси выражали через мольное соотношение z
Состав реакционной смеси, начиная с которого происходит формирование частиц ПЭК и начинается рост оптической плотности, принимали за zпред. Массовую концентрацию хитозана и N-сукцинил-хитозана в растворе находили по отношению массы растворенного вещества к общей массе раствора с учетом влажности полисахаридов. Влажность полисахаридов составляла 4–5%.
Фазовое поведение смесей оценивали визуально по появлению опалесценции смеси растворов полиэлектролитов и по образованию осадка комплекса. Размер частиц опалесцирующих систем ПЭК определяли методом лазерного рассеяния на приборе “Sald 7101” (“Shimadzu”). Длина волны полупроводникового лазера 375 нм. Рабочий диапазон измерения диаметров частиц 10 нм–300 мкм. Измерения проводили в специальных кварцевых кюветах “Sald-BC” с механическим вертикальным перемешиванием в инертной атмосфере аргона. Результат вычисления размеров частиц представлен в виде диаметра частиц D. Ошибка измерения 3%. Размер частиц для свежеприготовленных дисперсных систем определяли через 24 ч после получения. С целью оценки размеров частиц во времени через определенные промежутки отбирали пробы из объема реакционного сосуда и находили средний размер частиц. За время устойчивости принимали время до момента образования в системах визуально наблюдаемого осадка ПЭК.
Анализы выполнены на оборудовании Центра коллективного пользования “Химия” Уфимского института химии Уфимского федерального исследовательского центра Российской академии наук.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбор пары полисахаридов гидрохлорид хитозана – Na-соль N-сукцинил-хитозана помимо их прикладной значимости для биомедицинских приложений обусловлен тем, что оба компонента, являясь солями, хорошо растворимы в нейтральной водной среде. Водные смеси хитозан–N-сукцинил-хитозан имеют рН 6.5–7.0. Это выгодно отличает данную систему от многих полисахаридных пар, включающих хитозан, который обладает растворимостью и выступает как поликатион только в кислой среде, как, например, в работе [38].
Добавление к раствору полианиона даже малых порций раствора поликатиона сопровождалось фазовым разделением, обнаруживаемым по появлению устойчивой опалесценции общей системы. Область существования дисперсий частиц ПЭК указанных полисахаридов ограничивается мольным соотношением zпред = 0.8, выше которого уже в процессе смешения компонентов наблюдается выпадение осадка комплекса. Это имело место для всех исследованных систем с различными соотношениями молекулярных масс полимеров. Другой общей характеристикой всех систем оказалась их термодинамическая неустойчивость. Во всех исследованных системах, даже при z < zпред, через некоторое время обязательно наблюдался фазовый распад с выпадением осадка ПЭК. Однако время до фазового распада и изменение средних размеров частиц в течение этого времени существенно зависят от соотношения молекулярных масс полианиона и поликатиона, мольного соотношения ионогенных групп и общей концентрации полимерного раствора. Обусловливающие это причины представляют несомненный интерес.
При рассмотрении взаимодействия исследуемых полисахаридов при смешении их растворов необходимо иметь в виду, что сами растворы индивидуальных полимеров в зависимости от концентрации могут иметь сложную надмолекулярную структуру. Так, при исследовании растворов высокомолекулярных образцов хитозана в термодинамически хороших растворителях показано, что уже разбавленные растворы с концентрациями полимера ниже точки кроссовера С* = 1/[η] являются структурированными системами [39]. В случае хитозана с М = 100 × 103 (Х-2) точка кроссовера составляет 0.3 мас. %, для N-сукцинил-хитозана с М =207 × 103 (СХ-2) в водном растворе значение С* = 0.27 мас. %, т.е. в растворы данных полимеров с концентрацией более 0.3 мас. % представляют собой системы взаимодействующих макромолекул. В случае сравнительно низкомолекулярных полисахаридов точки кроссовера для растворов индивидуальных полимеров составляют 1.7 мас. % для N-сукцинил-хитозана с М = 26 × 103 (СХ-1) и 1.4 мас. % для хитозана с М = 30 × 103 (Х-1). В растворах неионогенных полимеров после превышения С* начинается формирование трехмерной флуктуационной сетки зацеплений, в которой узлы представляют собой зацепления участков макромолекул. Однако особенностью растворов заряженных макромолекул является наличие протяженной концентрационной области полуразбавленных растворов, в которых макромолекулярные клубки уже соприкасаются, а сетки зацеплений еще нет [40, 41], что обусловлено электростатическим отталкиванием одноименно заряженных звеньев цепей. Соответственно при рассмотрении процессов формирования частиц дисперсной фазы ПЭК следует исходить из того, что даже в разбавленных растворах сравнительно низкомолекулярных полимеров СХ-1 и Х-1 во взаимодействии между собой участвуют не только отдельные макромолекулы ПЭ, но и находящиеся с ними в равновесии объемные макромолекулярные ассоциаты. В данном случае солевые связи образуют только доступные к взаимодействию заряженные группы на поверхности ассоциатов. Каждый ассоциат имеет большое число поверхностных зарядов, что обеспечивает ему возможность связываться с несколькими противоположно заряженными ассоциатами. Очевидно, именно это обусловливает формирование достаточно крупных частиц, быстро теряющих седиментационную устойчивость. В растворах смесей СХ-1 и Х-1 с общей массовой концентрацией полимеров w = 0.17–0.56 мас. % при z ≤ ≤ zпред выпадение осадка ПЭК наблюдается уже через 24 ч с момента их получения. Размеры частиц ПЭК, определенные в течение 1–2 ч с момента смешения, лежат в интервале Dнач = 200–281 нм (табл. 2). Прослеживается слабая прямая зависимость размера частиц от мольного соотношения полиэлектролитов в растворе.
Таблица 2.
Влияние суммарной массовой концентрации полиэлектролитов СХ-1 и Х-1 в растворе и их мольного соотношения на размер частиц ПЭК после их выдерживания в течение 24 ч
| w, мас.% | z | D, нм | ||
|---|---|---|---|---|
| общая | СХ-1 | Х-1 | ||
| 0.17 | 0.16 | 0.008 | 0.5 | 219 |
| 0.18 | 0.16 | 0.016 | 0.6 | 204 |
| 0.20 | 0.16 | 0.036 | 0.7 | 266 |
| 0.21 | 0.16 | 0.048 | 0.8 | 242 |
| 0.42 | 0.4 | 0.02 | 0.2 | 200 |
| 0.44 | 0.4 | 0.04 | 0.4 | 206 |
| 0.46 | 0.4 | 0.06 | 0.6 | 240 |
| 0.48 | 0.4 | 0.08 | 0.8 | 281 |
| 0.50 | 0.4 | 0.10 | 0.2 | 216 |
| 0.52 | 0.4 | 0.12 | 0.4 | 239 |
| 0.54 | 0.4 | 0.14 | 0.6 | 252 |
| 0.56 | 0.4 | 0.16 | 0.8 | 264 |
К аналогичному результату должно приводить и повышение концентрации полимеров в растворе, увеличивающее общее число взаимодействующих объектов. Однако влияние концентрации раствора заряженных макромолекул оказывается более сложным. В работе [42] показано, что введение в раствор хитозана отрицательно заряженных коллоидных частиц (золя AgJ) приводит к более раннему формированию сетки зацеплений, исчезновению концентрационной области, отвечающей контактирующим, но не зацепленным макромолекулам, вследствие нейтрализации заряда хитозана при образовании межцепных ионных связей. Формирование флуктуационной сетки зацеплений, т.е. структурирование раствора за счет появления дополнительной сетки с узлами ПЭК, приводит к смене механизма массопереноса в системе с трансляционного на рептационный.
Очевидно, уже по этой причине время массопереноса в процессе формирования седиментационно неустойчивых частиц должно увеличиваться и в течение данного времени в объеме жидкой фазы будут обнаруживаться микрочастицы ПЭК. При повышении концентрации полимерного раствора смеси СХ-1 и Х-1 до ≈2.0 мас. % время до выпадения осадка ПЭК возрастает до 3 дней, а начальные размеры частиц – до 350–450 нм (табл. 3).
Таблица 3.
Влияние суммарной массовой концентрации полиэлектролитов СХ-1 и Х-1 в растворе и их мольного соотношения на размер частиц ПЭК и их изменение во времени
| w, мас. % | z | D (нм) после выдерживания | |||
|---|---|---|---|---|---|
| 24 ч | 72 ч | ||||
| общая | СХ-1 | Х-1 | |||
| 2.05 | 2.0 | 0.05 | 0.2 | 353 | 369 |
| 2.10 | 2.0 | 0.10 | 0.4 | 371 | 367 |
| 2.15 | 2.0 | 0.15 | 0.6 | 392 | 394 |
| 2.20 | 2.0 | 0.20 | 0.8 | 450 | 438 |
В смесях СХ-2 и Х-2, различающихся по молекулярной массе, при z < zпред также сразу образуются мутные системы, которые быстро распадаются с образованием осадков, как и смеси низкомолекулярных полиэлектролитов, если парциальная концентрация каждого компонента в растворе меньше соответствующей ему С*. Однако, если хотя бы один из компонентов использован в виде полуразбавленного раствора, то вследствие структурирования раствора из-за появления дополнительной сетки с узлами ПЭК время до выпадения осадка увеличивается, в данном случае до 7 дней (табл. 4). При этом прослеживается прямая зависимость начального размера частиц от мольного соотношения полиэлектролитов в смеси.
Таблица 4.
Влияние суммарной массовой концентрации полиэлектролитов СХ-2 и Х-2 в растворе и их мольного соотношения на размер частиц ПЭК и их изменение во времени
| w, мас. % | z | D (нм) после выдерживания | |||
|---|---|---|---|---|---|
| общая | СХ-2 | Х-2 | 24 ч | 168 ч | |
| 0.48 | 0.40 | 0.08 | 0.3 | 146 | 185 |
| 0.50 | 0.40 | 0.10 | 0.4 | 215 | 339 |
| 0.52 | 0.40 | 0.12 | 0.5 | 235 | 349 |
| 0.54 | 0.40 | 0.14 | 0.6 | 241 | Выпал осадок |
Система СХ-1–Х-2 имеет наибольшее различие молекулярных масс. Это, вероятно, и обусловило возможность получения наибольшей относительной агрегативной устойчивости в ряду исследованных систем (до 30 дней). На примере систем СХ-1–Х-2 проявляется сильная зависимость агрегативной устойчивости систем от условий их получения. Развивающиеся во времени процессы присходят не только в величине интервала до момента образования осадка ПЭК, но и в относительном изменении размеров частиц во времени в зависимости от мольного соотношения компонентов смеси и концентрационного режима общего раствора. Размеры частиц, определенные для систем, полученных при z < zпред и выдержанных 24 ч с момента получения (табл. 5), приняты за Dнач. Как видно, начальные средние размеры частиц лежат в диапазоне 110–360 нм. При этом, как и в описанных выше системах, наблюдаются прямые зависимости среднего размера частиц от мольного соотношения компонентов, но зависимости для систем с разной концентрацией высокомолекулярного СХ-2 в растворе различны. В разбавленных по СХ-2 растворах полисахаридов с w = 0.08 мас. % средний размер частиц линейно растет с увеличением z в интервале 0.5–0.8. Очевидно, при значительном недостатке хитозана как блокирующего полиэлектролита образуется сравнительно небольшое число дисперсных частиц и вероятность их участия в последующих агрегационных процессах сравнительно невелика. Рост соотношения хитозан : : N-сукцинил-хитозан приводит к увеличению числа частиц и соответственно к вероятности их вовлечения в образование агрегатов большего размера.
Таблица 5.
Влияние суммарной массовой концентрации полиэлектролитов СХ-1 и Х-2 в растворе и их мольного соотношения на размер частиц ПЭК и их изменение во времени
| w, мас. % | z | D (нм) после выдерживания, дней | ||||||
|---|---|---|---|---|---|---|---|---|
| общая | СХ-2 | Х-1 | 1 | 3 | 5 | 15 | 30 | |
| 0.096 | 0.08 | 0.016 | 0.5 | 112 | 279 | 346 | – | – |
| 0.100 | 0.08 | 0.02 | 0.6 | 258 | 256 | 276 | – | – |
| 0.104 | 0.08 | 0.024 | 0.7 | 271 | 264 | 293 | 266 | – |
| 0.108 | 0.08 | 0.028 | 0.8 | 361 | 306 | 335 | 223 | – |
| 0.50 | 0.40 | 0.10 | 0.4 | 258 | 259 | 253 | 255 | 256 |
| 0.52 | 0.40 | 0.12 | 0.5 | 271 | 270 | 266 | 263 | 264 |
| 0.54 | 0.40 | 0.14 | 0.6 | 361 | 324 | 326 | 288 | 210 |
| 0.92 | 0.80 | 0.12 | 0.2 | 363 | 350 | 298 | 260 | 223 |
| 0.94 | 0.80 | 0.14 | 0.4 | 340 | 308 | 290 | 276 | 232 |
| 0.96 | 0.80 | 0.16 | 0.6 | 312 | 300 | 284 | 280 | 272 |
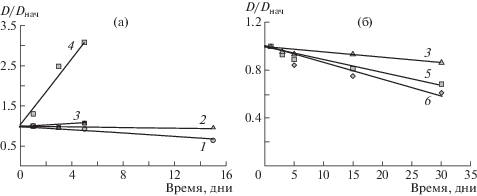
В растворах любой концентрации при одном и том же значении z во времени развиваются процессы, проявляющиеся в относительном изменении размеров частиц D/Dнач, вплоть до момента образования осадка (рис. 1). В разбавленном растворе полисахаридов при значительном недостатке хитозана (z = 0.5) как блокирующего полиэлектролита появляются частицы с наименьшим в данной системе размером, и во времени размеров частиц увеличивается в 3 раза к моменту выпадения осадка (рис. 1а) при сравнительно небольшом времени до образования осадка (5 дней). При повышении содержания хитозана сразу формируются частицы сравнительно большого размера, а относительный размер частиц в объеме раствора перестает изменяться во времени (z = 0.6) или несколько уменьшается (z = 0.7–0.8), при этом время до выпадения осадка увеличивается до 15 дней. В концентрированных по СХ-2 растворах наблюдается только относительное уменьшение размера частиц во времени (рис. 1б), а стабильность систем увеличивается до 30 дней.
Рис. 1.
Относительное изменение размеров частиц полиэлектролитного комплекса Х-2–СХ-1 в зависимости от времени выдержки. Мольное соотношение компонентов в смеси z = 0.8 (1), 0.7 (2), 0.6 (3), 0.5 (4), 0.4 (5) и 0.2 (6); суммарная массовая концентрация полимеров в растворе w = 0.10–0.11(а) и 0.92–0.96 мас. % (б).
Таким образом, характерным для взаимодействия гидрохлорида хитозана и Na-соли N-сукцинилхитозана в водном растворе является образование агрегативно неустойчивых систем с дисперсной фазой частиц ПЭК, в которых непрерывно идут процессы, приводящие к изменению размеров частиц и, в конечном счете, к выпадению осадка комплекса. Время до образования осадка зависит главным образом от разницы молекулярных масс лиофилизирующего и блокирующего полиэлектролитов и суммарной концентрации полимеров в растворе. При значительной разнице молекулярных масс и общей концентрации ≥0.5 мас. % можно получить системы, в которых дисперсная фаза микрочастиц в растворе сохраняется до 30 дней. Средний размер частиц в области относительной агрегативной устойчивости дисперсных систем составляет 100–380 нм, что перспективно для их использования в качестве лизируемых носителей лекарственных сред для их целенаправленного транспорта в организме.
Работа выполнена по программе ФНИ государственных академий на 2013-2020 гг. Гос. задание № АААА-А17-117011910026-3.
Список литературы
Krayukhina M.A., Samoilova N.A., Yamskov I.A. // Russ. Chem. Revs. 2008. V. 77. № 9. P. 799.
Izumrudov V.A., Volkova I.F., Grigoryan E.S., Gorshkova M.Yu. // Polymer Science A. 2011. V. 53. № 4. P. 281.
Ishihara M., Hattori H., Nakamura S. // Int. J. Pharma Bio Sci. 2015. V. 6. № 3. P. 162.
Yuan Q., Shah J., Hein S., R.D.K. // Acta Biomater. 2010. V. 6 № 3. P. 1140.
Yang J., Han S., Zheng H., Dong H., Liu J. // Carbohydr. Polymers. 2015. V. 123. P. 53.
Grenha A. // J. Drug Targeting. 2012. V. 20. № 4. P. 291.
Venkatesan J., Anil S., Kim S.-K., Shim M.S. // Polymers. 2016. V. 8. № 2. P. 30
Shu X.Z., Zhu K.J. // J. Microencapsul. 2001. V. 18. № 2. P. 237.
Lia N., Zhuang C., Wang M., Sun X., Nie S., Pan W. // Int. J. Pharm. 2009. V. 379. № 1. P. 131.
Губайдуллина А.А., Смагина Г.И., Мелентьев А.И., Алсынбаев М.М. // Биотехнология. 2010. № 5. С. 45.
Balabushevich N.G., Izumrudov V.A., Larionova N.I. // Polymer Science A. 2012. T. 54. № 7. C. 540.
Kirzhanova E.A., Pechenkin M.A., Balabushevich N.G., Balabushevich N.G. // Moscow Univ. Chem. Bull. 2016. V. 71. № 2. P. 127.
Guo R., Chen L., Cai S. // J. Mater. Sci. Mater. Med. 2013. V. 24. № 9. P. 2093.
Khorram M., Mohsen Samimi, Abdolreza Samimi // J. Appl. Polym. Sci. 2015. V. 132. № 4. P. 2093.
Skorik A., Golyshev A.A., Kritchenkov A.S., Gasilova E.R., Poshina D.N., Sivaram A.J., Jayakumar R. // Carbohydr. Polymers. 2017. V. 162. P. 49.
Yang Y., Wang S., Wang Y., Wang X., Wang Q., Chen M. // Biotechnol. Adv. 2014. V. 32. № 7. P. 1301.
Barck K., Butler M.F. // J. Appl. Polym. Sci. 2005. V. 98. № 4. P. 1581.
Boddohi S., Moore N., Johnson P.A., Kipper M.J. // Biomacromolecules. 2009. V. 10. № 6. P. 1402.
Bernkop-Schnurch A., Dunnhautpt S. // Eur. J. Pharm. Biopharm. 2012. V. 81. № 3. P. 463.
Gurina M.S., Vil’danova R.R., Badykova L.A., Vlasova N.M., Kolesov S.V. // Russ. J. Appl. Chem. 2017. V. 90. № 2. P. 219.
Patil S.B., Sawant K.K. // Colloid Surf B. Biointerfaces. 2011. V. 84. P. 384.
Rafiee A., Taraneh Gazori M.H.A., Riazi-rad F. // Asian Pacific J.Tropical Disease. 2014. V. 4. № 5. P. 372.
Кабанов В.А., Зезин А.Б. // Успехи химии 1982. Т. 51. № 9. С. 1447.
Kato Y., Onishi H., Machida Y. // Biomaterials. 2000. V. 21. № 15. P. 1579.
Panevin A.A., Golyshev A.A., Skorik Y.A., Zhuravskii S.G., Sonin D.L. // Pharm. Chem. J. 2017. V. 50. № 11. P. 711.
Dash B.C., Rethore G., Monaghan M., Fitzgerald K., Gallagher W., Pandi A. // Biomaterials. 2010. V. 31. № 32. P. 8188.
Song Y., Onishi H., Nagai T. // Int. J. Pharm. 1993. V. 98. № 1–3. P. 121.
Izume M. // Chitin Chitosan Res. 1998. V. 4. P. 12.
Kamiyama K., Onishi H., Machida Y. // Biol. Pharm. Bull. 1999. V. 22. № 2. P. 179.
Skorik Y.A., Kritchenkov A.S., Moskalenko Y.E., Golyshev A.A., Raik S.V., Whaley A.K., Vasina L.V., Sonin D.L. // Carbohydr. Polymers. 2017. V. 166. P. 166.
Sato M., Onishi H., Takahara J., Machida Y., Nagai T. // Biol. Pharm. Bull. 1996. V. 19. № 9. P. 1170.
Song Y., Onishi H., Machida Y., Nagai T. // J. Controlled Release. 1996. V. 42. № 1. P. 93.
Skorik Y.A., Golyshev A.A., Kritchenkov A.S., Gasilova E.R., Poshina D.N., Sivaram A.J., Jayakumar R. // Carbohydr. Polymers. 2017. V. 162. P. 49.
Купреев Н.И., Быковский Д.В., Кузнецов В.А., Ваел Шехта Матвалли Э.Е. Пат. 2417088 Россия. 2011.
Немцев С.В., Быкова В.М., Ежова Е.А., Лопатин С.А. // VIII Международ. конф. “Современные перспективы в исследовании хитина и хитозана”. М.: ВНИРО, 2006. С. 109.
Кучина Ю.А., Долгопятова Н.В., Новиков В.Ю., Сагайдачный В.А., Морозов Н.Н. // Вестн. МГТУ. 2012. Т. 15. № 1. С. 107.
Gamzazade A.I., Slimak V.M., Skljar A.M., Stykova E.V., Pavlova S.-S.A., Rogozin S.V. // Acta Polymerica. 1985. V. 36. № 8. P. 420.
Badykova L.A., Mudarisova R.Kh., Borisov I.M., Gurina M.S. // Russ. J. Appl. Chem. 2016. T. 89. № 7. C. 1126.
Kulish E.I., Chernova V.V., Volodina V.P., Kolesov S.V. // Polymer Science A. 2015. T. 57. № 5. C. 508.
Dobrynin A.V., Rubinshtein M., Colby R.H. // Macromolecules. 1995. V. 28. № 6. P. 1859.
Muthukumar M. // J. Chem. Phys. 1997. V. 107. № 7. P. 2619.
Bazunova M.V., Valiev D.R., Chernova V.V., Kulish E.I. // Polymer Science A. 2015. T. 57. № 5. C. 675.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


