Высокомолекулярные соединения (серия Б), 2020, T. 62, № 3, стр. 203-209
Синтез и свойства интерполимерных комплексов на основе хитозана и сульфатированного арабиногалактана
Н. В. Слюсаренко a, *, Н. Ю. Васильева a, А. С. Казаченко b, М. А. Герасимова a, А. С. Романченко b, Е. А. Слюсарева a
a Сибирский федеральный университет
660041 Красноярск, пр. Свободный, 79, Россия
b “Красноярский научный центр Сибирского отделения Российской академии наук”.
Институт химии и химической технологии
660036 Красноярск, ул. Академгородок, 50/24, Россия
* E-mail: sci_box@mail.ru
Поступила в редакцию 25.07.2019
После доработки 07.11.2019
Принята к публикации 22.11.2019
Аннотация
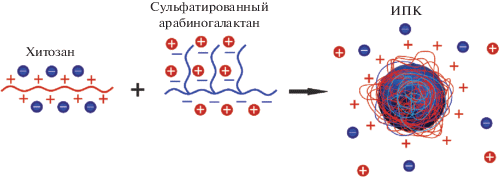
Синтезированы стабильные в течение 30 дней интерполимерные комплексы на основе хитозана и арабиногалактана с различной степенью сульфатирования (7.7–40.8%). Полученные комплексы охарактеризованы с помощью электронной сканирующей микроскопии, ИК-спектроскопии, динамического светорассеяния и электрофоретического измерения ζ-потенциала. Основной механизм образования комплексов рассмотрен в терминах электростатического связывания полиионов. Новые комплексы имеют перспективу применения в качестве биосорбентов и систем доставки лекарств.
Среди природных полисахаридов хитозан – продукт дезацетилирования хитина – занимает уникальное место. Он имеет поликатионную природу в кислых средах, биоразлагаем, обладает антибактериальным эффектом, биоадгезивными и заживляющими свойствами [1]. Формирование гидрофильных нестехиометрических интерполимерных комплексов (ИПК) на основе хитозана позволяет не только сохранить важные для биомедицины свойства полимера, но и дополнить их присущими частицам свойствами: подвижностью, увеличенной эффективной поверхностью, фильтрацией. Это дает возможность применять их в качестве биосорбентов или систем доставки лекарств [2–5]. Катионная природа хитозана позволяет формировать комплексы (в литературе их также называют полиэлектролитными комплексами) с различными анионными полисахаридами, например гепарином, каррагинанами, хондроитин сульфатом, гиалуронатом и другими [6–12]. Создание новых интерполимерных комплексов, выгодно сочетающих в себе свойства частиц и биополимеров, продолжается, а важным вопросом их практического применения является коллоидная стабильность.
В настоящей работе впервые исследована возможность создания нестехиометрических субмикронных интерполимерных комплексов на основе хитозана и сульфатированного арабиногалактана (САГ). Источником арабиногалактана в основном служит древесина лиственницы. Сульфатирование арабиногалактана значительно расширяет его границы применимости. Так, анионная активность позволяет формировать полиэлектролитные комплексы с поликатионами, а гиполипидемические и антикоагулянтные свойства дают возможность применять его как аналог гепариноидов или в качестве антимикробного агента [13, 14]. Совместное успешное использование указанных двух полисахаридов для тканевой инженерии было продемонстрировано на примере создания высокопористых губок [15].
Свойства комплексов, полученных из арабиногалактана с разной степенью сульфатирования, изучены методами сканирующей электронной микроскопии и динамического рассеяния света, приведены результаты измерений ИК-спектров интерполимерных комплексов (размер и ζ-потенциал), а также исходных полимеров, образующих ИПК. Новые коллоидно-стабильные субмикронные комплексы на основе хитозана и САГ являются перспективным биологически активным материалом, поскольку сочетают уникальные свойства входящих в его состав биополимеров [16–18].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных полимеров для синтеза ИПК в работе использовали хитозан низковязкий из панциря креветки c молекулярной массой М = (20–200) × 103 производства “Sigma–Aldrich”:
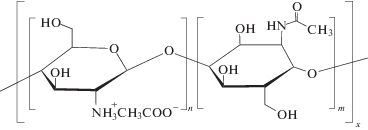
и арабиногалактан древесины лиственницы сибирской (Larix sibirica Ledeb.) со средней молекулярной массой М ~ 17 × 103, предоставленный Обществом с ограниченной ответственностью “Химия древесины” (Россия) под наименованием препарата “ФиброларС” [19]:
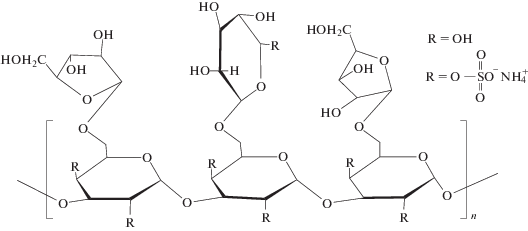
Синтез сульфатированного арабиногалактана осуществляли по методике [16] добавлением сульфаминовой кислоты в 1,4-диоксане или в диметилсульфоксиде в присутствии мочевины при различном температурном режиме и продолжительности процесса с последующим выделением САГ в виде аммониевой соли. Для удаления непрореагировавших реагентов продукт диализировали против воды в течение 8–10 ч, меняя воду каждый час. Диализ проводили с использованием целлюлозной мембраны Cellu Sep T1 (“Membrane Filtration Products Inc.”, США) с отсечкой по молекулярной массе 3.5 × 103. После диализа водный раствор САГ упаривали до полного высыхания (таблица 1, образцы 1, 3 и 4) или небольшого объема в вакууме на ротационном испарителе и осаждали в этанол. Образовавшийся осадок отфильтровывали, промывали на фильтре этанолом и высушивали на воздухе (образцы 2, 5). Образец 1 получали путем сульфатирования арабиногалактана в диметилсульфоксиде при температуре 85°С в течение 3 ч, образцы 2 и 3 – в 1,4-диоксане при 100°С также в течение 3 ч, а образцы 4 и 5 – в диоксане при 85°С в течение 2 ч.
Таблица 1.
Характеристика сульфатированного арабиногалактана и ИПК
| Образец, № | Сульфатированный арабиногалактан | ИПК | ||||
|---|---|---|---|---|---|---|
| содержание серы, мас. % | степень сульфатирования, % | 1 день после синтеза | 30 дней после синтеза | |||
| размер, нм (PDI) | ζ-потенциал, мВ | размер, нм (PDI) | ζ-потенциал, мВ | |||
| 1 | 13.5 ± 0.2 | 40.8 ± 1 | 439 ± 22 (0.17) |
40 ± 2 | 305 ± 18 (0.19) |
35 ± 2 |
| 2 | 11.7 ± 0.2 | 32.4 ± 1 | 424 ± 18 (0.12) |
39 ± 2 | 404 ± 8 (0.14) |
34 ± 3 |
| 3 | 12.1 ± 0.2 | 34.1 ± 1 | 426 ± 31 (0.14) |
38 ± 2 | 377 ± 11 (0.08) |
26 ± 2 |
| 4 | 4.0 ± 0.5 | 8.1 ± 1 | 334 ± 11 (0.20) |
38 ± 1 | 216 ± 11 (0.12) |
22 ± 2 |
| 5 | 3.8 ± 0.5 | 7.7 ± 1 | 328 ± 7 (0.20) |
38 ± 4 | 228 ± 3 (0.12) |
32 ± 3 |
Содержание серы и степени сульфатирования арабиногалактана в образцах определяли по модифицированной методике [20] сжиганием их в токе кислорода при температуре 1000°С с последующим поглощением продуктов сжигания 6%-ным водным раствором пероксида водорода. Согласно работе [19], степень сульфатирования (СС) рассчитывали по формуле:
(1)
${\text{CC}}\, = \,\frac{{{{М}_{{{\text{САГ}}}}}{{{{W}_{{\text{s}}}}} \mathord{\left/ {\vphantom {{{{W}_{{\text{s}}}}} {100}}} \right. \kern-0em} {100}}}}{{({{М}_{{\text{S}}}}\, - \,({{М}_{{{\text{OS}}{{{\text{O}}}_{{\text{3}}}}{\text{N}}{{{\text{H}}}_{{\text{4}}}}}}}\, - \,{{М}_{{{\text{OН}}}}}){{{{W}_{{\text{s}}}}} \mathord{\left/ {\vphantom {{{{W}_{{\text{s}}}}} {100}}} \right. \kern-0em} {100}})\, \times \,2.8}}\, \times \,100\% $Здесь ${{М}_{{{\text{САГ}}}}}$, ${{М}_{{\text{S}}}}$, ${{М}_{{{\text{OS}}{{{\text{O}}}_{{\text{3}}}}{\text{N}}{{{\text{H}}}_{{\text{4}}}}}}}$ и ${{М}_{{{\text{OН}}}}}$ – молекулярные массы одной условной структурной единицы арабиногалактана, серы, групп OSO3NH4 и OH соответственно; WS – содержание серы (мас. %). Результаты для серии образцов САГ приведены в табл. 1.
Степень дезацетилирования (СД) хитозана устанавливали из ИК-спектров поглощения по методике [21]:
где A1655, A3430 – оптические плотности на соответствующих значениях волновых чисел (см-1).За основу синтеза интерполимерных комплексов взяли методику, использованную ранее для хитозана и другого сульфатированного биополимера – хондроитин сульфата при близком значении pH [22, 23].
Для приготовления раствора хитозана применяли ацетатный буфер pH 5.40 ± 0.03 и ионной силой 0.15 моль/л. Раствор хитозана (0.1 мас. %) предварительно очищали от нерастворимых примесей с помощью бумажных фильтров, после чего к нему добавляли по каплям 0.1 мас. % водный раствор САГ (pH 5.40 ± 0.10) до появления опалесценции, объемное соотношение растворов хитозана и арабиногалактана составляло 2 : 1. Растворы интенсивно перемешивали с помощью магнитной мешалки в течение 2 ч. Молекулярную полимерную фракцию от коллоидного раствора интерполимерных комплексов отделяли путем седиментации с помощью центрифуги “Eppendorf Mini Spin Plus” (Германия) в течение 5 мин (14 500 об/мин). После удаления молекулярной фракции осадок ресуспензировался в ультразвуковой ванне “Elma Elmasonic S-30H” (Германия) в течение 30 мин при комнатной температуре в безбуферном водном растворе (pH 5.4 ± 0.10). Концентрацию ИПК оценивали путем взвешивания сухого остатка: для всей серии экспериментов она составляла 0.4–0.8 г/л. На основании средних молекулярных масс полимеров стехиометрическое соотношение макромолекул хитозана к сульфатированному арабиногалактану в ИПК примерно 1 : 3:
ИК-спектры хитозана, сульфатированного арабиногалактана и ИПК снимали с использованием ИК-фурье-спектрометра “Tensor-27” (“Bruker”, Германия) в области длин волн 400–4000 см–1. Твердые образцы для анализа готовили в виде таблеток в KBr (~2 мг образца/1000 мг KBr). ИК-спектры интерполимерных комплексов измеряли в первые три дня после синтеза.
Морфологию ИПК исследовали с применением сканирующего электронного микроскопа S-5500 (“Hitachi”, Япония). Для этого каплю разбавленного раствора ИПК в первый день после синтеза наносили на кремниевые подложки и высушивали.
Распределение частиц ИПК по размерам выполняли методом динамического рассеяния света с использованием “Zetasizer Nano ZS” (“Malvern Instruments Ltd.”, Великобритания). Угол рассеяния составлял 173°; длина волны лазерного излучения 532 нм. Исследования автокорреляционной функции осуществляли методом кумулянтного анализа. Каждый образец измеряли в трех сериях с двадцатью повторениями в каждой серии. Устанавливали ζ-потенциал частиц на этом же приборе методом электрофоретического рассеяния света; данные собирали в четырех сериях по пятьдесят повторений в каждой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для синтеза ИПК было использовано 5 образцов арабиногалактана, полученных в различных условиях и отличающихся степенью сульфатирования (табл. 1).
Об образовании комплексов свидетельствуют данные сканирующей электронной микроскопии (рис. 1) и ИК-спектроскопии (рис. 2). На микрограмме видны отдельно расположенные частицы ИПК, неоднородные по размерам и форме в субмикронном диапазоне.
Рис. 2.
ИК-спектры САГ (1), хитозана (2) и ИПК (3), полученного на основе образца 2 сульфатированного арабиногалактана, указанного в табл. 1.
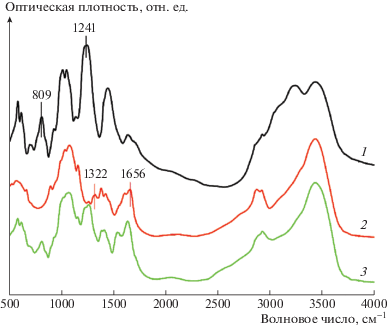
ИК-полосы хитозана и САГ во многом схожи благодаря их подобной структуре. Типичные для полисахаридов полосы могут быть идентифицированы в областях 3435, 2921–2924 и 1047–1075 см–1. Однако можно выделить характеристичные линии, присущие каждому полисахариду в отдельности. Для идентификации хитозана наглядными представляются полосы поглощения для амидных групп: 1656 (амид I) и 1322 см–1 (амид III). Показательным индикатором сульфатного замещения в арабиногалактане считается появление пика поглощения ~1241 см–1, соответствующего S=O асимметричным валентным колебаниям и пика при 809 см–1, характерного для валентных колебаний C–O–S. В интерполимерном комплексе эти линии оказываются смещенными по сравнению с исходными компонентами из-за взаимодействий, ведущих к комплексообразованию. Характерные пики поглощения амида I и S=O асимметричных валентных колебаний для ИПК лежат на 1633 и 1259 см–1 соответственно. Пик поглощения амида III исчезает, а для пика валентных колебаний C–O–S достоверного смещения не обнаружено.
Распределение частиц ИПК по размерам в первый день после синтеза показано на рис. 3. Видно мономодальное распределение частиц по размерам, максимум которого приходится на 330–440 нм. Эти данные не противоречат результатам микроскопических исследований. Показано, что размер частиц коррелирует со степенью сульфатирования арабиногалактана, входящего в его состав (рис. 3, вставка).
Рис. 3.
Распределение частиц ИПК по размерам, синтезированных из образцов сульфатированного арабиногалактана 1–5 в соответствии с табл. 1. На вставке показана зависимость среднего размера ИПК от степени сульфатирования арабиногалактана, входящего в его состав.
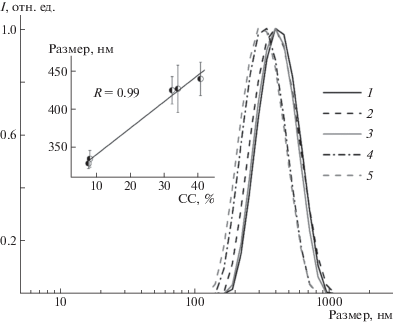
Следует отметить, что образцы ИПК как с низкой (7.7–8.1%), так и с высокой степенью сульфатирования (32.4–40.8%) в первый день имеют близкое значение ζ-потенциала (~40 мВ), которое удовлетворяет требованиям коллоидной стабильности (ζ-потенциал >30 мВ [24]). С течением времени происходит уменьшение размеров не только самих частиц, но и их ζ-потенциала (рис. 4). При этом ζ-потенциал ИПК на основе образцов 1, 2, 5 уменьшается не более чем на 15% и не преодолевает критического значения для коллоидно-стабильных частиц, а ζ-потенциал ИПК на основе образцов 3 и 4 снижается на 31–42% и преодолевает этот порог. Эти результаты не коррелируют со степенью сульфатирования арабиногалактана и могут быть связаны со способом синтеза самого САГ. Так, наиболее стабильными оказались невысажденные образцы и образец, синтезированный с использованием диметилсульфоксида. Предположительно, это связано со спецификой высаживания САГ, которая может косвенно влиять на молекулярную массу выделенной фракции полисахарида, а также с остатками прекурсоров синтеза.
Рис. 4.
ζ-Потенциал (а) и размер (б) ИПК, синтезированных из образцов сульфатированного арабиногалактана в соответствии с таблицей: 1 – 1 день, 2 – 30 дней после синтеза. Штриховой линией показан уровень, отвечающий требованию коллоидной стабильности.
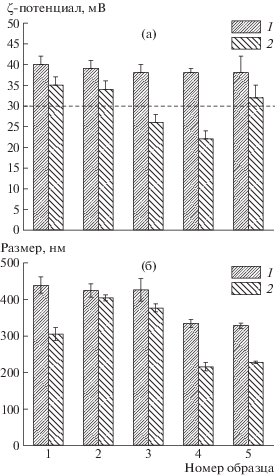
Уменьшение размеров частиц со временем возможно из-за их коллоидной нестабильности и выпадения в осадок наиболее крупных из них. Однако наименьшему изменению размеров оказались подвержены ИПК на основании образцов 2 и 3 (изменение 5–12%), в то время как средний размер частиц на основе образцов 1, 4 и 5 уменьшился на 30–35%. Это свидетельствует о более сложной связи между стабильностью размеров и ζ-потенциала. Как показано в работе [25], формирование полиэлектролитных комплексов состоит из нескольких этапов: начальное формирование полиэлектролитных комплексов, формирование новых внутренних связей, межкомплексная агрегация. Разделение этих этапов является сложной задачей. Полученные в настоящей работе показатели по стабильности частиц (например, для образца 2 изменение размера и ζ-потенциала за 30 дней не превышает 5 и 15% соответственно) сопоставимы или улучшены по сравнению с другими полиэлектролитными комплексами на основе хитозана [26, 27].
Образование ИПК рассмотрено с точки зрения анализа электростатического механизма связывания двух биополимеров. Подобный количественный анализ был сделан ранее в работе [26]. Эффективность электростатического связывания зависит от количества заряженных групп биополимеров, определяемых константами диссоциации при заданных условиях (pKa). Так, величина pKa для аминогрупп хитозана составляет 6.2–6.8 [28]. Для сульфогрупп арабиногалактана она может быть взята равной 1.5–2.0 по аналогии с сульфогруппами хондроитин сульфата [29]. Степень диссоциации α полиэлектролитов выражается уравнением Хендерсона–Хассельбаха, описывающим соответствие между pH и pKa:
Согласно этому уравнению, при pH 5.4 значение α для хитозана составляет 75%, а для САГ 78%. Учитывая средние молекулярные массы полимеров, степень дезацетилирования хитозана (88%) и степень сульфатирования арабиногалактана (7.7%–40.8%), а также массовое соотношение биополимеров при смешивании, получаем оценку соотношения положительно заряженных групп хитозана к отрицательно заряженным группам САГ – от 4 : 1 до 21 : 1. Смесь противоположно заряженных полиионов привела к образованию нестехиометрических комплексов, которые обычно состоят из нейтрального ядра и избыточных полиионных цепей [30]. Поскольку положительно заряженные аминогруппы хитозана находятся в избытке по сравнению с отрицательно заряженными группами САГ, то ζ-потенциал частиц оказывается положительным.
Увеличение размера ИПК (рис. 3) и уширение распределения частиц по размерам при повышении степени сульфатирования (для образцов с низкой степенью сульфатирования ширина на полувысоте составляет 340 нм, а для высокой 410–420 нм) указывает на то, что в образовании частиц с высокой степенью сульфатирования участвует бóльшее число молекул полисахаридов и(или) частицы имеют более рыхлую структуру. Кроме того, образование подобных комплексов зависит не только от электростатических, но и гидрофобных взаимодействий. Ранее [30] это было показано на примере комплексообразования сульфопроизводных лигнина и хитозана.
Полученные интерполимерные комплексы обладают положительным поверхностным зарядом, имеют стабильные коллоидные свойства, а также содержат в своем составе биополимеры с известной биологической активностью. Подобные системы могут быть использованы в качестве биосорбентов органических соединений или тяжелых металлов, а также систем доставки лекарств [31–33].
Авторы выражают благодарность Красноярскому региональному центру коллективного пользования “Красноярский научный центр Сибирского отделения РАН” за снятие ИК-спектров и проведение микроскопических измерений.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, правительства Красноярского края и Красноярского краевого фонда науки (код проекта 18-43-242003).
Список литературы
Berger J., Reist M., Mayer J.M., Felt O., Gurny R. // Biopharmaceutics. 2004. V. 57. № 1. P. 35.
Du W.L., Xu Z.R., Han X.Y., Xu Y.L., Miao Z.G. // J. Hazard. Mater. 2008. V. 153. P. 152.
Wang R., Jiang X., He A., Xiang T., Zhao C. // RSC Adv. 2015. V. 5. P. 51631.
Prabaharan M., Mano J.F. // Drug Delivery. 2004. V. 12. P. 41.
Krayukhina M.A., Samoilova N.A., Yamskov I.A. // Russ. Chem. Rev. 2008. V. 77. № 9. P. 799.
Kumar G.V., Su C.-H., Velusamy P. // Mater. Lett. 2016. V. 12. P. 119.
Lai C.K., Lu Y.L., Hsieh J.T., Tsai S.C., Feng C.L., Tsai Y.S., Tsai P.C., Su H.L., Lin Y.H., Lai C.H. // Nanomedicine (Lond). 2014. V. 9. P. 803.
Grenha A., Gomes M.E., Rodrigues M., Santo V.E., Mano J.F., Neves N.M., Reis R.L. // J. Biomed. Mater. Res. A. 2010. V. 92. № 4. P. 1265.
Rodrigues S., Rosa da Costa A.M. // Grenha, Carbohydr. Polym. 2012. V. 89. P. 282.
Abdullah T.A., Ibrahim N.J., Warsi M.H. // Int. J. Pharm. Investig. 2016. V. 6. P. 96.
Santo V.E., Gomes M.E., Mano J.F., Reis R.L. // J. Tissue Eng. Regen. M. 2012. V. 6. P. 47.
Lallana E., De La Rosa J.R., Tirella A., Pelliccia M., Gennari A., Stratford I., Puri S., Ashford M., Tirelli N. // Mol. Pharmaceut. 2017. V. 14. P. 2422.
Костыро Я.Н., Силизерцева О.А., Искра А.И., Петрова Е.Н., Корякина Л.Б., Верещагина С.А., Фадеева Т.Б., Алексеев К.В., Гуменникова Е.Н., Костыро В.В., Ганенко Т.В., Станкевич В.К., Трофимов Б.А. // Бюлл. ВСНЦ СО РАМН. 2011. Т. 80. № 4. С. 249.
Медведева Е.Н., Бабкин В.А., Остроухова Л.А. // Химия растительного сырья. 2003. № 1. С. 27.
Ehrenfreund-Kleinman T., Domb A.J., Golenser J. // J. Bioact. Compat. Polym. 2003. V. 18. P. 323.
Vasil’eva N.Y., Levdanskya A.V., Kuznetsova B.N., Skvortsova G.P., Kazachenko A.S., Djakovitch L., Pinel C. // Russ. J. Bioorg. Chem. 2015. V. 41. № 7. P. 725.
Костыро Я.А., Ковальская Г.Н. // Бюлл. ВСНЦ СО РАМН. 2008. Т. 60. № 2. С. 117.
Дрозд Н.Н., Кузнецова С.А., Лапикова Е.С., Давыдова А.И., Макаров В.А., Кузнецов Б.Н., Бутылкина А.И., Васильева Н.Ю., Скворцова Г.П. // Экспер. клин. фармакол. 2008. Т. 71. № 4. С. 30.
Черонис Н.Д., Ма Т.С. Микро- и полумикрометоды органического функционального анализа / Пер. с англ. под ред. В.А. Климовой. М.: Химия, 1973.
Бабкин В.А., Неверова Н.А., Медведева К.Н., Федорова Т.Е., Левчук А.А. // Химия растительного сырья. 2015. № 2. С. 29.
Czechowska-Biskup R., Jarosińska D., Rokita B., Ulański P., Rosiak J.M. // Prog. Chem. Appl. Chitin. Deriv. 2012. V. 17. P. 5.
Slyusareva E., Gerasimova M., Plotnikov A., Sizykh A. // Colloid Int. Sci. 2014. V. 417. P. 80.
Slyusareva E., Gerasimova M., Slabko V., Abuzova N., Plotnikov A., Eychmìller A. // Phys. Chem. Chem. Phys. 2015. V. 16. P. 3997.
Boddohi S., Moore N., Johnson P.A., Kipper M.J. // Biomacromolecules. 2009. V. 10. P. 1402.
Kulkarni A.D., Vanjari Y.H., Sancheti K.H., Patel H.M., Belgamwar V.S., Surana S.J., Pardeshi C.V. // Artif. Cells Nanomed. Biotechnol. 2016. V. 44. P. 1615.
Slyusarenko N., Gerasimova M., Plotnikov A., Gaponik N., Slyusareva E. // Phys. Chem. Chem. Phys. 2019. V. 21. P. 4831.
Jonassen H., Kjøniksen A.-L., Hiorth M. // Biomacromolecules. 2012. V. 13. P. 3747.
Schmuhl R., Krieg H.M., Keizer K. // Water SA. 2001. V. 27. P. 1.
Chandran P., Horkay F. // Acta Biomater. 2012. V. 8. P. 3.
Паламарчук И.А., Бровко О.С., Бойцова Т.А., Вишнякова А.П., Макаревич Н.А. // Химия растительного сырья. 2011. Т. 2. С. 57.
Kyzas G.Z., Bikiaris D.N., Mitropoulosa A.C. // Polym. Int. 2017. V. 66. P. 1800.
Hritsu D., Dodi G., Popa M.I. // IRECHE. 2012. V. 4. № 3. P. 364.
Bernkop-Schnürch A., Dünnhaupt S. // Eur. J. Pharm. Biopharm. 2012. V. 81. P. 463.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)



