Высокомолекулярные соединения (серия Б), 2022, T. 64, № 4, стр. 243-257
НИТРОНЫ И НИТРОЗОСОЕДИНЕНИЯ В РЕАКЦИЯХ СОЧЕТАНИЯ ДЛЯ СИНТЕЗА МАКРОМОЛЕКУЛЯРНЫХ СТРУКТУР НА ОСНОВЕ ПОЛИСТИРОЛА
Е. В. Колякина a, Ф. Х. Шоипова a, Д. Ф. Гришин a, *
a Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр. Гагарина, 23, Россия
* E-mail: grishin@ichem.unn.ru
Поступила в редакцию 05.04.2022
После доработки 13.05.2022
Принята к публикации 27.06.2022
- EDN: FFFSYU
- DOI: 10.31857/S2308113922700097
Аннотация
Раскрыты возможности реакций сочетания полистирола с ω-концевой группой брома в присутствии нитронов и нитрозосоедиений различного строения. На примере сочетания с использованием С-фенил-N-трет-бутилнитрона установлено, что в серии используемых растворителей (толуол, этилацетат, бензол, ацетонитрил и тетрагидрофуран) наиболее предпочтительными являются ацетонитрил и тетрагидрофуран. Данные растворители обладают наибольшей координационной способностью по отношению к каталитической системе на основе бромида меди (I) и позволяют достигать высокой степени сочетания (более 90%) при сохранении низкой дисперсности синтезируемых образцов. Показано, что нитрозосоединения в реакции сочетания полистирола способствуют образованию концевых нитроксильных фрагментов. В отличие от нитрозосоединений, нитроны позволяют получать симметричные высокомолекулярные алкоксиамины, содержащие в центре полимерной цепи нитроксильный фрагмент.
ВВЕДЕНИЕ
Функционализация полимерных материалов путем использования методов контролируемой радикальной полимеризации (КРП) – актуальное направление современной синтетической химии полимеров [1–4]. Среди методов проведения КРП синтез полимеров по механизму переноса атома является одним из наиболее эффективных способов модификации полимерной цепи и осуществления макромолекулярного дизайна с целью получения полимеров определенной архитектуры и топологии [5–8]. Так, ω-концевой атом галогена в полимерной цепи может быть преобразован в другие концевые функциональные группы с использованием реакций нуклеофильного замещения или электрофильного присоединения, а также за счет радикальных реакций замещения или присоединения:
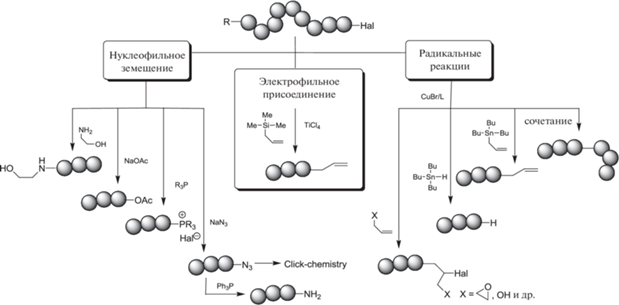
Наиболее простой способ модификации полимерной цепи заключается в сочетании радикалов по механизму переноса атома. Данным методом получают макромолекулы симметричной структуры с удвоенной молекулярной массой, телехелики, Н-образные, макроциклические и мультиблочные продукты, а при использовании агентов обратимой передачи цепи и нитроксилов возможен синтез полимеров с различными концевыми группами [9].
Особое внимание заслуживают работы, посвященные реакциям сочетания полимерных цепей, основанные на использовании спиновых ловушек, включая нитроны и нитрозосоединения. Описываемые процессы назвали радикальное сочетание путем переноса атома с помощью ловушки. Они позволяют получать симметричные высокомолекулярные алкоксиамины с заданной молекулярной массой, которые в отличие от продуктов сочетания без использования ловушек способны участвовать в дальнейшем росте полимерной цепи при добавлении очередной порции мономера. За счет последующего введения в структуру высокомолекулярных алкоксиаминов этинильных групп и проведения клик-реакций можно получать макромолекулы различной топологии (циклические, дендритные, H-образные и другие) [10–21]:
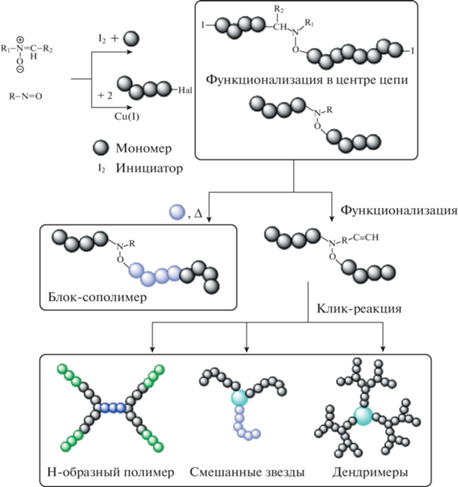
Следует отметить, что эффективность реакций сочетания макрорадикалов с участием спиновых ловушек была показана раннее в работах [22–31]. Рядом исследовательских коллективов предлагался оригинальный подход in situ сочетания радикалов роста, генерируемых за счет распада традиционных радикальных инициаторов с участием нитронов, нитрозосоединений и одностадийного формирования высокомолекулярных алкоксиаминов непосредственно в среде мономеров [22–34]. Это направление было развито в более поздних работах C. Barner-Kowollik с коллегами [35, 36]. В целом высокомолекулярные алкоксиамины, образующиеся в результате сочетания макрорадикалов in situ, способны при определенных условиях в дальнейшем участвовать в процессах КРП широкого круга мономеров в комфортных с практической точки зрения температурных условиях (70–90°С) и претерпевать различные функциональные превращения.
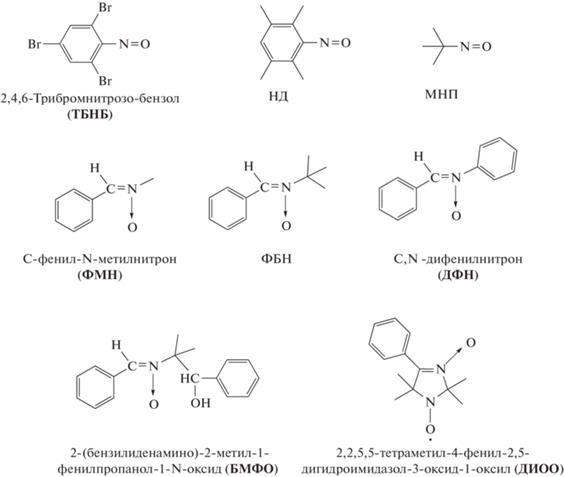
В ряде работ было показано, что строение спиновых ловушек играет существенную роль в in situ образовании высокомолекулярных алкоксиаминов и их использовании в полимеризации широкого круга мономеров [21–33]. Ранее в научных группах C. Barner-Kowollik и E.S. Tillman были исследованы реакции сочетания с применением следующих ловушек: 2-метил-2-нитрозопропана (МНП), С-фенил-N-трет-бутилнитрона (ФБН) [11–15] и нитрозобензола (НБ) [16–19]. В данной работе были использованы не только эти, но и новые ловушки и проведены детальные исследования процессов сочетания в присутствии разных по строению нитрозосоединений и нитронов:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы
Стирол (“Aldrich”) очищали от ингибитора 10%-ным водным раствором гидроксида натрия, отмывали щелочью, затем водой до нейтральной реакции рН промывных вод и сушили над прокаленным хлоридом кальция. После этого перегоняли, собирая фракцию с температурой кипения 48°С при 20 мм рт. ст. Хлористый метилен, изопропиловый спирт и ацетон (“Компонент-реактив”, Россия) осушали прокаленным хлоридом кальция и перегоняли. ТГФ (“Компонент-реактив”, Россия) сушили и перегоняли сначала над NaOH, а затем над металлическим натрием. ДМСО (“Компонент-реактив”, Россия) сушили над NaOH и перегоняли при пониженном давлении. Физико-химические константы всех растворителей соответствовали литературным данным [37].
Спиновые ловушки синтезировали по известным методикам, описанным в следующих литературных источниках: ТБНБ [38], НД [39], MНП [40], ФБН [41], ДФН, ФМН [42], БМФО [43]. Основы синтеза нитрона имидазолинового ряда ДИОО и нитроксильного радикала 2,2,5,5-тетраметил-4-фенил-2,5-дигидроимидазол-1-оксила (ДИО), являющегося структурным аналогом ДИОО, изложены в работе [44]. (1-Бромэтил)бензол (БЭБ) синтезировали по методике [45]. N,N,N',N'',N''-пентаметилдиэтилентриамин (ПМДЭТА) (“Sigma Aldrich”) использовали без предварительной очистки. Бромид меди (I) и бромид меди (II) (“Sigma-Aldrich”) применяли без предварительной очистки. Медь (0) использовали в виде медной проволоки, которую активировали раствором соляной кислоты.
Синтез образцов полистирола полимеризацией с переносом атома
Навеску катализатора бромида меди (I) (0.0499 г, 0.348 ммоля) помещали в ампулу, снабженную магнитной мешалкой. Добавляли необходимое количество стирола (2 мл, 0.0174 моль), инициатора БЭБ (47.5 мкл, 0.348 ммоля) и ПМДЭТА (72.5 мкл, 0.348 ммоля), чтобы получить мольное отношение компонентов [стирол] : [ПМДЭТА] : [CuBr] : [БЭБ] = 50 : 1 : 1 : 1. В ампулу приливали 2 мл ТГФ (50 об. %). Заполненные ампулы присоединяли к вакуумной установке, дегазировали до остаточного давления 2 × 10–2 мм рт. ст. путем трехкратного замораживания–дегазирования–размораживания в жидком азоте. Дегазированную ампулу запаивали и помещали в термостат с температурой 80°С на определенное время. По истечении времени ампулу вскрывали и окисляли комплексы меди на воздухе. Затем очищали полимер от остатков катализатора адсорбционной хроматографией на силикагеле марки “ACROS” 0.035–0.070 мм, элюентом служил ТГФ. Образцы высаживали из раствора TГФ в изопропиловый спирт. Синтезированные полимеры сушили до постоянной массы при пониженном давлении при 50°С, а затем исследовали методом ГПХ.
Проведение реакций сочетания с участием и без участия ловушек
Для проведения реакции сочетания брали точные навески синтезированного полистирола (например, для полимера с Мn = 2260–0.0339 г, 0.015 ммоля), CuBr (0.0108 г, 0.075 ммоля), активированной Cu (0) (0.0048 г, 0.075 ммоля) и загружали в ампулу с магнитной мешалкой. В отдельной колбе готовили раствор, содержащий 16 мкл ПМДЭТА (0.075 ммоля) в 2 мл ТГФ, и переливали его в ампулу. Получали отношение компонентов [ПС] : [ПМДЭТА] : [CuBr] : [Cu] = 1 : 5 : 5 : 5. Для проведения реакции сочетания с участием ловушки брали аналогичные навески ПС, CuBr и Cu (0), а также спиновую ловушку (от 0.0075 до 0.075 ммоля) и все компоненты загружали в ампулу с магнитной мешалкой. В отдельной колбе готовили раствор, содержащий 16 мкл ПМДЭТА (0.075 ммоля) в 2 мл TГФ, и приливали его в ампулу, получая отношение компонентов [ПС] : [ПМДЭТА] : : [CuBr] : [Cu] : [спиновая ловушка] = 1 : 5 : 5 : 5 : (от 1 до 5).
Приготовление ампул и проведение реакций сочетания вели при 50 и 80°С аналогично тому, как описано для синтеза ПС.
Степень (эффективность) сочетания вычисляли по формулам:
где Mn,0 и Mn – среднечисленные молекулярные массы исходного гомополимера и полимера, полученного по реакции сочетания, Mp,0 и Mp – наиболее вероятные молекулярные массы пика исходного гомополимера и полимера, полученного по реакциям сочетания.Деструкция продуктов сочетания
Навеску полимера 0.010 г загружали в ампулу, растворяли в 1 мл ДМСО и помещали в термостат с температурой 130°С. Деструкцию проводили на воздухе в течение 10 ч. Для анализа молекулярно-массовых характеристик полимеров производили замену ДМСО на ТГФ.
Анализ молекулярно-массовых характеристик полимеров
Молекулярно-массовые характеристики полимеров определяли методом ГПХ на жидкостном хроматографе “Knauer”, снабженном каскадом колонок “Phenomenex” (300 мм × 7.8 мм, феногель, 10 мкм) с диаметром пор 105 и 103 Å и двумя детекторами (рефрактометрическим и УФ). Элюентом служил ТГФ, температура колонки 25.0 ± 0.1°С. Для калибровки применяли узкодисперсные стандарты ПС.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Нитроны и нитрозосоединения находят широкое применение не только при исследовании радикальных процессов методом ЭПР, но и в синтетической органической химии, в частности они способны реагировать с электрофильными и нуклеофильными агентами, а также вступать в реакции 1,3-диполярного присоединения [46]. Указанные реакции позволяют рассматривать спиновые ловушки как перспективные реагенты – своеобразные строительные блоки в разных синтетических стратегиях, включая синтез разветвленных макромолекулярных структур [21, 32–34].
Нами были исследованы закономерности протекания реакции сочетания в присутствии спиновых ловушек различного строения, перечисленных выше.
Особенности процессов сочетания на основе полистирола с ω-концевой группой брома в среде различных растворителей
Разработку методики проводили на примере полистирола как модельного полимера, синтезированного полимеризацией с переносом атома и содержащего на конце цепи атом брома. Реакция сочетания бромсодержащих макромолекул приводит к удвоению молекулярной массы полимера. При этом в случае участия в процессе синтеза спиновых ловушек получаются высокомолекулярные алкоксиамины – макромолекулы с нитроксильным фрагментом внутри цепи:
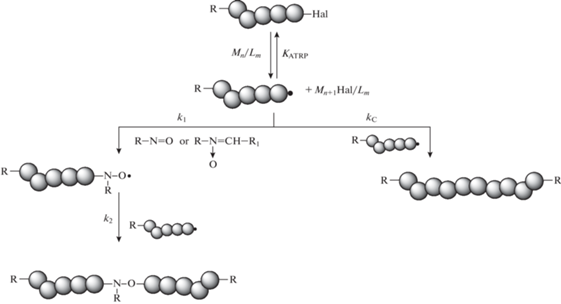
Здесь KATRP – константа равновесия, kС – константа скорости рекомбинации, k1 – константа скорости акцептирования активных радикалов нитронами или нитрозосоединениями, k2 – константа скорости обрыва активных радикалов на нитроксильном радикале.
При проведении сочетания ПС с использованием ФБН при 80°С и отношении компонентов [ПС] : [ПМДЭТА] : [CuBr] : [Cu] : [ФБН] = 1 : 5 : : 5 : 5 : 5 использовали следующие растворители: толуол, этилацетат, бензол, ацетонитрил и ТГФ. Установлено, что наилучшая растворимость CuBr (I) наблюдалась в ацетонитриле и ТГФ в присутствии ПДЭТМА. В других растворителях бромид меди (I) даже с дополнительным введением в систему ПДЭТМА растворим в меньшей степени. Строго говоря, ацетонитрил является “плохим” растворителем для ПС. Однако поскольку растворимость катализаторов в нем высокая, нам представлялось возможным исследовать реакции сочетания и в этом растворителе. Полученные экспериментальные данные по реакциям сочетания в присутствии различных растворителей представлены в табл. 1.
Таблица 1.
Влияние природы растворителя на реакцию сочетания ПС (Mn = 1.4 × 103, Ð = 1.40)
| Растворитель | Mn × 10–3 | Ð | Mp × 10–3 | χc | χp |
|---|---|---|---|---|---|
| Толуол | 1.7 | 1.39 | 2.1 | 0.41 | 0.17 |
| Этилацетат | 1.7 | 1.42 | 2.2 | 0.44 | 0.29 |
| Бензол | 2.1 | 1.38 | 3.3 | 0.68 | 0.85 |
| Ацетонитрил | 2.5 | 1.27 | 3.6 | 0.90 | 0.93 |
| ТГФ | 2.5 | 1.30 | 3.7 | 0.90 | 0.98 |
Межмолекулярное взаимодействие между компонентами системы и растворителем, определяемое общим понятием “сольватация”, обусловлено неспецифическими (электростатическими) и специфическими (химическими) взаимодействиями. К первой группе взаимодействий относят ориентационные, индукционные и дисперсионные силы. Химическое взаимодействие определяется образованием комплексов донорно-акцепторного типа или водородной связи между реагентами системы и растворителем. В табл. 2 представлены основные характеристики используемых растворителей, определяющие их сольватирующую способность.
Таблица 2.
| Растворитель | Диэлектрическая проницаемость | Дипольный момент, Д | Донорное число | Акцепторное число | Нормализо-ванный параметр полярности |
|---|---|---|---|---|---|
| Бензол | 2.3 | 0 | 3.5 | 8.2 | 0.11 |
| Толуол | 2.4 | 0.43 | 3.9 | 3.3 | 0.10 |
| Этилацетат | 6.0 | 1.81 | 17.1 | 9.3 | 0.23 |
| Ацетонитрил | 37.5 | 3.50 | 14.1 | 18.9 | 0.46 |
| ТГФ | 7.4 | 1.70 | 20.0 | 8.0 | 0.21 |
Ключевым моментом процессов сочетания является смещение равновесия в реакции активации спящих цепей с концевым атомом галогена в сторону образования радикалов за счет увеличения количества активатора (Mn/Lm) или уменьшения количества дезактиватора (Mn+1Hal/Lm). В случае полного подавления диспропорционирования радикалов роста и передачи цепи протекает бимолекулярное сочетание радикалов. Можно ожидать, что значимую роль в реакции сочетания будут играть комплексообразователь (ПМДЭТА) и растворитель. ПМДЭТА выполняет ряд важных функций: увеличивает растворимость каталитической системы, повышает активность и стабильность катализатора, а также регулирует равновесие в реакции переноса атома. Из данных табл. 1 можно сделать вывод о том, что природа растворителя влияет на эффективность протекания реакций сочетания с участием ловушки. Растворитель дополнительно может играть роль комплексообразователя и таким образом влиять на выход продукта сочетания. В случае использования толуола и этилацетата степень сочетания вдвое меньше, чем в ТГФ и ацетонитриле. Однако четкой взаимосвязи физических характеристик растворителей со степенью сочетания не прослеживается. Отметим некую общую закономерность сочетания ПС в различных средах: наибольше влияние на эффективность процесса оказывают растворимость CuBr и CuBr2 и донорно-акцепторные свойства растворителей, а не растворимость полимера. Так, при проведении реакции в этилацетате, обладающим хорошей растворяющей способностью по отношению к ПС и высоким донорным числом, наблюдается меньшая доля продуктов сочетания (χp = 0.29), по сравнению с ацетонитрилом (χp = 0.93). Последний является “плохим” растворителем для полимера, но хорошо растворяет CuBr и CuBr2 и способен образовывать комплексы с медью. Несмотря на то, что сочетание ПС в ацетонитриле протекает в гетерогенных условиях в отличие от ТГФ, степень сочетания в данных растворителях практически сопоставима за счет хорошей растворимости соединений меди. Кривые ММР для продуктов сочетания в ацетонитриле и ТГФ (рис. 1, кривые 5 и 6) унимодальные, и наиболее вероятная молекулярная масса пика для них вдвое выше по сравнению с исходным ПС (кривая 1). Следовательно, хорошая растворимость компонентов каталитической системы и возможное участие растворителей в качестве лигандов играют важную роль в реализации процесса сочетания.
Рис. 1.
ММР исходного ПС (1), а также продуктов реакции сочетания ПС в присутствии ФБН при 80°C в течение 30 мин в толуоле (2), этилацетате (3), бензоле (4), ацетонитриле (5) и ТГФ (6).
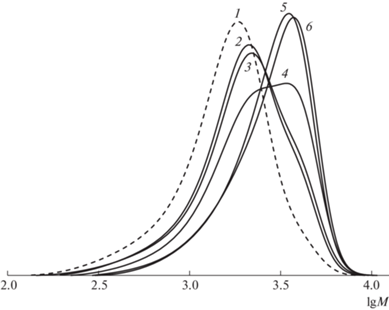
Отметим особенности реакции сочетания в неполярных и слабо полярных растворителях – бензоле и толуоле. Несмотря на близкие параметры полярности и донорно-акцепторные свойства данных растворителей и достаточно плохую растворяющую способность по отношению к металлсодержащему катализатору, закономерности реакции сочетания в этих средах отличаются. В присутствии бензола степень сочетания ПС существенно выше, чем в толуоле. Следует обратить внимание, что кривая ММР продуктов сочетания в бензоле бимодальная и сдвинута в область более высоких ММ по сравнению с кривой исходного полимера (кривая 4). Кривая ММР продуктов в толуоле (кривая 2) также сдвинута в область высоких ММ, однако на ней наблюдается лишь слабо выраженное плечо в высокомолекулярной области. Аналогичная картина характерна для продукта реакции сочетания в этилацетате (кривая 3). Остается открытым вопрос о причинах разного протекания реакций в растворителях с близкими физико-химическими характеристиками – толуоле и бензоле. На наш взгляд, это может быть обусловлено стерическим влиянием метильной группы толуола и “слабым” межмолекулярным нековалентным взаимодействием с ПС с атомом брома на конце цепи [50] или π-координацией с комплексами меди, которая предполагается в случае протекания известной реакции Ульмана [51].
В целом установлено, что растворитель оказывает непосредственное влияние на эффективность реакции сочетания в присутствии ФБН. Такие растворители, как ТГФ и ацетонитрил, обладающие наибольшей растворяющей способностью по отношению к соединениям меди и координационной способностью за счет наличия гетероатомов, содержащих неподеленные электронные пары, оптимизируют процессы сочетания с участием спиновых ловушек. Для исследования других систем нами в качестве растворителя был выбран ТГФ, который позволяет проводить реакцию сочетания ПС в гомогенных условиях.
Мононитроны циклического и ациклического строения в реакциях сочетания
Роль структуры спиновых ловушек в процессах сочетания исследовали на примере широкого круга нитронов, представленных выше. Влияние условий реакции, а именно: температуры, общей концентрации реагентов и ММ исходного ПС на степень сочетания были исследованы на примере ФБН. Полученные данные приведены в табл. 3.
Таблица 3.
Влияние условий на реакцию сочетания и молекулярно-массовые характеристики ПС в присутствии ФБН
| Образец, № | ПС | V(ТГФ), мл | Нитрон | Т, °С | Mn × 10–3 | Ð | Mp × 10–3 | χc | χp |
|---|---|---|---|---|---|---|---|---|---|
| 1 | ПС-1 | 1 | – | 50 | 2.8 | 1.27 | 3.2 | 0.37 | 0.12 |
| 2 | Mn = 2.3 × 103, Ð = 1.30 | 1 | ФБН | 50 | 3.1 | 1.28 | 3.5 | 0.53 | 0.25 |
| 3 | 2 | – | 50 | 2.6 | 1.20 | 3.3 | 0.29 | 0.16 | |
| 4 | 2 | ФБН | 50 | 3.7 | 1.27 | 5.5 | 0.77 | 0.90 | |
| 5 | 1 | – | 80 | 2.8 | 1.29 | 3.1 | 0.41 | 0.04 | |
| 6 | 1 | ФБН | 80 | 4.0 | 1.18 | 5.5 | 0.88 | 0.90 | |
| 7 | 2 | – | 80 | 2.9 | 1.24 | 3.4 | 0.47 | 0.21 | |
| 8 | 2 | ФБН | 80 | 3.8 | 1.23 | 5.5 | 0.82 | 0.89 | |
| 9 | ПС-2 | 2 | ФБН | 80 | 6.5 | 1.32 | 9.8 | 0.77 | 0.87 |
| Mn = 4.0 × 103Ð = 1.52 |
Реакцию сочетания проводили при 50 и 80°C. Нами было исследовано влияние общей концентрации всех компонентов на степень сочетания χc и χр, так как при одинаковой скорости отрыва атома галогена от ПС скорость процесса прямо пропорциональна скорости димеризации макрорадикалов (kС[Pn•]2), а скорость сочетания в присутствии ФБН лимитируется стадией акцептирования радикалов роста спиновой ловушкой и не зависит от скорости рекомбинации радикалов роста (k1[Pn•][ФБН]). Установлено, что наибольшее влияние концентрации всех компонетов системы проявляется при 50°C. Когда система обладает большей вязкостью (1 мл ТГФ), степень сочетания в присутствии ФБН лишь на 10% выше, чем в отсутствие ФБН (табл. 3, образцы 1 и 2). Разбавление системы в два раза позволяет увеличить степень сочетания ПС в присутствии ФБН (образцы 3 и 4). При 80°C вязкость раствора ниже и значение χc и χp в целом возрастает (образцы 5–8). Вероятно, это обусловлено оптимальным соотношением констант скоростей активации макрорадикалов и их акцептирования спиновой ловушкой.
На рис. 2 представлены кривые молекулярно-массового распределения ПС, полученного в условиях в отсутствие и присутствии ФБН. В первом случае кривая ММР бимодальная: низкомолекулярная мода соответствует исходному полимеру, а высокомолекулярная отвечает продуктам реакции сочетания. Во втором случае кривая ММР унимодальная и сдвинута в область высоких ММ.
Рис. 2.
ММР исходного ПС (1) и продуктов реакций сочетания в отсутствие ФБН (2) и в его присутствии (3) при 80°C в 1 мл ТГФ (табл. 3, образцы 5 и 6).
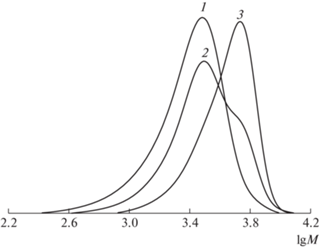
Анализируя процессы сочетания в присутствии ФБН на примере ПС-1 и ПС-2 с разными ММ, отметим, что в обоих случаях наблюдается увеличение ММ полимера и сужение ММР, свидетельсвующее об эффективности реакции сочетания (образцы 8 и 9).
Влияние структуры нитронов на сочетание ПС (Mn = 2.3 × 103, Ð = 1.30) исследовали на примере ряда ациклических и циклического соединений, представленных выше в температурном интервале 50–80°C в 2 мл ТГФ. Реакцию проводили в течение 2 ч при [ПС] : [ПМДЭТА] : [CuBr] : [Cu] : : [НТ] = 1 : 5 : 5 : 5 : 5. Как видно из данных, приведенных в табл. 4, наличие пространственного заместителя в структуре нитрона при атоме азота приводит к уменьшению степени сочетания полимерных радикалов. При 50°C степень сочетания уменьшается в ряду ДФН > ФБН > БМФО. При более высокой температуре степень сочетания понижается в зависимости от структуры нитрона в следующем ряду: ФМН–ФБН–ДФН–БМФО–ДИОО. Установлено, что вне зависимости от используемой концентрации нитрона (табл. 4, образцы 10 и 11) и температуры (образцы 4 и 15), для ФМН и ДФН, как и в случае использования ФБН, наблюдаются высокие степени сочетания.
Таблица 4.
Влияние условий реакции сочетания на эффективность и молекулярно-массовые характеристики ПС
| Образец, № | Реакция | Нитрон | Т, °С | Mn × 10–3 | Ð | Mp × 10–3 | χc | χp |
|---|---|---|---|---|---|---|---|---|
| 1 | Сочетание | – | 50 | 2.6 | 1.20 | 3.3 | 0.29 | 0.16 |
| 2 | Деструкция | – | 130 | 3.0 | 1.24 | 3.4 | – | – |
| 3 | Сочетание | ФБН | 50 | 3.7 | 1.27 | 5.5 | 0.77 | 0.90 |
| 4 | Сочетание | ДФН | 50 | 4.7 | 1.16 | 6.4 | 1.0 | 1.0 |
| 5 | Деструкция | – | 130 | 2.9 | 1.11 | 3.3 | – | – |
| 6 | Сочетание | БМФО | 50 | 3.3 | 1.22 | 3.6 | 0.65 | 0.3 |
| 7 | Деструкция | – | 130 | 2.3 | 1.15 | 2.6 | – | – |
| 8 | Сочетание | – | 80 | 2.9 | 1.24 | 3.4 | 0.47 | 0.21 |
| 9 | Деструкция | – | 130 | 2.8 | 1.14 | 3.3 | – | – |
| 10* | Сочетание | ФМН | 80 | 3.8 | 1.09 | 5.9 | 0.83 | 0.97 |
| 11 | Сочетание | ФМН | 80 | 4.1 | 1.08 | 5.9 | 0.89 | 0.97 |
| 12 | Деструкция | – | 130 | 2.5 | 1.09 | 3.0 | – | – |
| 13 | Сочетание | ФБН | 80 | 3.8 | 1.23 | 5.5 | 0.82 | 0.89 |
| 14 | Деструкция | – | 130 | 2.6 | 1.17 | 3.0 | – | – |
| 15 | Сочетание | ДФН | 80 | 3.8 | 1.23 | 6.1 | 0.81 | 1.0 |
| 16 | Деструкция | – | 130 | 3.4 | 1.26 | 3.9 | – | – |
| 17 | Сочетание | БМФО | 80 | 3.0 | 1.26 | 3.3 | 0.48 | 0.13 |
| 18* | Сочетание | ДИОО | 80 | 2.7 | 1.17 | 3.3 | 0.36 | 0.18 |
| 19* | Деструкция | – | 130 | 2.6 | 1.11 | 3.0 | – | – |
| 20 | Сочетание | ДИОО | 80 | 2.7 | 1.17 | 3.3 | 0.31 | 0.17 |
| 21 | Деструкция | – | 130 | 2.6 | 1.12 | 3.0 | – | – |
| 22 | Сочетание | ДИО | 80 | 2.6 | 1.18 | 3.2 | 0.24 | 0.11 |
Вместе с тем для БМФО имеет место прямо противоположная зависимость χc от температуры. Так, из данных, представленных в табл. 4 следует, что с увеличением температуры с 50 до 80°С степень сочетания исходного ПС понижается (табл. 4, образцы 6 и 17). Это может быть обусловлено меньшей акцептирующей способностью БМФО, а также достаточно эффективным распадом полимера на основе БМФО при более высоких температурах. Так, ранее нами было показано, что высокомолекулярные алкоксиамины на основе БМФО, генерируемые in situ при радикальном инициировании, способны осуществлять контролируемый процесс полимеризации стирола при 70°С [32].
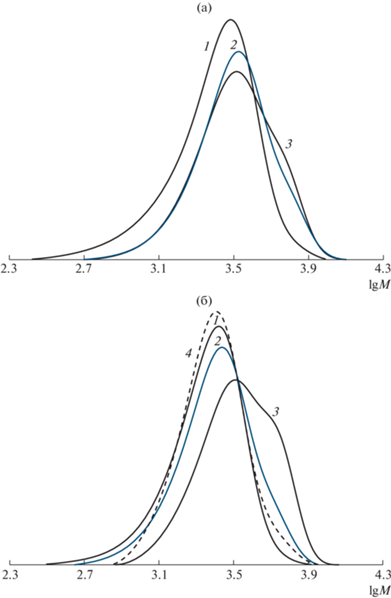
Кривые молекулярно-массового распределения ПС, синтезированного в присутствии БМФО при различных температурах, представлены на рис. 3. Данные кривые четко демонстрируют зависимость степени сочетания ПС от условий проведения процесса. В частности, кривые ММР продуктов сочетания в отсутствие и присутствии ловушки совпадают при проведении реакции при 80°С (рис. 3а). Понижение температуры реакции сочетания до 50°С позволяет увеличить долю макромолекул с удвоенной ММ, о чем свидетельствует появление бимодальности на кривой ММР на рис. 3б. Однако эффективность сочетания остается невысокой.
Рис. 3.
ММР исходного ПС (1), продуктов реакции сочетания в ТГФ в отсутствие БМФО (2) и в его присутствии (3), а также деструкции в ДМСО при 130°C (4). Сочетание проводили при 80 (а) и 50°C (б).
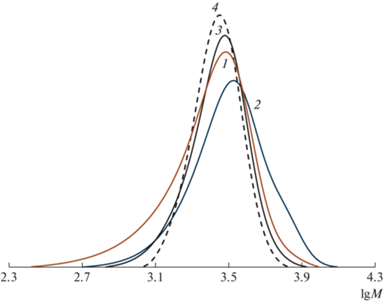
При использовании циклического нитрона – ДИОО степень сочетания в реакции сочетания при [ПС] : [ПМДЭТА] : [CuBr] : [Cu] : [ДИОО] = = 1 : 5 : 5 : 5 : 5 и температуре 80°C составляет всего 0.31 (табл. 4, образец 20). Кривые ММР исходного ПС (кривая 1) и продуктов реакции (кривые 2, 3) представлены на рис. 4. Совпадение кривых ММР и ММ продукта сочетания с участием ДИОО с исходным ПС может указывать на образование полимерного аддукта с нитроксилом вследствие высокого значения константы скорости обрыва на нитроксильном радикале. Димеризации макрорадикалов ПС в данном случае не происходит.
Рис. 4.
ММР исходного ПС (1), а также образцов ПС, полученных после проведения реакций сочетания при 80°C в ТГФ в отсутствие ДИОО (2) и в его присутствии (3, табл. 4, образец 20), а также при деструкции образца 20 в ДМСО при 130°C (4).
Установлено, что и при снижении концентрации ДИОО в пять раз (табл. 4, образец 18) наблюдаются аналогичные закономерности, приводящие к модификации концевого фрагмента цепи ПС, но не к сочетанию макромолекул.
Нами была проведена деструкция полученных полимеров на воздухе в ДМСО при 130°С в течение 10 ч с целью доказать, что в реакции сочетания с участием ловушки образуется димерный продукт, содержащий в центре цепи нитроксильный фрагмент. Как следует из табл. 4, молекулярно-массовые характеристики продуктов до и после деструкции сопоставимы в случае, когда реакцию сочетания проводили без использования ловушки (образцы 1 и 2, 8 и 9). Обратная ситуация – уменьшение ММ полимеров после деструкции наблюдается тогда, когда в реакции сочетания применяли ловушку – ФМН, ФБН, ДФН и БМФО (образцы 4 и 5, 6 и 7, 11 и 12, 13 и 14). Этот результат согласуется с предположением о наличии нитроксильного фрагмента внутри образовавшихся продуктов сочетания. На рис. 5 представлены ММР кривые продуктов сочетания и деструкции, полученных в присутствии ДФН при разной температуре. Из анализа представленных кривых следует, что при использовании ДФН при 50°C преимущественно осуществим процесс сочетания с участием спиновой ловушки и образованием высокомолекулярного алкоксиамина. Кривая, соответствующая образцу деструкции, смещается в область меньших ММ и по форме сходна с кривой исходного ПС, взятого для реакции сочетания (рис. 5а).
Рис. 5.
ММР исходного ПС (1), продуктов, полученных после проведения реакций сочетания в ТГФ при 50 (а) и 80°C (б) без (2) и с участием ДФН (3, образец 4 – а и 15 – б) и при деструкции образцов 4 (а) и 15 (б) в ДМСО при 130°C (4). Образцы 4 и 5 приведены в табл. 4.
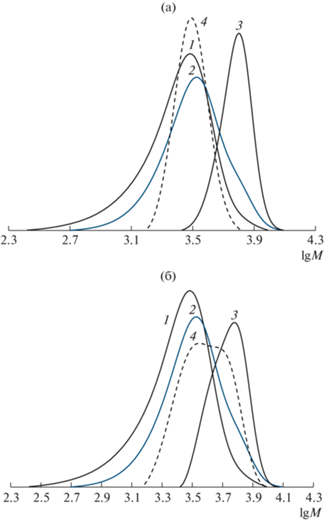
Однако даже в присутствии ловушки возможно образование продуктов рекомбинации двух макрорадикалов. Это подтверждается данными деструкции образцов ПС, полученных при 80°C в присутствии ДФН (табл. 4, образцы 15 и 16) и ДИОО (образцы 18 и 19, 20 и 21). Видно, что средняя ММ перечисленных полимеров не изменяется в процессе деструкции, но она выше ММ исходного ПС, взятого для сочетания. Анализ кривых ММР образца 15, полученного c участием ДФН при 80°C, и его же после деструкции показывает, что процесс сочетания идет по обоим механизмам – образования аддукта с нитроксилом и бимолекулярного обрывом макрорадикалов (рис. 5б).
В целом нами показано, что в присутствии нитронов ациклического ряда процессы сочетания макрорадикалов с образованием симметричных высокомолекулярных алкоксиаминов протекают весьма эффективно. При этом результативность реакции определяется не только структурой выбранного нитрона, в частности их способностью акцептировать макрорадикалы роста [52], но и рядом других праметров, включая температуру, сольватирующую способность растворителя и концентрацию реагентов.
Нитрозосоединения в процессах сочетания полистирола
Нитрозосоединения, как и нитроны, используются в качестве спиновых ловушек, при этом они обладают более высокими значениями констант скоростей акцептирования активных радикалов [52]. Нами была изучена эффективность процессов сочетания ПС в присутствии ароматических нитрозосоединений (НД и ТБНБ) и проведено сравнение с ранее используемой в процессах сочетания алифатической спиновой ловушкой МНП [18, 19]. Реакцию сочетания проводили, используя ПС с Mn = 1.7 × 103, Ð = 1.27, в 2 мл ТГФ в течение 2 ч при [ПС] : [ПМДЭТА] : [CuBr] : [Cu] : : [нитрозосоединение] = 1 : 5 : 5 : 5 : 5 (табл. 5).
Таблица 5.
Молекулярно-массовые характеристики полистирола, полученного с участием нитрозосоединений
| Образец, № | Реакция | Нитрозо-соединение | Т, °С | Mn × 10–3 | Ð | Mp × 10–3 | χc | χp |
|---|---|---|---|---|---|---|---|---|
| 1 | Сочетание | – | 50 | 2.1 | 1.19 | 2.4 | 0.37 | 0.28 |
| 2 | Деструкция | – | 130 | 2.2 | 1.24 | 2.3 | – | – |
| 3* | Сочетание | НД | 50 | 3.0 | 1.28 | 4.4 | 0.88 | 1.0 |
| 4 | Деструкция | – | 130 | 2.0 | 1.15 | 2.2 | – | – |
| 5 | Сочетание | НД | 50 | 3.0 | 1.22 | 4.0 | 0.87 | 0.97 |
| 6 | Деструкция | – | 130 | 1.8 | 1.24 | 2.1 | – | – |
| 7* | Сочетание | ТБНБ | 50 | 3.00 | 1.30 | 4.6 | 0.86 | 1.0 |
| 8 | Деструкция | – | 130 | 1.90 | 1.16 | 2.1 | – | – |
| 9 | Сочетание | ТБНБ | 50 | 2.0 | 1.22 | 2.4 | 0.32 | 0.31 |
| 10 | Деструкция | – | 130 | 1.9 | 1.20 | 2.3 | – | – |
| 11 | Сочетание | – | 80 | 2.3 | 1.17 | 2.3 | 0.53 | 0.25 |
| 12 | Деструкция | – | 130 | 2.1 | 1.11 | 2.3 | – | – |
| 13 | Сочетание | НД | 80 | 2.6 | 1.26 | 3.1 | 0.73 | 0.66 |
| 14 | Деструкция | – | 130 | 2.2 | 1.11 | 2.4 | – | – |
| 15 | Сочетание | ТБНБ | 80 | 2.1 | 1.21 | 2.6 | 0.39 | 0.39 |
| 16 | Деструкция | – | 130 | 2.1 | 1.19 | 2.5 | – | – |
| 17 | Сочетание | МНП | 80 | 2.8 | 1.20 | 3.4 | 0.79 | 0.78 |
| 18 | Деструкция | – | 130 | 1.7 | 1.18 | 2.1 | – | – |
Данные табл. 5 свидетельствуют о том, нитрозосоединения как и нитроны, выступают в роли эффективных акцепторов макрорадикалов и способствуют образованию высокомолекулярных алкоксиаминов с высокой степенью превращения (χc = 0.79–0.88). Следует отметить особое влияние температуры и концентрации нитрозосоединений на эффективность процесса сочетания. Ароматические нитрозосоединения более эффективны при 50°C. Понижение их эффективности при 80°С обусловлено термической нестабильностью. Известно, что НД и ТБНБ распадаются по связи N–C в области температур выше 70°С [52]. В результате степень сочетания при переходе от 50 к 80°С в присутствии НД понижается (образцы 5 и 13), а в случае ТБНБ она даже меньше, чем при сочетании в отсутствие ловушки (образцы 1 и 9, а также 11 и 15). Наибольшая доля образования димерных макромолекул при 80°С наблюдается при использовании алифатического нитрозосоедиения – МНП (образец 17).
Особо необходимо остановиться на выборе оптимальной концентрации нитрозосоединения. Для ТБНБ при [ПС] : [ПМДЭТА] : [CuBr] : [Cu] : : [ТБНБ] = 1 : 5 : 5 : 5 : 5 процесс сочетания не реализуется даже при понижении температуры до 50°С. В данном случае “видимая” степень сочетания и молекулярно-массовые характеристики ПС сопоставимы с аналогичными параметрами для реакции в отсутствие ловушки (образцы 1 и 9). Указанный эффект обусловлен достаточно высокой константой скорости акцептирования ТБНБ [52], вследствие чего процесс останавливается на первой стадии образования высокомолекулярного нитроксила, а не его аддукта. Пятикратное снижение концентрации ТБНБ при 50°С позволяет достичь желаемой степени сочетания и синтеза симметричного аддукта с нитроксилом (образец 7).
Кривые ММР полимерных аддуктов, полученных в присутствии НД и ТБНБ при выборе оптимальных температурных и концентрационных условий, представленные на рис. 6, свидетельствуют о высокой эффективности ароматических нитрозосоединений в реакциях сочетания. Кривые ММР продуктов сочетания смещены в область более высоких значений ММ по сравнению с исходным ПС. Следует отметить, что результаты деструкции полученных продуктов в ДМСО при 130°С в течение 10 ч однозначно доказывают возможность образования симметричных высокомолекулярных алкоксиаминов (образцы 3 и 4, 5 и 6, 7 и 8, 13 и 14). Видно, что кривые ММР, соответствующие деструктированным образцам, практически совпадают с кривой ММР исходного ПС. Еще раз подчеркнем, что в случае увеличения концентрации ТБНБ процесс взаимодействия спиновой ловушки вследствие ее избытка останавливается на стадии образования высокомолекулярного нитроксила. Данный факт подтверждается деструкцией полученного ПС (образцы 9 и 10, 15 и 16). ММ деструктированных образцов сопоставимы со значениями ММ продуктов сочетания без использования ловушки (образцы 1 и 11).
Рис. 6.
ММР исходного ПС (1), продуктов, полученных после проведения реакций сочетания в ТГФ при 50°C без (2) и с участием ловушки (3, образец 5 – а и 7 – б) и при деструкции образцов 5 (а) и 7 (б) в ДМСО при 130°C (4). Образцы 5 и 7 приведены в табл. 5.
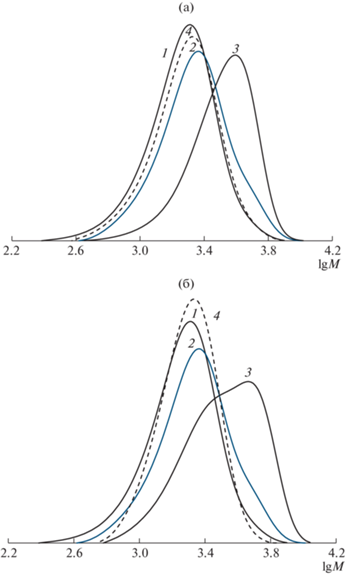
В целом следует отметить, что при использовании в качестве спиновых ловушек нитрозосоединений вследствие их более высокой акцептирующей способности в отличие от нитронов возможно образование как высокомолекулярных алкоксиаминов, так и нитроксилов.
ЗАКЛЮЧЕНИЕ
Таким образом, полученные данные свидетельствуют о повышении эффективности реакции сочетания при использовании спиновых ловушек (нитронов и нитрозосоединений) с 0.3 до 0.9–1.0. Установлено, что наиболее эффективно сочетание макрорадикалов реализуется в температурном интервале 50–80°С в среде растворителей, обладающих наибольшей координационной способностью, например, ТГФ и ацетонитрила. Показано, что процессы сочетания для полистирола в присутствии мононитронов позволяют получать симметричные высокомолекулярные алкоксиамины с низкими значениями дисперсности (1.18–1.20), содержащие в центре полимерной цепи нитроксильный фрагмент. Выявлено, что нитрозосоединения в отличие от используемых нитронов обладают большей акцептирующей способностью по отношению к полистирольным радикалам и позволяют наряду с процессом сочетания осуществлять модификацию концевого звена макромолекулы. В частности, увеличение концентрации спиновой ловушки приводит к замене атома галогена на нитроксильный фрагмент.
Авторы признательны сотрудникам Новосибирского института органической химии им. Н.Н. Ворожцова Сибирского отделения РАН И.А. Кирилюку и И.Ф. Журко за предоставленные нитроны БМФО, ДИО и ДИОО.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (код проекта 20-03-00150).
Список литературы
Reversible Deactivation Radical Polymerization: Mechanisms and Synthetic Methodologies / Ed. by K. Matyjaszewski, H. Gao, B.S. Sumerlin, N.V. Tsarevsky. Washington: Am. Chem. Soc., 2018.
Nitroxide Mediated Polymerization From Fundamentals to Applications in Materials Science / Ed. by D. Gigmes. UK: The Royal Society of Chemistry, 2016.
Moad G.A. // J. Polym. Sci., Polym. Chem. 2019. V. 57. № 3. P. 216.
Coiai S., Passaglia E., Cicogna F. // Polym. Int. 2019. V. 68. № 1. P. 27.
Ribelli T.G., Lorandi F., Fantin M., Matyjaszewski K. // Macromol. Rapid Commun. 2018. V. 40. № 1. Art. 1800616.
Pan X., Fantin M., Yuan F., Matyjaszewski K. // Chem. Soc. Rev. 2018. V. 47. № 14. P. 5457.
Grishin D.F., Grishin I.D. // Russ. Chem. Revs. 2021. V. 90. № 2. P. 231.
Anastasaki A., Willenbacher J., Fleischmann C., Gutekunst W.R., Hawker C.J. // Polym. Chem. 2017. V. 8. № 4. P. 689.
Wang G., Huang J. // Polym. Chem. 2014. V. 5. № 2. P. 277.
Zhang Z.N., Wang G.W., Huang J.L. // J. Polym. Sci., Polym. Chem. 2011. V. 49. № 13. P. 2811.
Wong E.H.H., Boyer C., Stenzel M.H., Barner-Kowollik C., Junkers T. // Chem. Commun. 2010. V. 46. № 11. P. 1959.
Wong E.H.H., Stenzel M.H., Junkers T., Barner-Kowollik C. // Macromolecules. 2010. V. 43. № 8. P. 3785.
Wong E.H.H., Altintas O., Stenzel M.H., Barner-Kowollik C., Junkers T. // Chem. Commun. 2011. V. 47. № 19. P. 5491.
Barner L., Quick A.S., Vogt A.P., Winkler V., Junkers T., Barner-Kowollik C. // Polym. Chem. 2012. V. 3. № 8. P. 2266.
Detrembleur C., Debuigne A., Altintas O., Conradi M., Wong E.H.H., Jerome C., Barner-Kowollik C., Junkers T. // Polym. Chem. 2012. V. 3. № 1. P. 135.
Voter A.F., Tillman E.S., Findeis P.M., Radzinski S.C. // ACS Macro Lett. 2012. V. 1. № 8. P. 1066.
Blackburn S.C., Myers K.D., Tillman E.S. // Polymer. 2015. V. 68. P. 284.
Arce M.M., Pan C.W., Thursby M.M., Wu J.P., Carnicom E.M., Tillman. E.S. // Macromolecules. 2016. V. 49. № 20. P. 7804.
Wu J.P., Pan C.W., Heiler K.E., Ching M.E., Tillman E.S. // Polymer. 2017. V. 127. P. 66.
Du M., Deng C., Wu X., Liu H., Liu H. // Macromol. Chem. Phys. 2017. V. 218. № 15. Art. 1700069.
Колякина Е.В., Шоипова Ф.Х., Алыева А.Б., Гришин Д.Ф. // Изв. АН. Сер. хим. 2021. № 9. С. 1736. [Kolyakina E.V., Shoipova F.H., Alyeva A.B., Grishin D.F. // Russ. Chem. Bull. 2021. V. 70. № 9. P. 1736.
Sciannamea V., Jérôme R., Detrembleur C. // Chem. Rev. 2008. V.108. № 3. P. 1104.
Колякина Е.В., Гришин Д.Ф. // Успехи химии. 2009. Т. 78. № 6. С. 579.
Гришин Д.Ф., Семенычева Л.Л., Колякина Е.В. // Докл. АН CCCР. 1998. Т. 362. № 5. С. 634.
Kolyakina E.V., Semenycheva L.L., Grishin D.F. // Polymer Science A. 2001. V. 43. № 12. P. 1223.
Павловская М.В., Колякина Е.В., Полянскова В.В., Семенычева Л.Л., Гришин Д.Ф. // Журн. прикл. химии. 2002. Т. 75. С. 1905.
Zaremski M.Yu., Orlova A.P., Garina E.S., Olenin A.V., Lachinov M.B., Golubev V.B. // Polymer Science A. 2003. V. 45. № 6. P. 502.
Zaremski M.Yu., Reznichenko A.L., Grinevich Yu.V., Garina E.S., Lachinov M.B., Golubev V.B. // Polymer Science A. 2005. V. 47. № 6. P. 908.
Sciannamea V., Guerrero-Sanchez C., Schubert U.S., Catala J.-M., Jerome R., Detrembleur C. // Polymer. 2005. V. 46. № 23. P. 9632.
Sciannamea V., Catala J.M., Jerome R., Detrembleur C. // J. Polym. Sci., Polym. Chem. 2007. V. 45. № 7. P. 1219.
Grishin D.F., Kolyakina E.V., Pavlovskaya M.V., Lazarev M.A., Shchepalov A.A. // Controlled/Living Radical Polymerization: Progress in RAFT, DT, NMP & OMRP. ACS Symp. Ser. / Ed. by K. Matyjiaszewski. Washington, 2009. V. 1024. Ch. 7. P. 95.
Колякина Е.В., Алыева А.Б., Сазонова Е.В., Щепалов А.А., Гришин Д.Ф. // Изв. АН. Сер. хим. 2019. № 8. С. 1585.
Kolyakina E.V., Alyeva A.B., Sazonova E.V., Zakharychev E.A., Grishin D.F. // Polymer Science B. 2020. V. 62. P. 328.
Колякина Е.В., Алыева А.Б., Захарычев Е.А., Гришин Д.Ф. // Изв. АН. Сер. хим. 2021. Т. 70. № 10. С. 1997.
Wong E.H.H., Junkers T., Barner-Kowollik C. // J. Polym. Sci., Polym. Chem. 2008. V. 46. № 21. P. 7273.
Junkers T., Wong E.H.H., Stenzel M.H., Barner-Kowollik C. // Macromolecules. 2009. V. 42. № 14. P. 5027.
Weissberger A., Proskauer E., Riddick J., Toops E. Organic Solvents. New York: Interscience Publ., 1955.
Holmes R.R., Bayer R.P., Simple A. // J. Am. Chem. Soc. 1960. V. 82. № 13. P. 3454.
Smith L.J., Taylor F.L. // J. Am. Chem. Soc. 1935. V. 57. № 8. P. 2460.
Stowell J.C. // J. Org. Chem. 1971. V. 36. P. 3055.
Emmons W.D. // J. Am. Chem. Soc. 1957. V. 79. № 21. P. 5739.
Hamer J., Macaluso A. // Chem. Rev. 1964. V. 64. № 4. P. 473.
Paulsen U., Lindeke B. // Acta. Pharm. Suec. 1978. V. 15. № 4. P. 264.
Кирилюк И.А., Григорьев И.А., Володарский Л.Б. // Изв. АН СССР. Сер. Хим. 1991. № 9. С. 2113.
Neumann R., de La Vega F., Bar-On A. // J. Org. Chem. 1995. V. 60. № 5. P. 1315.
Nitrile Oxides, Nitrones, and Nitronates in Organic Synthesis: Novel Strategies in Synthesis, Second Edition / Ed. by H. Feuer. USA: Wiley, 2008, 768 p.
Reichardt C. Solvents and Solvent Effects in Organic Chemistry. Wiley-VCH: Weinheim, 2003.
Handbook of Solvents / Ed. by G. Wypych. Toronto, New York: William Andrew Publ., ChemTec Publ., 2001.
Schmid R., Sapunov. V.N. Non-formal Kinetics. In Search for Chemical Reaction Pathways. Weinheim: Verlag Chemie, 1982.
Youn S., Kim D.Y., Cho W.J., Madridejos J.M.L., Lee H.M., Kolaski M., Lee J., Baig C., Shin S.K., Filatov M., Kim K.S. // J. Phys. Chem. A. 2016. V. 120. № 46. P. 9305.
Sambiagio C., Marsden S.P., Blacker A.J., McGowan P.C. // Chem. Soc. Rev. 2014. V. 43. № 10. P. 3525.
Зубарев В.Е. Метод спиновых ловушек. М.: Изд-во МГУ, 1984.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


