Высокомолекулярные соединения (серия Б), 2023, T. 65, № 1, стр. 72-80
ЯМР-ИССЛЕДОВАНИЕ ТЕТРАДНОГО РАСЩЕПЛЕНИЯ В РЕГУЛЯРНО-ЧЕРЕДУЮЩИХСЯ ДИФЕНИЛЕНОКСИД-ДИФЕНИЛЕНСУЛЬФИДНЫХ СОПОЛИАРИЛЕНФТАЛИДАХ ПЕРИОДИЧЕСКОГО СТРОЕНИЯ
В. А. Крайкин a, *, А. А. Фатыхов a, Н. Г. Гилева a, Т. А. Янгиров a, С. Н. Салазкин b
a Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук
450054 Уфа, пр. Октября, 71, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: vkrajkin@mail.ru
Поступила в редакцию 06.10.2022
После доработки 14.12.2022
Принята к публикации 28.12.2022
- EDN: PICMVM
- DOI: 10.31857/S230811392370033X
Аннотация
С помощью метода приращений изучено тетрадное расщепление сигналов узлового четвертичного sp3-гибридизированного атома углерода в ряду модельных (со)полиариленфталидов с различной длиной фениленоксифталидных (O) и фенилентиофталидных (S) последовательностей: O-1, OOOS-2, OOS-3, OS-4, SSO-5, SSSO-6, S-7 и OOSS-8. На основе данных анализа модульных значений диадных инкрементов рассчитаны тетрадные инкременты и предсказано расположение сигналов всех тетрад в спектрах ЯМР 13С индивидуальных (со)полиариленфталидов и их смесей. Достоверность расчетов подтверждена совпадением предсказанных и экспериментальных значений диадных и тетрадных инкрементов для специально синтезированного (со)полиариленфталида OOSS-8, спектрами смесей (со)полиариленфталидов с эквимольным содержанием расщепляемых тетрад, а также хорошей сходимостью их исходных составов, рассчитанных по деконволюированным спектрам.
ВВЕДЕНИЕ
С увеличением уровня полиад разница между химическими сдвигами структурно однотипных атомов водорода и углерода, имеющих различное химическое окружение, убывает в геометрической прогрессии. Как правило, разделение сигналов тетрад примерно на порядок ниже, чем диад, а разделение гексад – на порядок ниже, чем тетрад [1, 2]. По этой причине, а также из-за малого отличия в химических сдвигах разных протонов ароматических колец и сложных перекрывающихся мультиплетов подавляющая часть работ по определению микроструктуры ароматических и ароматически-алифатических сополимеров методами спектроскопии ЯМР 1H и ЯМР 13C выполнена на диадном и триадном уровнях. Из близких к (со)полиариленфталидам по химическому строению и свойствам наиболее изучены сополимеры, синтезируемые на основе тере-, изофталевой кислот и их хлоридов. Так, был выполнен диадный и триадный анализ последовательностей в полиарилатах, полиэфиркетонах, полиэфиркарбонатах и полиэфирамидах [3‒8]. Подробно исследована композиционная неоднородность полигетероариленов и других классов полимеров [9‒12]. Рассмотрение последовательностей, протяженностью выше триадных, как правило, требует специальных подходов ‒ подбор растворителей (в том числе, двухкомпонентных), проведение исследований при повышенных значениях температуры, использование сдвиговых реагентов, улучшающих разрешение мультиплетов. В частности, применение смесевых растворителей (трихлоруксусная кислота/дейтерохлороформ, о-хлорфенол/дейтерохлороформ) позволило определить тетрадные и пентадные последовательности в четырехкомпонентных сополиэфирах [13], а использование Eu(fod)3 – зарегистрировать тетрадное расщепление сигналов терефталевой кислоты в спектрах ароматических сополитерефталатов [14]. При распределении полиад более высокого порядка прибегают к компьютерному моделированию и статистическим методам расчета, основанным на распределениях Бернулли и цепей Маркова [15, 16]. Во многих случаях для проверки правильности отнесения пиков используют аддитивные схемы [17, 18] и правила аддитивности. Это правило полусуммы, согласно которому хим. сдвиг гетеродиады равен полусумме хим. сдвигов гомодиад [19, 20], и правило равенства сумм хим. сдвигов гомотриад и гетеротриад [21‒23].
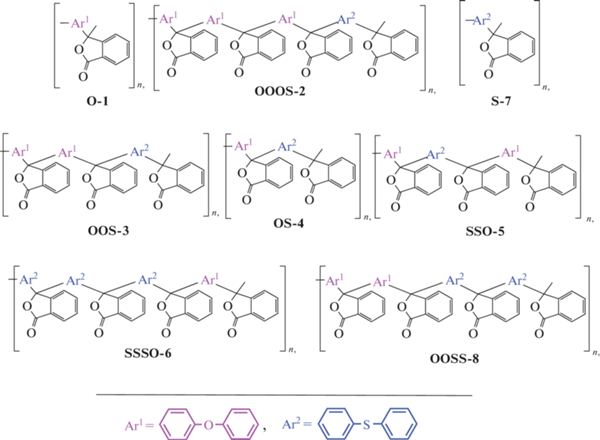
В настоящей работе методом инкрементов, а также путем подбора составов полимерных смесей и деконволюцией их спектров удалось продемонстрировать тетрадное расщепление сигналов sp3-гибридизированного углерода в исчерпывающей серии дифенилокси-дифенилтиофталидных (со)полиариленфталидах (1‒8):
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез полимеров
Гомополиариленфталиды O-1 (Mn = 22.3 × 103) и S-7 (Mn = 33.7 × 103) получали по реакции электрофильного замещения Фриделя‒Крафтса самоконденсацией псевдохлорангидридов o-(4-феноксибензоил)бензойной и o-(4-тиофенилбензоил)бензойной кислот соответственно. Совместной поликонденсацией 4,4'-бис-(3-хлор-3-фталидил)дифенилоксида с дифенилсульфидом выделяли регулярно-чередующийся сополиариленфталид OS-4 (Mn = 35.6 × 103) [24‒26]. Сополиариленфталиды триадного и тетрадного строения [27] представляли гетерополиконденсацией псевдохлорангидридов о-кетокарбоновых кислот с ди- и триарилфталидами, синтез которых описан в работе [28]: OOS-3 (Mw = 49.7 × 103) получали поликонденсацией 4,4'-бис-(3-хлор-3-фталидил)дифенилсульфида с 3,3-бис-(дифенилоксид)фталидом; SSO-5 (Mw = 46.18 × 103) – взаимодействием 4,4'-бис-(3-хлор-3-фталидил)дифенилоксида с 3,3-бис-(дифенилсульфид)фталидом; OOOS-2 (Mw = 34.9 × 103) и SSSO-6 (Mw = 31.7 × 103) ‒ взаимосвязью 4,4'-бис-(3-хлор-3-фталидил)дифенилоксида с 4,4'-бис-(3-дифенилоксид-3-фталидил)ди-фенилсульфидом и с 4,4'-бис-(3-дифенилсульфид-3-фталидил)дифенилсульфидом соответственно. Сополимер OOSS-8 (ηпр = 0.76 дл/г; CHCl3, c = 0.5 г/дл, Т = 25°C) синтезировали поликонденсацией 3,3-бис-(дифенилсульфид)фталида с 4',4''-бис-(2-карбоксибензо-ил)[ди(4-феноксифенил)фталидом].
Спектроскопия ЯМР 13С
Все ЯМР-эксперименты выполняли на спектрометре “Bruker AVANCE III” (500 МГц для протонов и 125.76 МГц для углерода) в CDCl3 при 298 К с использованием программного обеспечения “Bruker TopSpin 3.0” с зондом 5 мм, оснащенным катушкой с z-градиентом. Для увеличения разрешения ширину спектрального окна оптимизировали по отношению к исследуемым полиариленфталидам. Для повышения разрешения спектры ЯМР 1H снимали при ширине спектрального окна SW 1600 Гц (3.1 м.д.) на 32 K точек с длительностью импульса 11.5 мкс. Спектры ЯМР 13С измеряли при ширине окна 13.5 кГц (107 м.д.) на 64 К с длительностью импульса 9.7 мкс (30°). Время регистрации составляло 3 с в спектре ЯМР 1Н и 5 с в спектре ЯМР 13С. Хим. сдвиги регистрировали относительно внутреннего стандарта ТМС (δ = 0.0 м.д.) для спектра ЯМР 1H и центрального пика CDCl3 (δ = 77.0 м.д.) для спектра ЯМР 13C. Все двумерные спектры измеряли с помощью стандартной программы “Bruker TopSpin 3.0” cosygpqf для ge-2D [1H‒1H] COSY, noesygpph для ge-2D [1H‒1H] NOESY, hsqcetgp для ge-2D [1H‒13C] HSQC и hmbcgpndqf для ge-2D [1H‒13C] HMBC. Спектр [1H–1H] NOESY записывали с шириной спектрального окна 1600 Гц на 4096 × 128 точек данных. Спектры ge-2D [1H‒13C] HSQC, а также ge-2D [1H‒13C] HMBC накапливали на 2048 × 256 точек данных при ширине спектрального окна 1600 Гц для F2 (1H) и 13500 Гц для F1 (13C).
Деконволюцию спектральных кривых осуществляли с помощью программного пакета “OriginPro2016” с использованием для интегрирования перекрывающихся сигналов функций Лоренца и Войта.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее в работе [20] было установлено, что во фталидных областях спектров (со)полиариленфталидов 1‒7 регистрируется не более трех сигналов: δ(OO), δ(OS) и δ(SS) (рис. 1). На основании этого сделано заключение, что при рабочей частоте спектрометра 126 МГц (для ЯМР 13С) можно зафиксировать исключительно диадное расщепление структурно однотипных атомов фталидного цикла. Вместе с тем, обращает на себя внимание незначительное (не превышающие 0.01 м.д.), но закономерное снижение Δδ = = δ(OO)‒δ(OS) и Δδ = δ(OS)‒δ(SS), которое наблюдается при последовательном уменьшении на одно звено, в первом случае длины дифенилоксифталидных, а во втором – дифенилтиофталидных последовательностей. Величина смещения каждого из диадных сигналов в среднем кратна ≈0.005 м.д. Обнаруженные закономерности находят свое объяснение, если микрогетерогенность исследованных (со)полиариленфталидов рассматривать на тетрадном уровне, т.е. учитывать экранирующее влияние дальних соседей.
Рис. 1.
Спектральная область и диадные инкременты для фталидного атома углерода C1 сополиариленфталидов смеси O-1 + OS-4 + S-7 (1), OOOS-2 (2), OOS-3 (3), SSO-5 (4) и SSSO-6 (5).

В зависимости от природы соседних гетероароматических фрагментов ближнего (обозначены надстрочными символами) и дальнего окружения (обозначены подстрочными символами) в исследованном ряду (со)полиариленфталидов возможно существование четырех дифенилоксидных ${\text{o}}_{{\text{o}}}^{{\text{o}}},$ ${\text{o}}_{{\text{s}}}^{{\text{o}}},$ ${\text{o}}_{{\text{o}}}^{{\text{s}}},$ ${\text{o}}_{{\text{s}}}^{{\text{s}}}$ и четырех дифенилсульфидных ${\text{s}}_{{\text{o}}}^{{\text{o}}},$ ${\text{s}}_{{\text{s}}}^{{\text{o}}},$ ${\text{s}}_{{\text{o}}}^{{\text{s}}},$ ${\text{s}}_{{\text{s}}}^{{\text{s}}}$ триадных монад (монады обозначены строчным символом). Триадные монады, сочетаясь попарно, могут образовать десять центральных диад ‒ ${}_{{\text{o}}}^{{\text{o}}}{{{\text{o}}}_{{\text{Y}}}}{\text{o}}_{{\text{o}}}^{{\text{o}}}$, ${}_{{\text{o}}}^{{\text{o}}}{{{\text{o}}}_{{\text{Y}}}}{\text{o}}_{{\text{s}}}^{{\text{o}}}$, ${}_{{{\text{\;s}}}}^{{\text{o}}}{{{\text{o}}}_{{\text{Y}}}}{\text{o}}_{{\text{s}}}^{{\text{o}}}$, ${}_{{\text{o}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{o}}}$, ${}_{{\text{o}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{o}}}$, ${}_{{\text{s}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{o}}}$, ${}_{{\text{s}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{o}}}$, ${}_{{\text{o}}}^{{\text{s}}}{{{\text{s}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{s}}}$, ${}_{{\text{o}}}^{{\text{s}}}{{{\text{s}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{s}}}$, ${}_{{\text{s}}}^{{\text{s}}}{{{\text{s}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{s}}}$ (где Y ‒ фталидный цикл) в составе десяти фталидцентрированных тетрад ‒ OOOO, OOOS, SOOS, OOSO, OOSS, SOSO, SOSS, OSSO, OSSS, SSSS (табл. 1):
( , где • – узловой sp3-гибридизированный атом углерода C1)
, где • – узловой sp3-гибридизированный атом углерода C1)
Таблица 1.
Тетрадный состав (со)полиариленфталидов 1‒8 и их смесей
| Полимер (смесь) | Гомотетрады | Гетеротетрады | Гомотетрады | ||||||
|---|---|---|---|---|---|---|---|---|---|
| O-1 | OOOO | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ |
| OOOS-2 | ‒ | OOOS | ‒ | OOSO | ‒ | ‒ | ‒ | ‒ | ‒ |
| OOS-3 | ‒ | ‒ | SOOS | OOSO | ‒ | ‒ | ‒ | ‒ | ‒ |
| OS-4 | ‒ | ‒ | ‒ | ‒ | SOSO | ‒ | ‒ | ‒ | ‒ |
| SSO-5 | ‒ | ‒ | ‒ | ‒ | ‒ | SOSS | OSSO | ‒ | ‒ |
| SSSO-6 | ‒ | ‒ | ‒ | ‒ | ‒ | SOSS | ‒ | OSSS | ‒ |
| S-7 | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ | SSSS |
| OOSS-8 | ‒ | ‒ | SOOS | ‒ | OOSS | ‒ | OSSO | ‒ | ‒ |
| 1 + 4 + 7 | OOOO | ‒ | ‒ | ‒ | SOSO | ‒ | ‒ | ‒ | SSSS |
| 3 + 1 | OOOO | ‒ | SOOS | OOSO | ‒ | ‒ | ‒ | ‒ | ‒ |
| 5 + 7 | ‒ | ‒ | ‒ | ‒ | ‒ | SOSS | OSSO | ‒ | SSSS |
| 3 + 5 | ‒ | ‒ | SOOS | OOSO | ‒ | SOSS | OSSO | ‒ | ‒ |
| 2 + 6 | ‒ | OOOS | ‒ | OOSO | ‒ | SOSS | ‒ | OSSS | ‒ |
Из-за полного перекрывания пиков тетрадное расщепление не обнаруживается ни в спектрах статистических сополимеров, ни в спектрах полных смесей исследованных (со)полиариленфталидов. Однако оно отчетливо проявляется в неравенстве диадных инкрементов фталидных атомов, особенно sp3-гибридизированного углерода С1 индивидуальных (со)полиариленфталидов (см. рис. 1).
Оперируя только значениями усредненных диадных инкрементов, можно рассчитать вклады дальних соседей в экранирование этого атома в центральных диадах всех фталидцентрированных тетрад, т.е. определить тетрадные инкременты Δo и Δs.
Для сополиариленфталидов с преобладанием дифениленоксидных фрагментов (OOOS-2, OOS-3) можно записать
(1a)
${{\delta }}({}_{{\text{o}}}^{{\text{o}}}{{{\text{o}}}_{{\text{Y}}}}{\text{o}}_{{\text{s}}}^{{\text{o}}}) - {{\delta }}({}_{{\text{o}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{o}}}){\text{\;}} \approx {\text{\;}}0.120$(1б)
${{\delta }}({}_{{\text{s}}}^{{\text{o}}}{{{\text{o}}}_{{\text{Y}}}}{\text{o}}_{{\text{s}}}^{{\text{o}}}) - {{\delta }}({}_{{\text{o}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{o}}}){\text{\;}} \approx {\text{\;}}0.115$Вычитая (1б) из (1a):
получим
Откуда
Аналогичным образом в “дифениленсульфидном” ряду (со)полиариленфталидов (SSO-5, SSSO-6) можно найти значение инкремента ${{\Delta }_{{\text{o}}}}$:
(2a)
${{\delta }}({}_{{\text{s}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{o}}}) - {{\delta }}({}_{{\text{o}}}^{{\text{s}}}{{{\text{s}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{s}}}) \approx 0.120$(2б)
${{\delta }}({}_{{\text{s}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{o}}}) - {{\delta }}({}_{{\text{o}}}^{{\text{s}}}{{{\text{s}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{s}}}) \approx 0.115$Вычитая (2б) из (2а):
получим
Откуда
Приведенные выше, а также и другие структурные переходы между тетрадами, которые можно записать с помощью диадных и тетрадных инкрементов, представлены в виде обобщенной схемы:
Данная схема позволяет выдвинуть ряд предположений относительно спектральных характеристик синтезированного позже (со)полиариленфталида OOSS-8: хим. сдвиг несимметричной гетеротетрады OOSS данного сополимера должен совпадать с хим. сдвигом гетеротетрады OSOS в сополимере OS-4; также для этого сополимера должны соблюдаться аддитивные соотношения, такие как Δδ = δ(SOOS)–δ(OOSS) = δ(OOSS)– –δ(OSSO) ≈ 0.120 м.д.
Для доказательства приведенных предположений рассмотрим структурные пошаговые переходы и обусловленные этими переходами изменения хим. сдвигов, которые имеют место при замене в гетеротетрадах – дальнего дифенилоксидного соседа на дифенилсульфидный, и наоборот – дальнего дифенилсульфидного на дифенилоксидный.
Согласно схеме, к тетраде OOSS от гетеротетрады OSOS можно перейти как через тетраду OSOO, имеющую центральную гетеродиаду OS c дальним дифениленоксидным окружением, так и через тетраду SOSS, центральная диада которой имеет дальнее дифениленсульфидное окружение. В первом случае, надо сначала в O-центрированной триаде заменить дальний S-фрагмент на O-фрагмент (смещение сигнала в высокочастотную область спектра):
(3a)
$~{{\delta }}({}_{{\text{s}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{o}}}) + {{{{\Delta }}}_{{\text{o}}}} = {{\delta }}({}_{{\text{o}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{o}}})$Затем в S-центрированной триаде заменить O-фрагмент на S-фрагмент (смещение сигнала в низкочастотную область):
(3б)
${{\delta }}({}_{{\text{o}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{o}}}) + {{{{\Delta }}}_{{\text{s}}}} = {{\delta }}({}_{{\text{o}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{o}}})$Вычитая почленно (3б) из (3a), получим
Аналогичный конечный результат будет получен, если выполнить переход к OOSS по второму варианту – через тетраду SOSS с дифениленсульфидным дальним окружением центральной гетеродиады. Для этого необходимо сначала O-фрагмент заменить на S-фрагмент в O-центрированной триаде:
(4a)
${{\delta }}({}_{{\text{s}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{o}}}^{{\text{o}}}) - {{{{\Delta }}}_{{\text{s}}}} = {{\delta }}({}_{{\text{s}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{o}}}),~$(4б)
${{\delta }}({}_{{\text{s}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{o}}}) + {{{{\Delta }}}_{{\text{o}}}} = {{\delta }}({}_{{\text{o}}}^{{\text{s}}}{{{\text{o}}}_{{\text{Y}}}}{\text{s}}_{{\text{s}}}^{{\text{o}}})$Вычитая почленно (4б) из (4a), получим
Откуда
Из данных переходов следует, что пик центральной гетеродиады сначала смещается в высокочастотную (низкочастотную) область спектра, после чего возвращается в исходное положение. Таким образом, перемена местами дальних фрагментов “O” и “S” без изменения брутто-состава тетрад (при равенстве тетрадных инкрементов Δo и Δs) никак не отражается на хим. сдвиге диады OS.
Сделанные выше предположения были полностью подтверждены встречным синтезом (со)полиариленфталида OOSS-8. В синтезе этого сополимера был впервые использован олигомерный дихлорангидрид нового фталидцентрированного типа, который, в свою очередь, получен на основе новой (фталидсодержащей) дикетокарбоновой кислоты:
Помимо синтеза нового сополимера для проверки правильности отнесения тетрадных сигналов была приготовлена серия растворов смесей (со)полиариленфталидов 1‒8. Так, составлено шесть полимерных смесей с примерно одинаковым мольным соотношением (1 : 1) расщепляемых тетрад, что позволило зарегистрировать тетрадное расщепление сигналов различающихся на ≈0.01 м.д. в следующих парах: OOOO и SOOS, OOSO и SOSS, OSSO и SSSS (рис. 2). На рис. 2 также видно, что несимметричные (по дальнему окружению) тетрады OOOS, OSOS=OOSS и OSSS, отличающиеся от соответствующих близлежащих симметричных тетрад примерно на ±0.005 м.д., как и следовало ожидать, располагаются между ними. Деконволюция спектров всех смесей выявила абсолютную аддитивность хим. сдвигов тетрад:
Рис 2.
Спектры ЯМР13 С индивидуального (со)полиариленфталида OOSS-8 (2) и его смесей O-1 + OS-4 + S-7 (1), OOOS-2 + OSS-5 (3), OOOS-2 + OSSS-6 (4), OOS-3 + OSS-5 (5), OSS-5 + SSSS-7 (6), O-1 + OOS-3 (7).

Вместе с тем, деконволюция показала, что значения площади под спектральными кривыми смесей (со)полиариленфталидов аддитивно складываются из значений площади тетрадных лоренцианов, свидетельством чего является хорошее соответствие исходных составов смесей с составами, рассчитанными по деконволюированным спектрам (табл. 2).
Таблица 2.
Исходное и рассчитанное по деконволюированным спектрам (в скобках) мольное содержание сополиариленфталидов 1‒8 в искусственных смесях
| Смесь | Сополиариленфталиды, мол.% | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 1 + 7 + 8 | 0.13 | ‒ | ‒ | ‒ | ‒ | ‒ | 0.13 | 0.74 |
| (0.13) | (0.14) | (0.73) | ||||||
| 1 + 3 | 0.29 | ‒ | 0.71 | ‒ | ‒ | ‒ | ‒ | ‒ |
| (0.26) | (0.74) | |||||||
| 5 + 7 | ‒ | ‒ | ‒ | ‒ | 0.29 | ‒ | 0.71 | |
| (0.26) | (0.74) | |||||||
| 3 + 5 | ‒ | ‒ | 0.50 | ‒ | 0.50 | ‒ | ‒ | |
| (0.49) | (0.51) | |||||||
| 2 + 6 | ‒ | 0.48 | ‒ | ‒ | ‒ | 0.52 | ‒ | |
| (0.46) | (0.54) | |||||||
ЗАКЛЮЧЕНИЕ
Хим. сдвиги фталидных углеродных атомов отражают не только диадное, но и тетрадное строение изученных (со)полиариленфталидов. Тетрадное разделение сигналов максимально для sp3-гибридизированных атомов углерода С1. Хим. сдвиг каждого из этих атомов в тетрадах может быть рассчитан по аддитивным схемам, необходимым условием применимости которых является структурная аддитивность, т.е. наличие одинакового набора ближних и дальних заместителей в левой и правой частях уравнений аддитивности. Важно, что полученные результаты могут быть использованы для анализа микрогетерогенности статистических и блочных дифенилоксид-дифенилсульфидсодержащих (со)полиариленфталидов, а также для установления тонких различий в порядке присоединения к растущей полимерной цепи симметричных и несимметричных фталидсодержащих мономеров этого ряда.
Регистрация спектров ЯМР проведена на оборудовании Центра коллективного пользования “Химия” и “Агидель” Уфимского института химии Уфимского федерального исследовательского центра РАН.
Работа выполнена в рамках Госзадания по темам №№ 122031400279-9, 122031400282-9 и 075-00697-22-00 Министерства науки и высшего образования Российской Федерации.
Список литературы
Kinsinger J.B., Fischer T., Wilson C.W. // J. Polym. Sci., Polym. Phys. 1967. V. 5. P. 285.
Hellwege K.H., Johnsen U., Kolbe K. // Kolloid-Z. u. Z. Polym. 1966. V. 214. P. 45.
Giammanco G., Martinez de Ilarduya A., Alla A., Munoz-Guerra S. // Biomacromolecules. 2010. V. 11. P. 2512.
Kint D.P.R., Martinez de Ilarduya A., Munoz-Guerra S. // Macromolecules. 2002. V. 35. P. 314.
Martinez de Ilarduya A., Kint D.P.R., Munoz-Guerra S. // Macromolecules. 2000. V. 33. P. 4596.
Matsuda H., Asakura T., Miki T. // Macromolecules. 2002. V. 35. P. 4664.
Matsuda H., Nagasaka B., Asakura T. // Polym. J. 2003. V. 35. № 9. P. 740.
Matsuda H., Asakura T., Nakagawa Y. // Macromolecules. 2003. V. 36. P. 6160.
Montaudo G., Montaudo M.S., Scamporrino E., Vitalini D. // Macromolecules. 1992. V. 25. P. 5099.
Zhang Y., Feng Z.-G., Zhang Ai.-Y. // Polym. Int. 2003. V. 52. P. 1351.
Урман Я.Г. // Высокомолек. соед. А. 1982. Т. 24. № 9. С. 1795.
Zhou X.-M., Jiang Z.-H. // J. Polym. Sci., Polym. Phys. 2005. V. 43. P. 1624.
Matsuda H., Asakura T. // Macromolecules. 2004. V. 37. P. 2163.
Matlengiewicz M. // Macromolecules. 1984. V. 17. P. 473.
Ross J.F. // J. Macromol. Sci. A. 1987. V. 24. № 2. P. 211.
Pasich M., Henzel N., Matlengiewicz M. // Int. J. Polym. Anal. Charact. 2013. V. 18. P. 105.
Hansen P.E. // Org. Magn. Reson. 1979. V. 12. № 3. P. 109.
Jin J.-I., Chang J.-H., Hatada K., Ute K., Hotta M. // Polymer. 1992. V. 33. № 7. P. 1374.
Fatyhov A.A., Sedova E.A., Egorov A.E., Salazkin S.N., Kraikin V.A. // Magn. Reson Chem. 2017. V. 55. P. 958.
Kraikin V.A., Fatykhov A.A., Gileva N.G., Kravchenko A.A., Salazkin S.N. // Magn. Reson. Chem. 2021. V. 59. P. 61.
Levy G.C., Nelson G.L. Carbon-13 Nuclear Magnetic Resonance for Organic Chemists. New York: Wiley, 1972.
Урман Я.Г., Алексеева С.Г., Слоним И.Я. // Высокомолек. соед. А. 1977. Т. 19. № 2. С. 299.
Алексеева С.Г., Павлова A.Я., Урман Я.Г., Доброхотова M.K., Слоним И.Я., Фрунзе T.M. // Высокомолек. соед. А. 1981. Т. 23. № 7. С. 1505.
Салазкин С.Н., Рафиков С.Р., Толстиков Г.А., Золотухин М.Г. // Докл. АН СССР. 1982. Т. 262. № 2. С. 355.
Золотухин М.Г., Егоров А.Е., Седова Э.А., Сорокина Ю.Л., Ковардаков В.А., Салазкин С.Н., Сангалов Ю.А. // Докл. АН СССР. 1990. Т. 311. № 1. С. 127.
Kraikin V.A., Gileva N.G., Sedova E.A., Kuznetsov S.I., Fatykhov A.A., Musina Z.N., Salazkin S.N. // Polymer Science A. 2004. V. 46. № 10. P. 1027.
Гилева Н.Г., Фатыхов А.А., Янгиров Т.А., Юмагулова Р.Х., Крайкин В.А. // Вестн. Башкирского ун-та. 2020. Т. 25. № 1. С. 38.
Gileva N.G., Nosovskaya I.I., Fatykhov A.A., Salazkin S.N., Kraikin V.A. // Russ. J. Org. Chem. 2019. V. 55. № 2. P. 174.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)