Высокомолекулярные соединения (серия С), 2019, T. 61, № 1, стр. 77-82
Стереоселективный синтез и метатезисная полимеризация экзо-5-(пентаметилдисилоксанил)норборнена
М. А. Гусева a, b, Д. А. Алентьев a, Д. И. Гаврилов a, b, Е. В. Бермешева a, b, c, П. П. Чапала b, Е. Ш. Финкельштейн a, М. В. Бермешев a, b, *
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
b МИРЭА – Российский технологический университет,
Институт тонких химических технологий им. М.В. Ломоносова
119571 Москва, пр. Вернадского, 86, Россия
c Московский государственный медицинский университет имени И.М. Сеченова
119991 Москва, Трубецкая ул., 8, Россия
* E-mail: bmv@ips.ac.ru
Поступила в редакцию 21.03.2019
После доработки 29.04.2019
Принята к публикации 13.05.2019
Аннотация
Разработан одностадийный селективный метод синтеза экзо-изомеров кремнийсодержащих норборненов на основе гидросилилирования норборнадиена-2,5 коммерчески доступными силанами в присутствии Pd-катализатора и объемного лиганда R-MOP. Данный подход приводит к образованию исключительно экзо-изомеров. Отсутствие стадий алкилирования металлоорганическими реагентами и фотохимической изомеризации делает предложенный подход привлекательным для направленного дизайна и синтеза новых полимерных материалов, обладающих требуемыми свойствами.
ВВЕДЕНИЕ
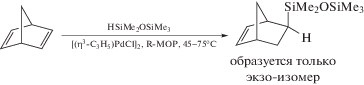
В течение последних 15 лет был опубликован ряд работ, продемонстрировавших возможность получения разнообразных материалов с ценными прикладными свойствами, на основе кремнийсодержащих норборненов и родственных соединений. В частности, с использованием соединений данного класса были получены полимеры, обладающие перспективными газоразделительными свойствами [1, 2], микропористые полимеры [3], чувствительные к давлению адгезивы [4] и т.д. Возможность получения полимеров с разнообразными свойствами из кремнийсодержащих норборненов обусловлена прежде всего богатой химией кремнийорганических соединений и уникальной способностью норборненов полимеризоваться по нескольким направлениям [5–10], образуя полимеры с разным строением основных цепей и различными свойствами из одного и того же мономера. Все это позволяет осуществлять направленный дизайн и синтез полимерных материалов с требуемыми свойствами. Однако, наличие объемной кремнийорганической группы в норборнене заметно снижает его активность в полимеризации. Более того, активность мономера существенно зависит от ориентации заместителя: экзо-изомеры производных норборнена, как правило, более активны в полимеризации по сравнению с их эндо-аналогами. В случае синтеза производных норборнена с использованием реакции Дильса–Альдера образуется смесь экзо- и эндо-изомеров, содержащая преимущественно менее активный эндо-изомер [11–13]. С целью селективного получения кремнийсодержащих экзо-норборненов ранее было реализовано [2+2+2]-циклоприсоединение алкенилхлорсиланов к квадрициклану [14]. Данная реакция приводит к образованию только экзо-изомеров. Однако для ее проведения требуется дополнительный синтез квадрициклана с помощью фотохимической изомеризации норборнадиена-2,5, а в реакцию вступают исключительно алкенилсиланы с электроноакцепторными группами. Это, с одной стороны, сильно сужает потенциальный круг мономеров, которые могут быть получены из квадрициклана, а с другой – требует использования дополнительной стадии алкилирования циклоаддукта реактивами Гриньяра или литийорганическими соединениями [15]. В настоящей работе мы предложили новый, более простой и эффективный подход к селективному получению экзо-изомеров кремнийсодержащих норборненов, а также изучили метатезисную полимеризацию синтезированных мономеров. Предлагаемый метод синтеза экзо-изомеров норборнена основывается на гидросилилировании норборнадиена-2,5 коммерчески доступными силанами и является одностадийным:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Норборнадиен-2,5 (“Аldrich”) сушили над Na и перегоняли в аргоне. Пентаметилдисилоксан (ABCR) сушили над CaH2 и перегоняли в вакууме. Димер аллилпалладийхлорида, лиганд R-MOP и катализатор метатезисной полимеризации – комплекс Граббса первого поколения (“Аldrich”) – применяли без предварительной очистки. В работе использовали ингибитор 2,2'-метилен-бис-(6-трет-бутил-4-метилфенол) (“Аldrich”). Толуол, тетрагидрофуран абсолютизировали над натрием и хранили над натриевой проволокой в аргоне.
Спектры ЯМР регистрировали на ЯМР-спектрометре “Varian Inova-500”. Для спектров ЯМР 1Н частота регистрации 499.83 МГц, для спектров ЯМР 13C – 125.69 МГц, для спектров ЯМР 29Si – 99.30 МГц.
Сигналы в спектрах ПМР относили по остаточным протонам CDCl3 (7.24 м.д.) и C6D6 (7.15 м.д.).
Хромато-масс-спектрометрический анализ проводили на газо-хромато-масс-спектрометре “Finnigan MAT 95 XL” (энергия ионизация 70 эВ, диапазон масс 20–800 а.е.м., разрешение 1000, температура источника 200°С, скорость сканирования 1 с/декада масс) и хроматографе HP 6890+ с капиллярной колонкой 30м × 0.25 мм с фазой DB-5 (полидиметилсилоксан, содержащий 5% фенильных групп), газ-носитель – гелий (деление потока 1 : 30).
Калориметрические исследования выполняли на дифференциальном сканирующем калориметре фирмы “Mettler” марки ТА-4000 с ячейкой DSC-30 при скорости повышения температуры 20 град/мин в атмосфере аргона. Термогравиметрический анализ проводили с помощью прибора “Perkin-Elmer TGA-7” при скорости повышения температуры 10 град/мин.
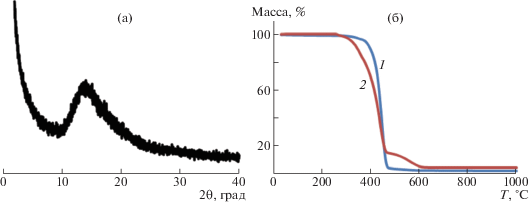
Рентгенографические измерения осуществляли на дифрактометре ДРОН-3М в режиме съемки “на прохождение” (асимметричный, фокусирующий на детектор, кварцевый монохроматор на первичном пучке). Использовали CuKα-излучение. Сканирование дифракционной картины проводили в “пошаговом режиме” с шагом ∆2θ = = 0.04° и временем накопления τ = 10 с.
Все операции по синтезу мономеров и их полимеризации проводили в атмосфере сухого аргона с использованием стандартной техники Шленка.
Синтез мономера
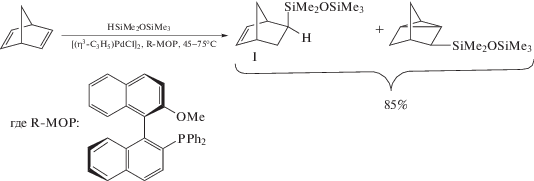
В ампулу объемом 25 мл помещали лиганд R-MOP (31.3 мг, 0.0668 ммоля). Ампулу трижды вакуумировали и заполняли аргоном. После этого в токе аргона в ампулу прибавляли раствор димера аллилпалладийхлорида (3.34 мл, 5 × 10–3 моль/л), норборнадиен-2,5 (5.7 г, 61.96 ммоля) и пентаметилдисилоксан (9.65 г, 65.05 ммоля). Ампулу запаивали и нагревали при 45°С в течение 30 дней. Затем ампулу вскрывали, в вакууме (2–3 мм рт. ст.) отгоняли непрореагировавшие реагенты и растворитель (толуол). В более глубоком вакууме (0.05 мм рт. ст.) при 40–50°С из оставшейся смеси отгоняли целевой мономер. Выход 13.0 г (85%).
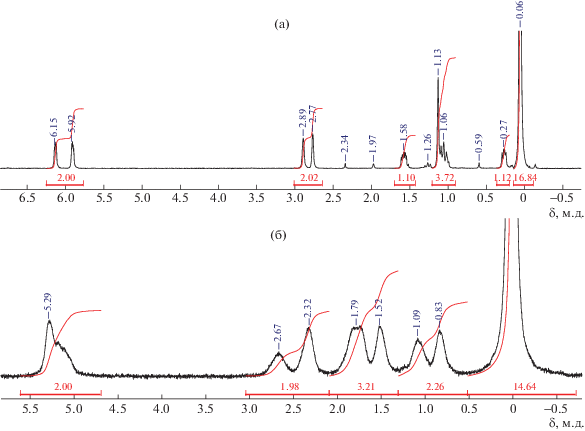
ЯМР 1H (CDCl3, м.д.): 6.15 (д.д., 1Н, С(2)Н, С(3)Н), 5.92 (д.д., 1Н, С(2)Н, С(3)Н), 2.89 (уш.с., 1Н, С(1)Н, С(4)Н), 2.77 (уш.с., 1Н, С(1)Н, С(4)Н), 1.64–1.50 (м, 1Н, С(6)Н), 1.19–0.97 (м. 3Н, С(6)Н, С(7)Н), 0.33–0.23 (м, 1Н, С(5)Н), 0.13–(–0.08) (м, 15Н, Si(CH3)).
Метатезисная полимеризация
В главбоксе в виалку объемом 8 мл помещали 0.20 г мономера (0.83 ммоля), 0.50 мл толуола и прибавляли 0.20 мл (1.4 × 10–3 моль/л, 2.8 × 10–4 ммоль) раствора карбенового комплекса Граббса первого поколения в толуоле при постоянном перемешивании (соотношение мономер : катализатор = = 3000 : 1). После 1 ч 10 мин перемешивания реакционной массы при 25°С смесь разбавляли 1.0 мл толуола, затем после перемешивания в течение 30 мин добавляли винилэтиловый эфир (0.02 мл) для дезактивации катализатора и ингибитор 2,2'-метилен-бис-(6-трет-бутил-4-метилфенола) (3–4 мг). Полимер осаждали в этанол, содержащий 0.5 мас. % 2,2'-метилен-бис-(6-трет-бутил-4-метилфенола). Коагулировавший полимер отфильтровывали, промывали свежим раствором 2,2'-метилен-бис- (6-трет-бутил-4-метилфенола) в этаноле и сушили в вакууме. Затем полимер заново растворяли в толуоле, содержащем ингибитор окисления, переосаждали этанолом и сушили в вакууме при 40°С до постоянной массы (процедуру повторяли дважды). Выход 0.15 г (75%).
ЯМР 1H (CDCl3, м.д.): 5.49–4.92 (м, 2Н, С(2)Н, С(3)Н), 2.87–2.52 (м, 0.7Н, С(1)Н, С(4)Н), 2.52–2.17 (м, 1.3Н, С(1)Н, С(4)Н), 2.04–1.34 (м, 3Н), 1.24–0.65 (м, 2Н), 0.42–(–0.38) (м, 15Н, Si(CH3)).
ЯМР 13C (CDCl3, м.д.): 134.60–132.50 (С(2), С(3)), 46.95–42.90, 41.1,–40.10, 39.24–37.80, 35.65–32.03, 2.46–1.59 (Si(CH3)3), 0.64–(–1.29) (Si(CH3)2).
ЯМР 29Si (CDCl3, м.д.): 7.49–6.57.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез мономера
В настоящей работе успешно реализован новый одностадийный подход к получению экзо-изомеров кремнийсодержащих норборненов:
 , (1)
, (1)
Предложенный подход основывается на селективном гидросилилировании норборнадиена-2,5 силаном, катализируемом комплексом Pd в присутствии объемного лиганда R-MOP.
Реакцию проводили в присутствии небольшого избытка силана (мольное соотношение норборнадиен-2,5 : пентаметилдисилоксан = 1 : 1.05). Необходимо отметить, что в рассматриваемой реакции образуется только экзо-изомер норборнена, а следов эндо-изомера не удалось обнаружить с помощью хромато-масс-спектрометрии. Единственным побочным продуктом реакции оказался соответствующий кремнийсодержащий нортрицилкан (соотношение продуктов экзо-изомер : : нортрициклан = 80 : 20). Однако это соединение является насыщенным, не будет взаимодействовать с катализатором на следующей стадии и не будет вступать в реакцию полимеризации. Гидросилилирование норборнадиена-2,5 пентаметилдисилоксаном протекает с заметной скоростью только при небольшом нагревании, при комнатной температуре образование продуктов гидросилилирования не удалось обнаружить при проведении реакции в течение нескольких дней. Проведение реакции при 45°С позволяет получать желаемый мономер I (схема (1) ) с большей селективностью, чем при 75°С. Но при температуре реакции 45°С для достижения конверсии норборнадиена-2,5 более 90% требуется несколько недель, в то время как при 75°С практически полная конверсия достигается за 48 ч. В классических условиях гидросилилирования норборнадиена-2,5 силанами происходит образование трех изомерных соединений, при этом экзо-изомер обычно является минорным продуктом [16, 17]:
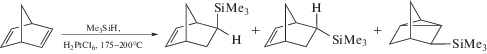 (2)
(2)
В качестве силана в настоящей работе был выбран один из наиболее коммерчески-доступных моногидросиланов – пентаметилдисилоксан. Выбор силана, содержащего фрагмент Si–O–Si, также обусловлен результатами пре-дыдущих исследований, позволяющих ожидать интересные и необычные газотранспортные свойства при введении в мономерное звено полинорборнена гибких силоксановых фрагментов [18–20].
Строение полученного продукта было подтверждено с помощью спектроскопии ЯМР 1H, ЯМР 13C, ЯМР 29Si и масс-спектрометрии (рис. 1).
Метатезисная полимеризация
Наличие напряженной эндоциклической (норборненовой) двойной связи и экзо-ориентация заместителя обеспечивает высокую реакционную способность синтезированного мономера в метатезисе с раскрытием цикла. Катализатором метатезисной полимеризации в работе служил комплекс Граббса первого поколения как один из наиболее доступных и активных однокомпонентных катализаторов. Кроме того, применение такого катализатора позволяет проводить корректное сравнение свойств полимера со свойствами описанных ранее родственных полимеров, синтезированных также в присутствии этого катализатора. Полимеризацию осуществляли в хлороформе при высоком мольном соотношении мономер : катализатор (табл. 1):
Таблица 1.
Метатезисная полимеризация мономера I
| Мольное соотношение мономер : Ru | Выход, % | Mw × 10–3 | Mn × 10–3 | Mw/Mn | Количество цис-звеньев, мол. % |
|---|---|---|---|---|---|
| 3000 : 1 | 75 | 1270 | 1010 | 1.3 | 35 |
| 5000 : 1 | 73 | 1340 | 1230 | 1.1 | – |
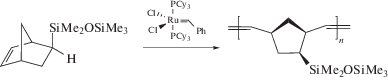 (3)
(3)
Соответствующие полимеры образуются с выходом, близким к количественному (в исходном мономере содержится около 20% кремнийсодержащего нортрициклана, не участвующего в полимеризации) (табл. 1). Молекулярная масса Mw полученных полимеров превышает 1 × 106, при этом молекулярно-массовое распределение остается довольно узким. Согласно данным ДСК, метатезисный полимер на основе мономера I является высокоэластическим (Тс = 9°С). Сравнение с температурой стеклования метатезисного поли(экзо-5-триметилсилилнорборнена) (Тс = 87°С [21]) позволяет сделать вывод, что введение даже одной группы –Me2SiO– в боковой заместитель приводит к заметному снижению температуры стеклования.
На основании результатов рентгенофазового анализа можно заключить, что метатезисный полимер на основе мономера I является аморфным (рис. 2). Его дифрактограмма представлена одним широким пиком, а значение межплоскостных расстояний, рассчитанное по формуле Вульфа–Брэгга, соответствует 6.6 Å. Синтезированный полимер (рис. 2) обладает высокой термической и химической стабильностью. Интересно, что при проведении ТГА анализа на воздухе не наблюдается увеличение массы за счет окисления, т.е. внутренние двойные связи в этих условиях не окисляются.
ЗАКЛЮЧЕНИЕ
В настоящей работе впервые предложен и реализован одностадийный селективный метод синтеза экзо-изомеров кремнийсодержащих норборненов. Метод основывается на прямом гидросилилировании норборнадиена-2,5 неактивированным силаном в присутствии Pd-катализатора в комбинации с объемным лигандом R-MOP. Такой подход приводит к образованию исключительно экзо-изомеров. Отсутствие стадий алкилирования металлорганическими реагентами и фотохимической изомеризации делает подход привлекательным для направленного дизайна и синтеза новых полимерных материалов, обладающих требуемыми свойствами. В частности, в работе продемонстрирована возможность синтеза на основе полученного с использованием предложенного подхода мономера метатезисного полимера с высокими выходом, молекулярной массой и узким молекулярно-массовым распределением.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 18-13-00415).
Список литературы
Alentiev D.A., Egorova E.S., Bermeshev M.V., Starannikova L.E., Topchiy M.A., Asachenko A.F., Gribanov P.S., Nechaev M.S., Yampolskii Y.P., Finkelshtein E.S. // J. Mater. Chem. A. 2018. V. 6. № 40. P. 19393.
Sundell B.J., Lawrence Iii J.A., Harrigan D.J., Vaughn J.T., Pilyugina T.S., Smith D.R. // Rsc Adv. 2016. V. 6. № 57. P. 51619.
Chapala P.P., Bermeshev M.V., Gavrilova N.N. // Polymer Science A. 2017. V. 59. № 1. P. 143.
Bermesheva E.V., Alentiev D.A., Moskalets A.P., Bermeshev M.V. // Polymer Science B. 2019. V. 61. № 3. P. 314.
Bermeshev M.V., Chapala P.P. // Prog. Polym. Sci. 2018. V. 84. № P. 1.
Ivin K.J., Mol J.C. // Olefin Metathesis and Metathesis Polymerization. London: Acad. Press, 1997. P. 224.
Gaylord N.G., Deshpande A.B., Mandal B.M., Martan M. // J. Macromol. Sci. Chem. 1977. V. 11. № 5. P. 1053.
Balciog`lu N., Tunog`lu N. // J. Polym. Sci., Polym. Chem. 1996. V. 34. № 12. P. 2311.
Bermeshev M.V., Bulgakov B.A., Genaev A.M., Kostina J.V., Bondarenko G.N., Finkelshtein E.S. // Macromolecules. 2014. V. 47. № 16. P. 5470.
Finkelshtein E., Gringolts M., Bermeshev M., Chapala P., Rogan Yu. // Membrane Materials for Gas and Vapor Separation. Chichester: Wiley, 2017. P. 143.
Müller K., Jung Y., Yoon D.Y., Agarwal S., Greiner A. // Macromol. Chem. Phys. 2010. V. 211. № 14. P. 1595.
Hermeling D., Schäfer H.J. // Chem. Ber. 1988. V. 121. № P. 1151.
Tsai S.D., Register R.A. // Macromol. Chem. Phys. 2018. V. 219. № 11. P. 1800059.
Petrov V.A., Vasil’ev N.V. // Curr. Org. Synth. 2006. V. 3. P. 215.
Bermeshev M., Chapala P., Lakhtin V., Genaev A., Filatova M., Peregudov A., Utegenov K., Ustynyuk N., Finkelshtein E. // Silicon. 2015. V. 7. № P. 117.
Kuivila H.G., Warner C.R. // J. Org. Chem. 1964. V. 29. № 10. P. 2845.
Stosur M., Szymańska-Buzar T. // J. Mol. Catal. A. 2008. V. 286. № 1. P. 98.
Bermeshev M.V., Syromolotov A.V., Starannikova L.E., Gringolts M.L., Lakhtin V.G., Yampolskii Y.P., Finkelshtein E.S. // Macromolecules. 2013. V. 46. № 22. P. 8973.
Tetsuka H., Isobe K., Hagiwara M. // Polym. J. 2009. V. 41. № 8. P. 643.
Tetsuka H., Hagiwara M., Kaita S. // Polym. J. 2011. V. 43. № 1. P. 97.
Alentiev D.A., Bermeshev M.V., Starannikova L.E., Bermesheva E.V., Shantarovich V.P., Bekeshev V.G., Yampolskii Y.P., Finkelshtein E.S. // J. Polym. Sci., Polym. Chem. 2018. V. 56. № 12. P. 1234.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)