Высокомолекулярные соединения (серия С), 2019, T. 61, № 1, стр. 122-151
Аддитивная полимеризация норборнена с катализаторами на основе соединений переходных металлов: 2008–2018
Д. С. Суслов a, *, М. В. Быков a, О. В. Кравченко a
a Иркутский государственный университет
664003 Иркутск, ул. К. Маркса, 1, Россия
* E-mail: suslov@chem.isu.ru
Поступила в редакцию 01.10.2018
После доработки 03.12.2018
Принята к публикации 24.12.2018
Аннотация
Представлен обзор литературы за период 2008–2018 гг., посвященной аддитивной полимеризации норборнена под действием разнообразных комплексов переходных металлов. Интерес к аддитивным полимерам норборнена обусловлен их диэлектрическими, механическими и оптическими свойствами, что делает их привлекательными для применения в микроэлектронной промышленности и оптике. Рассмотрены закономерности полимеризации с использованием катализаторов на основе Ti, Ir, Ni, Pd и Cu.
ВВЕДЕНИЕ
Настоящий обзор посвящен аддитивной полимеризации бицикло[2.2.1]гептена-2 (норборнена, НБ) с катализаторами координационного типа на основе соединений переходных металлов. В нем рассмотрены результаты исследований, выполненных главным образом после 2008 г. Основные результаты по этой теме в период с начала 1990-х по 2008 гг. были представлены в ряде обзорных статей, опубликованных в отечественной [1–3] и зарубежной печати [4–8]. За прошедшие годы появилось множество публикаций, в которых рассмотрены различные аспекты получения полимеров и сополимеров НБ, их свойства и применение, предложены различные каталитические системы для полимеризации НБ и его производных. Последние достижения и тенденции в области полимеризации производных норборнена, а также сополимеризации НБ с олефинами были обобщены в работах [9–13] и в данном обзоре подробно рассматриваться не будут.
В общем случае полимеризация НБ в зависимости от типа используемого инициатора может протекать по трем направлениям, приводящим к образованию полимеров с отличающимся строением звеньев и разными свойствами образующихся материалов:
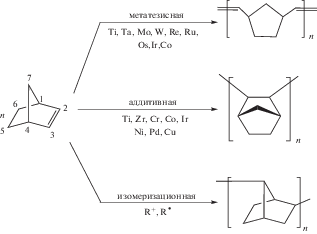
Полимеризация НБ и его производных при участии катализаторов метатезиса протекает с раскрытием цикла (ROMP). Получаемые полиалкенамеры содержат по одной двойной связи на каждое звено. По этим двойным связям полимеры могут быть вулканизированы. Сшитые таким образом полимеры применяются прежде всего как вибро- и звукогасящие эластомерные материалы. Пористые метатезисные полимеры используются как абсорбенты для сбора разливов нефти (торговая марка полимера – Norsorex®). Гидрированные метатезисные полинорборнены нашли применение в оптической и электронной промышленности (Zeonex®). Наиболее известным промышленным катализатором метатезисной полимеризации НБ служит система RuCl3/HCl в н-бутаноле [3, 6, 14–16]. Другие промышленные ROMP-процессы проводятся главным образом с использованием в качестве катализаторов соединений W, Mo, Re и Ru в виде галогенидов, оксидов или оксохлоридов в сочетании с алкилирующими (например, R4Sn, Et2AlCl) и промотирующими агентами. В академических исследованиях, как правило, применяют заранее сформированные металлокарбены на основе вольфрама, молибдена, рутения. В литературе имеются сообщения о метатезисной полимеризации НБ под действием титановых, циркониевых, ванадиевых, ниобиевых, танталовых, осмиевых, рениевых катализаторов (см. литературу в обзоре [6]), а также катализаторов на основе органических соединений с дополнительным фото- или электрохимическим инициированием [17]. Необходимо отметить, что метатезисная полимеризация норборнена протекает довольно легко в результате раскрытия напряженного цикла [18, 19]. Из численных значений функции Гиббса (ΔG$_{{298}}^{^\circ }$ = –47 кДж/моль) следует, что равновесие метатезисной полимеризации НБ полностью сдвинуто в сторону образования продуктов [18–20]. Это позволяет в свою очередь относительно просто вовлекать в ROMP норборнены с различными заместителями [18, 21]. Литература по метатезисной полимеризации различных производных норборнена проанализирована в ряде обзоров и монографий [11, 22–33].
Под действием катионных и радикальных инициаторов протекает изомеризационная олигомеризация (полимеризация) НБ [34–38]. Как правило, продуктами являются олигомеры с 2,7-соединением мономера [3, 6]. Инициаторами радикальной полимеризации могут служить, например, 2,2-азо-бис-изобутиронитрил или трет-бутилперацетат. Катионную полимеризацию может инициировать, например, EtAlCl2 [37], B(C6F5)3, BF3 ⋅ OEt2 [38] (см. также литературу в этой работе) в комбинации с протонодонорными соединениями.
АДДИТИВНАЯ ПОЛИМЕРИЗАЦИЯ НОРБОРНЕНА
НБ и его производные можно полимеризовать, оставляя бициклическую структуру нетронутой, раскрывая только двойную связь. Такой тип полимеризации получил название аддитивной (винильной) полимеризации бициклических углеводородов. Образующиеся полимеры не содержат двойных связей. Аддитивные полимеры норборнена (ПНБ) и его производных проявляют комбинацию уникальных свойств, что делает их привлекательными для применения в электронной промышленности и оптике (оптоволоконные материалы, подложки для дисплеев, фоторезистивные материалы, материалы для микроэлектронных компонентов), а также для мембранного газоразделения [3, 6, 10, 11, 39, 40]. Наиболее известными торговыми марками промышленных аддитивных полимеров НБ и их сополимеров с олефинами являются Avatrel® (“Promerus”; “Sumitomo Bakelite Co.”) и Topas® (“TOPAS Advanced Polymer’s”; “Daicel Corporation and Polyplastics Co.”).
Каталитические системы на основе соединений переходных металлов IV группы нашли промышленное применение в процессах сополимеризации норборнена с олефинами [39]. Однако в случае гомополимеризации НБ и его производных цирконоценовые катализаторы обычно приводят к высококристаллическим не растворимым в обычных органических растворителях аддитивным полимерам с высокой температурой стеклования, близкой к температуре разложения. Последующие исследования показали, что наиболее перспективными являются катализаторы на основе соединений никеля и палладия [1–3].
Анализ опубликованных за последнее десятилетие работ по аддитивной полимеризации бициклических углеводородов ряда НБ под действием металлокомплексных катализаторов позволяет выделить четыре группы катализаторов.
1. Индивидуальные катализаторы на основе катионных комплексов, как правило, содержащих связь металл–углерод.
2. Каталитические системы на основе нейтральных комплексов со связью металл–углерод.
3. Каталитические системы, состоящие из комплексов палладия и никеля, в сочетании с кислотами Льюиса или Бренстеда.
4. Циглеровские каталитические системы на основе металлокомплексов, в основном нейтральных, в сочетании с аланами, преимущественно с метилалюмоксаном (МАО) или (и) с борорганическими соединениями, главным образом с трис-(пентафторфенил)боратом.
Однокомпонентные катализаторы на основе индивидуальных катионных комплексов
По литературным данным, в ряду однокомпонентных катализаторов для аддитивной полимеризации НБ наиболее часто упоминаемым является комплекс палладия [Pd(MeCN)4]2+[(BF4)2]2− (Pd-1) [41] (комплекс устойчив при хранении под аргоном, однако быстро разлагается при контакте с воздухом [42]). Этот катализатор впервые был предложен для олигомеризации и полимеризации олефинов в 1981 г. А. Sen с сотрудниками. Его каталитические свойства были изучены и представлены в публикациях [43–47]. Однако в случае НБ распространение в качестве катализатора этот комплекс получил только после публикации серии работ W. Risse с сотрудниками в 1991–1992 гг., посвященных аддитивной полимеризации НБ и его производных под действием ряда комплексов общей формулы [Pd(RCN)4][BF4]2 (R = Me, Et, t-Bu; Pd-1, Pd-2 и Pd-3 соответственно) [41, 48, 49]. При полимеризации НБ в среде нитрометана были получены полностью насыщенные полимеры c Mn до 7 × 104 и Mw/Mn = 1.3–1.5, не растворимые в толуоле, ТГФ, CHCl3 или CH2Cl2, но растворимые в галогенированных ароматических растворителях и CCl4. Обнаруженная в перечисленных работах практически линейная зависимость Mn от конверсии указывает на протекание полимеризации по механизму “живых” цепей. Эта особенность также подтверждается другими авторами [42, 50, 51]. По данным работ [51, 52] максимальная средняя активность A комплексов Pd-1–Pd-3 в полимеризации НБ может достигать до 2 × 105 г НБ/(моль Pd ч).
Несколько позднее были синтезированы и испытаны [53, 54] в полимеризации НБ комплексы общей формулы [Pd(MeCN)2(Y–(CH2)2–XPh2)][BF4]2 (Pd-5: X = As, Y = SMe; Pd-6: X = P, Y = SMe; Pd-7: X = P, Y = PPh2) модифицированные сера-, фосфор- и мышьякорганическими бидентатными лигандами. Активность таких комплексов не превышает 3.8 × 104 г ПНБ/(моль Pd ч). Таким образом, введение сера-, фосфор- и мышьякорганических заместителей в лиганд существенно снижает активность катализаторов данного типа [53]. При полимеризации НБ в ионной жидкости (бис-(трифторметилсульфонил)имид N-бутил-N-триметиламмония) в присутствии комплекса Pd-1 авторами [42] было показано, что образуются полимеры с Mn в интервале (1.1–4.7) × 104 и с относительно широким ММР (3.1–5.6).
Необходимо отметить, что с использованием дикатионных палладиевых комплексов [42, 53–57] также была изучена полимеризация ряда производных норборнена (НБ-R, где R = CH3, н-C4H9, C7H15, C9H19, C11H23, C6H5, п-Cl(C6H4), м-NO2(C6H4), –CH=CH2), содержащих заместители в пятом положении бициклического фрагмента. Было установлено, что введение функциональной группы в структуру НБ приводило к замедлению полимеризации [55–57]. При этом реакционная способность мономеров зависела от их конформации: при использовании мономеров, синтезированных по реакции Дильса–Альдера и содержащих до 80% эндо-формы, выход полимеров был умеренным (до 30%). Фактически в полимеризации участвовали только экзо-конформеры. В то же время полимеризация специально синтезированных экзо-мономеров привела к получению полимеров с выходом до 85% [55–57]. Причина такого явления более детально рассмотрена в следующем разделе обзора. При полимеризации 5-винилнорборнена удалось получить [42] только олигомеры с числом мономерных звеньев в цепи до 9. Это объясняется авторами [42] возможностью обрыва цепи по механизму β-гидридного сдвига после внедрения винильной группы мономера по связи Pd–C.
Несмотря на наличие в литературе различных взглядов на механизм действия дикатионных
комплексов палладия в реакциях олигомеризации и полимеризации ненасыщенных углеводородов
[43, 44, 47], наиболее вероятным представляется механизм полимеризации НБ и его производных с
участием катионных гидридных комплексов, получаемых in situ в реакционной смеси. В
частности [48], при полимеризации НБ добавка значительного количества воды (до [H2O]0:[Pd]0 = 1000:1) в реакционную смесь не останавливала полимеризацию. Таким образом, можно
сделать вывод, что полимеризация не протекала по катионному механизму. Данный факт
находится в противоречии с карбкатионным механизмом, предложенным A. Sen с сотрудниками
и обоснованным рядом экспериментальных доводов на примере полимеризации стирола и
дивинилбензола [43, 44, 47]. Известно [58, 59], что гидридные комплексы палладия могут быть получены в вакер-процессе по реакции
между комплексами палладия, этиленом и водой. В случае дикатионных комплексов палладия
общей формулы [Pd(H2O)2(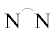 )][OTf]2 (
)][OTf]2 ( – дииминовые лиганды, OTf – трифторметансульфонат) в работе [60] было установлено, что реакция полимеризации этилена эффективно протекает только
при добавлении воды в качестве инициатора процесса ([H2O]0 : [Pd]0 = 10…200 : 1). Мониторинг реакции методом хроматомасс-спектрометрии показал образование
ацетальдегида (в случае полимеризации этилена) и 2-гексанона (в случае полимеризации
гексена-1) в качестве продуктов реакции формирования катализатора. Более того, в работе
[61] было установлено, что при взаимодействии Pd(
– дииминовые лиганды, OTf – трифторметансульфонат) в работе [60] было установлено, что реакция полимеризации этилена эффективно протекает только
при добавлении воды в качестве инициатора процесса ([H2O]0 : [Pd]0 = 10…200 : 1). Мониторинг реакции методом хроматомасс-спектрометрии показал образование
ацетальдегида (в случае полимеризации этилена) и 2-гексанона (в случае полимеризации
гексена-1) в качестве продуктов реакции формирования катализатора. Более того, в работе
[61] было установлено, что при взаимодействии Pd( )(OTf)2 (
)(OTf)2 ( = = 1,2-(CH2P(t-Bu)2)2C6H4) с метанолом образуются непосредственно катионные гидридные комплексы палладия общей
формулы [Pd(
= = 1,2-(CH2P(t-Bu)2)2C6H4) с метанолом образуются непосредственно катионные гидридные комплексы палладия общей
формулы [Pd( )H(S)]OTf (S = = MeOH, n-PrOH, ТГФ, EtCN).
)H(S)]OTf (S = = MeOH, n-PrOH, ТГФ, EtCN).
Другим типом известных палладиевых однокомпонентных катализаторов для полимеризации циклоолефинов являются метильные катионные комплексы, которые широко применяются при изучении механизмов реакций олиго- и полимеризации олефинов [62–67]. Это обусловлено тем, что они наиболее близко моделируют структуру предполагаемого активного гидридного катионного комплекса. Катионный комплекс палладия состава [(tmeda)Pd(OEt2)(Me)][BAr$_{4}^{{\text{F}}}$] (Pd-8, tmeda – тетраметилэтилендиамин, BAr$_{4}^{F}$ = = B[3,5–C6H3(CF3)2]4) был использован группой M.S. Brookhart с сотрудниками для изучения структурных особенностей реакции внедрения норборнена по связи металл–углерод [68]. В этой работе обсуждаемый комплекс палладия получали протонированием диметильного комплекса (tmeda)PdMe2 кислотой Брэнстеда. При изучении методами ЯМР и РСА продуктов внедрения НБ было установлено, что внедрившийся норборниловый фрагмент стабилизирован в структуре комплекса агостическим взаимодействием γ-эндо-водорода с металлическим центром. Фрагмент растущей цепи, по мнению авторов [68], можно представить так:
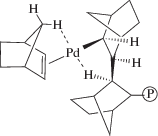
Позднее [69] также были выделены и охарактеризованы, в том числе методом РСА, продукты внедрения первой молекулы НБ по связи Pd–Me при использовании амино-пиридиновых исходных комплексов типа {[RHNCH2(o-C6H4N)]Pd(Me)(NCMe)}BF4 (R = = i-Pr (Pd-9), t-Bu (Pd-10), Ph (Pd-11), 2,6-Me2C6H3 (Pd-12), 2,6-(i-Pr)2C6H3 (Pd-13)). В этой же работе [69] приведены результаты формально-кинетического исследования внедрения НБ по связи Pd–C и определены активационные параметры данной стадии (ΔH‡ = 13.8 ккал/моль, ΔS‡ = = –8.9 кал/(моль K)) с участием комплекса Pd-13.
Интересными представляются результаты работы [70], в которой методом твердофазного ЯМР охарактеризованы нерастворимые продукты, полученные
при полимеризации НБ в присутствии однокомпонентных катализаторов типа [( )Pd(Me)(MeCN]BAr$_{4}^{{\text{F}}}$ (
)Pd(Me)(MeCN]BAr$_{4}^{{\text{F}}}$ ( – бидентатный имин–NHC-карбеновый лиганд) в атмосфере водорода:
– бидентатный имин–NHC-карбеновый лиганд) в атмосфере водорода:
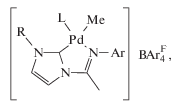
где L = ацетонитрил, Ar = 2,6-(i-Pr)2-C6H3, R = Me (Pd-14) или мезитил (Pd-15).
Согласно этим данным, в нерастворимой фракции ПНБ присутствовали изомеризованные 2,7-структры мономерного звена. Авторы предполагают, что наличие таких единиц в цепи способствует образованию более жесткой спиральной структуры ПНБ, влияющей на растворимость полимеров, получаемых на палладиевых катализаторах. Стоит отметить, что получение нерастворимых ПНБ в присутствии палладиевых катализаторов – явление довольно распространенное.
При изучении непосредственно полимеризационных процессов катионные метильные комплексы палладия, как правило, генерируют in situ в реакционной среде (см. следующий раздел). Непосредственно в качестве однокомпонентных катализаторов такие комплексы проявляют низкую активность в полимеризации НБ, поскольку содержат стабилизирующий лиганд (например, пиридин, ацетонитрил и т.п.) в цис-положении по отношению к активной связи металл–углерод, препятствующий координации мономера.
В работе [71] метильные комплексы палладия с α-дииминовыми лигандами [{ArN=C(R)–C(R)=NAr}Pd(Me)(MeCN)]BAr$_{4}^{{\text{F}}}$ (Pd-16: R = H, Ar = 2,6-Me2C6H3; Pd-17: R = CH3, Ar = 2,6-(i-Pr)2C6H3; Pd-18: R=CH3, Ar = 2-(t-Bu)C6H4; Pd-19: C(R)–C(R) = аценафтен, Ar = 2,6-(i-Pr)2C6H3) были использованы в качестве катализаторов полимеризации НБ. Однако их активность была низкой и не превышала 1 × 103 г ПНБ/(моль Pd ч). Низкую активность (2 × 103 г ПНБ/(моль Pd ч)) в гомополимеризации НБ также продемонстрировали предложенные в работе [72] для сополимеризации НБ с этиленом нейтральные метильные комплексы палладия с β-кетиминовыми лигандами:
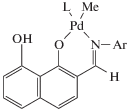
(здесь L = ДМСО (Pd-20) или пиридин (Pd-21), Ar = 2,6-(i-Pr)2-C6H3).
Ряд палладиевых и никелевых фосфин-сульфонатных однокомпонентных катализаторов [(o-R2PC6H4SO3)Mt(η3-аллил)] (Mt = Ni: R = Ph (Ni-1), o-MeO-C6H4(Ni-2), Cy (Ni-3); Mt = Pd, R = Cy (Pd-22)) был испытан [73] в реакции полимеризации НБ. Палладиевый комплекс активности в полимеризации НБ не проявил; никелевые комплексы Ni-1–Ni-3 продемонстрировали низкую активность в полимеризации НБ (A < 1.5 × 103 г ПНБ/(моль Ni ч), T = 100°C). В то же время выделенный цвиттер-ионный аддукт никелевого комплекса Ni-3 с B(C6F5)3
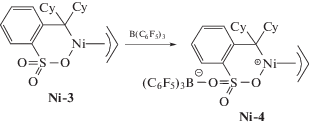
показывает активность в полимеризации НБ до 1.2 × 107 г ПНБ/(моль Ni ч) при 100°C (цвиттер-ионная структура для Ni-4 предполагается авторами из анализа длин связей в комплексе по данным РСА). Таким образом, можно предположить, что в процессе полимеризации норборнена в присутствии нейтральных никелевых фосфин-сульфонатных комплексов протекает формирование in situ активных катионных комплексов в результате гемилабильного поведения фосфинсульфонатного лиганда и образования внутримолекулярных цвиттер-ионных структур.
По существу аналогичная тенденция наблюдалась при изучении роли катионных и нейтральных палладиевых комплексов в олиго- и полимеризации норборнена, представленных в работах [74–76]. Авторы [74, 76] использовали добавки AgOTf и Cp2Co к фосфиносульфонатному метильному комплексу палладия для изменения заряда металлокомплекса:
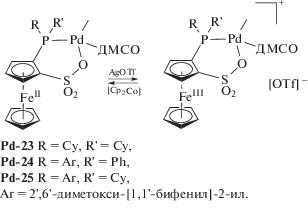
Было установлено [74, 76], что при добавлении Cp2Co олигомеризация НБ прекращалась, а при введении AgOTf и получении катионных комплексов Pd-23–Pd-25 реакция олигомеризации, напротив, возобновлялась. Такие переключения можно было осуществлять несколько раз в процессе превращения НБ (в качестве продуктов выделены олигомеры НБ: Mn = 720–810, Mw/Mn = = 1.9). Близкие результаты были получены в работе [75] при использовании ферроцен-гетероскорпионатного комплекса [(fc(PPh2){BH{(3,5-Me)2pz}2})PdMe][BAr$_{4}^{{\text{F}}}$] (Pd-26, fc = 1,1′-ферроцендиил, pz = пиразол). Однако в этом случае образуется нерастворимый ПНБ [75], активность катализатора невысока: 6.0 × 103 г ПНБ/(моль Pd ч).
Также в полимеризации НБ нашли применение различные аллильные11 комплексы палладия и никеля. Аллильные комплексы переходных металлов характеризуются тем, что содержат потенциально активную связь металл–углерод в аллильной форме [77]. При определенных условиях π-аллильная группа может трансформироваться в динамичную аллильную, а затем и в σ-аллильную структуру [78–80]. Создается ситуация, при которой мономер может занимать свободные координационные места в цис-положении к связи металл–углерод. Необходимо отметить, что однокомпонентные катализаторы, представляющие собой катионные аллильные комплексы никеля и палладия
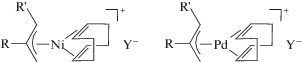 ,
,
где R, R′ = H, CH3; Y− = PF$_{6}^{ - }$, BF$_{4}^{ - }$, B(C6F5)$_{3}^{ - }$, по данным, опубликованным в брошюре компании “Promerus” [81], являются важнейшими промышленными катализаторами для полимеризации НБ и его производных. Разработка таких катализаторов была выполнена B.L. Goodall с сотрудниками в лаборатории фирмы “BF Goodrich” [7, 82]. Показано что, активность никелевых комплексов может превышать 2 × 106 г ПНБ/ (моль Pd ч) при комнатной температуре и считается самой высокой для однокомпонентных катализаторов [83]. Палладиевые аналоги демонстрируют весьма умеренную активность порядка 1 × 104 г ПНБ/(моль Pd ч).
В связи с этим аналогичные аллильные комплексы никеля и палладия в последние годы были использованы для исследования особенностей внедрения НБ по связи металл–углерод и для разработки новых однокомпонентных катализаторов. В случае никелевых катионных комплексов состава [(2-R-аллил)Ni(L)][B(ArF)4], (Ni-5: R = H, L = (MeCN)2; Ni-6: R = H, L = мезитилен; Ni-7: R = Me, L = мезитилен) [83] было экспериментально установлено, что внедрение НБ по связи Ni–аллил протекает обратимо. Внедрение первой молекулы НБ стабилизируется координацией двойной связи аллильного структурного фрагмента согласно схеме
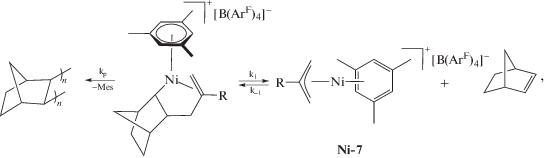
где R = Me, Mes – мезитилен.
Формально в случае обратимого внедрения НБ по связи Ni-аллил можно предполагать наличие β-гидридного сдвига от норборненового фрагмента. Однако из-за стерических затруднений в бициклическом фрагменте β-водород (как в экзо- так и в эндо-положениях), вероятнее всего, недоступен для агостического взаимодействия с металлом. Необходимо предполагать, что процесс элиминирования НБ протекает сложнее.
В работе [84] было проведено аналогичное исследование на близких по составу катионных аллильных палладиевых комплексах. Авторами указанной работы установлено обратимое внедрение НБ по связи Pd–аллил; выделены и охарактеризованы методом РСА продукты такого внедрения. Было показано, что вторая молекула норборнена координируется к палладиевому центру бидентатно: η2-координация олефина дополнительно стабилизируется агостическим взаимодействием с водородом в седьмом положении бицикла
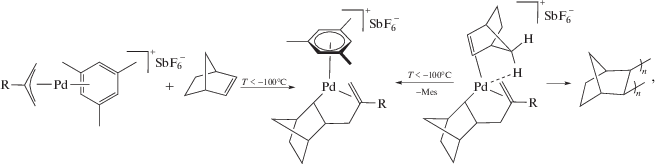
где R = Cl (Pd-27) и Me (Pd-28).
На основе выделенных комплексов палладия авторами [84] предложены новые аллильные однокомпонентные катализаторы, активность которых достигает 5.6 × 105 г ПНБ/(моль Pd ч). Получаемые полимеры имеют относительно узкое ММР, однако полимеризация не протекает в режиме “живых” цепей [84]. Внедрение НБ по связи Pd–аллил недавно [85, 86] также было исследовано методами квантовой химии в приближении теории функционала плотности. Был сделан вывод [85] о том, что в под действием “обнаженных”22 палладиевых катализаторов с высокой селективностью должны образовываться ПНБ с цис-дисиндиотактичной микроструктурой.
Каталитические системы на основе нейтральных комплексов со связью металл–углерод
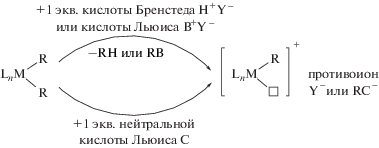
В основе концепции формирования каталитических систем обсуждаемых в данном разделе, по существу, лежат два процесса [62]. В первом, наиболее распространенном варианте, используют реакцию замещения атома галогена в нейтральном комплексе, содержащем связь металл–углерод, в присутствии слабо координирующего лиганда или непосредственно субстрата:
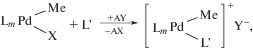
где А = Ag, щелочной металл; X = галоген; Y– = = слабо- или некоординирущий анион; L' = = слабокоординирующий лиганд или молекула ненасыщенного углеводорода; L = моно- или мультидентатный лиганд.
Во втором случае используют протонирование нейтральных диалкильных комплексов переходных металлов или селективное замещение одной алкильной группы сильной кислотой Льюиса [62]:
Подход удобен тем, что побочные продукты реакции представляют собой мало реакционноспособные газы. Ранее этот метод широко использовали для металлоценов начала переходного ряда при приготовлении комплексов или катализаторов in situ: часто применяются соли диметиланилина как источник протонов, или соединения триарилбора, играющие роль кислоты Льюиса, и используемые для замещения одной метильной (алкильной) группы [39].
В случае НБ в качестве катализаторов полимеризации в основном применяются генерированные in situ катионные аллильные и метильные комплексы, а также комплексы палладия с σ,π-бициклическим лигандом, получаемые in situ:
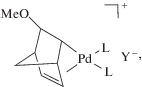
где Y− = [BF4]−, [SbF6]−; L — молекула растворителя или субстрата.
Впервые аналогичные стабилизированные циклооктадиеном комплексы палладия как однокомпонентные катализаторы для полимеризации НБ были предложены в патенте компании “BF Goodrich” B.L. Goodall [87]. Позднее B.S. Heinz и F.P. Alt установили [88], что генерирование in situ таких комплексов замещением галогена солями серебра приводит к существенному повышению их каталитической активности (до 1.8 × 105 г ПНБ/(моль Pd ч)).
Необходимо отметить, что получаемые in situ катионные метильные комплексы палладия являются “чемпионами” по каталитической активности в полимеризации НБ. Еще в 2001 г. в работе [89] было установлено, что композиция состава (COD)Pd(Me)Cl/PPh3/NaBAr$_{4}^{{\text{F}}}$ позволяет полимеризовать НБ с активностью до 1.0 × 109 г ПНБ/(моль Pd ч), получаемый ПНБ нерастворим. Недавно был предложен [90] чрезвычайно эффективный катализатор полимеризации НБ, состоящий из алкильного(арильного) комплекса палладия с хиральным бис-оксазолиновым лигандом (Pd-29–Pd-31)
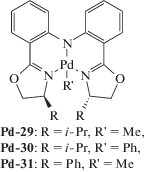
и [Ph3C][B(C6F5)4]. Полимеризацию НБ можно было осуществлять на воздухе и даже в присутствии небольших количеств воды в растворителе. Активность каталитической системы Pd-29/[Ph3C][B(C6F5)4] достигала 2.2 × 109 г ПНБ/(моль Pd ч) [90], полимеризация протекала за 15 с при производительности в 100 000 моль НБ на моль Pd (частота оборотов 6666 с–1!). При таких скоростях стоит учитывать возможный “саморазогрев” реакционной смеси при реализации этой экзотермической реакции. Можно предположить, что такие значения активности могли быть получены не в изотермических условиях процесса. Для никелевых катализаторов полимеризации НБ “саморазогрев” реакционной смеси представляет определенную технологическую проблему [7].
В работе [91] были предложены каталитические системы на основе циклопентадиенильных комплексов палладия и никеля. Было показано, что каталитическая система состава Pd-32/[Ph3C][BAr$_{4}^{{\text{F}}}$] (Pd-32 = CpPd(η3-аллил)) проявляет чрезвычайно высокую активность в полимеризации НБ до 1.1 × 108 г ПНБ/(моль Pd ч). Авторы не обсуждают механизм формирования активных комплексов в данных системах. Вероятнее всего, происходит атака карбкатиона по циклопентадиенильному лиганду с образованием замещенного циклопентадиена и “обнаженного” катионного аллильного комплекса палладия. Это предположение хорошо согласуется с более легкой η5–η1-перегруппировкой циклопентадиенильной группы при палладии по сравнению с аллильным лигандом [92].
В свою очередь введение фосфорорганических или NHC-карбеновых лигандов в координационную сферу палладия снижает каталитическую активность π-аллильных комплексов. В частности, в работе [93] активность каталитической системы (NHC)Pd(η3-аллил)Cl/NaBAr$_{4}^{{\text{F}}}$ (NHC = 1,3-Ar2-нафтахинимидозолиден; Pd-33: Ar = 2,6-Me2-C6H3, Pd-34: 2,6-(i-Pr)2-C6H3) составляет 2.5 × 103 г ПНБ/(моль Pd ч), продукт полимеризации нерастворим.
Последние 10 лет обсуждаемые в данном разделе типы каталитических систем использовались в основном для осуществления реакций гомополимеризации производных НБ или их сополимеризации с НБ. Несмотря на то, что аддитивная полимеризация НБ является термодинамически более выгодной (ΔG$_{{298}}^{^\circ }$ = –106 кДж/моль, [20]), чем метатезисная, вовлечение в обсуждаемую реакцию замещенных НБ не всегда протекает легко. Основным затруднением при полимеризации производных НБ является наличие двух изомерных форм мономера. Как правило, производные норборнена синтезируют по реакции Дильса–Альдера между циклопентадиеном и соответствующим олефином. Получаемый продукт содержит две изомерных формы мономера: экзо и эндо, при этом последняя с большим трудом вступает в полимеризацию. В случае замещенных НБ, содержащих функциональную группу, способную к координации к переходному металлу, в качестве основной причины рассматриваемой проблемы отмечают блокирование вакантного места в структуре активного комплекса необходимого для координации следующей молекулы субстрата [6]:
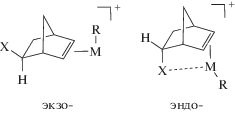
Это в свою очередь выводит переходный металл за пределы каталитического цикла полимеризации. Для эндо-производных НБ, не способных к образованию хелатов с переходным металлом (при координации или после внедрения молекулы мономера), необходимо рассматривать и другие причины снижения их реакционной способности в полимеризации. В частности, недавно в теоретическом исследовании [85] было показано, что полимеризация эндо-цис-5-норборнен-2,3-дикарбоксиангдрида в присутствии [Pd(η3-аллил)(CH3NO2)2]SbF6 не является термодинамически предпочтительной, поскольку для продуктов внедрения второй молекулы эндо-мономера значение энергии Гиббса выше, чем для исходного интермедиата.
Из анализа литературы можно выделить четыре способа решения указанной выше проблемы: 1) синтез мономеров, содержащих только экзо-форму производного норборнена [41, 48, 55, 56, 94, 95]; 2) пространственное удаление функциональной группы от ответственной за процесс двойной связи мономера [96–103]; 3) разработка катализаторов, способных предварительно изомеризовать эндо- в экзо-мономер по маршруту ретро-реакции Дильса–Альдера с последующей полимеризацией экзо-мономера [104]; 4) разработка катализаторов, способных эффективно полимеризовать обе изомерные формы мономера [105–110]. В последнем случае осуществить полимеризацию производных НБ можно путем использования специально разработанных каталитических систем. Консенсус среди исследователей заключается в применении в качестве предшественников катализаторов комплексов палладия с объемными и оснóвными фосфорорганическими или NHC-карбеновыми лигандами. На примере катионных палладиевых предшественников со связью Pd–C такой подход был, в частности, проиллюстрирован в работах [106, 110]. В присутствии каталитической системы Pd-35/NaBAr$_{4}^{{\text{F}}}$ (Pd-35 = (t-Bu3P)Pd(Me)Cl) было показано, что введение в координационную сферу палладия объемного три(трет-бутил)фосфинового лиганда, позволяет осуществлять полимеризацию двух изомеров при сопоставимой скорости (kendo/kexo = = 2.3). Каталитические системы, модифицированные объемным трициклогиксилфосфиновым лигандом Pd-32/PCy3/[Ph3C][BAr$_{4}^{{\text{F}}}$] [107]), NHC-карбеновым лигандом (Pd-36/AgSbF6 [108], Pd-36 = = [(NHC)Pd(η3-аллил)Cl], NHC = N,N'-бис-(2,6-диизопропилфенил)-имидазол-2-илиден) или даже более доступным PPh3 (Pd-37/nBF3 · OEt2 [109], Pd-37 = [(АcАc)Pd(PPh3)2]BF4), могут быть также использованы для этой цели. Более детальная информация по данной теме содержится в обзорах [10, 11].
Каталитические системы, представленные сочетанием комплексов палладия или никеля с кислотами
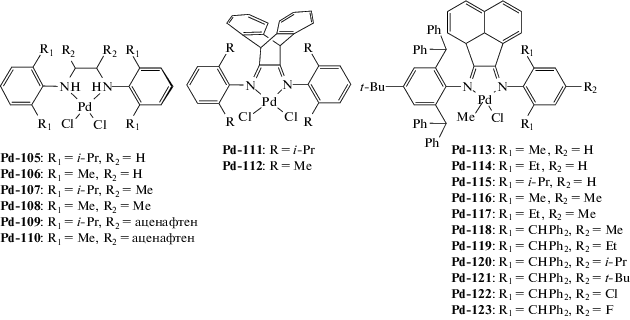
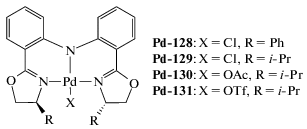
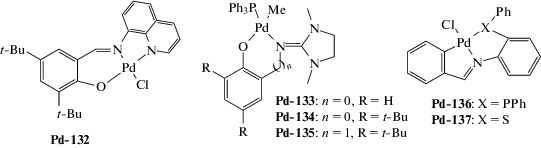
Альтернативным направлением разработки каталитических систем для полимеризации НБ является использование комбинации комплексов палладия и никеля в сочетании с кислотами Льюиса. Здесь необходимо отметить каталитические системы на основе β-дикетонатов палладия и эфирата трифторида бора [111–121]. Данные системы также нельзя отнести к циглеровским. Они не содержат π-аллильных комплексов, исходный комплекс палладия не имеет активной связи Pd–C. Несмотря на все отличия этих систем от традиционных, авторы указанных работ предполагают, что в них активными являются гидриды палладия. Впервые такие катализаторы были описаны в 1980 г. для процессов димеризации этилена и пропилена [111]. В дальнейшем каталитические системы на основе β-дикетонатов палладия и молекулярных комплексов трифторида бора были исследованы в ряде других процессов превращения ненасыщенных углеводородов [113, 118–120, 122–126]. В работах [123, 124] показано, что в присутствии каталитической системы Pd(АcАc)2/nBF3 ⋅ OEt2 в среде толуола полимеризация НБ протекает с активностью в среднем до 1.1 × 106 г ПНБ/(моль Pd ч). При этом на основании данных ЯМР-спектроскопии авторами был сделан вывод о необычной изомеризованной 2,7-структуре звена полимерной цепи. Однако затем по данным ИК-спектроскопии и твердофазного ЯМР образцов [121] эти результаты были интерпретированы в пользу неизомеризованной 2,3-аддитивной структуры. Каталитические системы на основе карбоксилатов палладия типа Pd(OCOR)2/nBF3 · OEt2 также позволяют проводить и полимеризацию НБ с высокой эффективностью [121, 127–129]. Позднее в литературе появились сообщения об использовании новых каталитических композиций близкого состава. Были предложены катализаторы на основе Pd(АcАc)2 и карбоксилатных комплексов палладия в сочетании c [NHMe2Ph][BAr$_{4}^{{\text{F}}}$] для полимеризации разнообразных производных НБ [130–137]. Необходимо отметить, что карбоксилатные комплексы палладия [(R3P)2Pd(κ2–O,O-O2CR')][B(C6F5)4] (Pd-38: R = Cy, R' = Me; Pd-39: R = Cy, R' = t-Bu; Pd-40: R = Cy, R' = Ph; Pd-41: R = i-Pr, R' = Me) в индивидуальном виде катализируют полимеризацию 5-децил-НБ и 5-бутил-НБ [132].
По существу в основе проявления каталитической активности систем типа Pd(β-дикетонат)2/(кислота Льюиса) лежит хорошо известная способность β-дикетонатного лиганда при палладии изменять форму координации из бидентатной O,O-хелатносвязанной формы в монодентатную С3-связанную форму [138, 139]. В случае полимеризации незамещенного НБ в последние годы рассматриваемые каталитические системы получили свое развитие путем применения катализаторов на основе катионных ацетилацетонатных комплексов палладия в сочетании с BF3 ⋅ OEt2. В серии работ были синтезированы такие комплексы с фосфор- и азотсодержащими лигандами [109, 140, 149, 141–149 ] и протестированы в полимеризации НБ (Pd-37, Pd-42–Pd-64):
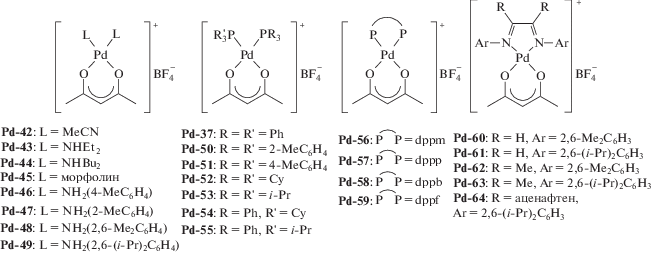
Большинство полученных образцов комплексов демонстрируют относительную устойчивость
при хранении на воздухе. При этом испытанные образцы катализаторов для получения ПНБ
характеризуются низкой чувствительностью к кислороду воздуха и влаге. Испытания каталитических
систем на основе комплексов с моно- (Pd-37, Pd-50–Pd-55) и бидентатными (Pd-56–Pd-59)
фосфорорганическими лигандами в сочетании BF3 ⋅ OEt2 в полимеризации НБ показали, что их активность в определенных условиях может достигать
до 3 × 108 г ПНБ/(моль Pd ч) [109]. Однако в среднем активность данных систем находится в пределах (2–3) × 106 г ПНБ/(моль Pd ч) при 60°C [109, 140, 150], при этом получаемые ПНБ ограничено растворимы в 1,2,4-трихлорбензоле. Нерастворимые
ПНБ также [143] были получены при использовании ряда катионных комплексов палладия состава [Pd(АcАc)( )]BF4 (
)]BF4 ( – α-дииминовые лиганды, Pd-60–Pd-64), они проявляют в среднем умеренную активность
до 9.4 × × 105 г ПНБ/(моль Pd ч). Аналогичные каталитические системы на основе комплексов Pd-46–Pd-49
с анилиновыми лигандами демонстрируют активность до 5.6 × 106 г ПНБ/(моль Pd ч) [144], которая сопоставима со средней активностью систем на основе комплексов палладия
в сочетании с алюминий- или борорганическими соединениями (см. следующий раздел).
В работе [148] было показано, что устойчивый на воздухе комплекс Pd-42 проявляет умеренную активность
в полимеризации НБ без добавок сокатализатора (до 1.6 × 105 г ПНБ/(моль Pd ч)). При добавке 20 мольных частей BF3 ⋅ OEt2 активность такой каталитической системы возрастает до 1.0 × 107 г ПНБ/(моль Pd ч).
– α-дииминовые лиганды, Pd-60–Pd-64), они проявляют в среднем умеренную активность
до 9.4 × × 105 г ПНБ/(моль Pd ч). Аналогичные каталитические системы на основе комплексов Pd-46–Pd-49
с анилиновыми лигандами демонстрируют активность до 5.6 × 106 г ПНБ/(моль Pd ч) [144], которая сопоставима со средней активностью систем на основе комплексов палладия
в сочетании с алюминий- или борорганическими соединениями (см. следующий раздел).
В работе [148] было показано, что устойчивый на воздухе комплекс Pd-42 проявляет умеренную активность
в полимеризации НБ без добавок сокатализатора (до 1.6 × 105 г ПНБ/(моль Pd ч)). При добавке 20 мольных частей BF3 ⋅ OEt2 активность такой каталитической системы возрастает до 1.0 × 107 г ПНБ/(моль Pd ч).
Особую группу катализаторов для полимеризации НБ представляют системы на основе комплексов никеля в нулевой степени окисления в сочетании с эфиратом трифторида бора. В этом случае большинство исследователей, изучающих каталитические системы превращения ненасыщенных углеводородов, придерживаются той точки зрения, что такие процессы превращения непосредственно связаны с гидридными комплексами переходных металлов. Классическими примерами работ по идентификации гидридных комплексов Ni(II) являются работы G. Wilke [151], а также C.F. Tolman [152–155] и Ф.К. Шмидта [156–159], в которых было экспериментально доказано окислительное присоединение кислот Брэнстеда к комплексам Ni(0) c образованием катионных гидридов [HNiLn]+. Авторам работы [159] с помощью метода ЯМР удалось также обнаружить взаимодействие гидридного комплекса никеля с непредельными углеводородами – этиленом и пропиленом.
В случае полимеризации НБ каталитическая система на основе Ni(PPh3)4 (Ni-8) и nBF3 · OEt2 (n = 100–400) формально без добавок кислот Брэнстеда была предложена в работах [160, 161], активность таких систем достигала 5 × 106 г ПНБ/(моль Pd ч). Позднее методом ЯМР 1H было установлено образование гидридов никеля(II), ответственных за каталитическую активность, при взаимодействии Ni-8 с BF3 ⋅ OEt2 в присутствии следовых количеств воды в растворителе [162–165]. Кроме того, было показано, что добавление контролируемых количеств протонодонорных соединений (H2O, АcАcH, HBF4 ⋅ OEt2, MeOH) приводит к существенному росту активности каталитических систем на основе комплексов Ni(0), в том числе сформированных in situ, и BF3 ⋅ OEt2 в аддитивной полимеризации НБ [165–168].
Параллельно было показано [169], что родственные каталитические системы из комплексов никеля Ni(0) в комбинации с B(C6F5)3 являются эффективными катализаторами данного процесса. Наряду с этим, авторы работы [169] отмечают, что каталитическая система на основе Ni(COD)2 (Ni-9) и nBF3 ⋅ OR2 (R = Bu, n = 5, [НБ]0:[Ni]0 = = 1000) полимеризацию норборнена в аналогичных условиях не инициировала. Кроме того, в работах [170, 171] описана аддитивная полимеризация НБ в присутствии близкой по составу каталитической системы Ni-9/nBF3 · OR2 (R = Et, n = 5, [НБ]0:[Ni]0 = 5000). Активность данной каталитической системы достигает 1.8 × 106 г ПНБ/(моль Ni ч). Согласно предложенной в работе [171] схеме, ответственными за катализ являются парамагнитные комплексы никеля, при этом рост цепи протекает путем последовательного окислительного присоединения и восстановительного элиминирования мономера, затем димеров, тримеров и т.д. На наш взгляд, такое различие в поведении фактически идентичных систем Ni-9/BF3 ⋅ OR2 (R = Et в одном случае [170, 171] и R = Bu – в другом [169]) может также объясняться различным содержанием примесной воды в реакционной системе.
Циглеровские каталитические системы в сочетании с алюминий- и борорганическими соединениями
Большинство работ по аддитивной полимеризации незамещенного НБ под действием металлокомплексных катализаторов посвящено системам Циглера–Натта с алюминийорганическими сокатализаторами или борорганическими соединениями. В случае никелевых катализаторов доля публикаций по полимеризации НБ за последние 10 лет с алюминий- и борорганическими сокатализаторами составляет приблизительно 90%, в случае палладия ∼40% от всех палладиевых катализаторов. Активность описанных в литературе наиболее эффективных систем типа Циглера–Натта в полимеризации НБ может достигать до 108 г ПНБ/(моль Mt ч) (см., например, работы [88, 172]). Однако в среднем такие системы в зависимости от состава и условий процесса характеризуются активностью порядка 105–107 г ПНБ/(моль Mt ч). Необходимо отметить, что в последние годы резко увеличивается число публикаций по применению комплексов палладия и никеля с азотсодержащими лигандами (главным образом типа оснований Шиффа) в полимеризации и сополимеризации НБ и его производных. Привлекательность этих лигандов вызвана тем, что их электронные и стерические свойства можно регулировать в широком интервале путем изменения заместителей при атомах азота.
Множество известных в литературе работ посвящено использованию весьма разнообразных по составу и строению нейтральных или катионных комплексов палладия и никеля в сочетании с МАО или его модифицированной формы (ММАО) в полимеризации НБ. Одним из основных недостатков таких каталитических систем является необходимость использования от сотен до нескольких тысяч мольных эквивалентов сокатализатора для достижения высокого уровня каталитической активности. В качестве примера можно привести работу [173], в которой была исследована активность комплексов Pd(II) и Ni(II) с N,N,P-тридентатными лигандами, полученными из аминодифенилфосфинов и 2-пиридинкарбоксиальдегида (или 2-хинолинкарбоксиальдегида) в сочетании с МАО. Для достижения высокой активности (до 2.5 × 108 г ПНБ/(моль Pd⋅ч) палладиевых каталитических систем авторы [173] используют отношение [Al]0 : [Pd]0 > 20 000.
При рассмотрении палладиевых катализаторов, активированных МАО для получения ПНБ, следует отметить, что в большинстве случаев сообщается о получении нерастворимых полимеров, особенно если активность катализатора превышала 105 г ПНБ/(моль Pd ч). Общий обзор систем за 2008–2018 гг. представлен в табл. 1, соответствующие структурные формулы использованных комплексов приведены ниже.
Таблица 1.
Полимеризация норборнена под действием комплексов палладия в сочетании с алюминийорганическими соединениями
| Комплекс | Соката-лизатор | [Аl]0 : [Pd]0 | T, °C | A, г ПНБ/(моль Ni ч) | Mw × 10–5 | Mw/Mn | Литература |
|---|---|---|---|---|---|---|---|
| Комплексы c арил(оксо/сульфоксо)-NHC-карбеновыми лигандами | |||||||
| Pd-65–Pd-69 | MAO | 2500 | 40 | (2.2–2.4) × 107 | – | – | [174] |
| Pd-70–Pd-74 | MAO | 1750 | 40 | (3.5–6.5) × 107 | – | – | [175] |
| Pd-75–Pd-79 | MAO | 2500 | 100 | (2.1–2.9) × 106 | – | – | [177] |
| Pd-80–Pd-84 | MAO | 5000 | 40 | (1.4–4.9) × 107 | – | – | [180] |
| Pd-85–Pd-89 | MAO | 7000 | 60 | (5.2–5.8) × 107 | – | – | [177] |
| Комплексы с иминопиридиновыми лигандами | |||||||
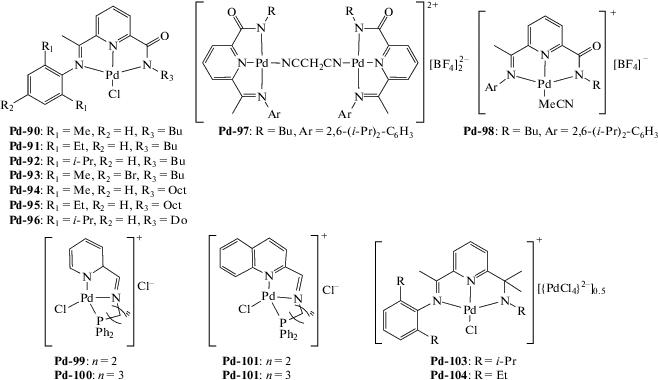
| Pd-90–Pd-96 | MAO | 1000 | 20 | (2.9–5.2) × 105 | – | – | [181] |
| Pd-97–Pd-98 | MAO | 1000 | 20 | (4.9–5.3) × 105 | – | – | [181] |
| Pd-99–Pd-102 | MAO | 20 000 | 50 | (1.0–2.5) × 108 | – | – | [173] |
| Pd-103–Pd-104 | MAO | 1000 | 30 | (0.6–1.9) × 107 | – | – | [182] |
| Комплексы с α-диаминовыми и α-дииминовыми лигандами | |||||||
| Pd-105–Pd-110 | MAO | 9000 | 50 | (1.9–7.0) × 107 | – | – | [183] |
| Pd-111–Pd-112 | MAO | 1000 | 35 | (2.2–3.0) × 105 | – | – | [184] |
| Pd-113–Pd-117 | MAO | 1500 | 20 | (0.4–1.3) ×105 | – | – | [185] |
| Pd-118–Pd-123 | MAO* | 1000 | 60 | (1.0–5.0) × 105 | – | – | [186] |
| Комплексы с иминопиразольными и амидооксазолиновыми лигандами | |||||||
| Pd-124–Pd-127 | MAO | 1000 | 20 | (2.3–2.4) × 106 | – | – | [187] |
| Pd-128 | МАО | 8000 | 50 | 4.8** × 108 | – | – | [188] |
| Pd-128–Pd-131 | МАО | 8000 | 25 | (0.5–8.0) × 107 | – | – | [188] |
| Комплексы Pd с арилоксоиминовыми и арилиминовыми лигандами | |||||||
| Pd-132 | MAO | 1500 | 25 | 1.6 × 107 | 19*** | – | [189] |
| Pd-133–Pd-135 | MAO | 9000 | 60 | (2.3–2.6) × 107 | – | – | [190] |
| Pd-133–Pd-135 | AlEtCl2 | 4500 | 40 | (1.1–1.2) × 107 | 3.4–5.1 | 1.6–2.0 | [190] |
| Pd-136 | MAO | 6000 | 50 | 8.5 × 106 | – | – | [191] |
| Pd-137 | MAO | 8000 | 100 | 8.8 × 106 | – | – | [191] |
Примечание. Здесь и в табл. 2–4 A – средняя активность каталитической системы.
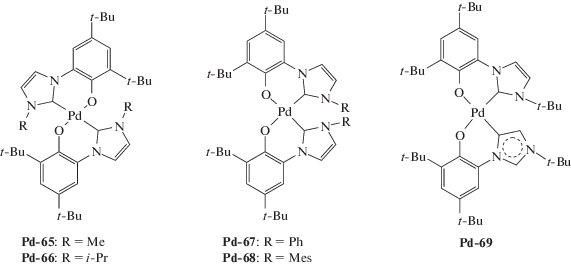
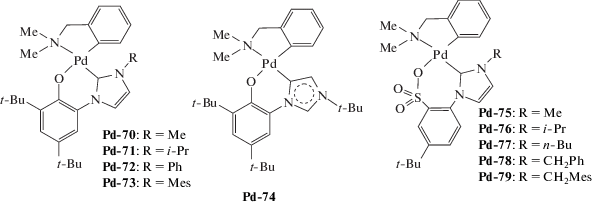
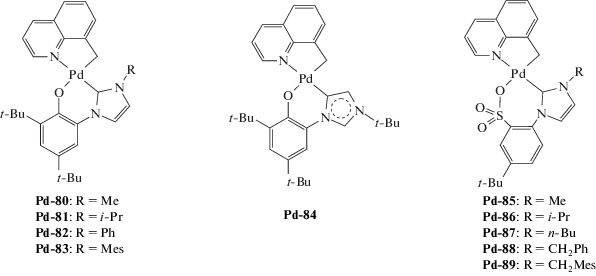
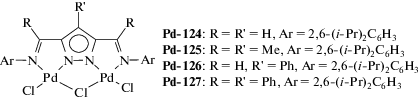
В работах [174–178] был синтезирован ряд комплексов палладия, содержащих арилоксид-N-гетероциклические
карбеновые (а также NHC-карбен-сульфонатные) наряду с бидентантными 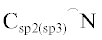 лигандами (Pd-65–Pd-89). Такие комплексы в сочетании с МАО были протестированы в
полимеризации НБ и показано, что оптимальной температурой полимеризации является 40–60°C.
Каталитические системы на основе этих комплексов могут проявлять активность до (5–6.5)
× 107 г ПНБ/(моль Pd ч) (время реакции 3 мин, [НБ]0:[Pd]0 = (1–5) × 104). Растворимые образцы полимеров были получены только в случае использования Et2AlCl в качестве сокатализатора (Mn = (4–16) × 103, Mw/Mn = 1.6–2.0) [179].
лигандами (Pd-65–Pd-89). Такие комплексы в сочетании с МАО были протестированы в
полимеризации НБ и показано, что оптимальной температурой полимеризации является 40–60°C.
Каталитические системы на основе этих комплексов могут проявлять активность до (5–6.5)
× 107 г ПНБ/(моль Pd ч) (время реакции 3 мин, [НБ]0:[Pd]0 = (1–5) × 104). Растворимые образцы полимеров были получены только в случае использования Et2AlCl в качестве сокатализатора (Mn = (4–16) × 103, Mw/Mn = 1.6–2.0) [179].
Любопытные результаты по полимеризации НБ в присутствии комплекса, содержащего тридентатный [N,N,O]-лиганд (Pd-103, Pd-104) представлены в работе [182]. Полимеризацию проводили при 30°C ([НБ] [Pd]0 = 10000 : 3), в качестве сокатализатора использовали МАО ([MAO]0 : [Pd]0 = = 1000). Активность составила 1.9 × 107 г ПНБ/(моль Pd ч) при практически полной конверсии мономера. Полученные ПНБ были не растворимы, однако часть полимера удалось растворить в 1,2,4-трихлорбензоле и выполнить анализ методом ГПХ. Наблюдалось бимодальное ММР: полимеры с М = (5.0–6.4) × 105 и олигомеры с Mn = = 650–670. Авторы считают, что такое бимодальное распределение обусловлено образованием двух типов каталитически активных комплексов: первые образуются из катиона Pd, а вторые из аниона PdCl$_{4}^{ - }$ при взаимодействии с МАО. При этом авторы постулируют, что последние ответственны за олигомеризацию НБ. С другой стороны, еще в 2003 г. [192] было показано, что анионные комплексы палладия [PdCl4]2−, [Pd2Cl6]2− проявляют высокую активность в полимеризации НБ (107 г ПНБ/(моль Pd ч)) в сочетании с МАО и образуют нерастворимые ПНБ.
Также высокую активность (до 1.2 × 108 г ПНБ/(моль Pd ч)) показали катализаторы на основе 20-членного палладийсодержащего цикла [Pd2Cl4{μ-HOC6H2(CH2PzMe2)2-2,6-Me-4-κ-N,N}2] (PzMe2 = 3,5-диметилпиразол) (Pd-138), активированного ММАО [193]. Однако в этой же работе сообщается, что активность существенно более простого комплекса [PdCl2(PhCN)2] (Pd-139) в сопоставимых условиях реакции всего в 2 раза меньше: 6.5 × 107 г ПНБ/(моль Pd ч). Продукты полимеризации были не растворимы.
В свою очередь для никелевых катализаторов, в том числе активированных МАО, характерно получение растворимых ПНБ. Общий обзор систем за 2008–2018 гг. представлен в табл. 2 и 3, структурные формулы использованных комплексов никеля приведены ниже.
Таблица 2.
Полимеризация норборнена под действием комплексов никеля в сочетании с алюминийорганическими соединениями
| Комплекс | Сокатализатор | [Аl]0 : [Ni]0 | T, °C | A, г ПНБ/(моль Ni ч) | Mw × 10–5 | Mw/Mn | Литература |
|---|---|---|---|---|---|---|---|
| Комплексы с β-дикетонатными и β-кетиминатными лигандами | |||||||
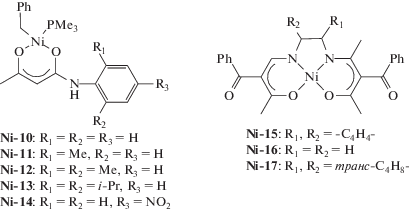
| Ni-10–Ni-14 | МMAO | 2500 | 50 | (2.6–6.8) × 107 | 3.1–5.1 | 2.1–2.4 | [194] |
| Ni-15–Ni-17 | MAO | 2500 | 20 | (4.5–13) × 105 | 4.0–7.0* | – | [195] |
| Комплексы с салицилиминовыми лигандами | |||||||
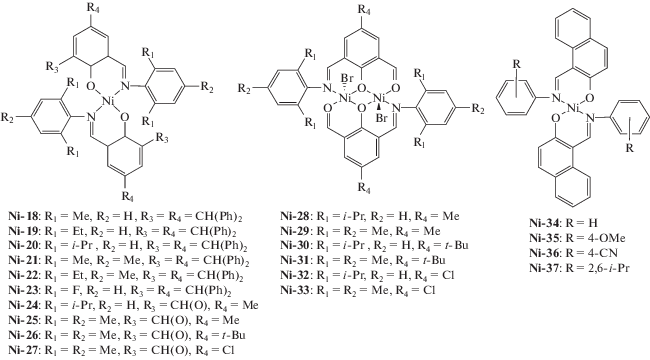
| Ni-18–Ni-23 | MAO | 1000 | 20 | (1.0–2.4) × 106 | – | – | [196] |
| Ni-24–Ni-27 | MAO | 1000 | 25 | (1.2–9.9) × 107 | 5.0–6.7* | 1.7–2.3 | [197] |
| Ni-28–Ni-33 | MAO | 1000 | 25 | (1.0–6.5) × 107 | 4.5–6.8 | 1.7–2.2 | [197] |
| Ni-34–Ni-37 | MAO | 2500 | 60 | (2.3–3.1) × 106 | 20–29* | – | [198] |
| Ni-38–Ni-47 | МMAO | 2000 | 20 | (2.5–4.3) × 107 | 6.1–8.5* | – | [199] |
| Ni-48–Ni-50 | MAO | 6000 | 10 | (1.3–1.5) × 106 | 6.7–9.6 | 1.2–1.4 | [190] |
| Ni-51 | MAO | 1100 | 10 | 1.9 × 105 | 10.6 | 1.7 | [200] |
| Ni-52–Ni-54 | MAO | 1500 | 25 | (1.1–1.7) × 107 | 17–18* | – | [189] |
| Комплексы с анилидоиминовыми лигандами | |||||||
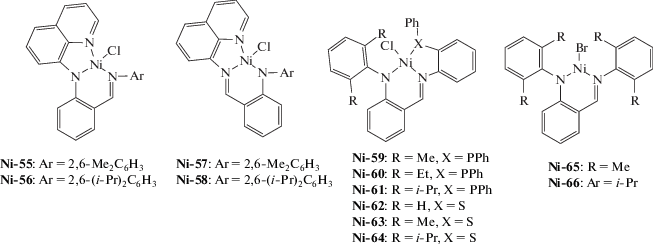
| Ni-55–Ni-56 | MAO | 1000 | 20 | (6.8–10.6) × 104 | 4.8–8.6* | – | [201] |
| Ni-57–Ni-58 | MAO | 1000 | 20 | (10.0–10.1) × 104 | 12–16* | – | [201] |
| Ni-59–Ni-61 | MAO | 5000 | 25 | (2.1–2.7) × 107 | 6.6–7.6* | – | [202] |
| Ni-62–Ni-64 | MAO | 5000 | 25 | (3.8–5.8) × 107 | 7.0–7.7* | – | [202] |
| Ni-65–Ni-66 | MAO | 3000 | 70 | (3.2–4.6) × 106 | 12–14* | – | [203] |
| Комплексы с β-дикетиминатными лигандами | |||||||
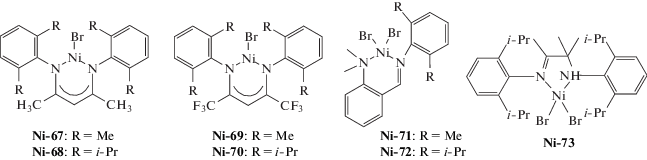
| Ni-67–Ni-68 | MAO | 3000 | 50 | (4.6–5.1) × 106 | 11–12 | 2.0–2.2 | [203] |
| Ni-69–Ni-70 | MAO | 3000 | 90 | (6.1–6.7) × 106 | 9.8–10 | 2.2–2.3 | [203] |
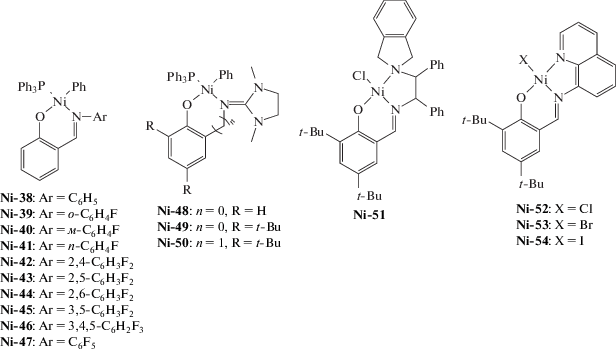
| Комплексы с иминоаминовыми лигандами | |||||||
| Ni-71–Ni-72 | MAO | 1000 | 75 | (3.9–4.2) × 105 | 4.3–4.4 | 1.6–1.7 | [204] |
| Ni-73 | МMAO | 1000 | −20 | 6.6 × 105 | 4.9 | 2.78 | [205] |
Таблица 3.
Полимеризация норборнена в присутствии комплексов никеля, активированных алюминийорганическими соединениями
| Комплекс | Соката-лизатор | [Аl]0:[Ni]0 | T, °C | A, г ПНБ/(моль Ni ч) | Mw × 10–5 | Mw/Mn | Литература |
|---|---|---|---|---|---|---|---|
| Комплексы с дииминовыми и иминопиридиновыми лигандами | |||||||
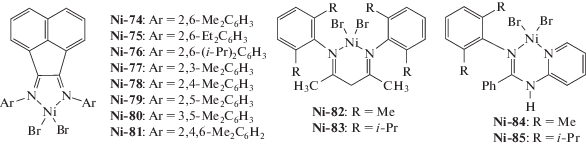
| Ni-74–Ni-81 | MAO | 2000 | 30 | (1.0–5.4) × 105 | 2.2–6.4 | 1.9–3.3 | [206] |
| Ni-82–Ni-83 | MAO | 3000 | 70 | (1.0–1.5) × 107 | 19–20 | 2.3–2.4 | [203] |
| Ni-84–Ni-85 | MAO | 800 | 10 | (1.1–3.8) × 106 | 32–39 | 2.0–2.3 | [207] |
| Комплексы с иминопиридиновыми лигандами | |||||||
| Ni-86–Ni-98 | MAO | 500 | 60 | (0.6–11) × 106 | 37–45 | 2.1–2.2 | [208] |
| Ni-99–Ni-104 | MAO | 500 | 30 | (1.9–4.2) × 106 | 3.2–5.5* | – | [209] |
| Ni-105–Ni-108 | MAO | 4000 | 75 | (2.2–4.0) × 107 | 26–41 | 1.7–2.0 | [173] |
| Комплексы с иминопиразолильными лигандами | |||||||
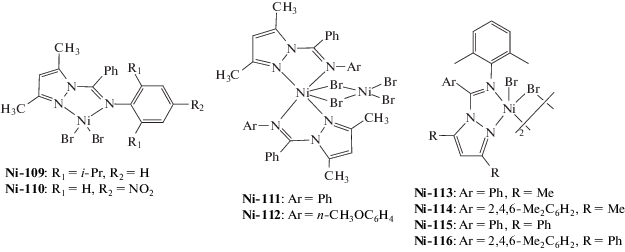
| Ni-109–Ni-110 | MAO | 600 | 20 | (1.8–8.5) × 105 | 9.0–11 | 1.4–2.0 | [210] |
| Ni-111–Ni-112 | MAO | 600 | 20 | (1.4–1.8) × 106 | 8.7–10 | 2.2–2.3 | [211] |
| Ni-113–Ni-116 | MAO | 800 | 40 | (1.9–6.6) × 105 | 3.9–4.6* | – | [212] |
| Комплексы с пиридинимидазолильными лигандами | |||||||
| Ni-117–Ni-125 | MAO | 2000 | 20 | (3.5–9.0) × 105 | 1.5–17 | 1.5–4.1 | [213] |
| Комплексы с (пиррол/анилидо/арил)иминовыми и амидооксазолиновыми лигандами | |||||||
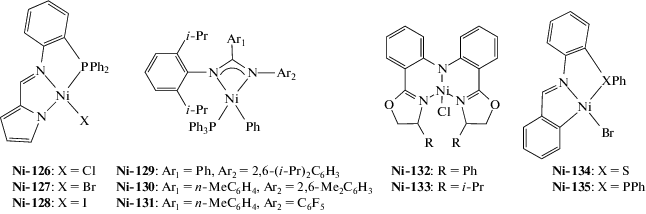
| Ni-126–Ni-128 | MMAO | 500 | 30 | (2.6–5.5) × 107 | 18 | 1.2–1.3 | [214] |
| Ni-129–Ni-131 | MAO | 600 | 60 | (1.4–1.9) ×107 | 1.2–3.0 | 2.3–2.7 | [215] |
| Ni-132–Ni-133 | MAO | 3000 | 25 | (3.5–4.9) × 107 | 3.5–12 | 1.9–2.8 | [188] |
| Ni-134 | MAO | 6000 | 50 | 6.6 × 106 | 0.23* | – | [191] |
| Ni-135 | MAO | 8000 | 100 | 3.9 × 106 | 0.14* | – | [191] |
| Комплексы с NHC-карбеновыми и (арил/алкил)оксо-NHC-карбеновыми лигандами | |||||||
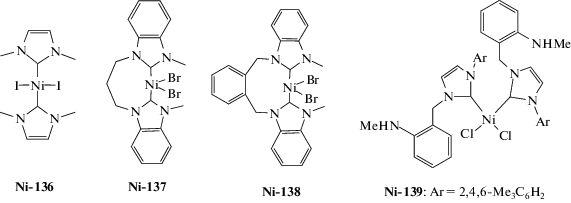
| Ni-136–Ni-138 | MAO | 500 | rt** | (4.6–5.4) × 106 | 11–84 | 2.0–3.2 | [216] |
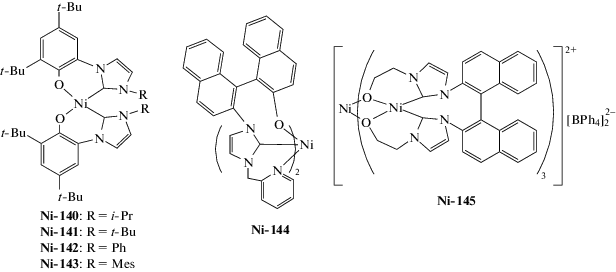
| Ni-139 | MAO | 3500 | 15 | 3.0 × 106 | – | – | [217] |
| Ni-140–Ni-143 | MAO | 2500 | 20 | (3.2–8.9) × 106 | – | – | [218] |
| Ni-144 | MAO | 2500 | 20 | 6.6 × 106 | 10 | 2.4 | [219] |
| Ni-145 | MAO | 2500 | 20 | 1.3 × 106 | 2.5 | 10.3 | [219] |

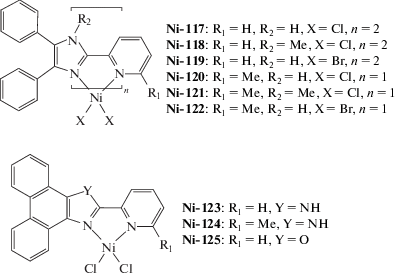
В работе [205] описан случай наблюдения полимеризации НБ по механизму “живых” цепей с использованием амино-иминового комплекса никеля (Ni-73) в сочетании с ММАО. Этого удалось добиться при последовательной полимеризации этилена и НБ с получением блок-сополимеров (Mn = (29–49) × 103, Mw/Mn = 1.15). Однако при проведении непосредственно гомополимеризации НБ [205] наблюдалось существенное уширение ММР. С увеличением отношения [ММАО]0 : [Ni]0 со 100 до 1000, каталитическая активность системы возрастала в 10 раз до 6.6 × 105 г ПНБ/(моль Ni ч), молекулярная масса ПНБ снижалась с 60 × 104 до 49 × 104, а индекс полидисперстности ПНБ возрастал с 1.5 до 2.8. По мнению авторов [205], уширенное ММР при высоком соотношении [ММАО]0 : [Ni]0 является результатом переноса цепи на алюминийорганический сокатализатор.
Достаточно редкий случай получения нерастворимых ПНБ в присутствии никельсодержащих катализаторов описан в работе [220]. Комплекс никеля с N,N-бис-(дифенилметилен)этилендиаминовым лигандом в сочетании с МАО проявляет активность в полимеризации НБ до 2.6 × 105 г ПНБ/(моль Ni ч) ([ММАО]0 : [Ni]0 = 100, растворитель толуол). ПНБ, полученный при 50°С в толуоле хорошо растворялся в циклогексане и хлорбензоле [220]. Если же полимер синтезирован при 25°С, то он был не растворим. При изменении полимеризационной среды (с толуола на циклогексан) наблюдалась противоположная тенденция [220].
В присутствии Ni-содержащих систем, включающих алюминийорганические соединения (МАО или этилалюминийсесквихлорид), был успешно вовлечен в гомополимеризацию 5-триметилсилилнорборнен [40, 221]. Авторами данных работ было показано, что поли(5-триметилсилилнорборнен) обладал высокой газопроницаемостью, которая на порядок превышала проницаемость незамещенного полинорборнена. В ходе полимеризации экзо-изомер расходовался существенно быстрее эндо-изомера. В связи с этим сотрудниками Института нефтехимического синтеза им. А.В. Топчиева РАН был предложен подход, заключающийся в использовании экзо-трициклононенов — производных НБ, в которых объемные заместители удалены от активной двойной связи [102]. Такие дизамещенные кремнийсодержащие трициклононены были заполимеризованы как на никелевых, так и на палладиевых системах циглеровского типа [103]. Наиболее удобной оказалась система Pd(OAc)2/B(C6F5)3. Необходимо отметить, что каталитические системы на основе комбинаций комплексов (π-C5H9NiCl)2, Ni(CCl3COO)2 и Ni(нафтенат)2 с алюминийорганическими сокатализаторами, такими как Et3Al2Cl3, (i-Bu)2AlCl, (i-Bu)3Al, MAO для полимеризации НБ были предложены в работах К.Л. Маковецкого с сотрудниками [40, 222].
В целом для активированных MAO Ni- или Pd-комплексов состав, структуру, основные стадии формирования активных в полимеризации НБ комплексов нельзя считать надежно установленными. Однако в последнее время появились работы, которые позволяют прояснить некоторые детали.
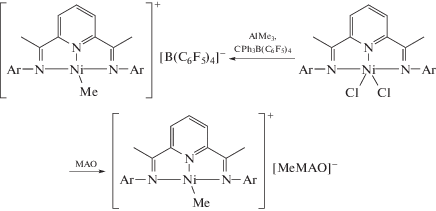
Обобщенный механизм формирования активных комплексов в каталитических системах на основе комплексов никеля с МАО описан в работах [208, 223]. Авторами [208, 223] были синтезированы бис-(имино)пиридиновые комплексы никеля (Ni-86–Ni-98) и в сочетании с МАО протестированы в полимеризации НБ. Активность комплексов в полимеризации НБ достигает 107 г ПНБ/(моль Ni ч) при [Al]0:[Ni]0 = 500 : 1, [НБ]0 : [Ni]0 = 50 000 : 1 и 60°C – в хлорбензоле. При исследовании взаимодействия компонентов таких систем методами ЯМР 1H, ЯМР 13C и ЯМР 19F было установлено [223] формирование ответственных за катализ катионных метильных комплексов никеля с противоионом МеМАО−. При изучении модельной системы [LNiCl2]/AlMe3/[CPh3][B(C6F5)4] (L – бис-(имино)пиридиновый лиганд) было обнаружено образование аналогичных комплексов [LNiMe]+[B(C6F5)4]− в соответствии со схемой
В работе [224] методом ЯМР было изучено взаимодействие перфторфенильного комплекса палладия CpPd(C6F5)(PPh3) (Pd-140) с МАО. Установлено, что МАО элиминирует PPh3 из координационной сферы палладия с образованием нейтрального комплекса [(C5H5)Pd(C6F5)(π-НБ)] (Pd-141). В продуктах полимеризации норборнена в присутствии аналогичной системы [224] методом ЯМР 19F было обнаружено наличие перфторарильных концевых групп. Авторы указанной работы отмечают, что только небольшая доля палладиевых комплексов при этом трансформируется в активные комплексы. Причина активации каталитического предшественника остается неясной.
При исследовании механизма активации в полимеризации НБ близкого по составу перфторарильного
комплекса палладия [Pd(C6F5)Cl(bpzm)] (Pd-142) [bpzm = бис-(3,5-диметилпиразол-1-ил)метан] методом ЯМР [225] был установлен обмен 13% атомов хлора на метильные группы при отношении [Pd]0 : [Al]0 = 1 : 10. При увеличении этого отношения до 100 в отсутствие НБ также наблюдается
элиминирование группы C6F5, восстановление Pd(II) до Pd(0) и образование пентафтортолуола. При полимеризации
НБ концевые групп (C6F5) в полимере не наблюдались, как следствие, авторы работы [225] делают вывод, что первая стадия внедрения НБ в данном случае не протекает по связи
Pd–C6F5. В работе [225] также отмечают, что при активации МАО различие в активности комплексов палладия
[( )Pd(C6F5)X] (
)Pd(C6F5)X] ( = tmeda, bipy, bpzm, X = Cl, OH) обусловлено исключительно скоростью элиминирования
лигандов из координационной сферы комплексного катиона. В результате активность систем
на основе комплексов Pd снижается в ряду лигандов
= tmeda, bipy, bpzm, X = Cl, OH) обусловлено исключительно скоростью элиминирования
лигандов из координационной сферы комплексного катиона. В результате активность систем
на основе комплексов Pd снижается в ряду лигандов  = tmeda (2.5 × 106), bipy (8.8 × 105), bpzm (7.3 × 105 г ПНБ/(моль Pd ч)). При этом постулируется, что ответственными за катализ являются
“обнаженные” катионы Pd2+.
= tmeda (2.5 × 106), bipy (8.8 × 105), bpzm (7.3 × 105 г ПНБ/(моль Pd ч)). При этом постулируется, что ответственными за катализ являются
“обнаженные” катионы Pd2+.
В ряде статей описано применение комплексов Ir, Cu, Ti в качестве катализаторов полимеризации НБ. Так, в сочетании с МАО иридиевые комплексы [226] позволяют полимеризовать НБ с активностью до 2 × 106 г ПНБ/(моль Ir ч) и Mη = = (1–2) × 106. В свою очередь титановые катализаторы [227], активированные Al(i-Bu)3/[Ph3C][BAr$_{4}^{{\text{F}}}$], полимеризуют норборнен с существенно меньшей активностью до 3 × 103 г ПНБ/(моль Ti ч).
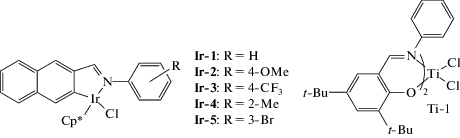
Комплексы меди(II) с α-дииминовыми [184] и саленовыми [228] лигандами в сочетании с МАО также были использованы для полимеризации НБ (активность систем находилась в диапазоне (0.7–2.0) × 105 г ПНБ/(моль Cu ч)).
Для достижения высокой активности каталитических систем типа Циглера–Натта с алюминийорганическими соединениями обычно требуется большое количество сокатализатора. Однако известно, что введение в систему таких кислот Льюиса, как B(C6F5)3, существенно снижает необходимое количество алюминийорганического соединения для достижения высокой активности, и в некоторых случаях такие кислоты сами могут выступать как сокатализаторы. Фактически трис-(пентафторфенил)боран является арилирующим агентом, т.е. действует аналогично МАО или другим алюминийорганическим соединениям. В работе [229] было установлено, что бета-дикетонатные комплексы Ni(dpm)2 (Ni-147) и Pd(dpm)2 (Pd-143) (dpm – 2,2,6,6-тетраметил-3,5-гептандионат) в комбинации с B(C6F5)3 приводят к высокоэффективным катализаторам в отсутствие алюминийорганического соединения ([НБ]0 : [Mt]0 : [B]0 = 4000 : 1 : 9). При этом сочетание индивидуальных комплексов с B(C6F5)3 · 3H2O позволяет уменьшить молярное отношение B : Pd(Ni) до 1–2. При мониторинге методом ЯМР обсуждаемой реакционной смеси авторы работы [229] установили, что на первой стадии взаимодействия компонентов протекает обмен β-дикетонатных групп у переходного металла с образованием диперфторфенильных комплексов, на следующей стадии происходит внедрение норборнена по связи металл–углерод. В этой же работе методом ЯМР 19F было показано наличие концевых пентафторфенильных групп в полимере. Позднее для никелевых каталитических систем с азотсодержащими лигандами в сочетании с B(C6F5)3 также было обнаружено наличие аналогичных концевых групп в полимерах [230, 231], что свидетельствует об обменном характере механизма активации катализаторов. Теоретическое DFT-исследование [231] стадии присоединения НБ по связи Ni–C6F5 в катионном предшественнике показало относительно “легкое” внедрение молекулы норборнена (энергетический барьер составляет не более 20 ккал/моль). T. Yamamoto с сотрудниками [232] при исследовании взаимодействия метильного комплекса никеля CpNi(PPh3)Me (Ni-148) с B(C6F5)3 установили обмен метильной группы при никеле на пентафторарильную. На первой стадии возможно формирование комплексного катиона и аниона общей формулы [CH3B(C6F5)3]−.
Интересные результаты по получению нанокомпозитных материалов на основе НБ представлены в работе [233]. В качестве катализатора был использован иммобилизованный на подложке из двуокиси кремния хлорид палладия в сочетании с B(C6F5)3:
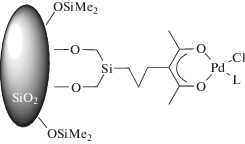
Средняя активность такого катализатора находилась в диапазоне (7.3–24.0) × 103 г ПНБ/(моль Pd ч) (60°C), Mn = (4.6–7.2) × 105. Кинетическими исследованиями было показано [233], что на начальном этапе полимеризации наблюдается существенный рост выхода полимера, затем выход продукта замедляется по причине образования на поверхности материала слоя из полинорборнена, который затрудняет доступ мономера к активному центру. Скорость полимеризации определяется главным образом диффузией мономера. Как следствие, с повышением температуры процесса с 20 до 100°C молекулярная масса полимера увеличивается. С помощью электронной микроскопии была изучена морфология полученного полимера [233]. Фактически в составе полимера содержались наночастицы оксида кремния. В ходе процесса наблюдался рост наночастиц с 21 до 3650 нм, при этом методом трансмиссионной электронной микроскопии в сочетании с энергодисперсионной рентгеновской спектроскопией было установлено наличие палладия внутри нанокомпозитной частицы. Похожие результаты были получены с помощью близких по составу катализаторов на основе иммобилизованного комплекса никеля(II) [234].
Различные каталитические системы полимеризации норборнена под действием комплексов палладия и никеля
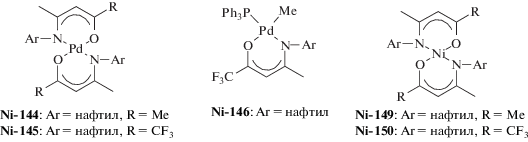
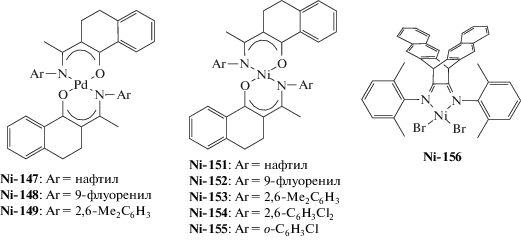
в сочетании с B(C6F5)3 представлены в табл. 4.
Таблица 4.
Полимеризация норборнена под действием комплексов никеля или палладия в сочетании с B(C6F5)3
| Комплекс | [B]0 : [Mt]0 | T, °C | A, г ПНБ/(моль Mt ч) | Mw × 10–5 | Mw/Mn | Литература |
|---|---|---|---|---|---|---|
| Pd-144 | 25 | 60 | 2.9 × 104 | – | – | [235] |
| Pd-145 | 20 | 60 | 2.3 × 105 | – | – | [236] |
| Pd-146 | 20 | 60 | 3.4 × 106 | – | – | [236] |
| Pd-147–Pd-148 | 20 | 60 | 2.3 × 105 | – | – | [237, 238] |
| Pd-149 | 20 | 60 | 1.8 × 105 | – | – | [239] |
| Ni-149–Ni-150 | 20 | 60 | (3.2–38) × 104 | – | – | [240] |
| Ni-151–Ni-155 | 20 | 60 | (1.6–3.0) × 105 | 1.9–3.0 | 2.1–2.2 | [237–239, 241] |
| Ni-156 | 5 | 100 | 4.2 × 107 | – | – | [242] |
ЗАКЛЮЧЕНИЕ
Анализ литературы за последние 10 лет свидетельствует о том, что исследования в области аддитивной полимеризации норборнена и его разнообразных производных, сополимеризации этих мономеров между собой, а также с различными непредельными углеводородами сохраняют высокую актуальность.
В первую очередь следует отметить результаты работ по исследованию механизма миграционного
внедрения норборнена по связи металл–углерод. Были выделены и охарактеризованы продукты
взаимодействия каталитических предшественников [(tmeda)Pd(OEt2)(Me)][B(ArF)4] [68], [( )Pd(MeCN)(Me)][B(ArF)4] [69], [(2-R-аллил)Pd(мезитилен)]SbF6 [84], [(2-R-аллил)Ni(мезитилен)][B(ArF)4] [83] с норборненом. Установлено, что на “обнаженных” палладиевых катализаторах норборнен
координирует бидентатно (π-связью и водородом в седьмом положении бицикла), а рост
цепи протекает путем цис-экзо-внедрения мономера, при этом растущая полимерная цепь стабилизируется γ-агостическим
взаимодействием.
)Pd(MeCN)(Me)][B(ArF)4] [69], [(2-R-аллил)Pd(мезитилен)]SbF6 [84], [(2-R-аллил)Ni(мезитилен)][B(ArF)4] [83] с норборненом. Установлено, что на “обнаженных” палладиевых катализаторах норборнен
координирует бидентатно (π-связью и водородом в седьмом положении бицикла), а рост
цепи протекает путем цис-экзо-внедрения мономера, при этом растущая полимерная цепь стабилизируется γ-агостическим
взаимодействием.
Экспериментальные данные работ последних лет [60, 61] подтвердили гидридный механизм полимеризации НБ на дикатионных комплексах палладия [Pd(RCN)4][BF4]2. Полимеризация инициируется следовыми количествами воды в реакционной смеси или добавкой спирта. Необходимо отметить, что под действием катализаторов данного типа реализуется “живой” характер полимеризации норборнена. Для других каталитических систем на основе металлов конца переходного ряда “живой” характер полимеризации НБ экспериментально не подтвержден. Параллельно, было показано, что добавление контролируемых количеств протонодонорных соединений (H2O, MeOH и т.д.) является ключевым для получения активных в аддитивной полимеризации НБ гидридных комплексов никеля и приводит к существенному росту активности каталитических систем на основе комплексов Ni(0) и BF3⋅OEt2 [162–168].
В последнее десятилетие для полимеризации НБ и его производных были предложены катализаторы на основе Pd(АcАc)2 и карбоксилатных комплексов палладия в сочетании c [NHMe2Ph][BAr$_{4}^{{\text{F}}}$] [130–137], индивидуальных комплексов [(R3P)2Pd(κ2–O,O-O2CR')][B(C6F5)4] [132], а также катализаторы на основе катионных ацетилацетонатных комплексов палладия в сочетании с BF3⋅OEt2 [109, 140–149]. Важной особенностью таких систем является низкая чувствительность к кислороду воздуха и влаге при высокой каталитической активности.
Часть работ по аддитивной полимеризации НБ посвящена поиску высокоактивных катализаторов. Наибольшее значение активности (2.2 × × 109 г ПНБ/(моль Pd ч)) получено для алкильных(арильных) комплексов палладия с хиральным бис-оксазолиновым лигандом активированных [Ph3C][B(C6F5)4] [90]. Высокая активность характерна и для каталитических систем Циглера–Натта. Среди этих работ основную долю составляют публикации, посвященные синтезу комплексов никеля и палладия, а также демонстрации их каталитической активности преимущественно в сочетании с МАО. Полимеризация НБ здесь выступает в качестве фундаментальной модельной реакции и, как правило, не является основным объектом исследования. Следует отметить, что роль МАО помимо алкилирования комплексов-прекурсоров и формирования аниона заключается еще и в элиминировании лигандов от переходного металла. Поэтому в проанализированных работах можно отметить общую закономерность: с увеличением количества МАО возрастает каталитическая активность систем, и при полном элиминировании лигандов от переходного металла, т.е. при образовании наиболее активного “обнаженного” катализатора, наблюдается максимальное значение активности. Таким образом, при активации МАО различие в активности комплексов палладия или никеля обусловлено скоростью элиминирования управляющих лигандов из координационной сферы комплексного катиона. Кроме того, каталитическую активность таких систем следует сравнивать при схожих условиях и соотношениях компонентов реакционной смеси. Однако авторы указанных работ проводят процесс полимеризации НБ не в одинаковых, а в “оптимизированных” условиях, т.е. в таких условиях, при которых наблюдается наивысшая каталитическая активность исследуемых систем. В связи с этим на сегодняшний день проблему влияния природы лигандного окружения переходного металла на свойства катализатора и получаемых ПНБ нельзя считать решенной.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований и Правительства Иркутской области (код проекта 17-43-380010). Исследование выполнено в рамках базовой части государственного задания в сфере научной деятельности Министерства образования и науки России (№ 4.9489.2017/8.9).
Список литературы
Маковецкий К.Л. // Высокомолек. соед. А. 1994. Т. 36. № 10. С. 1712.
Маковецкий К.Л. // Высокомолек. соед. Б. 1999. Т. 41. № 9. С. 1525.
Makovetskii K.L. // Polymer Science C. 2008. V. 50. № 1. P. 22.
Janiak C., Lassahn P.G. // Macromol. Rapid Commun. 2001. V. 22. № 7. P. 479.
Janiak C., Lassahn P.G. // J. Mol. Catal. A. 2001. V. 166. № 2. P. 193.
Blank F., Janiak C. // Coord. Chem. Rev. 2009. V. 253. № 7–8. P. 827.
Goodall B.L. // Late Transition Metal Polymerization Catalysis / Ed. by B. Rieger, L. Saunders Baugh, S. Kacker, S. Striegler. Weinheim: Wiley-VCH Verlag GmbH, 2003. P. 101.
Ma R., Hou Y., Gao J., Bao F. // Polym. Rev. 2009. V. 49. № 3. P. 249.
Boggioni L., Tritto I. // Polyolefins: 50 years after Ziegler and Natta II / Ed. by W. Kaminsky 2013. P. 117.
Bermeshev M.V., Chapala P.P. // Prog. Polym. Sci. 2018. V. 84. P. 1.
Flid M.R., Gringolts M.L., Shamsiev R.S., Finkelshtein E.S. // Russ. Chem. Rev. 2018. V. 87. P. 1169.
Boggioni L., Tritto I. // MRS Bull. 2013. V. 38. № 3. P. 245.
Zhao W., Nomura K. // Catalysts. 2016. V. 6. № 11. P. 175.
Ohm R.F., Vial T.M. // J. Elastomers Plast. 1978. V. 10. № 2. P. 150.
Kauffmaan G.B., Mason S.W., Seymour R.B. // J. Chem. Educ. 1990. V. 67. № 3. P. 198.
http://sanyocorp.com/materials/norsorex/rubber
Ogawa K.A., Goetz A.E., Boydston A.J. // J. Am. Chem. Soc. 2015. V. 137. № 4. P. 1400.
Ivin K. // Olefin Metathesis and Metathesis Polymerization. London: Acad. Press Inc., 1997.
Lebedev B., Kiparisova Y., Makovetsky K. // Makromol. Chem. 1992. V. 193. P. 1399.
Smirnova N.N., Lebedev B.V. // Polymer Science B. 2001. V. 43. № 11–12. P. 315.
Gringolts M.L., Bermeshev M.V., Makovetsky K.L., Finkelshtein E.S. // Eur. Polym. J. 2009. V. 45. № 7. P. 2142.
Bielawski C.W., Grubbs R.H. // Prog. Polym. Sci. 2007. V. 32. № 1. P. 1.
Vougioukalakis G.C., Grubbs R.H. // Chem. Rev. 2010. V. 110. № 3. P. 1746.
Handbook of Metathesis / Ed by R.H. Grubbs, A.G. Wenzel, D.J. O’Leary, E. Khosravi. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2015. V. 1.
Handbook of Metathesis / Ed by R.H. Grubbs, A.G. Wenzel, D.J. O’Leary, E. Khosravi. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2015. V. 2.
Handbook of Metathesis / Ed by R.H. Grubbs, A.G. Wenzel, D.J. O’Leary, E. Khosravi. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2015. V. 3.
Grubbs R.H. // Handbook of Metathesis. Weinheim, Germany: Wiley-VCH Verlag GmbH, 2003.
Martinez H., Ren N., Matta M., Hillmyer M. // Polym. Chem. 2014. P. 3507.
Schrock R.R. // Dalton Trans. 2011. V. 40. № 29. P. 7484.
Leitgeb A., Wappel J., Slugovc C. // Polymer. 2010. V. 51. № 14. P. 2927.
Nomura K., Abdellatif M.M. // Polymer. 2010. V. 51. № 9. P. 1861.
Teator A.J., Bielawski C.W. // J. Polym. Sci., Polym. Chem. 2017. V. 55. № 18. P. 2949.
Sutthasupa S., Shiotsuki M., Sanda F. // Polym. J. 2010. V. 42. № 12. P. 905.
Kennedy J.P., Makowski H.S. // J. Macromol. Sci. A. 1967. V. 1. № 3. P. 345.
Olah G.A., White A.M., Demember J.R., Commeyras A., Lui C.Y. // J. Am. Chem. Soc. 1968. V. 6. № 4. P. 4627.
Gaylord N., Deshpande A., Mandal B., Martan M. // J. Macromol. Sci. A. 1977. V. 11. № 5. P. 1053.
Sagane T., Mizuno A., Takata T. // Makromol. Chem. 1992. V. 193. № 10. P. 2697.
Bermeshev M.V., Bulgakov B.A., Genaev A.M., Kostina J.V., Bondarenko G.N., Finkelshtein E.S. // Macromolecules. 2014. V. 47. № 16. P. 5470.
Kaminsky W. // Adv. Polym. Sci. 2013. V. 258.
Finkelshtein E.S., Makovetskii K.L., Gringolts M.L., Rogan Y.V., Golenko T.G., Lakhtin V.G., Filatova M.P. // J. Mol. Catal. A. 2006. V. 257. № 1–2. P. 9.
Mehler C., Risse W. // Macromolecules. 1992. V. 25. № 16. P. 4226.
Blank F., Scherer H., Janiak C. // J. Mol. Catal. A. 2010. V. 330. № 1–2. P. 1.
Jiang Z., Sen A. // Organometallics. ACS Publ. 1993. V. 12. № 4. P. 1406.
Jiang Z., Sen A. // J. Am. Chem. Soc. 1990. V. 112. № 26. P. 9655.
Sen A., Lai T.W. // Organometallics. 1982. V. 1. № 2. P. 415.
Sen A., Lai T.-W. // J. Am. Chem. Soc. 1981. V. 103. № 15. P. 4627.
Sen A., Lai T.W. // Inorg. Chem. 1981. V. 20. № 11. P. 4036.
Seehof N., Mehler C., Breunig S., Risse W. // J. Mol. Catal. 1992. V. 76. № 1–3. P. 219.
Mehler C., Breunig S., Risse W. // Am. Chem. Soc., Polym. Prepr., Division of Polymer Chemistry. 1991. V. 32. № 1. P. 337.
McDermott J., Chang C., Martín L.F., Rhodes L.F., Benedikt G.M., Lattimer R.P. // Macromolecules. 2008. V. 41. № 9. P. 2984.
Haselwander T.F.A., Heitz W., Krugel S., Wendorff J. // Macromol. Chem. Phys. 1996. V. 197. P. 3435.
Haselwander T.F.A., Heitz W., Krugel S.A., Wendorff J. // Macromolecules. 1997. V. 30. № 18. P. 5345.
Abu-surrah A.S., Lappalainen K., Kettunen M., Repo T., Leskela M., Hodali H.A., Rieger B. // Macromol. Chem. Phys. 2001. V. 202. № 5. P. 599.
Abu-surrah A.S., Lappalainen K., Repo T., Klinga M., Leskela M., Hodali H.A. // Polyhedron. 2000. V. 19. P. 1601.
Mehler C., Risse W. // Makromol. Chem. Rapid Commun. 1992. V. 13. № 10. P. 455.
Breunig S., Risse W. // Makromol. Chem. 1992. V. 193. № 11. P. 2915.
Melia J., Connor E., Rush S., Breunig S., Mehler C., Risse W. // Macromol. Symp. 1995. V. 89. № 1. P. 433.
Jira R. // Angew. Chem. Int. Ed. 2009. V. 48. P. 9034.
Keith J.A., Henry P.M. // Angew. Chem. Int. Ed. 2009. V. 48. P. 9038.
Tao W.J., Li J.F., Peng A.Q., Sun X.L., Yang X.H., Tang Y. // Eur. J. A. 2013. V. 19. № 41. P. 13956.
Clegg W., Eastham G.R., Elsegood M.R.J., Heaton B.T., Iggo J.A., Tooze R.P., Whyman R., Zacchini S. // Organometallics. 2002. V. 21. № 9. P. 1832.
Mecking S. // Coord. Chem. Rev. 2000. V. 203. № 1. P. 325.
Ittel S.D., Johnson L.K., Brookhart M.S. // Chem. Rev. 2000. V. 100. № 4. P. 1169.
Kocen A.L., Klimovica K., Brookhart M.S., Daugulis O. // Organometallics. 2017. V. 36. № 4. P. 787.
Malinoski J.M., White P.S., Brookhart M.S. // Organometallics. 2003. V. 22. № 4. P. 621.
LaPointe A.M., Brookhart M.S. // Organometallics. 1998. V. 17. № 8. P. 1530.
Mecking S., Johnson L.K., Wang L., Brookhart M.S. // J. Am. Chem. Soc. 1998. V. 120. № 4. P. 888.
Walter M.D., White P.S., Brookhart M.S. // Chem. Commun. 2009. № 42. P. 6361.
Yu K.-H., Huang S.-L., Liu Y.-H., Wang Y., Liu S.-T., Cheng Y.-C., Lin Y.-F., Chen J.-T. // Molecules. 2017. V. 22. № 7. P. 1095.
Deng J., Gao H., Zhu F., Wu Q. // Organometallics. 2013. V. 32. № 16. P. 4507.
Kiesewetter J., Arikan B., Kaminsky W. // Polymer. 2006. V. 47. № 10. P. 3302.
Chen Y., Mandal S., Sen A. // Organometallics. 2010. V. 29. № 14. P. 3160.
Chen M., Zou W., Cai Z., Chen C. // Polym. Chem. 2015. V. 6. № 14. P. 2669.
Chen M., Yang B., Chen C. // Angew. Chem. Int. Ed. 2015. V. 54. № 51. P. 15520.
Abubekerov M., Shepard S.M., Diaconescu P.L. // Eur. J. Inorg. Chem. 2016. № 15–16. P. 2634.
Yang B., Pang W., Chen M. // Eur. J. Inorg. Chem. 2017. V. 2017. № 18. P. 2510.
Уилки Ж., Богданович Б., Хардт Р., Хаймбах Р., Кайм В., Кронер М., Оберкирх В., Танака К., Шпгайнрюке Е., Вальтер Д., Циммерман X. // Успехи химии. 1968. Т. 37. № 6. С. 1056.
Kurosawa H. // J. Organomet. Chem. 1987. V. 334. № 1–2. P. 243.
Jolly P.W. // Angew. Chem. Int. Ed. Engl. 1985. V. 24. № 4. P. 283.
Флид В.Р., Евстигнеева Е.М., Ткаченко О.Ю., Шамсиев Р.С. // Рос. Хим. журн. 2006. Т. 50. № 4. С. 93.
http://www.promerus.com/technology
Kaminsky W., Arndt-Rosenau M. // Stereoselective Polymerization with Single-Site Catalysts / Ed by. L.S. Baugh, J.A.M. Canich. Boca Raton: CRC Press, 2007. P. 413.
Walter M.D., Moorhouse R.A., White P.S., Brookhart M.S. // J. Polym. Sci., Polym. Chem. 2009. V. 47. № 10. P. 2560.
Walter M.D., Moorhouse R.A., Urbin S.A., White P.S., Brookhart M.S., Carolina N. // J. Am. Chem. Soc. 2009. V. 131. № 25. P. 9055.
Potier J., Commarieu B., Soldera A., Claverie J.P. // ACS Catal. 2018. V. 8. № 7. P. 6047.
Zhang T.X., Xia M.R., Li Z., Mao B.Q. // Comput. Theor. Chem. 2012. V. 997. P. 110.
Goodall B.L., Benedikt G.M., McIntosh III L.H., Barnes D.A.// Pat. 5468819 USA. 1995.
Heinz B.S., Alt F.P., Heitz W. // Macromol. Rapid Commun. 1998. V. 19. P. 251.
Hennis A.D., Polley J.D., Long G.S., Sen A., Yandulov D., Lipian J., Benedikt G.M., Rhodes L.F., Huffman J. // Organometallics. 2001. V. 20. № 13. P. 2802.
Huang Y., He J., Liu Z., Cai G., Zhang S., Li X. // Polym. Chem. 2017. V. 8. № 7. P. 1217.
Kaita S., Matsushita K., Tobita M., Maruyama Y., Wakatsuki Y. // Macromol. Rapid Commun. 2006. V. 27. № 20. P. 1752.
Bielinski E.A., Dai W., Guard L.M., Hazari N., Takase M.K. // Organometallics. 2013. V. 32. № 15. P. 4025.
Zou W., Pang W., Chen C. // Inorg. Chem. Front. 2017. V. 4. № 5. P. 795.
Mathew J.P., Reinmuth A., Melia J., Swords N., Risse W. // Macromolecules. 1996. V. 29. № 8. P. 2755.
Seehof N., Mehler C., Breunig S., Risse W. // J. Mol. Catal. 1992. V. 76. P. 53.
Müller K., Jung Y., Yoon D.Y., Agarwal S., Greiner A. // Macromol. Chem. Phys. 2010. V. 211. № 14. P. 1595.
Mulpuri S. V., Shin J., Shin B.G., Greiner A., Yoon D.Y. // Polymer. 2011. V. 52. № 19. P. 4377.
Liu B., Wang X., Wang Y., Yan W., Li H., Kim I. // React. Funct. Polym. 2009. V. 69. № 8. P. 606.
Park J.H., Koh T.W., Do Y., Lee M.H., Yoo S. // J. Polym. Sci., Polym. Chem. 2012. V. 50. № 12. P. 2356.
Eo M., Lee S., Park M.H., Lee M.H., Yoo S., Do Y. // Macromol. Rapid Commun. 2012. V. 33. № 13. P. 1119.
Park J.H., Yun C., Koh T.-W., Do Y., Yoo S., Lee M.H. // J. Mater. Chem. 2011. V. 21. № 14. P. 5422.
Finkelshtein E.S., Bermeshev M.V., Gringolts M.L., Starannikova L.E., Yampolskii Y.P. // Russ. Chem. Rev. 2011. V. 80. № 4. P. 341.
Gringolts M., Bermeshev M., Yampolskii Y., Starannikova L., Shantarovich V., Finkelshtein E. // Macromolecules. 2010. V. 43. № 17. P. 7165.
Commarieu B., Claverie J.P. // Chem. Sci. Roy. Soc. Chem. 2015. V. 6. № 4. P. 2172.
Kim K.H., Han Y.-K., Lee S.U., Chun S.-H., Ok J.H. // J. Mol. Model. 2003. V. 9. № 5. P. 304.
Takamiya I., Yamashita M., Nozaki K. // Organometallics. 2008. V. 27. № 20. P. 5347.
Tetsuka H., Hagiwara M., Kaita S. // Polym. J. 2010. V. 43. № 1. P. 97.
Park M.H., Yun C., Huh J.O., Do Y., Yoo S., Lee M.H. // Synth. Met. 2010. V. 160. № 17–18. P. 2000.
Suslov D.S., Bykov M.V., Kuzmin A.V., Abramov P.A., Kravchenko O.V., Pakhomova M.V., Rokhin A.V., Ushakov I.A., Tkach V.S. // Catal. Commun. 2018. V. 106. P. 30.
Yamashita M., Takamiya I., Jin K., Nozaki K. // Organometallics. 2006. V. 25. № 19. P. 4588.
Ткач В.С., Шмидт Ф.К., Гулая Н.А. // Изобретения. Полезные модели. 2001. Т. 16. № 2. С. 378.
Ткач В.С., Зелинский С.Н., Ратовский Г.В., Пройдаков А.Г., Шмидт Ф.К. // Координац. химия. 2004. Т. 30. № 10. С. 747.
Мягмарсурэн Г. Автореф. дис. … д-ра хим. наук. Иркутск: Иркутский гос. ун-т, 2008.
Чернышёв М.Л., Ткач В.С., Дмитриева Т.В., Ратовский Г.В., Зинченко С.В., Шмидт Ф.К. // Кинетика и катализ. 1997. Т. 38. № 4. С. 575.
Ткач В.С., Ратовский Г.В., Дмитриева Т.В., Малахова Н.Д., Шмидт Ф.К. // Координац. химия. 1984. Т. 10. № 12. С. 1687.
Ткач В.С., Ратовский Г.В., Мягмарсурэн Г., Месьеф М., Тюкалова О.В., Зелинский С.Н., Шмидт Ф.К. // Координац. химия. 2000. Т. 26. № 3. P. 219.
Бобкова А.В., Зелинский С.Н., Ратовский Г.В., Ткач В.С., Шмидт Ф.К. // Кинетика и катализ. 2001. Т. 42. № 2. С. 212.
Ткач В.С., Шмидт Ф.К., Дмитриева Т.В., Ратовский Г.В., Малахова Н.Д., Мурашева Н.А., Мягмарсурэн Г. // Координац. химия. 1988. Т. 14. № 10. P. 1424.
Ткач В.С., Шмидт Ф.К., Джемилев У.М., Ратовский Г.В., Чернышёв М.Л., Бурлакова О.И. // Координац химия. 1989. Т. 15. № 10. P. 1395.
Chernyshev M.L., Tkach V.S., Dmitrieva T.V.T., Ratovskii G.V., Zinchenko S.V.S., Shmidt F.K. // React. Kinet. Catal. Lett. 1992. V. 48. № 1. P. 291.
Tkach V.S., Myagmarsuren G., Mesyef M., Shmidt F.K. // React. Kinet. Catal. Lett. 1999. V. 66. № 2. P. 281.
Myagmarsuren G., Tkach V.S., Shmidt F.K. // React. Kinet. Catal. Lett. 2004. V. 83. № 2. P. 337.
Myagmarsuren G., Lee K., Jeong O., Ihm S. // Catal. Commun. 2003. V. 4. № 12. P. 615.
Myagmarsuren G., Lee K.S., Jeong O.Y., Ihm S.K. // Polymer. 2004. V. 45. № 10. P. 3227.
Myagmarsuren G., Jeong O.-Y., Ihm S. // Appl. Catal. A. 2005. V. 296. № 1. P. 21.
Myagmarsuren G., Lee K.S., Jeong O.Y., Ihm S.K. // Polymer. 2005. V. 46. № 11. P. 3685.
Tkach V.S., Myagmarsuren G., Suslov D.S., Shmidt F.K. // Russ. J. Gen. Chem. 2007. V. 77. № 3. P. 489.
Myagmarsuren G., Tkach V.S., Suslov D.S., Shmidt F.K. // Russ. J. Appl. Chem. 2007. V. 80. № 2. P. 252.
Myagmarsuren G., Park J. Il, Ihm S.K. // Polymer. 2006. V. 47. № 26. P. 8474.
Chang C., Lipian J., Barnes D.A., Seger L., Burns C., Bennett B., Bonney L., Rhodes L.F., Benedikt G.M., Lattimer R., Huang S.S., Day V.W. // Macromol. Chem. Phys. 2005. V. 206. № 19. P. 1988.
Morishita H., Sudo A., Endo T. // J. Polym. Sci., Polym. Chem. 2009. V. 47. № 16. P. 3982.
Thirupathi N., Amoroso D., Bell A., Protasiewicz J.D. // J. Polym. Sci., Polym. Chem. 2009. V. 47. № 1. P. 103.
Chang C., Lipian J., Burns C., Rhodes L.F., Lattimer R.P. // J. Photopolym. Sci. Technol. 2010. V. 23. № 5. P. 715.
Sudo A., Morishita H., Endo T. // J. Polym. Sci., Polym. Chem. 2010. V. 48. № 17. P. 3896.
Chang C., Barnes D., Seger L.D., Rhodes L.F., Lattimer R.P., Benedikt G.M. // J. Photopolym. Sci. Technol. 2012. V. 25. № 2. P. 161.
Kandanarachchi P., Chang C., Smith S., Bradley P., Rhodes L.F., Lattimer R.P., Benedikt G.M. // J. Photopolym. Sci. Technol. 2013. V. 26. № 4. P. 431.
Chang C., Bell A., Shick R.A., Seger L.D., Rhodes L.F., Benedikt G.M. // J. Photopolym. Sci. Technol. 2014. V. 27. № 4. P. 497.
Okeya S., Sazaki H., Ogita M., Takemoto T., Onuki Y., Nakamura Y., Mohapatra B.K., Kawaguchi S. // Bull. Chem. Soc. Jpn. 1981. V. 54. № 7. P. 1978.
Baba S., Ogura T., Kawaguchi S. // Bull. Chem. Soc. Jpn. 1974. V. 47. № 3. P. 665.
Tkach V.S., Suslov D.S., Myagmarsuren G., Ratovskii G.V., Rohin A.V., Tuczek F., Shmidt F.K. // J. Organomet. Chem. 2008. V. 693. № 12. P. 2069.
Suslov D.S., Bykov M.V., Belova M.V., Abramov P.A., Tkach V.S. // J. Organomet. Chem. 2014. V. 752. P. 37.
Tkach V.S., Suslov D.S., Kurat’eva N.V., Bykov M.V., Belova M.V., Kurat’eva N.V., Bykov M.V., Belova M.V. // Russ. J. Coord. Chem. 2011. V. 37. № 10. P. 752.
Suslov D.S., Pakhomova M.V., Bykov M.V., Tkach V.S. // Russ. J. Gen. Chem. 2014. V. 84. № 11. P. 2291.
Suslov D.S., Pahomova M.V., Abramov P.A., Bykov M.V., Tkach V.S. // Catal. Commun. 2015. V. 67. P. 11.
Suslov D.S., Bykov M.V., Abramov P.A., Pakhomova M.V., Ushakov I.A., Voronov V.K., Tkach V.S. // Inorg. Chem. Commun. 2016. V. 66. P. 1.
Быков М.В. Автореф. дис. … канд. хим. наук. Иркутск: Иркутский гос. ун-т., 2013.
Kuratieva N.V., Tkach V.S., Suslov D.S., Bykov M.V., Gromilov S.A. // J. Struct. Chem. 2011. V. 52. № 4. P. 813.
Suslov D.S., Bykov M.V., Ratovskii G.V., Abramov P.A., Pahomova M.V., Ushakov I.A., Voronov V.K., Tkach V.S. // J. Mol. Struct. 2017. V. 1133. P. 411.
Suslov D.S., Bykov M.V., Abramov P.A., Pahomova M.V., Ushakov I.A., Voronov V.K., Tkach V.S. // RSC Adv. 2015. V. 5. № 126. P. 104467.
Tkach V.S., Suslov D.S., Kurat’eva N.V., Bykov M.V., Belova M.V. // Russ. J. Coord. Chem. 2011. V. 37. № 10. P. 752.
Jonas K., Wilke G. // Angew. Chemie – Int. Ed. Eng. 1969. V. 8. № 7. P. 519.
Tolman C.A. // J. Am. Chem. Soc. 1970. V. 92. № 23. P. 6777.
Tolman C.A. // J. Am. Chem. Soc. 1970. V. 92. № 14. P. 4217.
Tolman C.A. // J. Am. Chem. Soc. 1972. V. 94. № 9. P. 2994.
Tolman C.A. // J. Am. Chem. Soc. 1970. V. 92. № 23. P. 6785.
Шмидт Ф.К., Миронова Л.В., Пройдаков А.Г., Калабина А.В. // Координац. химия. 1978. Т. 4. № 10. С. 1608.
Шмидт Ф.К., Миронова Л.В., Пройдаков А.Г., Калабин Г.А., Ратовский Г.В., Дмитриева Т.В. // Кинетика и катализ. 1978. Т. 19. № 1. С. 150.
Шмидт Ф.К. // Катализ комплексами переходных металлов первого переходного ряда реакций гидрирования и димеризации. Иркутск: Изд-во Иркутского гос. ун-та, 1986.
Несмеянов А.H., Шмидт Ф.К., Миронова Л.В., Исаева Л.С., Лоренс Л.Н., Пройдаков А.Г. // Докл. АН СССР. Сер. хим. 1977. Т. 233. № 2. С. 379.
Myagmarsuren G., Jeong O., Ihm S.K. // Appl. Catal. A.2003. V. 255. № 2. P. 203.
Myagmarsuren G., Jeong O.Y., Ihm S. // Appl. Catal. A. 2004. V. 275. № 1–2. P. 271.
Schmidt F.K., Belykh L.B., Gomboogiin M., Titova Y.Y. // Kinet. Catal. 2010. V. 51. № 2. P. 235.
Shmidt F.K., Titova Y.Y., Belykh L.B., Gomboogiin M., Titova J.J., Belykh L.B., Gomboogiin M. // Pet. Chem. 2010. V. 50. № 3. P. 205.
Tkach V.S., Suslov D.S., Myagmarsuren G., Gubaidulina O.V., Bykov M.V. // Russ. J. Gen. Chem. 2009. V. 79. № 2. P. 323.
Tkach V.S., Suslov D.S., Myagmarsuren G., Gubaydulina O.V., Bykov M.V., Umanets V.A. // Catal. Commun. 2009. V. 10. № 14. P. 1813.
Ткач В.С., Суслов Д.С., Губайдулина О.В., Быков М.В., Мисько О.И. Пат. 2414965 Россия. 2011.
Ткач В.С., Суслов Д.С., Губайдулина О.В., Быков М.В., Белова М.В., Мисько О.И. Пат. 2487896 Россия. 2013.
Ткач В.С., Суслов Д.С., Губайдулина О.В., Быков М.В., Белова М.В., Мисько О.И. Пат. 2487895 Россия. 2013.
Jang Y., Sung H.-K., Lee S., Bae C. // Polymer. 2005. V. 46. № 25. P. 11301.
Kraikivskii P.B., Saraev V.V., Bocharova V.V., Matveev D.A., Petrovskii S.K., Gotsko M.D. // Catal. Commun. 2011. V. 12. № 7. P. 634.
Сараев В.В., Крайкивский П.Б., Бочарова В.В., Матвеев Д.А. // Кинетика и катализ. 2012. Т. 53. № 4. С. 477.
Janiak C., Lassahn P., Lozan V. // Macromol. Symp. 2006. V. 236. P. 88.
Zhuang R., Liu H., Guo J., Dong B., Zhao W., Hu Y., Zhang X. // Eur. Polym. J. 2017. V. 93. P. 358.
Kong Y., Ren H., Xu S., Song H., Liu B., Wang B. // Organometallics. 2009. V. 28. № 20. P. 5934.
Kong Y., Wen L., Song H., Xu S., Yang M., Liu B., Wang B. // Organometallics. 2011. V. 30. № 1. P. 153.
Dang L., Guo J., Song H., Liu B., Wang B. // Dalt. Trans., 2014. V. 43. № 45. P. 17177.
Li M., Song H., Wang B. // Organometallics. 2015. V. 34. № 10. P. 1969.
Yang D., Tang Y., Song H., Wang B. // Organometallics. 2016. V. 35. № 10. P. 1392.
Yang D., Tang Y., Song H., Wang B. // Organometallics. 2016. V. 35. № 10. P. 1392.
Dang L., Guo J., Song H., Liu B., Wang B. // Dalt. Trans. 2014. V. 43. № 45. P. 17177.
Zhang W., Wang Y., Yu J., Redshaw C., Hao X., Sun W.-H. // Dalton Trans. 2011. V. 40. № 48. P. 12856.
Jie S., Ai P., Zhou Q., Li B.G. // J. Organomet. Chem. 2011. V. 696. № 7. P. 1465.
Zheng T., Liao H., Gao J., Zhong L., Gao H., Wu Q. // Polym. Chem. 2018. V. 9. № 22. P. 3088.
Tian J., He X., Liu J., Deng X., Chen D. // RSC Adv. 2016. V. 6. № 27. P. 22908.
Zeng Y., Mahmood Q., Zhang Q., Liang T., Sun W.-H. // J. Polym. Sci., Polym. Chem. 2018. V. 56. № 8. P. 922.
Zeng Y., Mahmood Q., Zhang Q., Liang T., Sun W.-H. // Eur. Polym. J. 2018. V. 103. P. 342.
Sachse A., Demeshko S., Dechert S., Daebel V., Lange A., Meyer F. // Dalton Trans. 2010. V. 39. № 16. P. 3903.
He J., Liu Z., Du G., Fu Y., Zhang S., Li X. // Organometallics. 2014. V. 33. № 21. P. 6103.
Li A., Chen J., Zhang L., Li Z., Zhu M., Zhang W., Lin X., Zhang Z. // J. Appl. Polym. Sci. 2009. V. 113. № 3. P. 1642.
Li M., Shu X., Cai Z., Eisen M.S. // Organometallics. 2018. V. 37. № 7. P. 1172.
Qiao Y.L., Jin G.X. // Organometallics. 2013. V. 32. № 6. P. 1932.
Lassahn P.-G., Lozan V., Janiak C. // Dalton Trans. 2003. № 5. P. 927.
Jana O., Mani G. // Inorg. Chem. 2018. V. 57. № 13. P. 7735.
Feng Q., Chen D., Feng D., Jiao L., Peng Z., Pei L. // Appl. Organomet. Chem. 2014. V. 28. № 8. P. 32.
Yu Y., Chen J., Meng S., Li C., Lan M., Zhang Z. // J. Mol. Catal. A. 2013. V. 380. P. 104.
Zhou Z., Hao X., Redshaw C., Chen L., Sun W.-H. // Catal. Sci. Technol. 2012. V. 2. № 7. P. 1340.
Guo Y., Ai P., Han L., Chen L., Li B.-G., Jie S. // J. Organomet. Chem. 2012. V. 716. P. 222.
Xu Y.-M., Li K., Wang Y., Deng W., Yao Z.-J. // Polymers. 2017. V. 9. № 3.
Song D.-P., Li Y.-G., Lu R., Hu N.-H., Li Y. // Appl. Organomet. Chem. 2008. V. 22. № 6. P. 333.
Wang J., Wan L., Zhang D., Wang Q., Chen Z. // Eur. J. Inorg. Chem. 2013. № 12. P. 2093.
Hao Z., Yang N., Gao W., Xin L., Luo X., Mu Y. // J. Organomet. Chem. 2014. V. 749. P. 350.
Shi X.C., Jin G.X. // Organometallics. 2012. V. 31. № 13. P. 4748.
Gao H., Pei L., Li Y., Zhang J., Wu Q. // J. Mol. Catal. A. 2008. V. 280. № 1–2. P. 81.
Zhang J.K., Wang P.C., Wang X.W., Wang L., Chen J.C., Zheng Z.W., Niu Y.P. // J. Organomet. Chem. 2011. V. 696. № 23. P. 3697.
Gao H., Liu Y., Li G., Xiao Z., Liang G., Wu Q. // Polym. Chem. 2014. V. 5. № 20. P. 6012.
Appukuttan V., Kim J.H., Ha C.S., Kim I. // Korean J. Chem. Eng. 2008. V. 25. № 3. P. 423.
Niu Y.-P., Wang X.-W., Zheng Z.-W., Ma X.-F., Cai J.-Q., Zhang J.-K., Cheng J.-L. // Appl. Organomet. Chem. 2014. V. 28. № 4. P. 688.
Antonov A.A., Semikolenova N.V., Zakharov V.A., Zhang W., Wang Y., Sun W.-H., Talsi E.P., Bryliakov K.P. // Organometallics. 2012. V. 31. № 3. P. 1143.
Huang Y., Chen J., Chi L., Wei C., Zhang Z., Li Z., Li A., Zhang L. // J. Appl. Polym. Sci. 2009. V. 112. № 3. P. 1486.
Wang Y.-Y., Lin S.-A., Zhu F.-M., Gao H.-Y., Wu Q. // J. Appl. Polym. Sci. 2008. V. 110. № 6. P. 3590.
Wang Y.Y., Li B.X., Zhu F.M., Gao H.Y., Wu Q. // Polym. Bull. 2013. V. 70. № 2. P. 681.
Wang Y.Y., Lin S. an, Zhu F.M., Gao H.Y., Wu Q. // Eur. Polym. J. 2008. V. 44. № 7. P. 2308.
Eseola A.O., Zhang M., Xiang J.F., Zuo W., Li Y., Woods J. a O., Sun W.H. // Inorgan. Chim. Acta. 2010. V. 363. № 9. P. 1970.
Han F., Zhang Y., Sun X., Li B., Guo Y., Tang Y. // Organometallics. 2008. V. 27. № 8. P. 1924.
Liu F.S., Gao H.Y., Song K.M., Zhao Y., Long J.M., Zhang L., Zhu F.M., Wu Q. // Polyhedron. 2009. V. 28. № 4. P. 673.
Berding J., Lutz M., Spek A.L., Bouwman E. // Appl. Organomet. Chem. 2011. V. 25. № 1. P. 76.
Zhang D., Zhou S., Li Z., Wang Q., Weng L. // Dalton Trans. 2013. V. 42. № 33. P. 12020.
Kong Y., Cheng M., Ren H., Xu S., Song H., Yang M., Liu B., Wang B. // Organometallics. 2011. V. 30. № 6. P. 1677.
Song H., Fan D., Liu Y., Hou G., Zi G. // J. Organomet. Chem. 2013. V. 729. P. 40.
Vijayakrishna K., Padmanabhan S., Kannan T., Dakshinamoorthy D. // Polym. Bull. 2012. V. 68. № 3. P. 635.
Finkelshtein E.S., Makovetskii K.L., Gringolts M.L., Rogan Y.V., Golenko T.G., Starannikova L.E., Yampolskii Y.P., Shantarovich V.P., Suzuki T. // Macromolecules. 2006. V. 39. № 20. P. 7022.
Маковецкий К.Л., Горбачева Л.И., Голенко Т.Г., Островская И.Я. // Высокомолек. соед. А. 1996. Т. 38. № 3. С. 435.
Antonov A.A., Samsonenko D.G., Talsi E.P., Bryliakov K.P. // Organometallics. 2013. V. 32. № 7. P. 2187.
Blank F., Vieth J.K., Ruiz J., Rodríguez V., Janiak C. // J. Organomet. Chem. 2011. V. 696. № 2. P. 473.
Blank F., Scherer H., Ruiz J., Rodríguez V., Janiak C. // Dalton Trans. 2010. V. 39. № 15. P. 3609.
Yao Z.-J., Li P., Li K., Deng W. // Appl. Organomet. Chem. 2018. V. 32. № 4.
Meng J., Li X., Ni X., Shen Z. // Polym. Int. 2017. V. 66. № 11. P. 1617.
Chu Z., Ding L.Q., Long Y., Chen L.L., Lü X.Q., Song J.R., Fan D. Di, Bao F., Ma R. // J. Inorg. Organomet. Polym. Mater. 2010. V. 20. № 2. P. 235.
Barnes D.A., Benedikt G.M., Goodall B.L., Huang S.S., Kalamarides H.A., Lenhard S., McIntosh L.H., Selvy K.T., Shick R.A., Rhodes L.F. // Macromolecules. 2003. V. 36. № 8. P. 2623.
Song D.-P., Mu H.-L., Shi X.-C., Li Y.-G., Li Y.-S. // J. Polym. Sci., Polym. Chem. 2012. V. 50. № 3. P. 562.
Huo P., Liu W., He X., Wang H., Chen Y. // Organometallics. 2013. V. 32. № 8. P. 2291.
Yamamoto T., Shikada C., Kaita S., Olivier T., Maruyama Y., Wakatsuki Y. // J. Mol. Catal. A.2009. V. 300. № 1–2. P. 1.
Yuan B., He X., Chen Y., Wang K. // Macromol. Chem. Phys. 2011. V. 212. № 21. P. 2378.
He X., Yuan B., Chen Y., Chen D. // High Perform. Polym. 2012. V. 25. № 3. P. 287.
Huang R., He X., Chen Y., Nie H., Zhou W. // Polym. Adv. Technol. 2012. V. 23. № 3. P. 483.
Tian J., Zhu H., Liu J., Chen D., He X. // Appl. Organomet. Chem. 2014. V. 28. № 4. P. 702.
He X., Liu Y., Chen L., Chen Y., Chen D. // J. Polym. Sci., Polym. Chem. 2012. V. 50. № 22. P. 4695.
Liu Y., Ouyang M., He X., Chen Y., Wang K. // J. Appl. Polym. Sci. 2013. V. 128. № 1. P. 216.
Chen L., Zhong Z., Chen C., He X., Chen Y. // J. Organomet. Chem. 2014. V. 752. P. 100.
Xing Y., Chen Y., He X., Nie H. // J. Appl. Polym. Sci. 2012. V. 124 № 2. P. 1323.
Hu M., He X., Chen Y., Chen D. // J. Polym. Res. 2012. V. 19. № 10.
Huo P., Li J., Liu W., Mei G., He X. // RSC Adv. 2017. V. 7. № 82. P. 51858.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)