Высокомолекулярные соединения (серия С), 2022, T. 64, № 2, стр. 237-250
АМФИФИЛЬНЫЕ БЛОК-ПРИВИТЫЕ МОЛЕКУЛЯРНЫЕ ЩЕТКИ ABA-ТИПА НА ОСНОВЕ ПОЛИИМИДА
И. В. Иванов a, *, А. В. Кашина a, Н. В. Кукаркина a, А. В. Якиманский a
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Большой пр., 31, Россия
* E-mail: ivanpsg1990@inbox.ru
Поступила в редакцию 25.04.2022
После доработки 04.05.2022
Принята к публикации 23.05.2022
- EDN: TLPGOZ
- DOI: 10.31857/S2308114722700042
Аннотация
Синтезированы новые амфифильные молекулярные щетки смешанной блок-привитой топологии ABA-типа с центральным блоком В – молекулярной щеткой с гидрофобной полиимидной основной цепью и гидрофильными боковыми цепями полиметакриловой кислоты и A – гидрофобными периферийными цепями полиметилметакрилата. Для синтеза целевых сополимеров предложен подход, основанный на комбинации метода радикальной полимеризации с переносом атома ATRP и “клик”-химии в варианте Cu(I)-катализируемого циклоприсоединения азидов и алкинов. Для реализации предложенного подхода разработана методика синтеза гетерофункциональных полиимидных макроинициаторов, содержащих в каждом звене ATRP-инициирующие группы и способные участвовать в “клик”-реакции концевые алкинильные группы. Далее на таких инициаторах осуществлен синтез четко определенных блок-привитых молекулярных щеток ABA-типа. Сначала с помощью ATRP в контролируемом режиме синтезированы периферийные цепи полиметилметакрилата с последующей функционализацией их азидными группами. Затем с помощью метода “клик”-химии эти цепи прививали к концевым алкинильным группам гетерофункционального инициатора. Введение гидрофильных боковых цепей в блок B осуществляли способом “прививка от” методом ATRP в несколько стадий через промежуточное образование регулярно привитого форполимера с боковыми цепями поли(трет-бутилметакрилата). На последней стадии в результате селективного кислотного гидролиза сложноэфирных групп боковых цепей в блоке B получены амфифильные мультикомпонентные щетки с гидрофильными звеньями полиметакриловой кислоты в боковых цепях. Протестирована возможность последовательного и одновременного проведения ATRP и “клик”-химии.
ВВЕДЕНИЕ
С развитием контролируемой/“живой” радикальной полимеризации синтез полимеров сложной архитектуры с четко определенной структурой привлек значительный интерес в течение последних нескольких десятилетий, поскольку позволяет разрабатывать новые полимерные материалы с набором уникальных свойств. К одним из наиболее перспективных макромолекулярных структур относятся молекулярные щетки – привитые сополимеры регулярного строения с плотно привитыми узкодисперсными боковыми цепями [1, 2]. Вследствие компактной разветвленной структуры и устойчивой цилиндрической формы молекулярные щетки стали уникальным классом наноструктурированных полимеров [3–5]. В отличие от линейных полимеров разветвленная архитектура молекулярных щеток предлагает более широкий спектр структурных параметров, таких как состав и длина боковых и основной цепей, плотность прививки, а также более высокое содержание реактивных групп, которые можно использовать для регулирования физико-химических свойств материалов на их основе [6].
В последние годы активно развивается дизайн, разработка методов синтеза и исследование свойств молекулярных полимерных щеток сложной архитектуры, включающих более двух типов полимерных блоков, с различным типом их распределения [7–9]. Введение в подобные мультикомпонентные сополимеры блоков, обладающих амфифильностью, термо- и рН-чувствительностью, не только придает данные свойства сополимеру, но и обусловливает зависимость их проявления от структурных параметров [10–12]. Это позволяет целенаправленно регулировать свойства молекулярных щеток путем варьирования параметров структуры. Одним из важнейших свойств таких сополимеров является способность к самоорганизации макромолекул в растворе или в массе и чувствительность образующихся структур к внешним воздействиям [13, 14]. Среди направлений практического применения подобных сополимеров наиболее перспективным является их использование в медицине, биохимии и микроэлектронике [15–18].
Однако мультикомпонентые молекулярные щетки сложной архитектуры редко удается синтезировать в рамках одного способа прививки и метода. Все активнее разрабатываются подходы, основанные на комбинации различных методов контролируемой полимеризации [19–21]. Для реализации этих подходов необходимо использовать гетерофункциональные инициаторы, в которых либо изначально содержатся несколько типов функциональных групп, способных параллельно или последовательно инициировать каждый из процессов [22], либо на стадии инициирования или обрыва полимеризации первого мономера нужно вводить функциональную группу, инициирующую полимеризацию следующего мономера [3]. Метод постмодификации более прост в исполнении, однако необходимость в промежуточной защите функциональных групп и дальнейших этапах их преобразования ограничивает его использование. Применение гетерофункциональных инициаторов более эффективно при полимеризации химически несовместимых мономеров. Такие инициаторы содержат две или более инициирующие группы разной природы, и каждая функциональность является селективной для различного механизма полимеризации [23]. Используя данный подход, можно синтезировать молекулярные щетки, имеющие в своей структуре несовместимые блоки без необходимости дальнейших преобразований или этапов защиты [24, 25].
Ранее наши исследования были направлены на вариацию сополимерного дизайна молекулярных щеток вдоль боковых цепей. Были синтезированы амфифильные мультикомпонентные молекулярные щетки с гидрофобной полиимидной основной цепью и амфифильными диблок-сополимерными боковыми цепями, содержащими внутренние гидрофильные блоки полиметакриловой кислоты и внешние гидрофобные блоки полиметилметакрилата [26]. На основе кинетических исследований и определения молекулярно-массовых характеристик продуктов полимеризации были установлены условия синтеза, позволяющие контролируемо регулировать плотность прививки и длину гидрофильного и гидрофобного блоков в боковых цепях. Проведено исследование процессов самоорганизации синтезированных амфифильных молекулярных щеток с блок-сополимерными боковыми цепями в ряде селективных и неселективных растворителей методами молекулярной гидродинамики и оптики [27]. Установлено влияние архитектуры, структурных параметров макромолекул (плотность прививки боковых цепей, длина и распределение цепей) и гидрофильно-гидрофобного баланса компонентов на строение и конформационные характеристики мицеллоподобных наноструктур, образующихся в результате самоорганизации в селективном растворителе.
Дальнейшее развитие наших исследований включает вариацию сополимерного дизайна вдоль основной цепи щеток, а также в обоих направлениях. Настоящая работа направлена на разработку подходов к синтезу и характеристике амфифильных мультикомпонентных блок-привитых молекулярных щеток АВА-типа ПММА–блок–(ПИ–прив–ПМАК)–блок–ПММА с центральным блоком В – молекулярной щеткой с полиимидной основной цепью и гидрофильными боковыми цепями полиметакриловой кислоты (ПМАК) и A – периферийными гидрофобными цепями полиметилметакрилата. Для синтеза целевых сополимеров предложен подход, основанный на комбинации методов ATRP и “клик”-химии в варианте Cu(I)-катализируемого циклоприсоединениея азидов и алкинов (copper-catalyzed azide−alkyne cycloaddition, CuAAC). Для реализации этого подхода разработаны условия синтеза гетерофункциональных мультицентровых полиимидных макроинициаторов, содержащих α-бромэфирные группы в каждом повторяющемся звене и алкинильные группами в концевых звеньях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
4,4'-(1,3-фенилен-диокси)-бисфталевый ангидрид (99%, “Ambinter Stock Screening Collections”) сушили при 140°С под вакуумом. Дигидрохлорид 2,4-диаминофенола (98%, “Lancaster”), перед синтезом предварительно сушили при 100°С под вакуумом.
N-метил-2-пирролидон (МП) (98%, “Aldrich”), ДМФА квалификации х.ч. (“Вектон”), толуол квалификации ч.д.а. (“Вектон”) сушили при нагревании с безводным гидридом кальция (99.9%, “Aldrich”), затем перегоняли в вакууме. Метилметакрилат (ММА) (99%, “Aldrich”) и трет-бутилметакрилат (ТБМА) (98%, “Aldrich”) перед использованием дважды перегоняли в вакууме. CuCl (≥99%, “Aldrich”) и CuBr (98%, “Acros Organics”) очищали от примесей Cu(II) выдерживанием в ледяной уксусной кислоте (двое суток, периодически перемешивая). Порошок отфильтровывали, промывали метанолом квалификации х.ч. (“Вектон”) и сушили в вакууме при 35−40°С в течение недели. Хлористый метилен квалификации х.ч. (“Вектон”), тетрагидрофуран квалификации х.ч. (“Вектон”) сушили над гидридом кальция и перегоняли. Этил-2-бромизобутират (98%, “Acros Organics”), 2-бром-изобутироилбромид (98%, “Aldrich”), триэтиламин (≥99%, “Aldrich”), 3-аминофенилацетилен (АФА) (98%, Acros Organics), азид натрия (≥99.5%, “Aldrich”), пиридин (99.8%, “Aldrich”), анизол (99.7%, “Aldrich”), трифторуксусную кислоту (99%, “Aldrich”), 4,4'-динонил-2,2'-бипиридин (dNbpy) (97%, “Aldrich”), N,N,N′,N′′,N′′-пентаметилдиэтилентриамин (PMDETA) (99%, “Aldrich”), 1,1',4,7,10,10'-гексаметилтриэтилентетрамин (HMTETA) (97%, “Aldrich”) использовали без дополнительной очистки.
Синтез гетерофункциональных гидроксилсодержащих полиимидов
Синтез гетерофункциональных алкинил-терминированных полиимидов, содержащих в каждом повторяющемся звене функциональные группы OH, осуществляли по стандартной методике в растворе МП. На первой стадии проводили поликонденсацию диамина и диангидрида при комнатной температуре. В атмосфере аргона навеску 2,4-диаминофенол дигидрохлорида (0.794 г, 4 ммоль), 6.12 мл МП и 1.3 мл пиридина помещали в круглодонную колбу объемом 250 мл. Далее при интенсивном перемешивании к полученной смеси прибавляли 4,4′-(1,3-фенилен-диокси)-бисфталевый ангидрид (1.8 г, 4.5 ммоля) в три порции с интервалом 15 мин. Реакцию продолжали в течение 12 ч. Далее в токе аргона вносили АФА (0.105 г, 0.9 ммоля). Получили 30%-ный раствор полиамидокислоты. На следующей стадии раствор разбавляли МП до концентрации 20 мас. % и проводили внутримолекулярную реакцию циклодегидратации полиамидокислоты при 170− 180°С в течение 4 ч с азеатропной отгонкой воды с толуолом. Полученный гетерофункциональный ПИ высаживали в метанол, промывали осадителем, фильтровали и сушили в вакууме при 50°С в течение 1 суток.
Синтез гетерофункциональных мультицентровых полиимидных макроинициаторов
В 15%-ный раствор гетерофункционального гидроксилсодержащего ПИ в пиридине в токе аргона вносили иодид калия. Затем к полученному раствору, охлажденному до –2…0°С, прикапывали раствор 2-бром-изобутироилбромида в ТГФ при интенсивном перемешивании и охлаждении. Мольное соотношение фрагмент ПИ, приходящийся на одну группу ОН в концевом звене : бромангидрид : иодид калия составляло 1 : 2 : 10. Реакционную смесь при охлаждении и перемешивании выдерживали в течение 4 ч, затем температуру повышали до комнатной, после чего фильтровали. Продукт реакции высаживали из фильтрата в метанол, осадок отфильтровывали и многократно промывали водой и этанолом. Выделенный полимерный продукт сушили в вакууме при 50°С до постоянной массы.
Синтез линейных цепей полиметилметакрилата
Типичная процедура синтеза была следующая. В колбу Шленка объемом 25 мл, снабженную магнитной мешалкой, в токе аргона вносили dNbpy (0.051 г, 0.12 ммоля) и этил-2-бром-изобутират (9.4 мкл, 0.06 ммоля). Содержимое колбы растворяли в МП (3.64 мл), перемешивая смесь до полного растворения порошка. В токе аргона в реакционную смесь с помощью продутого аргоном шприца вводили ММА (4 мл, 37.4 ммоля). Колбу герметично закрывали септой и трижды проводили цикл замораживание–вакуумирование–размораживание (продолжительность вакуумирования составляла 15 мин). Затем в колбу в токе аргона добавляли навеску CuCl (0.006 г, 0.06 ммоля). Для полного удаления кислорода из реакционной смеси повторяли цикл замораживание–вакуумирование–размораживание. Затем колбу с подготовленной реакционной смесью заполняли аргоном и при перемешивании со скоростью 800 об/мин термостатировали в масляной бане в течение 1 ч при 80°С.
После заданной продолжительности синтеза реакционную смесь охлаждали до комнатной температуры и, вскрыв септу, переносили в стакан, разбавив в 2 раза ТГФ. Для удаления солей меди смесь пропускали через колонку, заполненную Al2O3, после чего концентрировали с помощью ротационного испарителя. Продукт полимеризации ММА высаживали в метанол. Отфильтрованный порошок сушили в вакууме при 50°С до постоянной массы.
Синтез линейных цепей полиметилметакрилата с концевыми азидными группами ПММА(N3)
В раствор ПММА в ДМФА (5 мас. %) вносили азид натрия (пятикратный избыток по отношению к инициирующим группам) (0.0104 г). После перемешивания в течение 24 ч при комнатной температуре полимер высаживали в метанол, осадок отфильтровывали и промывали метанолом. Полимер сушили в вакууме при 50°С до постоянной массы.
Синтез блок-привитых молекулярных щеток ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА в режиме “one-pot”
Типичная синтетическая процедура была следующая. В колбу Шленка объемом 25 мл, снабженную магнитной мешалкой, в токе аргона вносили навеску гетерофункционального полимидного макроинициатора (ПИИ) (0.05 г, 0.077 ммоля ATRP-инициирующих групп, 0.004 ммоля алкинильных групп), ПММА(N3) (0.117 г, 0.006 ммоля). Затем с помощью продутого аргоном шприца последовательно добавляли МП (8.51 мл), PMDETA (16.1 мкл, 0.077 ммоля) и ТБМА (2.5 мл, 15.4 ммоля). Колбу герметично закрывали септой и трижды проводили цикл замораживание–вакуумирование–размораживание (продолжительность вакуумирования составляла 15 мин). Затем в колбу в токе аргона вводили навеску CuCl (0.008 г, 0.077 ммоля). Для полного удаления кислорода из реакционной смеси повторяли цикл замораживание–вакуумирование–размораживание. После этого колбу с подготовленной реакционной смесью заполняли аргоном и при перемешивании со скоростью 800 об/мин термостатировали в масляной бане в течение 1 суток при 70°С.
Методика выделения и очистки блок-привитых молекулярных щеток ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА аналогична описанной выше методике синтеза линейного блока ПММА.
Синтез прекурсорного триблок-сополимера ПММА–блок–ПИ–блок–ПММА
Синтезированный ПММА с азидными функциональными группами ПММА(N3) прививали к концевым алкинильным группам ПИИ. Типичная синтетическая процедура была следующая. В колбу Шленка объемом 25 мл, снабженную магнитной мешалкой, в токе аргона вносили навеску ПИИ (0.01 г, 0.008 ммоля алкинильных групп) и ПММА(N3) (0.234 г, 0.012 ммоля). Затем с помощью продутого аргоном шприца последовательно вносили ДМФА (2 мл), PMDETA (1.6 мкл, 0.008 ммоля). Колбу герметично закрывали септой и трижды проводили цикл замораживание–вакуумирование–размораживание (продолжительность вакуумирования составляла 15 мин). Затем в колбу в токе аргона вносили навеску CuBr (0.0011 г, 0.008 ммоля). Для полного удаления кислорода из реакционной смеси повторяли цикл замораживание–вакуумирование–размораживание. После этого колбу с подготовленной реакционной смесью заполняли аргоном и при перемешивании со скоростью 800 об/мин термостатировали в масляной бане в течение 1 суток при 70°С.
Методика выделения и очистки триблок-сополимеров ПММА–блок–ПИ–блок–ПММА аналогична описанной выше методике синтеза линейного блока ПММА.
Синтез блок-привитых щеток ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА в рамках двустадийной методики
Триблок-сополимер ПММА–блок–ПИ–блок–ПММА использовали для прививки в центральный блок боковых цепей ПТБМА. Для этого в колбу Шленка объемом 25 мл, снабженную магнитной мешалкой, в токе аргона добавляли навеску ПММА–блок–ПИ–блок–ПММА (0.05 г, 0.077 ммоля ATRP-инициирующих групп). Затем с помощью продутого аргоном шприца последовательно вводили МП (8.51 мл), PMDETA (16.1 мкл, 0.077 ммоля) или HMTETA (32.4 мкл, 0.077 ммоля) и ТБМА (2.5 мл, 15.4 ммоля). Колбу герметично закрывали септой и трижды проводили цикл замораживание–вакуумирование–размораживание (продолжительность вакуумирования составляла 15 мин). Затем в колбу в токе аргона добавляли навеску CuCl (0.008 г, 0.077 ммоля). Для полного удаления кислорода из реакционной смеси повторяли цикл замораживание–вакуумирование–размораживание. После этого колбу с подготовленной реакционной смесью заполняли аргоном и при перемешивании со скоростью 800 об/мин термостатировали в масляной бане при температуре 70 или 50°С соответственно.
Методика выделения и очистки блок-привитых щеток-прекурсоров ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА аналогична описанной выше методике синтеза линейного блока ПММА.
Синтез амфифильных блок-привитых щеток ПММА–блок–(ПИ–прив–ПМАК)–блок–ПММА
В раствор сополимера ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА концентрации 4 мас. % в свежеперегнанном хлористом метилене добавляли рассчитанное количество свежеперегнанной трифторуксусной кислоты. Реакцию проводили при комнатной температуре при перемешивании в течение 24 ч, затем растворитель выпаривали, осадок переосаждали из этилового спирта в хлористый метилен. Полимер сушили в вакууме при 50°С.
Выделение линейных цепей ПТБМА, ПММА из блок-привитых сополимеров
Навеску блок-привитого триблок-сополимера (0.1 г) растворяли в 15 мл свежеперегнанного ТГФ, затем добавляли 10 мл 5%-ного раствора KOH в CH3OH. Реакционную смесь выдерживали в стеклянной емкости с винтовой крышкой (“Schott Duran”, Germany) в течение 3 суток при 90°C. По окончании реакции смесь нейтрализовали соляной кислотой, затем продукт концентрировали и высаживали в воду, промывали осадителем (водой) и сушили при 50°С в вакууме.
Методы характеристики синтезированных блок-привитых сополимеров
Конверсию метакрилатов в процессе полимеризации определяли методом газовой хроматографии. Для этого в реакционную смесь вместе с растворителем вводили внутренний стандарт – анизол (5 мас. % от концентрации мономера). В заданные промежутки времени реакции из герметично закрытой реакционной колбы с помощью продутого аргоном микрошприца отбирали пробы реакционной смеси и растворяли в МП. Конверсию мономера определяли хроматографически по уменьшению площади пика мономера по отношению к площади пика внутреннего стандарта. Кинетические исследования выполняли с помощью газового хроматографа “Shimadzu GC-2010 Plus”, снабженного пламенно-ионизационным детектором, с использованием капиллярной колонки “Agilent J&W DB-WAX GC Column” (30 м, 0.53 мм, 0.50 мкм). Температура детектора и инжектора составляла 250°C.
Спектры ЯМР 1Н регистрировали на приборе “Bruker AC-400” (400.1 МГц) относительно сигналов растворителя (ДМСО-d6, CDCl3). ИК-спектры полимеров записывали на фурье-спектрометре “Vertex 70” (“Bruker”) в режиме многократного нарушенного полного внутреннего отражения с разрешением 4 см−1, число сканов 30.
Молекулярно-массовые характеристики исходных ПИИ, блок-привитых щеток и выделенных из них боковых цепей определяли с помощью эксклюзионной жидкостной хроматографии.
ЭЖХ-анализ полимерных продуктов проводили, используя хроматографический комплекс “Agilent-1260 Infinity”, оборудованный двумя колонками с сорбентом PLgel MIXED-C (размер колонок 7.5 × 300 мм, размер частиц 5 мкм). Режим элюирования изократический, элюент – ДМФА, содержащий 0.1 моль/л LiBr, скорость потока элюента 1 мл/мин, температура 50°C. Молекулярно-массовые характеристики образцов определяли по данным рефрактометрического и вискозиметрического детекторов в комбинации с детектором по светорассеянию, что позволяет не использовать калибровочные стандарты. ЭЖХ-анализ выделенных боковых цепей выполняли на хроматографе “Prominence” (“Shimadzu”), оснащенном рефрактометрическим детектором, на колонке HR 4E (“Waters”) с сорбентом μ-styrogel (7.8 × 300 мм, 5 мкм). Режим элюирования изократический, элюент – ТГФ, скорость потока 0.5 мл/мин, температура 40°C. Молекулярно-массовые характеристики образцов определяли по полистирольным стандартам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для синтеза амфифильных блок-привитых молекулярных щеток АВА-типа ПММА–блок–(ПИ–прив–ПМАК)–блок–ПММА с центральным блоком B − молекулярной щеткой с полиимидной основной цепью и гидрофильными боковыми цепями полиметакриловой кислоты (ПМАК) и A − периферийными гидрофобными цепями полиметилметакрилата предложен подход, основанный на комбинации методов радикальной полимеризации с переносом атома ATRP и “клик”-химии.
Cu(I)-катализируемое циклоприсоединение азидов и алкинов (сopper-catalyzed azide−alkyne cycloaddition, CuAAC) − высокоэффективная реакция сочетания − привлекает большое внимание в связи с высокой специфичностью и толерантностью к присутствию многих функциональных групп [28]. Метод ATRP активно используют для макромолекулярного дизайна сополимеров сложной архитектуры с заданными структурными параметрами и узким молекулярно-массовым распределением [29]. Поскольку и ATRP, и реакция CuAAC протекают с участием каталитических комплексов на основе солей Cu(I), их сочетание перспективно для проведения однореакторного синтеза целевых блок-привитых молекулярных щеток.
Синтез гетерофункциональных полиимидных макроинициаторов
Для реализации предложенного подхода к получению целевых сополимеров разработана методика синтеза гетерофункциональных мультицентровых полиимидных макроинициаторов, содержащих в каждом звене ATRP-инициирующие группы и способные участвовать в “клик”-реакции концевые алкинильные группы:
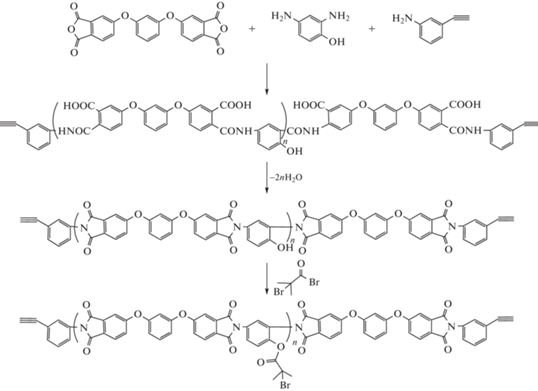
Для этого на первой стадии были получены образцы алкинил-терминированного ПИ с боковыми фенольными группами в каждом звене. Синтез проводили по стандартной двустадийной схеме получения ПИ через промежуточное получение полиамидокислоты на основе 4,4'-(1,3-фенилен-диокси)-бисфталевого ангидрида (рДА) и 2,4-диаминофенола (ДАФ) в растворе в МП и ее высокотемпературную дегидроциклизацию (имидизацию) в нативном растворе [30–32]. Для введения в концевые звенья полимера алкинильных функциональных групп часть диамина заменяли содержащим алкинильную группу моноамином АФА, сохраняя при этом эквимолярное соотношение диангидридных и диаминных групп. Мольное соотношение мономеров рДА : : ДАФ : АФА = 1.0 : 0.9 : 0.2. При проведении поликонденсации протестированы два способа введения в реакционную среду АФА. В первом (табл. 1, способ 1) АФА растворяли в МП одновременно с ДАФ, после чего при интенсивном перемешивании в инертной атмосфере (Ar) вводили рДА. Во втором (табл. 1, способ 2) сначала в раствор ДАФ аналогичным образом добавляли рДА, а АФА – через 12 ч после начала синтеза.
Таблица 1.
Условия синтеза и молекулярно-массовые характеристики гетерофункционального полиимидного макроинициатора (соотношение рДА : ДАФ : АФА =1.0 : 0.9 : 0.2, растворитель МП, T = 25°С, время 24 ч)
| Образец, № | Полиимид | Полиимидный макроинициатор | ||
|---|---|---|---|---|
| Mn × 10–3 | Ð | Mn × 10–3 | Ð | |
| 1* | – | – | 29.1 | 1.27 |
| 2** | 19.5 | 1.15 | 25.6 | 1.54 |
Прохождение поликонденсации и структуру синтезированных ПИ подтверждали методами ЯМР- (рис. 1а) и ИК-спектроскопии (рис. 1б). Наличие алкинильных групп в образцах гидроксилсодержащих ПИ контролировали по появлению в спектре ЯМР 1Н полученных образцов сигнала в области 4.3 мд, который отнесен к протонам –C≡CH групп (рис. 1а). В ИК-спектре ПИ помимо характеристических полос поглощения имидных циклов (при 1370 см−1 и дуплет в области 1776 см−1 и 1717 см−1) присутствует слабый пик при 2300 см−1, который относится к валентным колебаниям этинильной группы (–С≡С–) (рис. 1б).
Рис. 1.
Спектры ЯМР 1Н (а) и ИК-спектры (б) гидроксилсодержащего полиимида с концевыми алкинильными группами (1) и мультицентрового полиимидного макроинициатора с 2-бром-изобутиратными инициирующими группами и концевыми алкинильными группами (2).

В результате полимераналогичной этерификации групп ОН звеньев ПИ под действием 2-бром-изобутироилбромида были получены образцы гетерофункциональных ПИИ с инициирующими 2-бром-изобутиратными группами практически в каждом звене основной цепи и концевыми алкинильными группами (см. выше схему синтеза). Реакцию этерификации проводили в разработанных ранее условиях, обеспечивающих количественное взаимодействие 2-бром-изобутироилбромида с гидроксильными группами ПИ [32].
Полноту прохождения реакции этерификации контролировали с помощью спектров ЯМР 1Н продуктов по исчезновению сигналов протонов гидроксильных групп и появлению сигналов метильных протонов 2-бром-изобутиратных групп при 1.9 мд. (рис. 1а). Методом спектроскопии ЯМР 1Н также подтверждали сохранение алкинильных групп в структуре ПИ в процессе этерификации по сигналам протонов групп –C≡CH (4.3 мд).
В табл. 1 приведены молекулярно-массовые характеристики синтезированных образцов алкинил-терминированных ПИ с боковыми 2-бром-изобутиратными группами. Установлено, что варьирование очередности внесения моноамина позволило регулировать степень поликонденсации ПИ и соответственно в дальнейшем количество 2-бром-изобутиратных групп в образцах ПИИ на его основе. Интересно отметить, что данные по увеличению Mn при переходе от гидроксилсодержащего ПИ к ПИИ хорошо соответствуют присоединению n групп 2-бром-изобутирата (табл. 1, образец 2), т.е. характеризует процесс как полимераналогичный.
Синтез амфифильных блок-привитых молекулярных щеток АВА-типа ПММА–блок–(ПИ–прив–ПМАК)–блок–ПММА
Полученные образцы гетерофункциональных полиимидных макроинициаторов с α-бромэфирными группами в каждом повторяющемся звене и алкинильными группами в концевых звеньях были использованы для синтеза амфифильных блок-привитых молекулярных щеток АВА-типа ПММА–блок–(ПИ–прив–ПМАК) –блок–ПММА.
Для этого предварительно синтезировали периферийные линейные A-блоки ПММА с концевыми азидными группами ПММА(N3) методом ATRP:
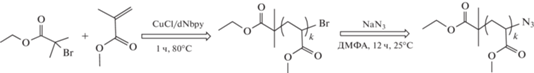
В качестве инициатора использовали этил-2-бром-изобутират. Синтез проводили в среде МП в присутствии каталитического комплекса хлорида меди (I) c 4,4'-динонил-2,2'-бипиридином (CuCl/dNbpy). Мольное соотношение компонентов реакционной смеси ПИИ : CuCl : dNbpy : : ММА = 1 : 1 : 2 : 600. Далее образцы ПММА, синтезированные в контролируемом режиме ATRP, обрабатывали азидом натрия в среде ДМФА для замещения концевых групп Br функциональными азидными группами. Линейные цепи ПММА(N3) были использованы в качестве макромономеров для синтеза блок-привитых щеток типа ABA.
Для получения целевых мультикомпонентных щеток типа ABA были протестированы два подхода: однореакторный и двустадийный. Поскольку реакции CuAAC и ATRP протекают под действием каталитических комплексов на основе солей Cu(I), в рамках первого подхода удалось провести одновременно прививку и боковых цепей к блоку B, и периферийных цепей блока A в режиме “one-pot”. Синтез осуществляли в среде МП при температуре 70°С в течение 24 ч, используя в качестве каталитического комплекса CuCl/PMDETА:

С помощью метода “клик”-химии прививали периферийные цепи ПММА(N3) с функциональными азидными группами к концевым алкинильным группам гетерофункционального ПИИ. Введение в блок B гидрофильных боковых цепей ПМАК осуществляли методом ATRP способом “прививка от” через промежуточное образование щетки-прекурсора с боковыми цепями ПТБМА. Мольное соотношение реагентов ПИИ : ПММА(N3) : : CuCl : PMDETA : ТБМА = 1 : 1.5 : 1 : 1 : 200. В результате последующего кислотного гидролиза звеньев ТБМА боковых цепей под действием трифторуксусной кислоты в среде хлористого метилена получали щеточный блок B с гидрофильными звеньями ПМАК в боковых цепях.
Успешное протекание полимеризации, полимераналогичное протекание кислотного гидролиза звеньев ТБМА боковых цепей и структуру синтезированных блок-привитых молекулярных щеток подтверждали методом спектроскопии ЯМР 1H (рис. 2). В спектре щетки-прекурсора ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА помимо сигналов ароматических протонов основной цепи в области 7–8 м.д. имеются сигналы при 1.4–1.5 мд, соответствующие протонам трет-бутильных групп; сигналы протонов OCH3-групп ПММА-блока (3.3–3.7 м.д.) и сигналы протонов метильных групп боковых цепей ПТБМА и линейного ПММА при 0.7–1.1 м.д. (рис. 2, спектр 1). В спектре продукта кислотного гидролиза (рис. 2, спектр 2) при сохранении сигналов ароматических протонов ПИ основной цепи блока B, сигналов протонов групп OCH3 блока ПММА и сигналов протонов метильных групп боковых цепей, практически отсутствуют сигналы протонов трет-бутильных групп при 1.4–1.5 м.д., но появляются сигналы протонов карбоксильных групп с δН = 12.2–12.5 м.д. Сигнал протонов воды в этом спектре уширен из-за обмена с карбоксильными группами полимера.
Рис. 2.
Спектры ЯМР 1Н блок-привитых молекулярных щеток-прекурсоров ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА (1) и амфифильных молекулярных щеток ПММА–блок–(ПИ–прив–ПМАК)–блок–ПММА (2).

В варианте двустадийной методики на первой стадии синтезировали линейные триблок-сополимеры ПММА–блок–ПИ–блок–ПММА. Для этого методом “клик”-химии CuAAC проводили прививку линейных блоков ПММА(N3) к концевым алкинильным группам гетерофункционального ПИИ:
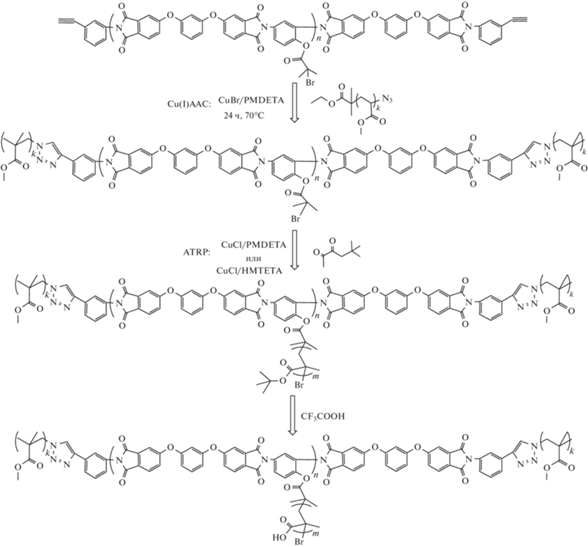
Успешное протекание реакции “клик”-химии, сохранение 2-бром-изобутиратных групп в звеньях полиимидного блока B подтверждали методом спектроскопии ЯМР 1H (рис. 3). На второй стадии способом “прививка от” на триблок-сополимере ПММА–блок–ПИ–блок–ПММА с 2-бром-изобутиратными группами в каждом звене полиимидного блока B как мультицентровом макроинициаторе проводили полимеризацию ТБМА методом ATRP. В качестве каталитического комплекса использовали Cu(I)Cl с азотсодержащими лигандами – PMDETA или HMTETA (табл. 2). В результате последующего кислотного гидролиза звеньев ТБМА боковых цепей под действием трифторуксусной кислоты в среде хлористого метилена получали щеточный блок B с гидрофильными звеньями ПМАК в боковых цепях. Методом спектроскопии ЯМР 1H контролировали протекание полимеризации ТБМА и полноту прохождения кислотного гидролиза сложноэфирных групп звеньев боковых цепей блока B (рис. 3).
Рис. 3.
Спектры ЯМР 1Н линейного триблок-сополимера ПММА–блок–ПИ–блок–ПММА (1), блок-привитых молекулярных щеток-прекурсоров ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА (2) и амфифильных блок-привитых молекулярных щеток ПММА–блок–(ПИ–прив–ПМАК)–блок–ПММА (3).

Таблица 2.
Экспериментальные условия синтеза и молекулярно-массовые характеристики блок-привитых щеток-прекурсоров ABA-типа ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА на гетерофункциональном ПИИ (Mn = 25.6 × 103, n = 39, Ð = 1.9)
| Образец, № | Способ синтеза | Условия синтеза | t, ч | T, °C | [M], % | Характеристики боковых цепей | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Блок A (ПММА) | Блок B (ПТБМА) | ||||||||||
| Mn × 10–3 | k | Ð | Mn × 10–3 | m | Ð | ||||||
| 1 | I | ПИИ : ПММА(N3) : CuCl : PMDETA : ТБМА = = 1.0 : 1.5 : 1.0 : 1.0 : 200 | 24 | 70 | 20 | 20.0 | 200 | 1.3 | 8.6 | 60 | 1.5 |
| 2 | II | Ин* : CuCl : PMDETA : ТБМА = 1 : 1 : 1 : 200 | 24 | 70 | 20 | 20.0 | 200 | 1.3 | 8.7 | 60 | 1.4 |
| 3 | II | Ин* : CuCl : HMTETA : ТБМА = 1 : 1 : 1 : 200 | 2 | 50 | 20 | 20.0 | 200 | 1.3 | 5.1 | 36 | 1.3 |
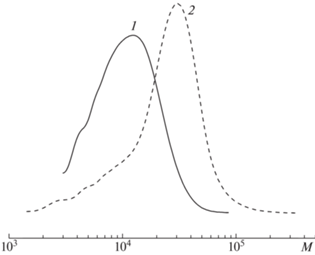
Для блок-привитых щеток-прекурсоров с боковыми цепями ПТБМА в щеточном блоке B методом ЭЖХ с использованием элюента ДМФА + 0.1 M LiBr были определены молекулярно-массовые характеристики (табл. 2). Использование двустадийной методики синтеза целевых блок-привитых щеток ABA-типа позволило охарактеризовать промежуточные полимерные продукты (рис. 4). Увеличение молекулярной массы при переходе от гетерофункционального ПИ макроинициатора к триблок-сополимеру ПММА–блок–ПИ–блок–ПММА свидетельствует об успешном протекании реакции CuAAC между линейным ПММА с азидными концевыми группами и алкинил-терминированным ПИИ.
Рис. 4.
Молекулярно-массовое распределение гетерофункционального полиимидного макроинициатора (1) и линейного триблок-сополимера ПММА–блок–ПИ–блок–ПММА (2).
Для характеристики синтезированных блок-привитых щеток ABA-типа ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА методом селективного щелочного гидролиза основной полимиидной цепи осуществляли выделение боковых цепей блока B и периферийных цепей блока A по разработанной ранее методике [31]. Методом ЭЖХ проведен анализ молекулярно-массовых характеристик выделенных цепей ПТБМА и ПММА (рис. 5). Установлено, что хроматограммы выделенных цепей при элюировании в растворителях разной природы отличаются. При использовании в качестве элюента ТГФ наблюдается один симметричный пик со среднечисленной молекулярной массой Mn = 6.4 × 103, который, по-видимому, относится к выделенным боковым цепям ПТБМА блока B. Хроматограмма образца выделенных цепей в ДМФА + 0.1 M LiBr также характеризуется мономодальностью с Mn = 20.0 × 103 и полностью совпадает с ММР линейных цепей ПММА, используемого в реакции CuAAC для прививки к алкинильным концевым группам гетерофункционального ПИИ. Наблюдаемый факт, по-видимому, связан с избирательным взаимодействием цепей ПТБМА и ПММА, выделенных из триблок-сополимеров ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА, с неподвижной фазой хроматографической колонки в элюентах разной природы.
Рис. 5.
Молекулярно-массовое распределение выделенных боковых цепей блока B и периферийных цепей блока A из блок-привитых молекулярных щеток ПММА–блок–(ПИ–прив–ПТБМА)–блок–ПММА при использовании элюента ТГФ (1) и ДМФА + 0.1 M LiBr (2) (табл. 2, образец 1).

ЗАКЛЮЧЕНИЕ
Разработана методика синтеза гетерофункциональных полиимидных макроинициаторов, содержащих α-бромэфирные группы в каждом повторяющемся звене и алкинильные группы в концевых звеньях. С использованием таких макроинициаторов путем сочетания методов ATRP и Cu(I)-катализируемого циклоприсоединения азидов и алкинов синтезированы четко определенные амфифильные блок-привитые молекулярные щетки типа ABA с центральным блоком B − молекулярной щеткой с полиимидной основной цепью и боковыми цепями полиметакриловой кислоты и A – периферийными цепями полиметилметакрилата.
Показана перспективность и эффективность использования комбинации методов контролируемой радикальной полимеризации с реакциями “клик”-химии. Полученные результаты открывают возможности для направленного синтеза сополимеров сложной архитектуры с заданными характеристиками и функциональностью, в том числе имеющие в своей структуре несовместимые блоки.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 20-13-00270).
Список литературы
Sheiko S.S., Sumerlin B.S., Matyjaszewski K. // Prog. Polym. Sci. 2008. V. 33. № 7. P. 759.
Müllner M., Müller A.H.E. // Polymer. 2016. V. 98. P. 389.
Matyjaszewski K., Tsarevsky N.V. // Nat. Chem. 2009. V. 1. P. 276.
Rzayev J. // ACS Macro Lett. 2012. V. 1. № 9. P. 1146.
Fenyves R., Schmutz M., Horner I.J., Bright F.V., Rzayev J. // J. Am. Chem. Soc. 2014. V. 136. № 21. P. 7762.
Verduzco R., Li X., Pesek S.L., Stein G.E. // Chem. Soc. Rev. 2015. V. 44. P. 2405.
Pelras T., Mahon C.S., Müllner M. // Angew. Chem., Int. Ed. 2018. V. 57. № 24. P. 6982.
Ivanov I.V., Meleshko T.K., Kashina A.V., Yakimansky A.V. // Russ. Chem. Rev. 2019. V. 88. № 12. P. 1248.
Teulère C., Ben-Osman C., Barry C., Nicolaÿ R. // Eur. Polym. J. 2020. V. 141. P. 110080.
Garcia E.A., Luo H.Y., Mack C.E., Herrera-Alonso M. // Soft Matter. 2020. V. 16. P. 8871.
Zhao B. // J. Phys. Chem. B. 2021. V. 125. № 24. P. 6373.
Ma H., Kim K.T. // Macromolecules. 2020. V. 53. № 2. P. 711.
Xu B., Qian H., Lin S. // ACS Macro Lett. 2020. V. 9. № 3. P. 404.
Chen K., Hu X., Zhu N., Guo K. // Macromol. Rapid Commun. 2020. V. 41. № 20. P. 2000357.
Müllner M. // Macromol. Chem. Phys. 2016. V. 217. № 20. P. 2209.
Xie G., Martinez M.R., Olszewski M., Sheiko S.S., Matyjaszewski K. // Biomacromolecules. 2019. V. 20. № 1. P. 27.
Feng C., Huang X. // Acc. Chem. Res. 2018. V. 51. № 9. P. 2314.
Li Z., Tang M., Liang S., Zhang M., Biesold G.M., He Y., Hao S.-M., Choi W., Liu Y., Peng J., Lin Z. // Prog. Polym. Sci. 2021. V. 116. P. 101387.
Xu B., Feng C., Huang X. // Nat. Commun. 2017. V. 8. P. 333.
Chen Y., Sun Z., Li H., Dai Y., Hu Z., Huang H., Shi Y., Li Y., Chen Y. // ACS Macro Lett. 2019. V. 8. № 6. P. 749.
Hobbs C.E., Vasireddy M. // Macromol. Chem. Phys. 2019. V. 220. № 7. P. 1800497.
Steinhaus A., Pelras T., Chakroun R., Gröschel A.H., Müllner M. // Macromol. Rapid Commun. 2018. V. 39. № 19. P. 1800177.
Han D., Tong X., Zhao Y. // Macromolecules. 2011. V. 44. № 13. P. 5531.
Wang Y., Ren R., Ling J., Sun W., Shen Z. // Polymer. 2018. V. 138. P. 378.
Luo H., Raciti D., Wang C., Herrera-Alonso M. // Mol. Pharm. 2016. V. 13. № 6. P. 1855.
Meleshko T.K., Ivanov I.V., Kashina A.V., Bogorad N.N., Simonova M.A., Zakharova N.V., Filippov A.P., Yaki-mansky A.V. // Polymer Science B. 2018. V. 60. № 1. P. 35.
Simonova M., Ivanov I., Meleshko T., Kopyshev A., Santer S., Yakimansky A., Filippov A. // Polymers. 2020. V. 12. № 12. P. 2922.
Neumann S., Biewend M., Rana, S., Binder W.H. // Macromol. Rapid Commun. 2020. V. 41. № 1. P. 1900359.
Matyjaszewski K. // Macromolecules. 2012. V. 45. № 10. P. 4015.
Meleshko T.K., Il’gach D.M., Bogorad N.N., Kukarkina N.V., Yakimansky A.V. // Polymer Science B. 2014. V. 56. № 2. P. 118.
Yakimansky A.V., Meleshko T.K., Ilgach D.M., Bauman M.A., Anan’eva T.D., Klapshina L.G., Lermontova S.A., Balalaeva I.V., Douglas W.E. // J. Polym. Sci., Polym. Chem. 2013. V. 51. № 20. P. 4267.
Meleshko T.K., Il’gach D.M., Bogorad N.N., Kukarkina N.V., Vlasova E.N., Dobrodumov A.V., Malakhova I.I., Gorshkov N.I., Krasikov V.D., Yakimanskii A.V. // Polymer Science B. 2010. V. 52. № 9–10. P. 589.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)


