Высокомолекулярные соединения (серия С), 2022, T. 64, № 2, стр. 106-120
ФЕРРОЦЕНИЛСОДЕРЖАЩИЕ ОЛИГО- И ПОЛИСИЛОКСАНЫ: СИНТЕЗ, СВОЙСТВА, ПРИМЕНЕНИЕ
К. В. Дерябин a, Р. М. Исламова a, *
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: r.islamova@spbu.ru
Поступила в редакцию 05.04.2022
После доработки 23.05.2022
Принята к публикации 27.06.2022
- EDN: WRJZRB
- DOI: 10.31857/S2308114722700091
Аннотация
Обзор направлен на систематизацию и анализ способов получения ферроценилсодержащих олиго- и (со)полисилоксанов, а также возможных областей применения данных соединений. Рассмотрены различные способы введения ферроценильного фрагмента в структуры олиго- и (со)полисилоксанов. Продемонстрированы методы синтеза ферроценилсодержащих олиго-, цикло-, силсесквио- и (со)полисилоксанов с использованием реакций каталитического гидросилирования, дегидросочетания, азид-алкинового циклоприсоединения, гидротиолирования, а также поликонденсации и полимеризации с раскрытием цикла. Показано, что ферроценилсодержащие олиго- и (со)полисилоксаны обладают редокс-свойствами и представляют интерес для молекулярной электроники, химической модификации электродов, для создания электрохимических сенсоров, материалов для рассеивания заряда и нейрональных имплантатов. Олиго- и (со)полисилоксаны с хиральными ферроценильными заместителями могут быть использованы для асимметрического катализа и получения на их основе жидких кристаллов для нелинейных оптических систем.
ВВЕДЕНИЕ
Полисилоксаны – это элементорганические полимеры, основная цепь которых состоит из чередующихся атомов кремния и кислорода, с присоединенными к каждому атому кремния боковыми органическими заместителями (–R2SiO–)n [1, 2]. Полисилоксаны являются одними из наиболее гибких, биоинертных, термо-, морозо- и атмосферостойких полимеров с высокой газопроницаемостью и электроизоляционными свойствами, что определяет их широкое применение в машино-, авиа- и судостроении, строительстве, биомедицине, электротехнике и пищевой промышленности [1–6]. Наряду с наиболее распространенными полисилоксанами (в которых R = CH3, H, CH2=CH2, Ph, CH2CH2CF3 и т.д.) [1–10], за последние 30 лет были получены различные функциональные (со)полисилоксаны и материалы на их основе [11–37 ]. Функционализированные силиконовые материалы обладают рядом новых свойств при сохранении ключевой характеристики – гибкости, что существенно расширяет их возможные области применения. В частности, были получены электроактивные [12–17], самовосстанавливающиеся [11, 12, 29–34], сольватохромные [18, 30, 32], люминесцентные [34–37], жидкокристаллические [25] и другие силиконовые материалы.
В связи с возросшим спросом на электроактивные полисилоксаны для мягкой робототехники и нейрохирургии [13, 14] в последние десятилетия особое практическое значение приобретает разработка направленных методов получения олиго- и (со)полисилоксанов, содержащих электроактивные центры в своей структуре.
В качестве электроактивных (редокс-активных) центров в (со)полисилоксанах используются циклопентадиенильные карбонильные комплексы железа (например, [(η5-C5R4)Fe(CO)(μ-CO)]2, R = H, CH3) [38], катионы кобальтоцения [19], боковые (η6-арил)трикарбонилхромные [20] и ферроценильные заместители [13, 14, 17]. Кроме того, известны некоторые электроактивные металлополимерные комплексы на основе сополисилоксанов и соединений переходных или редкоземельных металлов [11, 12, 15, 29, 30, 34].
Среди изученных редокс-активных центров ферроцен является одним из наиболее предпочтительных вследствие своей высокой химической и термической стабильности, а также доступности и относительно низкой стоимости по сравнению с другими металлоценами и металлорганическими соединениями [39–41].
В литературе представлены различные ферроценилсодержащие олиго- и полисилоксаны, сочетающие в себе редокс-активность, высокую термоокислительную стабильность и повышенную атмосферостойкость [20–28, 42–54]. Они могут быть использованы в химической модификации электродов и молекулярной электронике при создании электрохимических сенсоров и материалов для рассеивания заряда (защита от ионизирующего излучения). Если в ферроценильных фрагментах в полисилоксанах имеются хиральные заместители, то на их основе можно создавать жидкие кристаллы для нелинейных оптических систем. Эта же особенность позволяет применять данные соединения и для асимметрического катализа [21–23].
Высокая липофильность, противоопухолевая и противомалярийная активность ферроцена и его производных дает возможность рассматривать ферроценилсодержащие полисилоксаны как перспективные объекты для биомедицины [2, 26, 55].
Таким образом, цель настоящего обзора – систематизация и анализ способов получения ферроценилсодержащих олиго- и (со)полисилоксанов, а также рассмотрение потенциальных областей применения указанных полимеров.
СПОСОБЫ ВВЕДЕНИЯ ФЕРРОЦЕНИЛЬНЫХ ФРАГМЕНТОВ В ОЛИГО- И (СО)ПОЛИСИЛОКСАНЫ
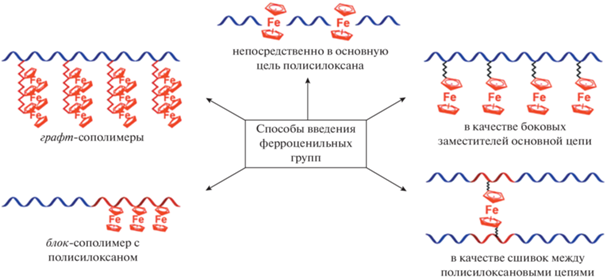
Добиться редокс-активности и антистатических свойств возможно введением ферроценильных фрагментов либо в основную цепь олиго- или полисилоксана, либо в качестве боковых заместителей. Существует несколько подходов (рис. 1) [1, 56].
1. По реакции поликонденсации между бифункциональным редокс-активным центром и α,ω-функциональным полидиметилсилоксаном. В этом случае образуется сополимер, в котором электроактивные центры находятся непосредственно в основной цепи полимера [1, 56].
2. Введением боковых ферроценильных групп с помощью органических реакций, таких как каталитическое гидросилилирование [20–25, 42–49, 57, 58], дегидросочетание [42], азид-алкиновое циклоприсоединение [45] или гидротиолирование [26].
3. В качестве сшивок между полисилоксановыми цепями по реакции гидросилилирования [21, 22].
4. С помощью “живой” анионной сополимеризации циклических олигосилоксанов и винилферроцена, либо с помощью привитой сополимеризации ферроценофанов методом “прививки от”, что приводит к образованию блок- и графт-сополимеров, соответственно [1, 2, 54, 56, 59].
ФЕРРОЦЕНИЛСОДЕРЖАЩИЕ ЦИКЛИЧЕСКИЕ ОЛИГОСИЛОКСАНЫ И СИЛСЕСКВИОКСАНЫ
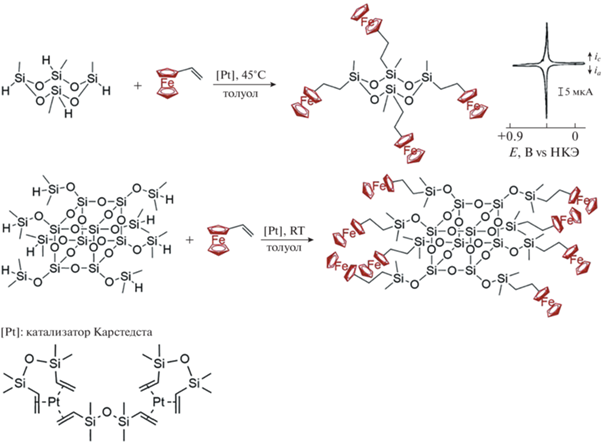
В 1993–1995 гг. M. Moran и C.M. Casado впервые синтезировали ферроценилсодержащие циклический олигосилоксан [22] и силсесквиоксан [21] по реакции каталитического гидросилилирования между винилферроценом и 1,3,5,7‑тетраметилциклотетрасилоксаном и гидридсодержащим силсесквиоксаном с использованием катализатора Карстедта (комплекс платины(0) и дивинилтетраметилдисилоксана) (рис. 2). Редокс-активность продуктов была подтверждена циклической вольтамперометрией (ЦВА), где использовали модифицированные платиновые электроды, покрытые ферроценилсодержащими циклическими олигосилоксанами и силсесквиоксанами [21, 22].
В 2001 г. B. Alonso с сотрудниками [23] применили те же реакции каталитического гидросилилирования с целью получения более сложных ферроценилсодержащих олигосилоксановых структур, представляющих собой циклические олигомеры и дендримеры с бисферроценилсилильными фрагментами при атомах кремния (рис. 3). Кривые ЦВА растворов таких производных олигосилоксанов показали два обратимых, зависимых друг от друга окислительно-восстановительных процесса при 0.4–0.60 В. Авторы отмечают [23], что соединения становятся нерастворимыми после полного окисления до соответствующих поликатионных частиц, образуя редокс-активные пленки на платиновых и стеклоуглеродных поверхностях электродов.
Рис. 3.
Схема синтеза бисферроценилсодержащих дисилоксана и циклотетрасилоксана, а также ЦВА для бисферроценилсодержащих дисилоксана и циклотетрасилоксана [23].

M. Herrero с соавторами [44] в 2012 г. впервые получили редокс-активные ферроценилсодержащие дендримеры посредством реакции каталитического “обратного” гидросилилирования. В отличие от упомянутого выше метода гидросилилирования здесь использовали бис(ферроценил)метилсилан вместо винилферроцена и винилсодержащие силсесквиоксаны вместо Si–H-содержащих силсесквиоксанов:

P. Boudjouk с сотрудниками. [42] смогли присоединить ферроценильные фрагменты к циклическим и линейным олигосилоксанам посредством реакции каталитического дегидросочетания Si–O с использованием катализатора Уилкинсона [(PPh3)3RhCl].
Реакцию гидросилилирования гетерометаллического соединения Co2(CO)6(μ,η2‑HCCFc) и гидросилоксанов в 2012 г. провели C. Blasco с соавторами [43]. Электрохимическое поведение в растворе продуктов показало, что все винилферроценильные звенья, присутствующие в молекулах, электрохимически независимы. Как и в предыдущем случае [23], ферроценилсодержащие олигосилоксаны становятся нерастворимыми после полного окисления до соответствующих поликатионных частиц, образуя редокс-активные пленки на платиновых электродах.

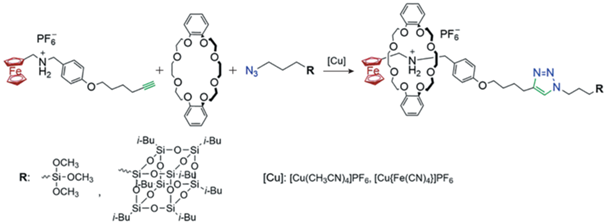
Спустя год G. Yu с соавторами [45] впервые реализовали присоединение ферроцена к олигосилоксанам путем реакции азид-алкинового циклоприсоединения. Реакцию проводили в присутствии дибензо [24]краун-8-эфира и катализаторов [Cu(CH3CN)4]PF6 или [Cu{Fe(CN)4}]PF6 с образованием ротаксанов, содержащих диалкиламмониевый фрагмент с объемной терминальной силильной группой:
Таким образом, рассмотренные ферроценилсодержащие циклические олигосилоксаны и силсесквиоксаны, представляющие собой жидкие смолообразные соединения, обладают редокс-свойствами. Однако их применение в качестве материалов для мягкой робототехники, электротехники и электроники существенно ограничено ввиду крайне низкой молекулярной массы и плохих пленкообразующих свойств.
ФЕРРОЦЕНИЛСОДЕРЖАЩИЕ (СО)ПОЛИСИЛОКСАНЫ
Согласно литературным данным [20–28, 39, 42–50, 57, 58], в линейных (со)полисилоксанах ферроценовый фрагмент может выступать как в роли боковой группы, так и в качестве фрагмента основной цепи – ферроценсодержащие полиамиды и сложные полиэфиры. Во втором случае ферроценовые фрагменты в основной цепи могут способствовать значительному улучшению термостабильности сополимера. Если у ферроценилсодержащего фрагмента в макромолекуле есть плоские хиральные заместители, то сополимер может найти применение и для создания жидких кристаллов. Многообразие жидкокристаллических полимеров обеспечивается варьированием линкеров и форм замещения в ферроценильном фрагменте [39].

Сополимеры с ферроценилсодержащими боковыми заместителями
Синтез ферроценилсодержащих сополисилоксанов преимущественно проводят с помощью полимераналогичных превращений, а именно химической модификацией полисилоксанов винилферроценом или 1‑ферроценилметанолом. Однако для успешного получения продуктов необходимо использовать заранее функционализированный полисилоксан, например, полиметилгидросилоксан (ПМГС) или поли[(3-меркапто-пропил)метилсилоксан] (ПММС).
Согласно данному подходу, в 1989 г. T. Inagaki с сотрудниками [24] впервые синтезировали ферроценилсодержащие сополисилоксаны посредством реакции каталитического гидросилилирования между ПМГС или гидридсодержащим ПДМС и винилзамещенными ферроценами с использованием катализатора Спайера (H2PtCl6 · 6H2O).

В работе [21] было отмечено, что применение катализатора Спайера не является эффективным для гидросилилирования винилферроцена. Было предложено использовать более активный катализатор Карстедта (рис. 2) для синтеза ферроценилсодержащих соединений. В работах [57, 58] катализаторами служили растворимые в реакционной смеси платиновые нанокластеры, полученные из координационного соединения [(cod)Pt(CH3)2] (cod: циклоокта-1,5-диен). Преимуществом последних является относительно легкая очистка полимерных продуктов реакции от остатков катализатора.
Согласно работам [57, 58], возможно два варианта присоединения винилферроцена к гидридсодержащим полисилоксанам: α (по правилу Марковникова) и β (против правила Марковникова). Последний оказался на 98% предпочтительным, т.е. реакция гидросилилирования винилферроцена идет почти полностью против правила Марковникова:

Реакция каталитического гидросилилирования оказалась настолько эффективной и востребованной, что с ее помощью были получены более сложные структуры, включающие ферроценильные и трикарбонилхромные фрагменты [20], а также жидкокристаллические ферроценилсодержащие сополисилоксаны с плоскими хиральными заместителями при ферроцене [25, 46]. Как следует из литературных источников [24, 47], все линейные ферроценилсодержащие сополисилоксаны обладают редокс-свойствами, схожими с аналогичными циклоолигосилоксанами и силсесквиоксанами.

В 1995 г. C.M. Casado и его коллеги [48] предложили уникальный способ модификации полисилоксановых цепей с привлечением реакции ацилирования. В первом случае в качестве ацилирующего агента выступал предварительно модифицированный полисилоксан, содержащий хлорангидридные группы в каждом звене, а во втором – хлоркарбонилферроцен. Однако данный способ имеет ряд существенных недостатков по сравнению с каталитическим гидросилилированием, а именно трудоемкость, многостадийность, образование побочных продуктов (HCl и его аддукты):
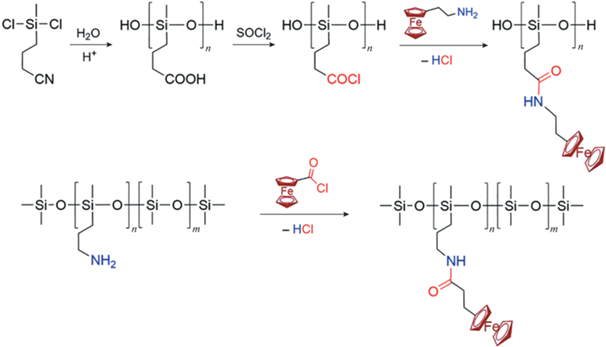
Как и в случае с олигосилоксанами, для введения ферроцена в качестве бокового заместителя силоксановой цепи можно применять дегидросочетание 1‑ферроценилметанола и его производных с ПМГС, катализируемое комплексами металлов платиновой группы [42]. В качестве катализатора наиболее эффективным с точки зрения выхода и селективности среди прочих (катализаторы Карстедта, Спайера, Co2(CO)8 и т.д.) оказался катализатор Уилкинсона [(PPh3)3RhCl]:

Еще одним способом введения ферроцена в качестве боковых заместителей являются реакции клик-химии: азид-алкиновое циклоприсоединение [45] и гидротиолирование [26]. В первом случае использовали алкинил-функционализированный ферроцен и предварительно модифицированный полисилоксан, в котором содержались боковые азидные группы, а в качестве катализатора – [Cu(Fe(CN)4)]PF6 [45]:

Во втором случае проводили радикальное присоединение меркапто-групп ПММС к двойной связи C=C винилферроцена. Реакции инициировали либо термически с использованием ДАК в качестве источника свободных радикалов, либо облучением ультрафиолетовым излучением в присутствии фотоинициатора (2,2-диметокси-2-фенилацетофенона). Таким образом, гидротиолирование – свободнорадикальный процесс, который идет против правила Марковникова и механизм которого существенно отличается от каталитического гидро-силилирования и окислительного сочетания [26].

Между тем, реакции клик-химии имеют ряд таких недостатков, как использование токсичных реагентов (азид натрия и ПММС), многостадийность синтеза и образование побочных продуктов, в частности циклических олигосилоксанов при гидротиолировании [26].
Согласно работам [26, 45], сополимеры, полученные в результате реакций клик-химии, редокс-активны и более стабильны к термоокислению [26] по сравнению с аналогами, не содержащими ферроценильные группы в своей структуре. Увеличение термостабильности при введении ферроцена аналогично описанным ранее эффектам повышения термостойкости полисилоксанов при добавлении в них соединений железа (оксидов железа(III), некоторых хлоридов железа, оксалатов железа и других солей) [60].
Сополисилоксаны с ферроценом в основной цепи
Ввести ферроцен в основную полисилоксановую цепь возможно либо поликонденсацией между α,ω-функционализированными олигосилоксанами и бифункциональным ферроценом, либо сополимеризацией ферроценофанов и олигосилоксанов с раскрытием цикла [39].
В 2006 г. M. Cazacu с сотрудниками [27, 28] провели синтез полисилиловых эфиров и амидов путем поликонденсации гидрокси- или амино-терминированных олигосилоксанов и 1,1'-ди(хлоркарбонил)ферроцена. Авторы [27, 28] выявили, что данные реакции обладают недостатками, типичными для поликонденсации (побочное образование циклических структур и избыток одного из бифункциональных мономеров), а продукты очень нестойки к гидролизу из-за наличия в основной цепи силиловых сложноэфирных групп [27]. В работе [27] была продемонстрирована возможность регулирования редокс-поведения и термостабильности полученных сополимеров путем изменения структуры исходного бифункционального полисилоксана.

Для поликонденсации можно использовать и диаминопроизводные ферроцена вместо 1,1'-ди(хлоркарбонил)ферроцена и дисиланолы вместо амино-терминированных олигосилоксанов, что было продемонстрировано в работе [51]:

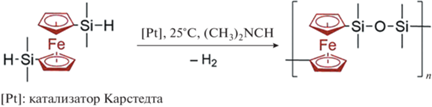
В 2009 г. D. Miles с соавторами [52] использовали иную реакцию – каталитическое дегидросочетание для синтеза полиферроценилдисилоксана. В качестве исходного реагента поликонденсации использовали только 1,1'‑бис-(диметилсилил)ферроцен. При этом сополисилоксан образовывался посредством автоокисления связей Si–Si.
Блок- и графт-сополисилоксаны с ферроценовыми фрагментами
Блок-сополимеры – полиферроценилсилан-со-полидиметилсилоксаны были впервые синтезированы в 1994 г. R. Rulkens с соавторами [53] с помощью анионной сополимеризации ферроценофана и циклических олигосилоксанов:

В работе [54] был усовершенствован метод синтеза осуществлением полимеризации ферроценофана на Si–H-содержащем олигосилоксановом макроинициаторе под действием Pt(0,II) катализатора при повышенной температуре с образованием триблок-сополимера:
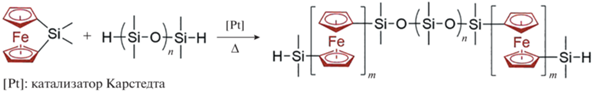
Кроме того, ферроценофан был заполимеризован методом “прививки от” на Si–H-содержащих макроинициаторах, представляющих собой ПМГС-со-ПДМС или циклический 1,3,5,7‑тетраметилциклотетрасилоксан [54]:

Сшитые сополисилоксаны с ферроценовыми фрагментами
Наряду с получением ферроценсодержащих сополисилоксанов, представляющих собой вязкие смолоподобные соединения, крайне важна разработка методов их сшивки. Сшитые ферроценсодержащие силиконовые материалы можно использовать для создания защитных антистатических покрытий, гибких электродов для оптоэлектроники, гибких электрохромных дисплеев и т.д.
Известны примеры [21, 22] использования дивинилферроцена (вместо винилферроцена) в реакции каталитического гидросилилирования с циклическими олигосилоксанами, которые позволили получить сшитые редокс-активные продукты. С помощью данных структур были получены нанокомпозиты с наночастицами золота с целью создания биосенсоров на их основе [49]. Предположительно из-за высокой степени сшивки такие сополимеры мало перспективны для гибкой электроники.

Аналогичным образом в работе [50] получены наночастицы сополисилоксана по реакции поликонденсации бифункционального ферроцена:
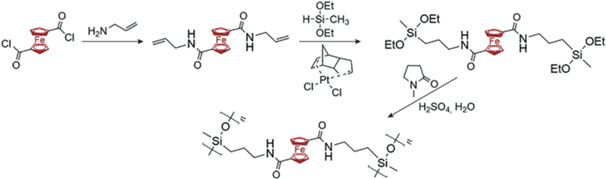
В 2019 г. реализован новый подход к получению сшитых ферроценилсодержащих силиконовых резин [13]. На первой стадии были синтезированы поли(метил(2-ферроценилэтил)силоксан-со-метил-гидросилоксан)ы (ПФМГС) по реакции каталитического гидросилилирования между ПМГС и винилферроценом в присутствии катализатора Карстедта или цис-[PtCl2(PhCH2CN)2]. Мольное соотношение гидридных групп (от ПМГС) и винилферроцена было выбрано 2 : 1, чтобы содержание ферроценилсодержащих звеньев в сополимере составляло 50 мол. %. На второй стадии была проведена “самосшивка” ПФМГС по оставшимся непрореагировавшим гидридным группам при комнатной температуре в течение 24 ч с последующей сушкой отвержденного полимера при 80°С в течение 3 ч на подложке.
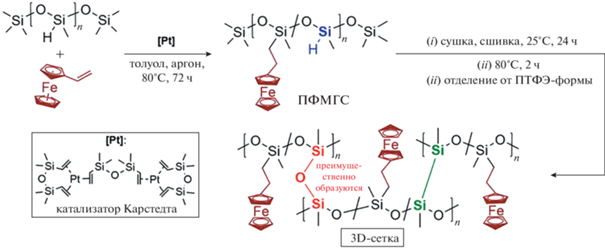
Возможный механизм “самосшивки” был установлен по модельной реакции с ПМГС [61] и соответствовал двум последовательным реакциям дегидросочетания Si–H-групп и автоокисления связей Si–Si.

Полученные коричневые ферроценилсодержащие силиконовые резины оказались нелипкими, гибкими образцами высокого качества (рис. 4).
Было отмечено [13], что сшитые ферроценилсодержащие полиметилгидросилоксаны обладают электропроводностью на уровне антистатических материалов [62–65] (1.5 × 10–10 См см–1, ниже границы удельного сопротивления полупроводников (108–1010 Ω см) [66, 67]). Установлено, что ПФМГС имеет электронный прыжковый или туннельный характер проводимости аналогично механизму проводимости в поливинилферроцене и в других ферроценилсодержащих полимерах [68–70].
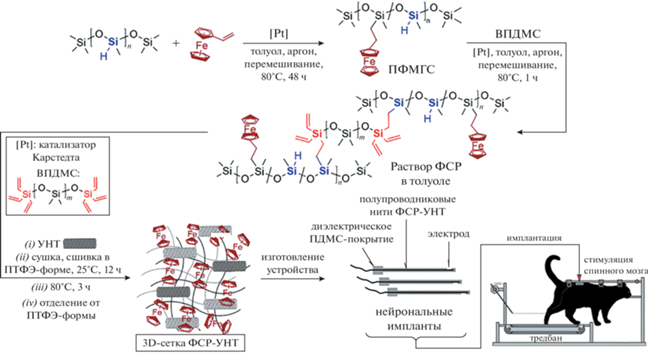
В 2020−2022 гг. был разработан [14] синтетический подход, включающий реакции гидросилилирования, для получения нанокомпозитов на основе ферроценилсодержащей силиконовой резины (ФСР) и многослойных углеродных нанотрубок (УНТ) (рис. 5). Было показано, что введение ферроценильных фрагментов в полисилоксан способствует достижению высокой емкости инжекции заряда при той же площади электрода, а также использованию более широкого электроактивного диапазона (или “электрохимического окна”) нанокомпозитного электрода на основе ФСР−УНТ (от –1.9 до +2.0 В) по сравнению с модельным ПДМС−УНТ (от –1.1 до +1.3 В). Полученные нанокомпозиты ФСР−УНТ имеют достаточное удлинение при разрыве ∼80%, предел прочности при растяжении (2.4 МПа), а также электропроводность, сравнимую с полупроводниковой (7 × 10–5 См см–1). Было обнаружено, что ФСР−УНТ заметно снижает концентрацию культивируемых клеток нейробластомы. Все эти свойства позволили создать на основе ФСР−УНТ прототипы нейрональных имплантатов, которые способствуют уменьшению риска повреждения нервных тканей при электростимуляции и потенциально могут быть использованы для лечения онкологических заболеваний [14].
Работа выполнена при финансовой поддержке Санкт-Петербургского государственного университета (проект 94385659).
Список литературы
Ullmann’s Encyclopedia of Industrial Chemistry / Ed. by H.-H.,Moretto M. Schulze, G.Wagner. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2000.
The Polysiloxanes / Ed. by J.E. Mark, D.W. Schaefer, G. Lin. Oxford: Oxford Univ. Press, 2015.
Islamova R., Dobrynin M., Ivanov D., Vlasov A., Kaganova E., Grigoryan G., Kukushkin V. // Molecules. 2016. V. 21. P. 311.
Islamova R.M., Dobrynin M.V., Vlasov A.V., Eremina A.A., Kinzhalov M.A., Kolesnikov I.E., Zolotarev A.A., Masloborodova E.A., Luzyanin K.V. // Catal. Sci. Technol. 2017. V. 7. № 24. P. 5843.
Dobrynin M.V., Pretorius C., Kama D.V., Roodt A., Boyarskiy V.P., Islamova R.M. // J. Catal. 2019. V. 372. P. 193.
Deriabin K.V., Yaremenko I.A., Chislov M.V., Fleury F., Terent’ev A.O., Islamova R.M. // New J. Chem. 2018. V. 42. № 18. P. 15006.
Islamova R.M., Vlasov A.V., Dobrynin M.V., Masloborodova E.A., Kaganova E.V. // Russ. J. Gen. Chem. 2015. V. 85. № 11. P. 2609.
Demakova M.Ya., Bolotin D.S., Bokach N.A., Islamova R.M., Starova G.L., Kukushkin V.Yu. // ChemPlusChem. 2015. V. 80. № 11. P. 1607.
Talianov P.M., Rzhevskii S.S., Pankin D.V., Deriabin K.V., Islamova R.M., Manshina A.A. // J. Polym. Res. 2021. V. 28. № 2. P. 37.
Добрынин М.В., Касаткина С.О., Байков С.В., Савко П.Ю., Антонов Н.С., Михердов А.С., Боярский В.П., Исламова Р.М. // Журн. общ. химии. 2022. Т. 92. № 1. С. 121.
Utrera-Barrios S., Verdejo R., López-Manchado M.A., Hernández Santana M. // Mater. Horiz. 2020. V. 7. № 11. P. 2882.
Li C.-H., Wang C., Keplinger C., Zuo J.-L., Jin L., Sun Y., Zheng, P.; Cao Y., Lissel F., Linder C., You X.-Z., Bao Z. // Nat. Chem. 2016. V. 8. № 6. P. 618.
Deriabin K.V., Lobanovskaia E.K., Kirichenko S.O., Barshutina M.N., Musienko P.E., Islamova R.M. // Appl. Organomet. Chem. 2020. V. 34. P. e5300.
Deriabin K.V., Kirichenko S.O., Lopachev A.V., Sysoev Y., Musienko P.E., Islamova R.M. // Compos. B. Eng. 2022. V. 236. P. 109838.
Williams Z.H., Burwell E.D., Chiomento A.E., Demsko K.J., Pawlik J.T., Harris S.O., Yarolimek M.R., Whitney M.B., Hambourger M., Schwab A.D. // Soft Matter. 2017. V. 13. № 37. P. 6542.
Miroshnichenko A.S., Deriabin K.V., Baeva M., Kochetkov F.M., Neplokh V., Fedorov V.V., Mozharov A.M., Koval O.Yu., Krasnikov D.V., Sharov V.A., Filatov N.A., Gets D.S., Nasibulin A.G., Makarov S.V., Mukhin I.S., Kukushkin V.Yu., Islamova R.M. //. J. Phys. Chem. Lett. 2021. V. 12. № 39. P. 9672.
Neplokh V., Kochetkov F.M., Deriabin K.V., Fedorov V.V., Bolshakov A.D., Eliseev I.E., Mikhailovskii V.Yu., Ilatovskii D.A., Krasnikov D.V., Tchernycheva M., Cirlin G.E., Nasibulin A.G., Mukhin I.S., Islamova R.M. // J. Mater. Chem. C. 2020. V. 8. № 11. P. 3764.
Jia X.-Y., Mei J.-F., Lai J.-C., Li C.-H., You X.-Z. // Chem. Commun. 2015. V. 51. № 43. P. 8928.
Cuadrado I., Casado C.M., Lobete F., Alonso B., González B., Losada J., Amador U. // Organometallics. 1999. V. 18. P. 4960.
Zamora M., Bruna S., Alonso B., Cuadrado I. // Macromolecules. 2011. V. 44. P. 7994.
Moran M., Casado C.M., Cuadrado I., Losada J. // Organometallics. 1993. V. 12. № 11. P. 4327.
Casado C.M., Cuadrado I., Moran M., Alonso B., Lobete F., Losada J. // Organometallics. 1995. V. 14. № 6. P. 2618.
Alonso B., González B., García B., Ramírez-Oliva E., Zamora M., Casado C.M., Cuadrado I. // J. Organomet. Chem. 2001. V. 637–639. № 3. P. 642.
Inagaki T., Lee H.S., Skotheim T.A., Okamoto Y. // J. Chem. Soc. Chem. Commun. 1989. V. 16. P. 1181.
Brettar J., Bürgi T., Donnio B., Guillon D., Klappert R., Scharf T., Deschenaux R. // Adv. Funct. Mater. 2006. V. 16. № 2. P. 260.
Martínez-Montero I., Bruña S., González-Vadillo A.M., Cuadrado I. // Macromolecules. 2014. V. 47. № 4. P. 1301.
Cazacu M., Munteanu G., Racles C., Vlad A., Marcu M. // J. Organomet. Chem. 2006. V. 691. № 17. P. 3700.
Cazacu M., Vlad A., Marcu M., Racles C., Airinei A., Munteanu G. // Macromolecules 2006. V. 39. № 11. P. 3786.
Deriabin K.V., Ignatova N.A., Kirichenko S.O., Novikov A.S., Islamova R.M. // Polymer. 2021. V. 212. P. 123119.
Deriabin K.V., Ignatova N.A., Kirichenko S.O., Novikov A.S., Kryukova M.A., Kukushkin V.Yu., Islamova R.M. // Organometallics. 2021. V. 40. № 15. V. 2750.
Mei J., Jia X., Lai J., Sun Y., Li C., Wu J., Cao Y., You X., Bao Z. // Macromol. Rapid. Commun. 2016. V. 37. № 20. P. 1667.
Liu L., Liang S., Huang Y., Hu C., Yang J. // Chem. Commun. 2017. V. 53. № 89. P. 12088.
Lai J.-C., Li L., Wang D.-P., Zhang M.-H., Mo S.-R., Wang X., Zeng K.-Y., Li C.-H., Jiang Q., You X.-Z., Zuo J.-L. // Nat. Commun. 2018. V. 9. № 1. P. 2725.
Miroshnichenko A.S., Deriabin K.V., Baranov A.I., Neplokh V., Mitin D.M., Kolesnikov I.E., Dobrynin M.V., Parshina E.K., Mukhin I.S., Islamova R.M. // ACS Appl. Polym. Mater. 2022. V. 4. № 4. P. 2683.
Dobrynin M.V., Sokolova E.V., Kinzhalov M.A., Smirnov A.S., Starova G.L., Kukushkin V.Yu., Islamo-va R.M. // ACS Appl. Polym. Mater. 2021. V. 3. № 2. P. 857.
Dobrynin M.V., Kasatkina S.O., Baykov S.V., Savko P.Y., Antonov N.S., Mikherdov A.S., Boyarskiy V.P., Islamova R.M. // Dalton. Trans. 2021. V. 50. № 42. P. 14994.
Baranovskii E.M., Khistiaeva V.V., Deriabin K.V., Petrovskii S.K., Koshevoy I.O., Kolesnikov I.E., Grachova E.V., Islamova R.M. // Molecules. 2021. V. 26. № 22. P. 6866.
Moran M., Pascual M.C., Cuadrado I., Losada J. // Organometallics. 1993. V. 12. № 3. P. 811.
Ferrocenes: Homogeneous Catalysis, Organic Synthesis, Materials Science. 1st ed. / Ed. by A.Togni, T.Hayashi. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 1995.
Исламова Р.М. // Журн. общ. химии. 2016. Т. 86. № 1. С. 133.
Исламова Р.М., Ярмухамедова Э.И. // Журн. общ. химии. 2014. Т. 84. № 12. С. 2056.
Boudjouk P., AL-Badri Z.M.H., Chauhan B.P.S. // J. Organomet. Chem. 2004. V. 689. № 21. P. 3468.
Blasco C., Bruña S., Cuadrado I., Delgado E., Hernández E. // Organometallics. 2012. V. 31. № 7. P. 2715.
Herrero M., Alonso B., Losada J., García-Armada P., Casado C.M. // Organometallics. 2012. V. 31. № 17. P. 6344.
Yu G., Suzaki Y., Abe T., Osakada K. // Dalton Trans. 2013. V. 42. № 5. P. 1476.
Kadkin O.N., Galyametdinov Y.G. // Russ. Chem. Rev. 2012. V. 81. № 8. P. 675.
Ikeda S., Oyama N. // Anal. Chem. 1993. V. 65. № 14. P. 1910.
Casado C.M., Moran M., Losada J., Cuadrado I. // Inorg. Chem. 1995. V. 34. № 7. P. 1668.
Ospina E., Armada M.P.G., Losada J., Alonso B., Casado C.M. // J. Electrochem. Soc. 2016. V. 163. № 9. P. H826.
Abd-El-Aziz A.S., Winram D.J., Shipman P.O., Dalgakiran S.S., Shipley P., Bichler L., Patrick B. // New J. Chem. 2011. V. 35. № 10. P. 2341.
Pittman C.U. // J. Inorg. Organomet. Polym. 2005. V. 15. № 1. P. 33.
Miles D., Ward J., Foucher D.A. // Macromolecules. 2009. V. 42. № 22. V. 9199.
Rulkens R., Ni Y., Manners I. // J. Am. Chem. Soc. 1994. V. 116. № 26. P. 12121.
Gómez-Elipe P., Resendes R., Macdonald P.M., Manners I. // J. Am. Chem. Soc. 1998. V. 120. № 33. P. 8348.
Silicon in Organic, Organometallic, and Polymer Chemistry / Ed. by M.A.Brook. New York: Wiley, 1999.
Yilgör E., Yilgör I. // Prog. Polym. Sci. 2014. V. 39. № 6. P. 1165.
Chauhan B.P.S., Rathore J.S. // J. Am. Chem. Soc. 2005. V. 127. № 16. P. 5790.
Silicon Based Polymers / Ed. by B.P.S. Chauhan, B. Balagam, J.S. Rathore, A. Sarkar, F. Ganachaud, S. Boileau, B. Boury Dordrecht: Springer Netherlands. 2008. P. 3.
Sheiko S.S., Sumerlin B.S., Matyjaszewski K. // Prog. Polym. Sci. 2008. V. 33. № 7. P. 759.
Кошелев Ф.Ф., Конев А.Е., Буканов А.М. Общая технология резины. М.: Химия, 1978.
Deriabin K.V., Lobanovskaia E.K., Novikov A.S., Isla-mova R.M. // Org. Biomol. Chem. 2019. V. 17. № 22. P. 5545.
Handbook of antistatics / Ed. by J. Pionteck, G. Wypych. Toronto: ChemTec Publ. 2016.
Hogan T.E., Hergenrother W.L., DeTrano M. Pat. 6399692B2 USA. 2002.
Fujiki H., Matsubayashi S., Kanto K., Suzuki T. Pat. 20150348670A1 USA. 2015.
Conductive Coatings for Textiles. Smart Textile Coatings and Laminates / Ed. by L. Wang, X. Wang, T. Lin. Cambridge: Woodhead Publishing Limited, 2010.
The Story of Semiconductors / Ed. by J.W. Orton. Oxford: Oxford Univ. Press. 2008.
Nakamura T. Pat. 5725922A USA. 1998.
Blauch D.N., Saveant J.M. // J. Am. Chem. Soc. 1992. V. 114. № 9. P. 3323.
Gan L., Suchand Sangeeth C.S., Yuan L., Jańczewski D., Song J., Nijhuis C.A. // Eur. Polym. J. 2017. V. 97. P. 282.
Pietschnig R. // Chem. Soc. Rev. 2016. V. 45. № 19. P. 5216.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)