Высокомолекулярные соединения (серия С), 2022, T. 64, № 2, стр. 158-167
ГРЕБНЕОБРАЗНЫЕ ПОЛИЭЛЕКТРОЛИТЫ С КАТИОНАМИ ХИНОЛИНИЯ И ТРИМЕТИЛАММОНИЯ В МИЦЕЛЛЯРНОМ КАТАЛИЗЕ
П. А. Фетин a, *, В. И. Фетина a, М. В. Кадников a, А. А. Лезов a, И. М. Зорин a
a Санкт-Петербургский государственный университет.
Институт химии, Физический факультет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
* E-mail: p.fetin@spbu.ru
Поступила в редакцию 05.04.2022
После доработки 08.06.2022
Принята к публикации 18.07.2022
- EDN: VKYKBW
- DOI: 10.31857/S2308114722700170
Аннотация
Получены гомо- и сополимеры поли-11-акрилоилоксиундецилтриметиламмоний бромида и поли-11-акрилоилоксиундецилхинолиний бромида. Определены молекулярные характеристики и солюбилизационные свойства этих полиэлектролитов. Исследована их каталитическая активность в модельной реакции щелочного гидролиза п-нитрофенилбутирата. Введение звеньев с хинолиновым фрагментом приводит к последовательному росту солюбилизационной емкости сополимера в отношении гидрофобного красителя Оранж-ОТ. Полученные гребнеобразные полиэлектролиты способны к солюбилизации во всем концентрационном диапазоне; для этих соединений отсутствует критическая концентрация мицелообразования, характерная для низкомолекулярных ПАВ. В присутствии гребнеобразных полиэлектролитов наблюдается ускорение реакции щелочного гидролиза модельного сложного эфира в 2–3 раза даже при низких концентрациях полиэлектролита. Синтезированные полимерные ПАВ не кристаллизуются при понижении температуры раствора в отличие от их мономеров и других катионных низкомолекулярных ПАВ.
Основой функционирования живых систем является их способность к самоорганизации [1]. Общепризнано, что движущей силой процессов самоорганизации чаще всего служит амфифильная структура молекул. Самые известные амфифилы – поверхностно-активные вещества. Изучение процессов самоорганизации амфифильных соединений, в частности ПАВ, привело к открытиям в биомиметике, к созданию разнообразных сенсорных устройств, разработке защитных покрытий [2–4]. В настоящей работе явления самоорганизации амфифильных полимерных соединений используются для создания каталитических систем, работающих по механизму локального концентрирования субстрата и реагента. В биологических системах их аналог – действие поверхностно-активных желчных кислот в процессах пищеварительного расщепления жиров. При использовании ионных ПАВ можно ожидать синергизма гидрофобных и ионных взаимодействий субстрата и реагента с мицеллами. В литературе представлено много работ по исследованию низкомолекулярных ПАВ для создания мицеллярных каталитических систем. Модельной каталитической реакцией в большинстве исследований служит реакция гидролиза сложных эфиров [5–7], а также окислительно-восстановительные реакции [8] с УФ-детектированием скорости химической реакции. Проблеме мицеллярного катализа таких реакций посвящены соответствующие обзоры [9], разработаны теоретические подходы к описанию этого явления [10], изучены, в частности, практические аспекты реакций гидролиза эфиров фосфорной кислоты [5].
Исследованию полимерных ПАВ для создания мицеллярных катализаторов уделено недостаточно внимания. В данной работе в качестве полимерных ПАВ используются гребнеобразные полиэлектролиты (полимыла), полученные полимеризацией поверхностно-активных мономеров. Сочетание гидрофобного и электростатического взаимодействия с ковалентными связями мономерных звеньев в макромолекуле – необходимый фактор для формирования новых самоорганизованных структур с отличными от низкомолекулярных ПАВ свойствами.
Цель настоящей работы – синтез и изучение мицеллярно-каталитических систем, сформированных из гребнеобразных полиэлектролитов с катионными звеньями триметиламмония и хинолиния.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты
2,2'-азобис-(2-метилпропионамидин)дигидрохлорид, 99% (V-50, “Aldrich”), 11-бромоундеканол, 99% (“Aldrich”) использовали без дополнительной очистки. Акрилоилхлорид перегоняли над CuCl, метиленхлорид, ацетонитрил, гексан, ацетон, метанол (“Вектон”) очищали по стандартным методикам. Хинолин перегоняли над CaCl2, перед перегонкой выдерживали 24 ч над KOH. Раствор (ω = 16%) триметиламина в ацетонитриле получали из 25%-ного водного раствора триэтиламина (“Вектон”) методом барботирования.
Синтез мономеров
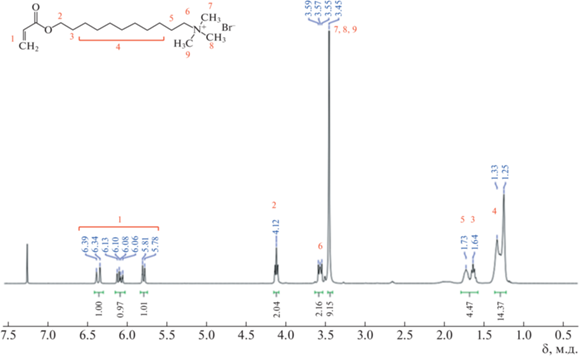
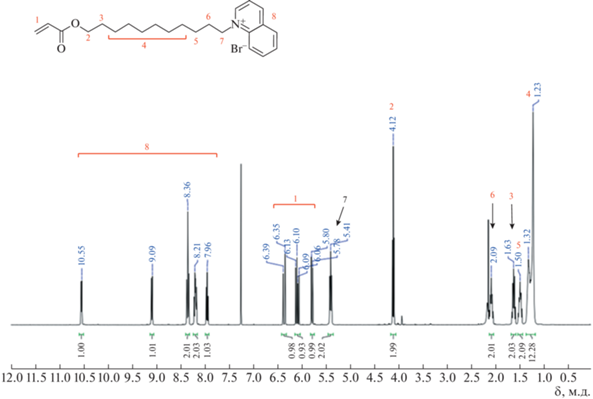
Бромиды 11-акрилоилоксиундецилтриметиламмония (АУТА) и 11-акрилоилоксиундецилхинолиния (AУХИ) получали по двустадийной методике. На первой стадии проводили реакцию этерификации 11-бромундеканола акрилоилхлоридом при 25°С в течение 4 суток в хлористом метилене в двукратном избытке акрилоилхлорида, NaHCO3, Na2SO4 по отношению к 11-бромундеканолу. Реакционную смесь декантировали, упаривали досуха, растворяли в гексане, промывали органическую фазу 5%-ным водным раствором соды. Сушили над безводным Na2SO4. Выход целевого продукта 11-бромундецилакрилата составил 95% (прозрачное масло). На второй стадии к раствору 11-бромундецилакрилата (1 экв.) в ацетонитриле добавляли при охлаждении по каплям приготовленный раствор триметиламина (1.3 экв.). Реакционную смесь оставляли на 1 сутки. Белые кристаллы АУТА многократно промывали гексаном. Целевое вещество очищали перекристаллизацией из ацетона с добавками метанола. Выход продукта 85%. Структуру вещества подтверждали методом ЯМР 1Н (рис. 1). В случае синтеза АУХИ к раствору 11-бромундецилакрилата (1 экв.) добавляли хинолин. Смесь помещали в запаянную ампулу и термостатировали при 80°С в течение 72 ч. После удаления растворителя и растирания продукта с гексаном получали целевое вещество в виде красного порошка, который очищали перекристаллизацией из ацетона с добавкой метанола. Выход 70%. Структуру вещества подтверждали методом ЯМР 1Н (рис. 2).
Полимеризация
Полимеризацию АУТА и AУХИ проводили в воде при концентрации мономеров 0.27 моль/л с инициатором V-50 (1 г/дл), при 60°С в течение 1 и 24 ч соответственно. Смесь перед синтезом барбатировали аргоном. Полимер очищали диализом против воды и выделяли лиофильной сушкой, перед исследованием хранили в эксикаторе над СaCl2. Синтез сополимеров осуществляли при аналогичных условиях в течение 24 ч. Концентрация АУТА–0.27 M, навеску AУХИ рассчитывали из мольного соотношения к сомономеру n(АУХИ) : n(АУТА) = 1 : 1 и 1 : 10. Полимеры очищали диализом против воды, выделяли лиофильной сушкой.
Методы исследования
Динамическое и статическое рассеяние света измеряли на установке “PhotoCor Complex” (“Фотокор”, Россия) с коррелятором реального времени “PhotoCor-FC”, содержащим 288 каналов в диапазоне углов рассеяния θ от 30°до 130° при 298 К. Образец освещали линейно поляризованным светом He-Nе-лазера с длиной волны ${{\lambda }_{0}}$ = = 632.8 нм, мощность которого составляла 25 мВт. Использовали стеклянную цилиндрическую кювету диаметром 1 см, которую погружали в растворитель декан, имеющий тот же показатель преломления, что и стекло кюветы. Автокорреляционные функции интенсивности обрабатывали с помощью программы “DynaLS”, что позволило получить функции распределения Ψ(τ) для исследованных гребнеобразных полиэлектролитов по временам релаксации. Коэффициент поступательной диффузии D находили из наклона линейной зависимости обратного времени релаксации 1/τ от квадрата вектора рассеяния q = ${\frac{{4\pi {{n}_{0}}}}{{{{\lambda }_{0}}}}{\text{sin}}(\theta {\text{/}}2)}$ [11]
Гидродинамический радиус Rh рассчитывали по формуле Стокса–Эйнштейна [12]:
Функции распределения Ψ(τ) являются взвешенными по интенсивности рассеянного света, и вес каждого пика ωi зависит не только от концентрации частиц в растворе, но и от их гидродинамического радиуса ${{R}_{{hi}}}$. Чтобы оценить массовую долю ${{X}_{i}}$ частиц каждого размера в полидисперсной системе использовали выражение [13]
Исследованные системы демонстрировали мультимодальное распределение интенсивности рассеянного света по гидродинамическим радиусам, однако согласно сделанным оценкам доли компонент в растворе, быстрая мода рассеяния соответствовала более чем 90% от всей массы растворенного вещества.
Молекулярную массу исследованных полимеров определяли методом статического рассеяния света согласно соотношению (рис. 3, табл. 1):
(4)
$Hc{\text{/}}{{R}_{\theta }}{{{\text{|}}}_{{\theta \to 0}}} = 1{\text{/}}{{M}_{W}} + 2{{A}_{2}}c$Рис. 3.
Построения Дебая для гребнеобразных полимеров: 1 – ПАУХИ, 2 – сополимер 1, 3 – сополимер 2. На вставках приведено распределение интенсивности рассеянного света по гидродинамическим радиусам соответствующих образцов (показано стрелками).

Таблица 1.
Молекулярные характеристики исследованных полимеров в водном растворе NaCl (с = 0.05 моль/л)
| Образец | n(АУХИ)/n(АУТА) | dn/dc, см3/г | [η], дл/г | D × 107, см2/с | Mw × 10–3 | A2 × 104 | A0 × 1010 эрг/К моль1/3 |
|---|---|---|---|---|---|---|---|
| ПАУТА [18] | – | 0.14 | 1.4 | 2.1 | 210 | 7 | 4.2 |
| ПАУХИ | – | 0.18 | 0.1 | 5.4 | 31 | 5 | 3.2 |
| Сополимер 1 | 1 : 1.05 (УФ) 1 : 1 ( ЯМР 1Н) |
0.16 | 0.5 | 2.4 | 81 | 3 | 3.0 |
| Сополимер 2 | 1 : 10.4 (УФ) 1 : 14 ( ЯМР Н) |
0.21 | 0.2 | 5.8 | 143 | 2 | 3.2 |
Примечание. dn/dc – инкремент показателя преломления, [η] – характеристическая вязкость, D – коэффициент диффузии макромолекулы, A2 – второй вириальный коэффициент, A0 – гидродинамический инвариант (определяли, используя соотношение ${{A}_{0}} = \sqrt[3]{{{{M}_{W}}\left[ \eta \right]}}\frac{{{{\eta }_{0}}D}}{T}$).
Здесь $H = \frac{{4{{\pi }^{2}}n_{0}^{2}}}{{{{N}_{{\text{A}}}}\lambda _{0}^{4}}}{{\left( {dn{\text{/}}dc} \right)}^{2}}$, ${{R}_{\theta }}$ – отношение Рэлея, ${{A}_{2}}$ – второй вириальный коэффициент, c – концентрация раствора, $dn{\text{/}}dc$ – инкремент показателя преломления, ${{N}_{{\text{А}}}}$ – число Авогадро [14]. Величины инкремента показателя преломления определяли на рефрактометре “Mettler Toledo RM40”. Интенсивность рассеянного света нормировали на вклад соответствующей моды рассеяния, определенный методом динамического рассеяния.
Для изучения солюбилизационной емкости использовали растворы полимера с разной концентрацией полиэлектролита. Для расчетов использовали концентрацию мономерных звеньев, выраженную в моль/л. При исследовании сополимеров АУХИ – АУТА для определения концентрации брали среднюю по мольной доле молекулярную массу мономерного звена Мзв. Для сополимера 1 она составила 399.39, для сополимера 2 – 368.92. В каждый образец помещали по 5 мг модельного красителя Оранж-ОТ и растворы выдерживали 14 суток при 25°С. Перед записью УФ-спектров раствор фильтровали через ватно-марлевый фильтр. Величину S рассчитывали по формуле
где S – солюбилизационная емкость, В – угол наклона концентрационной зависимости оптической плотности, εext – коэффициент экстинкции Оранж-ОТ на длине волны 495 нм (18720 л/моль см [15]), L – толщина кюветы 1 см.Для изучения каталитической активности использовали модельную реакцию гидролиза п-нитрофенилбутирата (с = 1 × 10–4) в щелочной среде (сNaOH = 1 × 10–3). За кинетикой гидролиза следили по росту оптической плотности на длине волны 400 нм (соответствует максимуму поглощения пара-нитрофенолят аниона). Эффективную константу скорости гидролиза kэф рассчитывали, применяя кинетическое уравнение реакции псевдоперовго порядка
в котором Ак – поглощение раствора по окончании реакции (выход на плато), A – поглощение в момент времени t.Концентрационную зависимость эффективной константы скорости гидролиза анализировали согласно модели Березина [10], используя программу Origin:
(7)
${{k}_{{{\text{эксп}}}}} = \frac{{\frac{{{{k}_{m}}}}{V}{{K}_{{s~}}}{{K}_{{{\text{OH}}~}}}\left( {{{C}_{{{\text{ПАВ}}}}} - {\text{KKM}}} \right) + {{k}_{w}}}}{{\left( {1 + {{K}_{{s~}}}{{C}_{{{\text{ПАВ}}}}}} \right)\left[ {1 + {{K}_{{{\text{OH}}~}}}\left( {{{C}_{{{\text{ПАВ}}}}} - {\text{ККМ}}} \right)} \right]~}},$РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ УФ-спектров полученных образцов
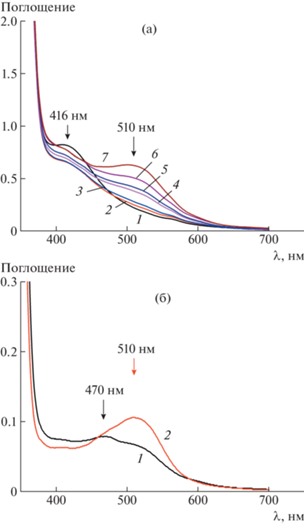
Наличие хромофорной группы в мономере AУХИ позволяет использовать метод УФ-спектроскопии для исследования особенностей самоорганизации мономеров и полимеров в водном растворе. Водный раствор АУХИ в коротковолновой области имеет полосы поглощения λ = = 236 нм (εext = 34 080 ± 170 л/моль см) и λ = 316 нм (εext = 7460 ± 30 л/моль см) (рис. 4а). Выше критической концентрации мицеллообразования для AУХИ (ККМ 0.027 моль/л (кондуктометрия), 0.016 моль/л (солюбилизация красителя)) наблюдается широкая полоса поглощения при длине волны λ = 457 нм (εext =14.2 ± 0.1 л/моль см), что обусловливает окраску его водного раствора при формировании мицелл (рис. 4б). После полимеризации водные растворы гребнеобразного полиэлектролита ПАУХИ сохраняют поглощение в коротковолновом диапазоне длины волн при незначительном уменьшении коэффициента экстинкции λ = 236 нм (εext = 31 300 ± 290 л/моль см) и λ = 316 нм (εext = 7244 ± 52 л/моль см), в то время как максимум поглощения в видимом диапазоне смещается в коротковолновую область λ = 416 нм, коэффициент экстинкции при этом увеличивается в 5 раз (εext = 72.0 ± 0.7 л/моль см). Подобный гипсохромный сдвиг может быть связан с коллективным характером полосы поглощения при λ = = 416 нм, вызванной образованием димеров и N-меров, сформированных катионами хинолиния в боковых звеньях гребнеобразного полиэлектролита за счет π–π-взаимодействий. С течением времени для растворов ПАУХИ наблюдается батохромный сдвиг полосы поглощения с λ = = 416 нм к λ = 510 нм. Визуально раствор при этом с темно-красного цвета становится малиново-алым (рис. 5а). Никаких изменений в положении химических сдвигов в спектрах ЯМР 1Н и ЯМР 13С гребнеобразного полиэлектролита при этом процессе обнаружено не было, что свидетельствует об отсутствии изменения химической структуры мономерного звена. Можно предположить, что смещение максимума полосы поглощения на 94 нм связано с медленной перестройкой самоорганизованной структуры гребнеобразного полиэлектролита ПАУХИ в растворе, вызванной набуханием. Разбавление хинолиновых мономерных звеньев триметиламмонийными в сополимерах ПАУХИ–ПАУТА сводит к минимуму дрейф полосы поглощения. Через 24 ч после приготовления раствора сополимер, содержащий минимальное количество катионов хинолиния, имеет максим поглощения λ = 510 нм (рис. 5б). Смещение максимумов поглощения в коротковолновой области 236 нм, 316 нм для гомополимера ПАУХИ и сополимеров с течением времени не было обнаружено. По поглощению сополимеров на длине волны 316 нм устанавливали состав сополимера (табл. 1). Полученное значение мольной доли звеньев АУХИ в УФ-эксперименте совпала с найденной из анализа спектров ЯМР 1Н и соответствует мольной доли мономеров при синтезе. Таким образом, можно сделать вывод, что мономеры АУХИ и АУТА обладают близкими к единице константами сополимеризации (r1 и r2) и образуют случайный сополимер [16]. Пример спектра ЯМР сополимера 1 приведен на рис. 6.
Рис. 4.
Спектры поглощения водных растворов AУХИ в коротковолновом диапазоне длин волн (а) и длинноволновом диапазоне (б) при различной концентрации АУХИ. Т = 25°С. а: сАУХИ = 1.1 × 10–5 (1), 2.2 × 10–5 (2), 3.3 × 10–5 (3), 6.7 × 10–5 (4), 1.3 × 10–4 (5) и 2.0 × 10–4 моль/л (6); б: сАУХИ = 0.0001 (1), 0.002 (2), 0.005 (3), 0.01 (4), 0.02 (5), 0.03 (6), 0.05 (7) и 0.07 моль/л (8).
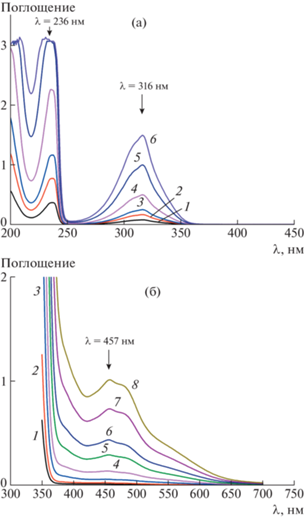
Рис. 5.
а – Спектры поглощения водного раствора ПАУХИ (с = 0.03 моль/л, 25°С) через 0 (1), 1 (2), 2 (3), 7 (4), 9 (5), 14 (6) и 20 суток (7) после приготовления раствора полиэлектролита; б – спектры поглощения водных растворов сополимеров 1 и 2 (с = 0.01 моль/л, рассчитано из усредненной молекулярной массы мономерного звена, 25°С) через 24 ч после приготовления раствора.
Обсуждение условий синтеза и молекулярно-массовых характеристик образцов
Присутствие сомономера АУХИ при полимеризации АУТА приводит к резкому уменьшению конверсии связей С=С в ходе синтеза в течение 1.5 ч как в случае образования сополимера (85% и 14% для сополимеров 2 и 1 соответственно), так и при гомополимеризации (15%). Для гомополимеризации АУТА характерна конверсия 98% за первые 10 мин синтеза, что свойственно для мицеллярной полимеризации [17]. Этот эффект может быть связан с возможностью дополнительной ассоциации катионов хинолиния в мицеллах мономера (например, за счет π-π-взаимодействия), что затрудняет обмен мономеров между мицеллами при полимеризации.
На уменьшение скорости полимеризации реакционной смеси, содержащей сомономер АУХИ, также указывает медленный спад удельной электропроводности σ, фиксируемый при синтезе (рис. 7). Зависимость σ от времени полимеризации для мономера АУТА имеет характерный для мицеллярной полимеризации вид в отличие от смесей, содержащих дополнительно АУХИ: начальный рост σ (первые 1–2 минуты) связан с разогревом реакционной смеси до температуры синтеза (60°С), который сопровождается дальнейшим резким уменьшением σ с выходом на плато. Уменьшение удельной электропроводности при полимеризации, во-первых, связано с изменением количества ионизированных частиц в растворе, так как бромид-ионы конденсируются на растущей полимерной цепи. Во-вторых, с повышением в растворе концентрации макромолекул уменьшается подвижность носителей заряда за счет значительной вязкости среды. При последовательном увеличении доли хинолиновых звеньев в мономерной смеси спад электропроводности в ходе полимеризации становится более плавным (рис. 7).
Рис. 7.
Зависимость удельной электропроводности раствора при полимеризации σ от времени синтеза. 1 – полимеризация АУТА, 2 – полимеризация АУХИ, 3 – полимеризация сополимера 1, 4 – полимеризация сополимера 2. Для наглядности данные приведены со смещением на 10 мин вдоль оси времени.

Молекулярные характеристики исследованных полимеров определяли методами динамического, статического рассеяния света и вискозиметрии. Было установлено, что для всех исследованных систем наблюдается линейная зависимость приведенной вязкости от концентрации, что свидетельствует, по крайней мере, о частичном подавлении полиэлектролитного эффекта. Зависимости коэффициента поступательной диффузии также имели линейный характер. Основные результаты этих исследований представлены в табл. 1. Полученные значения характерны для гибких и умеренно жестких полимеров. Подобные значения гидродинамических инвариантов получали для гребнеобразных полимеров близкой структуры [18–20].
Достаточно большие значения вторых вириальных коэффициентов, полученные для исследованных систем, свидетельствуют о том, что раствор, содержащий 0.05 M NaCl, является хорошим растворителем для данных систем.
Изучение мицеллярно-каталитических свойств полученных гребнеобразных полимеров
Полученные в работе гребнеобразные полиэлектролиты способны солюбилизировать малополярные вещества во всем диапазоне концентраций, включая крайне низкие концентрации. Для этих соединений отсутствует критическая концентрация мицеллообразования, характерная для низкомолекулярных ПАВ (рис. 8). В отличие от мицелл, образуемых низкомолекулярными ПАВ, мицеллы гребнеобразных полиэлектролитов стабилизированы ковалентными связями, соединяющими мономерные звенья в полимерную цепь. Фактически одна молекула полиэлектролита даже при бесконечном разбавлении должна быть способна к солюбилизации. Значение солюбилизационной емкости, определенной относительно красителя Оранж-ОТ, значительно выше, чем аналогичная величина, детектируемая для соответствующих мономеров (табл. 2, SАУТА = = (0.7 ± 0.1) × 10–3 и SАУХИ = (3.9 ± 0.3) × 10–3). Возрастание мольной доли хинолиновых звеньев в сополимерах ПАУХИ–ПАУТА приводит к увеличению солюбилизационной емкости. Можно предположить, что катионы хинолиния способны к дополнительным взаимодействиям с молекулами Оранж-ОТ за счет наличия ароматических фрагментов как в красителе, так и в боковых группах гребнеобразного полиэлектролита. Солюбилизация катионными мицеллами красителей, содержащих ароматические звенья, реализуется преимущественно во внешнем слое мицеллы [10, 21].
Рис. 8.
Зависимость поглощения насыщенного раствора Оранж-OT (λ = 495 нм) от концентрации ПАВ. Черные квадраты (0.05 М водный NaCl, 25°С), пустые красные круги (вода, 25°С): а – гребнеобразный полиэлектролит ПАУТА (1) и его мономер (2), б – гребнеобразный полиэлектролит ПАУХИ (1) и его мономер (2).
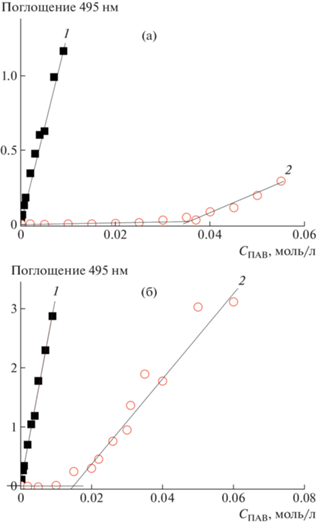
Таблица 2.
Мицеллярно-каталитические свойства гребнеобразных полиэлектролитов
| Образец | Гидролиз модельного субстрата | Солюбилизация Оранж-ОТ | |||
|---|---|---|---|---|---|
| km/V | Ks | KOH | Kэксп/kw | S × 103 (Orange-OT) | |
| ПАУТА | 0.0012 | 150 ± 14 | 540 ± 90 | 5.9 | 9.1 ± 0.2 |
| ПАУХИ | 0.0012 | 87 ± 19 | 318 ± 137 | 3.9 | 17.2 ± 0.4 |
| Сополимер 1 | 0.0014 | 118 ± 15 | 367 ± 75 | 5.1 | 13.0 ± 0.5 |
| Сополимер 2 | 0.0017 | 164 ± 28 | 483 ± 126 | 8.0 | 9.5 ± 0.1 |
Примечание. km – константа скорости гидролиза, солюбилизированного в мицелле субстрата, V – мольный объем ПАВ; Ks – константа солюбилизации, KOH – константа связывания мицеллы с реагентом. Kэксп – определенная константа скорости гидролиза. Kэксп/kw – ускоряющий эффект, S – солюбилизационная емкость относительно Оранж-ОТ.
Учитывая способность к солюбилизации гребнеобразными полиэлектролитами при крайне низких концентрациях, эти соединения могут стать перспективными катализаторами мицеллярно-каталитических реакций. В настоящей работе их каталитическую активность исследовали на модельной реакции гидролиза п-нитрофенилбутирата в щелочной среде.

Ускорение химической реакции в таком случае в основном связано с локальным увеличением концентрации субстрата и реагента в мицеллярной фазе по механизму солюбилизации и ионного притяжения. Анализируя экспериментальные данные согласно кинетической модели химической реакции псевдопервого порядка, были получены зависимости экспериментальных констант гидролиза kэксп от концентрации гребнеобразного полиэлектролита (рис. 9). Эти зависимости характеризуются экстремумом, соответствующим максимальному каталитическому эффекту. Уменьшение величины эффективной константы скорости гидролиза при высоких концентрациях ПАВ связано с разбавлением субстрата и реагента в мицеллярной псевдофазе и может быть нивелировано повышением концентраций последних. Обработка полученных зависимостей (kэкспvs t) согласно мицеллярно-каталитической модели Березина (уравнение (2)), позволила оценить константы солюбилизации Ks и константы связывания аниона ОН– с полимерной цепью KOH (табл. 2). Введение звеньев с хинолиновым фрагментом приводит к закономерному снижению констант связывания с анионом ОН–, что отражается в уменьшении каталитического эффекта. Константы солюбилизации также изменяются, для сополимера 2 наблюдаются максимальные значения константы солюбилизации. В совокупности с сохранением высоких значений констант связывания ОН– этот образец проявляет максимальный из исследованных гребнеобразных полиэлектролитов каталитической эффект. Для сополимера 2 установлено ускорение реакции (kэксп/kw) в 8 раз по сравнению с гидролизом в отсутствие ПАВ (kw).
Рис. 9.
Зависимость экспериментальной константы гидролиза kэксп для модельной реакции (концентрация п-нитрофенилбутирата 1 × 10–4 моль/л, сNaOH = = 1 × 10–1 моль/л, 25°C) от концентрации гребнеобразного полиэлектролита; кривые – аппроксимация этой зависимости согласно теоретической модели (уравнение (7)): 1 – ПАУТА, 2 – ПАУХИ, 3 – сополимер 1, 4 – сополимер 2.

ЗАКЛЮЧЕНИЕ
В ходе выполнения работы были получены новые гребнеобразные полиэлектролиты 11-акрилоилоксиундецилхинолиния бромида и 11-акрилоилоксиундецилтриметиламмония бромида, а также их сополимеры с мольным соотношением звеньев 1 : 1 и 1 : 10 соответственно. Было установлено, что эти полиэлектролиты способны к солюбилизации во всем концентрационном диапазоне, включая крайне низкие концентрации. Анализ солюбилизационной емкости выявил, что введение катионов хинолиния в сополимер увеличивает солюбилизационную емкость. Максимальное значение солюбилизационной емкости характерно для гомополимера, содержащего только хинолиновые звенья в повторяющемся звене. Полученные гребнеобразные полиэлектролиты ускоряют реакцию щелочного гидролиза модельного субстрата п-нитрофенилбутирата в воде. Гребнеобразные полиэлектролиты могут быть рекомендованы для разработки новых каталитических систем, функционирующих по механизму локального концентрирования субстрата и реагента.
Авторы выражают благодарность ресурсным центрам Санкт-Петербургского государственного университета: магнитно-резонансные методы исследования и криогенный отдел.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 21-73-10132).
Список литературы
Lehn J.M. // Eur. Rev. 2009. V. 17. № 2. P. 263.
Chakraborty S., Varghese S., Ghosh S. // Eur. J., Chem. 2019. V. 25. № 72. P. 16725.
Kashapov R.R., Bekmukhametova A.M., Petrov K.A., Nizameev I.R., Kadirov M.K., Zakharova L.Ya. // Sensors Actuators B. 2018. V. 273. June. P. 592.
Kushnazarova R.A., Mirgorodskaya A.B., Kuznetsov D.M., Tyryshkina A.A., Voloshina A.D., Gumerova S.K., Lenina O.A., Nikitin E.N., Zakharova L.Ya. // J. Mol. Liq. 2021. V. 336. P. 116318.
Gaynanova G.A., Vagapova G.I., Valeeva F.G., Vasilieva E.A., Galkina I.V., Zakharova L.Ya., Sinyashin O.G. // Colloids Surf. A. 2016. V. 489. P. 95.
Rahman F., Rafiquee M.Z.A. // J. Mol. Liq. 2019. V. 291.
Al-Shamary M.N., Al-Lohedan H.A., Rafiquee M. Z.A.,El-Ablack F., Issa Z.A. // J. Saudi Chem. Soc. King Saud Univ. 2017. V. 21. P. S193.
Patel B.K., Mandal H.K., Rudra S. Mahapatra A. // J. Mol. Liq. 2018. V. 250. P. 103.
Fendler E.J., Fendler J.H. // Adv. Phys. Org. Chem. 1970. V. 8. P. 271.
Berezin I.V., Martinek K., Yatsimirskii A.K. // Russ. Chem. Rev. Turpion-Moscow Limited. 1973. V. 42. № 10. P. 787.
Cummins H.Z. // Photon-correlation and Light-beating Spectroscopy. Plenum Pre. 1974. V. 57. P. 1.
Цветков В.Н. Жесткоцепные полимерные молекулы. Л.: Наука, 1986.
Litmanovich E.A., Ivleva E.M. // Polymer Science A. 2010. V. 52. № 6. P. 671.
Цветков В.Н., Эскин В.Е., Френкель С.Я. Структура макромолекул в растворах. М.: Наука. 1964.
Schott H. // J. Phys. Chem. 1967. V. 71. № 11. P. 3611.
Odian G. Principles of Polymerization. New York: Wiley, 2004.
Pashirova T.N., Fetin P.A., Kadnikov M.V., Valeeva F.G., Burilova E.A., Bilibin A.Yu., Zorin I.M. // Chempluschem. 2020. V. 85. P. 1939.
Lezov A.A., Fetin P.A., Gubarev A.S., Lezova A.A., Vezo O.S., Senchukova A.S., Mikhailova M.E., Mikusheva N.G., Zorin I.M., Tsvetkov N.V. // J. Polym. Res. 2020. V. 27. № 12. P. 1.
Tsvetkov N.V., Lebedeva E.V., Lezov A.A., Podseval’nikova A.N., Akhmadeeva L.I., Zorin I.M., Bili-bin A.Yu. // Polym. (United Kingdom). 2014. V. 55. № 7. P. 1716.
Tsvetkov N.V., Mikusheva N.G., Lezov A.A., Gubarev A.S., Mikhailova M.E., Podseval’nikova A.N., Akhmadeeva L.I., Lebedeva E.V., Zorin I.M., Shcherbinina T.M., Bili-bin A.Yu. // Eur. Polym. J. 2016. V. 75. P. 251.
Rosen M.J. Surfactants and Interfacial Phenomena. New Jersey: Wiley, 2004.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)