Высокомолекулярные соединения (серия С), 2022, T. 64, № 2, стр. 148-157
АМФИФИЛЬНЫE СОПОЛИМЕРЫ РАЗЛИЧНОГО СТРОЕНИЯ НА ОСНОВЕ ПОЛИЭТИЛЕНГЛИКОЛЯ: СИНТЕЗ, ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА И ЦИТОТОКСИЧНОСТЬ
М. Ю. Заремский a, *, Н. С. Мелик-Нубаров a, И. Д. Гроздова a, Э. Э. Алиев a, С. А. Румянцев a
a Московский государственный университет имени М.В. Ломоносова. Химический факультет
119992 Москва, Ленинские горы, Россия
* E-mail: zaremski@mail.ru
Поступила в редакцию 05.04.2022
После доработки 02.06.2022
Принята к публикации 16.06.2022
- EDN: KSCWAW
- DOI: 10.31857/S2308114722700121
Аннотация
Предложены новые способы получения привитых и разветвленных амфифильных сополимеров на основе полиэтиленгликоля. Радикальной полимеризацией с участием ТЕМПО и серной кислоты осуществлен контролируемый синтез привитых сополимеров метилметакрилата с полиэтиленгликольметакрилатом. Радикальной сополимеризацией аллилацетата и полиэтиленгликольакрилата в присутствии дивинилбензола синтезированы разветвленные сополимеры. Показана способность таких сополимеров формировать мицеллы в водной среде, исследована их цитотоксичность и способность подавлять устойчивость человеческих раковых клеток NCI/ADR-RES.
ВВЕДЕНИЕ
Свойства амфифильных сополимеров во многом зависят от их состава и морфологии. Например, они определяют размер, форму и стабильность коллоидных частиц, которые амфифильные сополимеры формируют в водных растворах. Учет этих факторов особенно важен при конструировании носителей для доставки лекарств, поскольку размер и морфология полимерных объектов в значительной мере устанавливает их взаимодействие с целевыми клетками и клетками ретикулоэндотелиальной системы (такими как макрофаги и дендритные клетки). Контроль стабильности полимерных контейнеров определяет скорость их выведения, а значит, также влияет на биодоступность содержащегося в полимерных частицах лекарства [1].
Сополимеры на основе ПЭГ наиболее выделяются среди амфифильных сополимеров благодаря своей самоорганизации в водном растворе с образованием широкого спектра структур [2]. Одной из важнейших особенностей сополимеров ПЭГ является их способность повышать чувствительность раковых клеток к химиотерапии, делая актуальным их применение в фармакологии. Прежде всего это относится к плюроникам – блок-сополимерам этиленоксида и пропиленоксида. Большинство плюроников подавляют устойчивость клеток к лекарствам в концентрации на один–два порядка меньше цитотоксичной.
Важно понимать, какие физико-химические особенности плюроников обусловливают их воздействие на устойчивость раковых клеток к лекарствам. Известно, что сходным с плюрониками действием обладают полиэтоксилированный α-токоферол сукцинат, блок-сополимеры ПЭГ с полидиметилсилоксаном или поликапролактамом, сополимеры полиглицерина с полипропиленоксидом [3–6]. Все упомянутые полимеры имеют небольшую массу гидрофобного блока и действуют подобно низкомолекулярным ПАВ. К сожалению, круг макромолекулярных структур, которые эффективны в ингибировании устойчивости раковых клеток к лекарствам ограничивается, с одной стороны, блок-сополимерами, и с другой – сополимерами, которые содержат в гидрофобном блоке простые или сложноэфирные звенья с кислородными атомами в основной цепи.
В настоящей работе предпринята попытка ответить на вопросы – могут ли подавлять резистентность полимеры, содержащие сложноэфирные связи в боковых цепях? Как влияет строение цепи сополимера (блочное, привитое, разветвленное) на его взаимодействие с раковыми клетками? Для этого были получены новые сополимеры и разработаны новые способы получения амфифильных сополимеров на основе ПЭГ, способных к самоорганизации в водных растворах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Метилметакрилат марки “Aldrich” очищали от ингибитора – монометилового эфира гидрохинона перегонкой при пониженном давлении в токе инертного газа (Ткип = 41°С при 80 мм рт.ст., $n_{{\text{D}}}^{{20}}$ = = 1.414). 2,2,6,6-Тетраметилпиперидин-1-оксил марки “Sigma” применяли без дополнительной очистки. Аллилацетат компании “Show Denko K.K.” очищали перегонкой ($n_{{\text{D}}}^{{20}}$ = 1.404). Монометиловый эфир полиэтиленгликольакрилата (ПЭГА) производства “Aldrich” с Mn = 480 использовали без дополнительной очистки. Дивинилбензол (“Aldrich”) очищали, пропуская через колонку с окисью алюминия. Радикальный инициатор ДАК (“Реахим”) очищали перекристаллизацией из этанола. Моноэтиловый эфир полиэтиленгликольметакрилата (ПЭГМА) с Мn = 1900 получали по методике [7]. По данным спектроскопии ЯМР 1Н он содержал 95% концевых виниловых групп.
Привитые сополимеры ММА с ПЭГМА готовили растворением заданного количества ДАК, ПЭГМА и ТЕМПО в ММА с последующей трехкратной дегазацией раствора в вакууме при 5 × × 10–3 мм рт.ст. Концентрация реагентов составляла [ДАК]0 = [ТЕМПО]0 = 0.05 моль/л, [H2SO4] = = 0.035 моль/л. Синтез осуществляли при 80°С в запаянных ампулах. Сополимеры осаждали из 10%-ного раствора в дихлорэтане в смесь изопропанол : гексан в соотношении 1 : 1 и высушивали в вакууме.
Блок-сополимеры ПММА–блок–ПЭГ синтезировали по методике [8]. ПЭГ с концевой бромизобутиратной группой (ПЭГБ) получали по методике [9]. Затем 52.5 мг (10 ммоль/л) ПЭГБ растворяли в ампуле в 100 мкл анизола, дегазировали барботированием аргона в течение 15 мин. В отдельную емкость взвешивали 2.5 мг (10 ммоль/л) CuCl и 21 мг (20 ммоль/л) динонилбипиридила (dNbpy). К смеси добавляли 400 мкл дегазированного ММА. Итоговое мольное отношение компонентов составляло ПЭГБ : CuCl : dNbpy : MMA = = 1 : 1 : 2 : 179. После чего 160 мкл раствора CuCl перенесли в ампулу с инициатором, повторно дегазировали, ампулу запаивали и проводили полимеризацию при 95°С в течение 12 ч. Продукт растворяли в хлороформе, жидкую фракцию отделяли, упаривали до исчезновения запаха анизола. Далее полимер очищали от следов катализатора хроматографией на колонке с Al2O3.
Разветвленные сополимеры получали полимеризацией в смеси 0.36 мл ПЭГА, 8.6 мл аллилацетата, 0.18 либо 0.09 мл (2 и 1 мас. % соответственно) дивинилбензола и 15 мг ДАК. Смесь вакуумировали, как описано выше, и проводили реакцию при 80°C в течение 5 ч. Продукты осаждали пятикратным избытком гексана и высушивали осадок в вакуумном сушильном шкафу.
Кинетику полимеризации изучали методом изотермической калориметрии на дифференциальном автоматическом калориметре ДАК-1-1А в режиме прямой регистрации скорости тепловыделения. При расчете конверсии использовали значения теплоты полимеризации метилметакрилата 57.7 кДж/моль, а при сополимеризации ПЭГА и аллилацетата – значения теплоты для обоих мономеров брали равным 85.3 кДж/моль.
Молекулярно-массовые характеристики сополимеров анализировали методом ГПХ на хроматографе “GPC-120” фирмы “PolymerLabs”, оснащенном двумя колонками “PLgel 5 μl MIXEDB” (M = 5 × 102–1 × 107). Анализ проводили в ДМФА, содержащем 0.1 мас. % LiBr при 50°С и скорости потока 1 мл/мин. Молекулярную массу рассчитывали по калибровке по узкодисперсным стандартам ПММА. Анализ разветвленных сополимеров методом ГПХ выполняли с помощью хроматографа “Agilent 1280 Infinity II” с рефрактометрическим и LALLS-детекторами, используя ТГФ в качестве элюента при 40°С и скорости потока 0.3 мл/мин. В качестве стандартов для калибровки применяли узкодисперсный ПС.
Для проведения ЯМР-анализа готовили 2% растворы анализируемого вещества в 0.6 мл CDCl3. Спектры ЯМР 1Н регистровали на ЯМР-спектрометре “Bruker DRX500”.
Динамическое светорассеяние выполняли на гониометре рассеянного лазерного света “PhotoCor” с гелий-неоновым лазером (λ = 633 нм, 15 мВт) в качестве источника света. Растворы сополимеров обеспыливали фильтрованием через полиэфирные фильтры диаметром пор 0.45 мкм непосредственно в измерительную кювету. Данные коррелятора накапливали в течение 15 мин, регистрируя с помощью программы FlexCor. Средние размеры частиц и их распределение рассчитывали с помощью программы DynaLS.
Влияние сополимеров на клетки тестировали на линии раковых клеток человека NCI/ADR-RES (ранее обозначавшиеся как MCF-7/ADR) по разработанной методике [10]. Для этого 1 мг сополимера растворяли в 20 мкл ацетона, диспергировали в 1 мл бессывороточной культуральной среды и готовили две серии последовательных разбавлений сополимера от 1000 до 15 мкг/мл. Для одной серии использовали раствор 5 мкг/мл доксорубицина в бессывороточной среде, а для второй серии – такую же среду без доксорубицина. Клетки инкубировали со 100 мкл полученных растворов в течение 1.5 ч в стандартных условиях. Каждое разведение образца анализировали в трех лунках с клетками. В качестве контроля применяли клетки, инкубированные со 100 мкл среды без полимеров. По окончании инкубации растворы удаляли и клетки инкубировали трое суток в стандартных условиях в 0.2 мл культуральной среды с 10% сыворотки. На третий день определяли количество живых клеток в лунках планшета с помощью МТТ-теста [11]. Поглощение растворов формазана в лунках при 550 нм (D550) определяли на фотометре “Multiscan” (“Titertek”, США). Влияние сополимера на жизнеспособность клеток оценивали по соотношению D550 в лунках с клетками, инкубированными с полимером, и среднего значения D550 в контроле, принятого за 100%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез привитых сополимеров
Для контролируемого синтеза привитых амфифильных сополимеров ММА с ПЭГ был выбран метод обратимого ингибирования [12, 13]. Он отличается тем, что дает продукты без содержания токсичных примесей [14]. Известно, что осуществить контролируемый синтез сополимеров ММА указанным методом практически невозможно в силу двух причин [15, 16]. Во-первых, нитроксилы любой природы диспропорционируют с радикалами роста ММА. В результате, вместо “живых” цепей образуются “мертвые” макромолекулы. Во-вторых, фоновая концентрация нитроксилов, которые накапливаются в системе вследствие эффекта Фишера–Ингольда настолько высока, что полностью ингибирует полимеризацию уже на начальных, максимум на средних, конверсиях. Недавно мы разработали простой подход к контролируемому синтезу амфифильных сополимеров ММА с ПЭГМА путем их совместной полимеризации под действием системы ДАК–ТЕМПО–серная кислота [15]:
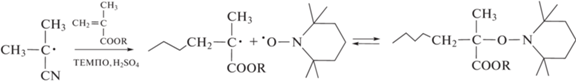 ,
,
где R = CH3, (CH2CH2O)nCH3
Определены оптимальные условия минимизации вероятности диспропорционирования радикалов роста с ТЕМПО и понижения фоновой концентрации нитроксила с помощью серной кислоты, что и позволило осуществить направленный синтез. Выбранная пара мономеров удобна тем, что их активности в радикальной полимеризации достаточно близки, т.е. состав сополимера не меняется по ходу синтеза и совпадает с составом мономерной смеси [17].
Оказалось, что при добавлении 0.035 моль/л H2SO4 в эквимольную систему [ДАК]0 = [ТЕМПО]0 = = 0.05 моль/л полимеризация по окончании индукционного периода протекает на фоне концентрации свободного ТЕМПО 10–4–10–5 моль/л, и ее абсолютное значение практически не зависит от содержания ПЭГМА (рис. 1). С одной стороны, это на два–три порядка ниже, чем в отстутствие кислоты [15, 16], что обеспечивает протекание реакции до глубоких конверсий, а с другой стороны, такой концентрации достаточно для поддержания режима обратимого ингибирования.
Рис. 1.
Изменение концентрации ТЕМПО (а) и выхода сополимера (б) в процессе сополимеризации ММА с 10 (1) и 30 мас. % (2) ПЭГМА. [ДАК] = [ТЕМПО] = 0.05 моль/л, [H2SO4] = 0.035 моль/л, Т = 80°С.

Об этом свидетельствует закономерный сдвиг кривых ММР сополимеров с конверсией (рис. 2) и низкое значение Ð полимера (табл. 1). Исключение составляет образец, полученный с 30 мас. % ПЭГМА при конверсии 53%, с достаточно высоким значением Ð = 2.5. Это может быть связано с частичным сшиванием сополимера под действием небольшой примеси ПЭГМА с двумя двойными связями.
Рис. 2.
Изменение кривых ММР с конверсией: а – 22 (1), 40 (2), 59 (3) и 88% (4); б – 11 (1), 22 (2) и 53 (3) для сополимеров ММА–ПЭГМА, полученных при 10 (а) и 30 мас. % ПЭГМА (б).

Таблица 1.
Выход и молекулярно-массовые характеристики сополимеров П-(ММА-со-ПЭГМА). [ДАК]0 = = [ТЕМПО]0 = 0.05, [H2SO4] = 0.035 моль/л, Т = 80оС
| ПЭГМА, мас. % | Время, мин | Конверсия, % | Mn × 10–3 | Ð |
|---|---|---|---|---|
| 10 | 105 | 22 | 33.7 | 1.2 |
| 125 | 40 | 44.6 | 1.3 | |
| 150 | 59 | 52.4 | 1.4 | |
| 250 | 88 | 67.7 | 1.4 | |
| 30 | 115 | 11 | 28.5 | 1.2 |
| 122 | 22 | 41.7 | 1.4 | |
| 250 | 53 | 71.4 | 2.5 |
Синтезированные таким образом две серии амфифильных привитых сополимеров содержали от 300 до 600 звеньев ММА в основной цепи и от двух до одиннадцати боковых цепей ПЭГ (табл. 2).
Таблица 2.
Синтезированные сополимеры и их характеристики
| Образец | Мономер | Средний состав | Примечания к синтезу | Rh, нм |
|---|---|---|---|---|
| П-1 | ММА | ПММА300–прив–ПЭГМА1.8 | 10 мас. % ПЭГМА | 130 |
| П-2 | ПММА400–прив–ПЭГМА2.4 | 110 | ||
| П-3 | ПММА470–прив–ПЭГМА2.8 | 112 | ||
| П-4 | ПММА610–прив–ПЭГМА3.5 | 110 | ||
| П-5 | ММА | ПММА290–прив–ПЭГМА6.5 | 30 мас. % ПЭГМА | 32 |
| П-6 | ПММА500–прив–ПЭГМА11.3 | 29 | ||
| Б-1 | ММА | ПММА220–блок–ПЭГ115 | 18 мас. % ПЭГ | 24 |
| Б-2 | ПММА58–блок–ПЭГ115 | 46 мас. % ПЭГ | 17 | |
| П–аллилацетат | Аллилацетат | ПАА10.5–прив–ПЭГ3 | – | 69 |
| Р-1 | Аллилацетат | ПАА36–разв–ПЭГ7.5 | 1% ДВБ | 73 |
| Р-2 | ПАА443–разв–ПЭГ92 | 2% ДВБ | 86 |
Синтез блок-сополимеров
Два образца блок-сополимера ПЭГ–блок–ПММА были получены по стандартной методике [17, 18]:

и охарактеризованы с помощью ГПХ и спектроскопии ЯМР (табл. 3).
Синтез разветвленных сополимеров
Для получения разветвленных амфифильных сополимеров на основе ПЭГ впервые был применен подход, описанный в работах [19–21]. Суть метода заключается в сополимеризации виниловых мономеров с дивиниловыми в присутствии агента передачи цепи. При этом “сшиватель” и передатчик берутся в больших и сопоставимых количествах, чтобы получить сильно разветвленный полимер и избежать сшивания продукта. Разветвленные сополимеры, хотя и не являются регулярными, но обладают свойствами аналогичными дендримерам, при этом их синтез более простой и доступный [22].
Оригинальность подхода состояла в объединении мономера и передатчика цепи в одном веществе – аллиловом мономере. В отсутствие сшивателя радикальная сополимеризация аллилацетата и ПЭГА проходит по законам деградационной передачи цепи и приводит к образованию олигомеров за счет передачи цепи на аллилацетат. В присутствии дивинилбензола при сополимеризации аллилацетата и ПЭГА образуются амфифильные разветвленные полимеры.
Выход сополимера заметно уменьшается с увеличением содержания аллилацетата и понижением доли ПЭГА в мономерной смеси fПЭГА (табл. 4).
Таблица 4.
Выход и состав сополимера аллилацетата и ПЭГА ([ДАК] = 10 ммоль/л, T = 80°C)
| fПЭГА, мол. % | Выход сополимера, мас. % | FПЭГА, мол. % |
|---|---|---|
| 50 | 95 | – |
| 30 | 56 | 78 |
| 20 | − | 74 |
| 15 | 28 | – |
| 10 | 22 | 48 |
| 7 | − | 38 |
| 5 | 12 | 30 |
| 4 | 9.1 | – |
| 2 | 5.1 | 15 |
| 1 | 3.3 | 13 |
| 0.5 | 2.4 | – |
Поскольку активность сомономеров не известна, предварительно были установлены значения констант сополимеризации. Для чего методом спектроскопии ЯМР 1Н был определен состав сополимеров, используя соотношение интегралов пиков при 3.36 м.д. (концевые метокси-группы ПЭГА) и 2.0–2.2 м.д. (протоны метильной группы аллилацетата) (табл. 4). Константы сополимеризации были рассчитаны методом Файнмана–Росса и методом наименьших квадратов (МНК) (табл. 5). Оказалось, что ПЭГА почти на два порядка активнее, чем аллилацетат. Это означает, что все сополимеры обогащены макромономером. Следовательно, для получения образцов с сопоставимым массовым содержанием обоих компонентов необходимо мольную долю ПЭГА в реакционной смеси понизить до 1–2%.
Таблица 5.
Значение констант сополимеризации ПЭГА с аллилацетатом
| Метод | rПЭГА | rаллилацетат |
|---|---|---|
| МНК | 8.5 ± 1.7 | 0.11 ± 0.01 |
| Метод Файнмана–Росса | 7.5 ± 0.9 | 0.09 ± 0.01 |
Разветвленные сополимеры ПЭГА и аллилацетата были получены при мольной доле ПЭГА 1% и дивинилбензола 1 и 2% в исходной смеси:

Выход сополимеров составил 3 и 4% соответственно. Методом спектроскопии ЯМР 1Н было установлено, что массовая доля ПЭГ в сополимерах находится в интервале 53–59% и не зависит от содержания дивинилбензола.
Для характеристики разветвленных сополимеров использован метод ГПХ, оборудованный рефрактометрическим детектором и детектором светорассеяния. Для линейных сополимеров значение Mn должно совпадать независимо от типа детектора, для разветвленных – второе (абсолютное) значение должно быть больше первого (относительного). Это различие должно расти при увеличении степени разветвления. Действительно, значение Mn линейного сополимера, определенное по обоим детекторам, совпадает в пределах ошибки измерения (табл. 6). При увеличении содержания сшивателя в полимеризационной смеси абсолютная молекулярная масса сополимера росла быстрее относительной ММ. Интересно, что при этом уменьшалась дисперсность (рис. 3; табл. 6).
Коллоидные свойства сополимеров в водных растворах
Известно, что блок-сополимеры, содержащие фрагменты ПЭГ, способны к самоорганизации в водном растворе с образованием широкого спектра структур в зависимости от состава [2]. Для исследования агрегации полученных нами амфифильных сополимеров в водных растворах мы использовали метод динамического светорассеяния. При анализе корреляционных функций методом регуляризации по Тихонову в большинстве образцов наблюдался единственный пик, средний гидродинамический радиус которого рассчитан в приближении формы частиц к сферической.
Блок-сополимеры ПММА с ПЭГ Б-1 и Б-2, содержащие 18 и 46 мас. % ПЭГ, образовывали частицы с Rh, равным 24 и 17 нм соответственно.
Средний гидродинамический радиус Rh полимерных частиц привитых сополимеров ПММА с 10 мас. % ПЭГ составлял 110–130 нм (см. табл. 2). Размер частиц, образованных привитыми сополимерами с 30% ПЭГ, был близок к 30 нм. Этот результат является вполне ожидаемым, поскольку увеличение содержания ПЭГ облегчает экранирование остова ММА от контакта с водой. В обоих случаях размер частиц почти не менялся с ростом степени полимеризации макромолекул.
Средний гидродинамический радиус полученных ассоциатов слабо увеличивался с ростом концентрации полимеров. Это означает, что вода служит хорошим растворителем для полученных частиц, т.е. их поверхность гидрофильна.
Таким образом, показано, что строение макромолекул значительно влияет на поведение сополимеров ММА с ПЭГ в водном растворе. Мицеллы блок-сополимеров оказываются по размеру существенно меньше, чем их привитые аналоги (рис. 4).
Рис. 4.
Размеры мицелл блочных Б-1 и Б-2 (1), привитых П-1–П-4 (2), П-5–П-6 (3) и П–аллилацетат (4), а также разветвленных Р-1 (5) и Р-2 (6) сополимеров на основе ПЭГ (пояснения в тексте и табл. 2).

Привитые сополимеры аллилацетата и ПЭГА также образуют мицеллы со средним гидродинамическим радиусом 70 нм (см. табл. 2). Это вдвое больше, чем у мицелл, сформированных из привитого сополимера ПЭГ и 70% гидрофобного ММА. Различие в размерах мицелл может быть связано с разной гидрофобностью ММА и аллилацетата и, следовательно, различием во внутрицепных гидрофобных взаимодействиях.
С увеличением содержания сшивателя, и соответственно ММ разветвленного сополимера, наблюдается увеличение среднего гидродинамического радиуса мицелл сополимеров. Поскольку доля ДВБ в составе сополимеров не превышала 2%, то маловероятно, что изменения гидродинамического размера вызваны изменением гидрофобности сополимера. Скорее всего, с ростом степени сшивки сополимера увеличиваются размеры макромолекулы, что приводит к укрупнению ассоциатов.
Взаимодействие сополимеров с клетками
Влияние полученных сополимеров на клетки было изучено на линии раковых клеток яичника человека NCI/ADR-RES, обладающих повышенной устойчивостью к лекарствам, в частности к противоопухолевому антибиотику доксорубицину. Влияние сополимеров на жизнеспособность клеток анализировалось в среде, не содержавшей лекарств, путем инкубации клеток с растворами полимеров в различной концентрации. Способность полимеров подавлять устойчивость клеток к лекарствам выяснялась путем инкубации клеток с сополимерами в среде, содержащей доксорубицин в нетоксичной концентрации.
Анализ привитых сополимеров ПММА с ПЭГ (см. табл. 2) в среде без доксорубицина показал, что они не токсичны для клеток вплоть до 1.5 мг/мл, как при степени конверсии 22% (П-5, рис. 5а), так и при 53% (П-6, рис. 5б). Но их аналоги блок-сополимеры Б-1 и Б-2 проявляли токсичность при концентрации выше 0.1 мг/мл. (рис. 5в).
Рис. 5.
Влияние привитых сополимеров ПММА–ПЭГМА П-5 (а) и П-6 (б) на количество выживших клеток без лекарства (1) и в присутствии 5 мкг/мл (8.6 мкМ) доксорубицина (2). в – Влияние блок-сополимеров ПММА–ПЭГ Б-1 (1) и Б-2 (3) без лекарства и в присутствии 5 мкг/мл (8.6 мкМ) доксорубицина (2 и 4 соответственно). г – Выживаемость клеток после инкубации с привитым аллилацетатом кривая (1) и разветвленными сополимерами аллилацетата и ПЭГА Р-1 (2) и Р-2 (3).

Известно, что сополимеры на основе ПЭГ обладают уникальным свойством повышать жизнеспособность клеток. Данный факт был многократно доказан на амфифильных блок-сополимерах, содержащих ПЭГ, таких как плюроники и полимеры на основе силоксана. Причем сополимеры, содержащие вместо ПЭГ разветвленный гидрофильный блок полиглицерина, были совершенно лишены этой способности, несмотря на сходный гидрофобный блок. Этот результат показал, что увеличение жизнеспособности клеток определяется блоком ПЭГ. Он способен к формированию водородных связей с полисахарами, в частности с гиалуроновой кислотой – одним из компонентов гликокаликса, слоя на поверхности клеток [23]. Связь между этим взаимодействием и жизнеспособностью клеток неизвестна. Поэтому получение любой информации о взаимодействии клеток с ПЭГ представляет интерес.
В связи с этим примечателен тот факт, что способность увеличивать количество живых клеток особенно выражена у привитого аллилацетата и слабо разветвленного (Р-1) сополимера аллилацетата с ПЭГ (рис. 5г, кривые 1 и 2). Количество клеток достигало максимума под действием 0.5 мг/мл этих сополимеров. Эффект сильно разветвленного сополимера (Р-2) (рис. 5г, кривая 3) был менее выражен. Таким образом, линейные и слаборазветвленный сополимеры ПЭГ и аллилацетата гораздо более эффективны в повышении жизнеспособности клеток, чем сильно сшитый сополимер.
Клетки MCF-7/ADR проявляют устойчивость к действию лекарств, которая обусловлена наличием в их мембране Р-гликопротеина, способного выбрасывать из клеток лекарства различной природы. Из обширной литературы по этому вопросу известно, что некоторые амфифильные блок-сополимеры, имеющие в своем составе блок полипропиленоксида, полидиметилсилоксана или поли-ε-капролактона, способны подавлять активность этого белка, способствуя накоплению лекарства в клетках.
Мы исследовали, могут ли синтезированные нами сополимеры различной молекулярной архитектуры влиять на чувствительность раковых клеток к противоопухолевому антибиотику доксорубицину. Оказалось, что привитые сополимеры в концентрации 0.003 (П-6, рис. 5б) или 0.1 мг/мл (П-5, рис. 5а) увеличивали цитотоксичность доксорубицина, что приводило к снижению количества клеток (кривые 2). В отличие от них, линейные блок-сополимеры Б-1 и Б-2 не подавляли устойчивость клеток к лекарствам (рис. 5в).
Можно было бы ожидать, что такое различие в поведении привитых и блок-сополимеров связано с наличием у первых отрицательных зарядов. Напомним, привитые полимеры были получены в системе с добавлением серной кислоты, которая может катализировать гидролиз сложноэфирных групп ММА в процессе синтеза. Доксорубицин представляет собой катионную молекулу, поэтому он связывается с полианионами [24].
Прямые измерения ζ-потенциала мицелл, образованных полимерами, имеющими привитую архитектуру, частично подтвердили это предположение: ζ-потенциал мицелл был действительно слабо отрицательным, в то время как ζ-потенциал блок-сополимеров практически не отличался от 0. При этом ζ-потенциал мицелл, построенных из привитых полимеров, почти не зависел от конверсии, т.е. от времени контакта с серной кислотой. К тому же значение ζ-потенциала этих мицелл (около –10 мВ) не позволяет утверждать, что однозарядный катион доксорубицина может эффективно связываться с такими мицеллами.
Еще одна причина различий между двумя сериями сополимеров состоит в более высокой цитотоксичности сополимеров, полученных полимеризацией с переносом атома. Не исключено, что причина этой токсичности, на фоне которой не удается зарегистрировать подавление устойчивости клеток к лекарству, заложена в присутствии примесей 4,4'-динонил-2,2'-бипиридила в составе блок-сополимеров. Эти примеси были нами обнаружены в препаратах методом спектроскопии ЯМР 1Н. Вполне возможно, что удаление этих примесей позволит увеличить концентрацию блок-сополимеров, что даст возможность зарегистрировать влияние блок-сополимеров на устойчивость клеток к лекарствам.
Различие между привитыми и блок-сополимерами может быть также обусловлено их молекулярной архитектурой. Привитой сополимер, занимая больше места в пространстве, способен вызывать бóльшее возмущение в мембранах раковых клеток, чем линейный блок-сополимер, и именно поэтому может вызывать подавление активности Р-гликопротеина.
ЗАКЛЮЧЕНИЕ
Впервые показано, что привитые и разветвленные полимеры на основе ПЭГ и ПММА способны подавлять устойчивость раковых клеток к действию лекарств. При этом привитая архитектура способствует увеличению эффективности сополимеров.
Способность амфифильных линейных блок-сополимеров полиэтиленоксида и полипропиленоксида повышать выживаемость клеток также оказалась характерной и для сополимеров полиэтиленоксида с аллилацетатом. Однако в этом случае, повышение разветвленности сополимеров приводит к ослаблению их воздействия на жизнеспособность клеток.
Авторы выражают благодарность М.В. Бермешеву и Е.В. Черниковой за помощь в проведении анализа ГПХ образцов полимеров, а также Е.М. Будыниной за исследование образцов методом спектроскопии ЯМР.
Работа выполнена в рамках госзадания “Современные проблемы химии и физикохимии высокомолекулярных соединений” (Госбюджет № АААА-А16-116031050014-6).
Список литературы
Park J.H., Ye M., Park K. // Molecules. 2005. V. 10. P. 146.
Schmolka I.R. // J. Am. Oil Soc. 1977. V. 54. № 3. P. 110.
Liu T., Liu X., Xiong H., Xu C., Yao J., Zhu X., Zhou J., Yao J. // Polym. Chem. 2018. V. 9. P. 1827.
Pavlov D.N., Dorodnykh T.Y., Zaborova O.V., Melik-Nubarov N.S. // Polymer Science A. 2009. V. 51. № 3. P. 295.
Elamanchili P., McEachern C., Burt H. // J. Pharm. Sci. 2009. V. 98. № 3. P. 945.
Demina T.V., Budkina O.A., Badun G.A., Melik-Nubarov N.S., Frey H., Müller S.S., Nieberle J., Grozdova I.D. // Biomacromolecules. 2014. V. 15. P. 2672.
Zalipsky C., Gilon A., Zilkha A. // J. Macromol. Sci. A. 1984. V. 21. P. 839.
Shipp D.A., Wang J.-L., Matyjaszewski K. // Macromolecules. 1998. V. 31. P. 8005.
Jankova K., Chen X., Kops J., Batsberg W. // Macromolecules. 1998. V. 31. P. 538.
Zhirnov A., Nam E., Badun G., Ezhov A., Melik-Nubarov N., Grozdova I. // Pharm. Res. 2018. V. 35. P. 205.
Demina T.V., Budkina O.A., Badun G.A., Melik-Nubarov N.S., Grozdova I.D., Frey H., Müller S.S., Nieberle J. // Biomacromolecules. 2014. V. 15. P. 2672.
Lessard B., Maric M. // Macromolecules. 2008. V. 41. № 21. P. 7870.
Nicolas J., Couvreur P., Charleux B. // Macromolecules. 2008. V. 41. № 11. P. 3758.
Zaremski M.Yu., Melik-Nubarov N.S. // Polymer Science C. 2021. V. 63. № 2. P. 126.
Zaremski M.Yu., Odintsova V.V. // Polymer Science C. 2021. V. 63. № 1. P. 11.
Zaremski M.Yu., Aliev E.E., Garina E.S., Melik-Nubarov N.S. // Mendeleev Commun. 2020. V. 30. P. 627.
Ali M.M., Sto1ver H.D.H. // Macromolecules. 2004. V. 37. P. 5219.
Magenau A.J.D., Kwak Y., Schröder K., Matyjaszew-ski K. // ACS Macro Lett. 2012. V. 1. № 4. P. 508.
O’Brien N., McKee A., Sherrington D.C., Slark A.T., Titterton A. // Polymer. 2000. V. 41. P. 6027.
Kurmaz S.V., Bubnova M.L., Perepelitsina E.O., Estrina G.A. // Polymer Science A. 2006. V. 48. P. 696.
Фадеева Н.В., Корма С.В., Кнерельман Е.И., Давыдова Г.И., Торбов В.И., Дремова Н.Н. // Изв. PАН. Сер. Химическая. 2016. № 8. С. 2089.
Smeets N.M. // Eur. Polym. J. 2013. V. 49. P. 2528.
Le-Deygen I.M., Musatova O.E., Orlov V.N., Melik-Nubarov N.S., Grozdova I.D. // Biomacromolecules. 2021. V. 22. № 2. P. 681.
Kitaeva M.V., Melik-Nubarov N.S., Menger F.M., Yaroslavov A.A. // Langmuir. 2004. V. 20. № 16. P. 6575.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)



