Водные ресурсы, 2021, T. 48, № 6, стр. 685-695
Особенности распределения растворенных форм металлов и металло-гумусовых комплексов в водах Зейского водохранилища
С. И. Левшина a, *, Л. А. Матюшкина a
a Институт водных и экологических проблем ДВО РАН
680000 Хабаровск, Россия
* E-mail: levshina250@gmail.com
Поступила в редакцию 30.01.2021
После доработки 20.04.2021
Принята к публикации 24.05.2021
Аннотация
Впервые оценено содержание растворенных форм металлов и их металло-гумусовых комплексов в водах Зейского водохранилища. Воды характеризовались высоким содержанием ионов Fe3+, Cu2+, Zn2+, превышающим ПДКрх в 1.5–3.7 раза, что, вероятно, является их природным фоном. Установлено, что подавляющая часть растворенных металлов (Al, Fe, Cu, Cr, V, Ni, Zn) связана гумусовыми кислотами в комплексах. Доля последних составляет от 40 до 62% общих растворенных форм, что способствует снижению детоксикации вод. По количеству закомплексованных гумусовым веществом ионов металлов в водах водохранилища их можно представить следующим убывающим рядом: Fe > Al > Cu > Ni > Cr > V > Zn > Pb > Co > Mn > Mg ≥ Ca > Cd. В целом качество исследуемых вод удовлетворительное. Однако повышенное (1.1 ПДКрх) содержание Pb2+ со стороны р. Гилюй, вероятно, связано с антропогенным (разработкой месторождений) источником поступления.
ВВЕДЕНИЕ
Проблемы качества поверхностных вод в пределах природных и природно-хозяйственных объектов становятся все более острыми. Особенно актуальна оценка экологического состояния поверхностных вод в связи с содержанием и динамикой в них металлов. Известно их негативное прямое воздействие на жизнедеятельность водных экосистем и опосредованное – на здоровье человека [15, 32]. Физиологическое действие металлов на биоту различно в зависимости от природы элемента, типа соединения, в котором он существует в природной среде, а также от его концентрации [6]. Часть металлов (Fe, Mn, Cu, Zn, Co, Mo) относится к числу важнейших “биометаллов”, необходимых для жизнедеятельности водной биоты [6, 26]. Однако такое выделение в определенной степени условно, так как перечисленные выше металлы при содержаниях >ПДК могут быть токсичными для живых организмов. К группе типичных металлов-токсикантов относят Hg, Cd, Pb, Sn, Ni, Cr, которые в определенных концентрациях и химических формах обладают мутагенными и канцерогенными свойствами [4].
Наличие растворенных форм металлов в поверхностных водах обусловлено как природными, так и техногенными источниками их поступления [11, 26]. Считается, что токсичны для биоты свободные (ионные) формы металлов и их соединения с неорганическими лигандами [5, 18, 21]. В то же время комплексообразование с лигандами гумусовой природы, к которым относятся гуминовые кислоты (ГК) и фульвокислоты (ФК) (в качестве обобщающего применяют термин “гумусовые кислоты” – ГФК), существенно и/или полностью снижает токсичность металлов [24, 28, 47]. Причина детоксикации связана со снижением химической и биологической активности металлов в подобных комплексных соединениях [38].
Зейское водохранилище – крупнейшее в Приамурье, оно создавалось в 1964–1985 гг. в ходе строительства ГЭС с целью зарегулирования р. Зеи и предотвращения паводков и катастрофических наводнений. Ему принадлежит третье место среди водохранилищ России по объему (68.4 км3), глубине (в нижней части до 100 м) и площади водосбора (83.8 тыс. км2) [25]. Речная сеть на водосборах водохранилища представлена 84 водотоками разной длины (от 10 до 545 км), из которых непосредственно в водоем впадают немногим более половины. Водосборная территория водохранилища характеризуется сложной тектонической структурой, преобладанием средне- и низкогорного рельефа, выходом к дневной поверхности магматических (гранитоиды, габбро, частично базальты) и метаморфических (кристаллические сланцы, гнейсы) пород [2, 13]. Почвенный покров в пределах водосбора водохранилища представлен преимущественно горными буротаежными (часто мерзлотными) почвами с характерной для них Al–Fe-гумусовой дифференциацией профиля [3]. Широко распространены заболоченные пространства, особенно на Верхнезейской равнине, в центре которой и расположен водоем. Заболоченность составляет в среднем 40%, а на водосборах некоторых рек (Дуткан, Темна и др.) до 70 и даже 90% [31].
На экологическое состояние поверхностных вод водосборной территории Зейского водохранилища оказывают влияние освоение и промышленная разработка горнорудных месторождений [7]. С 1986 г. ведомственная гидрохимическая лаборатория при Федеральном управлении эксплуатации Зейского водохранилища проводит систематические наблюдения за качеством воды в водоеме, в том числе за содержанием нормируемых металлов (Fe, Cu и др.). В настоящее время необходимо расширить перечень определяемых элементов, а также выявить особенности комплексообразования ГФК с ионами металлов, что крайне важно при оценке качества поверхностных вод.
Цель настоящей работы – изучение особенностей распределения растворенных форм металлов и металло-гумусовых комплексов (Me–ГФК) в водах Зейского водохранилища и оценка экологического состояния водоема. При этом водохранилище и его заливы рассматривали как единую водную систему.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
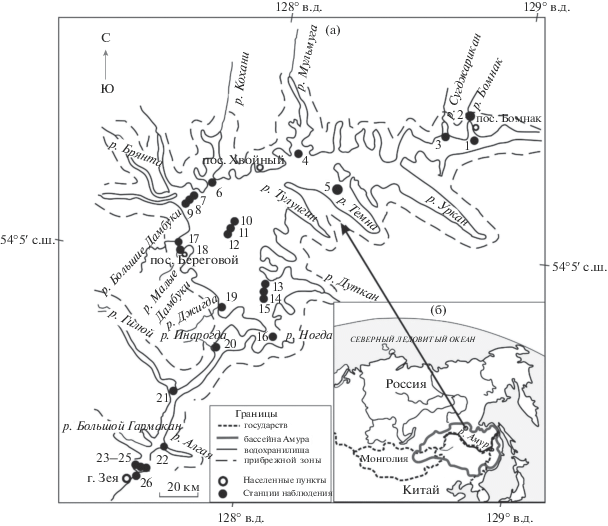
В основу работы положены результаты гидрохимических исследований вод Зейского водохранилища, его заливов, рек Бомнак и Зеи, проводившихся летом 2011 г. в период низкой воды. Отбор проб проводился с борта судна по акватории водохранилища от верхнего притока – р. Бомнак до р. Зеи в 500 м от плотины ГЭС ниже по течению (рис. 1). Воду отбирали как с поверхностных горизонтов (0.5 м от поверхности), так и с различных глубин (от 10 до 40 м) по [12]. Всего обследовано 26 станций.
Рис. 1.
Картосхема территории со станциями отбора проб воды (а), месторасположение Зейского водохранилища (б).
В пробах определяли цветность (Цв) воды, водородный показатель рН стандартными методами, принятыми в гидрохимии; взвешенные вещества (ВВ) гравиметрическим методом по [30]. Растворенный органический углерод Ср определяли в фильтрованной воде методом сухого сжигания на анализаторе углерода ТОС-ve (“Shimadzu”, Япония) в соответствии с [37]. Растворенные формы отделяли от взвешенных фильтрованием через ядерные фильтры с диаметром пор 0.45 мкм под вакуумом. ГФК выделяли на целлюлозных анионообменниках – диэтиламиноэтилцеллюлозе (ДЭАЭ-метод) [16]. Комплексы Me–ГФК извлекали непосредственно из вод (in situ). В качестве основной характеристики реакционной способности металлов в связывании с ГФК рассматривали условные (суммарные) константы устойчивости (lg К) соответствующих комплексов.
Изучали растворенные в воде формы металлов, наиболее распространенных в Приамурье и относящихся к разным классам опасности в соответствии с нормативами, принятыми для вод рыбохозяйственного использования [27]: Cd, Pb (2-й класс опасности); Zn, V, Cu, Co, Ni, Cr (3-й класс опасности); Fe, Al, Mn, Mg, Сa (4-й класс опасности). Природные воды фильтровали (размер пор 0.45 мкм) под вакуумом, переливали в контейнеры объемом 50 мл и подкисляли концентрированной HNO3 (очищенной методом изотермической перегонки) до рH 2. Хранили 2–4 сут и менее при температуре 2–5°С. Определяли металлы на масс-спектрометре “ICP-MS Elan DRC II” фирмы “PerkinElmer” (США) по [29] в Хабаровском инновационно-аналитическом центре при Институте тектоники и геофизики (ХИАЦ ИТиГ) им. Ю.А. Косыгина ДВО РАН. Для градуировки использовали многоэлементные стандартные растворы фирмы “PerkinElmer Pure Plus Multi-element Calibration Standard 3, 5”. Степень извлечения растворенных ионных форм проверялась экспериментально методом “введено-найдено” и составила 85–95%. Погрешность анализа при определении элементов в воде составляла 15–38% отн. Для извлечения из воды ГФК и элементов, связанных с ними, использовали метод концентрирования на диэтиламиноэтилцеллюлозе (ДЭАЭ-целлюлозе) в соответствии с методикой [16].
Статистическая обработка материала проводилась с применением общепринятых методик при помощи приложения Excel-2010, программного пакета “Statistica, Version 10” с учетом рекомендаций [9].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные характеристики содержания растворенных металлов в водах Зейского водохранилища, его придаточной системы, а также усредненные данные для рек мира представлены в табл. 1.
Таблица 1.
Содержание растворенных форм элементов в водах Зейского водохранилища, его заливов и рек Зеи, Бомнак (мкг/дм3, вдхр – водохранилище, прочерк – отсутствие данных)
| № станции | Место отбора, горизонт, глубина | Mg* | Ca* | Al | Fe | Mn | V | Cr | Co | Ni | Cu | Zn | Cd | Pb | рН | Ср, мг С/дм3 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | р. Бомнак, 1 км выше устья | 1.1 | 4.9 | 40 | 174 | 13.3 | 0.48 | 0.27 | 0.053 | 1.21 | 1.62 | 7.1 | 0.014 | 0.44 | 7.2 | 6.7 |
| 2 | р. Бомнак, устье | 0.9 | 4.7 | 54 | 325 | 15.4 | 0.63 | 0.28 | 0.056 | 1.09 | 1.80 | 7.9 | 0.016 | 0.49 | 7.1 | 6.8 |
| 3 | р. Сугджарикан | 0.9 | 3.8 | 76 | 368 | 19.3 | 0.82 | 0.26 | 0.062 | 0.70 | 1.08 | 8.1 | 0.019 | 0.34 | 6.8 | 7.6 |
| 4 | р. Мульмуга | 1.1 | 3.1 | 62 | 361 | 16.0 | 0.80 | 0.24 | 0.067 | 1.12 | 1.51 | 12.8 | 0.018 | 0.48 | 6.8 | 8.9 |
| 5 | р. Темна | 1.0 | 5.0 | 64 | 326 | 10.1 | 0.44 | 0.22 | 0.041 | 0.63 | 2.04 | 8.6 | 0.015 | 0.22 | 7.0 | 6.9 |
| 6 | р. Кохани | 1.0 | 4.0 | 63 | 341 | 18.8 | 0.64 | 0.37 | 0.071 | 0.90 | 1.24 | 9.3 | 0.015 | 0.32 | 7.0 | 7.5 |
| 7 | р. Брянта, поверхностный горизонт | 1.0 | 4.5 | 61 | 311 | 19.0 | 0.68 | 0.28 | 0.069 | 1.02 | 1.50 | 8.8 | 0.014 | 0.32 | 7.1 | 8.3 |
| 8 | 10 м | 1.0 | 4.8 | 63 | 372 | 15.8 | 0.71 | 0.20 | 0.069 | 0.87 | 1.92 | 9.1 | 0.013 | 0.35 | 7.0 | 7.8 |
| 9 | 20 м | 1.0 | 4.8 | 57 | 279 | 12.0 | 0.75 | 0.27 | 0.067 | 1.26 | 2.12 | 9.6 | 0.010 | 0.72 | 7.0 | 8.1 |
| 10 | вдхр, центральная часть, поверхностный горизонт | 1.1 | 4.3 | 63 | 183 | 14.0 | 0.69 | 0.32 | 0.059 | 1.38 | 2.12 | 14.1 | 0.017 | 0.28 | 7.0 | 9.5 |
| 11 | 20 м | 1.0 | 4.3 | 54 | 293 | 15.0 | 0.67 | 0.27 | 0.048 | 1.06 | 1.72 | 11.7 | 0.015 | 0.26 | 7.0 | 7.8 |
| 12 | 40 м | 1.0 | 4.2 | 54 | 230 | 15.8 | 0.59 | 0.26 | 0.052 | 0.94 | 1.96 | 9.8 | 0.012 | 0.44 | 7.2 | 7.5 |
| 13 | р. Дуткан, поверхностный горизонт | 1.0 | 3.0 | 62 | 332 | 18.5 | 0.44 | 0.20 | 0.055 | 0.64 | 2.62 | 9.6 | 0.015 | 0.23 | 6.7 | 6.5 |
| 14 | 20 м | 1.0 | 3.2 | 59 | 269 | 11.2 | 0.61 | 0.27 | 0.037 | 0.92 | 3.02 | 8.8 | 0.014 | 0.23 | 6.8 | 6.3 |
| 15 | 40 м | 1.0 | 3.1 | 45 | 279 | 12.7 | 0.51 | 0.25 | 0.033 | 0.52 | 1.79 | 7.4 | 0.013 | 0.24 | 6.8 | 7.9 |
| 16 | р. Ногда | 1.1 | 4.7 | 67 | 264 | 12.9 | 0.70 | 0.30 | 0.049 | 1.09 | 1.81 | 8.3 | 0.015 | 0.28 | 7.1 | 8.1 |
| 17 | р. Большие Дамбуки | 1.0 | 4.3 | 75 | 322 | 12.4 | 0.80 | 0.29 | 0.068 | 1.15 | 2.20 | 8.7 | 0.016 | 5.01 | 7.2 | 9.0 |
| 18 | р. Малые Дамбуки | 1.0 | 4.8 | 74 | 294 | 15.2 | 0.67 | 0.29 | 0.063 | 1.56 | 1.50 | 8.0 | 0.015 | 0.45 | 6.9 | 8.0 |
| 19 | р. Джигда | 0.9 | 4.4 | 55 | 277 | 12.4 | 0.75 | 0.22 | 0.052 | 1.13 | 3.30 | 6.7 | 0.013 | 0.26 | 7.0 | 9.1 |
| 20 | р. Инарогда | 1.0 | 4.9 | 80 | 173 | 11.8 | 0.72 | 0.27 | 0.058 | 1.04 | 2.46 | 8.8 | 0.019 | 0.28 | 7.0 | 9.5 |
| 21 | р. Гилюй | 1.0 | 3.9 | 78 | 313 | 15.1 | 0.68 | 0.28 | 0.078 | 1.52 | 1.86 | 8.9 | 0.024 | 6.53 | 7.0 | 10.9 |
| 22 | Р. Алгая | 1.0 | 4.2 | 62 | 287 | 12.2 | 0.73 | 0.28 | 0.050 | 0.93 | 3.52 | 10.0 | 0.013 | 0.55 | 6.8 | 9.5 |
| 23–25 | вдхр, приплотинная часть | 1.0 ± ± 0.1 | 3.5 ± ± 0.5 |
63 ± ± 2 | 311 ± ± 21 |
13.1 ± ± 1.8 |
0.52 ± ± 0.08 |
0.27 ± ± 0.06 |
0.067 ± ± 0.015 |
0.95 ± ± 0.1 |
2.70 ± ± 0.5 |
8.9 ± ± 0.7 |
0.019 ± ± 0.003 |
0.56 ± ± 0.12 |
7.0 ± ± 0.2 | 9.8 ± ± 1.2 |
| 26 | р. Зея, 500 м ниже плотины ГЭС | 0.9 | 4.1 | 58 | 301 | 14.9 | 0.48 | 0.23 | 0.088 | 0.81 | 2.72 | 8.7 | 0.018 | 0.49 | 7.1 | 7.5 |
| Среднее для рек мира [39] | 3.1 | 13.3 | 32 | 66 | 34 | 0.71 | 0.7 | 0.148 | 0.801 | 48 | 0.60 | 0.08 | 0.079 | – | – | |
| ПДКрх | 40 | 180 | 40 | 100 | 10 | 1 | 20** | 10 | 10 | 1 | 10 | 5 | 6 | – | – |
Основные макрокомпоненты в водах – ионы щелочноземельных металлов Ca2+ и Mg2+. Согласно классификации О.А. Алекина [1], исследуемые воды относятся к кальциевой группе гидрокарбонатного класса, что характерно для большинства поверхностных вод бассейна Амура [36]. Главные источники названных макрокомпонентов – карбонатные породы (известняки, доломиты и др.) и продукты их выветривания на территории водосбора водохранилища [10]. Несмотря на то, что воды характеризовались высоким содержанием Ca2+ и Mg2+, наличие комплексов Ca–Mg–ГФК в них невысокое – в целом ~7% валовых растворенных форм (табл. 2). В условиях природных вод ионы Ca2+ и Mg2+ не подвергаются гидролизу и практически не способны к реакциям комплексообразования с лигандами, что связано как с их строением (большим ионным радиусом), так и с низкими константами устойчивости с ГФК (табл. 3). Невысокая закомплексованность Ca2+ и Mg2+ веществами гумусовой природы характерна для поверхностных вод всего бассейна Амура, дренирующих разные природные зоны (от степных до таежных ландшафтов) [44].
Таблица 2.
Распределение металло-гумусовых комплексов (мкг/дм3) и их доли (%) в растворенных формах элементов в водах Зейского водохранилища, его заливов и рек Зеи, Бомнак (в скобках – номер станции; верхняя строка – Me–ГФК, нижняя – доля, % Me–ГФК в элементе; вдхр – водохрпнилище)
| Место отбора | Mg | Ca | Al | Fe | Mn | V | Cr | Co | Ni | Cu | Zn | Cd | Pb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| р. Бомнак 1 км выше устья (1) | 37 | 141 | 21 | 95 | 3.7 | 0.19 | 0.12 | 0.015 | 0.58 | 0.79 | 2.4 | 0.001 | 0.16 |
| 3.4 | 2.9 | 52.5 | 54.6 | 27.8 | 39.6 | 44.4 | 28.3 | 47.9 | 48.7 | 33.8 | 7.1 | 36.4 | |
| устье (2) | 17 | 88 | 28 | 167 | 4.5 | 0.25 | 0.13 | 0.017 | 0.52 | 0.91 | 2.7 | 0.001 | 0.19 |
| 1.9 | 1.9 | 51.9 | 52.1 | 29.2 | 39.7 | 46.4 | 30.4 | 47.7 | 50.5 | 34.2 | 6.2 | 38.8 | |
| р. Сугджарикан (3) | 29 | 110 | 39 | 199 | 5.3 | 0.33 | 0.12 | 0.017 | 0.32 | 0.54 | 3.1 | 0.002 | 0.13 |
| 3.2 | 3.0 | 51.3 | 54.1 | 27.5 | 40.2 | 46.1 | 27.4 | 44.9 | 50.0 | 38.3 | 10.5 | 38.2 | |
| р. Мульмуга (4) | 36 | 94 | 32 | 196 | 4.5 | 0.33 | 0.11 | 0.020 | 0.50 | 0.76 | 5.5 | 0.001 | 0.20 |
| 3.3 | 3.0 | 51.6 | 54.2 | 28.1 | 41.0 | 45.8 | 29.8 | 44.6 | 50.3 | 42.2 | 5.5 | 41.7 | |
| р. Темна (5) | 28 | 125 | 33 | 174 | 2.7 | 0.19 | 0.11 | 0.012 | 0.26 | 1.07 | 3.6 | 0.001 | 0.09 |
| 2.9 | 2.5 | 51.6 | 53.4 | 26.7 | 43.2 | 50.0 | 29.3 | 41.3 | 52.5 | 41.9 | 6.7 | 40.9 | |
| р. Кохани (6) | 25 | 92 | 31 | 175 | 5.6 | 0.26 | 0.17 | 0.021 | 0.41 | 0.61 | 3.8 | <0.001 | 0.13 |
| 2.5 | 2.3 | 49.2 | 51.2 | 29.8 | 40.6 | 45.9 | 29.6 | 45.6 | 49.2 | 40.9 | Не обн. | 40.6 | |
| р. Брянта, поверхностный горизонт (7) | 45 | 149 | 29 | 159 | 5.7 | 0.28 | 0.13 | 0.020 | 0.50 | 0.74 | 3.7 | 0.001 | 0.13 |
| 4.5 | 3.1 | 47.5 | 51.1 | 30.0 | 40.8 | 46.4 | 30.0 | 49.0 | 49.3 | 42.0 | 7.1 | 40.6 | |
| 10 м (8) | 35 | 139 | 32 | 213 | 5.3 | 0.30 | 0.09 | 0.022 | 0.42 | 0.99 | 4.0 | 0.001 | 0.14 |
| 3.5 | 2.9 | 50.8 | 57.2 | 33.5 | 42.2 | 45.0 | 31.9 | 48.3 | 51.6 | 43.8 | 6.9 | 40.0 | |
| 20 м (9) | 52 | 149 | 29 | 158 | 3.2 | 0.33 | 0.14 | 0.019 | 0.59 | 1.08 | 3.9 | 0.001 | 0.28 |
| 5.2 | 3.1 | 50.9 | 56.4 | 32.1 | 44.0 | 51.7 | 28.3 | 47.2 | 50.8 | 40.2 | 10.0 | 38.9 | |
| вдхр, центральная часть, поверхностный горизонт (10) | 35 | 95 | 32 | 103 | 4.4 | 0.30 | 0.16 | 0.019 | 0.62 | 1.07 | 6.0 | 0.002 | 0.12 |
| 3.2 | 2.2 | 50.8 | 56.7 | 31.4 | 43.2 | 49.7 | 32.2 | 44.9 | 50.5 | 42.7 | 11.8 | 42.9 | |
| 20 м (11) | 38 | 98 | 31 | 176 | 5.1 | 0.32 | 0.15 | 0.016 | 0.52 | 0.92 | 5.1 | 0.002 | 0.11 |
| 3.8 | 2.3 | 57.4 | 60.1 | 34.0 | 47.8 | 55.6 | 33.3 | 49.1 | 53.5 | 43.6 | 13.3 | 42.3 | |
| 40 м (12) | 35 | 96 | 29 | 132 | 5.3 | 0.27 | 0.13 | 0.016 | 0.46 | 1.03 | 4.1 | 0.001 | 0.18 |
| 3.5 | 2.3 | 53.7 | 57.4 | 33.5 | 45.1 | 50.0 | 30.8 | 48.9 | 52.5 | 41.7 | 8.3 | 40.9 | |
| р. Дуткан, поверхностный горизонт (13) | 34 | 96 | 34 | 190 | 5.5 | 0.20 | 0.09 | 0.019 | 0.27 | 1.32 | 3.8 | 0.001 | 0.09 |
| 3.4 | 3.2 | 54.8 | 57.2 | 29.7 | 45.5 | 45.0 | 34.5 | 42.2 | 50.4 | 39.6 | 6.7 | 39.1 | |
| 20 м (14) | 38 | 116 | 32 | 163 | 3.4 | 0.27 | 0.14 | 0.013 | 0.38 | 1.63 | 3.8 | 0.002 | 0.09 |
| 3.8 | 3.6 | 54.2 | 60.8 | 30.3 | 44.3 | 51.8 | 35.1 | 41.0 | 54.0 | 43.2 | 14.2 | 39.1 | |
| 40 м (15) | 36 | 105 | 23 | 169 | 3.8 | 0.23 | 0.12 | 0.011 | 0.27 | 0.94 | 3.2 | 0.001 | 0.11 |
| 3.6 | 3.4 | 51.1 | 58.4 | 29.9 | 45.1 | 48.0 | 33.3 | 51.9 | 52.5 | 43.2 | 6.9 | 45.8 | |
| р. Ногда (16) | 40 | 144 | 34 | 160 | 4.2 | 0.30 | 0.14 | 0.016 | 0.59 | 0.90 | 3.7 | 0.002 | 0.10 |
| 3.6 | 3.1 | 50.7 | 60.6 | 32.6 | 42.9 | 46.7 | 32.7 | 53.0 | 49.7 | 44.6 | 13.3 | 35.7 | |
| р. Большие Дамбуки (17) | 36 | 106 | 36 | 161 | 4.0 | 0.26 | 0.13 | 0.022 | 0.56 | 1.08 | 2.6 | 0.001 | 1.60 |
| 3.6 | 2.5 | 48.0 | 50.0 | 32.3 | 32.5 | 44.8 | 32.4 | 48.7 | 49.1 | 29.9 | 6.3 | 31.9 | |
| р. Малые Дамбуки (18) | 34 | 145 | 34 | 151 | 4.0 | 0.28 | 0.13 | 0.020 | 0.71 | 0.71 | 2.4 | 0.001 | 0.17 |
| 3.4 | 3.0 | 45.9 | 51.7 | 33.9 | 41.8 | 44.8 | 31.4 | 45.5 | 47.3 | 30.0 | 6.7 | 37.8 | |
| р. Джигда (19) | 33 | 154 | 28 | 141 | 3.8 | 0.34 | 0.10 | 0.017 | 0.54 | 1.62 | 2.6 | 0.001 | 0.09 |
| 3.7 | 3.5 | 50.9 | 50.8 | 34.4 | 45.3 | 45.5 | 32.7 | 48.3 | 49.1 | 38.8 | 7.7 | 34.6 | |
| р. Инарогда (20) | 40 | 144 | 34 | 93.4 | 4.2 | 0.30 | 0.13 | 0.016 | 0.49 | 1.31 | 3.9 | 0.002 | 0.10 |
| 4.0 | 2.9 | 42.5 | 54.6 | 32.8 | 41.7 | 48.1 | 27.6 | 47.3 | 53.3 | 44.3 | 10.5 | 35.7 | |
| р. Гилюй (21) | 39 | 154 | 37 | 158 | 4.3 | 0.27 | 0.12 | 0.023 | 0.48 | 0.90 | 2.8 | 0.002 | 2.14 |
| 3.9 | 3.9 | 47.4 | 50.5 | 28.4 | 39.7 | 42.9 | 29.5 | 31.6 | 48.4 | 31.5 | 8.3 | 32.8 | |
| р. Алгая (22) | 32 | 144 | 36 | 178 | 3.7 | 0.33 | 0.13 | 0.017 | 0.33 | 2.01 | 4.7 | 0.002 | 0.23 |
| 3.2 | 3.4 | 58.1 | 62.3 | 30.1 | 45.3 | 46.4 | 34.0 | 35.5 | 57.1 | 47.0 | 15.4 | 42.8 | |
| вдхр., приплотинная часть | 33 ± 3 | 110 ± 5 | 34 ± 1 | 165 ± 19 | 4.13 ± 0.5 | 0.23 ± 0.02 | 0.14 ± 0.02 | 0.020 ± 0.003 | 0.46 ± 0.07 | 1.44 ± 0.13 | 4.2 ± 0.2 | 0.002 | 0.24 ± 0.01 |
| (23–25) | 3.3 ± 0.3 | 3.1 ± 0.1 | 54.0 ± 1.6 | 55.7 ± 1.7 | 31.1 ± 0.8 | 44.2 ± 1.2 | 48.6 ± 1.9 | 29.9 ± 1.0 | 48.4 ± 0.8 | 53.8 ± 1.9 | 47.4 ± 0.6 | 10.5 | 42.6 ± 1.1 |
| р. Зея 500 м ниже плотины ГЭС (26) | 40 | 151 | 30 | 165.9 | 4.4 | 0.21 | 0.10 | 0.028 | 0.37 | 1.40 | 3.15 | 0.002 | 0.17 |
| 4.4 | 3.7 | 51.7 | 55.1 | 29.5 | 43.8 | 45.8 | 31.8 | 45.7 | 51.3 | 47.2 | 11.1 | 36.3 |
Таблица 3.
Логарифмы условных констант устойчивости (lg К) комплексных соединений ионов металлов с гумусовыми веществами природных вод (по литературным данным)
| Ионы металла | рH | Лиганд | lg К | Метод определения | Литературный источник |
|---|---|---|---|---|---|
| Сa2+ | 5.0 | ФК | 3.0 | pH-потенциометрия | [5] |
| 5.0 | ФК | 3.1 | То же | [50] | |
| Mg2+ | 8.0 | ГК | 3.26 | Гель-хроматография | [46] |
| 5.0 | ФК | 2.71 | рН-хроматография | [50] | |
| Fe2+ | 7.0 | ФК | 4.6 | Гель-хроматография | [6] |
| Fe3+ | 6.8 | ФК | 7.15 | То же | [6] |
| Mn2+ | 8.0 | ФК | 4.45 | То же | [46] |
| Cu2+ | 7.0 | ГК | 6.0 | Анодная вольтамперометрия с накоплением | [46] |
| 8.0 | ФК | 8.4 | Гель-хроматография | [46] | |
| 7.5 | ФК | 5.7 | То же | [6] | |
| Al3+ | 3.0 | ФК | 4.9 | Ионный метод, потенциометрическое титрование | [41] |
| 4.0 | ФК | 5.2 | |||
| Zn2+ | 5.0 | ФК | 3.54 | Ионный метод, потенциометрическое титрование | [50] |
| 6.8 | ГК | 5.0 | Ультрафильтрация | [40] | |
| 8.0 | ФК | 5.36 | Гель-фильтрация на нейтральных сефадексах | [46] | |
| Ni2+ | 5.0 | ФК | 3.81 | рН-хроматография | [50] |
| 8.0 | ГК | 5.14 | Гель-хроматография | [46] | |
| Co2+ | 7.6 | ФК | 6.97 | Ультрафильтрация, равновесный диализ | [42] |
| 8.0 | ГК | 4.67 | Гель-хроматография на нейтральных сефадексах | [46] | |
| 8.0 | ФК | 4.90 | То же | [46] | |
| V4+ | 5.0 | ФK | 5.6 | Электронный парамагнитный резонанс, гель-хроматография | [52] |
| Pb2+ | 6.0 | ФК | 5.0 | Ионообменная хроматография | [5] |
| Cd2+ | 4.0–8.0 | ФК | 3.15–4.08 | Ионометрия, диализ | [49] |
Содержание растворенного Al в водах менялось от 40 до 80 мкг/дм3, что превышало средние показатели рек мира в 1.2–2.5 раза. Однако такие концентрации, по мнению авторов [34, 35], типичны для рек бассейна Среднего Амура. Повышенные концентрации растворенного Al в водах Зейского водохранилища соответствуют высокому содержанию Al2O3 в продуктах выветривания горных пород и почвах [2, 14]. Важным источником растворенного Al в поверхностных водах следует считать миграцию Al–Fe-гумусовых соединений из почв горно-таежного и тундрового поясов [3]. Поэтому количество комплексов Al–ГФК в водах высокое и составляет 42.5–58.1% валовых растворенных форм. Высокая степень связывания в анионные комплексы ионов Al3+ с ГФК определена, в частности, в водах Киевского водохранилища (лесная зона) – 68–82% валовых растворенных форм [21].
Один из наиболее распространенных биогенных элементов на Земле, участвующих в круговороте органического вещества (ОВ) биосферы, – Fe. Результаты показали, что содержание растворенного Fe в водах водохранилища было довольно высокое (≥300 мкг/дм3). Это в 2.3–5.7 раза выше показателей для рек мира и в 1.5–3.7 раз превышает ПДКрх [27]. Предыдущие исследования [44] показали, что концентрация растворенного Fe в водах р. Зеи в ее среднем течении в летний меженный период составляла 248 мкг/дм3, более высокие показатели – до 800 мкг/дм3 – определены для ее левобережного притока – р. Граматухи. Это свидетельствует об активном выносе растворенного Fe с водосборной территории р. Зеи. Для сравнения, в водах крупного правобережного притока Амура – р. Сунгари (полностью протекает по территории Китая) 98% Fe выносится во взвешенной форме [44].
Высокое содержание Fe в водах водохранилища обусловлено несколькими причинами. Одна из них связана с высокой железорудной минерализацией территории. Так, в бассейнах рек Брянты, Бомнак, Дамбуки, питающих водохранилище, выявлены обширные железорудные районы с серно-колчеданными и железо-титановыми оруденениями [7]. В тех или иных количествах и формах Fe постоянно присутствует во всех аккумулятивных образованиях в долинах рек и почвенном покрове гор на территории бассейна Амура. Другой важнейший источник растворенного Fe и его комплексов гумусовой природы в водах – уже упомянутая Al–Fe-гумусовая миграция из почв горного пояса [3]. Большая часть растворенного Fe в исследуемых водах находится в форме комплексов Fe–ГФК (до 62.3%), более устойчивых по сравнению с ионными формами и менее доступных для биоты. Миграция Fe в системе водохранилища происходит в условиях низкой минерализациеи вод, преимущественно слабокислой и нейтральной реакции среды (рН 6.5–7.2), повышенного содержания Ср (до 10.9 мг С/дм3) с высокой долей ГФК (50–70% от Ср). Цв вод по акватории водоема менялась от 70 до 125 град. В водоем постоянно выносятся воды с больших массивов торфяных верховых болот, особенно с левобережными притоками (реки Дуткан, Алгая), которые и являются здесь основным источником гумусовых веществ [45]. Они и обусловливают максимальную Цв вод [19]. Следует отметить, что в ландшафтах, богатых современными органогенными отложениями, интенсивность миграции Fe в поверхностных водах достаточно велика – коэффициент его водной миграции KFe = 2.8 [33]. Выявлена положительная корреляционная связь (r = 0.52, p < 0.05, n = 24) между содержанием Fe (в комплексах Fe–ГФК) и Цв вод водоема.
В вертикальном распределении Fe, особенно в центральной части водохранилища, выявлено увеличение концентраций с глубиной, где преимущественно и происходит формирование водного гумуса. Здесь на глубине 20–40 м установлена концентрация Fe в ~2 раза выше, чем в поверхностных водах. В предыдущие годы исследователями [23] выявлено увеличение валовых концентраций металлов с глубиной водохранилища. Однако придонные воды, к сожалению, авторами статьи не изучались. В целом воды характеризовались невысокими концентрациями ВВ в воде, которые менялись от 7.5 до 23.3 мг/дм3. Минимальные показатели отмечены для левобережных заливов Дуткан, Ногда, формирующихся под воздействием вод, поступающих с заболоченных территорий. Более высокие показатели выявлены в водах заливов Бомнак, Суджарикан, Гилюй, что не исключает привноса взвеси в результате проводимых изыскательских работ на водосборах этих рек.
Наряду с Fe Mn – наиболее распространенный элемент в поверхностных и подземных водах Приамурья [17]. В целом содержание растворенного Mn в водах Зейского водохранилища не превысило средних концентраций элемента для рек мира, но было выше ПДКрх в 1.1–1.9 раза. Наличие Mn в воде обусловлено высокой марганцево-железистой минерализацией территории водосборов. Более низкие, по сравнению с Fe, концентрации Mn в водах объясняются невысокой его миграционной способностью (KMn – 0.25–1.0) [33].
Содержание комплексов Mn–ГФК в воде невысокое, всего 27–34.4% валовых растворенных форм элемента. Вероятно, большая часть растворенного Mn представлена в виде свободных ионов и/или в составе карбонатных и гидрокарбонатных комплексов. В целом для поверхностных вод бассейна Амура процессы комплексообразования ГФК с ионами Mn2+ не доминируют [20]. Исследователи [22] также указывают на невысокую (24–27%) закомплексованность данного металла ГФК.
Растворенные формы Pb в исследуемых водах имеют наиболее вариабельные показатели – от 0.22 до 6.53 мкг/дм3. Будучи токсичными для живых организмов соединения Pb2+ нарушают обмен веществ и выступают ингибиторами ферментов [15]. Максимальные показатели содержания растворенного Pb определены для вод залива р. Гилюй. Они превысили в 1.1 раза ПДКрх, что, вероятно, связано с разработкой месторождений полиметаллов на территории бассейна этой реки (Усть-Гилюйский массив) [7]. Немного меньше (на 6%) концентрации Pb были в воде залива р. Большие Дамбуки, что также связано с горнорудными разработками на территории ее бассейна.
Степень закомплексованности ионов Pb2+ природными гумусовыми веществами в водах водохранилища менялась в диапазоне от 31.9 до 45.8% общих растворенных форм. Литературные данные о связывании ионов Pb2+ лигандами гумусовой природы весьма противоречивы. Одни авторы считают, что комплексы Pb–ГФК весьма устойчивы и сравнимы с соответствующими комплексами Cu2+ [40, 51]. Другие считают, что комплексы Pb2+ с “водным гумусом”, напротив, уступают комплексообразованию Hg2+, Cu2+, Ni2+ и Zn2+ [48]. В целом в пресных поверхностных водах Pb на 90–98% существует в составе взвесей, что связано с его родством с природными адсорбентами (гидроксиды металлов, глинистые минералы и др.) [22].
Cu – один из важных микроэлементов в природных средах. Cu может иметь различную валентность, однако для поверхностных вод характерна степень окисления +2. Концентрация валовой растворенной Cu в исследуемых водах в целом достаточно высокая – до 3.52 мкг/дм3, что в 2.4 раза выше средних показателей для рек мира и в 3.5 раза выше ПДКрх. Повышенные концентрации Cu в воде связаны с наличием и разработкой многочисленных месторождений комплексных золото-медно-молибденовых, медно-железных и медно-никелевых руд [7].
Комплексы Cu–ГФК в исследуемых водах присутствуют в значительных количествах и составляют 48.4–57.1% валовых растворенных форм. В целом для поверхностных вод бассейна Амура характерно высокое содержание растворенных форм Cu и ее хелатных комплексов [20]. Даже в водах правого притока Амура – р. Сунгари, водосбор которой существенно преобразован в результате антропогенного воздействия, комплексы Cu–ГФК составляли 56% общих растворимых форм элемента. Следует отметить, что комплексные соединения ГФК с Cu2+ имеют более высокие log К по сравнению с другими ионами и лишь немногим уступают Fe3+. В частности, в поверхностных водах Каневского водохранилища, оз. Люцимир (Украина), принадлежащих разным природным зонам, выявлено значительное количество комплексов ионов Cu2+ с ФК и особенно с ГК [21].
В исследуемых водах содержание растворенного Zn менялось в широком диапазоне – от 6.7 до 14.1 мкг/дм3, что более чем на порядок выше средних концентраций элемента для рек мира и незначительно превышает ПДКрх для вод некоторых станций наблюдений. Повышенные показатели обусловлены наличием на территории бассейна Зеи значительного количества свинцово-цинковых рудопроявлений [7]. Содержание комплексов Zn–ГФК в водах менялось в диапазоне 29.9–47.4% общего растворенного Zn. Единого мнения о комплексообразовании ГФК с ионами Zn2+ нет. Однако авторы [46] считают, что Zn2+ образует с высокомолекулярными ОВ гумусовой природы устойчивые хелатные комплексы, уступающие лишь ионам Hg2+, Сu2+ и Ni2+. Проведенные ранее исследования также показали высокую степень связывания ионов Zn2+ с ГФК в водах рек, дренирующих различные природные зоны бассейна Амура [43].
Установлено, что содержание валового растворенного Ni в изучаемых водах в целом невысокое (до 1.56 мкг/дм3) и близко к содержаниям этого элемента в реках мира. В поверхностные воды Ni поступает из породообразующих минералов основных пород, вторичных минералов современной коры выветривания и почв [10]. Ni входит в состав медно-никелевых руд Брянтинского, Верхнезейского, Дамбукинского и других рудных районов, расположенных вдоль западного побережья Зейского водохранилища. В поверхностных водах 94.5% его переносятся во взвешенном состоянии [11]. Количество комплексов Ni–ГФК в исследуемых водах варьировало от 31.6 до 53.0% общих растворенных форм этого элемента. Невысокую закомплексованность Ni2+ авторы [22] объясняют конкурентным связыванием ФК с ионами Fe3+ и Cu2+.
Как и Ni, Сo – токсичный металл как для человека, так и для водной биоты. Содержание общего растворенного Сo в исследуемых водах в целом невысокое и менялось от 0.033 до 0.088 мкг/дм3, что ниже средних содержаний для рек мира. Степень закомплексованности ионов Co2+ лигандами гумусовой природы в целом невысокая – 27.4–35.1% общего растворенного Сo2+ и близка к таковой для ионов Mn2+ [20].
Валовое содержание растворенного Cr в исследуемых водах невысокое – 0.20–0.37 мкг/дм3, что в ≥2 раза ниже средних показателей для рек мира. Считается, что Cr в поверхностных водах переносится преимущественно во взвешенных формах. Несмотря на невысокие количественные характеристики, содержание комплексов Cr–ГФК в воде достаточно высокое и составило 42.9–55.6% валовых растворенных форм элемента. Исследования в предыдущие годы показали также высокую (43% общих растворенных форм элемента) закомплексованность данного элемента ГФК не только в водах таежных рек, но также в водах с низкой Цв лесостепных ландшафтов бассейна Верхнего Амура [43].
Несмотря на то, что V относится к рассеянным элементам и в природе в свободном виде не встречается, его соединения высокотоксичны для биоты [8], что обусловливает необходимость контроля его содержания в природных средах. Присутствие данного элемента в воде обусловлено наличием его в пироксенах и магнетитах, широко распространенных в Приамурье [7]. Содержание валового растворенного V в водах менялось от 0.44 до 0.82 мкг/дм3, что близко к средней концентрации элемента в реках мира и <ПДКрх. Количество комплексов V–ГФК в воде составляло 32.5–45.5% общего растворенного V, что подтверждает ранее полученные результаты о достаточно высокой степени его комплексообразования с ГФК [20].
Весьма токсичный металл для окружающей среды – Cd. В поверхностных водах он мигрирует преимущественно в растворенном состоянии и для него характерна степень окисления +2. Концентрации валового растворенного Cd в изучаемых водах очень низкие – от 0.010 до 0.024 мкг/дм3, что существенно ниже средних показателей для рек мира. Его поступление в поверхностные воды в основном связано с выщелачиванием из полиметаллических руд, привносом из почв и рудных отвалов в результате разработки месторождений. При этом содержание комплексов Cd–ГФК в водах невысокое (до 15.4% валовых растворенных форм элемента) или они вовсе не обнаружены. Полученные результаты еще раз подтверждают, что Cd не свойственны процессы комплексообразования с ГФК [20]. Вероятно, среди его растворенных форм доминируют ионные формы или комплексы с неорганическими лигандами.
ВЫВОДЫ
Установлено, что воды Зейского водохранилища содержат растворенные формы металлов и их металло-гумусовые комплексы преимущественно в повышенных концентрациях, что связано с их миграцией с заболоченных территорий и горно-таежных почв водоразделов, а также с широким развитием на водосборной территории железорудной и полиметаллической минерализации горных пород. В целом, в водах водохранилища и его придаточной системы проявляется устойчивая закономерность связывания металлов в комплексы с ГФК, которая может быть представлена следующим рядом: Fe > Al > Cu > Ni > Cr > V > > Zn > Pb > Сo > Mn > Mg ≥ Ca > Cd.
Авторы выражают благодарность Н.В. Бердникову, А.В. Штаревой (ХИАЦ ИТиГ ДВО РАН) за помощь в определении элементов в поверхностных водах; С.Ю. Игнатенко, Е.Н. Игнатенко (Зейский государственный природный заповедник) и сотрудникам аналитической лаборатории при Зейском водохранилище за помощь при сборе полевого материала.
Список литературы
Алекин О.А. Основы гидрохимии. Л.: Гидрометеоиздат, 1970. 444 с.
Амурская область: опыт энциклопедического словаря / Под ред. В.В. Воробьева, А.П. Деревянко. Благовещенск: Амурское отд. Хабаровского кн. из-ва, 1989. 416 с.
Ананко Т.В., Фридланд В.М. О формировании горных бурых лесных почв, буротаежных почв и подбуров хребта Тукурингра // Почвоведение. 1983. № 10. С. 20–32.
Бингам Ф.Т., Коста М., Эйхенбергер Э. и др. Некоторые вопросы токсичности ионов металлов / Под ред. Х. Зигеля, А. Зигеля. М.: Мир, 1993. 368 с. Пер. с англ.
Варшал Г. М. Формы миграции фульвокислот и металлов в природных водах. Автореф. дис. … докт. хим. наук. М.: ГЕОХИ РАН, 1994.
Варшал Г.М., Велюханова Т.К., Кощеева И.Я., Дорофеева В.А., Баучидзе Н.С., Касимова О.Г., Махарадзе Г.А. Изучение химических форм элементов в поверхностных водах // Журн. аналит. химии. 1983. Т. 38. № 9. С. 1590–1600.
Васильев И.А., Капанин В.П., Ковтонюк Г.П., Мельников В.Д., Лужнов В.Л., Данилов А.П., Сорокин А.П. // Минерально-сырьевая база Амурской области на рубеже веков / Отв. ред. И.А. Васильев. Благовещенск: Зея, 2000. 168 с.
Воробьева Н.М., Федорова Е.В., Баранова Н.И. Ванадий: биологическая роль, токсикология и фармакологическое применение // Биосфера. Фонд научных исследований ХХI века. 2013. Т 5. № 1. С 77–81.
Вуколов Э.А. Основы статистического анализа. Практикум по статистическим методам и исследованию операций с использованием пакетов STATISTICA и EXCEL. М: Форум, 2008. 464 с.
Геодинамика, магматизм и металлогения Востока России. Кн. 1 / Под ред. А.И. Ханчука. Владивосток: Дальнаука, 2006. 572 с.
Гордеев В.В. Геохимия системы река-море: монография. М.: ИП Матушкина И.И., 2012. 452 с.
ГОСТ 31861−2012. Вода. Общие требования к отбору проб. М.: Стандартинформ, 2013.
Государственная геологическая карта Российской Федерации. 1 : 200 000. Сер. Становая. Лист N-52-XIV (Береговой) / Под ред. Ю.В. Кошкова. СПб.: ВСЕГЕИ, 2008.
Ершов Ю.И. Закономерности почвообразования и выветривания в зоне перехода от Евразийского континента к Тихому океану. М.: Наука, 1984. 282 с.
Иванов В.В. Экологическая геохимия элементов. М.: Недра, 1994. Кн. 1. 340 с.
Красюков В.Н., Лапин И.А. Способ определения гумусовых веществ в природных водах. А. с. 1 385 041. БИ. 1988. № 12. С. 175.
Кулаков В.В., Кондратьева Л.М., Голубева Е.М. Геологические и биогеохимические предпосылки повышенного содержания железа и марганца в воде р. Амур // Тихоокеан. геология. 2010. Т. 29. № 6. С. 66–76.
Лапин И.А., Красюков В.Н. Роль гумусовых веществ в процессах комплексообразования и миграции металлов в природных водах // Вод. ресурсы. 1986. № 1. С. 134–145.
Левшина С.И. Растворенное и взвешенное органическое вещество вод Амура и Сунгари // Вод. ресурсы. 2008. Т. 35. № 6. С. 745–753.
Левшина С.И. Роль гумусовых кислот в миграции металлов в речных водах Приамурья // Вод. ресурсы. 2015. Т. 42. № 6. С. 635–646.
Линник П.Н., Жежеря В.А., Линник Р.П., Иванченко Я.С. Влияние компонентного состава органических веществ на соотношение растворенных форм металлов в поверхностных водах // Гидробиол. журн. 2012. Т. 48. № 5. С. 97–114.
Линник П.Н., Набиванец Б.И. Формы миграции металлов в пресных поверхностных водах. Л.: Гидрометеоиздат, 1986. 269 с.
Лопатко А.С., Карандашов А.И., Юдина И.М., Пискунов Ю.Г. Состав воды Зейского водохранилища спустя 30 лет с начала его заполнения // Материалы всерос. науч.-практ. конф. “Научные основы мониторинга водохранилищ” (Дружининские чтения. Вып. 2). Хабаровск: ИВЭП ДВО РАН, 2005. С. 69–71.
Моисеенко Т.И. Кудрявцева Л.П., Гашкина Н.А. Рассеянные элементы в поверхностных водах суши. М.: Наука, 2006. 261 с.
Мордовин А.М., Петров E.С., Шестеркин В.П. Гидроклиматология и гидрохимия Зейского водохранилища. Владивосток; Хабаровск, 1997. 138 с.
Мур Дж. В., Рамамурти С. Тяжелые металлы в природных водах. М.: Мир, 1987. 288 с.
Перечень рыбохозяйственных нормативов: предельно допустимых концентраций (ПДК) и ориентировочно безопасных уровней воздействия (ОБУВ) вредных веществ для воды водных объектов, имеющих рыбохозяйственное значение. М.: ВНРИРО, 2010. 304 с.
Перминова И.В. Анализ, классификация и прогноз свойств гумусовых кислот. Дис. … докт. хим. наук. М.: МГУ, 2000. 360 с.
ПНД Ф 14.1.2:4.143-98 Количественный химический анализ вод. Методика выполнения измерений массовых концентраций алюминия, бария, бора, железа, кобальта, марганца, меди, никеля, стронция, титана, хрома и цинка в пробах питьевых и сточных вод методом ИСП Спектрофотометрии М.: Аналит. центр “Росса”, 2019. 26 с.
РД 52.24.468-2005 Взвешенные вещества и общее содержание примесей в водах. Методика выполнения измерений массовой концентрации гравиметрическим методом / Разработчики Л.В. Боева, А.А. Назарова. Ростов-на-Дону: Гидрохим. ин-т, 2005. 33 с.
Ресурсы поверхностных вод СССР. Дальний Восток. Верхний и Средний Амур / Под ред. А.П. Муранова. Л.: Гидрометеоиздат, 1966. Т. 18. Вып. 1. 779 с.
Сает Ю.Е., Ревич Б.А., Янин Е.П. Геохимия окружающей среды. М.: Недра, 1990. 335 с.
Труфанов А.И. Коробий Э.Н. О миграции железа и микроэлементов в природных водах Среднеамурской впадины // Природные воды Дальнего Востока / Под ред. А.А. Степанова, К.П. Караванова. Хабаровск: ХабКНИИ, 1973. Сб. № 13. С. 106–112.
Харитонова В.А., Вах Е.А. Редкоземельные элементы в поверхностных водах Амурской области. Вест. Томского гос. ун-та. 2015. № 396. С. 232–244.
Чудаева В.А., Шестеркин В.П., Чудаев О.В. Микроэлементы в поверхностных водах бассейна р. Амур // Вод. ресурсы. 2011. Т. 38. № 5. С. 606–617.
Шестеркин В.П. Солевой состав вод Зейского водохранилища // Вод. хоз-во России. 2015. № 5. С. 32–42.
BS ISO (British Standard International Organization of Standardization) 8245. Water quality – guidelines for the determination of total organic carbon (TOC) and dissolved organic carbon (DOC). London: British Standard Institution, 1999.
Buchwalter D.B., Linder G., Curtis L.R. Modulation of cupric ion activity by pH and fulvic acid as determinants of toxicity in Xenopus laevis embryos and larvae // Environ. Toxicol. Chem. 1996. V. 15. № 4. P. 568–573.
Gaillardet J., Viers J., Dupre B. Trace Elements in River Waters // The Treatise on Geochemistry / Eds J.I. Drever, H.D. Holland, K.K. Turekian. Oxford: Elsevier-Pergamon, 2004. V. 5. P. 225–272.
Guy R.D., Chakrabarti C.L. Studies of metal-organic interactions in model systems pertaining to natural waters // Can. J. Chem. 1976. V. 54. № 16. P. 2600–2611.
Lakshman S., Mills R., Fang F. et al. Use of fluorescence polarization to probe the structure and aluminum complexation of three molecular weight fractions of a soil fulvic acid // Anal. Chim. Acta. 1996. № 321. 113−119.
Lee J. Complexation analysis of fresh waters by equilibrium diafiltration // Water Res. 1983. V. 17. № 5. P. 501–510.
Levshina S. An assessment of metal-humus complexes in river waters of the Upper Amur basin, Russia // Environ. Monitoring and Assessment. N. Y.: Springer, 2018. V. 190. № 1. P. 18.
Levshina S.I. Iron Distribution in Surface Waters in the Middle and Lower Amur Basin // Water Resour. 2012. V. 39. № 4. P. 375–383.
Levshina S., Sirotsky S. Organic Matter Distribution in the Zeya Reservoir, Central Priamurye, Russia // Natural Organic Matter: Structure-Dynamics Innovative Applications. 17th Meeting Int. Humic Substances Society / Eds Y. Deligannakis, I. Konstantinou. Ioannina, Greece, 2014. P. 68–69.
Mantoura R.F.C., Dixon A., Riley J.P. The speciation of trace-metals with humic compounds in natural waters // Thalassia Jugoslavica. 1978. V. 14. № l–2. P. 127–145.
Olk D.C., Bloom P.R., Perdue E.M., McKnight D.M., Chen Y., Farenhorst A., Senesi N., Chin Y-P., Schmitt-Kopplin P., Hertkorn N., Harir M. Environmental and Agricultural Relevance of Humic Fractions Extracted by Alkali from Soils and Natural Waters // J. Environ. Quality. 2019. V. 48. № 2. P. 217–232.
Pauli F.W. Heavy-metal humates and their behavior against hydrogen sulfide // Soil Sci. 1975. V. 119. № 1. P. 98–105.
Saar R.A., Weber J.H. Complexation of cadmium (II) with water- and soil-derived fulvic acids: effects of pH and fulvic acid concentration // Can. J. Chem. 1979. V. 57. № 11. P. 1263–1268.
Sposito G. Trace metals in contaminated waters // Environ. Sci. Technol. 1981. V. 15. № 4. P. 396–403.
Steinberg C. Species of dissolved metals derived from oligotrophic hards water // Water Res. 1980. V. 14. № 9. P. 1239–1250.
Templeton G.D., Chasteen N.D. Vanadium-fulvic acid chemistry: conformation and binding studies by electron spin probe techniques // Geochim. Cosmochim. Acta. 1980. V. 44. № 5. P. 741–752.
Дополнительные материалы отсутствуют.


