Водные ресурсы, 2022, T. 49, № 2, стр. 204-212
Логистическая модель популяционной токсикодинамики
В. И. Данилов-Данильян a, *, О. М. Розенталь a
a Институт водных проблем РАН
119333 Москва, Россия
* E-mail: vidd@iwp.ru
Поступила в редакцию 31.05.2021
После доработки 31.05.2021
Принята к публикации 27.07.2021
- EDN: KTUMQI
- DOI: 10.31857/S0321059622020031
Аннотация
Изучается зависимость результата воздействия загрязняющего вещества в воде на популяцию гидробионтов от продолжительности экспозиции. Сформулированы естественные предположения относительно характера этого процесса, прежде всего – о линейности связи скорости сокращения численности популяции с этой численностью и с количеством погибших в результате интоксикации особей. На основе сформулированных предположений построена модель популяционной токсикодинамики, описывающая кинетику угнетения популяции логистической функцией. Показано, что результаты расчетов по модели согласуются с известными экспериментальными данными, что подтверждает обоснованность сформулированных предположений о характере процесса интоксикации. Предложено расширение построенной модели включением в нее зависимости результата интоксикации от концентрации загрязняющего вещества по известной формуле Габера. На основании разработанной модели предложено уравнение регулируемой токсикодинамики для организации водопользования, не нарушающего режим естественного функционирования экосистем. Полученная конкретизация представлений о механизмах процесса интоксикации необходима для обоснования гигиенических нормативов содержания химических веществ в воде, прогнозных оценок биоразнообразия и выбора мер по поддержанию слабых звеньев трофических цепей в водных экосистемах.
ВВЕДЕНИЕ
Снижение качества природных вод – явление, в настоящее время весьма распространенное во многих странах. Оно надежно регистрируется для ряда водных объектов в России, а в большинстве рек и озер России, расположенных в хозяйственно освоенных регионах, его режим за последние два-три десятилетия можно назвать квазистационарным: в отдельные годы оно улучшается, в другие – ухудшается, но в целом остается примерно на одном уровне, к сожалению – невысоком [2]. Важнейшая проблема гидроэкологии – изучение реакций водной биоты на антропогенные воздействия – предполагает количественное описание токсического эффекта, производимого загрязняющим веществом на гидробионты при росте продолжительности его воздействия. Такое описание – типичная задача водной токсикологии – особенно важна именно при квазистационарном режиме качества воды. Надежные оценки токсического эффекта загрязняющих веществ, получаемые с помощью математических моделей экотоксикологических процессов, необходимы при обосновании выбора мер по снижению антропогенных загрязнений, поступающих в водные объекты.
Моделирование процессов водной токсикологии осложняется тем, что механизмы интоксикации недостаточно изучены, а экспериментальные данные, накопленные в опытах in vitro (микрокосмах, лабораториях), не совпадают с результатами in vivo (в природных водных объектах) [11, 12, 14, 16, 17, 21–23]. Поэтому количественные результаты, полученные в лабораториях [1, 13, 15, 18, 20, 24], непосредственно распространять на природные процессы некорректно. Однако можно утверждать, что общие зависимости типа “концентрация–эффект” или “время–эффект”, отражающие токсикодинамические закономерности, по характеру функции (но не по значениям ее параметров) одинаковы во всех упомянутых случаях [1, 11–18, 20–24] и описываются стандартной вогнуто/выпуклой логистической функцией.
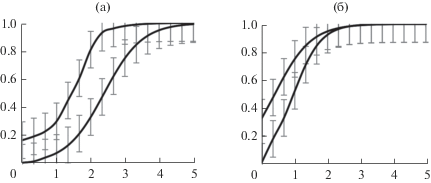
В качестве типового примера на рис. 1 приведены зависимости летальности колюшки от времени процесса ее вымирания при фиксированной концентрации C азотнокислых солей в воде [13, 18, 24].
Рис. 1.
Летальность (доля погибшей колюшки) в зависимости от времени экспозиции (сут) в растворе: а – Mg (нижняя линия, C = 300 мг/дм3), Ba (верхняя, C = 400 мг/дм3); б – Cu (нижняя, C = 0.2 мг/дм3), Ag (верхняя C = 0.04 мг/дм3).

Заметим, что, хотя кривые на рис. 1б не имеют точек перегиба, все же уравнение логистической функции с подходящими значениями коэффициентов удовлетворительно описывает соответствующие зависимости; это позволяет принять, что точки перегиба не “попали” на чертеж, так как значения аргумента для них лежат на оси абсцисс левее 0. В дальнейшем любой участок логистической функции, находящийся правее ее точки перегиба (как на рис. 1б), будем называть участком ее выпуклой вверх ветви.
Конечно, одно лишь графическое сходство кривых, описывающих различные наблюденные зависимости, может служить убедительным аргументом в пользу утверждения об адекватности логистического представления таких зависимостей (если не для всех, то хотя бы для значительного большинства реальных случаев) только при весьма значительном объеме наблюдений. Их количество по каждой паре “гидробионт–токсикант”, необходимое для достижения заданной точности, может быть оценено методами математической статистики, а число таких пар необозримо велико (правда, возможно применение и различных уменьшающих это число приемов). Другим аргументом может служить логический вывод из набора содержательных предположений о характере изучаемого процесса, по сути – аксиоматический подход, с помощью которого строится феноменологическая модель процесса. Если она приводит к той же зависимости, что и эмпирически выявленная, это служит весомым аргументом в пользу адекватности как самих предположений (аксиом), так и получаемого математического описания процесса. Именно такое построение с последующим сопоставлением его результатов с эмпирическими данными – цель настоящей статьи.
ФЕНОМЕНОЛОГИЧЕСКАЯ ТОКСИКОДИНАМИЧЕСКАЯ МОДЕЛЬ
Процесс отравления организмов токсичным веществом включает совокупность малоизученных противостоящих реакций защиты и повреждения [1]. Однако отмеченное выше единообразие известных типичных зависимостей (рис. 1) дает основание надеяться на возможность феноменологического описания токсикодинамических процессов путем выдвижения некоторых непротиворечивых гипотез о протекающих в токсичной среде процессах, построения соответствующей им аналитической модели и оценки правдоподобия получаемых из нее теоретических результатов.
Искомую модель процесса удобно представить как “атаку” вредоносного вещества на популяцию с распределенным уровнем сопротивляемости организмов. В процессе первоначального интенсивного проникновения токсичного вещества в организмы особенно быстро вымирают слабейшие. Скорость вымирания замедляется по мере того, как сохраняются живыми наиболее устойчивые особи. Для формализации этого общего представления и построения феноменологической модели токсикодинамики введем необходимые гипотезы.
Предполагается, что процесс интоксикации происходит при постоянных концентрации загрязнителя в воде и условиях его проникновения в организмы (первая гипотеза). Эта гипотеза упрощает реальные ситуации (и содержание токсиканта может заметно возрасти или сократиться даже за относительно короткий промежуток времени, и условия в принципе могут изменяться – температура, концентрация растворенного кислорода и пр.), однако как бы ни усложнялись модели по мере изучения любого процесса, базовая модель практически всегда опирается на предположение, аналогичное сформулированному. В “состав” этой гипотезы можно включить и предположение о том, что длительность процесса интоксикации не слишком велика, так что приростом численности популяции, если он имеет место за этот период, можно пренебречь (тем более что молодь более чувствительна к загрязнению среды, чем зрелые особи, и вымирает гораздо быстрее них).
Из первой гипотезы следует, что общее количество токсиканта, попавшего во все (живые) организмы популяции за единицу времени, снижается по мере их вымирания. Но за единицу времени в одну особь попадает столько же токсиканта, что и в начале процесса, эта величина принимается постоянной (вторая гипотеза), тогда как сопротивляемость даже наиболее устойчивых одиночек снижается. Эта биологическая закономерность – известная ускоренная гибель организмов, остающихся без сородичей (тем более в случае пребывания в токсичной среде), – убедительно описана, например, в [3].
Будем называть потерей качества популяции долю погибших организмов от общей начальной численности популяции и обозначим через $u\left( t \right)$ эту потерю за время экспозиции t; соответственно, $\frac{{du\left( t \right)}}{{dt}}$ выражает скорость гибели организмов. Эта величина пропорциональна количеству токсичного вещества, попадающего в организмы популяции, и их сопротивляемости – величинам, которые (в соответствии с вышеизложенным общим представлением о процессе интоксикации) пропорциональны, в свою очередь, качеству популяции (т. е. фактически ее численности) и потере этого качества.
Если теперь рассматривать u(t) как величину относительную, возрастающую от своего начального значения, в лучшем случае равного 0, до предельного (все организмы вымерли), равного 1, то можно воспользоваться вероятностной интерпретацией искомой скорости. Тогда принимаем, что $\frac{{du\left( t \right)}}{{dt}}$ прямо пропорциональна: а) вероятности сохранения качества на уровне $1 - u\left( t \right)$ (третья гипотеза); б) вероятности гибели отдельных организмов, возрастающей с ростом “угнетенности”, следовательно, u(t) (четвертая гипотеза). Другими словами, скорость токсикодинамического процесса $\frac{{du\left( t \right)}}{{dt}}\sim \left[ {(1 - u\left( t \right)} \right]u\left( t \right)$, или окончательно:
(1)
$~\frac{{du\left( t \right)}}{{dt}} = \frac{{u\left( t \right)\left[ {(1 - u\left( t \right)} \right]}}{{{{t}_{0}}}},$Предложенный феноменологический подход позволил редуцировать многомерную задачу токсикодинамики так, что получилось нелинейное дифференциальное уравнение процесса интоксикации.
Подобные уравнения обычно устанавливаются феноменологически в фундаментальных трудах по регулярной динамике, в данном случае результат естественным образом следует из принятых гипотез о постепенном отравлении и гибели организмов в токсичной среде. Заслуживает быть отмеченным то, что предположения о линейных связях накопления токсиканта и резистентности с качеством популяции привели к нелинейному токсикодинамическому уравнению (1).
Система введенных гипотез, позволяющая построить модель (1), не детализирует действие многих физико-химико-биологических процессов, вызывающих интоксикацию и определяющих ее протекание и последствия. Но если предложенная модель будет достаточно хорошо описывать общие наблюдаемые токсикодинамические зависимости, это значит, что она адекватно отражает совокупное действие таких процессов и может быть полезна при обосновании гигиенических нормативов содержания химических веществ в воде и при прогнозном оценивании биоразнообразия в зависимости от антропогенных загрязнений водных объектов, а в научно-теоретическом отношении – для выяснения приемлемости принятых линейных гипотез.
Для описания экспериментов с полученной моделью требуется представить в явном виде зависимости сокращения (потери) качества популяции от продолжительности экспозиции.
Решения нелинейных дифференциальных уравнений, подобных приведенному выше, зачастую сложны, и их трудно описать простыми формулами. Однако в данном случае это удалось сделать, представив каждую часть уравнения (1) в виде произведения функций, зависящих от разных переменных, и интегрируя обе части получившегося равенства. В результате имеем:
(2)
${\text{ln}}\frac{u}{{1 - u}} = \frac{t}{{{{t}_{0}}}} + {\text{ln}}\left( {{\text{const}}} \right),$Переписав правую часть (2) в виде $\ln \left( {K{\text{exp}}\frac{t}{{{{t}_{0}}}}} \right)$, а также учитывая начальное условие $K = \frac{1}{{u\left( 0 \right)}}$, где $~u\left( 0 \right) > 0$, нетрудно показать, что токсикодинамический процесс подчиняется следующему логистическому уравнению:
(3)
$u\left( t \right) = \frac{{u\left( 0 \right)}}{{u\left( 0 \right) + {\text{exp}}\left( { - \frac{t}{{{{t}_{0}}}}} \right)}}.$АПРОБАЦИЯ МОДЕЛИ
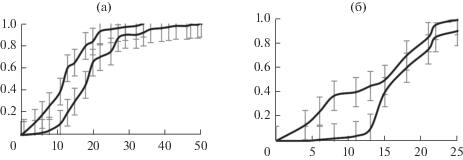
Полученное выражение для $~u\left( t \right)$ удовлетворительно описывает зависимости, приведенные на рис. 1, по крайней мере, в пределах погрешности эксперимента, как это показано на рис. 2 при t0 = = 1.7 сут, u(0) = 0.19 (верхняя линия рис. 2а); t0 = 1.5, u(0) = 0.02 (нижняя линия рис. 2а); t0 = = 1.2, u(0) = 0.4 (верхняя линия рис. 2б); u(0) = = 0.03, t0 = 1.4 (нижняя линия рис. 2б).
В рамках предложенной модели возникает возможность количественной оценки токсикодинамических процессов. Например, в случае сравнительно слабых токсикантов (соли Mg, Ba) величина t0 >1.5 сут, а в случае сильных токсикантов (соли Cu, Ag) – немногим >1 сут. Так же и организмы, отобранные для опытов, скорее всего были в различном начальном состоянии: для солей Mg и Cu – практически благополучные, так как величина $~u\left( 0 \right)$ близка к нулю, а для солей Ba и Ag – ослабленные, так как $u\left( 0 \right)$ достигает значений 0.2 и 0.4 соответственно.
Полученная токсикодинамическая функция (3) позволила удовлетворительно описать и другие экспериментальные данные.
В качестве еще одной иллюстрации были использованы экспериментальные результаты биотестирования токсичности водных растворов этанола и полученного на его основе антиоксиданта SkQ1 [11]. Испытания проводились на распространенном виде ракообразных организмов – цериодафниях, широко используемых в качестве тест-объекта для оценки качества пресных вод.
Результаты эксперимента приведены на рис. 3. Нетрудно убедиться, что они хорошо описываются полученным уравнением токсикодинамики при следующих параметрах: на рис. 3а – u(0) = = 0.05, ${{t}_{0}}~$ = 1.6 для нижней линии и u(0) = 0.10, ${{t}_{0}}~$ = 2.1 для верхней; на рис. 3б – u(0) = 0.15, ${{t}_{0}}~$ = 1.1 для нижней линии и $~u\left( 0 \right) = 0.25,{\text{\;}}~{{t}_{0}}$ = 0.7 для верхней. В обоих случаях для раствора спирта получены полные S-образные зависимости, а для более токсичного раствора SkQ1 – участки выпуклой вверх ветви логистической кривой.
Расчет показал, что время выживания тест-организмов в растворе антиоксиданта короче, чем в растворе спирта: в 1.3 раза при C = 55 нМ и в 1.6 раза при C = 280 нМ. При этом почти пятикратное повышение концентрации токсиканта сопровождалось снижением расчетного времени ${{t}_{0}}$ в полтора раза в растворах спирта и более чем вдвое в растворах антиоксиданта вне зависимости от значения $u\left( 0 \right)$.
В целом модельный расчет показывает, что увеличение уровня токсичности загрязнителя сопровождается замещением полной S-образной токсикодинамической зависимости на участок выпуклой вверх ветви логистической кривой. Это заключение соответствует экспериментальным выводам для разных групп тест-организмов, относящихся к практически противоположным звеньям трофической цепи, как это видно из сравнения рис. 1 и 4.
Рис. 4.
Пример зависимости потери качества популяции от уровня токсичности загрязняющего вещества и продолжительности экспозиции.

Известна формула Габера [13, 18], характеризующая эффект интоксикации “равно зависимым” от концентрации загрязнителя и длительности экспозиции $u\left( {C,t} \right) \sim Ct$. Представляется, что в связи с этим целесообразно отметить и сходство зависимостей потери качества от длительности экспозиции и уровня токсичности l загрязняющего вещества. Во всяком случае гипотезы, использованные при выводе временнóй зависимости потери качества $u\left( t \right)$, вполне приемлемы и при выводе функции $u = u\left( l \right)$. Поэтому соотношение Габера удобно привести к виду $u\left( {l,t} \right) = l~t$, после чего токсикодинамическая модель популяции будет выглядеть следующим образом:
(4)
$\begin{gathered} u\left( {l,t} \right) = u\left( l \right)u\left( t \right) = \\ = \frac{{u\left( 0 \right)}}{{u\left( 0 \right) + {\text{exp}}\left( { - \frac{t}{{{{t}_{0}}}}} \right)}}\,\,\,\frac{{u\left( 0 \right)}}{{u\left( 0 \right) + {\text{exp}}\left( { - \frac{{{\text{\;}}l~}}{{{\text{\;}}l{{~}_{0}}}}} \right)}}. \\ \end{gathered} $Соответствующий трехмерный S-образный график зависимости (4), приведенный на рис. 4, демонстрирует поведение под токсичной нагрузкой резистентной популяции. Видно, что на начальном этапе интоксикация не вызывает значительного ответного эффекта. Однако далее наблюдается биологический стресс (при плавно увеличивающейся продолжительности воздействия или токсичности загрязнителя эффект резко усиливается), а завершается все полным затуханием контролируемых жизненных функций популяции.
Для удобства использования полученной токсикодинамической модели на рис. 5, 6 приведены зависимости процесса интоксикации при показателях, характерных для водно-экологических систем, описанных в упомянутых выше литературных источниках.
Рис. 5.
Потеря качества, обусловленная уровнем токсичности загрязнителя в случае u(0) = 0.05. Слева направо: t0 = 0.8, 1.05, 1.33, 1.67, 2.0. Обозначения осей – как на рис. 1.
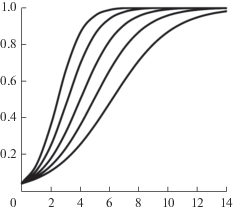
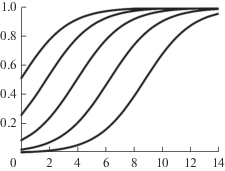
Рис. 6.
Процесс интоксикации в зависимости от начальной потери качества популяции при t0 = 1.7. Слева направо: u(0) = 0.50, 0.25, 0.10, 0.02, 0.005. Обозначения осей – как на рис. 1.
ВОЗМОЖНОСТЬ ПРАКТИЧЕСКОГО ИСПОЛЬЗОВАНИЯ МОДЕЛИ
Такая организация водопользования и промысла гидробионтов, при которой не происходит нарушений естественных экосистем, представляет собой важнейшую цель государственного и корпоративного управления ресурсами водных объектов. Для ее достижения необходима реализация комплекса самых разнообразных мероприятий – инвестиционных, организационных, регуляционно-экономических, юридических, а также лишь косвенно и не в самой близкой перспективе направленных на продвижение к указанной цели – научных, образовательных, воспитательных, культурных.
В случае, если мероприятие имеет экотехнологический характер и имеются хотя бы предположения о том, как его реализация может повлиять на скорость потери качества популяции (разумеется, в сторону снижения, иначе его вообще не следует рассматривать), предложенная в данной статье токсикодинамическая модель может быть полезной для оценки его целесообразности.
Необходимый для такой оценки метод расчетов наиболее удобно рассмотреть, приняв длительность экспозиции ${{t}_{{\text{o}}}} = 1$, что фактически не ограничивает общности, поскольку равносильно изменению единицы измерения времени. Это позволяет переписать уравнение (1) в виде: $\frac{{du\left( t \right)}}{{dt}} = u\left( t \right) - {{u}^{2}}\left( t \right)$, где первый член в правой части описывает угнетение популяции, а второй – ее сопротивляемость.
Пусть экотехнологическое мероприятие обеспечивает снижение потери качества популяции на величину $p$, так что $\frac{{du\left( t \right)}}{{dt}} = \left[ {u\left( t \right) - p} \right] - {{u}^{2}}\left( t \right)$. Частные случаи графической формы этого уравнения приведены на рис. 7. Как видно, при $~p~$ = 0 (отсутствие экотехнологических мероприятий) скорость $\frac{{du\left( t \right)}}{{dt}} > 0$ во всем диапазоне значений $u\left( t \right),$ кроме двух особых точек, из которых левая неустойчива (в том смысле, что малейшее отклонениe $u\left( t \right)$ от нуля приведет к падению качества популяции). Аналогично и при $p = 0.12$ качество популяции будет падать в большей части значений $~u\left( t \right)$, что указывает на недостаточную интенсивность экотехнологических мероприятий.
Рис. 7.
Скорость потерь качества популяции как функция фактического уровня потерь в нерегулируемом режиме при $p = 0$ (сплошная линия), 0.12 (штриховая), $0.25$ (штрих-пунктирная), $0.4$ (пунктирная).
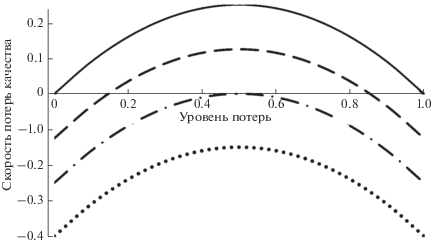
Такой же вывод следует для всего интервала $0 < p < 0.25$.
Качество популяции будет возрастать$~$ только при $p > 0.25,{\text{\;когда\;}}\frac{{du\left( t \right)}}{{dt}} < 0$. Однако при этом экотехнологическое мероприятие может оказаться непомерно дорогим, необходимые для его реализации ресурсы будут потрачены неэффективно. К тому же “избыточные” мероприятия, как и “недостаточные”, полезны не всегда с точки зрения требуемого результата.
Приемлемым решением могло бы быть установление величины $p$ на промежуточном уровне $p = 0.25$, но тогда условие $\frac{{du\left( t \right)}}{{dt}} = 0$ достигается в единственной особой точке u(t) = 0.5 (рис. 7), которая является неустойчивой, поскольку даже небольшие изменения величины $~p$ приводят к заметному снижению качества экосистемы.
Наилучший вариант решения задачи требует контроля потери качества популяции и установления временнóй зависимости величины $~p = p\left( t \right)$ на меняющемся уровне $p\left( t \right) = hu\left( t \right)$ $(h$ – подлежащий регулированию коэффициент). Тогда уравнение токсикодинамики примет вид: $~\frac{{du\left( t \right)}}{{dt}} = u\left( t \right)\left( {1 - h} \right) - {{u}^{2}}\left( t \right)$, так что скорость потери качества пересекает ось $u\left( t \right)$ в точках 0 и $u\left( t \right) = 1 - h$. Обе эти точки устойчивы, причем в области $u\left( t \right) > 1 - h$ скорость $\frac{{du\left( t \right)}}{{dt}}$ становится отрицательной, т. е. наблюдается не падение качества популяции, а его рост.
Благодаря этому появляется возможность экотехнологического управления путем задания значений $h$. Если, например, в конкретных ситуациях нежелательно допустить снижения качества популяции до уровня >0.6, 0.5, 0.4 или 0.3, то величина $~h = 1 - u\left( t \right)$ не должна быть < 0.4, 0.5, 0.6, 0.7, что иллюстрирует графическое отображение уравнения для $\frac{{du\left( t \right)}}{{dt}}$ (рис. 8).
ЗАКЛЮЧЕНИЕ
Преобладающие зависимости угнетения водных систем от времени экспозиции следующие:
логистическая S-образная функция, вторая производная которой меняет свой знак с “+” на “–”, проходя через точку перегиба;
участок выпуклой (вверх) ветви логистической S-образной функции (вторая производная которой на этой ветви отрицательна).
Для описания этих зависимостей в работе предложены непротиворечивые гипотезы о механизмах интоксикации:
условия протекания интоксикации (включая концентрацию токсиканта в воде) по ходу этого процесса не изменяются;
количество токсиканта, попадающего в организм гидробионта за единицу времени, в течение всего процесса интоксикации остается постоянным;
общий объем токсиканта, попавшего в организмы популяции, прямо пропорционален общей численности непогибших организмов;
скорость роста доли погибших организмов в популяции прямо пропорциональна самой этой доле (т. е. фактически числу погибших особей).
Эти гипотезы базируются на меняющемся соотношении уровней сопротивляемости/восприимчивости организмов к токсиканту в зависимости от уровня потери качества популяции (сокращению ее численности) в соответствии с представлением об интоксикации как “атаке” вредоносного вещества на популяцию, результативность которой (атаки) определяется распределением сопротивляемости организмов так, что снижение сопротивляемости и рост восприимчивости подчиняются логистическому уравнению.
Предложенная модель включает в себя два управляющих параметра:
уровень потери качества (угнетения) популяции в момент начала процесса интоксикации $u\left( 0 \right)$;
средняя продолжительность t0 выживания организмов популяции в загрязненной среде.
Показано, что если относительное значение $~u\left( 0 \right)$ ≤ 0.1 (что в рамках принятой модели обеспечивает высокую начальную сопротивляемость), а t0 ≥ 0.6 (что соответствует не слишком высокому уровню токсичности загрязнителя), то обеспечивается стандартная S-образная токсикодинамическая зависимость время–эффект. Если же первая величина ≥0.3, а вторая ≤0.7, S-образность зависимости “усекается” и реализуется траектория с высокой начальной скоростью снижения качества популяции и последующим асимптотическим затуханием этого эффекта.
Предложенная феноменологическая токсикодинамическая модель может способствовать обоснованию допустимой концентрации химических веществ в водных объектах и расширению представления об адаптационном потенциале популяций, позволяющем прогнозировать риск их резкого угнетения [4]. На этом основании получено уравнение регулируемой токсикодинамики для организации водопользования, не приводящего к нарушению экосистем.
Оценка параметров модели в каждом конкретном случае позволит обоснованно регулировать водоотведение и своевременно организовать мероприятия по охране вод и гидроэкосистем, направленные на поддержание слабых звеньев трофических цепей и биоразнообразия в целом, а также прогнозировать гидроэкологические катастрофы. Необходимое условие для этого – учет предложенных в данной работе токсикодинамических зависимостей при установлении водно-экологических правил, изложенных, в частности, в документах [5–10 ].
Список литературы
Безель В.С., Большаков В.Н., Воробейчик Е.Л. Популяционная экотоксикология. М.: Наука, 1994. 80 с.
Данилов-Данильян В.И. Водные ресурсы России: состояние, использование, охрана, проблемы управления // Экономика. Налоги. Право. 2019. Т. 12. № 5. С. 18–31. https://doi.org/10.26794/1999-849X-2019-12-5-18-31
Касумян А.О., Павлов Д.С. Стайное поведение рыб. М.: Товарищество науч. изд. КМК, 2018. 274 с.
МУ 2.1.5. 720-98 Методические указания. 2.1.5. Водоотведение населенных мест, санитарная охрана водоемов. Обоснование гигиенических нормативов химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования.
Постановление Правительства Российской Федерации от 28 февраля 2019 г. № 206 “Об утверждении Положения об отнесении водного объекта или части водного объекта к водным объектам рыбохозяйственного значения и определении категорий водных объектов рыбохозяйственного значения”.
Правила согласования Федеральным агентством по рыболовству строительства и реконструкции объектов капитального строительства, внедрения новых технологических процессов и осуществления иной деятельности, оказывающей воздействие на водные биологические ресурсы и среду их обитания, утвержденные постановлением Правительства Российской Федерации от 30 апреля 2013 г. № 384 // Собрание законодательства РФ. 2013. № 20.
Приказ Министерства сельского хозяйства РФ от 31 марта 2020 г. № 167 “Об утверждении Методики исчисления размера вреда, причиненного водным биологическим ресурсам”.
Приказ Минсельхоза России от 21 февраля 2020 г. № 83 “Об утверждении критериев и порядка подготовки биологического обоснования создания рыбохозяйственной заповедной зоны, а также формы паспорта рыбохозяйственной заповедной зоны” (зарегистрирован в Минюсте России 13 мая 2020 г., регистрационный № 58 336).
Приказ Минсельхоза России от 30 января 2015 г. № 25 “Об утверждении Методики расчета объема добычи (вылова) водных биологических ресурсов, необходимого для обеспечения сохранения водных биологических ресурсов и обеспечения деятельности рыбоводных хозяйств, при осуществлении рыболовства в целях аквакультуры (рыбоводства)” (зарегистрирован в Минюсте России 20 февраля 2015 г., регистрационный № 36 147).
РД 118-02-90 Методическое руководство по биотестированию воды. М.: Госкомприроды СССР, 1990.
Филенко О.Ф. Динамика эффекта загрязняющих веществ в экотоксикологии // Токсикол. вестн. 2001. № 2. С. 2–6.
Biological methods of water bodies research in Finland / Eds M. Ruopp, P. Heynonen. Helsinki: Suomen ympäristökeskus, Edita Prima Oy, 2006. P. 117.
Cairns J.Jr. Restoration Ecology and Ecotoxicology // Handbook of Ecotoxicology / Eds D.J. Hoffman, B.A. Rattner, G.A. Burton, J.Jr. Cairns. N.Y.: Lewis Publ., 2005. P. 1015–1029.
Denizeau F. The use of fish cells in the toxicological evaluation of environmental contaminants // Microscale Testing in Aquatic Toxicology: Advances, Techniques, and Practice / Eds P.G. Wells, K. Lee, C. Blaise. Boca Raton, FL: CRC Press, 1998. P. 113–128.
Encyclopedia of Aquatic Ecotoxicology / Eds S. Blaise, J. Ferard. Dordrecht: Springer, 2013. P. 721–729.
Gilron G.L., Lynn D. Ciliated Protozoa as Test Organism in Toxicity Assessment in Water and Soil // Microscale Testing in Aquatic Toxicology: Advances, Techniques, and Practice / Eds P.G. Wells, K. Lee, C. Blaise. Boca Raton, FL: CRC Press, 1998. P. 323–336.
Johnson B.T. Microtox acute toxicity test // Small-Scale Freshwater Toxicity Investigations. V. 1: Toxicity Test Methods / Eds C. Blaise, J-F. Férard. Dordrecht: Springer, 2005. P. 69–105.
Jones J.R.E. The reactions of Pygosteus pungitius L. to toxic solutions // J. Experimental Biol. 1947. 24. P. 110–122.
Søndergaard M., Jeppesen E., Torben L., Lauridsen C. SkovLake restoration: successes, failures and long-term effects // J. Applied Ecol. 2007. V. 44. P. 1095–1105.
Nalecz-Jawecki G. Spirotox test – Spirostomum ambiguum acute toxicity test // Small-Scale Freshwater Toxicity Investigations. V. 1. Toxicity Test Methods / Eds C. Blaise, J-F. Férard. Dordrecht: Springer, 2005. P. 299–322.
Oyama I., Okamura H., Rong L. Toxicity testing in Japan and the use of Toxkit microbiotests // New Microbiotests for Routine Toxicity Screening and Biomonitoring / Eds G. Persoone, C. Janssen, W.M. De Coen. N.Y.: Kluwer Acad/Plenum Publ., 2000. P. 123–133.
Ronco A., Castillo G., Díaz-Baez M.C. et al. The application of Hazard Assessment Schemes using the Watertox toxicity testing battery // Small-Scale Freshwater Toxicity Investigations. V. 2. Hazard Assessment Schemes / Eds C. Blaise, J-F. Férard. Dordrecht: Springer, 2005. P. 89–114.
Ruck J.G., Martin M., Mabon M. Evaluation of Toxkits as methods for monitoring water quality in New Zealand // New Microbiotests for Routine Toxicity Screening and Biomonitoring / Eds G. Persoone, C. Janssen, W.M. De Coen // Kluwer Acad/Plenum Publ. 2000. P. 103–119.
Walker C.H., Hopkin S.P., Sibly R.M., Peakall D.B. Principles of Ecotoxicology. 2nd Ed. London: Taylor&Francis Ltd, 2001. 307 p.
Дополнительные материалы отсутствуют.