Водные ресурсы, 2022, T. 49, № 3, стр. 351-360
Ихтиопланктон Черного моря в начале летнего нерестового сезона 2018 г.
Т. Н. Климова a, П. С. Подрезова a, *, А. А. Субботин a, И. В. Вдодович a, Е. Ю. Георгиева a
a ФИЦ “Институт биологии южных морей им. А.О. Ковалевского РАН”
299011 Севастополь, Россия
* E-mail: polyklim@gmail.com
Поступила в редакцию 01.07.2021
После доработки 24.11.2021
Принята к публикации 21.12.2021
- EDN: CBCFJV
- DOI: 10.31857/S0321059622030063
Аннотация
Представлены видовой состав и численность ихтиопланктона в открытых водах шельфа и в глубоководных районах Черного моря в июне 2018 г. Идентифицировано 17 видов икры и личинок рыб из десяти семейств. Средняя численность икры колебалась от 5.8 экз/м2 в западном секторе исследований до 20.9 экз/м2 – в восточном, а личинок – от 1.7 до 9.7 экз/м2 соответственно. В июне 2018 г. наблюдалась высокая эффективность нереста Engraulis encrasicolus: отношение численности личинок к количеству икры в море на порядок превышало данные 1970-х гг. и составляло в среднем 23.7%. Отмечено снижение минимальных размеров личинок массовых видов тепловодных рыб, что, вероятно, связано с сокращением периодов эмбрионального и постэмбрионального развития при повышении температуры воды в море >27°С. Неоднородность пространственного распределения численности ихтиопланктона и биомассы фитопланктона проявлялась в их увеличении от шельфовых к глубоководным станциям в соответствии с контрастами температуры воды и характером циркуляции на западных и восточных перифериях региональных квазистационарных антициклонических круговоротов и, наоборот, в их снижении вне зоны влияния этих динамических структур.
ВВЕДЕНИЕ
В морях умеренной природной зоны с хорошо выраженной сезонной изменчивостью гидрологического режима, к каковым относится Черное море, параметры гидрологических сезонов определяют многие биологические циклы. Устоявшийся в течение длительного периода (нескольких десятилетий) диапазон изменчивости основных лимитирующих факторов среды определяет время наступления и длительность биологических сезонов, в том числе и массовый нерест различных видов рыб [3–5, 27, 29].
Климатические изменения, отмеченные с начала 1990-х гг., оказали существенное влияние на сезонные гидрологические и экологические процессы в Мировом океане, изменили условия обитания и воспроизводства различных гидробионтов на всех трофических уровнях [32, 34, 36]. В Черном море повышение температуры воды (увеличение теплозапаса верхнего 100-метрового слоя) привело к изменениям в фенологии нереста как умеренноводных, так и тепловодных видов рыб, к снижению размерно-весовых характеристик рыб в период эмбрионального и постэмбрионального развития [2, 3, 14, 37, 38]. Выживание личинок рыб в период их перехода на экзогенное питание в значительной степени зависит от обеспеченности их кормом (фито- и микрозоопланктоном) [30, 31, 33, 35, 39]. Скопления личинок массовых видов рыб обычно наблюдаются в зонах конвергенции на внешних границах Основного черноморского течения (ОЧТ) и шельфовых термодинамических образований, однако в некоторых случаях – и в пределах западного и восточного циклонических круговоротов [6, 15, 16, 18, 40]. В последние годы исследований в летний гидрологический сезон отмечается рост видового разнообразия ихтиопланктона и в открытых водах шельфа [16, 37]. Замедление скорости ОЧТ в летний гидрологический сезон приводит к усилению его меандрирования вдоль свала глубин, к вовлечению в зону антициклонов вод из прилегающих участков моря и способствует более равномерному распределению планктона на шельфе и на прилегающих глубоководных участках [1, 2].
В настоящей статье рассмотрены особенности видового состава и пространственного распределения ихтиопланктона и фитопланктона, а также эффективность нереста и изменение размерных характеристик личинок массовых видов тепловодных рыб в связи с региональной изменчивостью гидрологического режима Черного моря в период интенсивного прогрева поверхностного слоя моря в начале летнего нерестового сезона 2018 г.
МАТЕРИАЛЫ И МЕТОДИКА
Материал собирался на шельфе и в открытых водах северной части Черного моря с 10 по 28 июня 2018 г. в 102 рейсе НИС “Профессор Водяницкий”. Ихтиопланктон собирали обратноконической ихтиопланктонной сетью Богорова–Расса (80/113), выполненной из мельничного сита ячеей 400 мкм в режиме вертикальных ловов в слое от дна до поверхности на станциях, выполненных над глубиной до 100 м, и от нижней границы кислородного слоя (согласно показаниям CTD-зонда “Sea Bird 911 plus”) до поверхности в глубоководных районах исследований. Ихтиопланктон фиксировался 4%-м раствором формальдегида и обрабатывался в стационарных условиях в течение месяца после сбора. Ихтиопланктон идентифицировали по монографии [7]. Индексы разнообразия рассчитаны по формулам, предложенным в [22]. Питание личинок рыб изучалось по методике [10], распределение личинок по типу питания дано по [26]. Для определения структуры фитопланктона были собраны пробы воды с различных глубин эвфотической зоны. Пробы отбирали кассетой 5-литровых батометров CTD-комплекса и сгущали методом обратной фильтрации через трековые мембранные фильтры диаметром пор 1 мкм. Обработку проб проводили по методике [25]. Видовые названия гидробионтов даны по WoRMS [42]. Всего проанализировано 60 проб ихтиопланктона и 36 проб фитопланктона.
Для анализа гидрологического режима моря в период исследований использованы данные инструментальных наблюдений за термохалинной структурой и течениями в 102 рейсе НИС “Профессор Водяницкий” [1], космические снимки поверхности моря и альтиметрические данные за период с середины апреля до середины июля 2018 г. [21], а также соответствующие по времени данные океанологических наблюдений в различных прибрежных районах Крымского п-ова [11, 12, 29].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
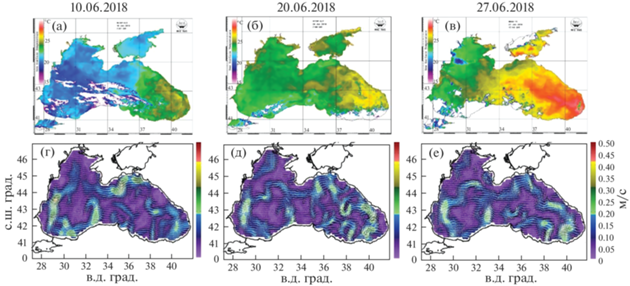
Период выполнения съемки (июнь 2018 г.) соответствовал начальной фазе летнего гидрологического сезона. Ему предшествовал умеренно-теплый зимний гидрологический сезон с пространственной изменчивостью температуры поверхности моря (ТПМ) в период максимального выхолаживания от 8–9°С в западном секторе до 10–11°С – в восточном. В весенний гидрологический сезон увеличение ТПМ повсеместно началось в первой половине апреля и продолжалось до конца мая – начала июня, когда большая часть исследуемой акватории прогрелась до 19–20°С, а у берегов Кавказа – до 21°С [21].
Расчет геострофической циркуляции по данным [21], динамической топографии и инструментальных измерений течений за период выполнения исследований [1] показали, что основным элементом циркуляции поверхностных вод было ОЧТ, ориентированное вдоль континентального склона с двумя глубокими циклоническими меандрами, к Ю от Керченского пролива и над западным склоном Большой топографической ложбины (БТЛ), образующими в прибрежной зоне юго-восточной части акватории квазистационарный антициклонический круговорот – Кавказский антициклон (КавАЦ) и над БТЛ – Севастопольский антициклон (СевАЦ) [13]. В течение съемки положение данных динамических образований существенно менялось. Если на начальном этапе работ КавАЦ располагался на обширной акватории в районе Сочи, а СевАЦ – на стадии заполнения над северным склоном БТЛ (рис. 1а, 1г), то к концу исследований КавАЦ деформировался и сместился на СВ, а СевАЦ преобразовался в замкнутый круговорот и переместился на В в сторону Каламитского залива (рис. 1в, 1е).
Рис. 1.
Распределение ТПМ по данным космических снимков (а, б, в) и расчетные схемы геострофической циркуляции (г, д, е) [21].
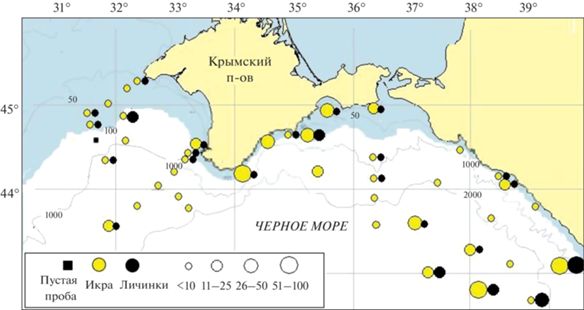
В ихтиопланктонных пробах идентифицированы 351 икринка и 116 личинок рыб. Видовой состав ихтиопланктона был представлен 17 видами рыб из десяти семейств. Средняя численность икры составляла 12.4, личинок 4.3 экз/м2. Пространственное распределение икры и личинок представлено на рис. 2.
В пробах доминировала тепловодная E. encrasicolus, чья икра составляла 81.5, а личинки – 55.9% общей численности всех видов. Доля мертвой икры E. encrasicolus в пробах составляла в среднем 73%. Такой процент погибшей икры в пробах характерен для июня – начала летнего нерестового сезона [7]. Доля икры T. mediterraneus составляла 9.7, ее личинок ≤2.3%. Продолжался нерест трех видов умеренноводных рыб (Sprattus sprattus, Merlangius merlangus, Trisopterus luscus). Видовой состав и средняя численность ихтиопланктона различались в зависимости от глубины в районе исследований (табл. 1).
Таблица 1.
Структура видового состава (%) и средняя численность (экз/м2) икры и личинок рыб на шельфе и в глубоководных районах Черного моря в июне 2018 г.
| Видовой состав | Всего | Глубина <200 м | Глубина >200 м | |||
|---|---|---|---|---|---|---|
| икра | личинки | икра | личинки | икра | личинки | |
| Engraulididae Engraulis encrasicolus Linnaeus, 1758 |
81.5 | 55.9 | 71.1 | 20.2 | 91.9 | 72.0 |
| Clupeidae Sprattus sprattus (Linnaeus, 1758) |
2.4 | 4.7 | 2.2 | 3.3 | 1.8 | 8.0 |
| Gadidae Merlangius merlangus Linnaeus, 1758 |
4.8 | 2.3 | 9.4 | 3.3 | 0.9 | – |
| Trisopterus luscus (Linnaeus, 1758) | – | 2.3 | – | 3.3 | – | 2.0 |
| Syngnathidae Syngnathus schmidti Popov, 1927 |
– | 7.0 | – | 10.0 | – | 6.0 |
| Hippocampus guttulatus (Cuvier, 1829) | – | 2.3 | – | 3.3 | – | – |
| Gobiesocidae Lepadogaster candolii Risso, 1810 |
– | 2.3 | – | 10.0 | – | – |
| L. lepadogaster (Bonnaterre, 1788) | – | 4.7 | – | 13.4 | – | 2.0 |
| Blenniidae Parablennius tentacularis (Brunnich, 1768) |
– | 2.3 | – | 3.3 | – | – |
| Coryphoblennius galerita (Linnaeus, 1758) | – | 2.3 | – | 3.3 | – | – |
| Gobiidae Gobius niger Linnaeus, 1758 |
– | 4.7 | – | 10.0 | – | 4.0 |
| Pomatoschistus minutus (Pallas, 1770) | – | 2.3 | – | 10.0 | – | – |
| P. pictus (Malm, 1865) | – | 2.3 | – | 3.3 | – | 2.0 |
| Aphia minuta (Risso, 1810) | – | 2.3 | – | 3.3 | – | – |
| Mugilidae Mugil cephalus Linnaeus, 1758 |
0.8 | – | – | – | 0.9 | – |
| Carangidae Trachurus mediterraneus Steindachner, 1868 |
9.7 | 2.3 | 15.1 | – | 4.5 | 4.0 |
| Scophthalmidae Scophthalmus maeoticus (Pallas, 1814) |
0.8 | – | 2.2 | – | – | – |
| Средняя численность, экз/м2 | 12.4 | 4.3 | 13.9 | 3.0 | 11.2 | 5.0 |
| Стандартное отклонение | 16.26 | 8.95 | 15.56 | 4.75 | 16.78 | 11.06 |
| Количество видов | 17 | 16 | 10 | |||
На шельфе (глубины <200 м) идентифицировано 16 видов икры и личинок рыб. Средняя численность икры составляла 13.9, личинок 3.0 экз/м2 (табл. 1). Среди икры преобладали тепловодные E. encrasicolus (71.1%) и T. mediterraneus (15.1%). Среди личинок преобладали тепловодные виды из донной икры, составляя 56.6%. Доля личинок E. encrasicolus составляла 20.2%, а личинки T. mediterraneus в пробах отсутствовали. Умеренноводные виды были представлены икрой двух (11.6%) и личинками трех (9.9%) видов (табл. 1). В глубоководных (>200 м) районах исследований отмечено всего 10 видов икры и личинок рыб. Средняя численность икры по сравнению с шельфом снизилась до 11.2 экз/м2, а численность личинок, наоборот, возросла до 5.0 экз/м2. В пробах также доминировала E. encrasicolus, доля ее икры возросла до 92, личинок – до 72%. Если на шельфе отношение численности личинок к количеству икры в море составляло всего 5.8% и было вполне сопоставимо с данными за 1960–1970-е гг., то в глубоководных районах исследований оно составляло 35%. Такая эффективность нереста обычно наблюдалась в июле [7]. Нерест T. mediterraneus здесь был результативным, доля ее личинок составляла 4% общей численности всех видов. Личинки S. schmidti составляли 6%, а личинки остальных тепловодных видов рыб встречались только единично. Умеренноводные рыбы были представлены икрой и личинками тех же трех видов, что и на шельфе. Доля их икры ≤2.7, личинок – 2% (табл. 1; рис. 2).
В июне 2018 г., в отличие от июня 2017 гг. [16], структура видового состава ихтиопланктона в целом была типична для начала летнего нерестового сезона в открытых водах Черного моря [7]. Несмотря на то, что количество видов в июне 2017 г. было выше, чем в 2018 г., индексы разнообразия [22] как на шельфе, так и в глубоководных районах исследований оказались вполне сопоставимы (табл. 2).
Таблица 2.
Индексы разнообразия ихтиопланктона
| Показатели | 102-й рейс НИС “Профессор Водяницкий”, 2018 г. |
95-й рейс НИС “Профессор Водяницкий”, 2017 г. |
||
|---|---|---|---|---|
| <200 м | >200 м | <200 м | >200 м | |
| Индекс видового разнообразия | 2.22 | 0.97 | 2.06 | 1.0 |
| Индекс видового богатства | 12.95 | 7.17 | 13.84 | 10.63 |
| Индекс доминирования | 0.40 | 0.74 | 0.46 | 0.72 |
| Индекс выровненности | 0.54 | 0.29 | 0.47 | 0.29 |
| Количество видов | 16 | 10 | 22 | 12 |
Существенно различались только индексы видового богатства на глубоководных участках исследований, где в июне 2018 г. количество видов снизилось при увеличении численности особей. В июне как 2017, так и 2018 гг. благодаря высокому доминированию E. encrasicolus на глубоководных участках индексы видового разнообразия (1.0) и выровненности (0.29) были одного порядка и сопоставимы с данными за 2013 г. [18]. На шельфе индексы видового разнообразия оказались почти вдвое выше, чем на глубоководных участках моря, и вполне сопоставимы с индексами разнообразия в прибрежных акваториях моря [17]. Высокие значения индекса разнообразия ихтиопланктона в шельфовых водах связаны, с одной стороны, с низкой степенью доминирования, а с другой – с увеличением количества видов личинок на шельфе.
Поскольку ихтиопланктонные исследования в июне 2018 г. проводили в течение трех недель, было выделено четыре сектора исследований, сбор проб в которых выполнялся в различные временны́е периоды (табл. 3).
Таблица 3.
Структура видового состава (%) икры и личинок рыб в различных районах исследований
| Видовой состав | Район Крымского п-ова | Район Кавказа | ||||||
|---|---|---|---|---|---|---|---|---|
| западный сектор | Вековой разрез | центральный сектор | восточный сектор | |||||
| икра | личинки | икра | личинки | икра | личинки | икра | личинки | |
| Engraulis encrasicolus | 81.0 | 16.0 | 78.8 | – | 83.4 | 27.6 | 82.3 | 91.7 |
| Sprattus sprattus | 6.9 | 24.0 | 8.7 | 17.6 | – | – | – | – |
| Merlangius merlangus | 5.2 | 4.0 | 10.0 | – | 2.6 | – | 5.3 | – |
| Trisopterus luscus | – | 12.0 | – | – | – | – | – | – |
| Syngnathus schmidti | – | 32.0 | – | 11.8 | – | 3.4 | – | 2.1 |
| Hippocampus guttulatus | – | – | – | – | – | 3.4 | – | – |
| Lepadogaster candolii | – | – | – | – | – | 13.9 | – | – |
| L. lepadogaster | – | – | – | 11.8 | – | 20.7 | – | – |
| Parablennius tentacularis | – | – | – | – | – | 3.4 | – | – |
| Coryphoblennius galerita | – | – | – | 11.8 | – | – | – | – |
| Gobius niger | – | 12.0 | – | 17.6 | – | 13.9 | – | – |
| Pomatoschistus minutus | – | – | – | 11.8 | – | 10.3 | – | – |
| P. pictus | – | – | – | 17.6 | – | – | – | – |
| Aphia minuta | – | – | – | – | – | 3.4 | – | – |
| Mugil cephalus | – | – | – | – | 0.7 | – | – | – |
| Trachurus mediterraneus | – | – | 2.5 | – | 13.3 | – | 12.4 | 6.2 |
| Scophthalmus maeoticus | 6.9 | – | – | – | – | – | – | – |
| Количество видов | 7 | 10 | 12 | 4 | ||||
Особенности пространственного распределения параметров вертикальной термической структуры: толщины верхнего квазиоднородного слоя (ВКС), глубины залегания ядра холодного промежуточного слоя (ХПС) и минимальных значений температуры в каждом из исследуемых секторов – соответствовали региональному характеру прогрева верхнего слоя моря, а также положению основных (циклонических и антициклонических) динамических образований, зон конвергенции и дивергенции течений. Толщина ВКС колебалась от 5–7 м в зонах циклонических меандров ОЧТ до 10–15 м в пределах СевАЦ и КавАЦ. Минимальные значения температуры в ядре ХПС по всей акватории составили 8.1–8.2°С, а глубины залегания варьировали от 40–50 м в зонах циклонических меандров до 70–80 м в области СевАЦ и 80–85 м – в КавАЦ [20].
В западном секторе исследования проводили с 10 по 16 июня 2018 г. юго-западнее м. Тарханкут в зоне влияния северо-западной периферии СевАЦ. Большая часть акватории прогрелась с 20–22 до 23–24°С, пониженные (на 1.0–1.5°С) значения ТПМ отмечались в центре СевАЦ и вдоль его восточной периферии вследствие адвекции более холодных вод из северо-западной части (СЗЧ) моря (рис. 1а). В ихтиопланктоне были отмечены икра и личинки только семи видов рыб, их средняя численность составляла 5.8 и 2.5 экз/м2 соответственно (табл. 3; рис. 3). Икра была представлена двумя видами тепловодных (87.9%) и двумя видами умеренноводных (12.1%) рыб. В пробах доминировала икра E. encrasicolus, ее нерест был достаточно эффективным, отношение численности личинок к количеству икры в море составляло 8.5%, что вполне сопоставимо с данными за июнь в 1970-е гг. [7]. Личинки тепловодных видов составляли 60, а умеренноводных – 40% (табл. 3).
Рис. 3.
Средняя численность икры (a) и личинок (б) рыб на шельфовых и глубоководных станциях в различных районах исследований.
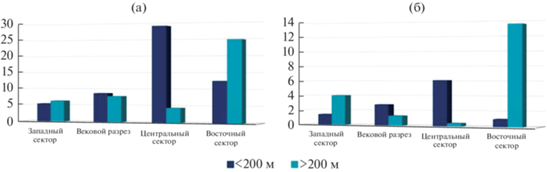
Средняя численность икры и личинок рыб возрастала от мелководных участков исследований к глубоководным. На шельфе средняя численность икры составляла 5.4, личинок – 1.4 экз/м2; на глубоководных станциях (в акватории северной части БТЛ) увеличилась до 6.3 и 4.0 экз/м2 соответственно (рис. 2, 3).
На Вековом разрезе (по направлению от м. Херсонес к Босфору) положение станций оказалось за пределами юго-восточной периферии СевАЦ – в зоне взаимодействия прибрежных вод, поступающих из Каламитского залива, и вод ОЧТ. Температура воды у поверхности была на один градус выше, чем в западном секторе района исследований, и только на ближайшей к м. Херсонес станции она была ≤20°С (рис. 1б). Здесь отмечены икра и личинки десяти видов рыб, их средняя численность составляла 8.0 и 1.7 экз/м2 соответственно (табл. 3; рис. 3). Из теплолюбивых видов в ихтиопланктоне, кроме икры E. encrasicolus, которая доминировала в пробах, появилась икра T. mediterraneus. Личинки тепловодных видов были представлены только S. schmidti и видами из демерсальной икры, которые и доминировали в пробах, составляя 70.6%. Личинки умеренноводных видов были представлены только S. sprattus.
В отличие от западного сектора исследований, на Вековом разрезе средняя численность ихтиопланктона снижалась от шельфа к глубоководным участкам исследований (рис. 3). На шельфе средняя численность икры составляла 13.0, личинок 4.0 экз/м2; а в глубоководных районах – 7.5 и 1.3 экз/м2 соответственно.
На Вековом разрезе качественный состав пищевых объектов тепловодных и умеренноводных видов рыб практически не различался. В пищевом комке теплолюбивых личинок сем. Gobiidae (TL 3.1−7.0 мм) и умеренноводной T. luscus (TL 5.7 мм) отмечены ювенильные стадии копепод и сильно переваренные науплиусы Calanoida размером 0.20−0.35 мм в количестве от 1 до 4 экз. на один кишечник. Пищевой комок молоди S. sprattus (TL 30.0 и 32.0 мм), пойманной в полночь на глубоководной станции (1897 м), состоял из переваренной массы, включающей в себя многочисленные яйца гидробионтов и твердые непереваренные рога динофлагелляты Ceratium tripos. Ранее в кишечниках S. sprattus оформленные пищевые объекты редко встречались после 21 ч [19].
В центральном секторе (от м. Сарыч до Керченского п-ова) с 16 по 22 июня 2018 г. были отмечены усиление ветра и волнения в северо-восточной части моря и в глубоководном районе акватории ЮБК между 34° и 37° в.д. В связи с этим ихтиопланктон собирали в основном в шельфовой зоне с глубинами до 200 м. Воды ОЧТ характеризовались повышенными до 23–24°С значениями ТПМ. Наиболее холодные воды (до 21–22°С) отмечены в узкой прибрежной зоне от Феодосийского залива до траверза Ялты как следствие ветрового сгона при сильном (до 12 м/с) северо-восточном ветре (рис. 1б, 1д). В ихтиопланктоне были отмечены 12 видов икры и личинок рыб, их средняя численность составляла 15.1 и 2.9 экз/м2 соответственно (табл. 3; рис. 3). Икра была представлена одним видом умеренноводных и тремя видами тепловодных рыб. Доминировала E. encrasicolus, доля ее икры составляла 83.4%. В отличие от Векового разреза, ее нерест здесь был результативным, личинки составляли 27.6% общей численности всех видов, а отношение численности личинок к количеству икры в пробах составляло 6.3%. В пробах доминировали личинки из демерсальной икры (65%), два вида из сем. Syngnathidae составляли 6.8%, в том числе Hippocampus guttulatus, который обычно обитает только в узкоприбрежных биоценозах над глубинами до 20 м (табл. 3).
Количество видов и показатели средней численности ихтиопланктона в центральном секторе, как и на Вековом разрезе, снижались от шельфа к глубоководным участкам исследований (рис. 3). На глубоководных участках моря отмечено всего 3 вида, а средняя численность икры и личинок ≤4.4 и 0.4 экз/м2 соответственно. На шельфе идентифицировано 11 видов рыб, средняя численность икры составляла 28.9, личинок – 6.1 экз/м2. Здесь наблюдались наибольшее разнообразие личинок рыб и самый широкий их размерный диапазон. Длина личинок сем. Gobiesocidae колебалась от 5.2 до 7.3 мм, личинок сем. Gobiidae – от 2.2 до 9.5 мм. Исходя из размерного диапазона (от 2.2 до 2.8 мм), можно заключить, что личинки E. encrasicolus все находились на желточном типе питания, что свидетельствовало о начале результативного нереста.
В восточном секторе (Кавказ) с 23 по 28 июня на большей части акватории диапазон изменчивости ТПМ составил 26–28°С. Максимальные значения ТПМ (до 29°С) наблюдались в юго-восточной части полигона (рис. 1в). Средняя численность икры составляла 20.9, личинок – 9.7 экз/м2. Отмечены икра и личинки трех видов тепловодных рыб, а умеренноводные представлены икрой M. merlangus (табл. 3). В восточном секторе распределение количества видов и средняя численность в ихтиопланктоне, как и в западном секторе, возрастали от мелководных участков исследований к глубоководным по мере увеличения ТПМ (рис. 3). Однако здесь максимальные значения параметров ихтиопланктона были приурочены к зонам конвергенции течений на внешней границе ОЧТ и глубоководной юго-восточной периферии КавАЦ (рис. 1в, 1е, 2). На шельфе в ихтиопланктоне отмечено 3 вида рыб, средняя численность икры составляла 12.5, личинок – 1.0 экз/м2. Преобладала икра тепловодных E. encrasicolus и T. mediterraneus, составляя 76%. На икру умеренноводного M. merlangus приходилось 24%. Личинки представлены только E. encrasicolus, отношение численности ее личинок к количеству икры в море достигало 20%. На глубоководных станциях в ихтиопланктоне отмечено 4 вида. Средняя численность икры и личинок рыб составляла 24.7 и 13.5 экз/м2 соответственно (рис. 3). Максимальная численность икры в пробах здесь достигала 80, личинок – 52 экз/м2. Как и в центральном секторе исследований, здесь наблюдался массовый результативный нерест E. encrasicolus. Доля этого вида в ихтиопланктонных пробах >91% (табл. 3). Отношение численности ее личинок к количеству икры в море составляло 54%, что обычно наблюдается только к началу августа [7]. Личинки E. encrasicolus на желточном типе питания составляли 85, на смешанном – 13, на внешнем – 2%.
В восточном секторе исследований пойманы личинки E. encrasicolus длиной ~3 мм на смешанном типе питания, которые, согласно [7], по уровню развития соответствовали личинкам длиной ~5 мм на внешнем типе питания (рис. 4).
Рис. 4.
Личинки Engraulis encrasicolus длиной 3.0 мм (слева) и Trachurus mediterraneus длиной 2.3 мм (справа).

Аналогичная ситуация наблюдалась и для T. mediterraneus (рис. 4). Отмечены личинки длиной от 2.0 до 2.3 мм, которые по развитию соответствуют личинкам размером 4 мм, по [7]. Согласно экспериментальным исследованиям [26, 34, 41], повышение температуры воды приводит к сокращению периода эмбрионального и постэмбрионального развития рыб и к снижению размерного состава личинок. В период исследований у Кавказского побережья ТПМ уже достигала 29°С, что, вероятно, привело к ускорению эмбрионального и постэмбрионального развития некоторых экземпляров личинок E. encrasicolus и T. mediterraneus (рис. 4).
Пространственное распределение икры и личинок рыб в западном, центральном и восточном районах исследований оказалось вполне сопоставимым с распределением биомассы фитопланктона в море (рис. 5). Фитопланктон – один из основных звеньев пищевой цепи водной экосистемы, присутствует в рационе всех ее обитателей. По данным [23], фитопланктон активно потребляют зоопланктонные организмы, составляющие основу кормовой базы практически всех представителей черноморской ихтиофауны на разных этапах их развития. По данным [40], темпы роста личинок S. sprattus положительно коррелировали с первичной продукцией (содержанием хлорофилла). Фитопланктон встречается и в пищевом комке личинок рыб на смешанном типе питания [8, 9, 28]. Так, из динофитовых в кишечниках личинок рыб отмечены Prorocentrum cordatum (Ostf.) J.D. Dodge, Prorocentrum micans Ehr., Protoperidinium divergens (Ehr.) Balech, из диатомовых – Thalassionema nitzschioides Grun, Nitzschia longissima (Breb.) Ralfs, Coscinodiscus sp. [8, 9, 28].
Рис. 5.
Средняя биомасса, мг/м3, фитопланктона в поверхностном слое на шельфовых и глубоководных станциях в различных районах исследований.
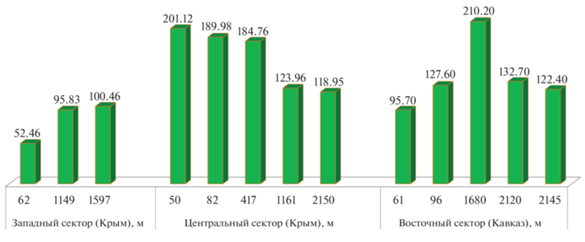
В период ихтиопланктонной съемки в июне 2018 г. в пробах фитопланктона были определены микроводоросли 48 наименований, относящиеся к пяти классам и одной сборной группе Flagellata. Видовой состав фитопланктона соответствовал летнему сезону с преобладанием динофитового (27 видов) и диатомового (15 видов) комплексов. В направлении от З к В отмечено изменение вклада диатомовых и динофитовых водорослей в биомассу суммарного фитопланктона. Вклад диатомовых водорослей возрастал от 28.6 (на З) до 45.2% (на В), вклад динофитовых уменьшался от 56.9 до 40.2% соответственно. При этом вклад примнезиевых водорослей существенно не менялся, составляя ~14.0%. По биомассе доминировали круглогодично вегетирующие водоросли – диатомовые P. calcar-avis, Proboscia alata (Brightw) Sundström и примнезиевая Emiliania huxleyi (Lohm.) Hay & Mohler. По численности во всех районах исследований преобладали примнезиевые водоросли, составляя в среднем 83% численности суммарного фитопланктона. В исследуемый период диапазон биомассы суммарного фитопланктона составлял 52.5–223.8 мг/м3. В западном и восточном секторах исследований средняя биомасса фитопланктона последовательно возрастала от мелководных участков исследований к глубоководным (рис. 5).
В западном секторе биомасса фитопланктона возрастала от 52.5 мг/м3 у берега до 100.5 мг/м3 на глубоководной станции, а в восточном секторе – от 95.7 мг/м3 над глубиной 61 м до 210.2 мг/м3 над глубиной 1680 м, а с увеличением глубины >2000 м – снижалась до 122.4 мг/м3. В центральном секторе наблюдалось снижение биомассы суммарного фитопланктона от прибрежных станций к глубоководным – от 201.1 мг/м3 над глубиной 50 м до 118.9 мг/м3 над глубиной 2150 м (рис. 5).
Особенности пространственного распределения численности ихтиопланктона и биомассы фитопланктона проявлялись в их увеличении от шельфовых станций к глубоководным в соответствии с контрастами температуры воды и характером циркуляции на западной периферии СевАЦ и на восточной периферии КавАЦ и, наоборот, в их снижении на типичных разрезах поперек ОЧТ вне зоны влияния этих динамических структур в центральном районе исследований и на Вековом разрезе [21, 24].
ВЫВОДЫ
В июне 2018 г. видовой состав ихтиопланктона был представлен 17 видами икры и личинок рыб из десяти семейств (16 видов на шельфе и 10 видов в глубоководных районах). Средняя численность икры составляла 12.4, личинок 4.3 экз/м2. Структура видового состава ихтиопланктона была типична для начала летнего нерестового сезона в открытых водах Черного моря. На шельфе индексы видового разнообразия (~2.0), выровненности (~0.5) и видового богатства (~13.0) оказались почти вдвое больше, чем на глубоководных участках моря, и вполне сопоставимы с таковыми в прибрежных акваториях.
Несмотря на высокую смертность (73%) икры E. encrasicolus в пробах, характерную для начала нерестового сезона, в июне 2018 г. была отмечена высокая эффективность ее нереста: отношение численности личинок к количеству икры в море составляло в среднем 23.7%, а в восточном секторе исследований, где к концу съемки ТПМ превысила 27°С, >50%.
В восточном секторе исследований отмечалось снижение минимальных размеров личинок массовых видов промысловых рыб Черного моря (E. encrasicolus и T. mediterraneus) на смешанном типе питания, что, вероятно, связано с ускорением их эмбрионального и постэмбрионального развития при высокой температурe воды в верхнем слое моря.
Характер пространственного распределения икры и личинок рыб был сопоставим с распределением биомассы фитопланктона в море. Отмечалось увеличение численности ихтиопланктона и биомассы фитопланктона от прибрежных районов к глубоководным в соответствии с контрастами температуры воды и характером циркуляции на западной периферии СевАЦ и восточной периферии КавАЦ. Уменьшение численности ихтиопланктона и биомассы фитопланктона от берега к открытому морю наблюдалось на типичных разрезах поперек ОЧТ вне зоны влияния этих динамических структур в центральном секторе и на Вековом разрезе.
Ослабление ОЧТ в летний гидрологический сезон приводит к усилению его меандрирования, активизации квазистационарных антициклонических круговоротов и вовлечению в зону антициклонов вод из соседних, как правило более мелководных, участков моря. Это способствует более равномерному распространению планктона как в шельфовой, так и в глубоководной частях моря и создает благоприятные условия для выживания личинок рыб уже в начале летнего нерестового сезона, что подтверждается наличием широкого размерного ряда личинок с типом питания от желточного до внешнего.
Список литературы
Артамонов Ю.В., Скрипалева Е.А., Федирко А.В., Шутов С.А., Дерюшкин Д.В., Шаповалов Р.О., Шаповалов Ю.И., Щербаченко С.В. Циркуляция вод в северной части черного моря летом – зимой 2018 года // Экол. безоп. прибрежной и шельфовой зон моря. 2020 № 1. С. 69–90. https://doi.org/10.22449/2413-5577-2020-1-69-90
Белокопытов В.Н. Климатические изменения гидрологического режима Черного моря. Дис. … докт. геогр. наук. Севастополь: Морской гидрофизический ин-т РАН, 2017. 377 с.
Белокопытов В.Н. Сезонный ход вертикальной термохалинной стратификации вод на Черноморском шельфе Крыма // Экол. безоп. прибрежной и шельфовой зон моря. 2019. Вып. 3. С. 19–24.
Белокопытов В.Н., Ломакин П.Д., Субботин А.А., Щуров С.В. Фоновая характеристика и оценка изменчивости вертикальной стратификации термохалинного поля у побережья Севастополя // Экол. безоп. прибрежной и шельфовой зон и комплексные исследования ресурсов шельфа. 2002. № 1 (6). С. 22−28.
Гирагосов В.Е., Зуев Г.В., Репетин Л.Н. Изменчивость репродуктивного Sprattus sprattus рhalericus потенциала черноморского шпрота в связи с температурными условиями среды // Мор. экол. журн. 2006. Т. 5. № 4. С. 5–22.
Гордина А.Д., Субботин А.А., Климова Т.Н. Численность и особенности распределения ихтиопланктона в западной части Черного моря в летний период 1988 года. Севастополь: АН УССР, ИнБЮМ, 1990. 33 с.
Дехник Т.В. Ихтиопланктон Черного моря. Киев: Наук. думка, 1973. 234 с.
Дука Л.А. Питание молоди бычков (Gobiidae) // Тр. Севастопольской биол. ст. М.: Изд-во АН СССР, 1959. Т. 12. С. 297−317.
Дука Л.А. Питание личинок черноморской хамсы // Тр. Севастопольской биол. ст. М.: Изд-во АН СССР, 1961. Т. 14. С. 242–256.
Дука Л.А., Синюкова В.И. Руководство по изучению питания личинок и мальков морских рыб в естественных и экспериментальных условиях. Киев: Наук. думка, 1976. 110 с.
Дьяков Н.Н., Мальченко Ю.А., Липченко А.Е., Боброва С.А., Тимошенко Т.Ю. Особенности термохалинной структуры и гидрохимических условий прибрежных вод западной части Черного моря в 2018 г. // Тр. ГОИН. 2019. Вып. 220. С. 244−262.
Дьяков Н.Н., Мальченко Ю.А., Липченко А.Е., Боброва С.А., Тимошенко Т.Ю. Гидролого-гидрохимические характеристика прибрежных вод Крыма и необходимые мероприятия по снижению уровня загрязнения рекреационных зон // Тр. ГОИН. 2020. Вып. 221. С.163−194.
Иванов В.А., Белокопытов В.Н. Океанография Черного моря. Севастополь: ЭКОСИ-Гидрофизика, 2011. 212 с.
Климова Т.Н., Вдодович И.В., Аннинский Б.Е., Субботин А.А., Подрезова П.С., Мельников В.В. Влияние некоторых абиотических и биотических факторов на нерест европейского шпрота Sprattus sprattus (Linnaeus, 1758) в Черном море в ноябре 2016–2017 гг. // Океанология. 2021. Т. 61. № 1. С. 67−78.
Климова Т.Н., Вдодович И.В., Загородняя Ю.А. Состояние ихтиопланктона у Крымского полуострова в августе 2011 г. // Вопр. ихтиол. 2018. Т. 58. № 3. С. 342–347. https://doi.org/10.7868/S0042875218030104
Климова Т.Н., Вдодович И.В., Субботин А.А., Загородняя Ю.А., Подрезова П.С., Гарбазей О.А. Распределение ихтиопланктона в связи с особенностями гидрологического режима у берегов Крыма (Черное море) в весенне-летний сезон 2017 г. // Вопр. ихтиологии. 2021. Т. 61. № 2. С. 194−204.
Климова Т.Н., Подрезова П.С. Видовое разнообразие ихтиопланктона в различных по степени антропогенной нагрузки районах прибрежной акватории Севастополя // V Балтийский морской форум. Всерос. науч. конф. “Водные биоресурсы, аквакультура и экология водоемов”. Калининград: КГТУ, 2017. С. 183−187.
Климова Т.Н., Субботин А.А., Мельников В.В., Серебрянников А.Н., Подрезова П.С. Пространственное распределение ихтиопланктона у Крымского полуострова в летний нерестовый сезон 2013 г. // Морской биол. журн. 2019. Т. 4. № 1. С. 63–80.
Липская Н.Я. Суточный и сезонный ход питания черноморского шпрота (Sprattus sprattus phalericus Risso) // Тр. Севастопольской биол. ст. М.: Изд-во АН СССР, 1960. Т. XIII. С. 190–203.
Морозов А.Н., Маньковская Е.В. Холодный промежуточный слой Черного моря по данным экспедиционных исследований 2016–2019 годов // Экол. безоп. прибрежной и шельфовой зон моря. 2020. № 2. С. 5–16.
Морской портал. Архив данных по Черному морю. [Элекронный ресурс]. http://dvs.net.ru/mp/data/ main_ru.shtm (дата обращения 23.04.2021)
Одум Ю. Экология. М.: Мир, 1986. Т. 2. 376 с.
Петипа Т.С. Питание планктонных ракообразных // Биологические исследования Черного моря и его промысловых ресурсов. М.: Наука, 1968. С. 67−71.
Попов Ю.П. Распространение шельфовых вод в северо-западной части Черного моря и их обмен с водами открытого моря // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. 2010. Вып. 23. С. 117–126.
Радченко И.Г., Капков В.И., Федоров В.Д. Практическое руководство по сбору и анализу проб морского фитопланктона. Учебно-методическое пособие для студентов биологических специальностей университетов. М.: Мордвинцев, 2010. 60 с.
Размножение и экология массовых рыб Черного моря на ранних стадиях онтогенеза. Киев: Наук. думка, 1970. 211 с.
Расс Т.С. Рыбные ресурсы европейских морей СССР и возможности их пополнения акклиматизацией. М.: Наука, 1965. 107 с.
Синюкова В.И. О питании личинок некоторых литоральных рыб в Севастопольской бухте // Тр. Севастопольской биол. ст. М.: Изд-во АН СССР, 1960. Т. 13. С. 254–268.
Трощенко О.А., Субботин А.А., Еремин И.Ю. Изменчивость основных лимитирующих факторов среды в процессе выращивания двустворчатых моллюсков на ферме в районе Севастополя // Уч. зап. КФУ. Сер. география и геология. 2019. Т. 5. № 2. С. 308−321.
Agostini V.N., Bakun A., Francis R.C. Larval stage controls on Pacific sardine recruitment variability: high zooplankton abundance linked to poor reproductive success // Mar. Ecol. Prog. Ser. 2007. V. 345. P. 237–244. https://doi.org/10.3354/meps 06992
Asch R.G., Stock C.A., Sarmiento J.L. Climate change impacts on mismatches between phytoplankton blooms and fish spawning phenology // Glob. Change Biol. 2019. V. 25. № 8. P. 2544–2559. https://doi.org/10.1111/ gcb.14650
Auth T.D., Daly E.A., Brodeur R.D., Fisher J.L. Phenological and distributional shifts in ichthyoplankton associated with recent warming in the northeast Pacific Ocean // Glob. Change Biol. 2018. V. 24. P. 259–272.https://doi.org/10.1111/gcb
Cushing D.H. Plankton production and year-class strength in fish populations: An update of the match/mismatch hypothesis // Advances in Mar. Biol. 1990. V. 26. P. 249–293. https://doi.org/10.1016/ S0065-2881(08)60202-3
Daufresne M., Lengfellner K., Sommer U. Global warming benefits the small in aquatic ecosystems // PNAS. 2009. V. 106. № 31. P. 12 788–12 793. https://doi.org/10.1073/pnas.0902080106
Durant J.M., Hjermann D.Ø., Anker-Nilssen T., Beaugrand G., Mysterud A., Pettorelli N., Stenseth N.C. Timing and abundance as key mechanisms affecting trophic interactions in variable environments // Ecol. Lett. 2005. V. 8. P. 952–958. https://doi.org/10.1111/j.1461-0248.2005.00798.x
Edwards M., Richardson A.J. Impact of climate change on marine pelagic phenology and trophic mismatch // Nature. 2004. 430. P. 881−884. https://doi.org/10.1038/nature 02808
Klimova T., Podrezova P. Seasonal distribution of the Black Sea ichthyoplankton near the Crimean Peninsula // Regional studies Mar. Sci. 2018. № 24. P. 260–269. https://doi.org/10.1016/j.rsma.2018.08.013
Klimova T., Vdodovich I., Podrezova P. Ichthyoplankton of the shelf and deepwater areas of the north and northeast of the Black Sea in the spring season // Turk. J. Fish. Aquat. Sci. 2021. V. 21. № 5. P. 255−263. https://doi.org/10.4194/1303-2712-v21_5_05
Malic M.J., Cox S.P., Mueter F.J., Peterman R.M. Linking phytoplankton phenology to salmon productivity along a north– south gradient in the Northeast Pacific Ocean // Can. J. Fish. Aquat. Sci. 2015. V. 72. P. 697–708. https://doi.org/10.1139/ cjfas-2014-0298
Munk P. Differential growth of larval sprat Sprattus sprattus across a tidal front in the eastern North Sea // Mar. Ecol. Prog. Ser. 1993. V. 99. P. 17–27.
Petereit Ch. Influence of temperature and salinity on sprat (Sprattus sprattus) eggs and yolk sac larvae from contrasting environments: Dissertation zur Erlangung des Doktorgrades der Mathematisch-Naturwissen schaftlichen Fakultat der Christian-Albrechts-Universitat zu Kiel. 2009.
WoRMS. World Register of Marine Species. 2021. [Электронный ресурс]. http://www.marinespecies.org (дата обращения 15.07.2021)
Дополнительные материалы отсутствуют.
Инструменты
Водные ресурсы