Химия высоких энергий, 2019, T. 53, № 1, стр. 82-84
Роль светового излучения искрового разряда на воздухе в генерации активных частиц
И. М. Пискарев *
Научно-исследовательский институт ядерной физики им. Д.В. Скобельцына,
Московский государственный университет имени М.В. Ломоносова
119234 Москва, Ленинские горы, дом 1, строение 2, Россия
* E-mail: i.m.piskarev@gmail.com
Поступила в редакцию 31.05.2018
После доработки 28.08.2018
Принята к публикации 20.08.2018
Применение плазмы для биомедицинских исследований постоянно растет. Подтверждением этому является один из последних обзоров, посвященных этой теме [1]. Роль излучения плазмы в этих процессах мала и она не учитывается. В работе [2] рассмотрено излучение плазмы электрического искрового разряда (ИР). В этой работе не учитывалась роль активных частиц, образующихся в самом ИР и попадающих за счет диффузии на поверхность обрабатываемой пробы воды.
В работе [3] показано, что активные продукты, образовавшиеся на поверхности влажной кожи под действием ИР, имеют большое время жизни и могут диффундировать под кожу. Представляет интерес получить дополнительную информацию о свойствах продуктов, образующихся в воде как модельной жидкости под действием ИР между твердыми электродами на воздухе. Работа посвящена определению роли импульсного светового излучения искрового разряда и частиц, образующихся в самом разряде, в образовании активных продуктов в пробе воды.
Для экспериментов использовался генератор ИР10 [4]. Разряд происходил между электродами из нержавеющей стали. Величина разрядной емкости 3.3 нф. Конденсатор заряжался от источника высокого напряжения 11 кВ через балластное сопротивление 5.5 МΩ. При подаче высокого напряжения начинался самостоятельный ИР с частотой повторения 10 Гц. Разрядная полость сообщалась с чашкой Петри, в которой помещалась проба обрабатываемой воды 5 мл, через отверстие диаметром 20 мм. Расстояние от поверхности воды до области разряда 30 мм. Для исключения излучения как действующего фактора перед отверстием в разрядной полости устанавливалась непрозрачная перегородка. Продукты, образующиеся в самом разряде, могли свободно огибать перегородку и диффундировать к поверхности воды.
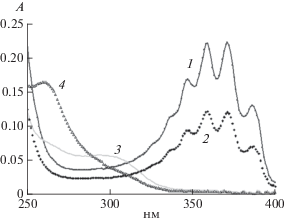
Пробы воды обрабатывались 10 мин в двух режимах: без перегородки (со светом) и с установленной перегородкой (без света). Пробы хранились в закрытых контейнерах. Оптическая плотность А (Бел) определялась относительно дистиллированной воды спектрофотометром СФ102 фирмы АК-ВИЛОН (Россия). Результаты представлены на рис. 1. Спектры сразу после обработки: кривая 1 – со светом, кривая 2 – без света; и на 8-й день после обработки: кривая 3 – со светом, кривая 4 – без света.
Линии поглощения проб сразу после обработки в диапазоне 340–390 нм характерны для азотистой кислоты [5].
Из спектров проб на 8-й день после обработки со светом (кривая 3) и без света (кривая 4) видно, что в пробе со светом пик 301 нм появляется, а в пробе без света его нет. Но без света появляется пик ~260 нм.
Согласно механизма Зельдовича, при ИР образуются окислы азота NO•. На воздухе они могут окисляться до ${\text{NO}}_{2}^{\centerdot }$. Азотистая кислота может образоваться при взаимодействии оксидов азота с водой:
(1)
${\text{N}}{{{\text{O}}}^{\centerdot }} + \quad{\text{NO}}_{2}^{\centerdot } + {\text{M}} \to {{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {\text{M}},$(2)
${{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 2{\text{HN}}{{{\text{O}}}_{2}}.$Азотистая кислота может образовываться под действием только излучения плазмы. В воде имеются растворенные газы: азот и кислород. Энергии фотонов импульсного излучения искрового разряда достаточно, чтобы реализовать процесс, в котором образуются NO• и ${\text{NO}}_{2}^{\centerdot }$ [4]. Далее азотистая кислота образуется в реакциях 1 и 2.
Таким образом, имеются механизмы образования азотистой кислоты как под действием активных частиц, образующихся в ИР и диффундирующих до поверхности пробы воды, так и под действием импульсного излучения.
Каналом распада азотистой кислоты может быть реакция:
(3)
$3{\text{HN}}{{{\text{O}}}_{2}} \to {\text{HN}}{{{\text{O}}}_{3}} + 2{\text{N}}{{{\text{O}}}^{\centerdot }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$В реакции 3 образуется азотная кислота, которая может наблюдаться по пику 301 нм.
Другой канал распада:
(4)
$2{\text{HN}}{{{\text{O}}}_{2}} \leftrightarrow {{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},\quad$(5)
${{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{3}} \leftrightarrow {\text{N}}{{{\text{O}}}^{\centerdot }} + {\text{NO}}_{2}^{\centerdot }.$В этом случае азотная кислота не образуется. При хранении пробы в закрытом сосуде устанавливаются равновесия (4, 5). В воде будет содержаться растворенный N2O3, который может наблюдаться по пику в спектре при λ ~ 260 нм [6].
В пробе, обработанной без света, на 8-й день, пик азотной кислоты может быть незаметным, так как коэффициент экстинкции азотной кислоты мал, ε = 7 л (моль см)−1 [4], и в реакции 3 на три молекулы азотистой кислоты образуется одна молекула азотной. В пробе, обработанной со светом, где выход азотистой кислоты больше (см. рисунок), азотная кислота по-прежнему может оставаться незаметной.
Рис. 1.
Спектры поглощения проб воды 5 мл, обработанные генератором ИР10 в течение 10 мин. Сразу после обработки: 1 – свет, 2 – без света; через 8 дней после обработки: 3 – свет, 4 – без света.
В работе [4] была предположена возможность образования под действием излучения ИР комплекса, распадающегося на пероксинитрит и пероксиазотистую кислоту. Для них существует равновесие:
Линия поглощения пероксинитрита находится при длине волны 301 нм, коэффициент экстинкции 1600 л(моль с)−1 [7]. Пероксинитрит имеет время жизни порядка 1 с, поэтому наблюдаться может мгновенная концентрация пероксинитрита. Сам комплекс полностью распадается за 14 дней. Несмотря на малую концентрацию, пероксинитрит может наблюдаться, так как у него большой коэффициент экстинкции.
Непосредственно сразу после обработки линия 301 нм, относящаяся к продукту распада комплекса, не видна.
Причина заключается в том, что продукты распада комплекса будут взаимодействовать c ионами ${\text{NO}}_{2}^{ - }$ [8]. При этом пероксинитрит расходуется.
Роль излучения может заключаться в том, что под его действием образуются радикалы ${\text{HO}}_{2}^{\centerdot }$ [9]. Для радикала ${\text{HO}}_{2}^{\centerdot }$ имеет место равновесие:
(7)
${\text{HO}}_{2}^{\centerdot } \leftrightarrow \quad{\text{O}}_{2}^{{\centerdot - }} + {{{\text{H}}}^{ + }},\quad\,\,\,p{{K}_{{\text{a}}}} = 4.8.$В наших экспериментах обрабатывается нейтральная вода, рН 6.5. В процессе обработки величина рН уменьшается [4]. Одним из каналов образования пероксинитрита является реакция:
(8)
${\text{O}}_{{\text{2}}}^{{\centerdot - }} + {\text{N}}{{{\text{O}}}^{\centerdot }} + {\text{M}} \to {\text{ONO}}{{{\text{O}}}^{ - }} + {\text{M}}{\text{.}}$В принципе возможна реакция
(9)
${\text{HO}}_{{\text{2}}}^{\centerdot } + {\text{N}}{{{\text{O}}}^{\centerdot }} + {\text{M}} \to {\text{ONOOH}} + {\text{M}}{\text{.}}$Пока в начале обработки pH > 4, будет играть роль реакция (8). В более кислой среде может играть роль реакция уже накопленной азотистой кислоты с перекисью водорода, образовавшейся при взаимодействии радикалов ${\text{HO}}_{2}^{\centerdot }$ [7]:
(10)
${\text{HO}}_{{\text{2}}}^{\centerdot } + {\text{HO}}_{{\text{2}}}^{\centerdot } \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{O}}}_{{\text{2}}}},$(11)
${\text{HN}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to {\text{ONOOH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.\quad$После обработки со светом азотистая кислота расходуется в реакции (11), поэтому пик 260 нм на 8-й день не наблюдается.
Таким образом, образование комплекса, распадающегося на пероксинитрит и пероксиазотистую кислоту, происходит преимущественно под действием излучения плазмы.
Список литературы
Bruggeman P.J., Kushner M.J., Locke B.R. et al. // Plasma Sources Sci. Technol. 2016. V. 25. 053002 (59pp).
Пискарев И.М., Иванова И.П., Трофимова С.В., Аристова Н.А. // Химия высоких энергий. 2012. Т. 46. № 5. С. 406.
Пискарев И.М., Астафьева К.А., Иванова И.П. // Биофизика. 2017. Т. 62. Вып. 4. С. 674.
Piskarev I.M. // Research Journal of Pharmaceutical, Biological and Chemical Science. 2016. V. 7(4). P. 1171.
Stutz J., Kim E.S., Platt U., Bruno P., Perrinos C., Febo A. // J. of Geophysical Research. 2000. V. 105. (D11). P. 14585.
Markovits G.Y., Schwartz S.E., Newman l. // Inorganic Chemistry. 1981. V. 20(2). P. 445.
Лобачев В.Л., Рудаков Е.С. // Успехи химии. 2006. Т. 75(5). С. 422.
Пискарев И.М. // Химия высоких энергий. 2016. Т. 50. № 5. С. 449.
Пискарев И.М. // Химия высоких энергий. 2018. Т. 52. № 3. С. 194.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


