Химия высоких энергий, 2019, T. 53, № 5, стр. 385-389
Редокс-процессы ионов хрома в водном растворе при действии разряда постоянного тока атмосферного давления в кислороде
Д. А. Шутов a, А. В. Сунгурова a, А. С. Манукян a, А. А. Извекова a, В. В. Рыбкин a, *
a Ивановский государственный химико-технологический университет
153000 Иваново, Россия
* E-mail: rybkin@isuct.ru
Поступила в редакцию 25.02.2019
После доработки 19.04.2019
Принята к публикации 08.05.2019
Аннотация
Исследованы кинетические закономерности процессов окисления–восстановления ионов хрома под действием на водный раствор бихромата калия разряда постоянного тока атмосферного давления в кислороде при токах (20–60) мА и концентрациях (0.092–0.39) ммоль/л. Раствор служил катодом разряда. Обнаружено, что под действием разряда начинают протекать обратимые реакции Cr6+ ↔ Cr3+ окисления–восстановления ионов хрома. Предельная степень восстановления ионов Cr6+ слабо зависит от тока разряда и падает с ростом начальной концентрации раствора. Найдены кажущиеся константы скоростей окисления и восстановления, оценена энергетическая эффективность процесса. Полученные данные сравниваются с ранее полученными результатами для разряда в воздухе и аргоне. Показано, что разряд в аргоне является наиболее эффективным для проведения процесса восстановления.
В последнее десятилетие опубликовано несколько сотен работ, посвященных методам очистки воды с использованием различных видов газовых разрядов [1–4]. Основная часть этих работ посвящена окислительной деструкции органических загрязнителей. В то же время работа предприятий различных отраслей промышленности приводит к загрязнению воды солями тяжелых металлов, и, в частности, солями хрома [5]. Соли Cr6+ являются сильными токсикантами [5]. Традиционно, Cr6+ переводят в менее вредный Cr3+ химическими методами [6]. Общим недостатком этих методов является то, что реакции окисления–восстановления являются обратимыми и достижение высокой степени восстановления требует избытка восстановителей, которые являются источником вторичного загрязнения воды. В то же время действие разрядов в разных газах на воду приводит к образованию в ней частиц, обладающих окислительно-восстановительными свойствами [7, 8]. Высокой окислительной способностью обладают радикалы •ОН, О, НО2, пероксид водорода, озон, тогда как атомы и молекулы водорода и сольватированные электроны являются хорошими восстановителями. Так как образование этих частиц не требует каких-либо химических реагентов, это делает плазменную обработку привлекательной.
Работ по исследованиям редокс-процессов с участием ионов хрома под действием разряда немного. В работе [9] изучалась кинетика восстановления Cr6+ в разряде, называемом Электролиз Тлеющим Разрядом (подводный разряд), при токе 100 мА и концентрации 100 мг/л, и различных добавках фенола. Добавки фенола от 0 до 500 мг/л увеличивали степень восстановления (α) Cr6+ от 0.5 до 0.7 за время 900 с. В работе [10] исследовали кинетику разложения фенола и восстановления Cr6+ в водных растворах под действием тлеющего разряда в воздухе. Было обнаружено, что в смеси хром–фенол имеет место ускорение как процессов восстановления хрома, так и разложения фенола. В таких смесях энергетическая эффективность восстановления оказалась почти на порядок величины больше, чем в отсутствие фенола [11, 12].
В работе [13] исследовали редокс-процессы в аргоновом разряде при токе 40 мА и концентрации Cr6+ 80 мг/л (~1.5 ммоль/л). Максимальная степень восстановления 0.8 достигалась за время обработки 900 с. Данные, полученные в [14] для такого же разряда показали, что величины α сильно зависят от начальных условий (начальной концентрации и тока разряда). Максимальная предельная величина α составила ~0.6 при токе 40 мА и концентрации 0.5 ммоль/л.
Насколько нам известно, возможности разряда в кислороде для инициирования редокс-процессов не исследованы. Поэтому целью данной работы было выявление закономерностей кинетики восстановления–окисления ионов хрома под действием разряда в кислороде, и сравнение их с имеющимися литературными данными для разряда в воздухе и аргоне. Можно ожидать, что эти закономерности будут близкими, поскольку качественный состав активных частиц газовой фазы для всех трех плазмообразующих сред является схожим, как и величины катодных падений потенциала [15–17].
МЕТОДИКА ЭКСПЕРИМЕНТА
Для проведения экспериментов использовалась установка, детально описанная ранее в [16, 17]. Установка включала вакуумный колпак (5 л), внутри которого находился сосуд (70 мл), содержащий водный раствор бихромата калия марки ЧДА заданной концентрации. Диапазон концентраций составлял (0.092–0.39) ммоль/л по иону Cr6+. Технический кислород (99.7%) при расходе 3 см3/с (н.у.) и атмосферном давлении пропускался через колпак. Разряд зажигали приложением постоянного напряжения между металлическим анодом и раствором (катод). Расстояние катод–анод составляло 10 мм. Диапазон токов разряда составлял 20–60 мА.
Концентрация бихромат-ионов определялась спектрофотометрически по поглощению на длине волны ~350 нм (максимум полосы поглощения) [18]. Для измерений использовали спектрофотометр CФ-56 (Россия). Для нахождения суммарной концентрации ионов хрома использовали тот же метод. Для этого ионы хрома со степенью окисления меньшей +6 окисляли персульфатом аммония в кислой среде [19]. Изменения рН раствора в ходе обработки измеряли рН-метром PHT-028 Kelilong (Китай).
Для получения каждой временной точки кинетической кривой использовали свежую порцию раствора и проводили не менее пяти независимых измерений.
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ И ОБСУЖДЕНИЕ
Как и для разрядов в воздухе и аргоне, действие кислородного разряда приводит к инициированию редокс-процессов с участием ионов Cr6+ (рис. 1). Ход кинетических кривых (выход концентрации на постоянное значение при увеличении времени) показывает, что наряду с расходованием ионов Cr6+ имеет место и их образование, т.е. процесс протекает обратимо Cr6+ ↔ Cr3+.
Рис. 1.
Изменение концентрации ионов Cr6+ и степени восстановления α при разных начальных концентрациях и токе 60 мА. Кривые – расчет по уравнению (2).

Формальное описание кинетических кривых мы проводили, используя следующие допущения. Предполагалось, что восстановление ионов Cr6+ протекает по реакции 1-го кинетического порядка с константой скорости Кred, а окисление ионов Cr3+ в Cr6+ также происходит в реакции 1-го кинетического порядка с константой скорости Кox. Постоянство формальных констант означает, что концентрации частиц, участвующих в окислении–восстановлении, устанавливаются за времена более короткие, чем времена измерений. Измерения показали, что суммарная концентрация ионов хрома не зависит от времени, то есть для каждого времени t
(1)
${{[{\text{C}}{{{\text{r}}}^{{3 + }}}(t)\left] {{\text{ }} + {\text{ }}} \right[{\text{C}}{{{\text{r}}}^{{6 + }}}(t)\left] {{\text{ }} = {\text{ }}} \right[{\text{C}}{{{\text{r}}}^{{6 + }}}]}_{0}},$В рамках этих предположений кинетика ионов Cr6+ описывается как
(2)
$\begin{gathered} \left[ {{\text{C}}{{{\text{r}}}^{{6 + }}}\left( t \right)} \right] = \frac{{{{{[{\text{C}}{{{\text{r}}}^{{6 + }}}]}}_{0}}}}{{{{K}_{{{\text{ox}}}}} + {{K}_{{{\text{red}}}}}}} \times \\ \times \,\,\left\{ {{{K}_{{{\text{red}}}}}{\text{exp}}\left[ { - \left( {{{K}_{{{\text{red}}}}} + {{K}_{{{\text{о x}}}}}} \right)t} \right] + {{K}_{{{\text{о x}}}}}} \right\}. \\ \end{gathered} $Оказалось, что соотношение (2) действительно хорошо описывает экспериментальные кинетические кривые (рис. 1). Коэффициент детерминации был не хуже R2 ≥ 0.98.
На рис. 1 приведены также степени восстановления α, которые рассчитывались как
(3)
$\alpha = \frac{{{{{\left[ {{\text{C}}{{{\text{r}}}^{{6 + }}}} \right]}}_{0}} - \left[ {{\text{C}}{{{\text{r}}}^{{6 + }}}\left( t \right)} \right]}}{{{{{\left[ {{\text{C}}{{{\text{r}}}^{{6 + }}}} \right]}}_{0}}}},$При фиксированном токе разряда увеличение начальной концентрации приводит к снижению степени восстановления. Формально, это связано с тем, что с ростом начальной концентрации Kred уменьшается, а Kox – увеличивается. Так, для тока 60 мА и концентрации 0.092 ммоль/л Kred и Kox cоставляют (4.8 ± 1) × 10–3 с–1 и (5.1 ± 1) × 10–3 с–1 , соответственно, а для концентрации 0.39 ммоль/л – (2.7 ± 0.5) × 10–3 с–1 и (2.7 ± 1) × 10–2 с–1. Рост концентрации приводит, вероятно, к тому, что процессы образования активных частиц, участвующих в восстановлении, становятся лимитирующей стадией. Об этом свидетельствуют зависимости скоростей восстановления от начальной концентрации, приведенные на рис. 2. Начиная с определенной концентрации, скорость восстановления перестает зависеть как от начальной концентрации, так и от тока разряда.
Рис. 2.
Зависимость начальной скорости восстановления от начальной концентрации. 1, 2, 3 – токи разряда 60, 40 и 20 мА соответственно.

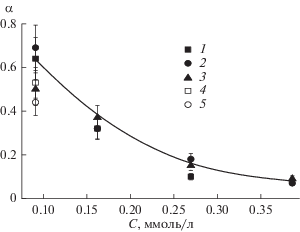
Полученные данные о константах, позволяют нам оценить предельно достижимую степень восстановления α(∞) (рис. 3). Из выражения (2) следует, что при t → ∞
(4)
$\alpha \left( \infty \right) = \frac{{{{K}_{{{\text{red}}}}}}}{{{{K}_{{{\text{red}}}}} + {{K}_{{{\text{о x}}}}}}}.$Причины уменьшения α(∞) с ростом начальной концентрации уже обсуждались, а слабая зависимость от тока разряда обусловлена слабой зависимостью Kred и Kox от тока. Для всех исследованных плазмообразующих газов (Ar, O2, воздух) величины α(∞) близки, но кинетически предельное значение для разряда в Ar устанавливается наиболее быстро из-за больших констант скоростей (характерное время равно (Kox+ Kred)–1).
К сожалению, в настоящее время отсутствуют теории, на основе которых можно было бы сравнивать эффективности разрядов разных типов в разных газах. Казалось бы, энергетические показатели (энергетические выходы) должны бы быть самыми общими. Однако, многочисленные данные об энергетических выходах превращения различных веществ, приведенные в работах [20, 21], показывают, что они различаются на несколько порядков величины даже для одного типа разряда, сорта плазмообразующего газа и параметров разряда. Так, в [20] было обнаружено, что кинетика разложения фенола в разряде постоянного тока в воздухе зависит не только от мощности (тока), но и от начальной концентрации, толщины слоя раствора и его объема. Поскольку в работах [12, 14] данные о кинетике окисления–восстановления ионов Cr6+ при разряде в воздухе и аргоне были получены в условиях идентичных условиям данной работы, мы можем провести корректное сравнение действия всех трех плазмообразующих газов.
Для разряда в воздухе [12], аргоне [14] и кислороде для концентрации 0.1 ммоль/л и тока 40 мА константы скорости восстановления составили (4 ± 0.7) × 10–3, (1.1 ± 0.2) × 10–2 и (2 ± 0.4) × 10–3 с–1 соответственно. Следовательно, концентрации частиц, восстанавливающих Cr6+, в разряде аргона должны быть максимальными, а в разряде в О2 – минимальными. Согласно данным работы [11], основным восстанавливающим агентом является пероксид водорода. В кислой среде он необратимо восстанавливает бихромат ионы (Cr6+). Стехиометрическое уравнение реакции имеет вид
Наши измерения показали, что при всех токах и начальных концентрациях действие разряда на раствор приводит к его подкислению (рис. 4). Измерение скоростей образования пероксида водорода при разряде в аргоне, кислороде и воздухе было проведено в работе [22]. Было обнаружено, что отношение скоростей образования Н2О2 равно примерно 1 : 3 : 4 для разрядов в кислороде, воздухе и аргоне, соответственно, а порядок величины скоростей образования составляет несколько мкмоль/(л с). Сравнение этих данных с вышеприведенными данными по константам скоростей и величинами скоростей восстановления (рис. 2) показывает, что гипотеза о роли Н2О2 является вполне обоснованной.
Рис. 4.
Изменение рН раствора при действии разряда. Начальные концентрации (0.092–0.39) моль/л. Токи – 20–60 мА. Указан диапазон разброса значений.

Используя полученные данные, а также результаты измерений напряженностей электрических полей и катодные падения потенциала, полученные в работах [15–17], мы рассчитали энергозатраты на восстановление 1-го иона Cr6+ по соотношению:
где W (моль л–1 с–1) – скорость восстановления при t → 0, V = 0.07 л – объем раствора, NАв = 6.02 × × 1023 – число Авогадро, e = 1.6 × 10–19 – заряд электрона, Р (Вт) – мощность, вкладываемая в разряд.Расчеты для тока разряда 40 мА и концентрации 0.1 ммоль/л дали следующие значения: аргон – η = 4.2 × 10–2 ионов на 100 эВ; кислород – η = 2.9 × 10–3; воздух – η = 0.75 × 10–3. Несмотря на то, что разряд в воздухе демонстрирует более высокие константы скоростей восстановления, чем разряд в кислороде, энергетическая эффективность разряда в кислороде оказывается выше. Причина связана с тем, что для поддержания одного и того же тока, разряд в воздухе требует больших мощностей.
ВЫВОДЫ
В работе показано, что разряд постоянного тока атмосферного давления в кислороде стимулирует процессы окисления–восстановления с участием ионов хрома в их водных растворах. Предельная степень восстановления Сr6+ слабо зависит от тока разряда и уменьшается от 0.7 до 0.1 при увеличении начальной концентрации раствора от 0.09 до 0.39 ммоль/л. Сравнение разрядов в аргоне, воздухе и кислороде показывает, что достигаемые степени восстановления во всех разрядах близки, но в аргоне процесс восстановления протекает быстрее и его энергетические показатели выше.
Работа выполнена при финансовой поддержке Минобрнауки РФ (проект 3.1371.2017/4.6).
Список литературы
Jiang B., Zheng J., Qiu S., Wu M., Zhang Q., Yan Z., Xue Q. // Chem. Eng. J. 2014. V. 236. P. 348.
Locke B.R., Mededovic Thagard S.M. // Plasma Chem. Plasma Process. 2012. V. 32. № 5. P. 875.
Бобкова Е.С., Гриневич В.И., Исакина А.А., Рыбкин В.В. // Известия ВУЗов. Химия и хим. технология. 2011. Т. 54. № 6. С. 3.
Magureanu M., Bradu C., Parvulescu V.I. // J. Phys. D: Appl. Phys. 2018. V. 51. № 31. P. 313002.
Kimbrough D.E., Cohen Y., Winer A.M., Crelman L., Mabuni C.A. // Crit. Rev. Environ. Sci. Technol. 1999. V. 29. № 1. P. 1.
Owlad M., Aroua M.K., Daud W.A.W., Baroutioan S. // Water, Air. Soil Pollut. 2009. V. 200. № 1–4. P. 59.
Рыбкин В.В., Шутов Д.А. // Физика плазмы. 2017. Т. 43. № 11. С. 929.
Шукуров А.Л., Maнукян A.С., Шутов Д.А., Рыб-кин В.В. // Изв. вузов. Химия и хим. технология. 2016. Т. 59. Вып. 12. С. 4.
Liu Y. // J. Hazard Mater. 2009. V. 168. P. 992.
Шутов Д.А., Сунгурова А.В., Смирнова К.В., Рыбкин В.В. // Химия высоких энергий. 2017. Т. 52. № 1. С. 79.
Shutov D.A., Sungurova A.V., Shoukourov A., Rybkin V.V. // Plasma Chem. Plasma Process. 2016. V.36. № 5. P. 1253.
Бобкова Е.С., Сунгурова А.В., Рыбкин В.В. // Химия высоких энергий. 2016. Т. 50. № 3. С. 216.
Ke Z., Huang Q., Zhang H., Yu Z. // Environ. Sci. Technol. 2011. V. 45. № 18. P. 7841.
Шутов Д.А., Сунгурова А.В., Манукян А.С., Рыбкин В.В. // Химия высоких энергий. 2018. Т. 52. № 5. С. 429.
Bobkova E.S., Smirnov S.A., Zalipaeva Ya.V., Ryb-kin V.V. // Plasma Chem. Plasma Process. 2014. V. 34. № 5. P. 721.
Smirnov S.A., Shutov D.A., Bobkova E.S., Rybkin V.V. // Plasma Chem. Plasma Process. 2016. V. 36. № 2. P. 415.
Shutov D.A., Smirnov S.A., Bobkova E.S., Rybkin V.V. // Plasma Chem. Plasma Process. 2015. V. 35. № 1. P. 107.
Иванов В.М., Фигуровская В.Н., Щербакова Я.И. // Вестн. Моск. Ун-та. Сер. 2. Химия. 2013. Т. 54. № 4. С. 216.
Национальный стандарт РФ ГОСТ Р 52962-2008. Вода. Методы определения содержания хрома (VI) и общего хрома. М.: Стандартинформ, 2008.
Bobkova E.S., Rybkin V.V. // Plasma Chem. Plasma Processing. 2015. V. 35. № 1. P. 133.
Malik M.A. // Plasma Chem. Plasma Process. 2010. V. 30. № 1. P. 21.
Kovačević V.V., Dojčinović B.P., Jović M., Roglić G.M., Obradović B.M., Kuraica M.M. // J. Phys. D: Appl. Phys. 2017. V. 50. № 20. P. 155205.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий